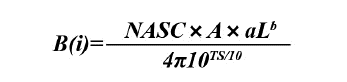Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta ene./jun. 2022 Epub 01-Ago-2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1065
Artículos de Investigación
DISTRIBUCIÓN Y BIOMASA DE ANCHOVETA (ENGRAULIS RINGENS) Y MÚNIDA (PLEURONCODES MONODON) EN EL ECOSISTEMA MARINO DE LA RESERVA NACIONAL DE PARACAS, REGIÓN SUR DEL PERÚ
1Instituto del Mar del Perú (Imarpe). Esq. Gamarra y General Valle s/n. Chucuito. Callao, Perú. rcornejo@imarpe.gob.pe
2Instituto del Mar del Perú (Imarpe). Esq. Gamarra y General Valle s/n. Chucuito. Callao, Perú. llacruz@imarpe.gob.pe
3Instituto del Mar del Perú (Imarpe). Esq. Gamarra y General Valle s/n. Chucuito. Callao, Perú. prcastillo@imarpe.gob.pe
The present study determined the distribution and biomass of the Peruvian anchovy and pelagic red squat lobster related to the oceanographic characteristics in the marine protected area of the Paracas National Reserve in the Northern Humboldt Current System. Acoustic, biological, and oceanographic information was collected on the pelagic habitat in surveys carried out by the Peruvian Marine Research Institute during the summer and spring of 2018, 2019, and 2020. The results obtained indicated that the spatial occupation of the pelagic habitat of Peruvian anchovy and pelagic red squat lobster were influenced by the dynamics of upwelling, water masses, and a shallow and intense Oxygen Minimum Zone. Spatial overlap of high biomass of Peruvian anchovy and pelagic red squat lobster were recorded in the surface layer during the night. Although, with the presence of dense swarms of múnida in anoxic intermediate waters of the Oxygen Minimum Zone during the day. The Marine Protected Area off the Paracas National Reserve functions as a protection zone for the structure and functioning of the pelagic-neritic ecosystem and strengthens the fishery production of Peruvian anchovy stock in the Northern Humboldt Current System.
Keywords: spatial ecology; fisheries acoustic; hydrobiological resources; ecosystem services.
El presente estudio determinó la distribución y biomasa de la anchoveta y múnida relacionadas a las características oceanográficas en el Área Marina Protegida de la Reserva Nacional de Paracas en el Sistema Norte de la Corriente de Humboldt. Se recolectó información acústica, biológica y oceanográfica del hábitat pelágico en cruceros de investigación efectuados por el Instituto del Mar del Perú durante el verano y primavera de 2018, 2019 y 2020. Los resultados obtenidos indicaron que la ocupación espacial del hábitat pelágico de la anchoveta y múnida estuvieron influenciados por la dinámica de afloramientos, masas de aguas y una somera e intensa Zona Mínima de Oxígeno. Se registró una sobreposición espacial de altas biomasas de anchoveta y múnida en la capa superficial durante la noche. Aunque con presencia de enjambres densos de múnida en aguas intermedias anóxicas de la Zona Mínima de Oxigeno durante el día. El Área Marina Protegida de la Reserva Nacional de Paracas funciona como zona de protección de la estructura y funcionamiento del ecosistema pelágico nerítico y fortalece la producción pesquera del stock de anchoveta en el Sistema Norte de la Corriente de Humboldt.
Palabras clave: ecología espacial; acústica pesquera; recursos hidrobiológicos; servicios ecosistémicos.
INTRODUCCIÓN
La anchoveta (Engraulis ringens) es una especie endémica y dominante del Sistema Norte de la Corriente de Humboldt (SNCH), con biomasas anuales estimadas entre 1,7 y 12,7 millones de t en los últimos 20 años, la cual sustenta la pesquería sostenible más grande del mundo (Vildoso et al., 1999; Castillo et al., 2020a). Por otro lado, la múnida (Pleuroncodes monodon) es un crustáceo decápodo que habita el ecosistema pelágico nerítico y es considerado un recurso pesquero potencial por sus niveles de abundancia que varían entre 1,5 y 3,5 millones de t durante el verano y primavera (Chirichigno, 1970; Gutiérrez et al., 2008; Castillo et al., 2020a, 2020b).
La Reserva Nacional de Paracas (RNP), ubicada al sur del Perú en las provincias de Pisco e Ica, fue creada el 25 de septiembre de 1975, con una extensión de 335 000 ha, de las cuales 35 % corresponden a tierra firme e islas y el 65 % a aguas marinas (Decreto Supremo N° 1281- 75-AG; Jacinto, 2014; Guezel y Wickel, 2015). El ecosistema marino de la RNP es de alta productividad debido a la ocurrencia de procesos de afloramiento y una intensa Zona Mínima de Oxigeno (ZMO) propios del SNCH (Strub et al., 1998; Messié y Chavez, 2015), lo cual sustenta la gran biodiversidad y biomasa marina de la provincia Peruano-Chilena (templada-fría) conformada por aves residentes y migratorias, así como cetáceos, delfines, lobos marinos, tortugas marinas, peces, crustáceos e invertebrados, destacando por su mayor frecuencia de ocurrencia la anchoveta (Engraulis ringens), pintadilla (Cheilodaytilus variegatus), concha de abanico (Argopecten purpuratus), choro (Aulacomya atra), caracol chino (Crossata ventricosa), caracol (Thaisella chocolata), palabrita (Transennella pannosa), jaiba (Cancer porteri), cangrejo peludo (Romaleon setosus), aracanto palo (Lessonia trabeculata), lapa negra (Fissurella latimarginata) y erizo rojo (Loxechinus albus) (Vélez, 1975; Vildoso et al., 1999; Chirichigno y Cornejo, 2001; Paz et al., 2002; Reyes et al., 2007; Guezel y Wickel. 2015; Flores et al., 2019; Goya et al., 2020). Sin embargo, existen escasos estudios sobre la densidad poblacional de especies marinas en áreas marinas protegidas (AMP), siendo importante como herramienta de gestión para la conservación, recuperación de los ecosistemas marinos y sus servicios ecosistémicos, así como mecanismos de mitigación de los efectos del cambio climático (FAO, 2012; Spalding et al., 2013; Cutipa-Luque et al., 2020).
El presente estudio tiene por objetivo determinar la distribución y biomasa de anchoveta y múnida y su relación con las características oceanográficas en la zona marino costera de la RNP.
MATERIALES Y MÉTODOS
Área de estudio
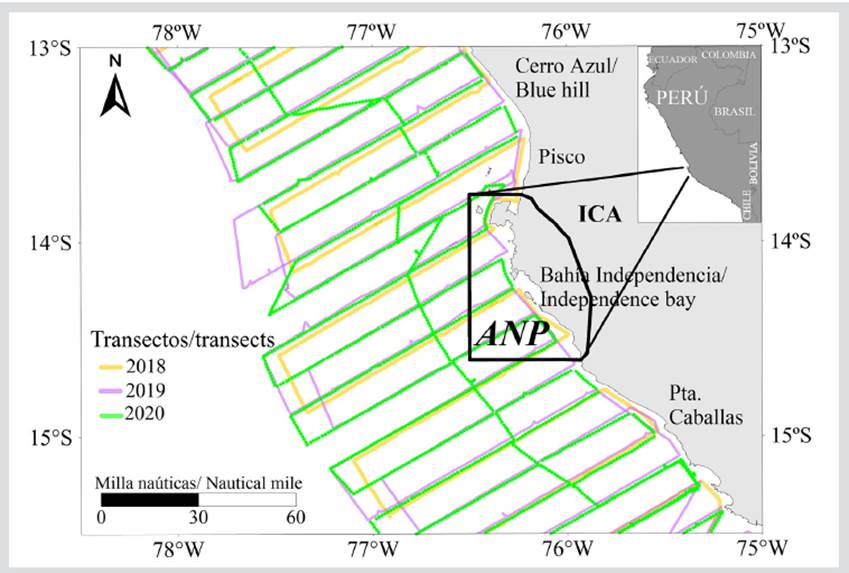
El ámbito geográfico del estudio comprendió el ecosistema marino correspondiente al área de influencia directa e indirecta del AMP de la RNP, en la zona sur del Pacífico suroriental del Perú de la Corriente de Humboldt entre Cerro Azul (13°01´S, 76°20´W) y San Juan (15°20´S, 75°19´W) (Figura 1). Se consideró como área de influencia directa la propia RNP y como área de influencia indirecta las áreas colindantes entre Cerro Azul y Punta Caballas, y un alcance horizontal desde 0,56 km [0,3 millas náuticas (mn) ] hasta 185,20 km (100 mn) de distancia a la costa.
Recolecta y análisis de datos acústicos, biológicos y oceanográficos
Los datos acústicos, biológicos y oceanográficos fueron recolectados durante el desarrollo de los Cruceros de Evaluación Hidroacústica de Recursos Pelágicos por el Instituto del Mar del Perú (Imarpe) con la participación de los Buques de Investigación Científica (BICs): José Olaya Balandra, Luis Flores Portugal y Humboldt, durante los meses de verano (febrero-marzo) y primavera (septiembre-octubre) de 2018, 2019 y 2020. Estos cruceros tuvieron como finalidad determinar la distribución y biomasa de los recursos pelágicos frente a toda la costa peruana (Tumbes 03°30’ -Tacna 18°20’ S). Para el presente trabajo se utilizó como área de estudio donde se sitúa la RNP entre 13°00’ (Cerro Azul) y 15°30’S (al sur de Punta Caballas).
Datos acústicos
Los datos acústicos (Coeficiente Náutico del Área de Dispersión Acústica-NASC- m2 mn2 [MacLennan et al., 2002] para la anchoveta y la múnida fueron recolectados durante los cruceros 1802-04, 1809-11, 1902-03, 1909-11 y 2002-03 (los dos primeros dígitos de la codificación corresponden a los dos últimos dígitos del año, seguido de los dígitos que corresponden a los meses en que fue realizado el crucero).
El diseño de muestreo acústico se realizó por el método sistemático (Simmonds y MacLennan, 2005), que consistió en transectos o perfiles perpendiculares a la línea de costa y paralelos entre sí, con una separación de 18,52 km (10 mn). La longitud o distancia de los transectos fue desde 0,56 hasta 185,2 km (0,3-100 mn) de distancia de la costa. La velocidad de navegación del crucero fue 18,5 km/h (10 nudos) y la unidad básica de muestreo acústico fueron 1,85 km (1 mn). Las millas náuticas totales evaluadas fueron 4453 (8246,96 km) en 2018, 4411 (8169,17 km) en 2019 y 2320 (4296,64 km) en 2020. Las mediciones acústicas de las especies objetivo se efectuaron con ecosondas científicas multifrecuencia de la marca Simrad Kongsberg EK80 (18, 38, 70, 120 y 200 kHz) y EK 60 (38 y 120 kHz). Las calibraciones de las ecosondas se realizaron antes de iniciar los cruceros, según la metodología estándar (Simmonds y MacLennan, 2005; Demer et al., 2015), utilizando esferas de calibración de cobre (Cu) y de carburo de tungsteno (WC). Los resultados de las calibraciones fueron aceptables (error cuadrático medio menor a 0,4 dB), según los indicadores y las recomendaciones del fabricante y el grupo de expertos en materia de acústica pesquera del International Council for the Exploration of the Sea (ICES).
Datos biológicos
Se recolectaron datos sobre la estructura de tallas (cm) y se estimaron los parámetros de a y b de la relación longitud (cm)-peso (g) de la anchoveta y múnida. Como muestreador se utilizaron las redes de arrastre pelágico de media agua de tipo Granton con aberturas verticales de 12 m para el BIC José Olaya Balandra (con sensores inalámbricos de pesca NOTUS), 8 m para el BIC Luis Flores Portugal y 14 m para el BIC Humboldt.
Datos oceanográficos
Para establecer los parámetros ambientales de preferencia de la anchoveta y la múnida fueron usados datos superficiales y verticales del CTD-O Seabird (Current-Temperature-Depth-Dissolved Oxygen). En los transectos se efectuaron estaciones oceanográficas por hora de navegación, lo que permitió recolectar parámetros físicos de la superficie del mar (temperatura, salinidad y oxígeno). Los registros de temperatura (°C) en la columna de agua se realizaron en las seis estaciones (5, 10, 20, 50, 70 y 100 mn de la costa) del perfil oceanográfico frente a Pisco (13° 42’S) con un CTD-O y un termómetro de superficie. Las muestras de la salinidad superficial del mar se analizaron abordo con el Portasal Guildline modelo 8410A por el método de inducción. El oxígeno disuelto en superficie se calculó empleando la metodología de Winkler modificada por Carrit y Carpenter (1966). El muestreo vertical de los parámetros físicos (temperatura, salinidad y oxígeno disuelto) se realizó con el despliegue de la CTD-O en el perfil oceanográfico de Pisco, desde la superficie del mar hasta 500 m de profundidad.
Procesamiento de datos acústicos y estimación de la biomasa
La discriminación acústica fue realizada en el programa EchoView versión 9 (Myriax, Hobart;www.echoview.com), la identificación de los ecotrazos de las especies detectadas (anchoveta y múnida) fue de acuerdo a la composición de la captura del lance de pesca, tipo de ecotrazo característico de cada especie y por el análisis multifrecuencia (gráficos de respuesta acústica en frecuencia de los cardúmenes de anchoveta y agregaciones de múnida) (Castillo et al., 2009; La Cruz et al., 2017).
El post-procesamiento de información y tratamiento de datos acústicos se efectúo de acuerdo al protocolo técnico para la evaluación acústica de las áreas de distribución y abundancia de recursos pelágicos en el mar peruano (Castillo et al., 2009).
La determinación de las áreas de distribución de la densidad y concentraciones de la anchoveta y la múnida fueron realizadas por interpolación de los datos NASC, que es una medida de la energía acústica retrodispersada de un blanco (especies evaluadas) en la columna de agua (ecointegración), obtenidos de la exportación de los cardúmenes y agregaciones detectados en el programa EchoView.
Asimismo, para la distribución vertical de las especies, se utilizó la fuerza del volumen de retrodispersión acústica (Sv, dB re 1 m-1), que indica la densidad de una agregación o cardumen, y que es directamente proporcional a la biomasa expresada en decibeles (Simmonds y MacLennan, 2005). Los estimados de abundancia o biomasa fueron obtenidos por el método de estratificación en Áreas Iso Paralitorales (AIP) de 18,52 × 55,56 km (10 × 30 mn), cuya formulación matemática está descrita en Castillo et al. (2009):
Donde B(i) se refiere a la biomasa en el AIP(n), A es igual al área expresada en mn2 de cada AIP. Los parámetros a y b son constantes de la relación longitud (cm)-peso (g) y L se refiere la talla media. TS (TS, Target Strength) se refiere a la ecuación de la fuerza de blanco para cada especie y rango de tallas especificas (Castillo et al., 2009).
Análisis de la relación recurso-ambiente
La relación de la presencia de anchoveta y múnida con las variables oceanográficas, fue realizado mediante los Modelos Aditivos Generalizados (GAM), de la familia gaussiana y función link: identidad. Previamente, fue realizado un análisis exploratorio con el fin de identificar las autocorrelaciones espaciales y la identificación de colinealidad de las variables explicativas, utilizando el método de Spearman (parcelas) (Zuur, 2012). Los GAM se aplican a un conjunto de datos acústicos y físico-oceanográficos para examinar los efectos de las variables ambientales sobre las distribuciones y/o densidades de la anchoveta y múnida.
La variable dependiente correspondió a las muestras acústicas de 1 mn con los valores NASC de anchoveta y múnida, y las variables independientes fueron la temperatura, salinidad y oxígeno disuelto en la superficie del mar. Los análisis se llevaron a cabo para cada crucero de investigación. Los valores NASC de las muestras acústicas se transformaron logarítmicamente debido a la amplia gama de valores.
Los análisis GAM, se realizaron con el paquete mgcv (versión 1,8-34) del programa R (R Development Core Team, 2020). La desviación explicada (análoga a la varianza en una regresión lineal), se ajustó de acuerdo a las puntuaciones r2 y generalised cross-validation(GCV). Se trazaron las formas funcionales para las covariables seleccionadas. Cuando las pendientes de las formas funcionales son positivas, las covariables están relacionadas positivamente con las variables dependientes o viceversa (Wood, 2006, 2017).
RESULTADOS
Condiciones oceanográficas
Condiciones oceanográficas superficiales
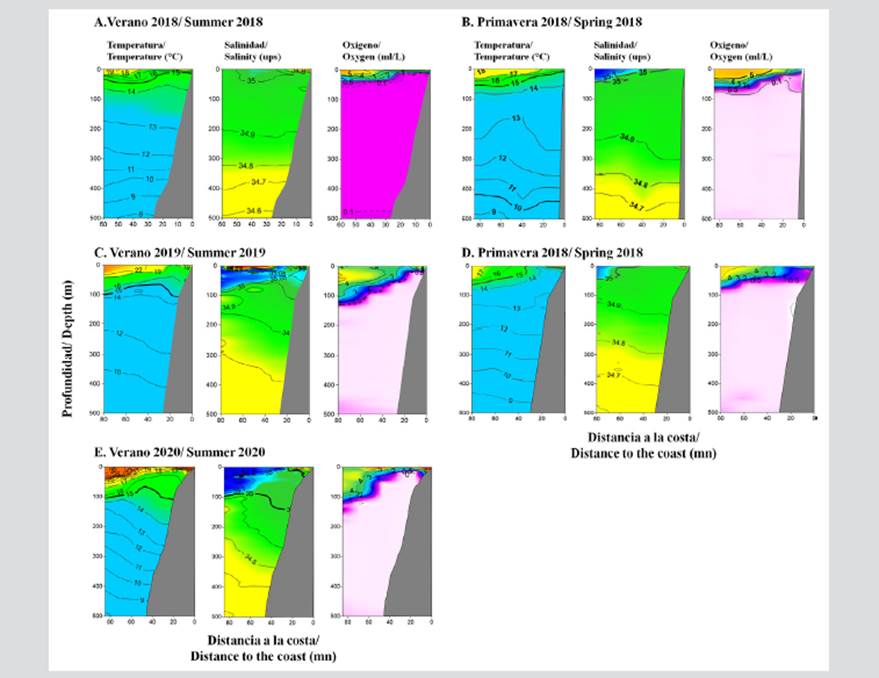
Las condiciones oceanográficas superficiales en el perfil frente a Pisco, en el verano de 2018, mostraron un predominio de condiciones de aguas frías con temperaturas alrededor de 19 °C, encontrándose los valores mayores a 21 °C por fuera de 92,6 km (50 mn). La salinidad en superficie se encontró entre 34,8 y 35,1 UPS, y los valores de oxígeno disuelto en superficie fueron mayores a 2 ml/l. En el verano de 2019, las condiciones fueron más cálidas con temperaturas entre 21 y 23 °C, con salinidades entre 34,8 y 35,3 UPS y valores de oxígeno mayores a 0,5 ml/l. En 2020 la temperatura fluctuó entre 19 y 24 °C, con salinidades de 34,8 UPS muy cerca a la costa y hasta 35,4 UPS alejadas de la costa, y con valores de oxígeno entre 5 y 7 ml/l.
Condiciones oceanográficas en la columna de agua
Las condiciones oceanográficas en el perfil frente a Pisco correspondieron a una zona de afloramiento costero de Aguas Costeras Frías (ACF) en primavera; y de agua de mezcla formada por ACF y Aguas Subtropicales Superficiales (ASS) en el verano. El perfil oceanográfico de Pisco se caracterizó por el ascenso de la isoterma de 15 °C, principalmente dentro de 50 m de profundidad durante 2018 y 2019, y por debajo de 80 m de profundidad en los veranos de 2019 y 2020.
La distribución de la salinidad registró la presencia de aguas de mezcla de ACF y ASS con la isohalina de 34,9 UPS ubicada entre 100 y 250 m de profundidad. Se registró el borde superior de la Zona Mínima de Oxígeno (ZMO) (valores de 0,5 ml/l) muy somera sobre la plataforma continental, principalmente en el verano y primavera de 2018 y profunda entre 50 y 120 m durante 2019 y 2020 (Figura 2).
Distribución horizontal de la anchoveta y múnida
La distribución de anchoveta fue principalmente costera, con dos características: (i) distribución discontinua y muy restringida a la costa dentro de los 37,04 km (20 mn) para 2019 y; (ii) distribución continúa para los veranos y primaveras de 2018 y 2020 (Figura 3a). Cabe resaltar que en 2018 la distribución de la anchoveta llego hasta 133,34 km (72 mn). A lo largo de la costa fueron observados importantes núcleos de alta concentración, principalmente localizados al norte de la RNP. Sin embargo, el área de la RNP concentró importantes densidades de anchoveta asociadas a una profundización de la ZMO en 2020.
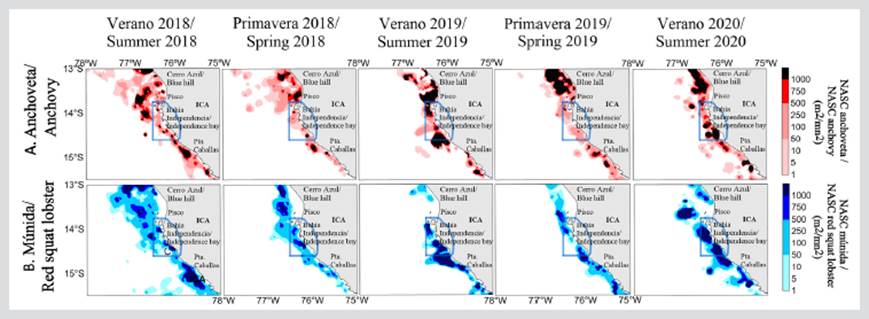
Figura 3 Distribución y concentración espacial de A) anchoveta y B) múnida durante 2018 - 2020 frente al Área Marina Protegida de la Reserva Nacional de Paracas (RNP), Pisco (Perú) (RNP, polígono de línea continua de color azul).
La múnida fue registrada a lo largo de la costa; generalmente tuvo una distribución continua durante 2018 y discontinua durante 2019 y 2020. Los núcleos de mayor abundancia se localizaron en la zona centro y sur de la RNP. Cabe indicar que durante el verano de 2018 la múnida presentó su mayor amplitud, registrándose hasta 138,9 km (75 mn) de distancia a la costa (Figura 3b), debido a una somera ZMO.
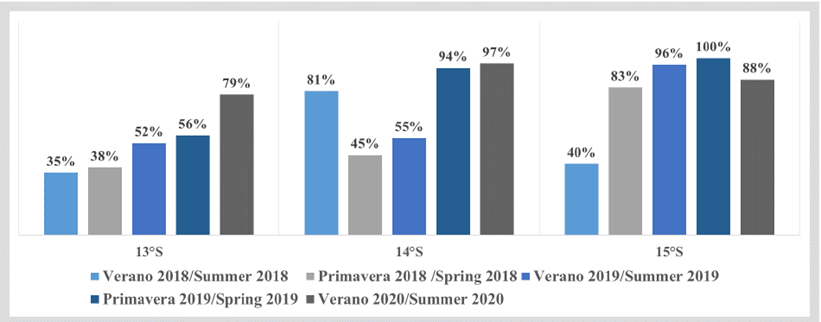
En algunas zonas al norte y sur de la RNP como Cañete, Punta Azua y San Nicolás se observaron registros acústicos de cardúmenes de anchoveta de altas abundancias formando cardúmenes tipo plumas y manchas con un rango de tallas entre 7 y 16 cm de longitud total (LT), compartiendo el hábitat con las agregaciones o enjambres de múnida (Figura 4). La estructura por tallas de la anchoveta capturada en el área evaluada, según grado de latitud, mostró la presencia dominante de individuos juveniles (tallas de LT menores a 12 cm). Los mayores porcentajes de juveniles fueron registrados en 15°S, seguida de 14°S y 13°S (Figura 5).
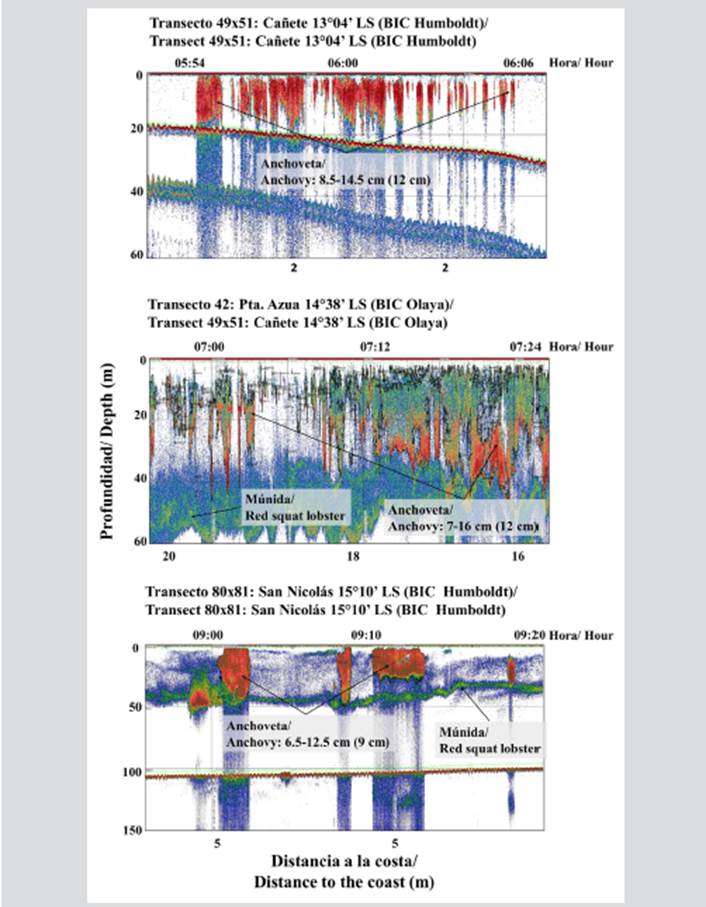
Figura 4 Registros típicos de anchoveta y múnida frente a la Reserva Nacional de Paracas (RNP). En cada imagen se muestra el rango de las tallas de anchoveta y en paréntesis la moda.
Distribución vertical de anchoveta y múnida
Verticalmente, los cardúmenes de anchoveta se encontraron a una profundidad media de 9,84 m y un rango de profundidad desde la superficie hasta 86,30 m. Los cardúmenes más someros se registraron frente a Cerro Azul y los más profundos al sur de Bahía Independencia, evidenciándose frente a la RNP un área de transición entre los cardúmenes más someros y profundos. La profundización de los cardúmenes de anchoveta en la zona sur se debió a la oxigenación de las capas más profundas de la columna de agua (> 30 m). Las mayores abundancias de anchoveta (> -45 dB) se encontraron principalmente en los primeros 20 m de la columna de agua (Figura 6a). Y en relación a las horas del día, los cardúmenes más densos fueron detectados durante las horas diurnas.
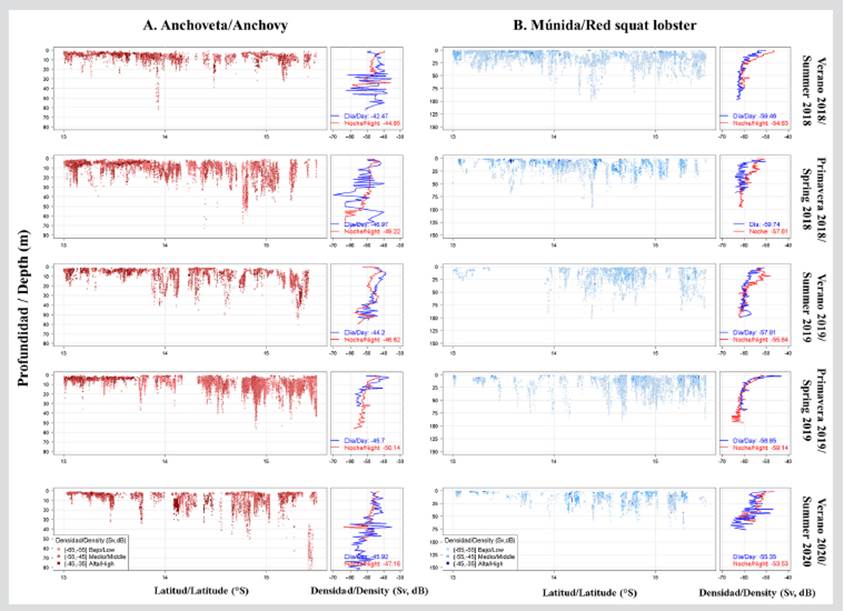
Figura 6 Distribución vertical de a) anchoveta y b) múnida frente a la Reserva Nacional de Paracas, Pisco (Perú) durante el periodo 2018-2020.
Verticalmente la múnida se registró entre 1,20 y 100,89 m de profundidad, con un valor medio de 18,23 m. Los registros más profundos se localizaron principalmente frente a Bahía Independencia; mientras que, las agregaciones más superficiales se registraron frente a Cerro Azul. Las mayores abundancias (> -55 dB) se encontraron principalmente en los primeros 25 m de la columna de agua y durante las horas de la noche (Figura 6b).
Biomasa acústica de anchoveta y múnida
En el área de estudio evaluada, las mayores biomasas acústicas de anchoveta fueron estimadas en13°S con 1 092 775,53 t (verano 2019) y 810 398,57 t (primavera 2019). Frente a 14°S y 15°S, las biomasas de anchoveta mostraron valores similares, con valores máximos durante los veranos del 2019 y 2020 (Figura 7). La biomasa acústica de la múnida ha sido variable frente a la RNP, mostrando una tendencia creciente entre 2018 y 2020. Registrándose en el verano de 2020, la mayor biomasa en 14°S con 995 972 t (Figura 7).
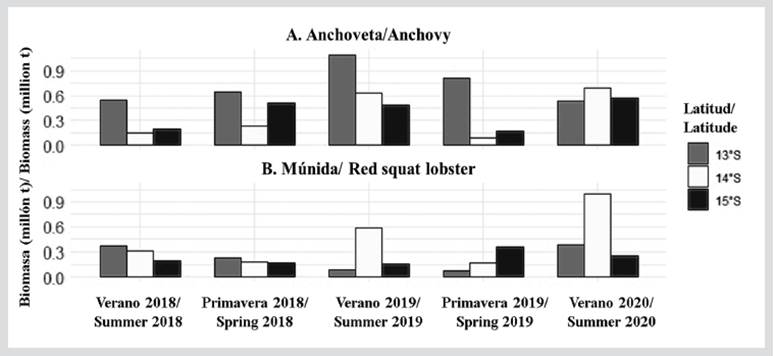
Figura 7 Biomasa de anchoveta y múnida frente a la Reserva Nacional de Paracas (RNP), Pisco (Perú) (13°S, 14°S y 15°S) durante el periodo 2018-2020.
Relación de la anchoveta y múnida con las variables oceanográficas superficiales
La anchoveta fue registrada principalmente cuando la Temperatura Superficial del Mar (TSM) registró valores entre 16°-18 °C durante 2018 y con valores mayores a 18 °C durante 2019 y 2020, la Salinidad Superficial del Mar (SSM) entre 34,97-35,05 ups y el Oxígeno Superficial del Mar (OSM) principalmente entre 4,0-5,4 ml/l y 6,3-7,7 ml/l (Figura 8).
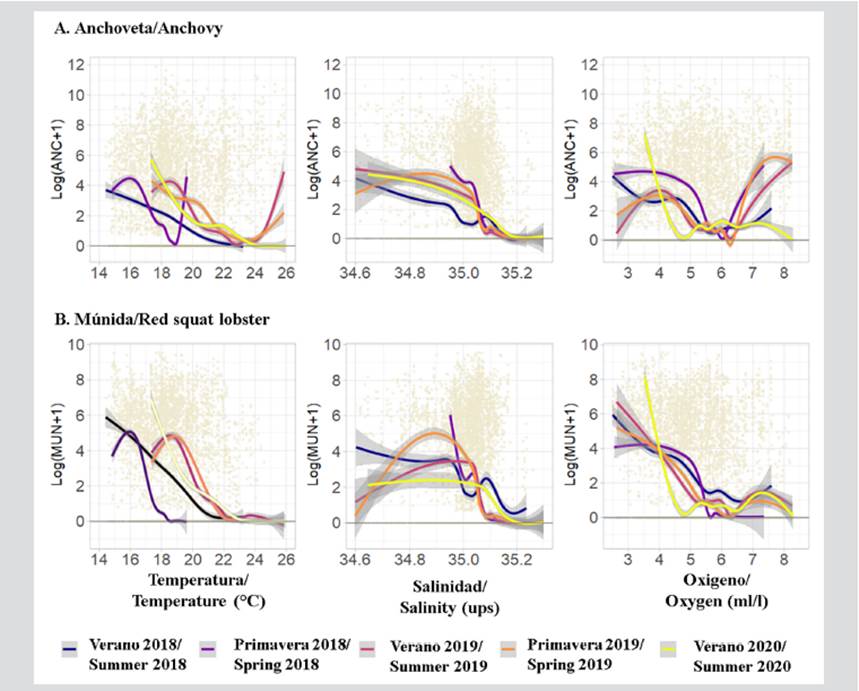
Figura 8 Resultados de los Modelos Aditivos Generalizados (GAM) de a) anchoveta y b) múnida en relación a la Temperatura, Salinidad y Oxígeno Superficial del Mar frente a la Reserva Nacional de Paracas (RNP), Pisco (Perú) durante el periodo 2018-2020.
Con respecto a la múnida, fue detectada principalmente cuando la TSM registró valores entre 14°-17 °C durante 2018 y con valores entre 18°-19 °C durante 2019 y 2020, la SSM entre 35,05-35,1 UPS y OSM principalmente entre 3,0-4,0 ml/l (Figura 8).
DISCUSIÓN
Las condiciones oceanográficas en el área de la RNP fueron variables en primavera y verano debido a la influencia de los intensos procesos de afloramiento costero y la presencia de una ZMO, lo cual determinó la ocupación espacial de la anchoveta y múnida en el hábitat pelágico. En el ecosistema marino peruano, la alta variabilidad oceanográfica es la normalidad (Espino, 2013; Flores et al., 2013). En el área de influencia de la RNP, frente a Pisco (13° 42,5´S) y San Juan (15° 20,0´S) se presentan las áreas de afloramiento más intensas del mar peruano, principalmente entre junio y agosto y diciembre a febrero (Zuta y Guillen, 1970; Walsh, 1975; Calienes, 2014; Palash, 2019). En estas áreas de afloramiento el agua fría llega hasta muy cerca de la costa y se advecta fuera de ella en una pluma entre 50 y 75 m de profundidad. Palash (2019) registra entre 11° y 16°S un gradiente de oxiclina somero cerca de la costa y profundo en aguas intermedias afuera de ella, con registros de altas abundancias de zooplancton principalmente en la zona costera. Este proceso oceanográfico ocurre en todas las áreas de afloramiento y esa heterogeneidad ambiental puede ser una clave en el desarrollo de la cadena alimentaria corta en el área de Pisco y San Juan: diatomeas-copépodos-engráulidos (Walsh y Dugdale, 1972; Ayon et al., 2008; Calienes, 2014), así como de la producción de biomasa pesquera (Bakun y Weeks, 2008).
Las evaluaciones hidroacústicas permitieron el mapeo de hábitats de las poblaciones de anchoveta y múnida en el área del ecosistema pelágico de la RNP. Entre 2018 y 2020, se estimaron altas biomasas para anchoveta (1,7 - 3,3 × 106 t) y múnida (1,43 - 1,60 × 106 t). Los cardúmenes de anchoveta estuvieron dominados por ejemplares juveniles distribuidos en la franja costera desde 9 a 86 m de profundidad (promedio 20 m) con altas concentraciones durante el día, mientras que los enjambres de múnida registraron una distribución más profunda, llegando hasta 100 m (promedio 18 m) y con registros de altas concentraciones durante la noche.
Los resultados son consistentes con la distribución y abundancia del stock Norte-Centro (02°-16°S) de la anchoveta en el ámbito de la Provincia Pacifico Sur Oriental Templada, influenciada por la Corriente de Humboldt (Bouchon et al., 2010; Castillo et al., 2019; Oliveros-Ramos et al., 2020), con biomasas que fluctúan entre 6 y 11 × 106 t y capturas de la flota cerquera industrial [operando fuera de 9,26 km (5 mn) de costa] entre 2 y 4 × 106 t en años recientes (Castillo et al., 2019; Oliveros-Ramos et al., 2020). Sin embargo, la zona de estudio corresponde al límite sur del Stock Norte-Centro de anchoveta, caracterizado por la mayor incidencia de cardúmenes de individuos juveniles (Imarpe, 2020). Mientras que la múnida presenta una distribución geográfica continua con núcleos de mayor abundancia en la costa central y sur del Perú (Castillo et al., 2020b).
La distribución espacial de recursos pelágicos neríticos como anchoveta y múnida está asociados con masas de aguas y frentes costeros de ACF y ASS, los cuales siguen la pluma de agua fría en áreas de afloramiento para forrajeo del zooplancton (Swartzman et al., 2008; Calienes, 2014). La múnida es considerada un indicador biológico de presencia de condiciones ambientales frías y distribuida en los principales focos de afloramiento (Aliaga et al., 2004; Gutiérrez, 2016; Santibáñez, 2017; Castillo et al., 2020b).
Registros acústicos indicaron que existe una sobreposición espacial entre la anchoveta y múnida durante el ciclo nictimeral regulada por la presencia de la ZMO. Durante el día y noche, la anchoveta se encuentra formando cardúmenes densos (plumas y capas) en los primeros metros de la columna del agua limitados a condiciones oxigenadas, mientras que la múnida, durante el día, realiza migraciones verticales formando enjambres densos en la zona anóxica de la ZMO. Y durante la noche, este crustáceo pelágico asciende a la superficie formando pequeñas sub-estructuras (Gutiérrez et al., 2008; Kiko et al., 2015; Gutiérrez y Gerlotto, 2016; Sanfuentes, 2017; Castillo et al., 2020b).
En el ecosistema marino peruano la presencia de una somera e intensa ZMO (< 0,5 ml/l, ~50-500 m), regula la distribución vertical de las especies pelágicas neríticas y oceánicas para el desarrollo de procesos bioecológicos (Cornejo, 2011; Lachkar y Gruber, 2012; Flores et al., 2013; Calienes, 2014; Espinoza-Morriberon et al., 2017; Palash, 2019; Castillo et al., 2020b).
De esta manera, el AMP de la RNP tiene un efecto beneficioso en la protección de la estructura, función e integridad de los ecosistemas marinos y la productividad pesquera (Kellner et al., 2007;Boerder et al., 2017; Elliot et al., 2017; Laffoley et al., 2019, Cutipa-Luque et al., 2020), permitiendo mejorar la capacidad reproductiva, crianza y alimenticia de stocks locales y regionales de la anchoveta y múnida, fortaleciendo su reclutamiento mediante el efecto de desborde de adultos y juveniles hacia áreas adyacentes al AMP. Asimismo, la RNP y las AMPs de la costa peruana pueden ofrecer una alternativa para garantizar que los niveles de extracción no sobrepasen los límites de sostenibilidad o que el tamaño de la población no disminuya más allá del nivel mínimo necesario, asegurando la viabilidad y sostenibilidad del Stock de anchoveta y de otros recursos pelágicos en el SNCH a mediano y largo plazo.
Es necesario desarrollar un programa de investigación integrativo en el AMP de la RNP y sus zonas contiguas considerando el monitoreo y evaluación científica de parámetros poblacionales de recursos hidrobiológicos, censos de biodiversidad marina, entre otros, con la finalidad de promover el aprovechamiento sostenible y conservación de la diversidad biológica de los ecosistemas marino-costeros a través de la zonificación ecológica y económica. Así como, la propuesta de valor de promoción de otras AMP en el ecosistema marino peruano, dado que presenta una baja cobertura de territorio marino protegido a nivel de América Latina y el Caribe.
CONCLUSIONES
La ocupación espacial del hábitat pelágico de la anchoveta y múnida en la RNP estuvo influenciada por la dinámica de afloramientos, masas de aguas y una somera e intensa ZMO. Se registró una sobreposición espacial de altas biomasas de anchoveta y múnida en la capa superficial durante la noche. Aunque, con presencia de enjambres densos de múnida en aguas intermedias anóxicas de la ZMO durante el día. El AMP de la RNP funciona como zona de protección de la estructura y funcionamiento del ecosistema pelágico nerítico y fortalece la producción pesquera del stock de anchoveta en el SNCH.
AGRADECIMIENTOS
A la dotación de los BIC´s Humboldt, José Olaya Balandra y Luis Flores Portugal. Al Área Funcional de Hidroacústica (AFH) de la Dirección General de Investigaciones en Hidroacústica, Sensoramiento Remoto y Artes de Pesca (DGIHSA) del Imarpe. Contribución del Objetivo 13: Aplicación del Método Hidroacústico en la Evaluación de Recursos Pesqueros. Dghisa, AFH, Imarpe.
REFERENCIAS
Aliaga, A., C. Salazar y J. Calderón. 2004. Distribución de anchoveta, múnida y calamar común en el norte del Perú, durante el verano 2001. Inf. Inst. Mar Perú, 32(3): 225-229. [ Links ]
Ayón, P., M.I. Criales-Hernández, R. Schwamborn and H. J. Hirche. 2008. Zooplankton research off Peru: A review. Prog. Oceanogr., 79(2-4): 238-255, https://doi.org/10.1016/j.pocean.2008.10.020 [ Links ]
Bakun, A. and S. J. Weeks. 2008. The marine ecosystem off Peru: what are the secrets of its fishery productivity and what might its future hold? Progr. Oceanogr., 79(2-4): 290-299. [ Links ]
Boerder, K., A. Bryndum-Buchholz and B. Worm. 2017. Interactions of tuna fisheries with the Galápagos marine reserve. Mar. Ecol. Prog. Ser., 585: 1-15. https://doi.org/10.3354/meps12399 [ Links ]
Bouchon, M., P. Ayón, J. Mori, C. Peña, P. Espinoza, I. Hutchings, B. Buitrón, A. Perea, C. Goicochea y M. Messie. 2010. Biología de la anchoveta peruana (Engraulis ringens Jenyns). Bol. Inst. Mar Perú, 25(1-2): 23-30. [ Links ]
Calienes, R. 2014. Producción primaria en el ambiente marino en el Pacífico sudeste, Perú, 1960-2000. Bol. Inst. Mar Perú, 29(1-2): 232-288. [ Links ]
Carrit, D. E. and J. H. Carpenter. 1966. Comparison and evaluation of currently employed modification of the Winkler method for determining dissolved oxygen in sea-water. J. Mar. Res., 24: 286-318. [ Links ]
Castillo, P. R., S. Peraltilla, A. Aliaga, M. Flores, M. Ballón, J. Calderón y M. Gutiérrez. 2009. Protocolo técnico para la evaluación acústica de las áreas de distribución y abundancia de recursos pelágicos en el mar peruano. Versión 2009. Bol. Inst. Mar Perú, 36(1-2): 7-28. [ Links ]
Castillo, R., L. Dalla Rosa, W. García Díaz, L. Madureira, M. Gutiérrez, L. Vásquez and R. Koppelmann. 2019. Anchovy distribution off Peru in relation to abiotic parameters: a 32-year time series from 1985 to 2017. Fish. Oceanogr., 28: 389-401. [ Links ]
Castillo, R. , L. La Cruz, D. Grados, R. Cornejo, R. Guevara-Carrasco, R. and J. Csirke. 2020a. Anchoveta (Engraulis ringens) biomass in the Peruvian marine ecosystem estimated by various hydroacoustic methodologies during spring of 2019. J. Mar. Biol. Oceanogr., 9: 2. [ Links ]
Castillo, R. , R. Cornejo, L. La Cruz, D. Grados, G. Cuadros, C. Valdez y M. Pozada. 2020b. Distribución y biomasa de recursos pelágicos neríticos y oceánicos en el ecosistema marino peruano obtenidos de los cruceros hidroacústicos en el 2019. Bol. Inst. Mar. Perú, 35(2): 213-241. [ Links ]
Chirichigno, F. 1970. Lista de crustáceos del Perú. Inf. Inst. Mar. Perú, 35: 1-92. [ Links ]
Chirichigno, F. y R. M Cornejo. 2001. Catálogo comentado de los peces marinos del Perú. Inst. Mar Perú Publ. Esp. 314 pp. [ Links ]
Cornejo, R. 2011. Caracterización biofísica del micronecton en relación a condiciones oceanográficas de meso-escala en el Sistema de la Corriente de Humboldt frente al Perú. Univ. Concepción, Fac. Cienc. Nat. Oceanogr., Dpto. Oceanogr. http://repositorio.udec.cl/jspui/handle/11594/6140 [ Links ]
Cutipa-Luque, L.M., L. Alvariño y J.A. Iannacone. 2020. Situación actual de las áreas marinas protegidas en el Perú y propuestas de conservación. Paideia XXI, 10 (2): 573-612. [ Links ]
Decreto Supremo N° 1281- 75-AG. Por medio del cual se estableció la Reserva Nacional de Paracas, ubicada en la provincia de Pisco, en el departamento de Ica, Área Natural Protegida que conserva una muestra representativa de los ecosistemas marino-costeros del Perú. 25 de setiembre de 1975. [ Links ]
Demer, D. A., L. Berger, M. Bernasconi, E. Bethke, K. Boswell, D. Chu, R. Domokos et al. 2015. Calibration of acoustic instruments. ICES Coop. Res. Rep., 326, 133 p. [ Links ]
Elliott, S.A.M., A.D. Sabatino, M.R. Heath, W. R. Turrell and D. M Bailey. 2017. Landscape effects on demersal fish revealed by field observations and predictive seabed modelling. Plos One, 12(12); e0189011. https://doi.org/10.1371/journal.pone.0189011 [ Links ]
Espino M. 2013. El jurel Trachurus murphyi y las variables ambientales de macroescala. Rev. Per. Biol., 20(1): 9-20. [ Links ]
Espinoza-Morriberon, D., V. Echevin, F. Colas, J. Tam, J. Ledesma, L. Vásquez and M. Graco. 2017. Impacts of El Nino events on the Peruvian upwelling ~ system productivity. J. Geophys. Res. Oc., 122, https://doi.org/10.1002/2016JC012439 [ Links ]
FAO. 2012. Estado de las áreas marinas y costeras protegidas en América Latina. Redparques Cuba, Santiago. 620 p. [ Links ]
Flores, D., A. Tejada, H. Sarmiento, R. Muñoz y J. Macalupú. 2019. Línea base del sitio piloto Punta San Juan: recursos pesqueros. Inf. Inst. Mar Perú, 46(1): 78-87. [ Links ]
Flores R., M. Espino, G. Luque y J. Quispe. 2013. Patrones de variabilidad ambiental en el mar peruano. Rev. Per. Biol., 20(1): 21 - 28. [ Links ]
Goya, E., C. Cardich, M. Llapapasca, J. Márquez, M. Meza y S. Rivadeneyra. 2020. Aves marinas en las islas Ballestas y Chincha, GEF-UNDP Perú, 2013. Inf. Inst. Mar Perú, 47(1): 65-79. [ Links ]
Guezel, R. y J. Wickel. 2015. Riqueza ecológica marina y áreas vulnerables de la Bahía de Paracas. Saber Hacer, 2 (1): 50-64. [ Links ]
Gutiérrez, M. y F. Gerlotto. 2016. Dinámica de la interacción espacial entre agregaciones de anchoveta (Engraulis ringens) y la pequeña langosta múnida (Pleuroncodes monodon) en el curso de un ciclo nictemeral. Inf. Inst. Mar Perú, 43(3): 264-274. [ Links ]
Gutiérrez, M., A. Ramírez, S. Bertrand, O. Morón and A. Bertrand. 2008. Ecological niches and areas of overlap of the squat lobster ‘munida’ (Pleuroncodes monodon) and anchoveta (Engraulis ringens) off Peru. Progr. Oceanogr., 79: 256-263. [ Links ]
Imarpe. 2020. Situación del stock Norte-Centro de la anchoveta peruana (Engraulis ringens) al mes de mayo de 2020 y perspectivas de explotación para la primera temporada de pesca del año. Inf. Inst. Mar Perú, 57 p. [ Links ]
Jacinto, M. 2014. Propuesta de un sistema de indicadores ambientales y socio económicos en la zona marino costera de Pisco - Paracas. Tesis Maestría Gestión Ambiental, 117 p. [ Links ]
Kellner, J.B., I. Tetreault, S.D. Gaines and R. M. Nisbet. 2007. Fishing the line near marine reserves in single and multispecies fisheries. Ecol. Appl., 17: 1039-1054. https://doi.org/10.1890/05-1845 [ Links ]
Kiko, R., H. Hauss, M. Dengler, S. Sommer and F. Melzner. 2015. The squat lobster Pleuroncodes monodon tolerates anoxic “dead zone” conditions off Peru. Mar. Biol., 162: 1913-1921. [ Links ]
Lachkar, Z. and N. Gruber. 2012. A comparative study of biological production in eastern boundary upwelling systems using an artificial neural network, Biogeosciences, 9: 293-308, https://doi.org/10.5194/bg-9-293-2012 [ Links ]
La Cruz, L., R. Castillo, J. Robles, C. Valdez and R. Cornejo. 2017. Pelagic species identification using multifrequency acoustic in the northern Humboldt Current System off Peru. 2017 IEEE/OES Acoustics in Underwater Geosciences Symposium (RIO Acoustics). https://doi.org/10.1109/rioacoustics.2017.8349744 [ Links ]
Laffoley, D. and J. M. Baxter. 2019. Ocean deoxygenation: everyone’s problem. Summary for policy makers. https://doi.org/10.2305/iucn.ch.2019.14.en [ Links ]
Maclennan, D., P. Fernandes and J. Dalen 2002. A consistent approach to definitions and symbols in fisheries acoustics. ICES J. Mar. Sci., 59(2): 365-369. https://doi.org/10.1006/jmsc.2001.1158 [ Links ]
Messié, M. and F. P. Chavez. 2015. Seasonal regulation of primary production in eastern boundary upwelling systems. Progr. Oceanogr., 134: 1-18. [ Links ]
Oliveros-Ramos, R., M. Ñiquén, J. Csirke and R. Guevara-Carrasco. 2020. Management of the Peruvian anchoveta (Engraulis ringens) fishery in the context of climate change. In Bahri, T., M. Vasconcellos, J. Johnson, D. Welsh, X. Ma and I. Perry (Eds). Adaptive management of fisheries in response to climate change. FAO Fish. Aq. Techn. Pap., 667. [ Links ]
Palash, S. A. 2019. Fine-scale vertical distribution of zooplankton in the oxygen minimum zone off Peru. M. Sc. thesis, Christian-Albrechts-Univ. Kiel, Kiel. 57 p. [ Links ]
Paz, N., J. Reyes y M. Echegaray. 2002. Datos sobre captura, comercio y biología de tortugas marinas en el área de Pisco-Paracas. Resumen I Jorn. Cient. Res. Nal. Paracas, 125-19 p. [ Links ]
R Core Team. 2020. R: A language and environment for statistical computing. Vienna, R Foundation for Statistical Computing. Retrieved from https://www.R-project.org/ [ Links ]
Reyes, J. C., M. Echegaray, H. Anchante, M. Ormeño y A. Altamirano. 2007. Nueva información sobre bufeos costeros y otros cetáceos menores en la Reserva Nacional de Paracas y su área de amortiguamiento. Resumen II Jorn. Cient. Res. Nal. Paracas. Pisco. [ Links ]
Sanfuentes, F. 2017. Recopilación de antecedentes biológicos pesqueros del langostino enano (Pleuroncodes sp.) en Chile y Perú. Centro Invest. Apl. Mar, 24 p. [ Links ]
Santivañez, M. 2017. Caracterización y comparación de patrones espacio temporales y nichos ecológicos de la múnida (Pleuroncodes monodon) y la anchoveta (Engraulis ringens) en el mar peruano desde 1998 hasta 2013. Tesis Biólogo, Univ. Nal. Mayor San Marcos Lima. 134 p. [ Links ]
Simmonds, J. and D. MacLennan. 2005. Fisheries acoustics: theory and practice, Blackwell Science, Oxford. [ Links ]
Spalding, M., M. Imèn, M. Amy, A. Fitzgerald and L. Hale. 2013. Coastal and marine spatial planning. Ocean Yearb., 27: 213-248. [ Links ]
Strub, T. P., J.M. Mesías, V. Montecino, J. Rutllant and S. Salinas. 1998. Coastal ocean circulation off western South America: 273-313. In: Robinson, A.R. y K.H. Brink (Eds). The global coastal ocean. The Sea 11, Interscience, New York. [ Links ]
Swartzman, G., A. Bertran, M. Gutiérrez, S. Bertrand and L. Vásquez. 2008. The relationship of anchovy and sardina to water masses in the Peruvian Humboldt Current System from 1983-2005. Progr. Oceanogr., 79: 228-237. [ Links ]
Vélez, J. 1975. Contribución al conocimiento de la ictiofauna marina de Pisco. Tesis, Univ. Nal. Mayor San Marcos, Lima. [ Links ]
Vildoso, A., J. Vélez, N. Chirichigno y A. Chirinos de Vildoso . 1999. Diversidad de los peces marinos del Perú. Bol. Inst. Mar Perú, 18(1-2): 49-76. [ Links ]
Walsh, J.J. 1975. A spatial simulation model of the Peru upwelling ecosystem. Deep-Sea Res., 22: 202-216. [ Links ]
Walsh, J.J. and R.W. Dugdale. 1972. Nutrient submodels of phytoplankton production in the sea. In:Allen, H.E. and Kramer J.R. (Eds). Nutrient in natural waters. Wiley. [ Links ]
Wood, S.N. 2006. Generalized additive models: an introduction with R. Chapman and Hall, New York. [ Links ]
Wood, S. N. 2017. Generalized additive models: an introduction with R. 2nd ed. CRC. [ Links ]
Zuta, S. y O. Guillén. 1970. Oceanografía de las aguas costeras del Perú. Bol. Inst. Mar Perú, 2(5): 157-324. [ Links ]
Zuur, A.F. 2012. A beginner’s guide to generalized additive models with R. Highland Statistics, Newburgh, England. [ Links ]
Recibido: 18 de Septiembre de 2020; Aprobado: 27 de Agosto de 2021











 texto en
texto en