Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta jan./jun. 2022 Epub 01-Ago-2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1096
Artículos de Investigación
Tortugas marinas en el mosaico de conservación Bahía Málaga, Pacífico colombiano
1Fundación Tortugas del Mar - FTM, Iniciativa Carey del Pacífico Oriental - Icapo, Wider Caribbean Sea Turtle Conservation Network - Widecast y Parques Nacionales Naturales de Colombia, Los Corales del Rosario y de San Bernardo. karla.barrientos@udea.edu.co
2Centro de Investigación en Limnología y Ciencias del Mar (CIMAR), Universidad de Costa Rica, San Pedro, Costa Rica; Centro de Rescate de Especies Marinas Amenazadas, Heredia, Costa Rica. maike.heidemeyer@ucr.ac.cr
3Centro de Investigación en Limnología y Ciencias del Mar (CIMAR), Universidad de Costa Rica, San Pedro, Costa Rica; Centro de Rescate de Especies Marinas Amenazadas, Heredia, Costa Rica. luferorg@gmail.com
4Consejo Comunitario de La Plata Bahía Málaga, Buenaventura y Asociación comunitaria de bahía Málaga Ecomanglar, Buenaventura. Colombia. ecomanglarpacifico@gmail.com
5Asociación de pescadores tradicionales de Bahía Málaga Los Esteros, Buenaventura. Buenaventura. Colombia carlosa1989@hotmail.es
6Consejo Comunitario de las Comunidades Negras de la Plata Bahía Málaga, Buenaventura. Colombiaconsejobahiamalaga@gmail.com
7Parques Nacionales Naturales de Colombia, Uramba Bahía Málaga. Valle del Cauca. Colombiaregulacion.uramba@parquesnacionales.gov.co
8Conservation International Colombia. Bogotá. Colombia. mdiazgranados@conservation.org,
9Conservation International Colombia. Bogotá. Colombia jcaldas@conservation.org
10Conservation International Colombia, Corporación Autónoma Regional del Valle del Cauca-CVC, Buenaventura. Colombia. biologosevilla@gmail.com
11Centro de Rescate de Especies Marinas Amenazadas, Tibás, San José, Costa Rica, rarauz@finsattached.org
12Fundación Tortugas del Mar - FTM y Iniciativa Carey del Pacífico Oriental-Icapo. Colombia ramirezgallego.cristian@gmail.com
Entre 2016-2020 se caracterizaron las especies y tamaños de las tortugas marinas presentes en el Mosaico de Conservación Bahía Málaga, Valle del Cauca por medio de monitoreo acuático y la entrega voluntaria por parte de los pescadores del área. El registro de individuos fue determinado mediante monitoreo acuático, que se dividió en tres fases: muestreo exploratorio, muestreo continuado, muestreo estandarizado, además de entregas voluntarias por los pescadores en sus faenas de pesca. Se emplearon 107 horas de esfuerzo para un total de 51 individuos de tortuga carey (Eretmochelys imbricata) y negra (Chelonia mydas) registradas. Estos resultados contribuyen como línea base para el conocimiento de las tortugas marinas como estrategia efectiva para la investigación y conservación de bahía Málaga.
Palabras clave: Eretmochelys imbricata; Chelonia mydas; monitoreo acuático; Oceáno Pacífico.
The species and sizes of sea turtles present in the Bahía Málaga Conservation Mosaic, Valle del Cauca, were characterized between 2016-2020 through aquatic monitoring and voluntary delivery by native fishermen. The registry of individuals was determined by aquatic monitoring, which was divided into three phases: exploratory sampling, continuous sampling, standardized sampling, plus voluntary deliveries by fishermen in their fishing tasks. A total of 107 hours of effort were used to detect 51 individuals of hawksbill (Eretmochelys imbricata) and black (Chelonia mydas) turtles. These results contribute as a baseline for the knowledge of sea turtles as an effective strategy for research and conservation in Bahía Málaga.
KEYWORDS: Eretmochelys imbricata; Chelonia mydas; in-water monitoring; Pacific Ocean
INTRODUCCIÓN
El océano Pacífico Oriental es una de las áreas más importantes de alimentación y anidación para cuatro especies de tortugas marinas (Groombridge y Luxmoore, 1989; Seminoff et al., 2012). Su compleja oceanografía y biogeografía, caracterizada por su angosta plataforma continental, extensas áreas de aguas profundas y el fenómeno del Niño-Oscilación del Sur (ENSO) constituyen hábitats altamente dinámicos para las tortugas marinas, cuyas poblaciones se adaptaron con una plasticidad en su biología, comportamiento, morfología y demografía comparado con sus con-específicos en otras regiones del mundo (Seminoff et al., 2012).
Las tortugas marinas son altamente migratorias con una compleja historia de vida que incluye la migración de adultos de áreas de alimentación a distantes áreas de reproducción y cambios ontogénicos que condiciona la distribución de juveniles en una variedad de hábitats marinos (Jensen et al., 2013). En este complejo ciclo de vida, el hábitat de anidación ocupa menos de 1 % de su tiempo de vida promedio (Bjorndal, 1999a), pero es allí donde se realizan la mayor parte de los estudios por facilidad logística y menores costos. Los estudios en zonas de alimentación son difíciles y costosos (Rincón-Díaz y Rodríguez-Zárate, 2004), pero para comprender la historia de vida de las tortugas marinas y gestionar de manera efectiva su conservación, es indispensable realizar esfuerzos en zonas de alimentación, tránsito y residencia (Bjorndal, 1999b; Broderick et al., 2007; Gaos et al., 2012; Barrientos-Muñoz et al., 2015a, 2015b; Páez et al., 2015; Ramírez-Gallego et al., 2015). Por lo cual, monitoreos continuos, sistemáticos y estandarizados son urgentes para conocer el estado actual de las tortugas marinas, que además permitan comprender el aporte de las tortugas marinas de esta zona para las poblaciones del Pacífico Oriental (Barrientos-Muñoz et al., 2015a; Barrientos-Muñoz et al., 2015b; Páez et al., 2015; Ramírez-Gallego et al., 2015; Barrientos-Muñoz et al., 2020).
De las cinco especies de tortugas marinas identificadas en Colombia, cuatro tienen presencia en el Pacífico: la tortuga caná (Dermochelys coriacea), la tortuga verde del Pacífico y en la región conocida como “tortuga negra” (Chelonia mydas), la tortuga carey (Eretmochelys imbricata) y la tortuga golfina (Lepidochelys olivacea), todas categorizadas como especies bajo algún riesgo de extinción por la Unión Internacional para la Conservación de la Naturaleza (IUCN por sus siglas en inglés) (Seminoff, 2004; Abreu-Grobois y Plotkin, 2008; Mortimer y Donelly, 2008; Wallace et al., 2013) y a nivel nacional por el Libro Rojo de Réptiles de Colombia (2015) (Barrientos-Muñoz et al., 2015a, 2015b; Páez et al., 2015; Ramírez-Gallego et al., 2015). Además, todas se encuentran en el Apéndice I de CITES y están protegidas por diferentes normativas nacionales e internacionales (ver fichas de tortugas marinas en Morales-Betancourt et al., 2015).
De acuerdo con Barreto-Sánchez (2011), en el Pacifico colombiano 40 % de las investigaciones en tortugas marinas son llevadas a cabo en playas de anidación y solo 12 % en zonas de alimentación. En el departamento del Chocó, se han llevado a cabo principalmente estudios en playas de anidación de la tortuga golfina en el Parque Nacional Natural (PNN) Utría y su zona de amortiguamiento (Amorocho et al., 1992; Amorocho, 1993; Martínez, 1999; Martínez y Páez, 2000; Hinestroza y Páez, 2001; Barrientos-Muñoz et al., 2014; Barrientos-Muñoz et al., 2014, 2015b) y se registra anidación esporádica de la tortuga negra (Barrientos-Muñoz et al., 2013). Mientras que los juveniles de carey han sido observados en los parches de coral de Punta Diego y el arrecife de la Aguada del PNN Utría (Ramírez-Gallego obs.). De manera similar, en el departamento de Nariño, en el PNN Sanquianga, los estudios se han enfocado en playas de anidación de la tortuga golfina y tortuga negra (Ceballos-Fonseca et al., 2003; Caicedo et al., 2009; Muñoz et al., 2010). Estudios que implican zonas de anidación y alimentación provienen únicamente del departamento del Cauca, en el PNN Gorgona (McCormick, 1996; Sánchez y Quiroga, 2002; Pavia et al., 2007; Gaos et al., 2010; Payan et al., 2010; Zorilla, 2011; Tobón-López y Amorocho, 2014). Donde se registra la anidación de la tortuga golfina y de la tortuga negra esporádicamente, además de la presencia en agua de la tortuga caná y carey (McCormick, 1996; Amorocho et al., 2001; Sánchez y Quiroga, 2002; Payan et al., 2010; Zorilla, 2011; Rivera-Gómez et al., 2016).
En 2003, el Instituto de Investigaciones Marinas y Costeras-Invemar realizó un recorrido por el Pacífico colombiano para confirmar especies, sitios de anidación y alimentación de tortugas marinas, pero el sector comprendido entre la bahía de Buenaventura y Cabo Corrientes no fue recorrido por presupuesto y se afirma que, al ser un área con manglares y acantilados, no son hábitats típicos para las tortugas marinas (Ceballos-Fonseca et al., 2003). De manera consecuente, el departamento del Valle del Cauca es el sitio de menor información sobre las tortugas marinas a lo largo del litoral Pacífico colombiano. En el Santuario de Fauna y Flora Malpelo, hay avistamiento esporádico de tortugas juveniles de carey y negras, mientras se realiza el monitoreo de los tiburones (Fundación Malpelo, com. pers). En bahía Málaga, la playa de Puerto España ha sido registrada como un sitio de anidación para la tortuga golfina (Merizalde et al., 2005; Nuñez, 2007; Barreto-Sánchez, 2011; Cubillos, 2016); y las comunidades asentadas al interior de la bahía, confirman el avistamiento en agua y una continua interacción de tortugas marinas en sus artes de pesca artesanal. Barrientos et al. (2020) registraron la primera hembra de tortuga carey para el Pacífico colombiano en el mosaico de conservación de bahía Málaga.
El presente estudio hace parte del primer esfuerzo interinstitucional, intersectorial y comunitario entre el 2016 - 2020 en el Pacífico de Colombia dirigido a identificar las especies de tortugas marinas, tamaños, estructura poblacional, potenciales sitios de alimentación, residencia y/o tránsito y amenazas por medio del monitoreo acuático y la entrega voluntaria de pescadores locales de las tortugas marinas que ocurren en el mosaico de conservación bahía Málaga.
ÁREA DE ESTUDIO
El mosaico de bahía Málaga (3º56’-4º05’ N, 77º19’-77º21’ O) se encuentra localizada en el Pacífico Oriental, en la vertiente occidental de la cordillera Occidental, en el Pacífico colombiano, departamento del Valle del Cauca, Distrito de Buenaventura (Cantera et al., 1999) (Figura 1). Tiene un área aproximada de 136 km2, correspondiente a su componente marino-costero. La bahía es reconocida como zona estuarina con playas arenosas, rocosas y fangosas, además con acantilados y aproximadamente 3000 ha de bosques de manglar (Cantera, 1991; Cantera et al., 1999). Presenta una humedad relativa de 90 % y una precipitación de 9000 mm, con un bosque muy húmedo tropical (bmh-T).
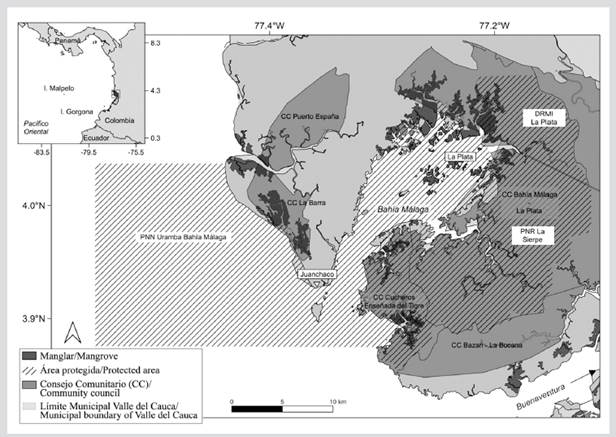
Figura 1 Área de estudio. Mosaico de conservación bahía Málaga en el Pacífico de Colombia. El mosaico está compuesto por las áreas protegidas Parque Nacional Natural (PNN) Uramba Bahía Málaga, el Distrito Regional de Manejo Integrado (DRMI) La Plata y el Parque Nacional Regional (PNR) La Sierpe y los consejos comunitarios (CC).
Bahía Málaga es un ecosistema estratégico del Pacifico oriental tropical, por los bienes y servicios ambientales que provee y por ser hábitat de una amplia diversidad de especies (Castellanos-Galindo et al., 2006; Molina et al., 2006; Invemar et al., 2006). El mosaico de conservación constituido por el PNN Uramba-Bahía Málaga, el Parque Regional Natural (PRN) de La Sierpe, el Distrito de Manejo Integrado (DMI) La Plata, Bahía Málaga, territorios colectivos de comunidades negras y resguardos indígenas. El mosaico es el resultado del trabajo continuo y coordinado entre autoridades ambientales de índole nacional y regional como Parques Nacionales Naturales de Colombia y la Corporación Autónoma Regional del Valle del Cauca-CVC, con los consejos comunitarios: La Plata - Bahía Málaga, Chucheros, La Barra y Puerto España - Miramar y las comunidades indígenas de la etnia Wounaan para el manejo, ordenamiento y conservación de este “Hot Spot” de la biodiversidad de la naturaleza a escala global (Resolución 1501 de 2010).
De acuerdo con entrevistas no estructuradas, existe un conocimiento tradicional de la población local sobre las tortugas marinas. Éstas, son observadas al interior de la bahía y/o interactuando con sus artes de pesca artesanal en o cerca de las más de 101 islas e islotes y en una entramada de canales y esteros identificado como el archipiélago de La Plata. Los sitios seleccionados para el esfuerzo de captura en el monitoreo acuático se realizó junto a pescadores locales y a partir del intercambio de conocimiento tradicional y científico.
MATERIALES Y MÉTODOS
Monitoreo acuático
El intercambio de conocimiento local-científico y la articulación con la Asociación de pescadores tradicionales de Bahía Málaga Los Esteros-ASOPES-permitió identificar y seleccionar los sitios importantes de avistamiento y potencial captura de tortugas marinas en la bahía. Se realizó el monitoreo acuático que incluyó tres fases de trabajo desde 2016 a 2020: monitoreo exploratorio con redes de trasmallo, monitoreo continuado/adaptado con red de enmalle y un monitoreo estandarizado.
Muestreo exploratorio con redes de trasmallo:
En el primer semestre de 2016, se realizaron dos jornadas de monitoreo acuático de cinco días cada una, empleando entre tres y cuatro redes tipo chinchorro adaptadas para capturar tortugas marinas. Estas redes son manufacturadas con hilo de seda, cada una de aproximadamente 80 m de largo, 8 m de altura y una luz de malla de 30 a 45 cm y con menos plomo de un chinchorro típico para evitar el ahogamiento de las tortugas en caso de ser capturadas. De dos a tres veces por día, las redes fueron tendidas y retiradas por periodos de 1-2 horas. Los movimientos, los cambios repentinos en la velocidad y en la dirección de la marea, determinaron el tiempo de esfuerzo en que la malla estuvo tendida. El nombre y georeferenciación con GPS en cada sitio donde se realizó el tendido de la malla fue registrado y si las condiciones de visibilidad y seguridad para ingresar al agua lo permitían, se procedía a revisar la red cada 40 minutos mediante buceo en apnea con snorkel para encontrar tortugas marinas enmalladas y subirlas al bote (ver métodos similares en Carrión-Cortez et al. (2013) y Chacón-Chaverri et al. (2015).
Muestreo continuado/adaptado con red de enmalle:
Desde el segundo semestre de 2016 se diseñó y estandarizó el método de captura de las tortugas marinas junto con los pescadores y líderes de las comunidades de bahía Málaga. Usando una red de enmalle elaborada en multifilamento de nylon torsionado (calibre 18), de 100 m de longitud por 8 m de fondo y luz de malla de 50 cm, se realizó el esfuerzo de captura en diferentes sitios donde comúnmente la comunidad ha avistado tortugas marinas y/o donde éstas han interactuado con las artes de pesca. Estos sitios generalmente son promontorios rocosos (denominados localmente como riscales, o troncos) a los que se asocian corales, esponjas y algas; La malla también fue desplegada en islotes y esteros.
En cada sitio donde se desplegó la malla, se realizó un avistamiento previo desde un bote y/o desde los riscales por un periodo de 15 minutos con el motor apagado, para detectar las tortugas saliendo a respirar y así, visualizar un punto preciso para hacer el tendido de ésta y aumentar las probabilidades de captura. Después de transcurridos los 15 minutos y no se avistaban tortugas, se procedía con el tendido de la malla. Ésta fue desplegada y recogida por períodos de entre 30 a 60 minutos con la ayuda de un bote con motor fuera de borda y otro bote más pequeño al remo. Dos personas en el bote pequeño revisaron manualmente la malla de manera frecuente, levantando la cuerda superior desde la proa para encontrar tortugas marinas enmalladas y subirlas a éste. Anotaciones correspondientes al nombre del sitio, coordenadas, clima, marea (puja o quiebra), estado de la marea (subiendo o bajando), hora de avistamiento de tortuga (en caso de observar tortugas respirando), hora de tendido y recogida de la malla, tiempo de esfuerzo del tendido y personas que lo realizaron, fueron registradas. Sin embargo, por presupuesto reducido, durante 2016 y 2018 no se realizaron jornadas de muestreo sistemáticos en el tiempo.ç
Muestreo estandarizado:
A partir del segundo semestre de 2019, se inició un muestreo estandarizado con el método de captura descrito en el punto anterior, ajustando nuestra unidad de esfuerzo al despliegue de la red de enmalle (100 m x 8 m, luz de malla = 50 cm) durante 30 minutos. La captura por unidad de esfuerzo (CPUE) se calculó dividiendo el número total de tortugas marinas capturadas en cada muestreo dividido por el número de unidades de esfuerzo. Se definieron cuatro jornadas de monitoreo acuático sistemático de diez días continuos durante el año (cada tres meses), en diferentes sitios escogidos la noche antes del monitoreo, donde comúnmente la comunidad ha avistado tortugas marinas recientemente empleando de cuatro a seis unidades de esfuerzo (2 - 3 horas) durante el día, en 41 sitios del mosaico.
Los sitios para el despliegue de la red, casi siempre estuvieron asociados a promontorios rocosos, muchos de estos sumergidos y que, con la reducida visibilidad del agua y cambios repentinos en la marea en esta área del Pacifico de Colombia, colocaba en riesgo la afectación de corales, esponjas, algas y el daño en sí mismo a la malla. Por esta razón, en nuestra unidad de esfuerzo se definió el despliegue de la malla por solo 30 minutos, a diferencia de los métodos usados en el Pacífico Oriental que emplean un esfuerzo de captura continuo de 24 h (Seminoff et al., 2003), de 4-8 h (Carrión-Cortez et al., 2013) y de 7 h (Chacón-Chaverri et al., 2015).
Pesca incidental y entrega por pescadores
Además del monitoreo acuático sistemático y estandarizado, desde el fortalecimiento comunitario llevado a cabo por los investigadores en 2016 al territorio, sus comunidades y posteriormente bajo el proyecto La Minga desde 2019, el consejo comunitario de bahía Málaga y la Asopes-Los Esteros han liderado el proceso de entrega voluntaria por parte de los pescadores en la pesca incidental de las tortugas marinas en sus faenas y en articulación con los investigadores hemos logrado acuerdos de conservación del territorio, incluidas las tortugas marinas como un objeto valor de conservación y sus ecosistemas asociados.
La Asopes-Los Esteros está ubicada en bahía Málaga y la conforman 56 pescadores activos organizados bajo la asociación. Las artes de pesca usadas y permitidas en el territorio son de malla, dentro de la que se encuentra redes de multifilamento (de trapo) y de monofilamento (de plástico); de anzuelo, como el espinel, la línea de mano, el volantin y el calabrote; y la red de atajo.
En articulación con el Consejo Comunitario y Asopes-Los Esteros, las tortugas que quedaron capturadas (vivas o muertas) durante sus faenas de pesca, fueron entregadas para este estudio de manera voluntaria entre el 2016 al 2020. En la entrega de las tortugas, se registró la fecha, especie, nombre del pescador, arte de pesca y el sitio de captura.
Registro de tortugas
Luego de la captura desde el monitoreo acuático y/o entrega voluntaria por pesca incidental, las tortugas fueron llevadas de acuerdo a su cercanía a las comunidades de La Plata o de Miramar para seguir el protocolo de registro de información. Éste incluye la identificación de la especie, la toma de datos biométricos, el proceso de marcación del individuo, registro fotográfico cuando sea posible y la liberación.
Los datos biométricos registrados fueron la medición del largo curvo mínimo del caparazón (LCCmín), largo curvo del caparazón nucal-supracaudal (LCCn-s), ancho curvo del caparazón (ACC), con una cinta métrica de ± 0,1 cm y peso de cada individuo con una pesa mecánica o digital (precisión: 0,01 kg). En cuanto al proceso de marcación, se aplicaron un par de marcas metálicas tipo Inconel 681C (National Band & Tag, Newport, KY, EE.UU.) con codificación única en la segunda escama proximal de cada aleta delantera y para algunos individuos, un PIT tag pasivo integrado tipo DNAchip ISO (AVID Identification Systems, Inc, Norco, CA, EE.UU.) fue colocado en su aleta delantera derecha con numeración única. Los subsecuentes eventos de captura fueron registrados como recapturas. Fotografías de cada lateral de la cabeza fueron registradas por individuo y se revisó la condición física externa para detectar lesiones, mutilaciones, deformidades y/o la presencia de fibropapilomas y continuar con su liberación en el mismo sitio o cerca del lugar inicial de captura dentro de las siguientes 4 horas. Este ejercicio fue realizado con la capacitación y acompañamiento de los investigadores, entidades públicas y continuada por los expertos locales capacitados en los protocolos estandarizados (Diez y Ottenwalder, 1999; Eckert et al., 1999; Ehrhart y Ogren, 1999).
Análisis de datos
En ocasiones en que una de las dos medidas para el LCC no fueron tomadas en el campo, se reemplazaron los datos faltantes agregando (para obtener el LCCn-s) o eliminando (para obtener el LCCmin) el promedio de la diferencia entre LCCmin y LCCn-s, respectivamente para cada especie. Para E.imbricata se convirtió LCCn-s en el largo recto de caparazón nucal-supracaudal (LRCn-s) utilizando la fórmula SCL = 0,9355 * LCCn-s + 0,4486 (Limpus, 1992). Para C. mydas se convirtió LCCmin primero al largo recto de caparazón mínimo (LRCmin) y de allí a LRCn-s utilizando la fórmula LRCmin = 0,9240 * LCCmin +1,0205 y LRCn-s = (SCLmin + 0,0460)/0,9883 según Meylan et al. (2011). Los LRCn-s convertidos fueron utilizados para calcular el índice de condición corporal (ICC) utilizando la fórmula: ICC = (Peso / LRC3) * 10 000 ( Bjorndal et al., 2000). Para todo análisis de datos se utilizó el programa R v.v.3.4 (R Core Team, 2020).
Con el fin de detectar las áreas con la mayor cantidad de capturas de tortugas marinas, se construyeron mapas calientes (“heatmaps”) basados en el estimado de densidad de Kernel (KDE) implementado en el programa QGIS (QGIS Development Team, 2020). Las densidades son calculadas a partir de la cantidad de puntos GPS de cada captura y el radio de acción. El radio de acción fue calculado basado en los promedios en el tamaño del área de 95 % de uso de 67,16 ha para juveniles de E. imbricata (Carrión Cortez et al., 2013) y de 1537 ha para C. mydas (Seminoff et al., 2002), resultando en un radio de 462,4 m y 2211,9 m, respectivamente.
RESULTADOS
Monitoreo acuático
Durante los cinco años de monitoreo acuático se llevaron a cabo tres fases en la captura de las tortugas marinas, para un total de 126 horas de esfuerzo en 41 sitios y 10 tortugas capturadas. En el monitoreo exploratorio con redes de trasmallo se emplearon 22 horas de esfuerzo de monitoreo acuático (2016/primer semestre) y se capturó un juvenil de tortuga negra. En el monitoreo continuado/adaptado con red de enmalle entre el segundo semestre de 2016 a 2018, se invirtieron 40 horas de esfuerzo de monitoreo y se capturaron tres juveniles de tortugas carey. Finalmente, un juvenil de tortuga negra y cuatro juveniles de tortuga carey con una recaptura adicional de uno de estos individuos, fueron capturados bajo el monitoreo estandarizado, en el cual se invirtieron 128 unidades de esfuerzo para un total de 64 horas de esfuerzo neto de tendido de la malla (octubre de 2019 a octubre de 2020). La mayor abundancia de tortugas capturadas con la malla fue de la tortuga carey 80,0 % (n = 8), seguido de la tortuga negra 20,0 % (n = 2).
Pesca incidental y entrega por pescadores
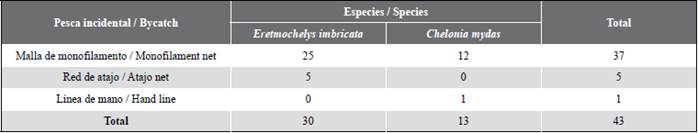
Desde mayo de 2016 a octubre de 2020, sin una tendencia temporal definida y a lo largo del mosaico de conservación un total de 43 tortugas marinas, entre carey (E. imbricata) y negra (C. mydas) fueron capturadas incidentalmente y entregadas por los pescadores de Asopes - Los Esteros a los investigadores y expertos locales. El 86 % conformado por 25 tortugas carey y 12 tortugas negras, fueron capturadas con malla de monofilamento. El 11,6 % conformado por cinco tortugas carey, fueron capturadas con red de atajo, mientras que 2,3 % conformado por una tortuga negra, fue capturada con línea de mano con anzuelo tipo J (Tabla 1). Adicionalmente, un juvenil de tortuga carey fue capturado en la playa del islote “El Cementerio”, cuando un pescador acercaba su embarcación a la orilla, el individuo estaba cerca, se asustó y emergió del mar, arrastrándose hacia la playa en donde fue capturada a mano.
Registro de tortugas
En los cinco años del estudio, un total de 54 tortugas han sido registradas e identificadas como tortugas carey y negra. Entre estas, 72,2 % (n = 39) fueron tortugas carey y 27,8 % (n = 15) tortugas negras registradas en el mosaico de conservación de bahía Málaga.
La tortuga carey fue la especie con mayor tasa de captura durante el estudio. Un total de 36 individuos fueron registrados y marcados dentro de la bahía. Ocho capturas de carey fueron bajo el monitoreo acuático, 30 por los pescadores con malla de monofilamento y red de atajo y una capturada adicional con la mano por un pescador. Fue la única especie con registro de recaptura (n = 3), un individuo fue marcado el 3 de julio de 2017 y recapturado el 1 de marzo de 2020, otro individuo fue marcado el 1 de marzo de 2020 y recapturado el 22 de octubre de 2020 y un individuo fue reportado muerto por los pescadores como pesca incidental meses después de su liberación. Basado en el tamaño mínimo de las hembras anidadoras reportadas en la colonia geográficamente más cercana de Machalilla en Ecuador (LCC = 73,0 cm; Gaos et al., 2017), la mayoría 97,2 %, (n = 35) fueron tortugas juveniles presentando un promedio en el LCCmin de 45,3 ± 11,6 cm con una hembra adulta (3 %) y un LCCmin de 90 cm, siendo la primera tortuga carey adulta reportada para el Pacífico colombiano (Barrientos-Muñoz et al., 2020) (Figura 2). Con la recaptura de dos juveniles de carey, el promedio individual de crecimiento (n = 2) osciló de -0,29 a -0,76 cm mes-1. La tasa de crecimiento más lenta la tuvo la tortuga que midió 52,1 y que pasó a 61,1 cm de LCC en 31 meses, mientras que la tortuga de crecimiento más rápido midió 40,2 y que pasó a 45,5 cm de LCC en 7 meses. El índice de condición corporal (ICC) varió de 0,8-2,2, con un promedio de 1,1 ± 0,2 (Tabla 2).
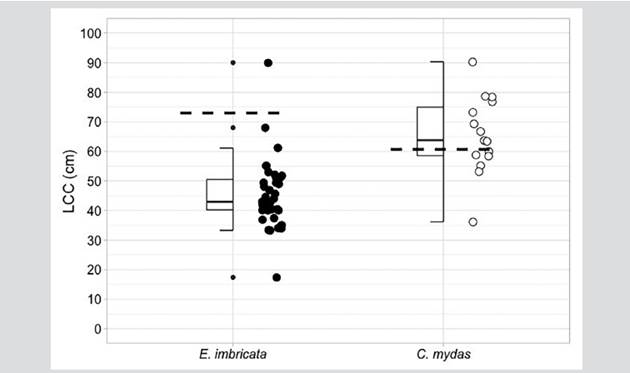
Figura 2 Mediana, cuartiles, rango y valores extremos del LCC (Largo Curvo Caparazón) en cm de individuos de tortuga carey (E. imbricata) y negra (C. mydas) capturadas en bahía Málaga. Se indican tallas mínimas de anidamiento para cada especie (E. imbricata = 73,0 cm LCC, Gaos et al., 2017; C. mydas = 60,7 cm LCC, Zárate et al., 2003).
Tabla 2 Promedios ± DE (rango) de las mediciones biométricas de la tortuga carey (Eretmochelys imbricata) y negra (Chelonia mydas) registradas en bahía Málaga, Valle del Cauca. Dónde: LCCmin = largo curvo mínimo del caparazón (cm), LCCn-s = largo curvo del caparazón nucal-supracaudal (cm), LRC = largo recto del caparazón (cm) convertido según Limpus (2002) para E. imbricata y según Meylan et al., 2011 para C. mydas, P = peso (kg) y el Índice de Condición Corporal (ICC).
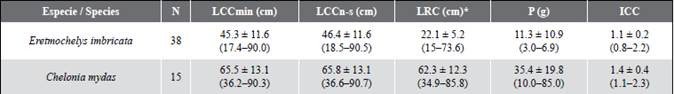
Por su lado, las 15 tortugas negras también fueron capturadas en el archipiélago de La Plata. Dos de éstas bajo el monitoreo acuático, 12 capturadas con malla de monofilamento y una con línea de mano con anzuelo por los pescadores. Basado en el tamaño mínimo de anidamiento de 66,7 cm LCC reportado en la colonia geográficamente más cercana en las Islas Galápagos (Zárate et al., 2003), la mayoría de los individuos de C. mydas son potencialmente adultos con un promedio de 65,6 ± 13,1 cm (Tabla 2). El ICC varió de 1,1-2,3, con un promedio de 1,4 ± 0,4 (Tabla 2).
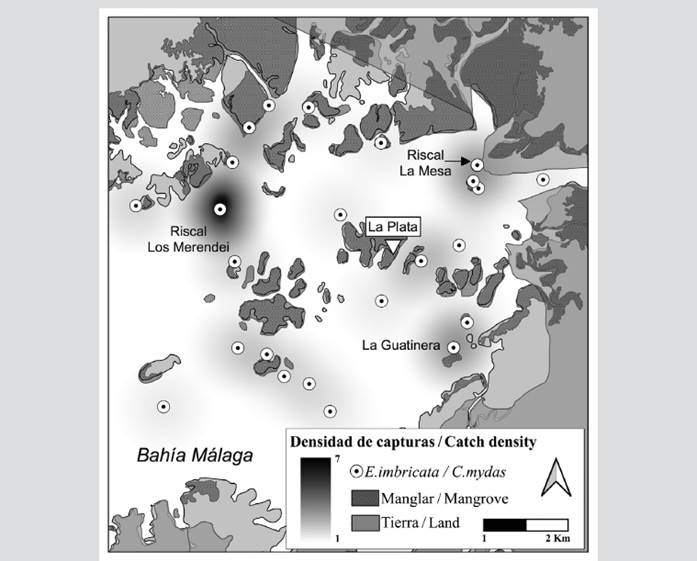
De los 41 sitios donde se capturaron tortugas por medio de la red de enmalle para tortugas o por pesca incidental, la mayor densidad fue en el riscal Los Merendei (n = 6; 5 de E. imbricata, 1 de C. mydas); Cementerio (n = 4; 3 de E. imbricata, 1 de C. mydas); La Guatinera (n = 3; 2 de E. imbricata, 1 de C. mydas); riscal La Mesa (n = 2; 1 de E. imbricata, 1 de C. mydas); y Parguera (n = 3 de E. imbricata). Mientras que la Jejenera, el riscal de Pital, Chontaduro y La Aguada con dos capturas de E. imbricata por sitio (Figura 3).
DISCUSIÓN
Este estudio indica que el Mosaico de Conservación de Bahía Málaga alberga sitios importantes para el desarrollo y la alimentación en diferentes estadios en individuos de E. imbricata y C. mydas. Ambas especies están representadas principalmente por juveniles, subadultos y en menor medida por individuos potencialmente adultos (Zárate et al., 2003; Chacón et al., 2015; Gaos et al., 2017; Barrientos-Muñoz et al., 2020). El conocimiento de estos estadios y de zonas de alimentación son esenciales para generar estrategias efectivas para la conservación de ambas especies, categorizadas bajo algún riesgo de extinción (Seminoff, 2004; Mortimer y Donelly, 2008; Hamann et al., 2010; Bjorndal et al., 2011; Rees et al., 2016; Llamas et al., 2017; Wildermann et al., 2018).
Las tortugas careyes que se encuentran en bahía Málaga exhiben un amplio rango de tamaño, que varía entre 17,4 - 90,0 cm con un promedio de 45,3 cm (n = 38) de LCCmin, mientras que en el PNN Gorgona, el rango varía de 32,0 - 58,0 cm con un promedio de 41,6 cm (n = 49) (Cañas-Uribe et al., 2020). Sin embargo, el promedio del tamaño de las tortugas carey, sugiere que la gran mayoría de los individuos que habitan bahía Málaga no han alcanzado la edad de madurez (Liles et al., 2011; Heidemeyer et al., 2014; Tobón-López y Amorocho, 2014; Chacón-Chaverrí et al., 2015; Liles et al., 2015; Gaos et al., 2017; Llamas et al., 2017). El tamaño de hembras anidantes en la única colonia conocida para el Pacífico Sur Oriental está ubicada en Machalilla, Ecuador a unos 700 km de distancia, es en promedio de 91,1 cm LCC con un tamaño mínimo de 73,0 cm y la hembra encontrada en nuestro estudio se encuentra por encima del éste valor mínimo, confirmando que además de juveniles hay presencia de adultos (Barrientos-Muñoz et al., 2020; Gaos et al., 2017). En zonas de reclutamiento, la tortuga carey está dominada por individuos de entre 30 y 60 cm LCCmin, que han sido descritos a lo largo de la costa pacífica de América Latina, como en Isla Gorgona (Tobón-López y Amorocho, 2014), Isla Coiba en Panamá (Llamas et al., 2017) y Costa Rica (Carrión, 2010; Carrión-Cortez et al., 2013; Heidemeyer et al., 2014; Chacón-Chaverrí et al., 2015). No obstante, la mayoría de estos sitios representan arrecifes coralinos y puntas rocosas, mientras que bahía Málaga, posee hábitats únicos como son los fondos de octocorales, manglares sobre sustrato rocoso, manglar enano y acantilados de rocas blandas (Invemar et al., 2006), siendo dominado por una gran franja de manglar y aguas turbias durante prácticamente todo el año, lo que se asemeja más a los hábitats descritos para las careys adultas en Centroamérica (Gaos et al., 2012).
En los muestreos se capturó una hembra de 90 cm de LCCmin, lo cual reitera la versatilidad de la tortuga carey en su uso de hábitats a lo largo de su desarrollo en el Pacífico Oriental (Gaos et al., 2012; Barrientos-Muñoz et al., 2020), pero también sugiere la posible existencia de sitios de anidación aún no descritos para esta especie en el Pacífico colombiano. Estudios genéticos y de telemetría para la carey del Pacífico Oriental (PO) evidencian que no tiene amplios desplazamientos entre sus sitios de anidación y forrajeo, por lo cual es necesario continuar esfuerzos para identificar y monitorear potenciales sitios de anidación en el área (Meylan et al., 2011; Gaos et al., 2012a, 2018; Barrientos-Muñoz et al., 2015, 2020). Si bien, los registros de tortugas carey provienen de muestreos en su mayoría exploratorios, esporádicos y hasta recientemente estandarizados en su metodología, la recaptura de un individuo después de 2,5 años sugiere que la residencia también ocurre en bahía Málaga (Tobón-López y Amorocho 2014; Llamas et al., 2017; Cañas-Uribe et al., 2020).
Por su lado, la tortuga negra muestra un patrón similar a la tortuga carey: las hembras reproductoras en las tres principales colonias de anidación del Pacífico Oriental (Colola en México, las islas Galápagos de Ecuador y la costa norte de Costa Rica) (Cornelius, 1986; Márquez, 1990; Alvarado y Figueroa, 1991; Alvarado-Díaz et al., 1991, 2001; Zárate et al., 2003; Chaloupka et al., 2004; Delgado Trejo y Alvarado Díaz, 2012) registran promedios de 85 cm LCCmin, por lo que la gran mayoría de los individuos capturados en bahía Málaga representan juveniles grandes o sub-adultos. Tamaños similares han sido encontrados en otros sitios de alimentación para la tortuga negra (López-Castro et al., 2010; Senko et al., 2010; Sampson et al., 2014), la variación del tamaño LCCmin estuvo más ajustada 36,2 - 90,3 con un promedio de 65,5 ± 13,1 cm (n = 15), sin embargo, estos valores son más amplios que los que ocurren en el PNN Gorgona con la tortuga negra, donde el promedio de LCCmin es de 64,0 cm con un rango de 37,9 - 82,7 cm (n = 276) (Sampson et al., 2014).
Los datos del marcaje-recaptura de marcas metálicas aplicadas a las aletas de las tortugas (Green, 1979; Figueroa et al., 1993; Heidemeyer et al., 2018), así como el rastreo satelital de C. mydas en el PO (Blanco et al., 2012; Hart et al., 2015) han demostrado, que las tortugas negras muchas veces emplean migraciones de largas distancias para reclutar diversos sitios de alimentación después de su fase reproductiva en sus playas natales. Aparte de algunos registros que evidencian la existencia de sitios de anidación en la costa Pacífico de Colombia (Barrientos-Muñoz et al., 2013), la presencia de individuos cercanos a la edad reproductiva en bahía Málaga, sugiere que este podría ser su sitio de desarrollo final para iniciar la migración reproductiva hacía sus playas de anidación en Colombia y/o países cercanos como Panamá, Costa Rica y/o Ecuador. Meylan et al. (2011) sugieren que en el PO, los hábitats primordialmente ocupados por juveniles y adultos, respectivamente, son más mezclados que segregados, comparando con otras regiones del mundo, y comparando nuestros registros -aún limitados- con los datos obtenidos de otros sitios de alimentación en la región, (isla Gorgona, Sampson et al., 2014), parece cumplirse en Colombia.
Es necesario seguir adelantando acciones de investigación y monitoreo continuos y estandarizados de las tortugas marinas presentes en el mosaico de conservación. Se plantea poder extender el trabajo en las otras comunidades replicando el ejercicio con pescadores y evaluando el porcentaje de captura de las artes de pesca. Incluso este sería un indicador de seguimiento para el ordenamiento pesquero y la reglamentación en el uso de artes y métodos de menor impacto para los recursos hidrobiológicos el cual han venido trabajando las comunidades locales y el PNN Uramba Bahía Málaga. En el cual, las áreas de pesca usadas por las tortugas en la bahía de Málaga deben contar con un manejo pesquero especial, para garantizar la permanencia de estas en los riscales en acuerdos de conservación en articulación con las comunidades. Con el continuo monitoreo y técnicas de muestreo adicionales, como el uso de transmisión satelital y genética se espera poder obtener mayor información sobre el uso temporal y espacial de las tortugas marinas, su origen, tamaños, densidades, abundancia, tasa de crecimiento, tiempo de residencia, conectividad, amenazas, que aporten al conocimiento y conservación de ambas especies a nivel local y regional.
CONCLUSIONES
Nuestro estudio destaca la importancia de bahía Málaga como el sitio en el Pacifico de Colombia, que exhibe la mayor amplitud de tamaños para las tortugas marinas, E. imbricata y C. mydas, siendo esto clave para la supervivencia de estas especies en el PO. A pesar del corto tiempo del presente estudio (2016-2020), se evidencia que bahía Málaga es un sitio crítico como zona de alimentación y residencia para la tortuga carey del PO. La combinación de hábitats únicos de manglar, riscales y fondos con octocorales y esponjas de bahía Málaga evidencian que son de gran importancia para el forrajeo de ambas especies, ya que de acuerdo al índice de condición corporal, están permitiendo agregaciones productivas y saludables. La evidencia de un solo individuo de carey encontrado muerto y una tortuga negra (posteriormente comercializada) en las redes de los pescadores, no refleja que la pesca incidental de tortugas marinas sea tan baja en el área, es posible que en los primeros años del estudio los pescadores locales al encontrar individuos muertos en sus redes tuvieran miedo o vergüenza de registrarlo, por lo tanto esto debe interpretarse con cautela. En subsiguientes años de estudio con tortugas marinas en bahía Málaga, es importante mantener un diálogo constante para afianzar la confianza local y que más pescadores reporten la pesca incidental de tortugas marinas. A partir del esfuerzo interinstitucional, intersectorial y comunitario, este estudio contribuye como línea base para el conocimiento y generación de estrategias efectivas para la investigación y conservación de estas especies y sus ecosistemas en el mosaico de conservación de bahía Málaga.
AGRADECIMIENTOS
El proyecto es posible gracias a las comunidades de La Plata, Miramar, Mangaña, La Sierpe y Puerto España. Un especial agradecimiento a la Asociación de Pescadores Tradicionales de Bahía Málaga Los Esteros y a los investigadores locales Edgar López, Vanessa Moreno, Otoniel Angulo, Vicente González, Yoselín Sinisterra, Maicol Valencia, Isabelino Valencia, Eddie Rebolledo, Jeiler Caicedo y Rubén Canga. A Parques Nacionales Naturales de Colombia y la Corporación Autónoma Regional del Valle del Cauca-CVC, en la Dirección Ambiental Regional Pacífico Oeste en Buenaventura, por su apoyo logístico y acompañamiento en algunos censos. A Jeffrey Seminoff de NOAA-National Marine Fisheries Service bajo el Marine Turtle Research Program quienes proveen las marcas metálicas en el marco del Pacific Sea Turtle Flipper Tagging Program. El proyecto fue financiado por el Oleoducto del Pacífico y recientemente en el marco de La Minga, el esquema de sostenibilidad financiera de las áreas protegidas regionales del Pacífico Colombiano, liderado por Fondo Acción y Conservación Internacional Colombia, la Corporación del Valle del Cauca - CVC - Los consejos comunitarios de La Plata Bahía Málaga y de Chucheros, y con fondos de la Fundación Tortugas del Mar y la Asociación Comunitaria de Bahía Málaga Ecomanglar, Consejo Comunitario de las Comunidades Negras de la Plata Bahía Málaga
REFERENCIAS
Abreu-Grobois, A. and P. Plotkin. 2008. Lepidochelys olivacea. The IUCN Red List of Threatened Species 2008. Version 3.1 https://www.iucnredlist.org02/10/2020. [ Links ]
Alvarado, J. y A. Figueroa. 1991. Comportamiento reproductivo de la tortuga negra Chelonia agassizii. Cienc. Desarr., 17: 43-49. [ Links ]
Alvarado-Díaz, J., C. Delgado-Trejo and I. Suazo-Ortuño. 2001. Evaluation of black turtle project in Michoacán, México. Mar. Turtle Newslet., 92:4-7. [ Links ]
Amorocho, D. 1993. Reporte temporadas de anidación 1991-1992. Inf. Fundación Natura. 74 p. [ Links ]
Amorocho, D.F., T.H. Rubio y R.W. Diaz. 1992. Observaciones sobre el estado actual de las tortugas marinas en el Pacífico colombiano: 155-179. En: Rodríguez-M., J.V. y H. Sánchez-P. (Eds). Contribución al conocimiento de las tortugas marinas de Colombia. Inderena, Bogotá. [ Links ]
Amorocho, D.F., F.A. Sánchez y D.D. Quiroga. 2001. El encanto de las tortugas marinas en el Parque Nacional Natural Gorgona: 141-147. En: Barrios, L.M. y M. López-Victoria (Eds.). Gorgona marina: Contribución al conocimiento de una isla única. Ser. Publ. Esp. Invemar, 7, 160 p. [ Links ]
Barreto Sánchez, L.J. 2011. Diagnóstico del estado actual de las tortugas marinas en el Pacífico Colombiano. Informe de País, Bogotá. 71 p. [ Links ]
Barrientos-Muñoz, K. G., C. Ramírez-Gallego and L. Rivas. 2013. First report on the nesting of black sea turtle (Chelonia mydas) on the north Pacific of Colombia. MTN, 138: 19-21. http://www.seaturtle.org/mtn/archives/mtn138/mtn138-7.shtml [ Links ]
Barrientos-Muñoz, K. G., C. Ramírez-Gallego and V. P. Páez. 2014. Nesting ecology of the olive Ridley sea turtle (Lepidochelys olivacea) (Cheloniidae) at Valle beach, northern Pacific, Colombia. Acta Biol. Col., 19: 437-445. https://dx.doi.org/10.15446/abc.v19n3.42457 [ Links ]
Barrientos-Muñoz, K., C. Ramírez-Gallego y V.P. Páez. 2015a. Eretmochelys imbricata (Linnaeus, 1766): 127-131. En: Morales-Betancourt, M.A., C.A. Lasso, V.P. Páez y B.C. Bock. (Eds). Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt (IAvH), Univ. Antioquia, Bogotá. 258 p. [ Links ]
Barrientos-Muñoz K.G., C. Ramírez-Gallego y V. Páez. 2015b. Lepidochelys olivacea (Eschscholtz, 1829): 161-165. En: Morales Betancourt, M.A., C.A. Lasso, V.P. Páez y B. Bock (Eds). Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt (IAvH), Bogotá. 258 p. [ Links ]
Barrientos-Muñoz, K. G., M. Valencia-Díaz, C. A Hinojosa-Romero, S. Valencia-González, M.C. Diazgranados, E.L. Sevilla-Dueñas y C. Ramírez-Gallego. 2020. Primer registro de una hembra de tortuga carey, Eretmochelys imbricata en el Mosaico de Conservación Bahía Málaga, Pacífico colombiano. Bol. Invest. Mar. Cost., 49 (Supl. Esp.): 289-294 http://boletin.invemar.org.co:8085/ojs/index.php/boletin/article/view/1073 [ Links ]
Bjorndal, K.A. 1999a. Conservation of hawksbill sea turtles: perception and realities. Chel. Cons. Biol. IUCN/SSC, 3 (2): 174-176. [ Links ]
Bjorndal, K.A. 1999b. Prioridades para la investigación en hábitats de alimentación: 13-15. En: Eckert, K., A. Bjorndal, A. Abreu, M. Donnelly (Eds). Técnicas de investigación y manejo para la conservación de las tortugas marinas. UICN/CSE Grupo Especialista Tortugas Marinas Publ., 4. [ Links ]
Bjorndal K.A., A.B. Bolten and M.Y. Chaloupka. 2000. Green turtle somatic growth model: evidence for density dependence. Ecol Appl., 10(1): 269-282. [ Links ]
Bjorndal K.A., B.W. Bowen, M. Chaloupka, L.B. Crowder and others. 2011. Better science needed for restoration in the Gulf of Mexico. Science, 331: 537−538. [ Links ]
Blanco, G. S., S.J. Morreale, H. Bailey, J.A. Seminoff, F.V. Paladino and J.R. Spotila. 2012. Post-nesting movements and feeding grounds of a resident East Pacific green turtle Chelonia mydas population from Costa Rica. Endang. Spec. Res., 18(3): 233-245. doi: https://doi.org/10.3354/esr00451 [ Links ]
Broderick, A.C., M.S. Coyne, W.J. Fuller, F. Glen and B.J. Godley. 2007. Fidelity and over- wintering of sea turtles. Proc. Roy. Soc. B Biol. Sci., 274: 1533-1539. [ Links ]
Caicedo, J., L. Jiménez. L. Zapata y X. Zorrilla. 2009. Resultados y proyecciones de la conservación de Tortugas marinas en el Parque Nacional Natural Sanquianga, Pacífico colombiano. Cali, 21 p. [ Links ]
Cantera, J. 1991. Etude structurale des mangroves et des peuplements macrobenthiques littoraux de deux bailes du pacifique colombien (Malaga et Buenaventura) rapport avec les conditions du milieu et les perturbations anthropiques. Tesis Doctorado. A l´ Universite d´ Aix-Marseille II Faculte Sciences de Luminy. 371 p. [ Links ]
Cantera J., B. Thomassin and P. Arnaud. 1999. Faunal zonation and assemblages in the Pacific Colombian mangroves. Hydrobiology, 413: 17-33. [ Links ]
Cañas-Uribe, M., L.F. Payán, D.F. Amorocho y V.P. Páez. 2020. Tasas de crecimiento somatico de tortuga carey, Eretmochelys imbricata, en el Parque Nacional Natural Gorgona, Colombia, entre 2004 y 2018. Bol. Invest. Mar. Cost., 49 (Supl. Esp.): 13-30. https://doi.org/10.25268/bimc.invemar.2020.49.SuplEsp.1061 [ Links ]
Carrion-Cortez, J., P. Zárate and J. Seminoff. 2010. Feeding ecology of the green sea turtle (Chelonia mydas) in the Galapagos Islands. J. Mar. Biol. Assoc. UK, 90. 1005 - 1013. 10.1017/S0025315410000226. [ Links ]
Carrión-Cortez, J., C. Canales-Cerro, R. Arauz and R. Riosmena-Rodríguez. 2013 Habitat use and diet of juvenile Eastern Pacific hawksbill turtles (Eretmochelys imbricata) in the north Pacific coast of Costa Rica. Chel. Conserv. Biol., 12(2): 235-245. [ Links ]
Castellanos-Galindo, G.A., J.A. Caicedo-Pantoja, L.M. Mejía-Ladino y E. Rubio. 2006. Peces marinos y estuarinos de bahía Málaga, Valle del Cauca, Pacífico colombiano. Biota Col., 7(2): 262-282. [ Links ]
Ceballos-Fonseca, C., L. Martínez y D. Quiroga. 2003. Distribución, amenazas y esfuerzos de conservación de las tortugas marinas en el Pacífico colombiano: 13-17. En: Informe final, Invemar, Santa Marta. [ Links ]
Chacón-Chaverri, D., D.A. Martínez-Cascante, D. Rojas y L.G. Fonseca. 2015. Golfo Dulce, Costa Rica, un área importante de alimentación para la tortuga carey del Pacífico oriental (Eretmochelys imbricata). Rev. Biol. Trop., 63 (Suppl.1): 351-362. [ Links ]
Chaloupka, M., P. Dutton and H. Nakano. 2004. Status of sea turtle stocks in the Pacific. Papers presented at the Expert Consultation on Interactions between Sea Turtles and Fisheries within an Ecosystem Context. https://www.fao.org/3/y5750e/y5750e00.pdf [ Links ]
Cornelius, S. 1986. The sea turtles of Santa Rosa National Park. Fund. Parques Nales. Costa Rica. Programa Educación Ambiental UNED. 64 p. [ Links ]
Cubillos Pérez, D.L. 2016. Características geomorfológicas de una playa potencial de anidación e identificación de las posibles amenazas para tortugas marinas en Puerto España, Departamento del Valle del Cauca. Tesis Biología, Pont. Univ. Javeriana, Cali. 44 p. [ Links ]
Delgado Trejo, C. and J. Alvarado Díaz, 2012. Current conservation status of the black sea turtle in Michoacán, México: 263-278. In: Seminoff, J.A. and B.P. Wallace (Eds). Sea turtles of the Eastern Pacific: advances research and conservation. Univ. Arizona Press, Tucson, USA. [ Links ]
Díez, C. and J. Ottenwalder. 2000. Habitat surveys: 41. In: Eckert, K., K. Bjorndal, F. Abreu-Grobois and M. Donnelly (Eds). Research and management techniques for the conservation of sea turtles. IUCN/SSC Mar. Turtle Spec. Group Publ., 4. 278 p. [ Links ]
Eckert, K., K. Bjorndal, F. Abreu-Grobois and M. Donnelly (Eds). Research and management techniques for the conservation of sea turtles. IUCN/SSC Mar. Turtle Specialist Group Publ., 4: 232. [ Links ]
Ehrhart and Ogren. 1999. Studies in foraging habitats: capturing and handling turtles: 61-64. In: K. Eckert, K. Bjorndal, F. Abreu-Grobois y M. Donnelly (Eds). Research and management techniques for the conservation of sea turtles. IUCN/SSC Mar. Turtle Spec. Group Publ., 4, 278 p. [ Links ]
Figueroa, A., J. Alvarado, F. Hernández, G. Rodríguez and J. Robles. 1993. The ecological recovery of sea turtles of Michoacán, Mexico. Special attention to the black turtles (Chelonia agassizii). Final Report to WWF-USFWS. Albuquerque, USA. 96 p. [ Links ]
Gaos, A.R., F.A. Abreu-Grobois, J. Alfaro-Shigueto, D. Amorocho, R. Arauz, A. Baquero, R. Briseno, D. Chacón, C. Dueñas, C. Hasbun, M. Liles, G. Mariona, C. Muccio, J.P. Muñoz, W.J. Nichols, M. Peña, J.A. Seminoff, M. Vásquez, J. Urteaga, B. Wallace, I.L. Yáñez and P. Zárate. 2010. Signs of hope in the eastern Pacific: international collaboration reveals encouraging status for a severely depleted population of hawksbill turtles Eretmochelys imbricata. Oryx, 44(4): 595-601. [ Links ]
Gaos, A.R., R.L. Lewison, B.P. Wallace, I.L. Yáñez, M.J. Liles, W.J. Nichols, A. Baquero, C.R. Hasbun, M. Vasquez, J. Urteaga and J.A. Seminoff. 2012a. Spatial ecology of critically endangered hawksbill turtles Eretmochelys imbricata: implications for management and conservation. Mar. Ecol. Prog. Ser., 450: 181-198. [ Links ]
Gaos, A. R., R.L. Lewison, I.L. Yáñez, B.P. Wallace, M.J. Liles, W.J. Nichols, Baquero, A., Hasbún, C. R., Vásquez, M., J. Urteaga and J.A. Seminoff. 2012b. Shifting the life-history paradigm: discovery of novel habitat use by hawksbill turtles. Biol. Let., 8 (1): 54-56. https://doi.org/10.1098/rsbl.2011.0603 [ Links ]
Gaos, A., M. Liles, V. Gadea, A. Peña de Niz, F. Vallejo, M. Cristina, J. Darquea, A. Henríquez, A. Rivera, S. Chavarría, D. Melero, J. Urteaga, C. Pacheco, D. Chacón, C. LeMarie, J. Alfaro-Sigueto, J. Mangle, I. Yáñez and J. Seminoff. 2017. Living on the edge; hawksbill turtle nesting and conservation along the Eastern Pacific Rim. Lat. Am. J. Aquat. Res., 45(3): 572-584. [ Links ]
Gaos, A.R., R.L. Lewison, M.P. Jensen, M.J. Liles, A. Henríquez. S. Chavarría, C.M. Pacheco, P. Torres, F. Vallejo, C. Miranda, C. LeMaire, J. Lucero, K. Oceguera, D. Chacón, L. Fonseca M. Abrego, J.A. Seminoff, E.E. Flores, I. Llamas, R. Donadi, B. Peña, J.P. Muñoz, D.A. Ruales, J.A. Chaves, S. Otterstrom, A. Zavala, C.E. Hart, R. Brittain, J. Alfaro-Shigueto, J. Mangel, I.L. Yáñez and P.H. Dutton. 2018. contributions, movements and conservation needs of hawksbill turtles at foraging grounds in the eastern Pacific Ocean. Mar. Ecol. Prog. Ser., 586: 203-216. https://doi.org/10.3354/meps12391 [ Links ]
Green, D. 1979. Double tagging of green turtles in the Galapagos Islands. Mar. Turtle Newslet., 13:4-9. [ Links ]
Groombridge, B. and R. Luxmoore. 1989. The green turtle and hawksbill (Reptilia: Cheloniidae): world status, exploitation and trade. Switzerland: CITES Secretariat. 601 p. [ Links ]
Hamann, M, M.H. Godfrey, J.A. Seminoff, K. Arthur and others. 2010. Global research priorities for sea turtles: informing management and conservation in the 21st century. Endang. Spec. Res., 11: 245−269. [ Links ]
Hart, C.E., G.S. Blanco, M.S. Coyne, C. Delgado-Trejo, B.J. Godley, T.T. Jones, A. Resendiz, J.A. Seminoff, M.J. Witt and W. Nichols. 2015. Multinational tagging efforts illustrate regional scale of distribution and threats for East Pacific green turtles (Chelonia mydas agassizii). PloS One, 10(2), e0116225. https://doi.org/10.1371/journal.pone.0116225 [ Links ]
Heidemeyer, M., R. Arauz-Vargas and E. López-Agüero. 2014. New foraging grounds for hawksbill (Eretmochelys imbricata) and green turtles (Chelonia mydas) along the northern Pacific coast of Costa Rica, Central America. Rev. Biol. Trop., 62: 109-118. [ Links ]
Heidemeyer, M., C. Delgado-Trejo, C.E. Har, C. Clyde-Brockway, L.G. Fonseca, R. Mora, A. Lara and R. Obando. 2018. Long-term in-water recaptures of adult black turtles (Chelonia mydas) provide implications for flipper tagging methods in the Eastern Pacific. Herpetol. Rev., 49(4): 653-657. [ Links ]
Hinestroza, L. M. y V. P. Páez. 2001. Anidación y manejo de la tortuga golfina (Lepidochelys olivacea) en la playa la Cuevita, Bahía Solano, Chocó, Colombia. Cuad. Herpetol., 14: 131 - 144. [ Links ]
Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” [Invemar], Universidad del Valle e Instituto para la Investigación y la Preservación del Patrimonio Cultural y Natural del Valle del Cauca [Inciva]. 2006. Biomálaga: Valoración de la biodiversidad marina y costera de Bahía Málaga (Valle del Cauca), como uno de los instrumentos necesarios para que sea considerada un área protegida. Cali: Invemar, Univalle e Inciva. [ Links ]
Jensen, M.P., N.N. FitzSimmons and P.H. Dutton. 2013. Molecular genetics of sea turtles: 135-161. In: Wyneken, J., K.J. Lohmann and J.A. Musick (Eds). The biology of sea turtles. Vol 3. CRC, Boca Raton, EE. UU. [ Links ]
Liles, M. J., M.V. Jandres, W. A. López, G. I. Mariona, C. R. Hasbún and J. A. Seminoff. 2011. Hawksbill turtles Eretmochelys imbricata in El Salvador: nesting distribution and mortality at the largest remaining nesting aggregation in the Eastern Pacific Ocean. Endang. Spec. Res., 14, 23-30. [ Links ]
Liles, M.J., M.J. Peterson, J.A. Seminoff, E. Altamirano, A.V. Henríquez, A.R. Gaos, V. Gadea, J. Urteaga, P. Torres, B.P. Wallace and T.R. Peterson. 2015. One size does not fit all: importance of adjusting conservation practices for endangered hawksbill turtles to address local nesting habitat needs in the EP Ocean. Biol. Conserv., 184: 405-413. [ Links ]
Limpus, C. J. 1992. Estimation of tag loss in marine turtle research. Wildl. Res., 19: 457- 469. [ Links ]
Llamas, I., E. Flores, M. Abrego, J. Seminoff, C. Hart, B. Pena, G. Álvarez, W,Poveda, A. Amorocho and A. Gaos. 2017. Distribution, size range and growth rates of hawksbill turtles at a major foraging ground in the eastern Pacific Ocean. Lat. Am. J. Aq. Res., 45(3): 597-605. http://dx.doi.org/10.3856/vol45-issue3-fulltext-9 [ Links ]
López-Castro, M., K. Volker, A. Mariscal-Loza and W.J. Nichols. 2010. Long term monitoring of black turtles (Chelonia mydas) at coastal foraging areas of the Baja California Peninsula, México. Endang. Spec. Res., 11: 35. [ Links ]
Márquez, M. 1990. Sea turtles of the world. An annotated and illustrated catalogue of sea turtle species known to date. FAO Spec. Cat. FAO Fish. Synop., 11(125), 81 p. [ Links ]
Martínez, L. M. 1999. Ecología de anidación de la tortuga golfina (Lepidochelys olivacea) en la playa de La Cuevita, costa Pacífica chocoana, Colombia, en 1998. Tesis Univ. Antioquia, Medellín. 24 p. [ Links ]
Martínez, L. M. y V. P. Páez. 2000. Ecología de anidación de la tortuga golfina (Lepidochelys olivacea) en la playa La Cuevita, costa pacífica chocoana, Colombia, en 1998. Actual. Biol., 22: 131-143. [ Links ]
McCormick, C. 1996. Contribución al conocimiento de la ecología y biología reproductiva de las tortugas marinas en la Isla Gorgona. Tesis Univ. Valle, Cali. [ Links ]
Merizalde, L., D. Amorocho, J. Loaiza, D. Gómez, V. Pérez y C. Ortiz. 2005. Reconocimiento de áreas potenciales para la reproducción de las tortugas marinas en el Valle del Cauca. Inf. Técn. CIMAD - CVC. Cali. [ Links ]
Meylan P.A., A.B. Meylan and J.A. Gray. 2011. The ecology and migrations of sea turtles 8. Tests of the developmental habitat hypothesis. Bull. Am. Mus. Nat. Hist., 357: 1−70. [ Links ]
Molina, M. F., S. Espinosa y G. Parra. 2006. Fortalecimiento de los criterios de conservación de la diversidad marina y costera de bahía Málaga, costa pacífica del Valle del Cauca, Colombia. Tesis Fund. Univ. Popayán, Popayán. [ Links ]
Morales-Betancourt, M. A., C. A. Lasso, V. P. Páez y B. C. Bock. 2015. Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt, Univ. Antioquia. Bogotá. 258 p. [ Links ]
Mortimer, J. A. and M. Donnelly. 2008. Eretmochelys imbricata. The IUCN Red List of Threatened Species 2008. Version 3.1 https://www.iucnredlist.org 02/11/2020. [ Links ]
Muñoz, O., X. Moreno y G. Mayor. 2010. Aspectos sobre la actividad reproductiva de la tortuga caguama del Pacífico Lepidochelys olivacea (Testudines: Cheloniidae) en la Playa Mulatos del PNN Sanquianga, Colombia: 103. III Congr. Col. Zool., Asoc. Col. Zool. 327 p. [ Links ]
Núñez, L. E. 2007. Plan de manejo integral de la Reserva Natural Especial de Puerto España - Miramar. [ Links ]
Páez, V., C. Ramírez-Gallego y K.G. Barrientos-Muñoz. 2015. Chelonia mydas (Linnaeus, 1758): 153-156. En: Morales Betancourt, M. A., C. A. Lasso, V. P. Páez y B. Bock (Eds.). Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt (IAvH), Univ. Antioquia. Bogotá. 258 p. [ Links ]
Pavía, A., D. Amorocho and J. Rodríguez. 2007. Nesting ecology and public participation for conservation management of olive ridley sea turtle (Lepidochelys olivacea) at Gorgona National Park - Colombia. Final report presented to Rufford Small Grants for Nature Conservation. CIMAD. Cali. 38 p. [ Links ]
Payan, L., D. Amorocho, E. Sandoval y L. Jiménez. 2010. Biología reproductiva de tortugas marinas en el PNN Gorgona - Colombia durante la temporada julio 2009 - febrero 2010: 104. III Congr. Col. Zool. 327 p. [ Links ]
QGIS Development Team. 2020. QGIS Geographic Information System. Open Source Geospatial Foundation Project. http://qgis.osgeo.org [ Links ]
R Core Team, 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/ [ Links ]
Ramírez-Gallego C., V. Páez y K.G. Barrientos-Muñoz. 2015. Dermochelys coriacea (Vandelli, 1761): 122-126. En: Morales Betancourt, M. A., C. A. Lasso, V. P. Páez y B. Bock (Eds). Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt (IAvH), Univ. Antioquia. Bogotá. 258 p. [ Links ]
Rees, A.F, J. Alfaro-Shigueto, P.C.R. Barata, K.A. Bjorndal and others. 2016. Are we working towards global research priorities for management and conservation of sea turtles? Endang. Spec. Res., 31: 337−382. [ Links ]
Rincón-Díaz, M. P. y C. J. Rodríguez-Zárate. 2004. Caracterización de playas de anidación y zonas de alimentación de tortugas marinas en el archipiélago de San Bernardo, Caribe colombiano. Bol. Invest. Mar. Cost., 33: 137-158. [ Links ]
Rivera-Gómez, M., I.C. Calle-Bonilla, A. Cuéllar-Chacón, F. Paredes-Mina y A. Giraldo-López. 2016. Registro de la tortuga caná (Dermochelys coriacea) en el Parque Nacional Natural Gorgona, Pacífico colombiano. Biota Col., 17(2): 163-166. https://doi.org/10.21068/c001 [ Links ]
Sampson, L., L.F. Payán, D.F. Amorocho, J.A. Seminoff and A. Giraldo. 2014. Intraspecific variation of the green turtle, Chelonia mydas (Cheloniidae), in the foraging area of Gorgona Natural National Park (Colombian Pacific). Acta Biol. Col., 19: 461-470. [ Links ]
Sánchez, F. A. y D. D. Quiroga. 2002. Determinación de hábitos y comportamiento alimenticio de la tortuga marina negra del Pacífico (Chelonia mydas agassizii) en el Parque Nacional Natural Gorgona, Pacífico Colombiano. Tesis Ecólogo, Fund. Univ. Popayán, Popayán. [ Links ]
Seminoff, J.A. 2004. Chelonia mydas. The IUCN Red List of Threatened Species 2004. Version 3.1. https://www.iucnredlist.org 02/11/2020. [ Links ]
Seminoff, J.A., A. Resendiz and J.N Wallace. 2002. Home range of green turtles Chelonia mydas at a coastal foraging area in the Gulf of California, Mexico. Mar. Ecol. Progr. Ser., 242: 253 - 265. [ Links ]
Seminoff, J.A., T.T. Jones, A. Resendiz, J.N Wallace and M.Y. Chaloupka. 2003. Monitoring green turtles (Chelonia mydas) at a coastal foraging area in Baja California, Mexico: multiple indices describe population status. J. Mar. Biol. Assoc. UK, 83: 1355 - 1362. [ Links ]
Seminoff, J.A., J. Alfaro-Shigueto, D. Amorocho, R. Arauz, A. Baquero, D. Chacón, A. Gaos, S. Kelez, J. Mangel, J. Urteaga and B.P. Wallace. 2012. Biology and conservation of sea turtles in the eastern Pacific Ocean: A general overview: 11-38. In: Seminoff, J.A. and W.P Wallace (Eds). Sea Turtles of the Eastern Pacific Ocean: research advances, conservation challenges and signs of success. Univ. Arizona, Tucson, EE. UU. [ Links ]
Senko, J., M. López-Castro, K. Volker and W.J. Nichols. 2010. Immature East Pacific green turtles (Chelonia mydas) use multiple foraging areas off the Pacific coast of Baja California Sur, Mexico: first evidence from mark-recapture data. Pac. Sci., 64 (1):125-130 https://doi.org/10.2984/64.1.125 [ Links ]
Tobón-López, A. and D.F. Amorocho. 2014. Population study of the hawksbill turtle Eretmochelys imbricata (Cheloniidae) in the southern Pacific region of Colombia. Acta Biol. Col., 19(3): 447-457. [ Links ]
Wallace, B.P., M. Tiwari and M. Girondot. 2013. Dermochelys coriacea. The IUCN Red List of Threatened Species 2013. Version 3.1. https://www.iucnredlist.org 02/11/2020. [ Links ]
Wildermann, N., C. Gredzens, H. Barrios-Garrido, I. Bell, J. Blumenthal, A. Bolten and others. 2018. Informing research priorities for immature sea turtles through expert elicitation. Endang. Spec. Res., 37: 55-76. https://doi.org/10.3354/esr00916 [ Links ]
Zárate P., A. Fernie and P. Dutton. 2003. First results of the East Pacific green turtle, Chelonia mydas, nesting population assessment in the Galapagos Islands: 70-73. In Seminoff, J. A. (ed.) Proceedings of the 22nd symposium on sea turtle biology and conservation. NOAA Techn. Mem. NMFS - SEFSC. [ Links ]
Zorrilla, X. 2011. Monitoreo de tortugas marinas en el Parque Nacional Natural Gorgona Acciones, avances y proyecciones. Mem. Taller de diagnóstico del estado de las tortugas marinas en el Pacífico colombiano. Fund. Conserv. Amb. Col.. Cali. 40 p. [ Links ]
Recibido: 21 de Agosto de 2020; Aprobado: 30 de Agosto de 2021











 texto em
texto em