Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta Jan./June 2022 Epub Aug 01, 2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1020
Artículos de Investigación
Biomasa de pastos marinos y su rol como sumideros de carbono en las localidades de la isla de San Andrés y La Guajira, Caribe colombiano
1Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” Invemar, Santa Marta D. T. C .H., Colombia. andres.acosta@invemar.org.co
2 Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” Invemar, Santa Marta D. T. C .H., Colombia. laura.sanchez@invemar.org.co
3Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” Invemar, Santa Marta D. T. C .H., Colombia. diana.gomez@invemar.org.co
4Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” Invemar, Santa Marta D. T. C .H., Colombia. juan.gonzales@invemar.org.co
5Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis” Invemar, Santa Marta D. T. C .H., Colombia. raul.navas@invemar.org.co
Seagrass meadows have stood out for being very effective fixing atmospheric carbon, among others, due to their ability to produce plant biomass. Therefore, the values of shoot density (m2), biomass (cores) and carbon present in 12 locations with Thalassia testudinum at the Colombian Caribbean (La Guajira and San Andrés Island) were quantified. The biological samples were processed in laboratory until obtaining the values of aerial, underground and total dry weight, and the estimation of the carbon was stablishing from a ratio of 35 % of the dry biomass. Statistical tests were carried out to determine significant differences between the sites, highlighting the aerial biomass in La Guajira and the underground biomass in San Andrés. It was calculated that the total carbon in the seagrasses’ biomass from La Guajira were 197 484 Mg C and in San Andrés 1835.4 Mg C. The difference between locations were due to particular geomorphological and intrinsic factors. It is highlighted that, although the carbon retained in the biomass (aerial and underground) is comparatively lower than in sediments, it constitutes the pillar of conservation of both carbon sink as well as for the sustainability of the ecosystem.
Keywords: Seagrass; Colombia; biomass; blue carbon.
Los pastos marinos se han destacado por ser muy efectivos en la fijación de carbono atmosférico, entre otros, debido a su capacidad de producir biomasa vegetal. Por lo anterior, se cuantificaron los valores de densidad de vástagos (m2), biomasa (corazonadores) y el carbono presente en 12 localidades con Thalassia testudinum del Caribe colombiano (La Guajira y San Andrés isla). Las muestras biológicas se procesaron en laboratorio hasta obtener los valores de peso seco aéreo, subterráneo y total, y la estimación del carbono se realizó a partir de la relación del 35 % de la biomasa seca. Se realizaron pruebas estadísticas para determinar diferencias significativas entre las estaciones, resaltando la biomasa aérea en La Guajira y la biomasa subterránea en San Andrés. Se calculó que el carbono total en la biomasa viva de las praderas de La Guajira fue de 197 484 Mg C y en San Andrés 1835,4 Mg C. La diferencia entre áreas se debió a factores geomorfológicos e intrínsecos particulares. Se destaca que, aunque el carbono retenido en la biomasa (aérea y subterránea) es comparativamente menor al que se encuentra en los sedimentos, constituye el pilar de conservación tanto del sumidero de carbono como para la sostenibilidad del ecosistema.
Palabras Clave: Pastos marinos; Colombia; biomasa; carbono azul.
INTRODUCCIÓN
Los pastos marinos representan menos de un 2 % de la cobertura a nivel global, sin embargo, son diez veces más eficientes para secuestrar carbono que otros sistemas biológicos terrestres (Mcleod et al., 2011; Murray et al, 2011, Ramírez-García et al., 2019), lo que los convierte en importantes sumideros de carbono en las zonas costeras, en una temática denominada carbono azul (Nellemann y Corcoran, 2009; Pendleton et al., 2012, Macreadie et al., 2019). Las praderas de pastos marinos almacenan tanto el carbono producido en sus tejidos (autóctono) como el proveniente de fuentes distintas (alóctono) (seston, macroalgas, etc), acumulándolo en sus sedimentos (Duarte et al., 2005, 2010; Kennedy et al., 2010; Fourqurean et al., 2012). Se calcula que globalmente las praderas de pastos marinos secuestran entre 20,73 a 50,69 Tg C/año (Charpy-Roubaud y Sournia, 1990; Duarte y Cebrián, 1996; Duarte et al., 2005, 2010), lo que corresponde entre 10 y 18 % de la captura de carbono en los océanos, con un estimado diario de hasta 1,21 ± 0,3 g/m2 en los rizomas y raíces de la biomasa subterránea (Duarte y Chiscano, 1999).
El hecho de secuestrar carbono, se debe principalmente a su capacidad de producir biomasa vegetal, la cual juega un papel primordial en el almacenamiento de este en los sedimentos anóxicos, llegando incluso a hacerlo por décadas (Duarte et al., 2005), por lo que entre más extensas y altas sean las praderas que conforman, mayor secuestro de carbono tendrá. Autores como Fourqurean et al. (2012) estiman que el carbono almacenado globalmente como biomasa promedia en 2,52 ± 0,48 Mg C/ha y de este, dos tercios corresponden a lo almacenado en rizomas y raíces, que finalmente podrá quedar sepultado por incluso milenios, convirtiéndolo en un gran sumidero de carbono a largo plazo (Pergent et al., 1994; Mateo et al., 1997; Ricart et al., 2020). En Colombia, son pocas las estrategias y los estudios enfocados en esta temática, centrándose principalmente en la evaluación de atributos estructurales sin resaltar la importancia de estos en los reservorios de carbono, por este motivo, el presente estudio buscó cuantificar la biomasa y el carbono presente en esta, de las praderas de pastos marinos más representativas del Caribe colombiano, como lo son las de San Andrés y La Guajira.
ÁREA DE ESTUDIO
El estudio se llevó a cabo en dos regiones del Caribe colombiano donde el desarrollo y presencia de las praderas de pastos marinos es destacada. Una de ellas, en el Caribe continental, es La Guajira, en donde se encuentra más de 80 % del total de los pastos marinos del país (Díaz et al., 2003). La otra región fue en el Caribe occidental insular, en la isla de San Andrés, la cual hace parte de la Reserva de Biósfera SeaFlower desde 2000 y desde 2005 hace parte de la sección sur del Área Marina Protegida (AMP) establecida al interior de la Reserva (Gómez-López et al., 2012).
La Guajira
La plataforma continental en esta región constituye el extremo más norte de Colombia, presenta amplitudes que varían entre 8 y 17 km con un perfil de fondo que aumenta progresivamente y que constituye el talud continental, a su vez, cuenta con una extensión de pastos marinos de 56 424 ha básicamente de Thalassia testudinum (K.D. Koenig, 1805) que se extienden entre 0 y 15 metros de profundidad (Gómez-López et al., 2014).
Los sedimentos de la plataforma continental de La Guajira, generalmente presentan contenidos de carbonatos, compuestos principalmente por restos de moluscos (bivalvos y gastrópodos) y equinodermos (ofiuros y otros organismos). Desde el punto de vista granulométrico, los depósitos sedimentarios son principalmente arenosos, con fracciones areno-lodosas hacia la Sierra Nevada y lodosas desde Bahía Honda hacia el oeste (Corpoguajira e Invemar, 2012). La intensidad de los vientos noreste y este, en la zona, transportan continuamente grandes cantidades de sedimentos que afectan la transparencia de las aguas. Además, estos vientos traen consigo un fuerte oleaje que genera continuamente resuspensión del material depositado en los fondos poco profundos y un efecto de surgencia, con afloramiento de aguas subsuperficiales (Gutiérrez-Leones et al., 2015).
La toma de datos en esta zona se realizó en dos sectores: Media Guajira, en las estaciones de Musichi donde se muestreo una pradera extensa a 1 m de profundidad, constituida por T. testudinum; y Carrizal, estación donde se muestreo una pradera a 0,8 m de profundidad. En el sector de la Alta Guajira se muestrearon seis praderas, una en Cabo de la Vela (0,5 m de profundidad), dos en Bahía Portete (1,5 m de profundidad) y tres Bahía Hondita (1 m de profundidad) (Fig. 1).
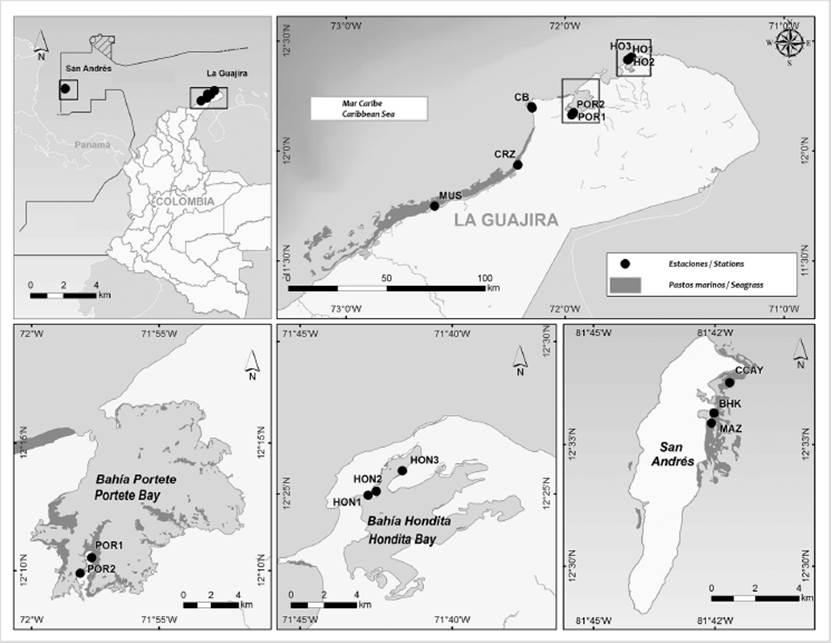
Figura 1 Mapa de las diferentes estaciones de muestreo ubicadas en la zona de La Guajira y San Andrés, (Guajira con POR: Bahía Portete, CB: Cabo de la Vela, CRZ: Carrizal, HON: Bahía Hondita; San Andrés con CCAY: Cotton Cay, BHK: Bahia Hooker, MAZ: Mar Azul) (Laboratorio servicios de Información geográfica - Invemar, 2020).
San Andrés
La isla de San Andrés se encuentra ubicada en la porción occidental del mar Caribe, a unos 800 km de la costa de Colombia y a unos 110 de la de Nicaragua, posee una longitud de aproximadamente 12 km y un ancho de alrededor de 4 km en su sector más amplio. Por el lado de barlovento, posee una barrera arrecifal que separa un costado expuesto al oleaje y vientos, y un segundo ambiente por lo general protegido y calmo, donde se observa una cuenca lagunar que varía su extensión a la costa (Díaz et al., 1996, 2000; Gamboa et al., 2010). En esta cuenca se han depositado fragmentos de corales, erizos y otros animales, así como macroalgas calcáreas de especies como Penicillus spp., Caulerpa spp. y Halimeda spp., siendo estas últimas las más representativas (Díaz et al., 2003), dando origen a las arenas bioclásticas que dominan como el tipo de sedimento más común. En este sector, se encuentran formaciones de praderas de pastos marinos que ayudan a consolidar la capa de sedimento con una extensión aproximada que en la isla llega a ser de 399 ha (Gómez-López et al., 2014).
En esta área se ubicaron tres estaciones en los lugares conocidos como Cotton Cay (2 m de profundidad), Mar Azul y Bahía Hooker (las dos a aproximadamente a 1 m de profundidad), todos ellos ubicados al interior de la laguna prearrecifal, al costado de barlovento de la isla (Fig. 1) y constituidas predominantemente por T. testudinum.
MATERIALES Y MÉTODOS
Durante el segundo semestre de 2017, y haciendo uso de un cuadrante de PVC de 50 x 50 cm, se tomaron datos de densidades (vástagos/m2), en cada uno de los sitios de muestreo siguiendo los protocolos descritos en el manual de SeagrassNet (Short et al., 2008), posterior a ello, se realizó la extracción de la biomasa en sectores con alta densidad de pastos marinos (> 200 vástagos/m2) con ayuda de un nucleador de PVC (8 cm de diámetro y 40 cm de largo) que se insertó a través del sedimento, teniendo especial atención en no cortar las hojas, y llegando hasta el componente de rizomas y raíces de las plantas. El nucleador fue tapado en la parte superior y extraído del fondo con la muestra inmersa en él, tomando tres réplicas por estación. Cada una de estas fue tamizada para retirar sedimento particulado y puesta en bolsas herméticas dentro de una nevera con hielo para su traslado al laboratorio.
Fase de laboratorio
De cada estación se obtuvo el peso de la biomasa húmeda (g), separando a su vez las hojas y rizomas verticales (en adelante sección aérea) y las raíces y rizomas horizontales (en adelante sección subterránea). Las muestras fueron llevadas al laboratorio de calidad ambiental marina de Invemar, donde se limpiaron con HCl al 10 % para obtener únicamente el peso de la biomasa de la planta y minimizar el error por otros componentes asociados. Posteriormente, cada muestra fue puesta en bolsas de papel previamente rotuladas que se secaron en un horno a 60 °C durante 72 horas hasta obtener un peso constante del valor de la biomasa seca (g PS).
Procedimientos numéricos
Para calcular en cada estación los datos de biomasa (g PS/m2), se extrapoló el valor inicial del peso correspondiente a las muestras a 1 m2. Adicionalmente, posterior a determinar que los datos no correspondían a una distribución normal, los resultados se compararon con una prueba de Kruskal-Wallis y una prueba de comparaciones múltiples de Tukey, con el fin de determinar diferencias entre las estaciones a nivel de su biomasa aérea, subterránea y total, haciendo uso del programa Statgraphics Centurion XVI.
El contenido de carbono se determinó teniendo en cuenta lo descrito por Fourqurean et al. (2012), en el que se calcula que el valor corresponde al 35 % del peso seco de la biomasa. Este procedimiento se realizó con cada estación muestreada, para finalmente convertir los valores encontrados a Mg C/ha y así extrapolar el valor a la extensión de pastos correspondiente a las dos áreas de muestreo (La Guajira y San Andrés).
RESULTADOS
Los registros de biomasa aérea indican que las estaciones de Bahía Hondita 3 y Bahía Hondita 2 presentaron los datos más altos, con valores de 923,2 y 1068,4 g PS/m2, seguidos por Cotton Cay y Carrizal, que superaron los 700 g PS/m2. Por su parte, en la biomasa subterránea, las estaciones de Bahía Hondita 2 y Bahía Hooker destacaron con valores de 866,8 g PS/m2 y 1057,1 g PS/m2 respectivamente, seguidos de Cotton Cay, con 725,5 g PS/m2. Cabe resaltar que 6 de las 11 estaciones presentaron una biomasa total que supera los 1000 g PS/m2 mientras que las estaciones Bahía Hondita 1 y Bahía Portete 1 y 2 de La Guajira, registraron los menores valores.
Las densidades presentaron valores más altos en Mar Azul (400 vástagos/m2) y Bahía Hondita 2 (384 vástagos/m2) y más bajos en Bahía Portete 1 y 2 (por debajo de 280 vástagos/m2). Se destaca de igual modo que los valores más altos de la biomasa aérea corresponden a La Guajira y los de la subterránea a San Andrés. En la comparación entre las estaciones, se evidenciaron diferencias significativas a nivel de la biomasa aérea (Kruskal Wallis = 19,24, valor p = 0,03), la biomasa subterránea (Kruskal Wallis = 23,53, valor p = 0,008), así como en la total (Kruskal Wallis = 20,53, valor p = 0,02).
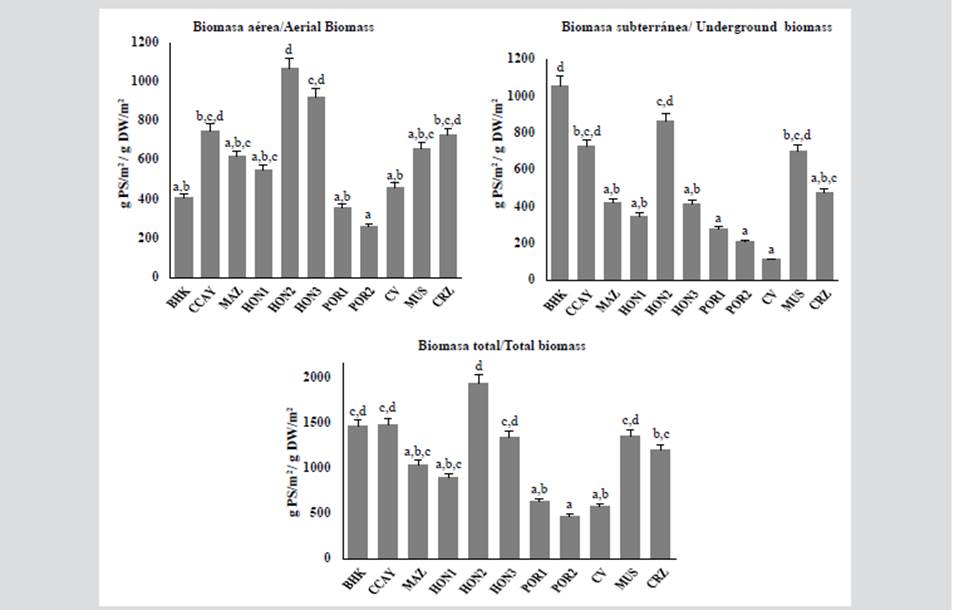
Figura 2 Valores de biomasa aérea, subterránea y total para cada una de las estaciones, siendo POR: Bahía Portete, CV: Cabo de la Vela, CRZ: Carrizal, HON: Bahía Hondita, CCAY: Cotton Cay, BHK: Bahia Hooker y MAZ: Mar Azul (letras diferentes representan diferencias significativas entre estaciones, p < 0,05).
Por otro lado, San Andrés presentó una mayor presencia de carbono en su biomasa total (4,6 Mg C/ha) frente a La Guajira (3,5 Mg C/ha), sin embargo, La Guajira presentó un valor más alto a nivel de la sección aérea, especialmente en Bahía Hondita 2 (3,7 Mg C/ha), mientras que en San Andrés destacó la subterránea, especialmente en Bahía Hooker (3,7 Mg C/ha). Estaciones como Bahía Portete 1, Bahía Portete 2 y Cabo de la Vela, presentaron los valores más bajos en ambas secciones (por debajo de 1,6 Mg C/ha). Las estaciones que tuvieron una presencia más destacada de carbono sumando ambas secciones fueron Cotton Cay en San Andrés con 5,2 Mg C/ha y Bahía Hondita 2 para La Guajira con 6,8 Mg C/ha. Estaciones como Bahía Portete 1 y 2, presentaron los valores más bajos (menores a 2,2 Mg C/ha).
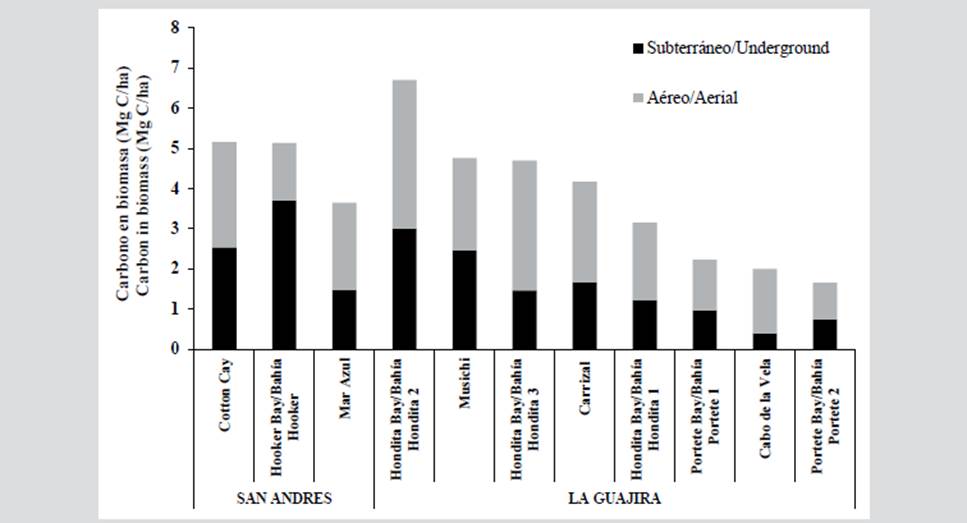
Figura 3 Valores de carbono (Mg C/ha) para cada sección de la planta en cada una de las estaciones trabajadas.
Teniendo en cuenta los valores promedio de carbono registrados en ambas regiones y la extensión de las praderas de cada área, se estimó que los valores del stock de carbono asociado a las biomasas de pastos marinos son de 197 484 Mg C para La Guajira y de 1835,4 Mg C para San Andrés.
DISCUSIÓN
Las diferencias registradas a nivel de las biomasas pueden deberse a diferentes factores relacionados a las condiciones de cada sitio, en el caso específico de La Guajira, la resuspensión de sedimentos es frecuente en la mayoría de los casos (Corpoguajira e Invemar, 2012), lo que hace que sus aguas sean extremadamente turbias, factor que contribuye a estimular el incremento del área foliar para la obtención de luz y llevar a cabo el proceso de fotosíntesis, aumentando su biomasa aérea (Kraemer y Hanisak 2000, Díaz et al., 2003). Esto se reafirma con estudios de monitoreo realizados por Invemar (Gómez-López et al., 2018), donde se pudo observar que aquellas con mayor longitud corresponden a La Guajira (23,3 cm), mientras que en San Andrés se tomaron datos comparativamente más bajos (18,4 cm).
De forma distinta sucede en San Andrés, dado que los puntos donde se encuentran las praderas presentan condiciones de eutrofización producto de su cercanía al muelle de la isla y al centro poblado de esta (Gómez-López et al., 2012). Esta situación trae consigo un aumento de las fracciones fangosas y lodosas, una disminución del oxígeno disponible y la proliferación de algas oportunistas (Burkholder et al., 2007). En este sentido, especies como Halimeda spp, Chaetomorpha spp y Cladophora spp, son características de la zona (Gómez-López et al., 2012; Albis-Salas y Gavio, 2015), y pueden crecer encima de las praderas, limitando en algunos casos, el crecimiento foliar (Duarte y Cebrián, 1996). A su vez, el mayor desarrollo de biomasa subterránea en esta región puede estar ligado a la alta fuente de sedimentos disponibles para atrapar en su sistema rizoidal, llegando incluso a formar terrazas que en algunos sectores de la isla pueden llegar a tener una altura entre 30 cm a 1 m sobre el fondo. Este sistema rizoidal les otorga un mejor mecanismo de fijación ante la presión por factores físicos como la remoción por embarcaciones y la presencia de vientos y corrientes por efecto de los alisios del nororiente (Albis-Salas et al., 2006).
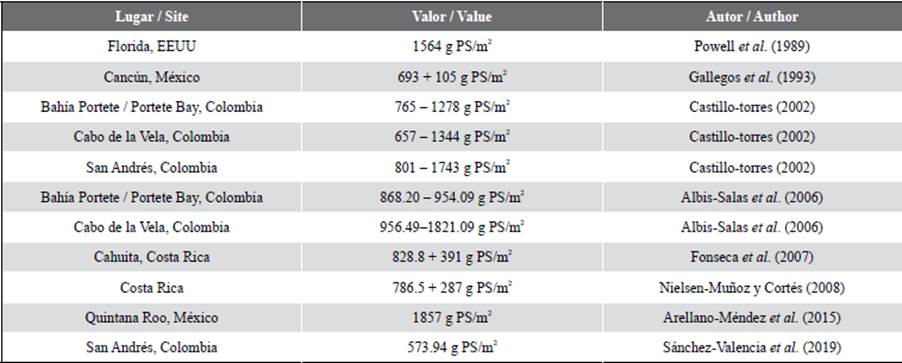
Comparando los resultados con estudios anteriores realizados en las mismas estaciones (Tabla 1), se puede identificar que los valores expuestos en este estudio corresponden a los rangos indicados anteriormente sin variaciones marcadas, sumándose a ellos los casos de Bahía Hondita 1, Bahía Hondita 2, Bahía Hondita 3 y Carrizal, que no contaban con registros anteriores, siendo estos los primeros. La excepción a esto corresponde a Cotton Cay, dado que el valor de abril de 2018 varía considerablemente en relación al valor de 1473,7 g PS/m2 del presente estudio. Esto pudo deberse a la variación del atributo según la época de muestreo, dado que el primer caso corresponde a una temporada seca y el segundo a una lluviosa (Gómez-López et al, 2012). Esta variación se ha documentado en otras localidades del Caribe colombiano, donde se han registrado cambios notorios en los parámetros de estructura en las praderas entre los dos semestres del año, debido a que este fenómeno genera variaciones en los nutrientes, la salinidad y en la disponibilidad de luz en la columna de agua (Gavio et al., 2010). Ejemplo de ello es lo documentado por Gómez-López y Alonso (2016) en las praderas de Ballena y Manaure en La Guajira, así como las de Triganá y Pinorroa en Chocó Darién.
Tabla 1 Variables de biomasa aérea, subterránea (a 50 cm de profundidad) y total (promedio + desviación estándar, g PS/m2) y densidad (vástagos/m2) para cada una de las estaciones.
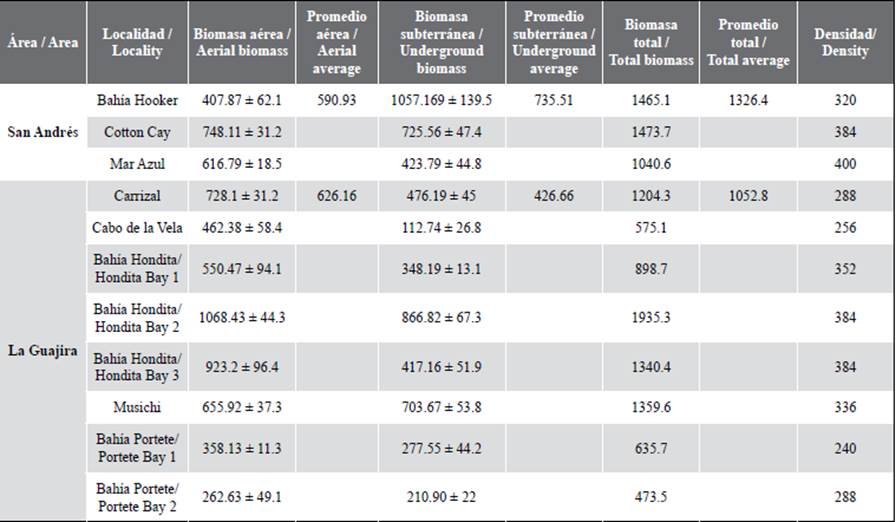
Por otro lado, los valores promedio de biomasa total se encontraron en un punto intermedio respecto a estudios realizados en otros países (Tabla 1). Las variaciones entre estos sitios pudieron deberse a componentes fisicoquímicos en la columna de agua, el tipo de sustrato en el que se desarrollan (Lee et al., 2007; Ralph et al., 2007) y variables como la temperatura y salinidad, que pueden generar cambios en la composición y estructura de la pradera. En el caso de este estudio, estas variables parecen no intervenir de manera negativa en la biomasa, dado que los valores promedio de temperatura (La Guajira: 28,6 °C; San Andrés: 29,1 °C) y salinidad (La Guajira: 36,6 ups; San Andrés: 35,9 ups) (Invemar, 2020), se encuentran cercanos a los rangos óptimos reportados para T. testudinum, de aproximadamente 30 °C para temperatura, y entre 24-35 para salinidad (Mazzotti et al., 2007). Zonas con una biomasa menor, pueden ser resultado de temperaturas elevadas y aguas euri o estenohalinas, causando efectos deletéreos por la proliferación de fitoplancton y macroalgas, o bien por dinámicas naturales de la pradera en su ciclo anual (Burkholder et al., 2007).ç
En cuanto al carbono presente en la biomasa de las dos áreas de estudio, cabe resaltar que son pocos los estudios enfocados en determinar este dato, especialmente en la región Caribe, sin embargo, los valores registrados en este estudio, superan el promedio mundial de 2,5 + 0,4 Mg C/ha Fourqurean et al. (2012). Cabe aclarar que este se trata de un promedio de estudios realizados en diferentes regiones del mundo y con diferentes especies de pastos marinos, por lo cual el resultado podría variar significativamente según la especie, como en el caso de las praderas de Posidonia oceanica en el Mediterráneo con valores promedio de 7,2 + 1,5 Mg C/ha (Fourqurean et al., 2012). Particularmente, en el caso de las praderas de T. testudinum, se registran datos presentes en el Caribe mexicano de 14,5 Mg C/ha (ArellanoMéndez et al., 2015) y de 0,39 + 0,05 Mg C/ha (Congdom et al., 2017); así mismo, Fourqurean et al. (2012) presentan valores de 0,84 + 0,1 Mg C/ha para el Atlántico occidental en la parte del trópico. Estos valores son contrastantes con respecto al de este estudio, evidenciando no solo la variabilidad del comportamiento de esta especie y cómo la distribución geográfica y los patrones intrínsecos de cada sitio pueden afectar este resultado, sino también lo importante que es seguir investigando todo lo referente a carbono azul.
Si bien los reservorios de carbono asociados a la biomasa tienden a ser comparativamente más bajos al compararlos con los valores calculados para el sedimento (Ricart et al., 2020), cuyo promedio global es de 194,2 + 20,2 Mg C/ha (Fourqurean et al., 2012), su importancia no radica sólo en esta función, teniendo en cuenta que también cumplen un papel fundamental para la prestación de algunos servicios ecosistémicos importantes, entre los que destaca la regulación climática, dado que el mantenimiento de la estructura de las praderas, permite llevar a cabo de manera más eficiente su función como reservorio de carbono en sedimentos (Pergent et al., 1994; Romero et al., 1994, Mazarrasa et al., 2015).
A nivel del Caribe colombiano esto cobra mayor importancia, teniendo en cuenta los datos registrados en Serrano et al. (2021), los cuáles muestran una aproximación al cálculo del carbono en los sedimentos de los pastos marinos del país, destacando que el valor de los stocks en los sedimentos de La Guajira y San Andrés superan los promedios globales, alcanzando los 240 Mg C/ha. Esto, sumado a lo registrado por Guerra et al. (2020) para San Andrés, donde se calculó que el valor de carbono en los sedimentos osciló entre 91 y 144 Mg C/ha, y lo hallado por Congdon et al. (2017) y Gullström et al. (2018), donde se evidenció que el contenido de carbono en sedimentos es más alto en zonas donde la cobertura y la biomasa tiende a ser mayor, refrenda el hecho de que la protección del sistema de biomasa aérea y subterránea repercute directamente en los reservorios de los sedimentos, y por ende en la optimización de los procesos de captura de carbono.
CONCLUSIONES
Se evidenciaron diferencias significativas en las estaciones a nivel de la biomasa aérea, subterránea y total, mostrando la variación que hay según las condiciones particulares en las que se desarrollan las praderas de cada lugar.
En La Guajira predominó la sección aérea, presumiblemente debido a factores de turbidez que estimulan su crecimiento para optimizar la captación de luz, mientras que en San Andrés predominó la sección subterránea, debido a que las estaciones se encuentran en sustratos fangosos por lo que requieren mecanismos de fijación al fondo más fuertes.
Los valores de biomasa total se encuentran de manera generalizada cercanos a los valores registrados por diversos autores en las mismas localidades de estudio, y en un punto intermedio con respecto a otras regiones del Caribe como Costa Rica, México y Florida.
Los valores de carbono (Mg C/ha) en San Andrés y en La Guajira superan el dato del promedio mundial calculado con datos de varias especies, sin embargo, presentaron una variación con respecto a los registrados en otras regiones del Caribe correspondientes a la misma especie (T. testudinum).
Los stocks de carbono registrados para San Andrés y La Guajira corresponden a estimaciones basadas en los datos recopilados aquí; sin embargo, se requieren de estudios a futuro donde se tenga en cuenta la variabilidad de las coberturas a lo largo de ambas regiones, para dar un dato con un grado de certidumbre mayor.
Si bien los valores de reservorios de carbono asociados a la biomasa son comparativamente más bajos con respecto a los sedimentos, la presencia y mantenimiento de la estructura en la pradera representa un factor primordial en el mantenimiento de este reservorio.
AGRADECIMIENTOS
Agradecimientos a la Acción MAPCO cofinanciada según contrato de subvención ENV/2016/380-256 de la Unión Europea, Instituto de Investigaciones Marinas y Costeras-Invemar y Fundación Natura Colombia con la asesoría del IMEDEA-CSIC de España y la Universidad Edith Cowan de Australia. Los autores agradecen a la Dra. Núria Marbà del Instituto Mediterráneo de Estudios Avanzados de España por sus valiosos aportes y sugerencias en la elaboración del documento, al personal de Coralina que acompañó las actividades de campo en el sector de San Andrés. La presente publicación es responsabilidad exclusiva de los autores y no necesariamente refleja los puntos de vista de la Unión Europea. Esta es la contribución # 1334 del Instituto de Investigaciones Marinas y Costeras - Invemar
REFERENCIAS
Albis-Salas, M. R. and B. Gavio. 2015. Notes on the marine algae of the International Biosphere Reserve Seaflower, Caribbean Colombia IV: New records of macroalgal epiphytes on the seagrass Thalassia testudinum. Bol. Invest. Mar. Cost., 44(1), 55-70. ISSN 0122-9761 [ Links ]
Albis-Salas, M. R. , D. I. Gómez-López y G. Duque. 2006. Estructura y producción primaria de las praderas de Thalassia testudinum en La Guajira, Caribe colombiano, en época climática seca. Acta Biol. Colomb., 11, 100 p. ISSN: 1900-1649. [ Links ]
Arellano-Méndez, L., S. Morales-Ojeda y J. Herrera-Silveira. 2015. Carbono orgánico de las praderas de Thalassia testudinum en bahía de la Ascensión (Quintana Roo, México). Una primera estimación del contenido de carbono azul en una laguna costera del Caribe mexicano: 476-481. En: Paz, F. y J. Wong. (Eds). Estado actual del conocimiento del ciclo del carbono y sus Interacciones en México: Síntesis a 2014. Texcoco, México. pp. ISBN: 978-607-96490-2-9. [ Links ]
Burkholder, J. M., D. A. Tomasko and B.W. Touchette. 2007. Seagrasses and eutrophication. J Exp Mar Bio Ecol., 350 (1-2): 46-72. https://doi.org/10.1016/j.jembe.2007.06.024. [ Links ]
Castillo-Torres, P. 2002. Caracterización estructural y evaluación del estado ambiental de las praderas de pastos marinos del Caribe colombiano. Tesis Biol. Mar.,Univ. Jorge Tadeo Lozano, Santa Marta. 81 p. [ Links ]
Charpy-Roubaud, C. and A. , Sournia A. 1990. The comparative estimation of phytoplanktonic and microphytobenthic production in the oceans. Mar. Microb. Food Webs, 4: 31- 57. [ Links ]
Congdon, V. M., S. S. Wilson and K. H. Dunton. 2017. Evaluation of relationships between cover estimates and biomass in subtropical seagrass meadows and application to landscape estimates of carbon storage. Southeastern Geographer, 57(3), 231-245. [ Links ]
Corpoguajira e Invemar. 2012. Atlas marino costero de La Guajira. Santa Marta, Colombia: Serie de Publicaciones Especiales de Invemar No. 27. 188 p. ISBN: 978-958-8448-45-9. [ Links ]
Díaz, J. M., G. Díaz-Pulido, J. Garzón-Ferreira, J. Geister y J. A Sánchez. 1996. Atlas de los arrecifes coralinos del Caribe colombiano. I. Complejos arrecifales oceánicos. Ser. Publ. Esp. Invemar, 2, 83 p. ISBN: 958-95950-3-0. [ Links ]
Díaz, J. M. , L. M. Barrios-Suárez, M. H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Santa Marta, Colombia: Invemar, Serie de Publicaciones Especiales No.5. 179 p. ISBN: 958-95950-8-1. [ Links ]
Díaz, J. M. , L. M. Barrios-Suárez y D. I. Gómez-López. (Eds.). 2003. Praderas de pastos marinos en Colombia: Estructura y distribución de un ecosistema estratégico. Ser. Publ. Espec.,10, 162 p. ISBN: 958-97301-5-9. [ Links ]
Duarte, C. and J. Cebrián. 1996. The fate of marine autotrophic production. Limnol. Oceanogr. Bull., 41: 1758-1766. https://doi.org/10.4319/lo.1996.41.8.1758 [ Links ]
Duarte, C. and C. Chiscano. 1999. Seagrass biomass and production: a reassessment. Aquat. Bot., 65: 159-174. https://doi.org/10.1016/S0304-3770(99)00038-8 [ Links ]
Duarte, C. M. , J. J. Middelburg and N. Caraco. 2005. Major role of marine vegetation on the oceanic carbon cycle. Biogeosciences, 2(1): 1-8. https://doi.org/10.5194/ bg-2-1-2005 [ Links ]
Duarte, C. , N. Marbà, E. Gacia, J. Fourqurean, J. Beggins, C. Barrón and E. Apostolaki. 2010. Seagrass community metabolism: Assessing the carbon sink capacity of seagrass meadows. Global Biogeoch. Cycles, 24: 1-8. https://doi.org/10.1029/2010GB003793 [ Links ]
Fourqurean, J. W., C. M. Duarte, H. Kennedy, N. Marbà, M. Holmer, M. A. Mateo and O. Serrano. 2012. Seagrass ecosystems as a globally significant carbon stock. Nat. Geosci., 5(7), pp 505. https://doi.org/10.1038/ngeo1477. [ Links ]
Fonseca, A. C., V. Nielsen y J. Cortés. 2007. Monitoreo de pastos marinos en Perezoso, Cahuita, Costa Rica (sitio Caricomp). Rev. Biol. Trop., 55(1): 55-66. ISSN 0034-7744. [ Links ]
Gallegos, M. E., M. Merino, N. Marbà and C. M. Duarte. 1993. Biomass and dynamics of Thalassia testudinum in the Mexican Caribbean: elucidating rhizome growth. Mar. Ecol. Prog. Ser., 185-192. https://doi.org/10.3354/meps095185 [ Links ]
Gamboa, L., B.O. Posada, O.C. González, G. Hurtado y C.A. Andrade-Amaya. 2010. Descripción física del archipiélago de San Andrés, Providencia y Santa Catalina: 35-53. En Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. ISBN: 978-958-8448-50-3. [ Links ]
Gavio, B., P. Palmer-Cantillo and J. E. Mancera. 2010. Historical analysis (2000-2005) of the coastal water quality in San Andrés Island, SeaFlower Biosphere Reserve, Colombian Caribbean. Mar. Pollut. Bull., 60(7), pp 1018-1030. https://doi.org/10.1016/j.marpolbul.2010.01.025 [ Links ]
Gómez-López, D. I. y D. Alonso. (Eds.). 2016. Levantamiento de información para la caracterización y diagnóstico de las praderas de pastos marinos con fines de elaborar una propuesta de zonificación de la zona marino-costera del departamento de La Guajira y Chocó Caribe. Fase II: época climática seca. Informe Técnico final Temática 2. En: Vides et al. (Eds). Levantamiento de información ambiental de sistemas marinos y costeros sobre el Caribe colombiano Fase II. Convenio 167 ANH- Invemar, Santa Marta. [ Links ]
Gómez-López, D. I., C. Segura-Quintero, P.C. Sierra-Correa y J. Garay-Tinoco. 2012. Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. Ser. Publ. Espec. Invemar, 28. ISBN: 978-958-8448-50-3. [ Links ]
Gómez-Lopez, D. I., C. Díaz-Sanchez, E. Galeano, L. Muñoz, S. Millán, N. Bolaños y C. Garcia. 2014. Informe técnico final Proyecto de Actualización cartográfica del atlas de pastos marinos de Colombia: Sectores Guajira, Punta San Bernardo y Chocó: Extensión y estado actual. PRY- BEM-005-13 (convenio interadministrativo 2131068) Fonade-Invemar. Santa Marta. 136 p. [ Links ]
Gómez-López, D.I., A. Acosta-Chaparro, J.D. González, L. Sanchez, R, Navas-Camacho y D. Alonso. 2018. Reporte del estado de los arrecifes coralinos y pastos marinos en Colombia (2016-2017). Ser. Publ. Gen. Invemar,101. 100 p. [ Links ]
Guerra-Vargas, L. A., L. G. Gillis and J. E. Mancera-Pineda. 2020. Stronger together: do coral reefs enhance seagrass meadows “Blue Carbon” potential? Front. Mar. Sci., 7, 628. [ Links ]
Gullström, M., L. D. Lyimo, M. Dahl, G. S. Samuelsson, M. Eggertsen, E. Anderberg and M. Björk. 2018. Blue carbon storage in tropical seagrass meadows relates to carbonate stock dynamics, plant-sediment processes, and landscape context: insights from the western Indian Ocean. Ecosystems, 21(3), 551-566. doi: https://doi.org/10.1007/s10021-017-0170-8 [ Links ]
Gutiérrez Leones, G. A., M. A. Correa Ramírez, H. Fritz y S. Ernesto. 2015. Análisis de la variabilidad espacio-temporal del sistema de surgencia de La Guajira en el dominio espacio-frecuencia, empleando el MTM-SVD (Multi Taper Method Singular Value Decomposition). Bol. Cient. CIOH, (33), 87-106. doi https://doi.org/10.26640/01200542.33.87_106. [ Links ]
Invemar. 2020. Sistema de Información Ambiental Marina de Colombia - SIAM. Base de datos de la Red de vigilancia para la conservación y protección de las aguas marinas y costeras de Colombia - REDCAM (segundo muestreo 2017 La Guajira y San Andrés). Invemar. Disponible en: http://www.invemar.org.co/siam/redcam [ Links ]
Kraemer, G.P. and M.D. Hanisa. 2000. Physiological and growth responses of Thalassia testudinum to environmentally-relevant periods of low irradiance. Aquat. Bot., 67(4): 287-300. https://doi.org/10.1016/S0304-3770(00)00096-6 [ Links ]
Lee, K.-S., S.R. Park and Y.K. Kim. 2007. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses: A review. J. Exp. Mar. Biol. Ecol., 350 (1-2): 144-175. https://doi.org/10.1016/j.jembe.2007.06.016. [ Links ]
Macreadie, P. I., A. Anton, J. A. Raven, N. Beaumont, R. M. Connolly, D. A. Friess and C. M. Duarte. 2019. The future of Blue Carbon science. Nature communications, 10(1), 1-13. https://doi.org/10.1038/s41467-019-11693-w [ Links ]
Mateo, M.A., J. Romero, M. Pérez, M.M. Littler and D.S. Littler. 1997. Dynamics of millenary organic deposits resulting from the growth of the Mediterranean seagrass Posidonia oceanica. Estuar. Coast. Shelf Sci., 44: 103-110. https://doi.org/10.1006/ecss.1996.0116. [ Links ]
Mazarrasa, I., N. Marbà, C.E. Lovelock, O. Serrano, P.S. Lavery, J.W. Fourqurean and C.M. Duarte. 2015. Seagrass meadows as a globally significant carbonate reservoir. Biogeosciences, 12(16), 4993-5003. https://doi.org/10.5194/bg-12-4993-2015 [ Links ]
Mazzotti, F.J., L.G. Pearlstine, R. Chamberlain, T. Barnes, K. Chartier and D. DeAngelis. 2007. Stressor-response models for seagrasses, Halodule wrightii and Thalassia testudinum. Final report to the South Florida Water Management District and the US Geological Survey. Univ. Florida, Florida Lauderdale Res. Educ. Cent., Fort Lauderdale, USA. [ Links ]
Mcleod, E., G. L. Chmura, S. Bouillon, R. Salm, M. Björk, C. M. Duarte and B. R. Silliman. 2011. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2. Front. Ecol. Environ., 9(10), pp 552-560. https://doi.org/10.1890/110004. [ Links ]
Murray, B., L. Pendleton, W. Jenkins and S. Sifleet. 2011. Green payments for blue carbon economic incentives for protecting threatened coastal habitats. https://nicholasinstitute.duke.edu/sites/default/files/publications/blue-carbon-report-paper.pdf. [ Links ]
Nielsen-Muñoz, V. y J. Cortés, J. 2008. Abundancia, biomasa y floración de Thalassia testudinum (Hydrocharitaceae) en el Caribe de Costa Rica. Rev. Biol. Trop., 56(4), pp 175-189. ISSN: 0034-7744. [ Links ]
Nellemann, C. and E. Corcoran. (Eds.). 2009. Blue carbon: the role of healthy oceans in binding carbon: a rapid response assessment. United Nations Environment Programme /Earthprint. ISBN: 978-82-7701-060-1. [ Links ]
Pendleton, L., D.C. Donato, B.C. Murray, S. Crooks, W.A. Jenkins, S. Sifleet, C. Craft, J.W. Fourqurean, J.B. Kauffman, N. Marba, P. Megonigal, E. Pidgeos, D. Herr, D. Gordon and A. Baldera. 2012. Estimating global “blue carbon” emissions from conversion and degradation of vegetated coastal ecosystems. PloS One, 7(9). https://doi.org/10.1007/s11273-016-9501-3. [ Links ]
Pergent, G., J. Romero, C. Pergent-Martini, M. A. Mateo and C. F. Boudouresque. 1994. Primary production, stocks and fluxes in the Mediterranean seagrass Posidonia oceanica. Mar. Ecol. Prog. Ser., 106(1-2):139-146. https://doi.org/10.3354/meps106139. [ Links ]
Powell, G.V., J.W. Kenworthy and J.W. Fourqurean. 1989. Experimental evidence for nutrient limitation of seagrass growth in a tropical estuary with restricted circulation. Bull. Mar. Sci., 44(1), 324-340. [ Links ]
Ralph, P.J., M.J. Durako, S. Enríquez, C.J. Collier and M.A. Doblin. 2007. Impact of light limitation on seagrasses. J. Exp. Mar. Biol. Ecol, 350 (1-2): 176-193. https://doi.org/10.1016/j.jembe.2007.06.017. [ Links ]
Ramírez-García P., K. Pedraza-Venegas y A. Granados-Barba, 2019. Los pastos marinos y la captura de carbono azul una razón para estudiarlos en el CASGM: 281-300. En: Granados-Barba A., L. Ortiz-Lozano, C. González-Gándara y D. Salas-Monreal (Eds). Estudios Científicos en el Corredor Arrecifal del Suroeste del Golfo de México. Univ. Autón. Campeche. 376 p. ISBN 978-607-8444-54-0. https://doi.org/10.26359/epomex0319 [ Links ]
Ricart, A.M., P.H. York, C. Bryant, M. Rasheed, D. Lerodiaconou and P. Macreadie. 2020. High variability of Blue Carbon storage in seagrass meadows at the estuary scale. Sci. Rep., 10: 5865. https://doi.org/10.1038/s41598-020-62639-y. [ Links ]
Romero, J., M. Pérez, M.A. Mateo and E. Sala. 1994. The belowground organs of the Mediterranean seagrass Posidonia oceanica as a biogeochemical sink. Aquat. Bot., 47(1): 13-19. https://doi.org/10.1016/0304-3770(94)90044-2 [ Links ]
Sánchez-Valencia, L., A. Acosta-Chaparro, J.D. González-Corredor, R. Navas-Camacho, D.I. Gómez-López y N. Bolaños. 2019. Estado de los pastos marinos en las islas de San Andrés y Providencia en 2016 y 2018. Ser. Publ. Gen., 105. Invemar-Coralina. [ Links ]
Serrano, O., D.I. Gómez-López, L. Sánchez-Valencia, A. Acosta-Chaparro, R. Navas-Camacho, J. González-Corredor and N. Marbà. 2021. Seagrass blue carbon stocks and sequestration rates in the Colombian Caribbean. Scient. Rep., 11(1): 1-12. [ Links ]
Short, F.T., L.J. McKenzie, R.G. Coles, K.P. Vidler and J.L. Gaeckle. 2008. SeagrassNet manual for scientific monitoring of seagrass habitat, Univ. New Hampshire Publ,. ISBN: 095-797-4124. [ Links ]
Recibido: 31 de Mayo de 2020; Aprobado: 17 de Enero de 2022











 text in
text in