Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.2 Santa Marta jul./dez. 2022 Epub 14-Dez-2022
https://doi.org/10.25268/bimc.invemar.2022.51.2.1173
ARTICULO DE INVESTIGACIÓN
Estructura comunitaria del microfitobentos de la zona costera central de Venezuela
1Laboratorio de Ecología de Sistemas Acuáticos, Instituto de Zoología y Ecología Tropical, Universidad Central de Venezuela. Caracas, Venezuela. carlosjpereyra2@gmail.com
2Laboratorio de Ecología de Sistemas Acuáticos, Instituto de Zoología y Ecología Tropical, Universidad Central de Venezuela. Caracas, Venezuela.
3Laboratorio de Ecología de Sistemas Acuáticos, Instituto de Zoología y Ecología Tropical, Universidad Central de Venezuela. Caracas, Venezuela. edie.montiel@ciens.ucv.ve
4Laboratorio de Ecología de Sistemas Acuáticos, Instituto de Zoología y Ecología Tropical, Universidad Central de Venezuela. Caracas, Venezuela. vanessahernandezq8@gmail.com
5Oficina de Catastro del Municipio Simón Rodríguez. El Tigre, Venezuela. anyoeliscastillo22@gmail.com
Microphytobenthos is a community that groups benthic photosynthetic microorganisms. In Venezuela and the other countries in the Caribbean Sea, this group has been scarcely studied, so its diversity is unknown. This study aims to describe the spatial and temporal variations of its composition and abundance in the central coastal zone of Venezuela. Samplings were conducted monthly from June 2014 to March 2015, in random stations at depths less than 20 m. Richness and abundance data were processed through multivariate hypothesis tests (Anosim - SIMPER - nMDS). A total of 327 species were identified, with a dominance of diatoms and dinoflagellates, without significant spatial and temporal variations. In terms of abundance, the most representative group was diatoms (68 %), followed by cyanobacteria (28 %). The microfitobenthos presented a temporal variability in which the highest densities were reached between July and August, while the rest of the months presented similar abundances. Thus, standard abundances were obtained in all the samples according to that found in other areas of the world, with notable differences between the microphytobenthos of the evaluated substrates, and a high and constant specific richness throughout the year.
Key words: community structure; marine ecology; Caribbean Sea; microalgae
El microfitobentos es una comunidad que agrupa a los microorganismos fotosintéticos bentónicos. En Venezuela y el resto de los países del mar Caribe, este grupo ha sido escasamente estudiado, por lo que se desconoce su diversidad. Así, se propuso describir las variaciones espaciales y temporales de su composición y abundancia en la zona costera central de Venezuela. Los muestreos fueron realizados mensualmente desde junio 2014 hasta marzo 2015, en estaciones aleatorias con profundidades inferiores a 20 m. Los datos de riqueza y abundancia fueron procesados mediante pruebas de hipótesis multivariadas (Anosim - SIMPER - nMDS). Se identificaron 327 especies, dominadas por diatomeas y dinoflagelados, sin variaciones espaciales y temporales notables. En términos de abundancia, el grupo más representativo fue el de las diatomeas (68 %), seguido por las cianobacterias (28 %). El microfitobentos presentó una variabilidad temporal en la que se alcanzaron densidades mayores entre julio y agosto, mientras que el resto de los meses presentaron abundancias similares. En términos generales, se obtuvo abundancia estándar de acuerdo con lo encontrado en otras áreas del mundo, con diferencias notables entre el microfitobentos de los sustratos evaluados y una riqueza específica alta que se mantiene constante durante todo el año.
Palabras-clave: estructura comunitaria; ecología marina; mar Caribe; microalgas
INTRODUCCIÓN
El microfitobentos es un término genérico que agrupa a las microalgas eucariotas, cianobacterias y otros microorganismos fotosintéticos que colonizan el sustrato bentónico (MacIntyre et al., 1996; Dalu et al., 2018). Esta comunidad juega un papel importante en los ecosistemas acuáticos debido a que, con las macroalgas y macrofitas sumergidas, transforman la energía química en biomasa y constituyen la base de las redes tróficas bentónicas (Madigan et al., 1999). De hecho, la producción primaria del microfitobentos representa la mayor fuente de energía disponible para los niveles tróficos más altos que habitan en el fondo, excediendo en muchos casos la del fitoplancton (Blanchard et al., 2001). Adicionalmente, contribuye a la estabilización de los sedimentos, mediante la formación de una biopelícula que es utilizada por los organismos como fuente de energía y mecanismo de transporte, favoreciendo la deposición de sedimentos, disminución de la erosión y protección de microorganismos ante la herbivoría y la acción de bacterias patógenas (Kang et al., 2003; Stal, 2010; Launeau et al., 2018). Asimismo, el estudio de los dinoflagelados, de los cuales se han encontrado un poco menos de 200 especies netamente bentónicas (Hoppenrath et al., 2014), ha ganado interés en los últimos años, debido a sus implicaciones durante las floraciones algales nocivas (Aguilar et al., 2014).
La abundancia y composición del microfitobentos suele variar sustancialmente entre una localidad y otra y estos atributos comunitarios son afectados por variables ambientales y biológicas a diferentes escalas espaciales y temporales (Van der Grinten et al., 2004; Jesus et al., 2006). Espacialmente, una de las particularidades en la distribución de estos organismos es la agregación, donde las comunidades se distribuyen en parches, altamente variables en tamaño y composición, que forman un mosaico a escalas superiores (Spilmont et al., 2011). Temporalmente, ocurren variaciones que pueden ser de interdiarias a anuales (Round, 1971; Pinckney y Zingmark, 1993).
En el mar Caribe, se han realizado pocos estudios sobre la composición del microfitobentos marino con referencias escasas sobre su abundancia, destacándose las investigaciones sobre diatomeas bentónicas de Navarro et al. (1989) en la isla de Caja de Muertos en Puerto Rico, López-Fuerte et al. (2017, 2019) y Hernández et al. (2013) en México y Loza et al. (2011) en Cuba. Otras investigaciones están relacionados a dinoflagelados bentónicos que causan floraciones algales nocivas, distinguiéndose las realizadas por Delgado et al. (2006) en Cuba, Rodríguez et al. (2010), Quintana y Mercado-Gómez (2014), Arbeláez et al. (2017) en Colombia y Almazán-Becerril et al. (2012) en México. En Venezuela, destacan cuatro estudios sobre los dinoflagelados epifitos presentes en las praderas de Thalassia testudinum en las costas nororientales del país (Valerio y Díaz-Ramos; 2007, 2008) y los dinoflagelados bentónicos en diferentes sustratos en el golfo de Cariaco (Navarro-Vargas et al., 2014) y la isla de Margarita (Marchán-Álvarez et al., 2017), sin embargo, la diversidad de microalgas bentónicas y su densidad, así como sus variaciones espaciales y temporales son poco conocidas.
Por estas razones, se planteó describir las variaciones espaciales y temporales de la composición y abundancia del microfitobentos y sus relacionadas con las variables ambientales en la zona costera entre las localidades Chirimena y Puerto Francés, estado Miranda, Venezuela, como contribución al conocimiento de la diversidad biológica, considerando la relevancia de esta comunidad para el ecosistema marino.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio se encuentra en la región continental centro-norte de Venezuela y comprende desde las poblaciones de Chirimena hasta Puerto Francés, estado Miranda (Figura 1). Es un área heterogénea con costas profundas y someras con la influencia de quebradas y ríos, tales como el Tuy y la laguna costera de Tacarigua (Herrera y Bone, 2011). Fisiográficamente, esta zona se asienta en las estribaciones finales de la cordillera de la Costa y se caracteriza por la presencia de numerosas ensenadas formadoras de playas. Los vientos predominantes son los alisios del norte (dirección NE-SO) y la temperatura media en el agua es de 26 °C (Solé y Vera, 1997; Crespo et al., 2020).
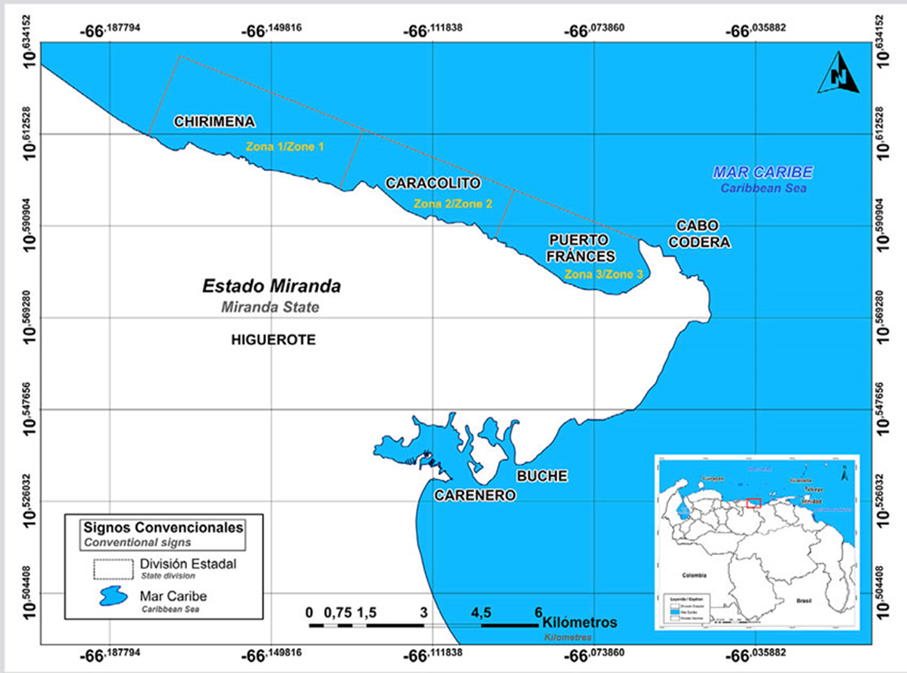
Figura 1 Ubicación de las zonas de muestreo en el área costera entre Chirimena y Puerto Francés, Venezuela
La región se caracteriza por un clima tropical con verano seco (As), de acuerdo con la clasificación climática de Köppen, con una temperatura media de 29 °C y precipitación anual de 1327 mm, con la precipitación mayor en noviembre (Crespo et al., 2020). En cuanto a las corrientes marinas, el área presenta un patrón diferencial debido al accidente topográfico de Cabo Codera, pero en general, el patrón de corrientes es en dirección oriente-occidente (Pereira et al., 2020).
Muestreo
Las muestras para cada uno de los tratamientos fueron recolectadas a partir de un diseño por conglomerado bietápico y polietápico con submuestras. El área de estudio fue dividida en tres zonas separadas entre sí por áreas extensas con fondos arenosos. La primera zona Chirimena (10° 36’ 42” N y 66° 10’ 37,15” W - 10° 36’ 01,3” N y 66° 08’ 08,3” W), la segunda Caracolito (10° 35’ 30,7” N y 66° 06’ 06,7” W), la cual limita con la primera zona, y Puerto Francés (10° 34’ 52” N y 66° 03’ 40,8” W) que limita con Caracolito (Figura 1).
Se realizaron muestreos mensuales desde junio 2014 hasta marzo 2015. Para la aleatorización de las estaciones de muestreo, se establecieron tres criterios; el primero fue la elaboración de una rejilla con cinco filas y cinco columnas en cada zona; cada celda contó con una dimensión de 50 m de largo en dirección hacia el mar y 870 m a lo largo de la costa. El segundo criterio fue el establecimiento de tres bloques horarios (mañana: 8:00-11:00, mediodía: 11:00-14:00 y tarde: 14:00-18:00) y el tercero, fue el tipo de fondo con los niveles: arenoso y rocoso. En cada zona, se seleccionaron cuatro muestras al azar y para toda el área de estudio, se incluyeron cuatro muestras en cada bloque horario.
Las muestras de microfitobentos se obtuvieron usando una cuadrata de 0,25 m2 dividida en 25 cuadros del mismo tamaño. Una vez en el punto de muestreo, se tomaron tres muestras aleatorias dentro de la misma, usando un muestreador cilíndrico de 5 cm de diámetro, el cual fue enterrado a 1 cm en el sustrato arenoso y por succión, se obtuvo la capa del sustrato y los organismos. En el caso del sustrato rocoso, se realizaron movimientos circulares con el nucleador para raspar la capa superficial que cubre la roca, rápidamente se tapó por ambos lados y se trasladó a la embarcación para su fijación con una solución de lugol y formalina neutralizada al 5 % v/v.
Se estimaron las variables: temperatura, salinidad (Método 2520 B, American Public Health Association 1998), pH (Método 4500-0 H, American Public Health Association, 1998), oxígeno disuelto (Método 4500-0 G, American Public Health Association, 1998) y los nutrientes: fosfatos, nitritos y nitratos (Strickland y Parsons, 1972). Los datos de precipitaciones fueron suministrados por la estación meteorológica de Petróleos de Venezuela S.A. en Carenero.
Análisis de las muestras en laboratorio
Se extrajeron 50 g de sedimento por muestra y se le agregó agua destilada para separar el microfitobentos por ultrasonido; luego se dejó sedimentar durante cuatro horas para separar las microalgas y cianobacterias de las partículas de sedimento. Una fracción de la muestra fue digerida con peróxido de hidrógeno al 33 % v/v a 90 °C, mientras que la otra fracción no pasó por este proceso para evitar la degradación de dinoflagelados, cianobacterias y otros grupos de microalgas, que fueron identificados y cuantificados en este estudio. La fracción digerida fue suspendida en agua de mar filtrada y formalina neutralizada al 5 % v/v. Las microalgas fueron identificadas hasta el nivel taxonómico menor posible y se estimaron sus abundancias por el método de Utermöhl (1958), a partir del análisis de 360 muestras de sedimento, mediante el uso de cámaras de sedimentación y un microscopio invertido Leica®. Las cianobacterias fueron contadas a partir de sus filamentos mientras que las formas eucariotas fueron contadas por células, independientemente si formaban colonias o filamentos. Los análisis de las variables físicas y químicas se realizaron siguiendo las metodologías estandarizadas establecidas en la literatura (Strickland y Parsons, 1972; American Public Health Association, 1998). La ubicación taxonómica se realizó con literatura especializada (Cupp, 1943; Peragallo y Peragallo, 1965; Ferguson, 1968; Saunders y Glenn, 1969; Sournia, 1986; Balech, 1988; Round et al., 1990; Chretiennot-Dinet et al., 1993; Moreno-Ruíz et al., 1996; Tomas, 1996, 1997; Yamaji, 1996; Berárd-Therriault et al., 1999; Witkowski et al., 2000; Siqueiros-Beltrones y Hernández-Almeida, 2006; Siqueiros-Beltrones y López-Fuerte, 2006; López-Fuerte et al., 2010; Siqueiros-Beltrones et al., 2014; Al-Yamani y Saburova, 2019) y los nombres de las especies fueron verificados en la página web de algaebase.org (Guiry y Guiry, 2021).
Análisis estadístico
Como parte de la caracterización de la comunidad, se realizaron pruebas de hipótesis con los datos de abundancia para cada especie a partir de un modelo bifactorial (mes y zona) sin interacciones, mediante análisis de similaridad (Anosim) con el fin de probar si existía la misma estructura comunitaria durante los 10 meses de muestreo, las tres zonas y los dos tipos de sustratos (Ho). Adicionalmente, se estimó el índice de diversidad de Shannon y la amplitud de nichos para aquellas especies que en su conjunto representaron 95 % de la abundancia (Ignatiades, 1994). En los casos donde se hallaron diferencias significativas con un error tipo I (α) = 0,05, se aplicaron las pruebas a posteriori de diferencias menos significativas (DMS). Se aplicó la prueba SIMPER con los datos de abundancia por especies para conocer el porcentaje de similaridad entre grupos de muestras (meses y zonas) y se aplicaron análisis de ordenación de escalamiento multidimensional no métrico (nMDS) para conocer la distribución de las muestras (Clarke et al., 2014). Para evaluar las relaciones entre las variables biológicas (abundancias de las especies) y abióticas determinadas en este estudio, se empleó el análisis multivariado Bioenv (Clarke et al., 2014). Los análisis estadísticos se realizaron en el programa PAST versión 4.03 (Hammer et al., 2001).
RESULTADOS
Características ambientales de la zona de estudio
Durante el periodo de muestreo, se obtuvo una temperatura media de 26,3 ± 1,5 °C, una mínima de 24 °C en julio y enero y una máxima de 28 °C en septiembre y noviembre. El oxígeno disuelto presentó una media de 6,56 ± 0,59 mg/L, con diferencias espaciales notables entre junio y octubre. La salinidad mostró una media de 37,64 ± 2,01 con valores superiores entre junio y agosto (39,3 ± 0,6) mientras que la más baja se obtuvo en noviembre con una media de 34,2 ± 3. El pH mostró una media de 8,1 ± 0,1 con un comportamiento muy similar en las tres zonas de muestreo (Tabla 1).
Tabla 1 Variables ambientales medidas en la zona marina entre Chirimena y Puerto Francés entre junio 2014 y marzo 2015.
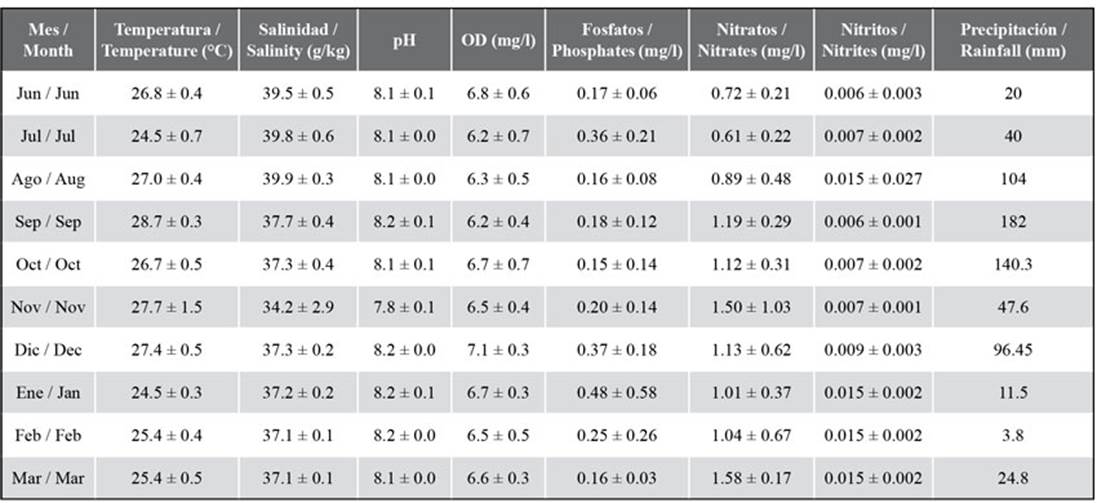
La concentración media de fosfatos fue de 0,25 ± 0,19 mg/L, notándose variaciones temporales similares en las tres zonas de muestreo. Las concentraciones menores se detectaron en junio, agosto, septiembre y marzo con 0,18 mg/L y las más altas en julio y diciembre (0,42 mg/L). La concentración media de nitritos fue de 0,009 ± 0,004 mg/L con diferencias espaciales no significativas. Temporalmente, se obtuvieron concentraciones constantes entre junio y diciembre (0,007 ± 0,001 mg/L), a partir del cual se duplicó la concentración (0,015 ± 0,002 mg/L) y se mantuvo constante hasta marzo. La concentración media de nitratos fue 1,08 ± 0,49 mg/L con máximos en agosto, noviembre y febrero (1,53 ± 0,18 mg/L). En cuanto a las precipitaciones, los valores más bajos se obtuvieron en junio, julio y a partir de enero hasta marzo con acumulados mensuales inferiores a 60 mm y las más altas en agosto, septiembre, octubre y diciembre, alcanzándose 182 mm en septiembre (Tabla 1).
Composición taxonómica y abundancia del microfitobentos
El microfitobentos estuvo constituido por 327 especies distribuidas en 241 diatomeas (74 % de las especies identificadas), 64 dinoflagelados, 11 cianobacterias, 7 euglenofitas, 3 clorofitas y 1 ocrofita (Tabla 1, Figura 2). Del grupo de las diatomeas, una tercera parte de las especies estuvo presente durante todo el periodo de estudio, siendo algunas de las más importantes desde el punto de vista de su abundancia: Nitzschia sp.1, Navicula pavillardi, Amphora angustissima, Thalassiosira aestivalis y varias especies del género Cocconeis. Las especies de dinoflagelados más frecuentes fueron: Prorocentrum norrisianum, Ostreopsis siamensis, Gyrodinium estuariale y Dinophysis acuminata, las cianobacterias: Merismopedia sp. y Trichodesmium thiebautii y las euglenofitas: Eutreptiella gymnastica, Notosolenus ostium y Petalomonas sp. Es importante destacar la presencia de especies generadoras de floraciones algales nocivas, tales como Dinophysis spp., Coolia monotis, Eutreptiella sp. y Ostreopsis spp. Los órdenes de magnitud de sus abundancias se muestran en el Anexo 1.
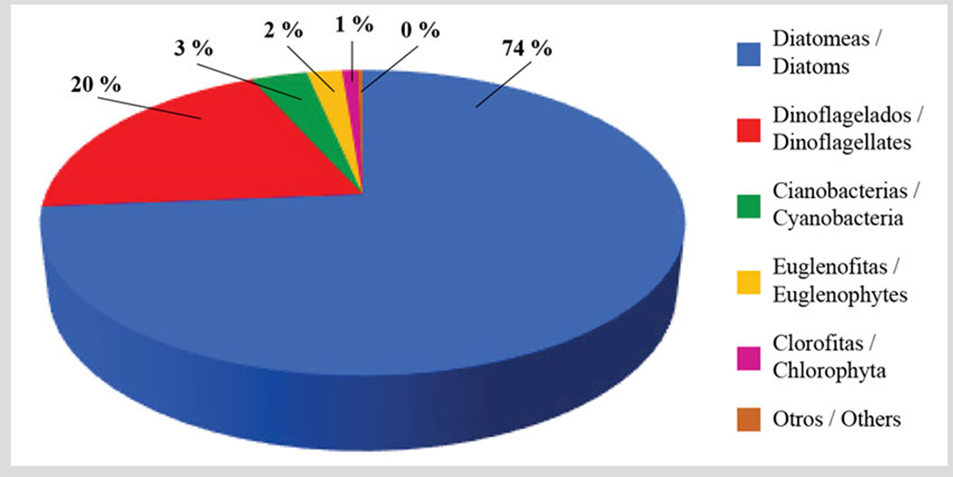
Figura 2 Riqueza porcentual de las especies de microlagas bentónicas de la zona costera entre Chirimena y Puerto Francés, Venezuela.
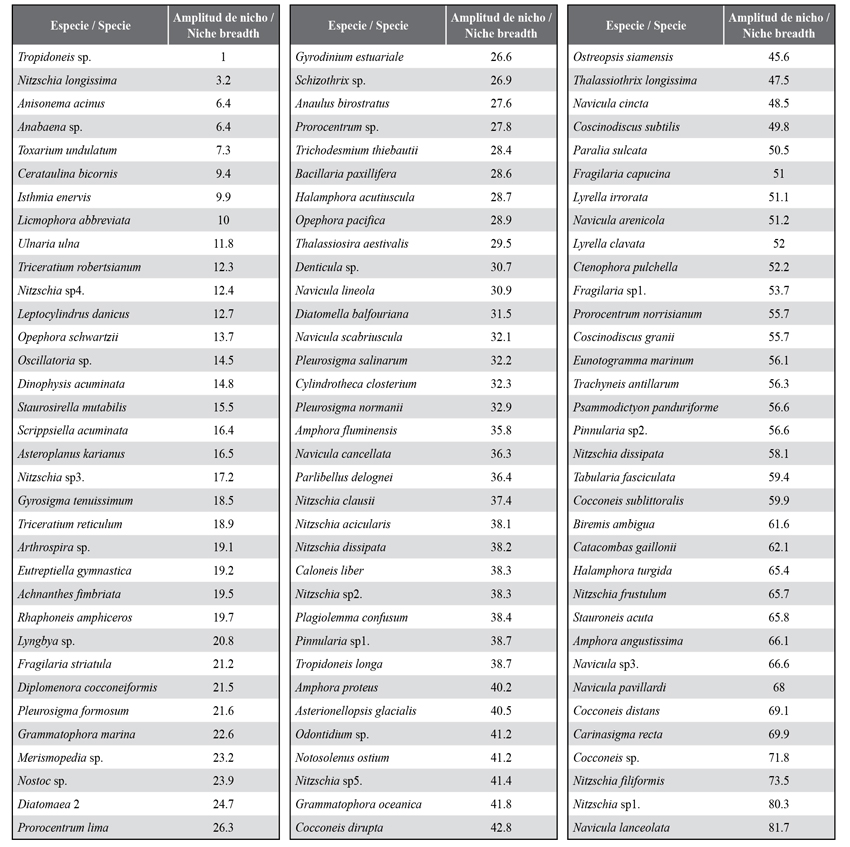
En general, se evidenció una variación mensual de la riqueza en dos bloques. El primero presentó una riqueza ligeramente más alta desde junio con 203 especies hasta octubre con 216 especies y comenzó a descender, manteniéndose una riqueza constante con una media de 196 especies entre enero y marzo (Figura 3). Esta variación se debe a las fluctuaciones en el grupo de las diatomeas y los dinoflagelados, ya que, a partir de octubre y noviembre cuando se evidenció una disminución importante de la salinidad, hubo un cambio en la composición de especies, tal como se identifica en el Anexo 1. El resto de los grupos presentaron variaciones escasas de la riqueza (Figura 3). El índice de amplitud de nicho para cada especie (Anexo 2), el cual, en este caso se encuentra en el intervalo entre 1 y 120 en función del número de estaciones y meses de muestreo, indica la presencia de 25 especies de las 104 incluidas en el análisis que muestran una amplitud de nicho estrecha (< 20), mientras que sólo 15, entre las que destacan las diatomeas más abundantes, presentan una amplitud de nicho mayor (> 60).
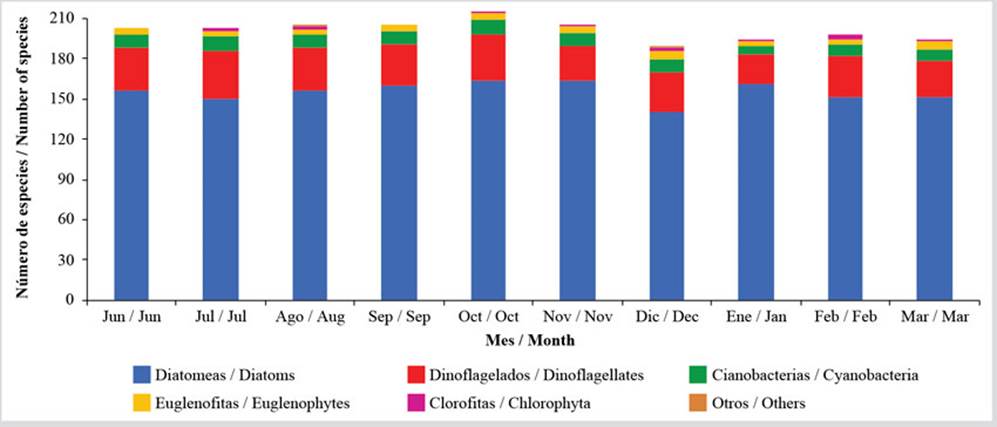
Figura 3 Variación temporal de la riqueza de las microalgas bentónicas de la zona costera entre Chirimena y Puerto Francés entre junio 2014 y marzo 2015.
En cuanto a las zonas establecidas, la 1 presentó una riqueza media de 240 especies sin diferencias considerables entre los sustratos rocosos y arenosos, la zona 2 presentó la más alta con variación mayor entre ambos sustratos, obteniéndose 252 especies en el sustrato arenoso y 237 en el rocoso, mientras que la 3 presentó una riqueza ligeramente más baja con una media de 232 especies. Con respecto a la abundancia, las más altas se obtuvieron en julio y agosto (inicio de la época de precipitaciones) con máximos cercanos a los 10 × 1010 células/m3. A partir de septiembre, se obtuvo una densidad media de 24,53 ± 3,84 × 109 células/m3, que indica una estabilidad en la abundancia del microfitobentos incluso en épocas de mayor inestabilidad de los sedimentos, en la que las abundancias registradas variaron más por el tipo de sustrato que por la zona.
Al hacer el análisis por grupos, se observó que, durante los meses evaluados, la abundancia relativa varió en mayor magnitud en las diatomeas y cianobacterias. Esto se debe al aumento de la densidad de cianobacterias en julio y agosto, en la que se alcanzan promedios de 27,56 × 109 células/m3 y 22,23 × 109 células/m3, respectivamente, los cuales representan unos incrementos importantes con relación al resto de los meses, los cuales exhiben una media de 4,85 ± 2,18 × 109 células/m3. En el caso de las diatomeas, las cuales representaron el grupo más abundante del microfitobentos con una representación de 79 %, se obtuvo una media de 21,42 ± 10,18 × 109 células/m3 con valores constantes en la mayoría de los meses, a excepción de agosto en la que se alcanzó una densidad media de 49,33 × 109 células/m3. El resto de los grupos manifestaron pocas variaciones, con abundancias medias de 7,33 ± 2,93 × 108 células/m3 en el caso de los dinoflagelados, 2,31 ± 1,22 × 108 células/m3 de euglenofitas y 4,81 ± 4,33 × 107 células/m3 de clorofitas (Figura 4).
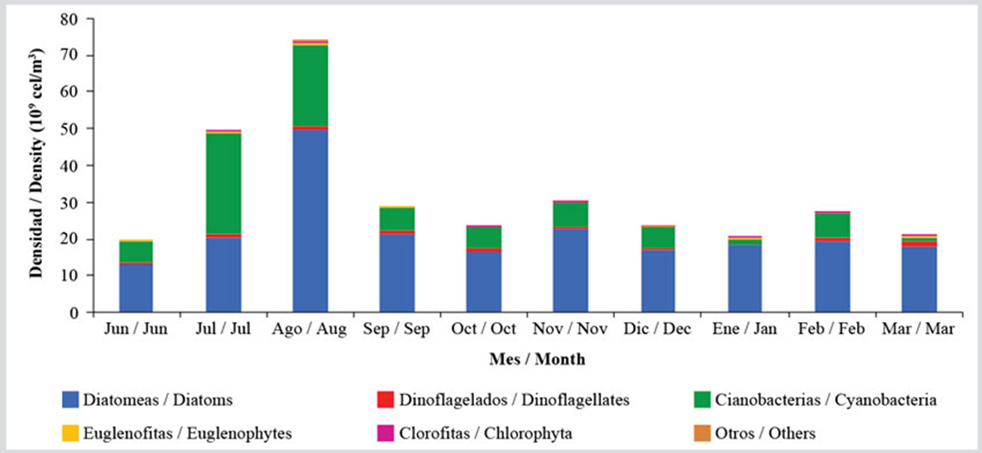
Figura 4 Variación temporal de la abundancia media de los grupos de microalgas bentónicas de la zona costera entre Chirimena y Puerto Francés entre junio 2014 y marzo 2015.
Por otra parte, el índice de diversidad biológica mostró valores superiores a 2,5 bits/cél, siendo menor en julio y agosto con valores cercanos a 2,8 bits/cél y superior entre septiembre y marzo con una media de 3,3 bits/cél. En el análisis de similaridad (Anosim), no se encontraron diferencias significativas entre las zonas (R = 0,13; P p= 0,006) pero si entre los meses (R = 0,677; P= 0,00001), de los cuales solo en junio, julio y marzo se diferenciaron de los otros meses. La prueba SIMPER indicó que las muestras presentaron similitudes entre 38,7 % en junio y 51,1 % en marzo con fluctuaciones entre los meses. Al comparar, se obtuvo que junio y julio presentaron una similaridad media con el resto de los meses de 35,9 y 37,3 %, respectivamente y entre el resto de los meses, se observaron similaridades un poco mayores que fluctuaron entre 40 y 47 %. Las especies que contribuyeron a estas variaciones en la comunidad fueron las cianobacterias: Merismopedia y Trichodesmium thiebautii y las diatomeas: Nitzschia sp1., Cocconeis sp., Amphora angustissima, Opephora pacifica, Thalassiothrix longissima y varias especies del género Navicula.
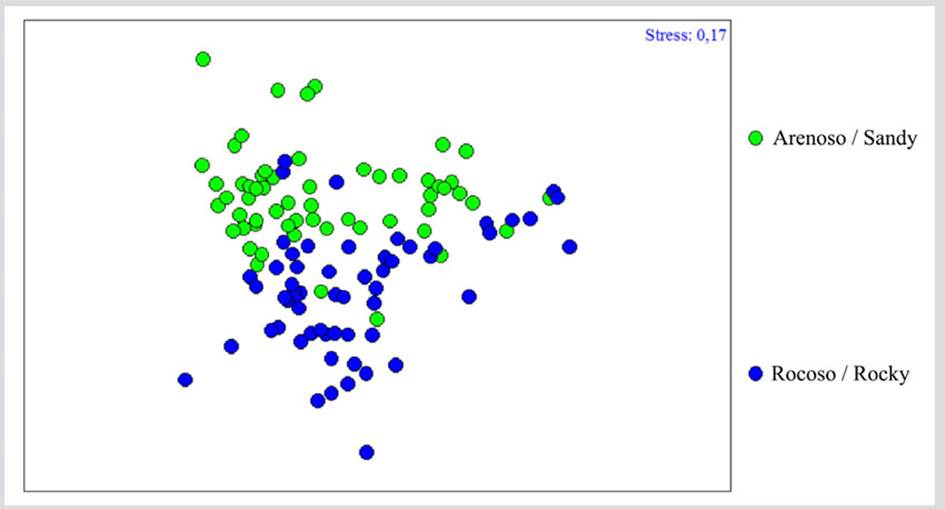
En cuanto a la diferenciación de la comunidad en función del tipo de sustrato, el ANOSIM mostró diferencias significativas (R = 0,263; P= 0,00001), que se evidencian en el análisis de ordenación de escalamiento multidimensional no métrico (nMDS), donde se puede observar una diferenciación clara entre ambos grupos que sugiere que la comunidad pudiera variar en función del tipo de sustrato (Figura 5). La prueba SIMPER indicó una similaridad entre las muestras del sustrato arenoso del 44,88 % en la que especies como Nitzschia sp1., Amphora angustata, Merismopedia spp., Cocconeis sp., Navicula pavillardii, Carinasigma recta, Thalassiosira aestivalis, Nitzschia frustulum, Stauroneis acuta y Cocconeis sublittoralis contribuyeron a 70 % de esta similaridad. En el caso del sustrato rocoso, se obtuvo una similaridad entre las muestras de 43 %, en la que además de las mismas especies mencionadas para el sustrato arenoso, contribuyeron Paralia sulcata, Thalassiothrix longissima, Navicula arenicola, Nostoc spp., Fragilaria capucina y Trichodesmium thiebautii.
DISCUSIÓN
La riqueza de diatomeas fue superior a la estimada en la isla de Caja de Muertos en Puerto Rico (Navarro et al., 1989), el Caribe mexicano (López-Fuerte et al., 2019), el Golfo de México (López-Fuerte et al., 2017) y Baja California Sur (Siqueiros-Beltrones et al., 2014). No obstante, se asemeja a la obtenida por Siqueiros-Beltrones et al. (2017) en aguas del Pacífico mexicano. De igual manera, se encontró dominancia de los géneros Amphora, Diplonesis, Cocconeis, Nitzschia y Navicula, tanto en términos de riqueza como de abundancia, lo cual parece ser una generalidad en la comunidad microfitobentónica (Navarro et al., 1989; Facca et al., 2002; Patil y Anil 2015; Al-Harbi, 2017; Siqueiros-Beltrones et al., 2017; López-Fuerte et al., 2017, 2019).
En cuanto a los dinoflaglados, los estudios relacionados con praderas de fanerógamas muestran una riqueza de 20 especies en el Caribe colombiano y venezolano (Valerio y Díaz-Ramos, 2007, 2008; Rodríguez et al., 2010; Quintana y Mercado-Gómez, 2014; Arbeláez et al., 2017) en la que solo las especies Cabra aremorica, Coolia malayensis, Gambierdiscus caribaeus, Prorocentrum belizeanum, P. concavum, P. emarginatum y Sinophysis microcephala no se encontraron en este estudio. En cuanto a otros sustratos, la riqueza fue superior a la encontrada en un arrecife del Caribe mexicano (Almazan-Becerril et al., 2012) y en varios sustratos en la región oriental de Venezuela (Navarro-Vargas et al., 2014; Marchan-Álvarez et al., 2017) pero cercana a la obtenida en una playa arenosa en Francia (Gómez y Artigas, 2014). No obstante, las especies de dinoflagelados bentónicos identificadas en otros trabajos en las costas de Venezuela fueron halladas en este estudio (Valerio y Díaz-Ramos, 2007, 2008; Navarro-Vargas et al., 2014; Marchan-Álvarez et al., 2017).
En líneas generales, el número de especies identificadas en esta investigación indica una complejidad alta de la estructura comunitaria, en las que algunos grupos funcionales están representados por muchas especies, lo cual facilita que la energía se transfiera a través de las vías tróficas. En consecuencia, se tienen interacciones más complejas que tienden a aumentar la estabilidad de la red trófica y, por ende, la capacidad de resiliencia (Sokolowski et al., 2012). De hecho, se conoce la existencia de redes competitivas complejas en el microfitobentos y que la heterogeneidad de hábitats y los micronichos pueden explicar la diversidad en esta comunidad (de Jong y Admiraal, 1984).
Con relación a la abundancia, la variabilidad temporal se mantuvo homogénea, con valores máximos entre julio y agosto por aumentos de las cianobacterias y diatomeas respectivamente, alcanzándose una densidad máxima en el orden de 105 células/cm3. Estos valores están en el límite inferior indicado por MacIntyre et al. (1996) y Schmidt et al. (1998), quienes consideran abundancias medias entre 105 células/cm3 y 107 células/cm3 en los primeros 10 mm de los sedimentos, llegando a alcanzar en algunos casos 109células/cm3, basados en estudios realizados en EE.UU., Noruega, Países Bajos, España y Dinamarca. Sin embargo, Round (1971) distingue densidades entre 103 y 104células/cm3 y Cibic et al. (2007) cuantificaron abundancias entre 104 y 105células/cm3 en el golfo Trieste, al noreste del mar Adriático, las cuales son similares a las encontradas en este estudio.
Al comparar con otros estudios, se obtuvieron densidades 100 veces menor a la encontrada en la laguna de Venecia en Italia (Facca et al., 2002) y en un humedal salino dominado por cianobacterias en Río de Janeiro (Masuda y Enrich-Prast, 2016). En el caso del mar Caribe, no se pueden hacer comparaciones con otros estudios debido a que los pocos que han calculado la densidad la han relacionado con la biomasa de macroalgas o fanerógamas marinas debido a que ellas proporcionan heterogeneidad de espacio para el asentamiento y colonización de epífitas, aumentando la probabilidad de que haya mayor riqueza y abundancia de microalgas. Sin embargo, se puede comparar con la densidad de dinoflagelados obtenida por Marchan-Álvarez et al. (2017), quienes obtuvieron valores 20 veces menores.
Es importante considerar que este muestreo incluye núcleos con una profundidad de 1 cm, lo cual pudiera afectar cuantiosamente las estimaciones, al considerar que la zona fótica de los sedimentos está por el orden de 2 mm. Aunque, en los sedimentos arenosos, las microalgas pueden alcanzar 16 cm de profundidad, pero con una disminución importante de su densidad a partir de los primeros 5 mm (Joint, 1978).
En cuanto a la relación de esta comunidad con las condiciones ambientales, las tendencias climáticas a nivel global y regional incluyen cambios de temperatura, nivel del mar, amplitud de la marea, precipitaciones, aportes de los ríos, turbidez y frecuencia e intensidad de tormentas, los cuales son factores con efectos potenciales sobre la biomasa y la producción primaria microfitobentónica a largo plazo (van der Wal et al., 2010). A pesar de esto, muchos estudios evidencian la importancia de factores a nivel local, sugiriendo que la composición taxonómica del microfitobentos es el resultado de una interacción compleja de factores tanto biológicos como ambientales; que incluyen la luz, salinidad, nutrientes, herbivoría y tipo de sedimento (Van der Grinten et al., 2004; Jesus et al., 2006).
En la costa central de Venezuela, la temperatura suele ser estable y los nutrientes están disponibles durante todo el año, por lo que la inestabilidad del sedimento en época de surgencia y la disminución de la penetración de la luz por la carga sedimentaria de los ríos en época de lluvias pueden ser los factores más importantes en la distribución y abundancia de estos organismos. Se ha demostrado que, en los arrecifes de coral, la temperatura puede determinar hasta 70 % de la variabilidad de las poblaciones microfitobentónicas (Blackford, 2002). Los géneros Nitzschia, Gyrosigma, Navicula y Amphora, los cuales se encuentran ampliamente distribuidos en las zonas costeras de todo el mundo, incluyendo esta, se asocian a temperaturas altas (Cibic et al., 2009). También se ha observado que mientras la abundancia de la mayoría de los géneros de diatomeas aumenta con la temperatura, los géneros Pinnularia y Diploneis prefieren temperaturas bajas (Cibic et al., 2007). Sin embargo, en ambientes tropicales en los que las temperaturas tienen variaciones que no superan 5 ºC, dificulta ver este tipo de relaciones entre las especies y variables ambientales específicas, lo cual pudiera explicar la relación escasa que se obtuvo entre la composición y distribución de la comunidad con las variables ambientales estimadas.
Con respecto a la salinidad, su efecto depende de la capacidad de adaptación de cada una de las especies, lo cual varía incluso entre las del mismo género (Cibic et al., 2012). Diversos estudios taxonómicos han demostrado composiciones de especies muy diversas con variaciones temporales en el dominio de especies, lo que indica una competencia intensa en esas comunidades, que favorecen a algunas especies (Admiraal, 1984). En el caso particular de las regiones tropicales, las relaciones de los componentes del microfitobentos con las variables ambientales han sido escasamente estudiadas, por lo que se requiere mayor investigación. En un estudio realizado en la zona intermareal de un estuario en Corea se observó que los géneros Amphora y Navicula eran más abundantes cuando la salinidad disminuía, lo cual coincide con lo hallado en este estudio (Du et al., 2009).
En cuanto al tipo de sedimento, los componentes de la comunidad microfitobentónica suelen variar considerablemente. Por ejemplo, en sedimentos arenosos, donde existe un estrés hidrodinámico alto, las microalgas suelen unirse firmemente a las partículas del sedimento y resistir la abrasión, dominando diatomeas episámmicas monorrafídeas, tales como Cocconeisspp. y Achnanthes spp., así como cianobacterias del género Merismopedia (Paterson y Hagerthey, 2001). De igual manera, los sustratos rocosos suelen exhibir una diversidad alta por la complejidad que les confiere la estructura basal y los propios organismos que colonizan este sustrato, aunque se requiere la ejecución de más investigaciones al respecto (Fuji et al., 1991; Maggi et al., 2017). No obstante, Siqueiros-Beltrones et al. (2014) encontraron diferencias significativas en la estructura comunitaria de estos sustratos, similares a las encontradas en este estudio.
Finalmente, en este trabajo se indican nuevos registros de especies de microalgas para Venezuela, que tributan al conocimiento de la diversidad biológica de la región. Aunque presentaron pocas variaciones estacionales de su densidad, mostraron un recambio significativo de especies cuando iniciaron las precipitaciones, por lo que factores ambientales como la luz, concentración de material en suspensión, salinidad y estabilidad de los sedimentos pudieran incidir sobre esta comunidad. No obstante, se evidenció una interacción compleja entre las variables que inciden sobre la estructura comunitaria del microfitobentos y el resto de los productores primarios, la cual debe ser estudiada con mayor detenimiento.
AGRADECIMIENTOS
Este estudio fue financiado por Petróleos de Venezuela, S.A. Los análisis de laboratorio fueron realizados en los laboratorios de Ecología de Sistemas Acuáticos del Instituto de Zoología y Ecología Tropical de la Universidad Central de Venezuela y los de Ecotoxicología y Química Ambiental de PDVSA Intevep.
REFERENCIAS
Admiraal, W. 1984. The ecology of estuarine sediment inhabiting diatoms. Phycol. Res., 3: 269. [ Links ]
Aguilar, A., Y. Okolodkov, F. Merino, I. Osorio y J. Herrera. 2014. Variación espacial de dinoflagelados bentónicos/epifíticos en aguas costeras del norte de Yucatán (agosto de 2011). 147-160. En: Botello, A., J. von Osten, J. Benítez y G. Gold (Eds.). Golfo de México. Contaminación e impacto ambiental: diagnóstico y tendencias. UAC, UNAM-ICMYL, CINVESTAV, Mérida. 1174 p. https://www.researchgate.net/publication/270453899_Variacion_espacial_de_dinoflagelados_bentonicosepifiticos_en_aguas_costeras_del_norte_de_Yucatan_agosto_de_2011 [ Links ]
Al-Harbi, S. 2017. Epiphytic microalgal dynamics and species composition on brown seaweeds (Phaeophyceae) on the northern coast of Jeddah, Saudi Arabia. J. Oceanogr. Mar. Sci., 5(1): 1-9. https://www.doi.org/10.4172/2572-3103.1000153 [ Links ]
Almazán-Becerril, A., G. Rosiles-González, S. Escobar-Morales, M. Rodríguez-Palacios y D. Hernández-Becerril. 2012. Dinoflagelados bentónicos del arrecife mesoamericano: Caribe mexicano. Centro de Investigación Científica de Yucatán. México D.F. https://doi.org/10.15468/zkdrko [ Links ]
Al-Yamani, F. and M. Saburova. 2019. Marine phytoplankton atlas of Kuwait’s waters. Institute for Scientific Research, Kuwait. 336 p. [ Links ]
American Public Health Association. 1998. Standard methods for the examination of water and wastewater. American Public Health Association, American Water Works Association and Water Environmental Federation, Washington. 1220 p. [ Links ]
Arbeláez, N., J. Mancera y B. Reguera. 2017. Dinoflagelados epífitos de Thalassia testudinum en dos sistemas costeros del Caribe colombiano. Bol. Invest. Mar. Cost., 46(2): 9-40. https://doi.org/10.25268/bimc.invemar.2017.46.2.725 [ Links ]
Balech, E. 1988. Los dinoflagelados del Atlántico sudoccidental. Instituto Español de Oceanografía, Madrid. 310 p. [ Links ]
Berárd-Therriault, L., M. Poulin and L. Bossé. 1999. Guide d´identification du phytoplancton marin de l´estuaire et du Golfe de Saint-Laurent. Incluant également certains protozoaries. Conseil National de Recherches du Canada, Ottawa. 388 p. [ Links ]
Blackford, J. 2002. The influence of microphytobenthos on the northern Adriatic ecosystem: a modelling study. Estuar. Coast. Shelf Sci., 55: 109-123. https://doi.org/10.1006/ecss.2001.0890 [ Links ]
Blanchard, G., J. Guarini, F. Orvain and P. Sauriau. 2001. Dynamic behavior of benthic microalgal biomass in intertidal mudflats. J. Exp. Mar. Biol. Ecol., 264: 85-100. https://doi.org/10.1016/S0022-0981(01)00312-4 [ Links ]
Chretiennot-Dinet, M., A. Sournia, M. Ricard and C. Billard. 1993. A classification of the marine phytoplankton of the world from class to genus. Phycology, 32(3): 159-179. https://doi.org/10.2216/i0031-8884-32-3-159.1 [ Links ]
Cibic, T., O. Blasutto, C. Falconi and S. Umani. 2007. Microphytobenthic biomass, species composition and nutrient availability in sublittoral sediments of the Gulf of Trieste (northern Adriatic Sea). Estuar. Coast. Shelf Sci., 75: 50-62. https://doi.org/10.1016/j.ecss.2007.01.020 [ Links ]
Cibic, T., O. Blasutto and N. Bettoso. 2009. Microalgal-meiofaunal interactions in a sublittoral site of the Gulf of Trieste (northern Adriatic Sea, Italy): A three-year study. J. Exp. Mar. Biol. Ecol., 370: 144-154. https://doi.org/10.1016/j.jembe.2008.12.006 [ Links ]
Cibic, T., C. Comici, A. Bussani and P. Del Negro. 2012. Benthic diatom response to changing environmental conditions. Estuar. Coast. Shelf Sci., 115: 158-169. https://doi.org/10.1016/j.ecss.2012.03.033 [ Links ]
Clarke, K., R. Gorley, P. Somerfield and R. Warwick. 2014. Change in marine communities: An approach to statistical analysis and interpretation. PRIMER-E: Plymouth Marine Laboratory, Plymouth. 255 p. http://www.vliz.be/imisdocs/publications/ocrd/213560.pdf [ Links ]
Crespo, M., C. Pereira, E. Zoppi De Roa, J. Scott-Frías, E. Montiel y V. Hernández. 2020. Composición y abundancia del zooplancton marino y costero del estado Miranda, Venezuela. Bol. Inst. Oceanogr. Venez., 59(01): 69-84. http://www.iov-udo.com/revista/index.php/boletin57-1/login?source=%2Frevista%2Findex.php%2Fboletin57-1%2Fissue%2Farchive [ Links ]
Cupp, E. 1943. Marine plankton diatoms of the west coast of North America. Bull. Scripps Inst. Oceanogr. Tech. Ser., 15: 1-238. https://escholarship.org/content/qt922945w8/qt922945w8_noSplash_253fe42125d7c12405eeab0205b7ec7b.pdf [ Links ]
Dalu, T., J. Adams, J. Taylor, G. Bate, M. Nunes, P. Froneman and R. Wasserman. 2018. Overview and status of estuarine microphytobenthos ecological research in South Africa. Afr. J. Mar. Sci., 40(1): 1-12. https://doi.org/10.2989/1814232X.2018.1431309 [ Links ]
De Jong, L. and W. Admiraal. 1984. Competition between three estuarine benthic diatom species in mixed cultures. Mar. Ecol., 18: 269-275. https://doi.org/10.3354/meps018269 [ Links ]
Delgado, G., C. Lechuga-Devéze, L. Troccoli and C. Salinas. 2006. Epiphytic dinoflagellates associated with ciguatera in the northwestern coast of Cuba. Rev. Biol. Trop., 54(2): 299-310. https://doi.org/10.15517/rbt.v54i2.13870 [ Links ]
Du, G., M. Son, M. Yun, S. An and I. Chung. 2009. Microphytobenthic biomass and species composition in intertidal flats of the Nakdong River estuary, Korea. Estuar. Coast. Shelf Sci., 82: 663-672. https://doi.org/10.1016/j.ecss.2009.03.004 [ Links ]
Facca, C., A. Sfriso and G. Socal. 2002. Changes in abundance and composition of phytoplankton and microphytobenthos due to increased sediment fluxes in the Venice Lagoon, Italy. Estuar. Coast. Shelf Sci., 54: 773-792. https://doi.org/10.1006/ecss.2001.0848 [ Links ]
Ferguson, J. 1968. Dinoflagellates of the Caribbean Sea and adjacent areas. University of Miami, Florida. 142 p. [ Links ]
Fuji, A., H. Watanabe, K. Ogura, T. Noda and S. Goshima. 1991. Abundance and productivity of microphytobenthos on a rocky shore in southern Hokkaido. Bull. Fish. Sci. Hokkaido Univ., 42(4): 136-146. https://eprints.lib.hokudai.ac.jp/dspace/bitstream/2115/24085/1/42%284%29_P136-146.pdf [ Links ]
Gómez, F. and L. Artigas. 2014. High diversity of dinoflagellates in the intertidal sandy sediments of Wimereux (north-east English Channel, France). J. Mar. Biolog. Assoc. U.K., 94(3): 443-457. https://doi.org/10.1017/S0025315413001744 [ Links ]
Guiry, M. and G. Guiry. 2021. AlgaeBase. http://www.algaebase.org [23/02/2021]. [ Links ]
Hammer, O., D, Harper and P. Ryan. 2001. PAST: Paleontological statistics software package for education and data analysis. Palaeontol. Electron., 4(1): 1-9. https://palaeo-electronica.org/2001_1/past/past.pdf [ Links ]
Hernández, O., J. Herrera y F. Merino. 2013. Nueve nuevos registros de diatomeas bentónicas de los géneros Climaconeis, Cocconeis, Licmophora, Talaroneis, Oestrupia, Petroneis y Synedrosphenia en la costa norte de la península de Yucatán, México. Hidrobiol., 23(2): 154-168. http://www.scielo.org.mx/pdf/hbio/v23n2/v23n2a4.pdf [ Links ]
Herrera, A. and D. Bone. 2011. Influence of riverine outputs on sandy beaches of Higuerote, central coast of Venezuela. Lat. Am. J. Aquat. Res., 39(1): 56-70. https://scielo.conicyt.cl/pdf/lajar/v39n1/art06.pdf [ Links ]
Hoppenrath, M., S. Murray, N. Chomérat and T. Horiguchi. 2014. Marine benthic dinoflagellates - unveiling their worldwide biodiversity. Kleine Senckenberg-Reihe, 54: 1-266. https://doi.org/10.1111/pre.12076 [ Links ]
Ignatiades, L. 1994. Species dominance and niche breadth in “bloom” and “non-bloom” phytoplankton populations. Oceanol. Acta, 17(1): 89-96. https://archimer.ifremer.fr/doc/00099/21022/18648.pdf [ Links ]
Jesus, B., C. Mendes, V. Brotas and D. Paterson. 2006. Effect of sediment type on microphytobenthos vertical distribution: Modeling the productive biomass and improving ground truth measurements. J. Exp. Mar. Biol. Ecol., 332 (1): 60-74. https://doi.org/10.1016/j.jembe.2005.11.005 [ Links ]
Joint, I. 1978. Microbial production of an estuarine mudflat. Estuar. Coast. Mar. Sci., 7: 185-195. https://doi.org/10.1016/0302-3524(78)90074-9 [ Links ]
Kang, C., J. Kim, K. Lee, J. Kim, P. Lee and J. Hong. 2003. Trophic importance of benthic microalgae to macrozoobenthos in coastal bay systems in Korea: dual stable C and N isotope analyses. Mar. Ecol. Prog. Ser., 259: 79-92. https://doi.org/10.3354/meps259079 [ Links ]
Launeau, P., V. Méléder, C. Verpoorter, L. Barillé, F. Kazemipour-Ricci, M. Giraud, B. Jesus and E. Le Menn. 2018. Microphytobenthos biomass and diversity mapping at different spatial scales with a hyperspectral optical model. Remote Sens., 10(5): 1-29. https://doi.org/10.3390/rs10050716 [ Links ]
López-Fuerte, F., D. Siqueiros-Beltrones, L. Veleva and D. Huerta-Quintanilla. 2017. Species composition and assemblage structure of microfouling diatoms growing on fiberglass plates off the coast of Yucatán, Mexico. Hidrobiol., 27(1): 23-37. https://www.redalyc.org/articulo.oa?id=57853140003 [ Links ]
López-Fuerte, F., D. Siqueiros-Beltrones and L. Veleva. 2019. Diatoms (Bacillariophyta) from artificial substrates and sediments in the Caribbean Sea off Yucatan, Mexico. Phytotaxa, 406(1): 1-54. https://doi.org/10.11646/phytotaxa.406.1.1 [ Links ]
Loza, S., M. Sánchez, M. Carmenate y D. Siqueiros. 2011. Adición a la microflora de diatomeas de las aguas marinas de Cuba. Ser. Oceanol., 8: 47-52. https://aquadocs.org/bitstream/handle/1834/4058/articulo86.pdf?sequence=1 [ Links ]
MacIntyre, H., R. Geider and D. Miller. 1996. Microphytobenthos: the ecological role of the “Secret Garden” of unvegetated, shallow-water marine habitats. I. Distribution, abundance and primary production. Estuaries, 19(2A): 186-201. https://doi.org/10.2307/1352224 [ Links ]
Madigan, M., J. Martinko y J. Parker. 1999. Eukaryota: micro-organismos eucarióticos. 770-774. En: Madigan, M., J. Martinko y J. Parker (Eds.). Brock, Biología de los microorganismos. Prentice Hall, Madrid. 1200 p. [ Links ]
Maggi, E., L. Rindi, M. Dal Bello, D. Fontanini, A. Capocchi, L. Bongiorni and L. Benedetti-Cecchi. 2017. Spatio-temporal variability in Mediterranean rocky shore microphytobenthos. Mar. Ecol. Prog. Ser., 575: 17-29. https://doi.org/10.3354/meps12216 [ Links ]
Marchan-Álvarez, J., L. Valerio-González, L. Troccoli-Ghinaglia y F. López. 2017. Dinoflagelados bentónicos nocivos, asociados con el sedimento arenoso en dos playas de la isla de Margarita, Venezuela. Rev. Biodivers. Neotrop., 7(3): 156-168. https://doi.org/10.18636/BIONEOTROPICAL.V7I3.539 [ Links ]
Masuda, L. and A. Enrich-Prast. 2016. Benthic microalgae community response to flooding in a tropical salt flat. Braz. J. Biol., 76(3): 577-582. http://dx.doi.org/10.1590/1519-6984.18314 [ Links ]
Moreno-Ruíz, J., S. Licea y H. Santoyo. 1996. Diatomeas del golfo de California. Universidad Autónoma de Baja California Sur. La Paz, México. 272 p. [ Links ]
Navarro, J., C. Pérez, N. Arce and B. Arroyo. 1989. Benthic marine diatoms of Caja de Muertos Island, Puerto Rico. Nova Hedwigia, 49: 333-367. [ Links ]
Navarro-Vargas, G., J. Díaz-Ramos, L. Troccoli y S. Subero. 2014. Dinoflagelados epibentónicos presentes en diferentes sustratos en la bahía Turpialito, Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 53(2): 161-170. http://www.iov-udo.com/revista/index.php/boletin57-1/login?source=%2Frevista%2Findex.php%2Fboletin57-1%2Fissue%2Farchive [ Links ]
Paterson, D. and S. Hagerthey. 2001. Microphytobenthos in contrasting coastal ecosystems: biology and dynamics. 106-125. En: Reise, K. (Ed). Ecological comparisons of sedimentary shores. Ecological studies. Springer-Verlag, Berlin. 387 p. [ Links ]
Patil, J. and A. Anil. 2005. Biofilm diatom community structure: influence of temporal and substratum variability. Biofouling, 21: 189-206. https://doi.org/10.1080/08927010500256757 [ Links ]
Peragallo, H. and M. Peragallo. 1965. Diatomées marines du France et des districts maritimes voisins. A Asher Co., Amsterdam. 539 p. [ Links ]
Pereira, C., A. Fernández, L. Troccoli y V. Hernández. 2000. Ocurrencia de floraciones nocivas de microalgas en las costas del estado Miranda, Venezuela. Cienc. Amb. Clima, 3(1):55-71. https://doi.org/10.22206/cac.2020.v3i1.pp55-71 [ Links ]
Pinckney, J. and R. Zingmark. 1993. Modeling the annual production of intertidal benthic microalgae in estuarine ecosystems. J. Phycol., 29: 396-407. https://doi.org/10.1111/j.1529-8817.1993.tb00140.x [ Links ]
Quintana, H. y J. Mercado-Gómez. 2017. Composición de dinoflagelados epífitos y forófitos en la costa norte del golfo de Morrosquillo, Sucre, Colombia. Rev. Col. Cienc. Anim., 9(2):129-140. https://doi.org/10.24188/recia.v9.n2.2017.550 [ Links ]
Rodriguez, E., J. Mancera and B. Gavio. 2010. Survey of benthic dinoflagellates associated to beds of Thalassia testudinum in San Andrés Island, Seaflower Biosphere Reserve, Caribbean Colombia. Acta Biol. Colomb., 15(2): 229-245. https://revistas.unal.edu.co/index.php/actabiol/article/view/9781 [ Links ]
Round, F. 1971. Benthic marine diatoms. Oceanogr. Mar. Biol., 9: 83-139. [ Links ]
Round, F., R. Crawford and D. Mann. 1990. The diatoms, biology and morphology of the genera. Cambridge University Press, Cambridge. 747 p. [ Links ]
Saunders, R. and D. Glenn. 1969. Diatoms. Memoirs of the Hourglass Cruises. Vol X. Florida Department of Natural Resources Marine Research Laboratory, St. Petersburg. 119 p. [ Links ]
Schmidt, J., J. Deming, P. Jumars and R. Keil. 1998. Constancy of bacterial abundance in surficial marine sediments. Limnol. Oceanogr., 43: 976-982. https://doi.org/10.4319/lo.1998.43.5.0976 [ Links ]
Siqueiros-Beltrones, D. y O. Hernández-Almeida. 2006. Florística de diatomeas epifitas en macroalgas de un manchón subtropical. Oceánides, 21(1): 11-61. https://doi.org/10.37543/oceanides.v21i1-2.25 [ Links ]
Siqueiros-Beltrones, D. and F. López-Fuerte. 2006. Benthic diatoms associated to red mangrove (Rhizophora mangle L.) prop roots in Bahia Magdalena, B.C.S, México. Biol. Trop., 54(1): 287-297. https://www.scielo.sa.cr/pdf/rbt/v54n2/3820.pdf [ Links ]
Siqueiros-Beltrones, D., U. Argumedo-Hernández, J. Murillo-Jiménez y A. Marmolejo-Rodríguez. 2014. Diversidad de diatomeas bentónicas marinas en un ambiente ligeramente enriquecido con elementos potencialmente tóxicos. Rev. Mex. Biodivers., 85: 1065-1085. https://doi.org/10.7550/rmb.43748 [ Links ]
Siqueiros-Beltrones, D., U. Argumedo-Hernández y F. López-Fuerte. 2017. Diversidad de especies de diatomeas bentónicas en la laguna Guerrero Negro (Reserva de la Biosfera El Vizcaíno), península de Baja California, México. Rev. Mex. Biodivers., 88: 21-35. https://doi.org/10.1016/j.rmb.2017.01.026 [ Links ]
Sokolowski, A., M. Wolowicz, H. Asmus, R. Asmus, A. Carlier, Z. Gasiunaité, A. Grémare, H. Hummel, J. Lesutiené, A. Razinkovas, P. Renaud, P. Richard and M. Kedra. 2012. Is benthic food web structure related to diversity of marine macrobenthic communities? Estuar. Coast. Shelf Sci., 108: 76-86. https://doi.org/10.1016/j.ecss.2011.11.011 [ Links ]
Solé, M. y B. Vera. 1997. Caracterización de las macroalgas marinas bénticas en la región Chirimena-Punta Caimán, Edo. Miranda, Venezuela. Caribb. J. Sci., 33(3-4): 180-190. [ Links ]
Sournia, A. 1986. Atlas du phytoplancton marin. Vol 1. Centre National de la Recherche Scientifique, Paris. 261 p. [ Links ]
Spilmont, N., L. Seuront, T. Meziane and D. Welsh. 2011. There’s more to the picture than meets the eye: Sampling microphytobenthos in a heterogeneous environment. Estuar. Coast. Shelf Sci., 95: 470-476. https://doi.org/10.1016/j.ecss.2011.10.021 [ Links ]
Stal, L. 2010. Microphytobenthos as a biogeomorphological force in intertidal sediment stabilization. Ecol. Eng., 36: 236-245. https://doi.org/10.1016/j.ecoleng.2008.12.032 [ Links ]
Strickland, J. and T. Parsons. 1972. A practical handbook of seawater analysis. J. Fish. Res. Board Can., 167: 1-310. https://epic.awi.de/id/eprint/39262/1/Strickland-Parsons_1972.pdf [ Links ]
Tomas, C. 1996. Identifying marine diatoms and dinoflagellates. Academic Press, New York. 598 p. [ Links ]
Tomas, C. 1997. Identifying marine phytoplankton. Academic Press, New York. 874 p. [ Links ]
Utermöhl, H. 1958. Zur vervollkommnung der quantitativen Phytoplankton Methodik. Mitt. Verein. Theor. Argiew. Limnol. 9: 1-38. https://doi.org/10.1080/05384680.1958.11904091 [ Links ]
Valerio, L. y J. Díaz-Ramos. 2007. Dinoflagelados epifitos potencialmente tóxicos presentes en praderas de Thalassia testudinum en las costas nororientales de Venezuela. Rev. Fac. Agron. LUZ, 24(1): 39-43. https://produccioncientificaluz.org/index.php/agronomia/article/view/26682 [ Links ]
Valerio, L. y J. Díaz-Ramos. 2008. Distribución de dinoflagelados epifitos potencialmente tóxicos asociados a praderas de Thalassia testudinum en la isla La Tortuga, la bahía de Mochima y golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 47(1): 47-58. [ Links ]
Van der Grinten, E., S. Simis, C. Barranguet and W. Admiraal. 2004. Dominance of diatoms over cyanobacterial species in nitrogen-limited biofilms. Archivfür Hydrobiologie 161(1): 98-111. https://doi.org/10.1127/0003-9136/2004/0161-0099 [ Links ]
Van der Wal, D., A. Wielemaker-van den Dool and P. Herman. 2010. Spatial synchrony in intertidal benthic algal biomass in temperate coastal and estuarine ecosystems. Ecosystems, 13: 338-351. https://doi.org/10.1007/s10021-010-9322-9 [ Links ]
Witkowski, A., H. Lange-Bertalot and D. Metzeltin. 2000. Diatom flora of marine coasts I. In Iconographia Diatomologica, Vol. 7, H. Lange-Bertalot (Ed.). A.R.G. Gantner Verlag K. G. Ruggell, Germany. 925 p. [ Links ]
Yamaji, I. 1996. Illustration of the marine plankton of Japan. Hoikusha Publishers. Osaka, Japan. 369 p. [ Links ]
ANEXO 1
Anexo 1 Lista de especies de microalgas y cianobacterias del microfitobentos de la zona costera entre Chirimena y Puerto Francés entre junio 2014 y marzo 2015. (S): especies presentes sólo en época de sequía, (P): especies presentes sólo en época de lluvias, (10x): indica la magnitud de la abundancia promedio en células/m3.

Recibido: 08 de Mayo de 2021; Aprobado: 17 de Febrero de 2022











 texto em
texto em