Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.2 Santa Marta jul./dez. 2022 Epub 14-Dez-2012
https://doi.org/10.25268/bimc.invemar.2022.51.2.1171
ARTICULO DE INVESTIGACIÓN
Las esponjas en el Perú y su potencial como fuente de compuestos antibacterianos
1Universidad Científica del Sur, Facultad de Ciencias Veterinarias y Biológicas, Carrera de Biología Marina, Antigua Panamericana Sur Km. 19, Villa El Salvador, Lima, Perú. bcondor@cientifica.edu.pe
2Universidad Científica del Sur, Facultad de Ciencias Veterinarias y Biológicas, Carrera de Biología Marina, Antigua Panamericana Sur Km. 19, Villa El Salvador, Lima, Perú. jfrancia@cientifica.edu.pe
In the last decades, sponges have emerged as the largest source of active compounds of animal origin for pharmaceutical purposes. In Peru information on these animals is incipient and scattered, which limits taking the right measures for their adequate management, exploitation, and conservation. The aim of this study is to provide an update on the scope and perspectives of sponge research in Peru, with an emphasis on species richness and their antibacterial potential. Likewise, research initiatives carried out in other South American Pacific countries are reviewed. Research efforts in Peru have allowed the description of 46 species; however, the sponge richness is underestimated. On the other hand, in other latitudes, active principles with antimicrobial activity have been isolated from at least 36 species belonging to 11 of the 25 genera recorded in Peru (44 %), suggesting the high potential of Peruvian sponges as a source of antibacterial metabolites. It is concluded that the implementation of projects that integrate sponge research at different scales is necessary to contribute to the development of innovation plans and bio-businesses in the fishing, aquaculture, and pharmaceutical industries.
KEYWORDS: antimicrobial activity; bacteria; biotechnology; marine biodiversity; Porifera.
En las últimas décadas, las esponjas se han perfilado como la mayor fuente de principios activos de origen animal, con fines farmacéuticos. En el Perú, la información sobre estos animales es incipiente y dispersa, lo cual limita la toma de medidas correctas para su adecuado manejo, aprovechamiento y conservación. El objetivo de este estudio es brindar una actualización sobre los alcances y perspectivas de la investigación sobre esponjas en el Perú, con énfasis en la riqueza de especies y su potencial antibacteriano. Asimismo, se revisan las iniciativas de investigación de otros países del Pacífico sudamericano. Los esfuerzos de investigación en el Perú han permitido la descripción de 46 especies; sin embargo, se considera que la riqueza se encuentra aún subestimada. Por otro lado, en otras latitudes, se han aislado principios activos con actividad antimicrobiana de por lo menos 36 especies pertenecientes a 11 de los 25 géneros registrados para el Perú (44 %), sugiriendo el alto potencial de las esponjas peruanas como fuente de metabolitos antibacterianos. Se concluye que la implementación de proyectos que integren la investigación de esponjas a diferentes escalas es necesaria para contribuir al desarrollo de planes de innovación y bionegocios en las industrias pesquera, acuícola, y farmacéutica.
PALABRAS CLAVES: actividad antimicrobiana; bacteria; biodiversidad marina; biotecnología; Porifera.
INTRODUCCIÓN
El uso indebido de medicamentos ha dado lugar a la aparición de bacterias patógenas que presentan resistencia a múltiples fármacos, lo cual se ha convertido en una amenaza para la salud pública, y se estima que será una de las principales causas de muerte a nivel mundial para el 2050 (WHO, 2014). Como consecuencia, se hace necesaria la renovación del arsenal terapéutico frente a cepas resistentes de bacterias patógenas Gram positivas (e.g. Enterococcus sp., Mycobacterium tuberculosis (Zopf 1883) Lehmann y Neumann 1896, Staphylococcus aureus Rosenbach 1884) y Gram negativas (e.g. Acinetobacter baumannii Bouvet y Grimont 1986, Klebsiella pneumoniae (Schroeter 1886) Trevisan 1887, Pseudomonas aeruginosa (Schroeter 1872) Migula 1900) (WHO, 2014, 2015). Frente a lo anterior, organismos marinos, como las esponjas, se convierten en una fuente importante para la obtención de biomoléculas que permiten el diseño de nuevos fármacos (López et al., 2018).
Las esponjas (filo Porifera) son organismos acuáticos, sésiles, bentónicos y filtradores. Son consideradas los animales más antiguos aún vivientes, estimando su origen hace 760 millones de años (Brain et al., 2012). Su distribución es global, habitando ecosistemas dulceacuícolas, mixohalinos y marinos, desde la zona intermareal hasta las grandes profundidades (Hooper et al., 2002). Presentan un nivel de organización sencillo, formado por células con gran movilidad y totipotencia, facilitando procesos de diferenciación y transdiferenciación (Klautau, 2016). La mayoría de las especies se caracterizan por presentar un sistema de poros, canales y cámaras coanocitarias (estructuras especializadas para la filtración), conocido como sistema acuífero, a través del cual realizan las actividades de alimentación y reproducción (a excepción de las esponjas carnívoras, Vacelet y Boury-Esnault, 1995). Además, poseen un esqueleto compuesto por espículas (agregaciones minerales) de sílice o carbonato de calcio y/o fibras orgánicas de espongina (Vos et al., 1991; Hooper et al., 2002).
Estos animales desempeñan un rol importante en los ecosistemas acuáticos: contribuyen al reciclaje de nutrientes (sponge loop, de Goeij et al., 2013), brindan refugio para muchos invertebrados (Pearse, 1932; Frith, 1976; Kunzmann, 1996) y forman extensas agregaciones conocidas como sponge grounds de diferente naturaleza (Maldonado, 2016). Por otro lado, también destacan en el ámbito de la biotecnología, habiéndose realizado estudios sobre su uso como bioindicadores de calidad de agua por sus reconocidas condiciones de filtración y bioacumulación (Mahaut et al., 2013), el empleo de sus espículas para la elaboración de nanomateriales (Kulchin et al., 2009) y el potencial de su capacidad regenerativa para la ingeniería de tejidos (Granito et al., 2016). En el campo de la biotecnología azul, constituyen el grupo de invertebrados marinos que provee la mayor cantidad de compuestos naturales con potencial farmacéutico (Pierdacaris et al., 2013; Brinkmann et al., 2017; Santhanam et al., 2019), habiéndose aislado y caracterizado más de 5 000 compuestos bioactivos marinos, donde alrededor de 30 % provienen de esponjas (Han et al., 2019). Los compuestos naturales con actividad antibacteriana pueden ser sintetizados por las esponjas propiamente, o a partir de la simbiosis con otros organismos (bacterias, levaduras, hongos, Marinho et al., 2010; Anjum et al., 2016; McCauley et al., 2020).
En el Perú, la biotecnología es una oportunidad única para incrementar la competitividad y contribuir al desarrollo socioeconómico; este abordaje se fundamenta en la búsqueda y conquista de nuevos mercados a través del uso sostenible de la biodiversidad marina. Sin embargo, el problema radica en que las actuales aplicaciones biotecnológicas no trascienden de los esfuerzos a nivel académico o permanecen como acciones y/o iniciativas a pequeña escala, a pesar de emplear tecnologías avanzadas. Además, las empresas (peruanas) aún presentan limitaciones tecnológicas y económicas para aplicar la biotecnología en la mejora de sus productos o procesos, y se vislumbra lejana su aplicación a nivel industrial (Concytec, 2016).
En este contexto, el propósito de este trabajo fue brindar una actualización sobre el estado del conocimiento de las esponjas en el Perú y las perspectivas de su uso antibacteriano, abordando tres ejes principales: (1) investigación científica, (2) riqueza de especies y (3) potencial antimicrobiano. Para el primer eje, se realizó una recopilación de proyectos y/o iniciativas de investigación en repositorios de centros de investigación, universidades, blogs y noticias de prensa, a través de motores de búsqueda virtuales. Además, se consultó a líderes de proyectos para conocer los logros a nivel de formación de recursos humanos y producción científica. Para el segundo eje, se revisó cada uno de los registros de las especies de esponjas (marinas y dulceacuícolas) registradas para el Perú en World Porifera Database (http://www.marinespecies.org/porifera/) y se verificó su distribución geográfica y batimétrica. Considerando los géneros de esponjas registradas para el Perú, se elaboró una lista de especies co-genéricas de otras regiones del mundo con actividad antimicrobiana comprobada. Para ello, se realizó una búsqueda de artículos científicos publicados en revistas indizadas en bases de datos e.g. Scopus, JStor, Sciencedirect, Scielo y Wiley Online Library, usando las siguientes palabras claves: actividad antibacteriana, esponja, Porifera (en inglés y español); así como los géneros reportados para el Perú (latín). Finalmente, se presenta un breve análisis comparativo del estado del conocimiento y potencial de las esponjas en el Perú como fuente de productos antimicrobianos, en relación con otros países de la región.
Investigación sobre el filo Porifera en el Perú
El estudio de las esponjas en el Perú inició con el registro de la primera especie de la clase Demospongiae, Dysidea ligneana (Hyatt, 1877) para el norte del país (Tumbes, Hyatt, 1877). Algunos años después, se recolectaron los primeros especímenes de la clase Hexactinellida durante la expedición científica a bordo del crucero Albatross (1904-1905) en el Pacífico Tropical bajo la dirección de Alexander Agassiz. Estas muestras fueron obtenidas mediante lances de dragas a profundidades de 4 000 metros e identificadas por el zóologo austriaco Robert von Lendenfeld (1915) a partir de material pobremente conservado dada la metodología de recolecta utilizada. Décadas más tarde, como resultado de la revisión del material registrado en la Colección del National Museum of Natural History (Smithsonian Institution, USNM), se identificaron otras especies de Demospongiae (van Soest et al., 1991; Desqueyroux-Faúndez y van Soest, 1996). van Soest et al. (1991) realizaron una detallada revisión biogeográfica del género Acarnus y describieron la primera especie de este género para el Perú, recolectada en zona intermareal; en cuanto que Desqueyroux-Faúndez y van Soest (1996) describieron las dos primeras especies de Myxilla recolectadas durante el Programa Oceanográfico Biológico del Pacífico Este (Sepbop), a bordo del R.V. Anton Bruun (en 1966).
En las últimas décadas se realizaron iniciativas con el fin de conocer la riqueza de esponjas de América del Sur. El proyecto EsponjAS, liderado por el especialista brasileño Eduardo Hajdu (Museu Nacional-Universidade Federal do Rio de Janeiro, UFRJ), en cooperación con el biólogo belga Philippe Willenz (Royal Belgium Institute of Natural Sciences, RBNSc) tuvieron como objetivo inventariar la espongiofauna de áreas poco exploradas en Sudamérica, con particular interés en las costas de Argentina y Chile. En 2008 este proyecto expandió su área de estudio al Perú. Casi paralelamente, en 2007, surgió el proyecto de cooperación peruano-belga ESPER (Esponjas del Perú), liderado por el biólogo Yuri Hooker (Universidad Peruana Cayetano Heredia) y Philippe Willenz (RBNSc), con financiamiento de Global Biodiversity Information Facility (GBIF), con el fin de identificar las esponjas del Perú (Aguirre et al., 2011).
En el marco de estos proyectos (2007-2009), fueron recolectadas más de 800 muestras de esponjas a lo largo de la costa peruana (ca. 90 localidades), mediante recolección manual en la zona intermareal y buceo semiautónomo y autónomo en la zona submareal (Aguirre et al., 2011; Azevedo et al., 2015). Estos proyectos incluyeron la participación de estudiantes de distintas universidades y profesionales afines a la biología, quienes fueron capacitados en técnicas de recolección y preservación de esponjas; además, algunas estudiantes realizaron pasantías en la UFRJ, financiadas con becas brindadas por el Consejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (Concytec) y proyecto ESponjAS. Como resultado de estas iniciativas, se han identificado y descrito 30 especies, integrando abordajes morfológicos que incluyen la caracterización de espículas con auxilio de microscopía electrónica (Aguirre et al., 2011; Hajdu et al., 2015; Recinos et al., 2020; Bispo et al., 2022) y herramientas moleculares como la secuenciación de ADN (Azevedo et al., 2015; Cóndor-Luján et al., 2019). La identificación del material recolectado servirá para la elaboración de una guía de identificación de las esponjas del Perú, a ser publicada próximamente (Ph Willenz, com. pers).
Diversos esfuerzos por conocer los aspectos ecológicos de las esponjas también han sido desarrollados en el Perú, destacando entre ellos, la determinación de la macrofauna asociada (Cóndor et al., 2010) y la interacción erizo-esponja (Aguirre et al., 2011). Por otro lado, el equipo del Laboratorio de Ecología Microbiana de la Universidad Nacional Mayor de San Marcos (UNMSM), liderado por el microbiolólogo Jorge León, ha realizado estudios para determinar la actividad biológica de actinomicetos asociados a algunas esponjas marinas, obteniéndose resultados promisorios (e.g. León et al., 2015; Lino et al., 2016).
En 2019, la Universidad Científica del Sur (Científica) continuó con las investigaciones en Porifera en el Perú, iniciando con la determinación de las esponjas registradas en la Colección Científica de dicha Institución, con financiamiento propio, en el marco del Proyecto Evaluación de la diversidad de Demospongiae (Phylum Porifera) de las costas central y sur del Perú; involucrando docentes y estudiantes del Perú, así como, investigadores especialistas extranjeros (Eduardo Hajdu y Philippe Willenz). A finales de 2019, la Científica comenzó la ejecución del subproyecto Bioprospección de esponjas marinas de las costas central y sur del Perú para obtención de principios activos, con el objetivo de conocer la riqueza y distribución de esponjas de la costa centro-sur del Perú con potencial antimicrobiano, co-financiado por el Banco Mundial a través del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA) del Ministerio de la Producción (Produce), y en colaboración con dos organizaciones sociales de pescadores artesanales (OSPAS), Cooperativa de Trabajadores Pesqueros Artesanales Algas Marinas (Cotrapalmar), y Asociación de Maricultores El Arca de Noé de Marcona.
En los últimos 15 años, nueve proyectos de investigación que han contado con financiamiento de diversas fuentes han sido desarrollados con esponjas del Perú. Entre estos, cinco corresponden a iniciativas peruanas con interés en la identificación de especies y el potencial biotecnológico de las mismas (Tabla S1). Como resultado de estas iniciativas, nueve artículos han sido publicados en revistas científicas y ca. 26 presentaciones en eventos científicos han sido realizadas (Tabla S2); incluyendo estudiantes del Perú (e.g.Aguirre et al., 2011; Arroyo et al., 2020; Azevedo et al, 2015, Lino et al., 2016).
Riqueza de Esponjas en el Perú
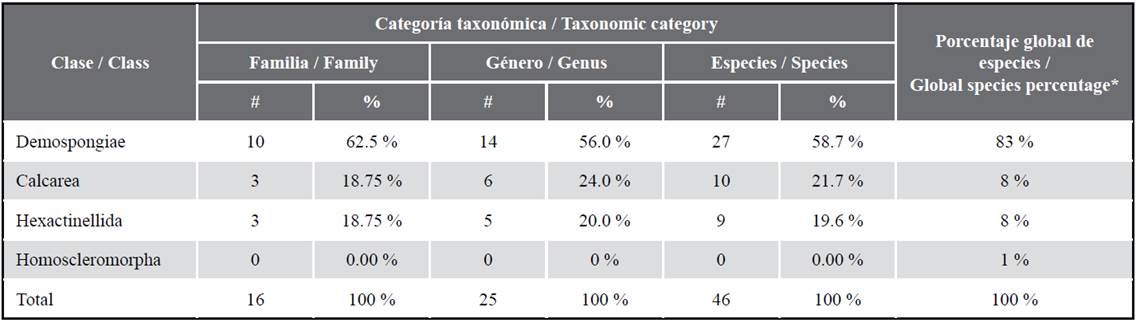
Actualmente, se reconocen más de 9 000 especies de esponjas, organizadas en cuatro clases: Calcarea (8 %), Demospongiae (83 %), Hexactinellida (8 %) y Homoscleromorpha (1 %) (van Soest et al., 2012). Entre ellas, sólo Calcarea incluye especies con esqueleto compuesto exclusivamente por espículas de carbonato de calcio e.g. diactinas, triactinas, tetractinas y pentactinas (Manuel et al., 2002; Rossi et al., 2006), y presenta los cinco tipos de sistema acuífero conocidos en Porifera: asconoide, leuconoide, siconoide, sileibide y solenoide (Cavalcanti y Klautau, 2011). A diferencia de Calcarea, las esponjas de Demospongiae presentan diversidad de colores y están adaptadas también a ambientes dulceacuícolas, incluyendo algunas lagunas altoandinas en el Perú (Boury-Esnault y Volkmer-Ribeiro, 1991). Hexactinellida incluye esponjas que se caracterizan por presentar células que forman tejidos sincitiales y en su mayoría, presentan distribución restringida a aguas profundas (200-6 000 m). Sólo las especies de Homoscleromorpha presentan membrana basal, pinacocitos flagelados y espículas de sílice con simetría tetraxónica (Gazave et al., 2012). Además, al igual que Calcarea, las esponjas Homoscleromorpha habitan frecuentemente lugares protegidos de la luz, como cavidades en paredes verticales o se encuentran debajo de las rocas (Pérez et al., 2017). Asimismo, se reconoce también la clase Archaeocyatha, que incluye especies extintas que presentaban forma de cono invertido y esqueleto basal de carbonato de calcio y formaron arrecifes durante el Cambriano (Debrenne et al., 2002).
Para el Perú, se han registrado 46 especies de esponjas distribuidas en tres de las cinco clases conocidas en este filo (Tabla 1). La Clase Demospongiae lidera la lista con 10 familias, 14 géneros y 27 especies. A la fecha, es el género Haliclona de la familia Chalinidae (orden Haplosclerida) el que alberga el mayor número de especies (n = 10; Bispo et al., 2022). Los géneros Chalinula, Eurypon, Hamacantha y Myxila incluyen dos especies; en cuanto que, los restantes nueve presentan apenas una especie (Tabla S3). Estas esponjas han sido encontradas en distintos hábitats y a variadas profundidades. Entre ellas, 21 han sido encontradas asociadas a sustrato duro, a profundidades entre 0 y 40 m; dos fueron recolectadas en sustrato areno-fangoso, a más de 200 m (Desqueyroux-Faúndez y van Soest, 1996); y una pertenece al Lago Titicaca (3 812 m.s.n.m, Boury-Esnault y Volkmer-Ribeiro, 1991). Recientemente, dos especies han sido halladas sobre las raíces de los mangles de Tumbes (Bispo et al., 2022). Sobre su distribución geográfica, 23 especies han sido registradas únicamente en el Perú y las restantes cuatro presentan afinidades con localidades vecinas. Acarnus peruanus van Soest, Hooper & Hiemstra, 1991 ha sido encontrada también en las Islas Galápagos (Desqueyroux-Faúndez y van Soest, 1997) y el Pacífico mexicano (Aguilar-Camacho et al., 2013). Hamacantha (Zygherpe) hyaloderma (Laubenfels, 1932) y Johannesia reticulosa (Thiele, 1905) fueron previamente descritas para California (de Laubenfels, 1932) y Chile (Thiele, 1905), respectivamente. Balliviaspongia wirrmanni Boury-Esnault y Volkmer-Ribeiro, 1991 es compartida con Bolivia (Lago Titicaca).
En cuanto a la Clase Calcarea, se han registrado tres familias, seis géneros y 10 especies (Tabla S3), ubicadas a profundidades entre el intermareal y los 30 m, y en hábitats protegidos de la luz (Azevedo et al., 2015; Cóndor-Luján et al., 2019). Siete especies son preliminarmente consideradas endémicas del Perú, y entre estas, Arturia spiralatta y Clathrina peruana presentan mayor ámbito de distribución. Clathrina aurea y Ernstia tetractina fueron descritas por primera vez para la costa sureste brasileña (Solé-Cava et al., 1991) y actualmente, presentan distribución anfi-americana (Azevedo et al., 2015) incluyendo el mar Caribe para C. aurea (Fontana et al., 2018; Cóndor-Luján et al., 2021). Clathrina antofagastensis presenta la mayor distribución en la costa Pacífica, desde la Península Mejillones (Chile, Azevedo et al., 2009) hasta Bahía de Sechura (Perú, Azevedo et al., 2015).
La Clase Hexactinellida incluye cuatro familias, cinco géneros y nueve especies (Tabla 1). Estas especies fueron recolectadas en localidades alejadas de la costa, a profundidades mayores a 4 000 m, durante la Expedición Albatross (1904-1905). Cuatro especies han sido únicamente encontradas durante dicha expedición, y las cinco restantes presentan una distribución más amplia (von Lendenfeld, 1915; Lévi, 1964; Koltun, 1970; Kersken et al., 2018; O’Hara et al., 2020).
Potencial antibacteriano de las esponjas registradas para el Perú
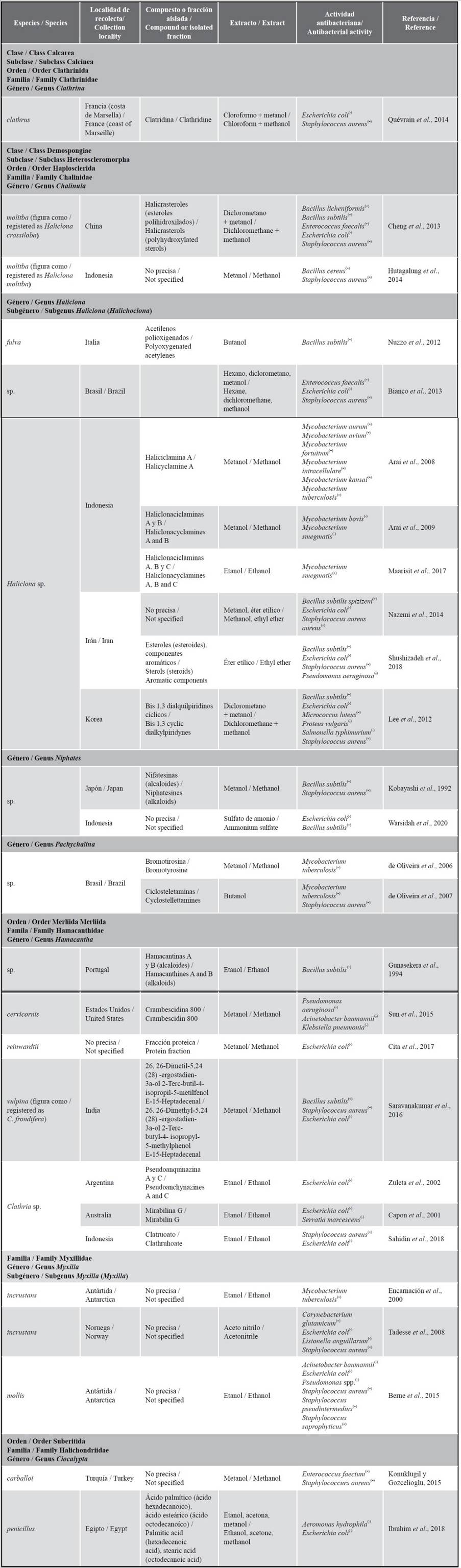
A la fecha, el potencial antimicrobiano de las esponjas del Perú aún no ha sido objeto de estudio. Sin embargo, considerando los 25 géneros registrados para el país, 11 de estos albergan por lo menos 36 especies que han demostrado actividad antimicrobiana. A partir de los extractos orgánicos de estas especies, recolectadas en la Antártida, Atlántico Norte (Francia, Irlanda), Pacífico Oeste (Indonesia) y en otras localidades, se han aislado varios principios activos (Tabla 2).
Haliclona es el género que presenta el mayor número de investigaciones (n = 13) sobre actividad antibacteriana comprobada. Se ha demostrado su efecto frente a 20 bacterias Gram positivas y 20 Gram negativas, atribuido a la presencia de esteroles y alcaloides (Cheng et al., 2013; Viegelmann et al., 2014; Shushizadeh et al., 2018; Kaplan et al., 2021). Además, se han obtenido algunos metabolitos secundarios como la Haliciclamina A (Arai et al., 2008), Haliclonaciclaminas A y B (Arai et al., 2009) y Haliclonaciclaminas A-C (Maarisit et al., 2017). Clathria es el segundo género más estudiado, habiéndose registrado 11 especies con acción inhibitoria para cinco bacterias Gram positivas y ocho Gram negativas. Se ha logrado aislar un considerable número de compuestos, destacando la Mirabilina G (Capon et al., 2001), Pseudoanquinazinas A y C (Zuleta et al., 2002), Microcionamidas A y B (Davis et al., 2004), Araiosaminas A y D (Wei et al., 2011), Clatrimidas A y B (Gupta et al., 2012), Gombaespiroacetales A-C, Fortona, Anselona C, Saponina gombasida A (Woo et al., 2015), Crambescidina 800 (Sun et al., 2015) y Clatruoato (Sahidin et al., 2018). En Dysidea, se reconocen cuatro especies que poseen acción bactericida frente a 10 bacterias (Gram positivas y negativas), y entre ellas, dos producen bromofenoles frente a Escherichia coli (Migula 1895) Castellani and Chalmers 1919, Salmonella sp. y Staphylococcus aureus (Sun et al., 2015). Dos especies de Ciocalypta y Myxilla han evidenciado actividad antibacteriana; resaltando la de C. penicillus Bowerbank, 1862 sobre Aeromonas hydrophila (Chester 1901) Stanier 1943 (Ibrahim et al., 2018) y la de M. (Myxilla) incrustans (Johnston, 1842) sobre Mycobacterium tuberculosis (Encarnación et al., 2000), Listonella anguillarum corrig. (Bergman 1909) MacDonell and Colwell 1986 (Tadesse et al., 2008), S. pseudintermedius Devrieseet al. 2005 y S. saprophyticus (Fairbrother 1940) Shaw et al. 1951 (Berne et al., 2015). Niphates contiene un grupo de alcaloides alquilpiridínicos denominados nifatesinas, que actúan contra Bacillus subtilis (Ehrenberg 1835) Cohn 1872 y S. aureus (Kobayashi et al.,1992) y su extracto inhibe el crecimiento de E. coli y B. subtilis (Warsidah et al., 2020). Se han aislado compuestos como Hamacantinas A y B y Acarnidina, con efecto sobre B. subtilis a partir de especies de Hamacantha y Acarnus, respectivamente (Gunasekera et al., 1994), Bromotirosina y Ciclosteletaminas con acción sobre M. tuberculosis y S. aureus a partir de Pachychalina (de Oliveira et al., 2006, 2007). En cuanto a la clase Calcarea, se destaca Clathrina que presenta actividad antibacteriana frente a E. coli y S. aureus (Quévrain et al., 2014).
Estos resultados sugieren la existencia de un alto potencial de las especies co-genéricas peruanas como fuente de biocompuestos o metabolitos antibacterianos. Asimismo, es probable que, las especies peruanas que se encuentran en proceso de descripción (Tabla 2), evidencien aplicabilidad de interés farmacéutico, destacando la actividad antimicrobiana.
Tabla 2 Especies de esponjas con actividad antimicrobiana comprobada, a partir de los géneros registrados para el Perú, detallando (cuando posible) localidad de recolecta, compuesto o fracción aislada, composición de extracto y actividad antibacteriana. Bacteria Gram Positiva = (+), Bacteria Gram Negativa = (-).
En este contexto, se evidencia el potencial biotecnológico del Perú, donde se pueden identificar oportunidades de investigación, innovación y negocios para las industrias pesquera, acuícola y farmacéutica. No obstante, el desarrollo de bionegocios enfocado en la búsqueda de bioproductos derivados de especies acuáticas debe involucrar planes tecnológicos que estén acompañados del desarrollo de capacidades e infraestructura instalada, interacción de grupos de trabajo, convenios nacionales e internacionales de instituciones y empresas involucradas, que orienten el aprovechamiento y valorización de recursos, como las esponjas marinas, desde una visión sostenible que proteja la biodiversidad, y contribuya al desarrollo socioeconómico del país.
Investigaciones sobre Porifera en el Pacífico Sudamericano
Similar al Perú, la investigación en Porifera en otros países del Pacífico sudamericano inició con las descripciones de los especímenes obtenidos en las campañas oceanograficas e.g. H.M.S. Challenger (Ridley, 1881; Ridley y Dendy, 1887; Wilson, 1904; von Lendenfeld, 1910). Sin embargo, no se realizaron mayores estudios hasta la década de los años ochenta del siglo pasado, cuando la investigadora Ruth Desqueyroux analizó detalladamente el material de Chile y Ecuador.
En Chile, los estudios han sido predominante orientados al conocimiento de la diversidad (riqueza y distribución) de especies de los fiordos (Thiele, 1905; Hajdu et al., 2013; Fernández et al., 2021). Actualmente, se conocen 190 especies, incluyendo las clases Calcarea (n = 15), Demospongiae (n = 160) y Hexactinellida (n = 15); y entre estas, 140 han sido registradas para los fiordos (Bertolino et al., 2020; Fernández et al., 2021). De manera complementaria, se han realizado investigaciones sobre la biogeografía, la ecología (interacción macroalga-esponja) y el potencial biotecnológico de estos organismos (e.g. Desqueyroux y Moyano, 1987; Hajdu y Desqueyroux-Faúndez, 2008; San Martín et al., 2011; Cárdenas et al., 2016).
En el Ecuador, el esfuerzo taxonómico se ha centrado en las Islas Galápagos, habiéndose descrito ca. 105 especies (van Soest et al., 2020; Sim-Smith et al., 2021), recolectadas tanto en aguas someras como profundas; mientras que apenas cuatro especies han sido registradas para el litoral ecuatoriano (Jaramillo et al., 2021). Por otro lado, se conoce un único estudio sobre el potencial biotecnológico de estos animales (Calabro et al., 2018).
En los últimos años, la implementación de proyectos nacionales e internacionales en Chile y Ecuador han permitido no sólo dar continuidad a la investigación (recolección de nuevas muestras e identificación y descripción de nuevas especies); si no también, contribuir a la formación de recursos humanos en la región. Como resultado de estas iniciativas, la producción científica, i.e. artículos publicados en revistas científicas, libros o capítulos de libros y presentaciones en congresos, ha incrementado, y se encuentra liderado por Chile (Tablas S4 y S5).
En el Pacífico colombiano, son pocos los estudios relacionados a la identificación y descripción de esponjas, en comparación con aquellos realizados en el Caribe Colombiano. Lizarazo et al. (2020a) rescatan los aportes ecológicos de Narváez (1999) sobre cuatro Demospongiae, un inventario que registra 21 especies (Escobar, 2000) y la guía de fotoidentificación de García-Suárez et al. (2012). Recientemente, se realizó un esfuerzo conjunto entre el Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis” (Invemar) y el Instituto de Estudios en Ciencias del Mar (Cecimar), logrando determinar 24 morfotipos de esponjas e identificándose 12 especies (Lizarazo et al., 2020b).
PERSPECTIVAS
A nivel mundial, las esponjas son fuente de compuestos con actividad antibacteriana comprobada, y origen de principios activos que han resultado en nuevos medicamentos. Sin embargo, para el Perú, el desarrollo en el ámbito de la investigación e innovación relacionada a la obtención de biomoléculas y fármacos provenientes de organismos marinos, que no son de consumo humano directo y/o indirecto, aún se encuentra en un estado incipiente, como es el caso de las esponjas. A pesar de esto, la producción científica peruana sobre esponjas tiene una tendencia creciente, principalmente, en temas sobre riqueza y distribución de especies, desarrollada en ámbitos académicos universitarios y enriquecida por la cooperación internacional existente. Todo lo anterior demuestra que, existe un recurso hidrobiológico (esponjas) con gran potencial biotecnológico y económico en el Perú, pero que requiere de la implementación de programas estatales y privados que financien proyectos que integren la investigación a diferentes escalas (taxonómica, ecológica y biotecnológica), y así se permita el desarrollo de planes de innovación y bionegocios para las industrias pesquera, acuícola y farmacéutica, a nivel nacional e internacional
AGRADECIMIENTOS
Los autores agradecen al Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA) y a la Universidad Científica del Sur (Científica) por el financiamiento brindado en el marco del Subproyecto Bioprospección de esponjas marinas de la costa central y sur del Perú para obtención de principios activos (PNIPA-PES-SIADE-PP-000158 / Contrato Nº 276-2019). Además, al geólogo José Herrera de la Universidad de Piura (UNP, Perú) por su colaboración en la verificación de las profundidades registradas para Hexactinellida y al ingeniero químico Oscar Reátegui de Científica por su apoyo en la traducción al español de algunos compuestos químicos
REFERENCIAS
Aguilar-Camacho, J.M., J.L. Carballo and J.A. Cruz-Barraza. 2013. Acarnidae Porifera: Demospongiae: Poecilosclerida) from the Mexican Pacific Ocean with the description of six new species. Sci. Mar., 77(4): 677-696. https://doi.org/10.3989/scimar.03800.06A [ Links ]
Aguirre, L.K., Y. Hooker, Ph. Willenz and E. Hajdu . 2011. A new Clathria (Demospongiae, Microcionidae) from Peru occurring on rocky substrates as well as epibiontic on Eucidaris thouarsii sea urchins. Zootaxa, 3085: 41-54. https://doi.org/10.11646/zootaxa.3085.1.3 [ Links ]
Anjum K., S.Q. Abbas, S.A.A. Shah, N. Akhter, S. Batool and S.S.U. Hassan. 2016. Marine sponges as a drug treasure. Biomol. Ther. (Seoul), 24(4): 347-362. https://doi.org/10.4062/biomolther.2016.067 [ Links ]
Arai, M., M. Sobou, C. Vilchéze, A. Baughn, H. Hashizume, P. Pruksakorn, S. Ishida, M. Matsumoto, W.R. Jacobs Jr. and M. Kobayashi. 2008. Halicyclamine A, a marine spogean alkaloid as a lead for anti-tuberculosis agent. Bioorg. Med. Chem., 16:6732-6736. https://doi.org/10.1016/j.bmc.2008.05.061 [ Links ]
Arai, M., S. Ishida, A. Setiawan and M. Kobayashi. 2009. Haliclonacyclamines, tetracyclic alkylpiperidine alkaloids, as anti-dormant mycobacterial substances from marine sponge of Haliclona sp. Chem. Pharm. Bull., 57(10):1136-1138. https://doi.org/10.1248/cpb.57.1136 [ Links ]
Arroyo, Y., E. Hajdu, Ph. Willenz and B. Cóndor-Luján. 2020. First record ofCiocalyptaBowerbank, 1862 (Demospongiae, Suberitida, Halichondriidae) in the Eastern Pacific, with description of a new species from Peru. Zootaxa, 4853(3): 429-441. https://doi.org/10.11646/zootaxa.4853.3.6 [ Links ]
Azevedo, F., E. Hajdu, Ph. Willenz and M. Klautau. 2009. New records of calcareous sponges (Porifera, Calcarea) from the Chilean coast. Zootaxa, 2072(1): 1-30. https://doi.org/10.11646/zootaxa.2072.1.1 [ Links ]
Azevedo, F., B. Cóndor-Luján, Ph. Willenz, E. Hajdu, Y. Hooker and M. Klautau. 2015. Integrative taxonomy of calcareous sponges (subclass Calcinea) from the Peruvian coast: morphology, molecules, and biogeography. Zool. J. Linn. Soc., 173: 787-817. https://doi.org/10.1111/zoj.12213 [ Links ]
Berne, S., M. Kalauz, M. Lapat, L. Savin, D. Janussen, D. Kersken, J. Ambrožič, Š. Zemljič, D Jaklič, N. Gunde-Cimerman, M. Lunder, I. Roškar, T. Eleršek, T. Turk and K Sepčić. 2016. Screening of the Antarctic marine sponges (Porifera) as a source of bioactive compounds. Polar Biol., 39:947-959. https://doi.org/10.1007/s00300-015-1835-4 [ Links ]
Bertolino, M., G. Costa, G. Bavestrello, M. Pansini and G. Daneri. 2020. New sponge species from Seno Magdalena, Puyuhuapi Fjord and Jacaf Canal (Chile). Eur. J. Taxon., 715: 1-49. https://doi.org/10.5852/ejt.2020.715 [ Links ]
Bianco E.M., S.Q. de Oliveira, C. Rigotto, M.L. Tonini, T. da Rosa Guimarães, F. Bittencourt, L.P. Gouvêa, C. Aresi, M.T. de Almeida, M.I. Moritz, C.D. Martins, F. Scherner, J.L. Carraro, P.A. Horta, F.H. Reginatto, M. Steindel, C.M. Simões and E.P. Schenkel. 2013. Anti-infective potential of marine invertebrates and seaweeds from the Brazilian coast. Molecules (Basel, Switzerland), 18(5):5761-5778. https://doi.org/10.3390/molecules18055761 [ Links ]
Bispo, A., Ph. Willenz and E. Hajdu. 2022. Diving into the unknown: fourteen new species of haplosclerid sponges (Demospongiae: Haplosclerida) revealed along the Peruvian coast (southeastern Pacific). Zootaxa, 5087(2):201-252. https://doi.org/10.11646/zootaxa.5087.2.1 [ Links ]
Boury-Esnault, N. and C. Volkmer-Ribeiro. 1991. The Porifera: description of a new taxonBalliviaspongia wirrmannin.g., n.sp.: 295-301. In: Dejoux, C. and A. Iltis. (Eds.), Lake Titicaca: a synthesis of limnological knowledge. Monographiae Biologicae, 68. Kluwer Academic: Dordrecht, Boston, London: i-xxiv, 1. 296 p. [ Links ]
Brain, C.K., A.R. Prave, K.H. Hoffmann, A. E. Fallick, A. Botha, D. A. Herd, C. Sturrock, I. Young, D.J. Condon and S.G. Allison. 2012. The first animals: ca. 760-million-year-old sponge-like fossils from Namibia. S. Afr. J. Sci., 108(1/2):1-8.http://dx.doi.org/10.4102/sajs.v108i1/2.658 [ Links ]
Brinkmann, C., A. Marker and D. I. Kurtböke. 2017. An overview on marine sponge-symbiotic bacteria as unexhausted sources for natural product discovery. Diversity, 9(4): 40. https://doi.org/10.3390/d9040040 [ Links ]
Calabro K., B.E. Chalen, G. Genta-Jouve, K.B. Jaramillo, C. Domínguez, M. de la Cruz, B. Cautain, F. Reyes, O.P. Thomas and J. Rodríguez. 2018. Callyspongidic Acids: amphiphilic diacids from the Tropical Eastern Pacific sponge Callyspongia cf. californica. J. Nat. Prod., 81(10):2301-2305. [ Links ]
Capon, R., M. Miller and F. Rooney. 2001. Mirabilin G: A new alkaloid from a southern Australian marine sponge, Clathria species. J. Nat. Prod., 64 (5):643-644. https://doi.org/10.1021/np000564g [ Links ]
Cárdenas, C.A., E.M. Newcombe, E. Hajdu, M. González-Aravena, S.W. Geange and J.J. Bell. 2016. Sponge richness on algae-dominated rocky reefs in the western Antarctic Peninsula and the Magellan Strait. Polar Res., 35(1):1-6. https://doi.org/10.3402/polar.v35.30532 [ Links ]
Carter, G.T. and K.L. Rinehart Jr. 1978. Acarnidines, novel antiviral and antimicrobial compounds from the sponge Acarnus erithacus (de Laubenfels). J. Am. Chem. Soc., 100 (13):4302-4304. https://doi.org/10.1021/ja00481a049 [ Links ]
Cavalcanti, F. and M. Klautau. 2011. Solenoid: a new aquiferous system to Porifera. Zoomorphology, 130(4):255-260. https://doi.org/10.1007/s00435-011-0139-7 [ Links ]
Cheng, Z.B., H. Xiao., C.Q. Fan, Y.N. Lu, G. Zhang and S. Yin. 2013. Bioactive polyhydroxylated sterols from the marine sponge Haliclona crassiloba. Steroids, 78(14):1353-1358. https://doi.org/10.1016/j.steroids.2013.10.004 [ Links ]
Cita, Y.P., F.K. Muzaki, O.K. Radjasa and P. Sudarmono. 2017. Screening of antimicrobial activity of sponges extract from Pasir Putih, East Java (Indonesia). J. Marine Sci. Res. Dev., 7(5):1-5. https://doi.org/10.4172/2155-9910.1000237 [ Links ]
Concytec. 2016. Programa Nacional Transversal de Biotecnología 2016-2021. Primera edición. Lima, Perú. 81 p. https://portal.concytec.gob.pe/images/noticias/pronbiotec_final.pdf [ Links ]
Cóndor, B., P. Gallegos y E. Hajdu. 2010. Macrofauna asociada a Hymeniacidon cf. sinapium (Porifera: Demospongiae: Halichondriidae) en bahía de Ancón, Lima, Perú. Segundo Congreso de Ciencias del Mar del Perú, Piura, Perú. [ Links ]
Cóndor-Luján, B., F. Azevedo, E. Hajdu, Y. Hooker, Ph. Willenz and M. Klautau. 2019. Tropical Eastern Pacific Amphoriscidae Dendy, 1892 (Porifera: Calcarea: Calcaronea: Leucosolenida) from the Peruvian coast. Mar. Biodivers., 49(3):1813-1830. https://doi.org/10.1007/s12526-019-00946-y [ Links ]
Cóndor-Luján, B., P. Leocorny, A. Padua, F. Azevedo, V. Corrêa Seixas, Y. Hooker, E. Hajdu, Ph. Willenz, T. Pérez and M. Klautau. 2021. Evolutionary history of the calcareous spongeClathrina aurea: genetic connectivity in the western Atlantic and intriguing occurrence in the Eastern Pacific. Mar. Biol., 168(127):1-23. https://doi.org/10.1007/s00227-021-03934-8 [ Links ]
Davis, R.A., G.C. Mangalindan, Z.P. Bojo, R.R. Antemano, N.O. Rodríguez, G.P. Concepción, S.C. Samson, D. de Guzmán, L.J. Cruz, D. Tasdemir, M.H. Harper, X. Feng, G.T. Carter and C.M. Ireland. 2004. Microcionamides A and B, bioactive peptides from the Philippine sponge Clathria (Thalysias) abietina. J. Org. Chem., 69:4170-4176. https://doi.org/10.1021/jo040129h [ Links ]
Debrenne, F., A.Y. Zhuravlev and P.D. Kruse. 2002. Class Archaecyatha Bornemann, 1884: 1539-1699. In: Hooper, J.N.A. and R.W.M. van Soest. (Eds.) Systema Porifera. A guide to the classification of sponges. Kluwer Academic/Plenum Publishers, New York. 1707 p. [ Links ]
de Goeij, J.M., D. von Oevelen, M.J.A. Vermeij, R. Osinga, J.J. Middelburg, A.F.P.M. de Goeij and W. Admiraal. 2013. Surviving in a marine desert: the sponge loop retains resources within coral reefs. Science, 342(6154): 108-110. https://doi.org/10.1126/science.1241981 [ Links ]
de Laubenfels, M.W. 1932. The marine and fresh-water sponges of California. Proc. U.S. Natl. Mus., 81 (2927): 1-140. https://doi.org/10.5479/si.00963801.81-2927.1 [ Links ]
de Oliveira, J.H.H., M.H.R. Seleghim, C. Timm, A. Grube, M. Köck, G.G.F. Nascimento, A.C.T. Martins, E.G.O. Silva, A.O. De Souza, P.R.R. Minarini, F.C.S. Galetti, C.L. Silva, E. Hajdu and R.G.S. Berlinck. 2006a. Antimicrobial and antimycobacterial activity of cyclostellettamine alkaloids from sponge Pachychalina sp. Mar. Drugs, 4(1): 1-8. https://doi.org/10.3390/md401001 [ Links ]
de Oliveira, M.F., J.H.H.L. de Oliveira, F.C.S. Galetti, A.O. de Souza, C. Lopes Silva, E. Hajdu, S. Peixinho and R.G.S. Berlinck. 2006b. Antinycobacterial brominated metabolites from two species of marine sponges. Planta Medica 72(5): 437-441. https://doi.org/10.1055/s-2005-916239 [ Links ]
de Silvestri, S. Zea y C. Duque. 1994. Actividad antibacteriana de algunas esponjas del Caribe colombiano. Rev. Col. Cienc. Quím. Farm., 22: 21-26. [ Links ]
Desqueyroux, R. y H. Moyano. 1987. Zoogeografía de demospongias chilenas. Bol. Soc. Biol. Concepc. (Chile), 58: 39-66. [ Links ]
Desqueyroux-Faúndez, R. and R.W.M. van Soest. 1996. A review of Iophonidae, Myxillidae and Tedaniidae occurring in the South East Pacific (Porifera: Poecilosclerida). Rev. Suis. Zool., 103(1): 3-79. https://doi.org/10.5962/bhl.part.79938 [ Links ]
Desqueyroux-Faúndez, R. and R.W.M van Soest. 1997. Shallow water Demosponges of the Galápagos Islands. Rev Suisse Zool., 104(2):379-467. https://doi.org/10.5962/bhl.part.80003 [ Links ]
Duraikannu, K., D. Edupalli, G. Rameshkumar and S. Ravichandran. 2009. Antimicrobial peptide from marine sponge Clathria indica (Dendy,1889). Am.-Eurasian J. Sci. Res., 4(1):47-53. [ Links ]
Encarnación, D.R., S.G. Franzblau, C.A. Tapia and R. Cedillo-Rivera. 2000. Screening of marine organisms for antimicrobial and antiprotozoal activity. Pharm. Biol., 38(5):379-384. https://doi.org/10.1076/phbi.38.5.379.5964 [ Links ]
Escobar, T. 2000. Inventario y estudio taxonómico de las esponjas (Phylum Porifera) de algunas áreas del Pacífico colombiano. Tesis Biol. Mar. Univ. Valle, Cali. 149 p. [ Links ]
Fernández, J.C., M. Gastaldi, G. Zapata-Hernández, L.M. Pardo, F.L. Thompson and E. Hajdu. 2021. New species ofCrella (Pytheas) Topsent, 1890 andCrellomimaRezvoi, 1925 (Crellidae, Poecilosclerida, Demospongiae) from Chilean shallow and Argentinean deep waters, with a synthesis on the known phylogenetic relationships of crellid sponges. Zootaxa, 5052(3):353-379. https://doi.org/10.11646/zootaxa.5052.3.3 [ Links ]
Fontana, T., B. Cóndor-Luján, F. Azevedo, T. Pérez and M. Klautau. 2018. Diversity and distribution patterns of calcareous sponges (subclass Calcinea) from Martinique. Zootaxa, 4410:331-369.https://doi.org/10.11646/zootaxa.4410.2.5 [ Links ]
Frith, D.W.1976. Animals associated with sponges at North Haying, Hampshire. Zool. J. Linn. Soc., 58:353-362. [ Links ]
García-Suárez, S.D., A. Acosta, E. Londoño-Cruz y J.R. Cantera K. 2012. Organismos sésiles y móviles del litoral rocoso: en el Pacífico colombiano: una guía visual para su identificación. Ser. Doc. Esp., (26). Invemar, Santa Marta. 133 p. [ Links ]
Gazave, E., P. Lapébie, A. Ereskovsky, J. Vacelet, E. Renard, P. Cárdenas and C. Borchiellini. 2012. No longer Demospongiae: Homoscleromorpha formal nomination as a fourth class of Porifera. In: Maldonado, M., X. Turon, M.A. Becerro and M.J. Uriz (Eds.) Ancient animals, new challenges. Sponge research developments. Hydrobiologia, 687(1): 3-10. https://doi.org/10.1007/s10750-011-0842-x [ Links ]
Granito, R.N., M.R. Custódioand A.C. Rennó. 2016. Natural marine sponges for bone tissue engineering: The state of art and future perspectives. J. Biomed. Mater. Res. Part B Appl. Biomater., 105(6): 1717-1727. https://doi.org/10.1002/jbm.b.33706 [ Links ]
Gunasekera, S.P., P.J. McCarthy and M. Kelly-Borges. 1994. Hamacanthins A and B, new antifungal bis indole alkaloids from the deep-water marine sponge, Hamacantha sp. J. Nat. Prod., 57(10): 1437-1441. https://doi.org/10.1021/np50112a014 [ Links ]
Gupta, P., U. Sharma, T.C. Schulz, A.B. McLean, A.J. Robins and L.M. West. 2012. Bicyclic C21 terpenoids from the marine sponge Clathria compressa. J. Nat. Prod., 75: 1223-1227. https://doi.org/10.1021/np300265p [ Links ]
Hajdu, E. and R. Desqueyroux-Faúndez. 2008. A reassessment of the phylogeny and biogeography of Rhabderemia Topsent, 1890 (Rhabderemiidae, Poecilosclerida, Demospongiae). Rev. Suis. Zool., 115(2): 377-395. [ Links ]
Hajdu, E., R. Desqueyroux-Faúndez, M.S. Carvalho, G. Lôbo-Hajdu and Ph. Willenz. 2013. Twelve new Demospongiae (Porifera) from Chilean fjords, with remarks upon sponge-derived biogeographic compartments in the SE Pacific. Zootaxa, 3744: 1-64. https://doi.org/10.11646/zootaxa.3744.1.1 [ Links ]
Hajdu, E., Y. Hooker and Ph. Willenz. 2015. New Hamacantha from Peru, and resurrection of Zygherpeas subgenus (Demospongiae, Poecilosclerida, Hamacanthidae). Zootaxa, 3926(1): 87‒99. https://doi.org/10.11646/zootaxa.3926.1.3 [ Links ]
Han, B.N., L.L. Hong, B.B. Gu, Y.T. Sun, J. Wang, J.T. Liu and H.W. Lin. 2019. Natural products from sponges. In: Li, Z. (Ed.) Symbiotic microbiomes of coral reef sponges and corals. Springer, Dordrecht. 329-463. https://doi.org/10.1007/978-94-024-1612-1_15 [ Links ]
Hooper, J., R. van Soest and F. Debrenne. Phylum Porifera Grant, 1836. 2002. 9-13. In: Hooper, J.N.A. and R.W.M. van Soest. (Eds.) Systema Porifera. A guide to the classification of sponges. Kluwer Academic/Plenum Publishers, New York. 1707 p. [ Links ]
Hutagalung, R.A., V.M. Karjadidjaja, V. D. Prasasty and N. Mulyono. 2014. Extraction and characterization of bioactive compounds from cultured and natural sponge, Haliclona molitba and Stylotella aurantium Origin of Indonesia. Int. J. Biosci. Biochem. Bioinform., 4(1): 14-18. [ Links ]
Hyatt, A. 1877. Revision of the North American Poriferae; with remarks upon foreign species. Part II. Mem. Boston Soc. Nat. Hist., 2: 481-554, pls XV-XVII. [ Links ]
Ibrahim, H.A., H.O. Ahmed, F.A.A. El Razek and E. Elmasry. 2018. Proteolysis and heat sensitive antibacterial agents from several levantine sponge species. Int. J. Adv. Res., 6(2): 14-27. http://dx.doi.org/10.21474/IJAR01/6403 [ Links ]
Ibrahim, H.A.H., D.E. Elabiary and M.M. Hamed. 2020. Antimicrobial activity of some Egyptian marine invertebrates, Red Sea. Egypt. J. Aquat. Biol. Fish., 24(4): 321-340. http://doi.org/10.21608/ejabf.2020.98494 [ Links ]
Jaramillo, K.B., B. Cóndor-Luján, B. Longakit. J. Rodriguez, O.P. Thomas, G. McCormack and E. Hajdu. 2021. New records of Demospongiae (Porifera) from Reserva Marina El Pelado (Santa Elena, Ecuador), with description of Tedania (Tedania) ecuadoriensis sp. nov. Zookeys, 1011:101-120. https://doi.org/10.3897/zookeys.1011.54485 [ Links ]
Karimpoor, M., E. Kamrani, M. Yousefzadi and M. Nazemi. 2018. Antibacterial and antioxidant potential of Haliclona caerulea extracts from Tidal Island Larak, Persian Gulf. JMBS, 9(3): 347-353. [ Links ]
Kaplan, A.R., C.L. Schrank and W.M. Wuest. 2021. An efficient synthesis of 3-alkylpyridine alkaloids enables their biological evaluation. Chem. Med. Chem., 16: 2487-2490. https://doi.org/10.1002/cmdc.202100134 [ Links ]
Kersken, D., D. Janussen and P. Martínez. 2018. Deep-sea glass sponges (Hexactinellida) from polymetallic nodule fields in the Clarion-Clipperton Fracture Zone (CCFZ), northeastern Pacific: Part I - Amphidiscophora.Mar. Biodivers .,48(1):545-573. https://doi.org/10.1007/s12526-017-0727-y [ Links ]
Klautau, M. 2016. Capitulo 7 Porifera. En: Fransozo, A. y M.L. Negreiros-Fransozo (Eds). Zoologia dos Invertebrados. Editora Guanabara Koogan, Rio de Janeiro. [ Links ]
Kobayashi, J., C. Zeng, M. Ishibashi, H. Shigemori, T. Sasakiband Y. Mikami. 1992. Niphatesines E-H, new pyridine alkaloids from the Okinawan marine sponge Niphates sp. J. Chem. Soc., 1: 1291-1294. [ Links ]
Koltun, V.M. 1970. Sponge fauna of the northwestern Pacific from the shallows to the hadal depths: 165-221. In: Bogorov, V.G. (Ed.) Fauna of the KurileKamchatka Trench and its environment. Inst. Oceanol. Acad. Sci. U.S.S.R., 86 (Akademiya Nauk SSSR. Trudy Instituta Okeanologii in P.P. Shishov and Izdatelstvo Nauka, Moskwa). 372 p, pls 1-8. [ Links ]
Konuklugil, B. and B. Gozcelioglu. 2015. Antimicrobial activity of marine samples collected from the different coasts of Turkey. Turk. J. Pharm. Sci., 12(3): 116-125. [ Links ]
Kulchin, Y., A.V. Bezverbny, O.A. Bukin, S.S. Voznesensky, A.N. Galkina, A. L. Drozdov and I.G. Nagorny. 2009. Optical and nonlinear optical properties of sea glass sponge spicules: 315-340. In: Müller, W.E.G. and M.A. Grachev (Eds.) Biosilica in evolution, morphogenesis, and nanobiotechnology. Prog. Mol. Subcell Biol., 47. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-540-88552-8_14 [ Links ]
Kunzmann, K. 1996. Associated fauna of selected sponges (Hexactinellida and Demospongiae) from the Weddell Sea, Antarctica. Berich. Polarfors., 210: 1-93. [ Links ]
Latifah, L.A., A. Tahir and N.H. Soekamto. 2021. Antibacterial assay of crude extracts from marine sponge Haliclona fascigera in Badi Island of Spermonde Archipelago against shrimp pathogenic bacteria. IOP Conf. Ser.: Earth Environ. Sci., 763:012029. https://doi.org/10.1088/1755-1315/763/1/012029 [ Links ]
Lee, Y., K.H. Jang, J. Jeon, W.Y. Yang, C.J. Sim, K.B. Oh and J. Shin. 2012. Cyclic Bis-1,3 dialkylpyridinoums from the sponge Haliclona sp. Mar. Drugs, 10:2116-2137. https://doi.org/10.3390/md10092126 [ Links ]
León, J., J. Aponte, S. Montero, N. Galindo, M. Huamány U. Tarazona. 2015. Aislamiento de actinomicetos asociados a esponjas marinas y evaluación del potencial antimicrobiano frente a patógenos multi-drogo-resistentes (MDR). XXIV Reun. Cient. Inst. Invest. Cienc. Biol. Antonio Raymundi, Lima. [ Links ]
Lévi, C. 1964. Spongiaires des zones bathyale, abyssale et hadale. Galathea Rep. Sci. Res. Danish Deep-Sea Exp. Round World, 1950-52. 7: 63-112, pls II-XI. 93 p. [ Links ]
Lino, M., J. León y M. Huáman. 2016. Evaluación de la capacidad antagonista de un antimicrobiano producido por Streptomyces sp. CEPA 13A-2 frente a microorganismos resistentes a β-lactámico de origen hospitalario. Rev. Peru Investig. Matern. Perinat., 5(1): 28‒34. https://doi.org/10.33421/inmp.201652 [ Links ]
Lippert, H., R. Brinkmeyer, T. Mulhaupt and K. Iken. 2003. Antimicrobial activity in sub-Arctic marine invertebrates. Polar Biol., 26: 591‒600. https://doi.org/10.1007/s00300-003-0525-9 [ Links ]
Lizarazo, N., S. Zea, L. Chasqui y N. Rincón-Díaz. 2020a. Diversidad de esponjas (Porifera) en los riscales y morros del Pacífico norte chocoano: 82‒91. En: Chasqui, L. (Ed.). Biodiversidad de los arrecifes rocosos (riscales y morros) del Pacífico norte chocoano. Ser. Publ. Gen. Invemar. 318 p. https://n2t.net/ark:/81239/m9x11f [ Links ]
Lizarazo, N., S. Zea, L. Chasqui y N. Rincón-Díaz. 2020b. Biodiversidad de esponjas en arrecifes rocosos del Chocó norte, Pacífico colombiano. Bol. Invest. Mar. Cost., 49(2): 79‒130. [ Links ]
López, Y., V. Cepas and S.M. Soto. 2018. The marine ecosystem as a source of antibiotics. In: Rampelotttao, P. and A. Trincone (Eds.) Grand challenges in marine biotechnology. Springer, Cham. https://doi.org/10.1007/978-3-319-69075-9_1 [ Links ]
Maarisit, W., D.B. Abdjul ,, ,H. Yamazaki, H. Kato, H. Rotinsulu, D. S. Wewengkang, D. A. Sumilat, M. M. Kapojos, K. Ukai and M. Namikoshi. 2017. Anti-mycobacterial alkaloids, cyclic 3-alkyl pyridinium dimers, from the Indonesian marine sponge Haliclona sp. Bioorg. Med. Chem. Lett., 27:3503-3506. https://doi.org/10.1016/j.bmcl.2017.05.067 [ Links ]
Mahaut, M.L., O. Basuyaux, E. Baudinière, C. Chataignier, J. Pain and C. Caplat. 2013. The porifera Hymeniacidon perlevis (Montagu, 1818) as a bioindicator for water quality monitoring. Environ. Sci. Pollut. Res. Int., 20(5): 2984‒2992. https://doi.org/10.1007/s11356-012-1211-7 [ Links ]
Maldonado, M., R. Aguilar, R.J. Bannister, J.J. Bell, K.W. Conway, P.K. Dayton, C. Diaz, J. Gutt, M. Kelly, E.L.R. Kenchington, S. Leys, S.A. Pomponi, H.T. Rapp, K. Rützler, O.S. Tendal, J. Vacelet and C.M. Young. 2016. Sponge grounds as keys marine habitats: a synthetic review of types, structure, functional roles, and conservation concerns: 1‒39. In: Rossi, S., L. Bramanti, A. Gori and C. Orejas Saco del Valle (Eds.) Marine animal forests: The ecology of benthic biodiversity hotspots. Springer, Switzerland. https://doi.org/10.1007/978-3-319-17001-5_24-1 [ Links ]
Manuel, M., R. Borojevic, N. Boury-Esnault and J. Vacelet. 2002. Class Calcarea Bowerbank, 1864: 1103‒1110. In: Hooper, J.N.A. and R.W.M. van Soest. (Eds.) Systema Porifera. A guide to the classification of sponges. Kluwer Academic/Plenum Publishers, New York. 1707 p. [ Links ]
Marinho, P.R., G.R.S. Muricy, M.F.L. Silva, M.G. de Marval and M.S. Laport. 2010. Antibiotic resistant bacteria inhibited by extracts and fractions from Brazilian marine sponges. Rev. Bras. Farmacogn., 20(2): 267-275. https://doi.org/10.1590/S0102-695X2010000200022 [ Links ]
McCauley E.P., I.C. Piña, A.D. Thompson, K. Bashir, M. Weinberg, S. L. Kurz and P. Crews. 2020. Highlights of marine natural products having parallel scaffolds found from marine-derived bacteria, sponges, and tunicates. J. Antibiot., 73:504-525. https://doi.org/10.1038/s41429-020-0330-5 [ Links ]
McClintock, J.B. and J.J. Gauthier. 1992. Antimicrobial activities of Antarctic sponges. Antarct. Sci., 4(2): 179-183. https://doi.org/10.1017/S0954102092000270 [ Links ]
Narváez, K. 1999. Identificación y aspectos ecológicos de las esponjas del arrecife coralino de Playa Blanca, isla Gorgona (Pacífico colombiano). Tesis Biol. Mar., Univ. Valle, Cali. 57 p. [ Links ]
Nazemi, M., M.A. Salimi, P.A. Salimi, A. Motallebi, S.T. Jahromiand O. Ahmadzadeh. 2014. Antifungal and antibacterial activity of Haliclona sp. from the Persian Gulf, Iran. J. Mycol. Med., 24: 220- 224. https://doi.org/10.1016/j.mycmed.2014.03.005 [ Links ]
Nuzzo, G., M.L. Ciavatta, G. Villani, E. Manzo, A. Zanfardino, M. Varcamonti and M. Gavagnin. 2012. Fulvynes, antimicrobial polyoxygenated acetylenes from the Mediterranean sponge Haliclona fulva. Tetrahedron, 68(2):754-760. https://doi.org/10.1016/j.tet.2011.10.068 [ Links ]
O’Hara, T.D., A. Williams, S.T. Ahyong, P. Alderslade, T. Alvestad, D. Bray, I. Burghardt, N. Budaeva, F. Criscione, A.L. Crowther, M. Ekins, M. Eléaume, C.A. Farrelly1, J.K. Finn, M.N. Georgieva, A. Graham, M. Gomon, K. Gowlett-Holmes, L.M. Gunton, A. Hallan, A.M. Hosie, P. Hutchings, H. Kise, F. Köhler, J.A. Konsgrud, E. Kupriyanova, C.C. Lu, M. Mackenzie, C. Mah, H. MacIntosh, K.L. Merrin, A. Miskelly, M.L. Mitchell, K. Moore, A. Murray, P.M. O’Loughlin, H. Paxton, J.J. Pogonoski, D. Staples, J.E. Watson, R.S. Wilson, J. Zhang and N.J. Bax. 2020. The lower bathyal and abyssal seafloor fauna of eastern Australia. Mar. Biodivers. Rec., 13: 11. https://doi.org/10.1186/s41200-020-00194-1 [ Links ]
Orhan, I.E., B. Ozcelik, B. Konuklugil, A. Putz, U.G. Kaban and P. Proksch. 2012. Bioactivity screening of the selected Turkish marine sponges and three compounds from Agelas oroides. Rec. Nat. Prod., 6(4): 356-367. [ Links ]
Pearse, A.S. 1932. Inhabitants of certain sponges at Dry Tortugas. Carnegie Instit. Wash., 435:117-124. [ Links ]
Pech-Puch, D., M. Pérez-Povedano, P. Gómez, M. Martínez-Guitián, C. Lasarte-Monterrubio, J.C. Vásquez-Ucha, M.L. Novoa-Olmedo, S. Guillén-Hernández, H. Villegas-Hernández, G. Bou, J. Rodríguez, A. Beceiro and C. Jiménez. 2020. Marine organisms from the Yucatan Peninsula (Mexico) as a potential natural source of antibacterial compounds. Mar. Drugs, 18(7):369. https://doi.org/10.3390/md18070369 [ Links ]
Pérez, T., M.-C. Díaz, C. Ruiz, B. Cóndor-Luján, M. Klautau, E. Hajdu, G. Lobo-Hajdu, S. Zea, S.A. Pomponi, R.W. Thacker, S. Carteron, G. Tollu, A. Pouget-Cuvelier, P. Thélamon, J.-P. Marechal, O.P. Thomas, A.V. Ereskovsky, J. Vacelet and N. Boury-Esnault. 2017. How a collaborative integrated taxonomic effort has trained new spongiologists and improved knowledge of Martinique Island (French Antilles, eastern Caribbean Sea) marine biodiversity. PLoS One, 12(3): e0173859. https://doi.org/10.1371/journal.pone.0173859 [ Links ]
Pierdacaris S., T. Vlachogianni and A. Valavanidis. 2013. Bioactive natural substances from marine sponges: new developments and prospects for future pharmaceuticals. Nat. Prod. Chem. Res., 1(3): 1000114:1-8. https://doi.org/10.4172/2329-6836.1000114 [ Links ]
Quévrain, E., M. Roué, I. Domart-Coulon and M. Bourguet-Kondracki. 2014. Assessing the potential bacterial origin of the chemical diversity in calcareous sponges. J. Mar. Sci. Technol., 22(1):36-49. https://doi.org/10.6119/JMST-013-0718-2 [ Links ]
Ravichandran, S., S. Wahidullahb, L. D’Souza and R.M. Anbuchezhian. 2011. Antimicrobial activity of marine sponge Clathria indica (Dendy, 1889). Russ. J. Bioorganic Chem., 37(4): 428-435. https://doi.org/10.1134/s106816201104011x [ Links ]
Recinos, R., U. Pinheiro, Ph. Willenz and E. Hajdu. 2020. Three new Raspailiidae Hentschel, 1923 (Axinellida, Demospongiae) from Peru.Zootaxa, 4778(3): 521-545. https://doi.org/10.11646/zootaxa.4778.3.5 [ Links ]
Reiswig, H.M. 2002. Class Hexactinellida Schmidt, 1870: 1201-1202. In: Hooper, J.N.A. and R.W.N. van Soest. (Eds.) Systema Porifera. A guide to the classification of sponges. Kluwer Academic/Plenum Publishers, New York. 1707 p. [ Links ]
Ridley, S.O. 1881. XI. Spongida. Horny and siliceous sponges of Magellan Straits, S.W. Chili, and Atlantic off SW Brazil. In: Günther, A. (Ed.) Account of the Zoological Collections made during the Survey of H.M.S. ‘Alert’ in the Straits of Magellan and on the Coast of Patagonia. Proc. Zool. Soc. Lond., 107-141, pls. X-XI. https://doi.org/10.1111/j.1096-3642.1881.tb01270.x [ Links ]
Ridley, S.O. and A. Dendy. 1887. Report on the Monaxonida collected by H.M.S. “Challenger” during the years 1873-76. Report on the Scientific Results of the Voyage of H.M.S. Challenger during the years 1873-76. Zoology. 20 (part 59): i-lxviii, 1-275, pl. 1-51, 1 map. https://doi.org/10.5962/bhl.title.6513 [ Links ]
Rossi, A.L., M. Farina, R. Borojevic and M. Klautau. 2006. Occurrence of five-rayed spicules in a calcareous sponge:Sycon pentactinalissp. nov. (Porifera: Calcarea). Cah. Biol. Mar., 47(3):261-270. [ Links ]
Sahidin, I., C.W. Sabandar, R. Wahyuni, R. Hamsidi, M.H. Malaka, B. Sadarun and L.O. Aslan. 2018. A nor steroids from the marine sponge, Clathria species. MJAS, 22(3):375-382. https://doi.org/10.17576/mjas-2018-2203-02 [ Links ]
Sánchez-Lozano, I., C.J. Hernández-Guerrero, M. Muñoz-Ochoa and C. Hellio. 2019. Biomimetic approaches for the development of new antifouling solutions: Study of incorporation of macroalgae and sponge extracts for the development of new environmentally friendly coatings. Int. J. Mol. Sci., 20(19): 4863. https://doi.org/10.3390/ijms20194863 [ Links ]
San Martín, A., J. Rovirosa, I. Vaca, K. Vergara, L. Acevedo, F. Orallo and C.M. Chamy. 2011. New butyrolactone from a marine-derived fungus Aspergillus sp. J. Chil. Chem. Soc., 56(1): 625-627. https://doi.org/10.4067/S0717-97072011000100023 [ Links ]
Santhanam, R., S. Ramesh and A. Sunilson. 2019. Biology and ecology of pharmaceutical marine sponges. CRC Press. 342 p. [ Links ]
Saravanakumar, K., B. Ramkumar and V. Muthuraj. 2016. In vitro antimicrobial potential efficiency of Clathria frondifera marine sponge. Int. J. Res. Pharm. Chem., 6(3):458-464. https://doi.org/10.5958/0974-360X.2020.00664.2 [ Links ]
Selvin, J. and A.P. Lipton. 2004. Biopotentials of secondary metabolites isolated from marine sponges. Hydrobiologia, 513: 231-238. https://doi.org/10.1023/B:hydr.0000018183.92410.21 [ Links ]
Shushizadeh, M.R., S. Behroozi, A A. Behfar and M. Nazemi. 2018. Antibacterial activity and GC-Mass analysis of organic extract from Persian Gulf Haliclona sp. Pharmacophore, 9(2): 19-24. https://pharmacophorejournal.com/3ASNkVr [ Links ]
Sim-Smith, C.C., Hickman Jr. and M. Kelly. 2021. New shallow-water sponges (Porifera) from the Galápagos Islands. Zootaxa, 5012(1): 1-71. https://doi.org/10.11646/zootaxa.5012.1.1 [ Links ]
Solé-Cava, A.M., M. Klautau, N. Boury-Esnault, R. Borojevic and J.P. Thorpe. 1991. Genetic evidence for cryptic speciation in allopatric populations of two cosmopolitan species of the calcareous sponge genusClathrina. Mar. Biol., 111(3):381-386. https://doi.org/10.1007/BF01319410 [ Links ]
Sun, S., C.B. Canning, K. Bhargava, X. Sun, W. Zhu, N. Zhou, Y. Zhang and K. Zhou. 2015. Polybrominated diphenyl ethers with potent and broad spectrum antimicrobial activity from the marine sponge Dysidea. Bioorg. Med. Chem. Lett., 25(10):2181-2183. https://doi.org/10.1016/j.bmcl.2015.03.057 [ Links ]
Tadesse, M. B.Gulliksen. M.B. Strøm, O.B. Styrvold and T. Haug. 2008. Screening for antibacterial and antifungal activities in marine benthic invertebrates from northern Norway. J. Invertebr. Pathol., 99(3): 286-293. https://doi.org/10.1016/j.jip.2008.06.009 [ Links ]
Thiele, J. 1905. Die Kiesel- und Hornschwämme der Sammlung Plate. Zool. Jahrb. Suppl.6 (Fauna Chiliensis III): 407-496, 427-433. [ Links ]
Vacelet, J. and N. Boury-Esnault. 1995. Carnivorous sponges. Nature, 373:333-335. [ Links ]
van Soest, R.W.M., J.N.A. Hooper and F. Hiemstra. 1991. Taxonomy, phylogeny and biogeography of the marine sponge genusAcarnus(Porifera: Poecilosclerida). Beaufortia, 42(3): 49-88. [ Links ]
van Soest, R.W.M., N. Boury-Esnault, J. Vacelet, M. Dohrmann, D. Erpenbeck, N.J. de Voogd, N. Santodomingo, B. Vanhoorne, M. Kelly and J.N.A. Hooper. 2012. Global diversity of sponge (Porifera). PLoS One, 7(4): e35105. https://doi.org/10.1371/journal.pone.0035105 [ Links ]
van Soest, R.W.M., N. Boury-Esnault, J.N.A. Hooper, K. Rützler, N.J. de Voogd, B. Álvarez, E. Hajdu, A.B. Pisera, R. Manconi, C. Schönberg, M. Klautau, M. Kelly, J. Vacelet, M. Dohrmann, M.C. Díaz, P. Cárdenas, J.L. Carballo, P. Ríos, R. Downey and C.C. Morrow. 2020. World Porifera database. Accessed at http://www.marinespecies.org/porifera on 2020-11-22. [ Links ]
Viegelmann, C., J. Parker, T. Ooi, C. Clements, G. Abbott, L. Young, J. Kennedy, A.D.W. Dobson, A.D.W. and R. Edrada-Ebel. 2014. Isolation and identification of antitrypanosomal and antimycobacterial active steroids from the sponge Haliclona simulans. Mar. Drugs, 12:2937-2952. https://doi.org/10.3390/md12052937 [ Links ]
von Lendenfeld, R. 1910. The Sponges. 2. The Erylidae. In: Reports on the Scientific Results of the Expedition to the Eastern Tropical Pacific, in charge of Alexander Agassiz, by the U.S. Fish Commission Steamer ‘Albatross’, from October, 1904, to March, 1905, Lieut. Commander L.M. Garrett, U.S.N., Commanding, and of other Expeditions of the Albatross, 1888-1904. (21). Mem. Mus. Comp. Zoology Harv. Coll., 41(2):261-324, pls 1-8. [ Links ]
von Lendenfeld, R. 1915. The Sponges. 3. Hexactinellida. In: Reports on the Scientific Results of the Expedition to the Eastern Tropical Pacific, in charge of Alexander Agassiz, by the U.S. Fish Commission Steamer ‘Albatross’, from October, 1904, to March, 1905, Lieut. Commander L.M. Garrett, U.S.N., Commanding, and of other expeditions of the ‘Albatross’, 1891-1899. (29). Mem. Mus. Comp. Zoology Harv. Coll., 42(2). pls.1-109, 396 p. http://www.marinespecies.org/aphia.php?p=sourcedetails&id=7835 [ Links ]
Vos, L., K. Rützler, N. Boury-Esnault, C. Donadey and J. Vacelet. 1991. Atlas of sponge morphology. Atlas de morphologie des éponges. Washington. Smithsonian Institution Press. 117 p. [ Links ]
Warsidah. Masrianih, M.S.J. Sofiana, I. Safitri, A. Sapar, A.B. Aritonang, Y. Saputri and D. Fadly. 2020. Protein isolation from sponge Niphates sp. as an antibacterial and antioxidant. Sys. Rev. Pharm. 11(9): 518-521 [ Links ]
Wei, X., N. Henriksen, J. Skalicky, M. Harper, T. Cheatham, C. Ireland and R. Wagoner. 2011. Araiosamines A-D: Tris-bromoindole cyclic guanidine alkaloids from the marine sponge Clathria (Thalysias) araiosa. J. Org. Chem., 76(14):5515-5523. https://doi.org/10.1021/jo200327d [ Links ]
WHO. 2014. Antimicrobial resistance: global report on surveillance. Technical report, World Health Organization. 232 p. https://apps.who.int/iris/handle/10665/112642 [ Links ]
WHO. 2015. Global Action Plan on Antimicrobial Resistance. Technical report, World Health Organization, 45 p. https://www.who.int/publications/i/item/9789241509763 [ Links ]
Wilson, H.V. 1904. Reports on an exploration off the west coast of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, by the US Fish Commission steamer” Albatross” during 1891, Lieut. Commander Z.L. Tanner, U.S.S., Commanding. XXVI. The Sponges. Mem. Mus. Comp. Zoology Harv. Coll., 30:1-164 [ Links ]
Woo, J.K., C.K. Kim, C. H. Ahn, D.C. Oh, K.B. Oh and J. Shin. 2015. Additional sesterterpenes and a nortriterpene saponin from the spongeClathria gombawuiensis. J. Nat. Prod., 78(2):218-224. https://doi.org/10.1021/np500753q [ Links ]
Zuleta, I., M. Vitelli, R. Baggio, M. Garland, A. Seldes and J. Palermo. 2002. Novel pteridine alkaloids from the sponge Clathria sp. Tetrahedron, 58:4481-4486. https://doi.org/10.1016/S0040-4020(02)00392-7 [ Links ]
Recibido: 18 de Abril de 2021; Aprobado: 14 de Marzo de 2022











 texto em
texto em