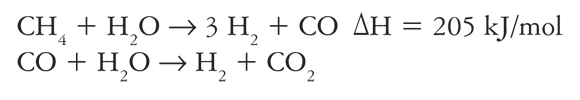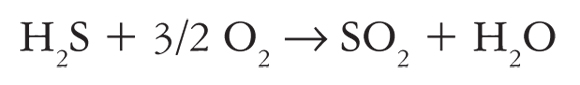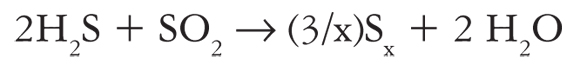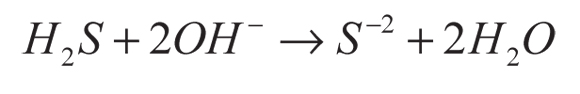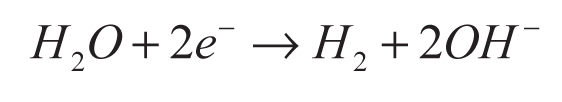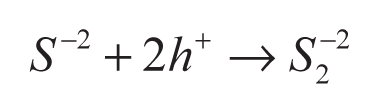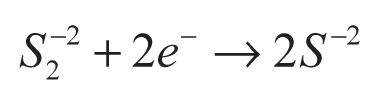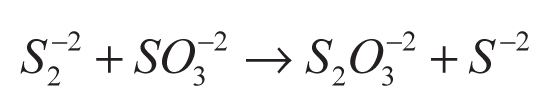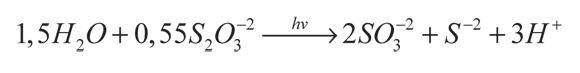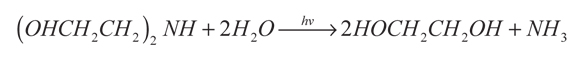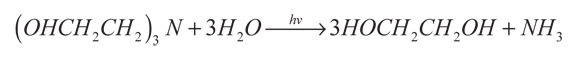Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Universidad
Print version ISSN 0123-2126
Ing. Univ. vol.15 no.1 Bogotá Jan./June 2011
Revisión de los materiales fotocatalíticos para la producción de hidrógeno a partir de H2S1
Review of Photocatalytic Materials for Hydrogen Production from H2S2
Revisão dos materiais fotocatalíticos para a produção de hidrogênio a partir de H2S3
Laura Milena Corredor-Rojas4
1Instituto Colombiano del Petróleo, Santander, Colombia.
2Submitted on October 26, 2010. Accepted on January 27, 2011. This article is the result of the research activity of the Instituto Colombiano del Petróleo, Santander, Colombia.
3Data de recepção: 26 de outubro de 2010. Data de aceitação: 27 de janeiro de 2011. Instituto Colombiano do Petróleo, Santander, Colômbia.
4Ingeniera Química, Universidad Industrial de Santander, Bucaramanga, Colombia. Magíster en Ingeniería Química, Universidad Industrial de Santander. Estudiante del Doctorado en Ingeniería Química, Universidad Industrial de Santander. Instituto Colombiano del Petróleo (Ecopetrol S. A.), Santander, Colombia. Correo electrónico: laura.corredor@ecopetrol.com.co.
Fecha de recepción: 26 de octubre de 2010. Fecha de aceptación: 27 de enero de 2011.
Resumen
A partir del trabajo realizado por Fujishima y Honda, en 1972, en el cual se consiguió disociar electroquímicamente el agua sobre un electrodo de TiO2, numerosos investigadores han estudiado la disociación del agua y del H2S usando fotoelectrodos o fotocatalizadores para la producción de hidrógeno. Las investigaciones actuales se enfocan en la síntesis de un material estable y con capacidad de absorber luz visible. Al igual que la actividad catalítica del material, el diseño del reactor influye en la posibilidad de aplicar las reacciones fotocatalíticas a los procesos industriales. Hasta el momento han sido ensayados diversos tipos de reactores, pero muy pocos trabajos han logrado reproducir exitosamente los resultados obtenidos en el laboratorio. En este artículo se presenta una revisión de la situación actual de los materiales heterogéneos desarrollados para la producción de hidrógeno a partir de la conversión directa e indirecta del sulfuro de hidrógeno. Adicionalmente, se plantean esquemas en los cuales es posible integrar los procesos fotoasistidos a los industriales empleados para la disposición del H2S.
Palabras clave: Fotocatálisis, sulfuro de hidrógeno, hidrógeno.
Abstract
Based on the work carried out by Fujishima and Honda (1972), who accomplished the electrochemical photolysis of water on a TiO2 electrode, numerous researchers have extensively studied water and sulfide hydrogen splitting by using semiconductor photo-electrodes and photocatalysts for producing hydrogen. Current research is focused on the development of a stable material with visible-light response. Both the catalytic activity of the semiconductor and the design of the reactor influence the possibility of applying photocatalytic reactions to industrial processes. Different types of reactors have been tried but, so far, a successful laboratory photocatalysis setup has not been scaled up to an industrially relevant scale. This paper presents a review of heterogeneous photocatalyst materials for hydrogen production based on direct and indirect conversion of hydrogen sulfide. Additionally, this study proposes a number of schemes for integrating photo-assisted reactions with industrial processes for H2S treatment.
Key words: Photocatalysis, hydrogen sulfide, hydrogen.
Resumo
A partir do trabalho realizado por Fujishima e Honda, em 1972, no conseguiu-se dissociar eletroquimicamente a água sobre um eletrodo de TiO2, numerosos pesquisadores tem estudado a dissociação da água e do H2S usando foto-eletrodos ou foto-catalizadores para a produção de hidrogênio. As pesquisas atuais enfocam-se na síntese de um material estável e com capacidade de absorver luz visível. Da mesma forma que a atividade catalítica do material, o desenho do reator influi na possibilidade de aplicar as reações fotocatalíticas aos processos industriais. Até o momento foram testados diversos tipos de reatores, mas muito poucos trabalhos conseguiram reproduzir com sucesso os resultados obtidos no laboratório. Neste artigo apresenta-se uma revisão da situação atual dos materiais heterogêneos desenvolvidos para a produção de hidrogênio a partir da conversão direta e indireta do sulfeto de hidrogênio. Adicionalmente, são propostos esquemas nos quais é possível integrar os processos fotoassistidos aos industriais empregados para a disposição do H2S.
Palavras chave: Foto-catálise, sulfeto de hidrogênio, hidrogênio.
Introducción
La producción sostenible de hidrógeno es un objetivo fundamental para el desarrollo de una nueva alternativa energética que contribuya al abastecimiento de la demanda mundial, la cual viene aumentándose por el incremento de la población mundial y por el crecimiento económico de países como India y China.
Aproximadamente el 96% del hidrógeno producido en el mundo se obtiene a partir de combustibles fósiles, y el 4%, por la electrólisis del agua (Gupta, 2009). El proceso principal para su obtención es el reformado del gas natural (ecuación 1), que comercialmente es eficiente, debido a que consume menor cantidad de energía por mol de H2 producida y genera un mayor número de moles de H2 por mol de materia prima en comparación con otros procesos. Las desventajas de los procesos convencionales son los altos consumos de energía y la generación de CO2. Para reducir estos efectos se están investigando diversos procesos para su adaptación con fuentes energéticas renovables. Ejemplo de esto son las investigaciones sobre gasificación solar de carbón o biomasa (Yoshida et al., 1999; Trommer et al., 2005; Z'Graggen et al., 2006; Piatkowski y Steinfeld, 2008), el reformado solar de metano con vapor (Muir et al., 1994; Dahl et al., 2001; Berman et al., 2006; Kodama et al., 2003) o con CO2 (Kodama et al., 2002; Wörner y Tamme, 1998) y la electrólisis del agua cuya energía eléctrica provenga de la energía solar o de la eólica (Muradov y Veziroglu, 2008).
(1)
Dentro de las alternativas para la producción limpia de hidrógeno se encuentran los procesos fotocatalíticos, en los cuales las reacciones son inducidas por la luz solar y tienen lugar en la superficie de un catalizador. En este campo, la reacción más estudiada ha sido la disociación del agua. Dentro de los materiales desarrollados para esta reacción se encuentran el dióxido de titanio, preferible por su resistencia a la corrosión, su estabilidad y su bajo precio (van Gerven et al., 2007), los tantalatos de metales alcalino y alcalinotérreos (NaTaO3) (Kudo, 2006; Kato y Kudo, 2001) y los sulfuros metálicos (CdS, MoS2, ZnS) (Kudo y Miseki, 2009; Navarro et al., 2009; Shengli et al., 2009).
También se ha investigado la disociación del H2S, un producto de desecho que se genera en grandes cantidades en la industria petrolera y metalúrgica, en las plantas de gas y en las plantas generadoras de electricidad a través de la energía geotérmica. Actualmente, en la industria el H2S es convertido en agua y azufre sólido mediante el proceso de Claus (ecuación 4) (Elsner et al., 2003). Las principales desventajas de este proceso son los elevados costos de operación asociados al tratamiento químico de las corrientes y que no se puede recuperar el hidrógeno.
(2)
(3)
(4)
Teniendo en cuenta el potencial de las reacciones fotoasistidas para la producción limpia de hidrógeno, el presente artículo se enfoca en la presentación y análisis de los fotocatalizadores desarrollados para la conversión directa o indirecta del H2S. Adicionalmente, se presentan esquemas en los cuales se pueden integrar los procesos fotocatalíticos con los industriales para la disposición del H2S.
1. Principios básicos de la fotocatálisis
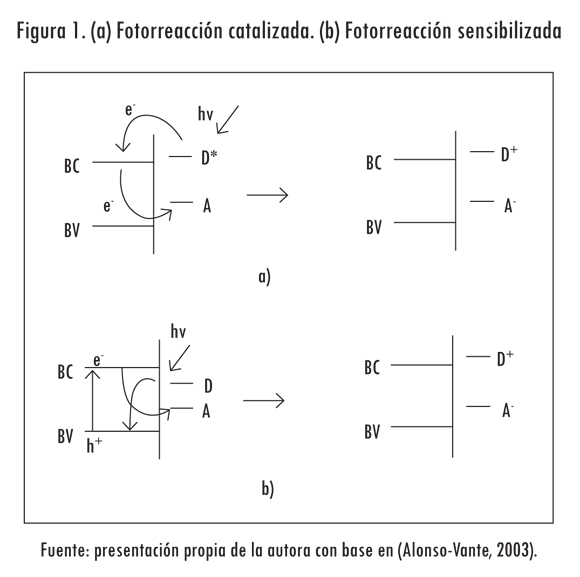
En el término fotocatálisis se incluyen todos los procesos químicos que ocurren bajo irradiación y que utilizan partículas de semiconductor dispersas en un fluido. Por esta razón, usualmente se refiere a este campo de estudio como fotocatálisis heterogénea. Dependiendo del sitio donde se produzca la excitación inicial, la fotocatálisis puede dividirse en dos tipos: la fotorreacción catalizada o la sensibilizada. En la primera, la fotoexcitación inicial ocurre en la molécula adsorbida en la superficie del catalizador (Figura 1a), y en la segunda, la excitación tiene lugar en el catalizador, de manera que este transfiere electrones o energía a la molécula adsorbida (Figura 1b). Este último caso es el más general en los procesos fotocatalíticos en fase heterogénea.
Los principales procesos que tienen lugar en las reacciones fotocatalíticas son descritos a continuación (De, Roy y Bhattacharya, 1995):
- Absorción del fotón (hv) para generar el par electrón-hueco (e- -h+). La formación del par se dará si la energía del fotón incidente es superior a la diferencia de energía entre la banda de valencia y la banda de conducción del semiconductor.
- Reacciones de oxidación y reducción producidas por los electrones y los huecos fotogenerados.
- Reacciones de recombinación de cargas tanto en la superficie como en el seno de la partícula.
2. Diseño de sistemas fotocatalíticos
2.1 Dopaje aniónico o catiónico
El reemplazo de cationes o de aniones en la estructura cristalina de un semiconductor crea niveles de energía dentro de su ancho de banda y ello facilita la absorción de la luz visible. Usualmente el reemplazo de aniones genera menos centros de recombinación, por lo cual es más efectivo para mejorar la actividad catalítica que el dopaje catiónico.
2.2 Quimisorción o fisisorción de pigmentos
Este proceso corresponde a una fotorreacción catalizada en la que se produce la fotosensibilización del semiconductor por una molécula adsorbida. El pigmento adsorbe un fotón de radiación menos energética que la requerida para excitar al semiconductor, por lo que genera la transición de un electrón que pasa del pigmento hacia la banda de conducción del semiconductor, que lo cede posteriormente a la especie oxidante del electrólito.
2.3 Sistema de semiconductores acoplados
Estos sistemas se basan en el acoplamiento de un semiconductor de amplio ancho de banda (absorbe luz UV) con uno de estrecho ancho de banda (absorbe luz VIS), el cual debe tener un nivel de banda de conducción más negativo (Navarro et al., 2009). De esta manera, los electrones del semiconductor de menor ancho de banda pasan al otro semiconductor e incrementan la capacidad de absorción del sistema. Estos sistemas también se usan para mitigar las reacciones de recombinación.
2.4 Nanodiseño
El tamaño de partícula y la pureza de los fotocatalizadores deben tenerse en cuenta para mejorar la eficiencia de los fotocatalizadores. Los defectos en la estructura cristalina del fotocatalizador actúan como centros de recombinación entre los electrones y los huecos fotogenerados, lo que resulta en un decrecimiento de la actividad fotocatalítica. Por otra parte, si las partículas son más pequeñas, la recombinación disminuye, debido a que la distancia en la que deben migrar los electrones y los huecos fotogenerados es más corta (Kudo y Miseki, 2009).
2.5 Cocatalizadores en la superficie del semiconductor
La absorción en la superficie del fotocatalizador puede mejorarse por la presencia de metales nobles u óxidos de metálicos (Pt, Rh, NiO, RuO2, entre otros), debido a que capturan los electrones de la banda de conducción o los huecos de la banda de valencia y disminuyen las reacciones de recombinación.
2.6 Soluciones sólidas
Se forman a partir de fotocatalizadores con estrecho y amplio ancho de banda que tengan similar estructura cristalina. El resultado es un fotocatalizador cuya banda de valencia (BV3) y de conducción (BC3) se encuentran entre las respectivas bandas de los fotocatalizadores que la componen. De esta forma, el ancho de banda de las soluciones sólidas se modifica y cambia su composición (Tsuji et al., 2004).
3. Fotocatalizadores desarrollados para la disociación del H2S
La producción fotocatalítica de hidrógeno a partir de H2S se puede realizar por conversión directa o indirecta para producir hidrógeno-azufre o hidrógenotiosulfato. A continuación se presentan y analizan los materiales desarrollados para estos dos tipos de conversión.
3.1 Conversión indirecta
En la conversión indirecta, el ácido sulfhídrico se disuelve en una solución básica para producir iones S-2 y/o HS- (ecuación 5), usados como agentes de sacrificio en la disociación del agua (Jang et al., 2007a). La función de los agentes de sacrificio es evitar la corrosión de los sulfuros (CdS y ZnS) empleados como fotocatalizadores en esa reacción (ecuaciones 6-9).
(5)
(6)
(7)
(8)
(9)
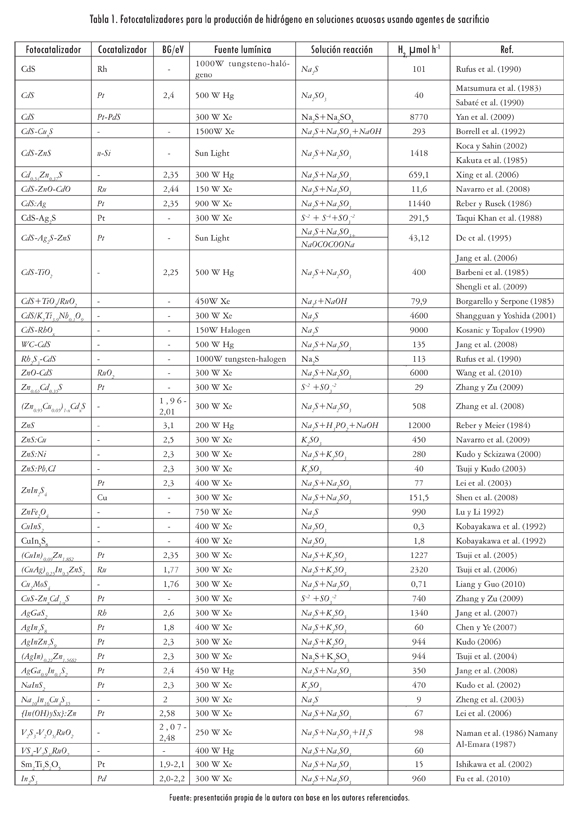
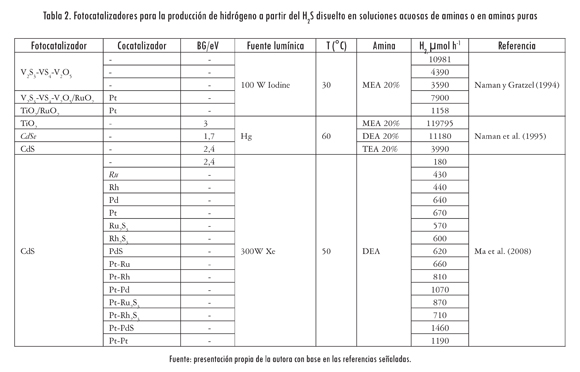
En la Tabla 1 se presentan algunos de los materiales reportados para la producción de hidrógeno en soluciones acuosas usando agentes de sacrificio. Como se observa, los sulfuros son los compuestos más utilizados, por su capacidad de absorber luz visible -y dentro de este grupo el más estudiado es el CdS-. Para mejorar la actividad catalítica del CdS se han ensayado diversos mecanismos, como la variación de los métodos de preparación, la adición de cocatalizadores (Pt y Rh), la combinación con otros semiconductores (TiO2, ZnO y CdO) y la incorporación de elementos para formación de soluciones sólidas (Cd1-xZnxS).
El método de preparación de los fotocatalizadores desempeña un papel fundamental en el rendimiento, debido a que a través de él se pueden modificar el tamaño de partícula y la cristalinidad del fotocatalizador, propiedades relacionadas con la actividad catalítica (Naman, 1992). Un ejemplo de esto es el estudio realizado por Borrell et al. (1992), el cual mostró que con el aumento de la temperatura de tratamiento del CdS se reducía la producción de H2, debido a que se obtenían partículas de fotocatalizador más grandes. Por otra parte, Vucemilovic, Vukelic y Rajh (1988) mostraron que la actividad catalítica se incrementa en partículas de diámetro entre 10 y 100 nm y que permanece constante a diámetros menores.
La actividad catalítica del CdS ha mejorado con la inclusión de otros semiconductores (TiO2, ZnO y CdO), que pueden actuar como receptores de los electrones fotogenerados por el CdS (y reducir las reacciones de recombinación) o pueden catalizar la transferencia de los huecos fotogenerados desde la banda de conducción del CdS a la solución reaccionante. En el caso del fotocatalizador CdS-TiO2, el TiO2 actúa como el receptor de electrones; mientras que en el sistema CdS-RuO2, el RuO2 actúa como el catalizador para la transferencia de los huecos.
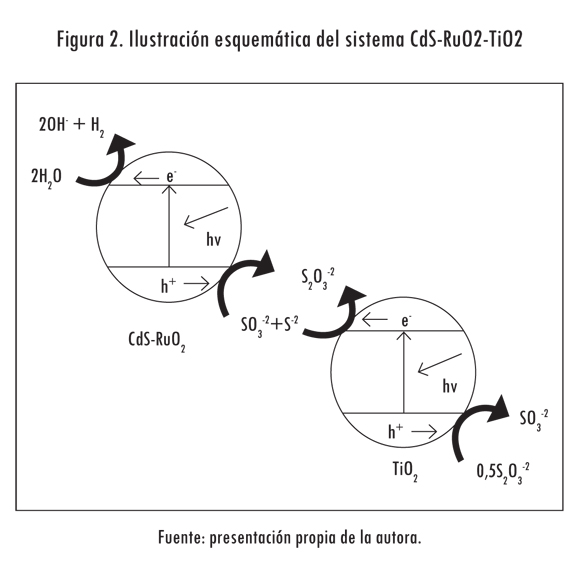
Para utilizar estos dos efectos, Borgarello y Serpone (1985) probaron la mezcla CdS + TiO2/RuO2. En este caso se observó que la reducción del H+ y la oxidación de los iones sulfito y sulfuro ocurre en las partículas de CdS-RuO2, mientras que en las de TiO2 se lleva a cabo el ciclo del tiosulfato (figura 2). Este ciclo incrementa la producción de hidrógeno, produce SO3-2 (ecuación 10) y beneficia las reacciones principales, debido a que previene el oscurecimiento de la solución reaccionante por la formación de polisulfuros. Ello evita que la cantidad de luz absorbida por el fotocatalizador decrezca con el paso del tiempo.
(10)
Debido a que el CdS y el ZnS poseen la misma estructura cristalina, estos dos compuestos pueden formar soluciones sólidas, activas para la producción de hidrógeno. Valle et al. (2009) investigaron las propiedades fotocatalíticas de las soluciones de Cd1-x Znx S con diferentes concentraciones de Zn (0,2 < X < 0,35). El resultado observado fue el incremento en la producción de hidrógeno (entre 150 y 360 mmol/h), a medida que se aumentó la concentración de Zn entre 0,2 y 0,3. El incremento de la actividad con el aumento de la concentración del Zn hasta 0,3 se debe a la modificación de la cantidad de energía de la banda de conducción, mientras que la disminución de la actividad para la muestra con concentración de Zn igual a 0,35 se atribuye a una disminución del número de fotones disponibles con energía mayor que el ancho de banda de la solución sólida y al aumento del tamaño del cristal.
Otra soluciones sólidas estudiadas son las formadas por el ZnS con compuestos como el AgIns2 y el CuInS2. Tsuji et al. (2004) estudiaron la actividad fotocatalítica del (Ag)InxZn2(1 x)S2 Ellos mostraron que la absorción óptica de estos materiales puede ser ajustada mediante la composición de la solución sólida y que la producción de H2 se incrementa 2,5 veces hasta alcanzar un QY del 20% a 420 nm, con la adición de Pt. Otros estudios presentados por los mismos autores (Tsuji et al., 2005) muestran actividad a la luz visible de la solución (CuIn)xZn(1-x)S2 y un QY de 12,5% a 420 nm, con la adición de Pt.
3.2 Conversión directa
Naman, Al-Mishhadani y Al-Shamma (1995) estudiaron la conversión directa del H2S disuelto en soluciones acuosas de aminas al 20% (MEA, DEA y TEA), usando CdS, CdSe, TiO2, modificando la temperatura del sistema entre 30 y 80 °C. La mayor producción de hidrógeno (3000 µL/h) se obtuvo con el TiO2 en la solución de MEA a 60 °C, y la menor producción (5 µL/h), con el CdS en la solución de TEA a 60 °C. Los subproductos fueron etilenglicol y amoniaco generados mediante las siguientes reacciones:
(11)
(12)
Ma et al. (2008) consiguieron disociar directamente el H2S disuelto en MEA, DEA y TEA pura usando fotocatalizadores basados en CdS a temperatura ambiente. La mayor producción de hidrógeno (1460 jumol/h) se obtuvo con el fotocatalizador Pt-PdS/CdS en DEA (Tabla 2). Según estos resultados, la DEA es un medio excelente para la transferencia de los protones y evita que los polisulfuros consuman los electrones fotogenerados.
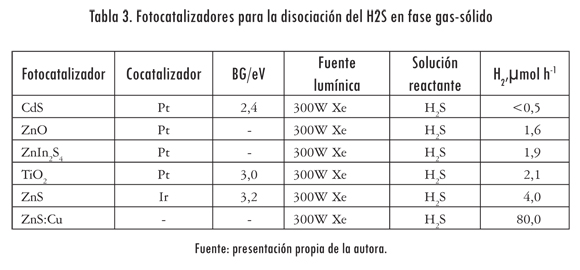
Muy pocos autores han reportado la disociación del H2S en fase gas-sólido. En la tabla 3 se muestran los fotocatalizadores ensayados por Guijun et al. (2008). Los resultados de las pruebas mostraron que el mejor fotocatalizador era el ZnS y que la producción de hidrógeno se incrementaba 20 veces al doparlo catiónicamente con Cu+2.
La disociación del H2S disuelto en agua también se ha analizado. En el estudio de Jang et al. (2007) usando un sistema acoplado de CdS-TiO2, la cantidad de hidrógeno producida fue muy baja, debido al pH ácido de la solución reaccionante (pH de 4,05). Tal como lo demostró Matsumura, Saho y Tsubomura (1983), en soluciones que contienen agentes de sacrificio con CdS platinizado, la producción de hidrógeno está relacionada con el pH de la solución reaccionante. En ese estudio, la producción de hidrógeno estuvo entre 0 y 0,7 mmol para pH entre 2 y 14 (se presentó un máximo en pH 8). Esto se debe a que en soluciones con pH menores a 8, los electrones fotogenerados son consumidos en la reacción de reducción del sulfito y no en la reacción de producción de hidrógeno; mientras en soluciones con valores más altos se modifica la posición de la banda de conducción, que llega a ser más negativa que el potencial de H+/H2. Ello implica el decrecimiento de la reactividad del fotocatalizador.
4. Papel de los procesos fotocatalíticos en la disposición de H2S en la industria
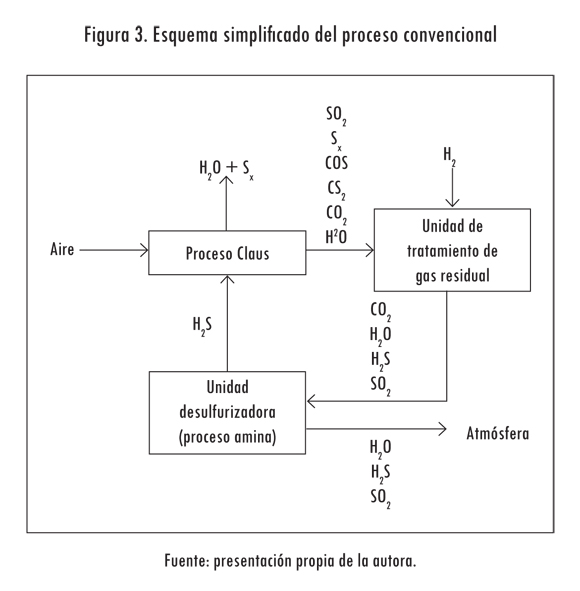
La recuperación del azufre contenido en los gases agrios de las corrientes de desecho incorpora valor económico a la producción obtenida en las refinerías y contribuye a mejorar la calidad del aire, pues se elimina la incineración del producto en las antorchas de combustión de las refinerías (Figura 3). La recuperación y conversión de gases agrios se realiza mediante el proceso Claus en dos etapas. La primera es un proceso térmico que se produce en un horno de diseño especial, a temperaturas que oscilan entre 900 y 1300 °C. Aquí se logra una conversión de hasta el 70% en peso del azufre ingresado como carga a la unidad. Simultáneamente, el calor producido por la reacción se aprovecha para generar vapor de alta presión. La segunda etapa de recuperación se logra por medio de reactores catalíticos en los cuales se completa la reacción, que alcanza una conversión del 96% sobre la carga original. La corriente remanente se denomina gas de cola y se compone de H2S, H2O y SO2.
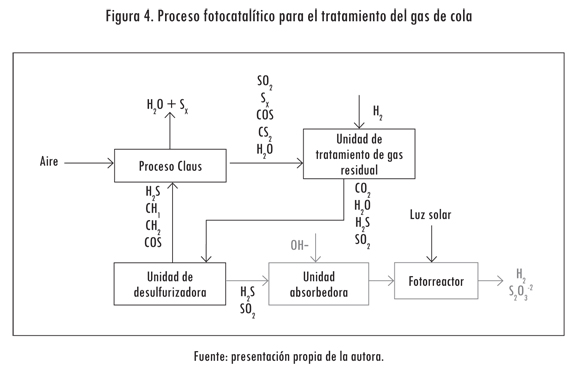
Una de las alternativas para integrar las reacciones fotocatalíticas al proceso de Claus, propuesta por Cervera-March et al. (1992), es mezclar el gas de cola con una pequeña cantidad de H2S y absorber esta corriente con una corriente alcalina acuosa (Figura 4), para obtener la solución de sulfito + sulfuro, la cual es requerida para producir hidrógeno y tiosulfato (ecuaciones 5-9).
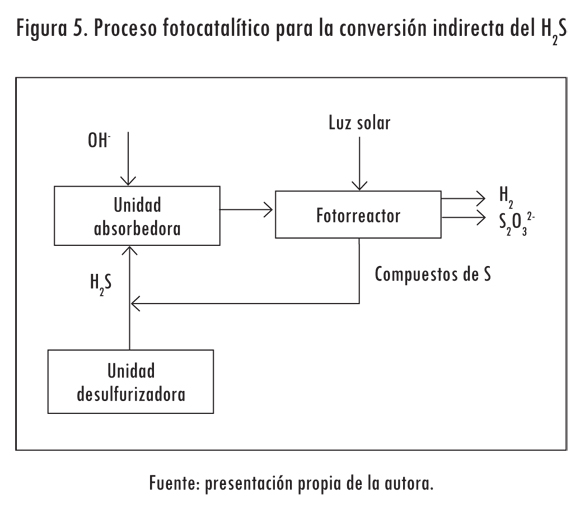
Otra alternativa es absorber con una solución alcalina acuosa la corriente de H2S proveniente de las unidades desulfurizadoras, con lo cual se obtendría un sistema similar al presentado (Figura 5). Desde luego, la cantidad de H2S tratada será mayor (Tambwekar y Subrahmanyam, 1997).
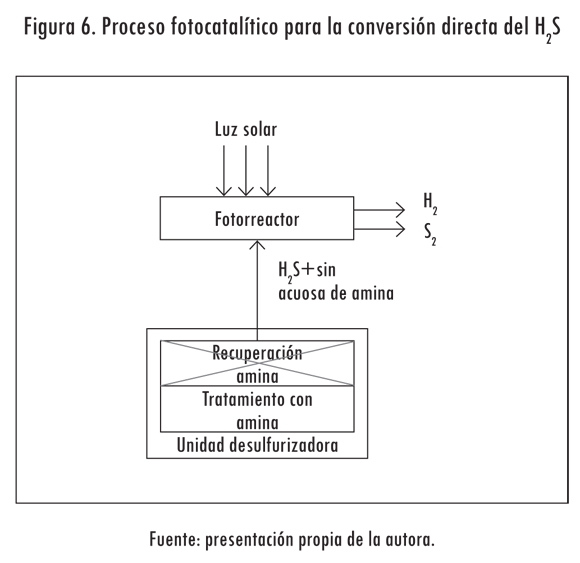
Por último, se presenta la posibilidad de usar la corriente de H2S + solución acuosa de amina proveniente de la unidad de desulfurización para producir hidrógeno (Figura 6), usando los fotocatalizadores desarrollados para la conversión directa del H2S.
En general, existen diversas alternativas para integrar las reacciones fotocatalíticas a los procesos industriales, lo que limita su aplicación son los problemas asociados al escalado de dichos procesos. Los principales problemas son la dificultad para reproducir los resultados de laboratorio y la baja eficiencia de los sistemas fotocatalíticos, este último asociado al contacto limitado entre los reactivos y el fotocatalizador y a la baja eficiencia de iluminación (van Gerven, et al., 2007). Para resolverlo se han propuesto múltiples reactores (anulares, monolíticos, de inmersión, de fibra óptica, disco rotativo, entre otros); sin embargo, la reactividad del fotocatalizador, en combinación con los fotorreactores, se encuentra todavía entre 0,05 y 0,1 mol/m3reactor*s, cifra que según diversos autores debe ser incrementada entre 100 y 1000 veces para hacer posible la implementación de este tipo de reacciones en procesos industriales.
5. Conclusiones
La fotodisociación del H2S es una alternativa promisoria para aprovechar la energía del sol y, al mismo tiempo, hacer viable la economía del hidrógeno. Adicionalmente, puede ofrecer una alternativa para la fotodisociación del agua. Desde el descubrimiento del efecto Honda-Fujishima, se han desarrollado múltiples materiales para la producción fotocatalítica de hidrógeno a partir de agua y de H2S. Dichos estudios han permitido determinar que la viabilidad de estos procesos depende de las características del fotocatalizador y del diseño del reactor. Mejorar las propiedades del fotocatalizador requiere desarrollos basados en el entendimiento de aspectos como los mecanismos de transferencia de carga, la estructura y los defectos superficiales del fotocatalizador y los mecanismos de reacción molecular involucrados en la oxidación y en la reducción de las diferentes especies sobre el fotocatalizador.
Los fotocatalizadores más prometedores son los sulfuros metálicos, debido a su respuesta a la luz visible y a su funcionamiento estable durante mucho tiempo. También lo son las soluciones sólidas a partir de dos o más semiconductores, debido a que sus características ópticas y fotocatalíticas se pueden ajustar a través de sus componentes o su contenido.
Por otra parte, los estudios sobre diseño de fotorreactores deberán ser intensificados, debido que hasta la fecha la investigación básica realizada en laboratorio se ha basado en dispositivos experimentales, cuyo objetivo principal es obtener unas condiciones que permitan una adecuada reproducibilidad de resultados para determinar la influencia de los diferentes parámetros en la reacciones fotocatalíticas y no se han enfocado en su eficiencia. Este planteamiento, que resulta adecuado desde un punto de vista científico, no es suficiente cuando se intenta realizar un cambio de escala para poder llevar un resultado de laboratorio a la industria.
Referencias
ALONSO-VANTE, N. Electroquímica y electrocatálisis. Materiales: aspectos fundamentales y aplicaciones. Vol. Ib. Buenos Aires: s. e., 2003. [ Links ]
BARBENI, M. et al. Hydrogen from hydrogen sulfide cleavage. Improved efficiencies via modification of semiconductor particulates. International Journal of Hydrogen Energy, 1985, núm. 10, pp. 249-253. [ Links ]
BERMAN, A.; KARN, R. y EPSTEIN, M. A new catalyst system for high-temperature solar reforming of methane. Energy and Fuels. 2006, vol. 20, pp. 455-462. [ Links ]
BORGARELLO, E. y SERPONE, N. Hydrogen production through microheterogeneous photocatalysis of hydrogen sulfide cleavage: The thyosulfate cycle. International Journal of Hydrogen Energy. 1985, núm. 10, pp. 737-741. [ Links ]
BORRELL, L.; CERVERA-MARCH, S.; GIMÉNEZ, J. y SIMARRO, R. A comparative study of CdS-based semiconductor photocatalysts for solar hydrogen production from sulphide+sulphite substrates. Solar Energy Materials and Solar Cells. 1992, núm. 25, pp. 25-39. [ Links ]
CERVERA-MARCH, L. et al. Solar hydrogen photoproduction from sulphide/sulphite substrate. International Journal of Hydrogen Energy. 1992, vol. 17, núm. 9, pp. 683-688. [ Links ]
CHEN, D. y YE, J. Photocatalytic H2 evolution under visible light irradiation on Ag In5S8 photocatalyst. Journal of Physics and Chemistry of Solids. 2007, núm. 68, pp. 2317-2320. [ Links ]
DAHL, J.; TAMBURINI, J. y WEIMER, A Solar-thermal processing of methane to produce hydrogen and syngas. Energy and Fuels. 2001, núm. 15, pp. 1227-1232. [ Links ]
DE, G.; ROY, A. y BHATTACHARYA, S. Photocatalytic production of hydrogen and concomitant cleavage of industrial waste hydrogen sulphide. International Journal of Hydrogen Energy. 1995, vol. 20, núm. 2, pp. 127-131. [ Links ]
ELSNER, M.; MENGEB, M.; MÜLLER, C. y AGAR, D. The Claus process: teaching an old dog new tricks. Catalysis Today. 2003, vol. 79, núm. 80, pp. 487-494. [ Links ]
FU, X et al. Photocatalytic performance of tetragonal and cubic β-In2S3 for the water splitting under visible light irradiation. Applied Catalysis B: Environmental. 2010, núm. 95, pp. 393-399. [ Links ]
FUJISHIMA, A. y HONDA, K. Electrochemical photolysis of water at a semiconductor electrode. Nature. 1972, núm. 238, pp. 37-38. [ Links ]
GERVEN, T. et al. A review of intensification of photocatalytic processes. Chemical Engineering and Processing. 2007, núm. 46, pp. 781-789. [ Links ]
GRIGORIEV, S.; POREMBSKY, V. y FATEEV, V. Pure hydrogen production by PEM electrolysis for hydrogen energy. International Journal of Hydrogen Energy. 2006, vol. 31, núm. 2, pp. 171-175. [ Links ]
GUIJUN, M. et al. Photocatalytic splitting of H2S to produce hydrogen by Gas-Solid phase reaction. Chinese Journal of Catalysis. 2008, núm. 29, pp. 313-315. [ Links ]
GUPTA, R. Hydrogen fuel: production, transport and storage. s. l.: CRC Press, 2009. [ Links ]
ISHIKAWA, A. et al. Oxysulfide Sm2Ti2S2O5 as a stable photocatalyst for water oxidation and reduction under visible light irradiation (λ≤650 nm). Journal of the American Chemical Society. 2002, núm. 124, pp. 13547-13553. [ Links ]
JANG, J. et al. AgGaS2-type fotocatalysts for hydrogen production under visible light. Effects of post-synthetic H2S treatment. Journal of Solid State Chemistry. 2007, núm. 180, pp. 1110-1118. [ Links ]
JANG, J. et al. Indium induced band gap tailoring in AgGa1-xInxS2 chalcopyrite structure for visible light photocatalysis. Journal of Physical Chemistry. 2008, núm. 128, pp. 154717-154723. [ Links ]
JANG, J. et al. Role of platinum-like tungsten carbide as cocatalyst of CdS photocatalyst for hydrogen production under visible light irradiation. Applied Catalysis A: General. 2008, núm. 346, pp. 149-154. [ Links ]
JANG, J.; KIM, H.; BORSE, P. y LEE, J. Simultaneous hydrogen production and decomposition of H2S dissolved in alkaline water over Cd-TiO2 composite photocatalysts under visible light irradiation. International Journal of Hydrogen Energy. 2007, núm. 32, pp. 4786-4791. [ Links ]
JANG, J.; LI, W ; OH, S. y LEE, J. Fabrication of CdS/TiO2 nano-bulk composite photocatalysts for hydrogen production from aqueous H2S Solutions under visible light. Chemical, Physics Letters. 2006, núm. 425, pp. 278-282. [ Links ]
KAKUTA, N. et al. Photoassisted hydrogen production using visible light and coprecipitated ZnS-CdS without noble metal. Journal of Physical Chemistry. 1985, núm. 89, pp. 732-734. [ Links ]
KATO, H. y KUDO, A. Water splitting into H2 and O2 on Alkali Tantalate Photocatalysts ATaO3 (A) Li, Na, and K. The Journal of Physical Chemistry B. 2001, núm. 105, pp. 4285-4292. [ Links ]
KOBAYAKAWA, K.; TERANISHI, A.; TSURUMAKI, T.; SATO, Y y FUJUSHIMA, A. Photocatalytic activity of CuInS2 and CuIn5S8. Electrochimica Acta. 1992, vol. 37, núm. 3, pp. 465-467. [ Links ]
KOCA, A. y SAHIN, M. Photocatalytic hydrogen production by direct sun light from sulfide/ sulfite solution. International Journal of Hydrogen Energy. 2002, núm. 27, pp. 363-367. [ Links ]
KODAMA, T.; OHTAKE, H.; SHIMIZU, K. y KITAYAMA, Y. Nickel catalyst driven by direct light irradiation for solar CO2-reforming of methane. Energy and Fuels. 2002, núm. 16, pp. 1016-1023. [ Links ]
KODAMA, T.; KIYAMA, A. y SHIMIZU, K. Catalytically activated metal foam absorber for light-to-chemical energy conversion via solar reforming of methane. Energy and Fuels. 2003, núm. 17, pp. 13-17. [ Links ]
KOSANIC, M. y TOPALOV, A. Photochemical hydrogen production from CdS/RhOx/Na2S. dispersions. International Journal of Hydrogen Energy. 1990, núm. 15, pp. 319-323. [ Links ]
KUDO, A. Development of photocatalyst materials for water splitting. International Journal of Hydrogen Energy. 2006, núm. 31, pp. 197-202. [ Links ]
KUDO, A. y MISEKI, Y. Heterogeneous photocatalyst materials for water splitting. Chemical Society Reviews. 2009, núm. 38, pp. 253-278. [ Links ]
KUDO, A. y SCKIZAWA, M. Photocatalytic H2 evolution under visible light irradiation on Ni-doped ZnS photocatalyst. Chemical Communications, 2000, pp. 1371-1372. [ Links ]
KUDO, A. et al. H2 evolution from aqueous potassium sulfite solutions under visible light irradiation over a novel sulfide photocatalyst NaInS2 with a layered structure. Chemical Letters, 2002, núm. 31, pp. 882-883. [ Links ]
LEI, Z. et al. Photocatalytic water reduction under visible light on a novel ZnIn2S4 catalyst synthetized by hydrothermal method. Chemical Communications. 2003, pp. 2142-2143. [ Links ]
LEI, Z. et al. Sulfur-substituted and zinc-doped In(OH)3: A new class of catalyst for photocatalytic H2 production from water under visible light illumination. Journal of Catalysis.2006, núm. 237, pp. 322-329. [ Links ]
LIANG, H. y GUO, L. Synthesis characterization and photocatalytic performances of Cu2MoS4. International Journal of Hydrogen Energy. 2010. [ Links ]
LINKOUS, C.; MURADOV, N. y RAMSER, S. Consideration of reactor design for solar hydrogen production from hydrogen sulfide using semiconductor particulates. International Journal of Hydrogen Energy. 1995, núm. 20, pp. 701-709. [ Links ]
LU, G. y LI, S. Hydrogen production by H2S photodecomposition on ZnFe2O4. International Journal of Hydrogen Energy. 1992, núm. 17, pp. 767-770. [ Links ]
MA, G.; YAN, H.; SHI, Y; ZONG, X.; LEI, Z. y LI, C. Direct splitting of H2S into H2 and S on CdS- based photocatalyst under visible light irradiation. Journal of Catalisys. 2008, núm. 260, pp. 134-140. [ Links ]
MATSUMURA, M.; SAHO, Y y TSUBOMURA, H. Photocatalytic hydrogen production from solutions of sulfite using platinized cadmium sulfide power.Journal of Physical Chemistry. 1983, núm. 87, pp. 3807-3808. [ Links ]
MUIR, J.; HOGAN, R.; RUSSELL, J.; SKOCYPEC, D. y BUCK, R. Solar reforming of methane in a direct absorption catalytic reactor on a parabolic dish: Test and analysis. Solar Energy.1994, vol. 52, núm. 6, pp. 467-471. [ Links ]
MURADOV, N. y VEZIROGLU, T. Green path from fossil-based to hydrogen economy, pp. An overview of carbon-neutral technologies. International Journal of Hydrogen Energy. 2008, núm. 33, pp. 6804-6839. [ Links ]
NAMAN, S. Comparison between thermal decomposition and photosplitting of H2S over VxSy supported on oxides at 450-550°C in a static system. International Journal of Hydrogen Energy. 1992, núm. 17, pp. 499-504. [ Links ]
NAMAN, S. y AL-EMARA, K. Hydrogen from hydrogen sulfide cleavage, the stability and efficiency of VO/VS mixed semiconductor dispersion. International Journal of Hydrogen Energy. 1987, núm. 12, pp. 629-632. [ Links ]
NAMAN, S. y GRATZEL, M. Visible-Light generation of hydrogen from hydrogen sulphide in aqueous solutions of ethanolamines containing vanadium sulphide dispersions. Journal of Photochemistry andPhotobiology A: Chemistry. 1994, núm. 77, pp. 249-253. [ Links ]
NAMAN, S.; ALIWI, S. y AL-EMARA, K. Hydrogen production from the splitting of H2S by visible light irradiation of vanadium sulfides dispersion loaded with RuO2. International Journal of Hydrogen Energy. 1986, núm. 11, pp. 33-38. [ Links ]
NAMAN, S.; AL-MISHHADANI, N. y AL-SHAMMA, L. Photocatalytic production of hydrogen from hydrogen sulfide in ethanolamine aqueous solution containing semiconductors dispersion. International Journal of Hydrogen Energy. 1995, núm. 20, pp. 303-307. [ Links ]
NAVARRO, R.; DEL VALLE, F. y FIERRO, J. Photocatalytic hydrogen evolution from CdS-ZnO-CdO systems under visible light irradiation: Effect of thermal treatment and presence of Pt and Ru cocatalysts. International Journal of Hydrogen Energy. 2008, núm. 33, pp. 4265-4273. [ Links ]
NAVARRO, R. et al. Water splitting on semiconductor catalyst under visible-light irradiation. ChemSusChem. 2009, núm. 2, pp. 471-485. [ Links ]
PIATKOWSKI, N. y STEINFELD, A. Solar-driven coal gasification in a thermally irradiated packed-bed reactor. Energy and Fuels. 2008, núm. 22, pp. 2043-2052. [ Links ]
REBER, J. y MEIER, K. Photochemical production of hydrogen with zinc sulfide suspensions. Journal of Physical Chemistry. 1984, núm. 88, pp. 5903-5913. [ Links ]
REBER, J. y RUSEK, M. Photochemical hydrogen production with platinized suspensions of cadmium sulfide and cadmium zinc sulfide modified by silver sulfide. Journal of Physical Chemistry. 1986, núm. 90, pp. 824-834. [ Links ]
RUFUS, I.; RAMAKRISHNAN, V.; VISWANATHAN, B. y KURIACOSE, J. Rhodium and rhodium sulfide coated cadmium sulfide as a photocatalyst for photochemical decomposition of aqueous sulfide. Langmuir. 1990, núm. 6, pp. 565-567. [ Links ]
SABATÉ, J.; CERVERA-MARCH, S.; SIMARRO, R. y GIMÉNEZ, J. A comparative study of semiconductor photocatalysts for hydrogen production by visible light using different sacrificial substrates in aqueous media. International Journal of Hydrogen Energy. 1990, núm. 15, pp. 115-124. [ Links ]
SHANGGUAN, W. y YOSHIDA, A. Synthesis and photocatalytic properties of CdS-intercalated metal oxides. Solar Energy Materials and Solar Cells. 2001, núm. 69, pp. 189-194. [ Links ]
SHEN, S.; ZHAO, L.; ZHOU, Z. y GUO, L. Enhanced photocatalytic hydrogen evolution over Cu-doped ZnIn2S4 under visible light irradiation. Journal of Physical Chemistry. 2008, núm. 112, pp. 16148-16155. [ Links ]
SHENGLI, G.; QINGZHANG, D. y YU, J. A New Visible-Light Photocatalyst: CdS Quantum Dots Embedded Mesoporous TiO2. Enviromental Science & Technology. 2009, vol. 43, núm. 18, pp. 7079-7085. [ Links ]
STEINBERG, M. y CHENG, H. (1989). Modern and prospective technologies for hydrogen production from fossil fuels. International Journal of Hydrogen Energy. 1989, vol. 14, núm. 11, pp. 797-820. [ Links ]
TAMBWEKAR, S. y SUBRAHMANYAM, M. Photocatalytic generation of hydrogen from hydrogen sulfide: An energy bargain. International Journal of Hydrogen Energy. 1997, núm. 22, pp. 959-965. [ Links ]
TAQUI KHAN, M.; BHARDWAJ, R. y BHARDWAJ, C. Photodecomposition of H2S by silver doped cadmium sulfide and mixed sulfides with ZnS. International Journal of Hydrogen Energy. 1988, núm. 13, pp. 7-10. [ Links ]
TROMMER, D. et al. Hydrogen production by steam-gasification of petroleum coke using concentrated solar power-I. Thermodynamic and kinetic analyses. InternationalJournal of Hydrogen Energy. 2005, núm. 30, pp. 605-618. [ Links ]
TSUJI, I. y KUDO, A. H2 evolution from aqueous sulfite solutions under visible-light irradiation over Pb and halogen-codoped ZnS photocatalysts. Journal of Photochemistry and Photobiology A: Chemistry. 2003, núm. 156, pp. 249-252. [ Links ]
TSUJI, I.; KATO, H. y KUDO, A. Photocatalytic hydrogen evolution on ZnS- CuInS2 - AgInS2 solid solution photocatalysts with visible light absorption bands. Chemistry of Materials. 2006, núm. 18, pp. 1969-1975. [ Links ]
TSUJI, I.; KATO, H.; KOBAYASHI, H. y KUDO, A. Photocatalytic H2 evolutiom reaction from aqueous solutions over band structure-controlled (Ag)InxZn2(1-x)S2 solid solution photocatalysts with visible-light response and their surface nanostructure. Journal of the American Chemical Society. 2004, núm. 126, pp. 13406-13413. [ Links ]
TSUJI, I. ; KATO, H. ; KOBAYASHI, H. y KUDO, A. Photocatalytic H2 evolution under visible-light irradiation over band-structured-controlled (CuIn)xZn(1-x)S2 solid solutions. The Journal of Physical Chemistry B. 2005, núm. 109, pp. 7323-7329. [ Links ]
VALLE, F. et al. Influence of Zn concentration in the activity of Cd1xZnxS solid solutions for water splitting under visible light. Catalysis Today. 2009, núm. 143, pp. 51-56. [ Links ]
VAN GERVEN, T. et al. A review of intensification of photocatalytic processes. Chemical Engineering and Processing. 2007, núm. 46, pp. 781-789. [ Links ]
VUCEMILOVIC, M.; VUKELIC, N. y RAJH, T. Solubility and photocorrosion of small CdS particles. Journal of Photochemistry and Photobiology A: Chemistry. 1988, vol. 42, núm. 1, pp. 157-167. [ Links ]
WANG, X.; LUI, G.; LU, G. y CHENG, H. Stable photocatalytic hydrogen evolution from water over ZnO-CdS core-shell nanorods. International Journal of Hydrogen Energy. 2010. [ Links ]
WÖRNER, A. y TAMME, R. CO2 reforming of methane in a solar driven volumetric receiver-reactor. Catalysis Today. 1998, núm. 46, pp. 165-174. [ Links ]
XING, C.; ZHANG, Y; YAN, W y GUO, L. Band structure-controlled solid solution of Cd1-xZnxS photocatalyst for hydrogen production by water splitting. International Journal of Hydrogen Energy. 2006, núm. 31, pp. 2018-2024. [ Links ]
YAN, H. et al. Visible-light-driven hydrogen production with extremely high quantum efficiency on Pt/PdS/CdS photocatalyst. Journal of Catalysis. 2009, núm. 266, pp. 165-168. [ Links ]
YOSHIDA, S. et al. Coal/CO2 Gasification System Using Molten Carbonate Salt for Solar/Fossil Energy Hybridization. Energy and Fuels. 1999, núm. 13, pp. 961-964. [ Links ]
Z'GRAGGEN, A. et al. Hydrogen production by steam-gasification of petroleum coke using concentrated solar power-II. Reactor design, testing, and modeling. International Journal of Hydrogen Energy. 2006, núm. 31, pp. 797-811. [ Links ]
ZHANG, W y ZU, R. Surface engineered active photocatalysts without noble metals. CuS-ZnxCd1-xS nanospheres by one-step synthesis. International Journal of Hydrogen Energy. 2009, núm. 34, pp. 8495-8503. [ Links ]
ZHANG, W.; ZHONG, Z.; YONGSHENG, W. y XU, R. Doped solid solution: (Zn0.95Cu0.05)1-xCdxS nanocrystals with high activity for H2 evolution from aqueous solutions under visible light. The Journal of Physical Chemistry C. 2008, núm. 112, pp. 17635-17642. [ Links ]
ZHENG, N.; BU, X.; VU, H. y FENG, P Open-framework chalcogenides as visible-light photocatalysts for hydrogen generation from water. Angewandte Chemie. 2003, vol. 44, núm. 33, pp. 5299-5303. [ Links ]