Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y competitividad
Print version ISSN 0123-3033
Ing. compet. vol.14 no.2 Cali July/Dec. 2012
Tratamiento de emisiones de hidrocarburos livianos con MgO-CaO
Light hydrocarbons emission treatment with MgO-CaO
Mauricio E. Sánchez
Universidad de Antioquia, Facultad de Ingeniería, Grupo de Investigación Gasure, Medellín, Colombia
E-mail: msanchez@udea.edu.co
Elías de J. Gómez
Universidad de Antioquia, Facultad de Ingeniería, Grupo de Investigación Gasure, Medellín, Colombia
E-mail: egomez@udea.edu.co
César A. Vásquez
Universidad de Antioquia, Facultad de Ingeniería, Grupo de Investigación Gasure, Medellín, Colombia
E-mail: cvasquez545@gmail.com
Alejandro Jaramillo
Universidad de Antioquia, Facultad de Ingeniería, Grupo de Investigación Gasure, Medellín, Colombia
E-mail: ajarami@udea.edu.co
Eje temático: Ingeniería química / Chemical engineering
Recibido: Noviembre 8 de 2011
Aceptado: Agosto 9 de 2012
Resumen
La mayor parte de los requerimientos energéticos actuales para la generación de electricidad, la industria y el transporte se obtienen de combustibles fósiles mediante el proceso de combustión térmica, la cual genera emisiones de gases que contienen hidrocarburos livianos como metano, etano y propano. Entre éstos, el metano es un importante promotor del efecto invernadero, muchas veces más nocivo que el CO2 y el hidrocarburo más difícil de oxidar debido a su alta estabilidad química. Entre las tecnologías desarrolladas para el control de dichas emisiones, la combustión térmica soportada catalíticamente ha ido ganando interés. Los mejores resultados se han logrado con metales nobles y óxidos metálicos simples o combinados los cuales tienen dificultades de inestabilidad térmica y alto costo. Este proyecto se enfocó en el desarrollo y ensayo de óxido de magnesio dopado con óxido de calcio que mostró ser de bajo costo, activo y térmicamente estable para promover la oxidación completa de gas natural (3.0%), GLP (0.5%) y mezclas de estos en presencia de CO2 (10%) con exceso de oxígeno y por debajo del límite inferior de inflamabilidad. La presencia de GLP facilitó la combustión del gas natural mientras la presencia de CO2 redujo la actividad del material para la oxidación pero disminuyó las emisiones de CO.
Palabras claves: Combustión catalítica, GLP, MgO-CaO, Metano, Propano.
Abstract
Most current energy requirements for electricity generation, industry and transportation are supplied from fossil fuels by thermal combustion processes, which generates emissions of gases containing light hydrocarbons such as methane, ethane and propane. Among them, methane is a major promoter of the greenhouse effect, many times more harmful than CO2, furthermore it is the hydrocarbon more difficult to oxidize due to its high chemical stability. Among the technologies developed to control those emissions, catalytically supported thermal combustion has been gaining interest. The best results have been achieved with noble metals and simple or combined metal oxides which remain having difficulties with thermal stability and high cost. This project focused on the development and testing of a material based on magnesium oxide doped with calcium oxide, which shown to be low cost, active and thermally stable to promote the complete oxidation of natural gas (3.0%), LPG (0.5%) and mixtures thereof in the presence of CO2 (10%) and excess oxygen below the lower limit of flammability. The presence of LPG facilitated the combustion of natural gas while the presence of CO2 reduced the activity of the material for the hydrocarbons oxidation but decreased CO emissions.
Key words: Catalytic combustion, LPG, MgO-CaO, Methane, Propane.
1. Introducción
Desde los albores del siglo XVIII la industrialización ha sido el eje del desarrolloeconómico y del mejoramiento de las condiciones y calidad de vida en diferentes regiones del mundo. Una gran parte de la energía requerida en los sectores industrial, transporte y generación eléctrica se obtiene a partir de combustibles fósiles mediante el proceso de combustión térmica, el cual ha sido de gran utilidad, pero entre sus impactos negativos están las emisiones de gases que contienen hidrocarburos livianos como metano, etano y propano, los cuales pueden tener efectos nocivos al contribuir al problema del smog fotoquímico, el efecto invernadero y a la toxicidad del aire.
Entre las tecnologías tradicionales existentes para el control de las emisiones de los hidrocarburos livianos pueden mencionarse la retención sobre lechos de material adsorbente que luego deben tratarse y disponerse; la combustión térmica que busca convertirlos en materiales inocuos o menos perjudiciales como sugiere De Nevers (1998).
Particularmente el metano, tiene un efecto mucho mayor que el CO2 como promotor del efecto invernadero y su alta estabilidad química lo hace el hidrocarburo más difícil de oxidar de manera homogénea; sin embargo desde mediados de los años 70, Pfefferle (1975) reportó desarrollos relacionados con la mejora de la eficacia en la oxidación de metano ayudada por la presencia de catalizadores; desde los años 80 se observa una creciente y variada literaturarespecto al tema como la de Prasad et al. (1984); Swinkels et al. (1993); Choudhary et al. (2002).
Los metales nobles (Pd, Pt, Rh y Au) sobre diversos soportes han sido reportados como los materiales más activos para diversas aplicaciones por diferentes autores como Requies et al. (2008), Choudhary et al. (2002), Eguchi et al. (1999); pero el hecho de que presentan altos costos, baja estabilidad a altas temperaturas y dificultades con la presencia de agua y SO2 según mostró McCormick et al. (1999), ha motivado el desarrollo de catalizadores basados en óxidos metálicos simples y combinados según mencionan Choudhary et al. (2002). Sin embargo es sabido que los óxidos metálicos adolecen de menor actividad por sitio activo y requieren mayores temperaturas para la oxidación de hidrocarburos.
Algunos óxidos simples de metales de transición (Cu, Co, Mn, Cr, Fe) usualmente se han soportado sobre alúmina y silica para mejorar su actividad. Arnone et al. (1998a) ensayaron óxidos de Mn, Fe, Cr y Co en combustión de metano a temperaturas entre 300 y 600°C encontrando actividad similar para Mn, Co y Cr y menor para Fe.
Por otra parte los óxidos mixtos, entre los que se cuentan las perovskitas, espinelas, óxidos metálicos dopados y hexaaluminatos, han sido ampliamente estudiados buscando mejorar las propiedades de actividad y resistencia de los óxidos simples y tratando de lograr una actividad comparable con la de los metales nobles. Las perovkitas de formula genérica ABO3, donde A y B son cationes que pueden además ser parcialmente sustituidos, ofrecen una infinita variedad de posibles composiciones y estructuras que hacen de estos materiales un grupo muy estudiado y versátil para la combustión de metano. Choudhary et al. (2002) estudiaron los óxidos LaCoO3 y LaMnO3 con y sin pretratamiento con vapor en la conversión de metano mejorando la conversión desde 20.0% hasta 64.0% y desde 15.0% hasta 40.0%, respectivamente, cuando la reacción se llevó a cabo a 600°C con 2.5% CH4 y velocidad espacial de 51,000 cm3g-1h-1. Dicha mejora fue atribuida al aumento del área superficial. Muchos trabajos se han enfocado en el estudio de perovskitas sustituidas y estabilizadas o soportadas sobre materiales de mayor área superficial como alúminas o espinelas según reportan Marti et al. (1994), Arnone et al. (1998b), Klvana et al. (1999), Zwinkels et al. (1999), Cimino et al. (2000), Popescu et al. (2009); en todos los casos promoviendo mejoras en el desempeño de los catalizadores para la oxidación de metano.
Se ha reportado que los óxidos dopados con metales mostraron cambios significativos en sus propiedades respecto a las de los materiales originales, como ejemplo, los óxidos de zirconio y cerio han sido muy estudiados con dopantes como La, Co, Fe, Cr, Cu, Ca, Sr, Y, Ni, Nd, Pb, Mn y Ag en la combustión de metano, encontrándose buen desempeño aunque con aspectos por mejorar como resistencia a temperaturas altas y tiempos largos de reacción, Jones (1996), Terribile et al. (1999), Milt et al. (2001).
Para la combustión a altas temperaturas se han mostrado como materiales promisorios, los hexaaluminatos y los óxidos de metales alcalinotérreos. Los hexaaluminatos, de formula general AAl12O19 donde A es un metal alcalino o alcalinotérreo, basan su estabilidad térmica en la conformación laminar consistente de bloque s de espinelas apiladas separadas por una monocapa de óxidos según explican Machida et al. (1988), quienes además son autores pioneros del estudio de este tipo de materiales Arai et al. (1987). Dado que a pesar de su alta estabilidad térmica, la actividad catalítica de los hexaaluminatos es reducida, muchos investigadores han tratado de dopar estos materiales con cationes mientras se mantiene su estructura cristalina. Machida et al. (1989), por ejemplo, incorporaron Cr, Mn, Fe, Co y Ni en BaMAlO encontrando1119-α que el Mn presentó la mayor mejora en las propiedades del catalizador para la combustión de metano. Artizzu-Duart et al. (1999) por su parte encontraron que los hexaaluminatos de Ba dopados con Cu presentaron mejor actividad pero incorporaron menor cantidad del catióny presentaron menor área superficial. Eguchi et al. (1998) trabajaron sobre la determinación del efecto de incorporar lantánidos como La, Pr, Sm y Nd en AMnAlO encontrando1119−y que tanto el área como la actividad catalítica aumentaron con el radio iónico del lantánido incorporado siendo el La el de mayor efecto. Los hexaaluminatos también han sido usados como soportes para dispersar metales activos como Pd en la combustión de metano según reporto Sekizawa et al. (1996) y óxidos metálicos como Mn3O4 según Machida et al. (1995) aunque siguen teniendo dificultades de sinterización de la fase activa.
Materiales de mayor estabilidad térmica pero de menor actividad que los hexaaluminatos son los óxidos de metales alcalinotérreos, entre ellos el óxido de magnesio, frecuentemente usado como soporte; el óxido de magnesio es mucho más fácil de preparar y con ello más económico y considerado el más promisorio de los óxidos de metales alcalinotérreos según reportan Berg y Järås (1995). El estudio de oxidación de metano sobre óxido de magnesio puro o dopado con otros elementos como litio, hierro, cobalto y calcio viene aumentando en interés y ha sido abordado por Teng et al. (2008), Spretz et al. (2000) y Berg & Järås (1994). El sistema Li-MgO mostró mayor selectividad hacia etano y etileno, por acoplamiento oxidativo, que hacia dióxido de carbono por oxidación total de acuerdo a resultados de Dubois & Cameron (1990) e Ito et al. (1987). Ulla et al. (2001) encontraron que cuando el MgO se dopó con cobalto o hierro se da la oxidación total del metano promovida por el metal de transición. Aigler & Lunsford (1991) con base en sus estudios plantean que la presencia de calcio en la superficie del óxido de magnesio aumenta de manera considerable la actividad para oxidación parcial de metano. Berg & Jarås (1994) encontraron que el óxido de magnesio puro, usado frecuentemente como soporte de metales nobles por su alta estabilidad térmica, tiene alguna actividad para la oxidación total de metano en exceso de oxígeno. Gómez et al. (2008) obtuvieron un catalizador promisorio de MgO dopado con CaO de fácil preparación y bajo costo que exhibió alta estabilidad térmica y promovió la combustión de gas natural desde 500°C en concentraciones de CH4 por debajo del límite inferior de inflamabilidad; Gómez et al. (2009) obtuvieron una expresión cinética para la combustión sin llama de gas natural sobre MgO-CaO en condiciones de exceso de oxígeno y concentraciones de metano inferiores al 2.50% v/v.
Baldi et al. (1998) desarrollaron una serie de catalizadores basados en Mn3O4, Fe2O3 y sus mezclas en la combustión de propano encontrando que la mezcla molar 2:1 (Mn3O4:Fe2O3) fue mucho más activa que los componentes puros y que las mezclas 1:1 y 1:2. Garetto et al. (2007) compararon la actividad de catalizadores de Pt soportados en varios materiales en la combustión de hidrocarburos C2-C4 encontrando que en el caso del Pt/MgO el orden creciente de actividad, en términos de la temperatura para el 50.0% de conversión, fue C4 > C3 > C2. Por su parte Demoulin et al. (2008) observaron que el catalizador Pd(2.0% p/p)/γAl2O3 promueve la conversión de hidrocarburos livianos en el orden C> C> C. Cimino et 321al. (2003) investigaron el comportamiento del catalizador LaMnO3/La-γAl2O3 en la combustión de metano y mezclas propano/ metano encontrando que la presencia de C3H8 disminuye tanto la temperatura de oxidación como las emisiones de CH4 inquemado. Corro et al. (2006) encontraron que la adición de C3H8 a la mezcla reactiva de alimentación resultó en un fuerte efecto promotor de la oxidación de metano sobre el catalizador Pt-Sn/γ-Al2O3 sulfatado.
2. Metodología
Para preparar el material catalítico se partió de óxido de magnesio industrial (95.0% MgO; 0.90% CaO; 1.2% SiO; 0.5% FeO; 0.5% AlO22323 y 1.9% inertes). Se prepararon suspensiones acuosas de una parte de sólido por cuatro de agua, con agitación mecánica vigorosa durante 1.5 horas después de las cuales se dejó la mezclaen reposo; después de 12 horas se separó el sedimento y se secó en estufa a 125°C por 36 horas. El sólido seco se empastilló en una matriz de acero a una presión alrededor de 400 MPa y luego se trituró y tamizó para obtener partículas con tamaños promedio entre 2.0 y 2.4 mm que luego se calcinaron en aire durante 4 horas a 1,100°C con una velocidad de calentamiento de 5.0 °C/min. Gómez et. al. (2006) reportaron la caracterización del catalizador mediante técnicas de DRX, BET y SEM-EPMA.
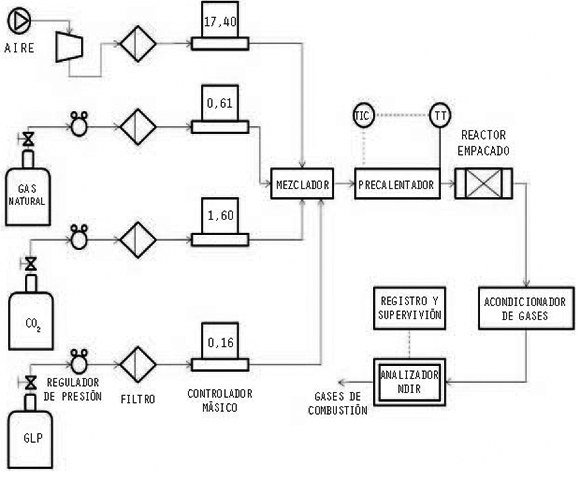
La Figura 1 muestra un esquema general de la instalación experimental. Para controlar la composición de mezcla reactiva de aire, metano, propano y dióxido de carbono, se utilizaron reguladores de flujo másico tipo hilo caliente dotados con interfaz de usuario y electrónica local (OMEGA Eng., modelos FMA-2606, FMA5508 y FMA5524), con una exactitud entre ± 0.01 y 0.10 litros estándar por minuto, SLPM, según el rango del equipo. El gas alimentado fue filtrado y a una presión regulada de aproximadamente 15.0 psig, se mezcló antes de pasar por el precalentador, el cual junto con el reactor se construyeron en material cerámico silico-aluminoso de 2.0 cm de diámetro interno, 1.5 cm de espesor de pared y 60.0 cm de longitud. Al precalentador se acopló una resistencia eléctrica de 4.0 kW al interior del tubo cerámico y termopares a la entrada y salida, tanto del precalentador como del lecho catalítico; El sistema se aisló con ladrillo refractario y manta cerámica. El calentamiento y control de temperatura se realizó con un controlador de temperatura (AUTONICS, modelo TZ4ST) multicanal con precisión de 0.1ºC, dotado con algoritmo PID. El lecho se empacó con una capa inicial de SiC inerte para garantizar la homogeneidad en la concentración y la temperatura de entrada al lecho reactivo. El catalizador ocupó un volumen de 27.5 cm3. La concentración de la mezcla alimentada al reactor así como la de los gases de combustión se analizaron, después de pasar por una unidad de succión, acondicionamiento térmico y eliminación de humedad, con el analizador de gases NDIR (MAIHAK, modelo Multor 610) adecuado para la medición simultanea de CO, CO2, CH4 y O2.
Los ensayos de combustión se llevaron a cabo con el fin de investigar el efecto de la presencia de catalizador en la combustión de gas natural, GLP y sus mezclas así como la influencia de la presencia de CO2 en la corriente de alimentación a temperaturas entre 250 y 750°C. Se utilizaron 25.0 g de catalizador para un flujo total de mezclagaseosa de 20.0 SLPM, lo que corresponde a una velocidad espacial GHSV (Gas Hourly Space Velocity) de unas 130,000 h-1, la cual según estudios previos garantiza la eliminación de efectos difusionales intra-partícula según Gómez et al. (2009). Se utilizó gas natural de la Guajira (98.0% CH4, 1.4% N2, 0.24% CO2 como componente principales) como fuente de metano; gas licuado de petróleo (60.0% C3H8,= 40.0%CH, C-C< 0.5%, aprox.) que se 41022 denomina en este trabajo GLP; CO2 99.9 % de pureza y aire atmosférico comprimido y seco.
Se utilizaron mezclas reactivas balanceadas en aire compuestas por 3.0% CH4, de acuerdo al límite inferior de inflamabilidad; 0.50% GLP, acorde a la concentración de propano medida en corrientes típicas de emisión de fuentes fijas; y CH4 + GLP a las concentraciones anteriores. Cada una de las mezclas reactivas se alimentó con y sin la presencia de 10.0% de CO2, para evaluar la influencia de este gas en la reacción catalítica. Las pruebas "blanco" se realizaron con el lecho empacado con igual cantidad de SiC de la misma granulometría del catalizador a usar. Las mediciones de conversión se realizaron aumentando la temperatura de precalentamiento desde 250°C hasta 750°C, con intervalos entre 12.5°C y 50°C según la conversión observada de la mezcla reactiva.
La conversión reportada se calculó con base en la cantidad de metano que reacciona para los experimentos que emplean sólo gas natural y la cantidad total de CO y CO2 formados para los casos donde se alimenta GLP. Debido a que la concentración de combustible siempre estuvo por debajo del límite inferior de inflamabilidad y ésta permite controlar la temperatura máxima de reacción sin que sobrepase 1,400ºC, no se midieron las emisiones de NOx y se asumen despreciables dado que el mecanismo térmico de formación comienza a tener importancia por encima de 1,500ºC y ni el gas natural ni el GLP tienen nitrógeno en su composición.
3. Resultados y discusión
3.1 Combustión en fase homogénea
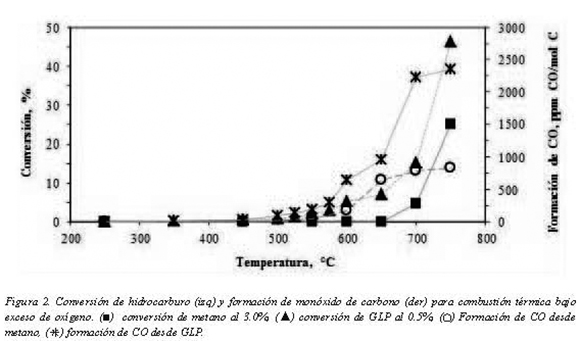
Conforme al montaje experimental planteado, se realizaron ensayos con entradas de 20.0 SLPM de mezclas hidrocarburo-aire: una con 3.0% de metano y otra con 0.5% GLP. Cada una de las mezclas se pasó a través del reactor empacado con carburo de silicio con el fin de determinar la conversión del metano y la formación de CO en la reacción efectuada en fase homogénea en ausencia de catalizador. Los flujos alimentados de cada combustible corresponden a la relación 1.76 mol de C en CH4/mol de C en GLP para comparar el efecto de la combustión homogénea en la formación de CO en función del contenido de carbono en cada hidrocarburo. Las concentraciones de combustibles empleadas garantizan un exceso de oxígeno superior a tres veces la cantidad estequiométrica evitando la existencia de limitaciones en cuanto al flujo de comburente.
Con estos experimentos, variando la temperatura entre 250 y 750°C, se observó que en combustión térmica existe una mayor conversión del GLP que de gas natural en todo el intervalo de medición. Las máximas conversiones alcanzadas a 750°C fueron sólo 25.0% para el gas natural y 46.0% para el GLP. Estos valores, mostrados en la figura 2, se explican por la estabilidad química que presenta el metano en comparación con hidrocarburos de mayor peso molecular como los del tipo C2, C3 y C4 confirmando lo reportado por Demoulin et. al. (2008).
En cuanto a la formación de monóxido de carbono (CO), se puede apreciar que si bien en la reacción de combustión a estas condiciones se obtiene una baja conversión, se produce una menor cantidad de CO en el caso del gas natural. Es de resaltar que aunque se alimentó una baja concentración de GLP (0.5%) el CO producido a 750°C (2353 ppm CO/mol C) fue casi tres veces mayor que para el experimento con gas natural (3.0% CH4) donde se midieron sólo 832 ppm de CO/mol C.
A partir del mecanismo de reacción que explica la formación de CO2 basado en la reacciones 1 y 2, y teniendo en cuenta que estas reacciones elementales son independientes del combustible empleado como reporta Miller y Kee (1990), la formación de CO dependerá exclusivamente de vencer la barrera energética de la transformación inicial del hidrocarburo. Lo anterior se corresponde con las observaciones experiementales de mayor conversión de GLP acompañada de una consecuente formación de CO por mol de carbono alimentada, respecto a una molécula con mayor energía de enlace C-H como el metano.
H + O2 ↔ OH + O (1)
CO + OH ↔ CO2 + H (2)
3.2 Efecto del catalizador MgO-CaO
Con el fin de cuantificar la oxidación de los hidrocarburos en combustión catalítica con MgO-CaO, se empacaron 25.0 g de catalizador preparado de acuerdo al procedimiento explicado en la parte experimental y se midieron las composiciones de los gases emitidos. Las resistencias de difusión interna se evitaron con un flujo de 20.0 SLPM para diámetros de partícula promedio de 2.4 mm; las posibilidades de canalización del flujo en el lecho se redujeron con la relación tamaño de partícula a diámetro de reactor (2.4/20) según criterios enunciados por Froment y Bischoff (1990).
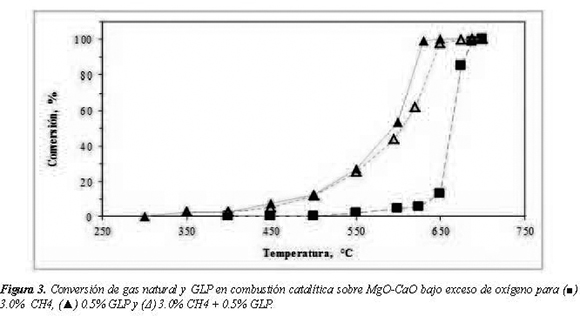
En la figura 3 se observa que para combustión de metano sobre el catalizador, a temperaturas mayores a 500°C empezó a disminuir la concentración de esta especie en los gases emitidos, alcanzándose la conversión completa a688°C a diferencia de la combustión homogénea en la cual los primeros indicios de reactividad se dieron sólo por encima de 650°C y a 750°C se obtuvo el 25.0% de conversión.
La figura 3 muestra que para el GLP al 0.5% se obtuvo conversión completa a 630°C a diferencia de la reacción homogénea en la cual se alcanzó apenas el 46% de conversión a 750°C. En la figura 3 también se muestra la conversión de la mezcla CH4 (3.0%) + GLP (0.5%) sobre MgO-CaO, la cual prácticamente se superpone a la del GLP hasta 550°C comportándose como si el único hidrocarburo presente fuese el GLP. A temperaturas superiores a 550°C la conversión de la mezcla es mayor a la del metano pero inferior a la del GLP aunque más próxima a este último, evidenciando que la presencia de hidrocarburos de mayor peso molecular que el metano, aunque sea a bajas concentraciones, ayudan a aumentar la reactividad. Los resultados obtenidos están de acuerdo con trabajos realizados anteriormente relacionados con el uso de materiales que contienen MgO como activos para potenciar la combustión de estos hidrocarburos (Berg y Järas, 1994; Ulla et. al., 2001). Esta mejora en la reactividad de los hidrocarburos hacia la oxidación se explica porque éste material aporta sitios activos sobre los cuales se puede presentar una adsorción del hidrocarburo y del oxígeno que logra disminuir la energía de activación necesaria para la oxidación, promoviendo la reacción sobre la superficie del material sólido o promoviendo la formación de especies que reaccionen en la fase gaseosa.
El efecto de la superficie activa es tan notorio que la de cualquier otro hidrocarburo, la oxidación cuando se tiene solamente metano, cuyo enlace tiene lugar a temperaturas mucho más bajas C-H requiere mayor energía para romperlo que que cuando se realiza en fase homogénea sin superficie activa. La mayor reactividad de la mezcla CH4-GLP con respecto al CH4 se puede explicar por el efecto sinérgico del GLP, el cual se debe a la mayor facilidad para la ruptura del enlace C-H acompañado de la liberación de energía y la formación de radicales libres que facilitan la oxidación del metano.
3.3 Efecto del dióxido de carbono
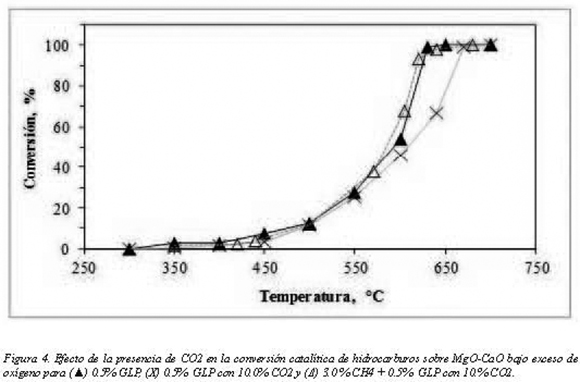
A través del reactor catalítico se hicieron pasar tres mezclas diferentes: a) 0.5% GLP en aire, b) 0.5% GLP, 10% de CO2 en aire y c) 3.0% de CH4, 0.5% GLP y 10% de CO2 en aire. El flujo alimentado de cada una de las mezclas fue 20.0 SLPM. En la figura 4 se observa el efecto negativo del CO2 sobre la conversión de GLP para el cual se requieren temperaturas mayores a 670°C para alcanzar combustión completa mientras que cuando no hay CO2 se logra a 630°C. El CO2 puede adsorberse sobre la superficie y ocupar sitios activos de la superficie sólida limitando la posibilidad de que el hidrocarburo acceda a ellos para oxidarse en concordancia con lo reportado por Burch y colaboradores (1995) en su estudio del efecto del CO2 y H2O en la conversión de metano sobre paladio. Otra posible explicación puede relacionarse con el equilibrio termodinámico que se genera en el sistema por la presencia de CO2 en alta concentración, un gas que también es producto de la reacción el cual hace que se desplace el equilibrio hacia los reactivos generando una menor conversión.
Respecto a la mezcla de CH4, GLP, CO2 y aire (3%, 0.5%, 10% y 86.5%, respectivamente) no se observan marcadas diferencias en la conversión de hidrocarburos con respecto al GLP en aire. El efecto inhibitorio de CO2 sobre la conversión de la mezcla podría ser contrarrestado por la presencia de CH4 que compite por sitios activos con el CO2 y al oxidarse produce agua (CH4 + 2O = CO + 2HO, CH+ 3/2O = CO + 2HO), 222422 la cual se podría consumir en el reformado de metano (CH4 + H2O = CO + 3H2); el hidrógeno producido también generaría agua por oxidación (H2 + O2 = 2H2O ) y esta nuevamente puede involucrarse en el reformado como reportan Lee y Trimm (1995). Esta secuencia de reacciones eleva la conversión de la mezcla de hidrocarburos (GLP, CH4) con CO2 comparada con el caso en que sólo reacciona el GLP en presencia de CO2.
3.3 Efecto del dióxido de carbono
A través del reactor catalítico se hicieron pasar tres mezclas diferentes: a) 0.5% GLP en aire, b) 0.5% GLP, 10% de CO2 en aire y c) 3.0% de CH4, 0.5% GLP y 10% de CO2 en aire. El flujo alimentado de cada una de las mezclas fue 20.0 SLPM. En la figura 4 se observa el efecto negativo del CO2 sobre la conversión de GLP para el cual se requieren temperaturas mayores a 670°C para alcanzar combustión completa mientras que cuando no hay CO2 se logra a 630°C. El CO2 puede adsorberse sobre la superficie y ocupar sitios activos de la superficie sólida limitando la posibilidad de que el hidrocarburo acceda a ellos para oxidarse en concordancia con lo reportado por Burch y colaboradores (1995) en su estudio del efecto del CO2 y H2O en la conversión de metano sobre paladio. Otra posible explicación puede relacionarse con el equilibrio termodinámico que se genera en el sistema por la presencia de CO2 en alta concentración, un gas que también es producto de la reacción el cual hace que se desplace el equilibrio hacia los reactivos generando una menor conversión.
Respecto a la mezcla de CH4, GLP, CO2 y aire (3%, 0.5%, 10% y 86.5%, respectivamente) no se observan marcadas diferencias en la conversión de hidrocarburos con respecto al GLP en aire. El efecto inhibitorio de CO2 sobre la conversión de la mezcla podría ser contrarrestado por la presencia de CH4 que compite por sitios activos con el CO2 y al oxidarse produce agua (CH4 + 2O2 = CO2 + 2H2O, CH4 + 3/2O2 = CO + 2H2O), la cual se podría consumir en el reformado de metano (CH4 + H2O = CO + 3H2); el hidrógeno producido también generaría agua por oxidación (H2 + O2 = 2H2O ) y esta nuevamente puede involucrarse en el reformado como reportan Lee y Trimm (1995). Esta secuencia de reacciones eleva la conversión de la mezcla de hidrocarburos (GLP, CH4) con CO2 comparada con el caso en que sólo reacciona el GLP en presencia de CO2.
Formación de monóxido de carbono
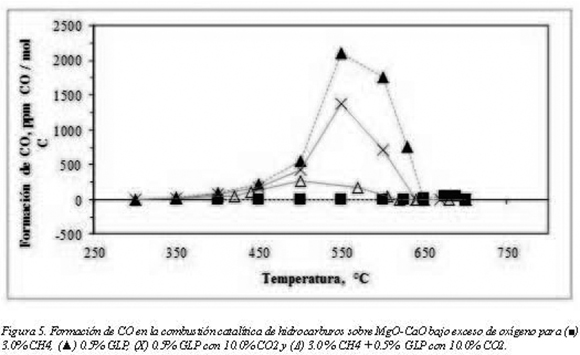
Si bien las altas conversiones son un objetivo a buscar en todos los sistemas reactivos, la selectividad en reacciones adicionales dadas por los diferentes mecanismos no siempre permite la formación de una única especie. En el caso de la combustión, se desea la formación únicamente de dióxido de carbono y la minimización de los hidrocarburos inquemados y del CO. En los experimentos anteriormente descritos se hizo seguimiento al CO producido por la reacción catalítica, los resultados que están representados en la figura 5.
Para la combustión catalítica de CH4 sobre MgO-CaO, se observa una producción de CO muy baja (45 ppm de CO/mol de C a 675°C). De hecho, es de resaltar que incluso en temperaturas a las cuales la conversión era menor al 50.0% la reacción tendía únicamente a la formación de CO2. En el extremo opuesto al CH4 está el comportamiento del GLP, el cual produjo la mayor cantidad de CO en la zona de temperaturas donde la conversión era incompleta (2100 ppm de CO/ mol de C a 550°C) y que corresponden a una conversión del 27% (figura 3), a tales condiciones de operación el monóxido llega a su máximo y conforme aumenta la temperatura lo hace también la conversión y la selectividad hacia CO2.
En cuanto a la mezcla de GLP y CO2, se observó un efecto positivo en la disminución de la concentración de CO, asociada a una disminución en la conversión como se discutió en el apartado anterior. En el caso de la mezcla GLP + CH4 + CO2 se evidencia la formación de menor cantidad de CO por la presencia de metano acorde al mecanismo de reformado mencionado previamente.
La mayor formación de CO se da a la misma temperatura donde se observó el aumento abrupto de la conversión de las mezclas de hidrocarburos indicando que a 550°C hay una alta producción de especies intermedias formadoras de monóxido de carbono el cual con mayor facilidad se terminaría de oxidar en fase gaseosa.
5. Conclusiones
El catalizador MgO-CaO preparado mostró tener actividad para promover la combustión térmica soportada catalíticamente de hidrocarburos livianos como metano y GLP en concentraciones menores al límite inferior de inflamabilidad en exceso de oxígeno y velocidad espacial de 130,000 h-1.
En el caso del CH4 la actividad del catalizador se evidenció al pasar de 25.0% de conversión a 750°C sin catalizador hasta 100% de conversión a 675°C en presencia de MgO-CaO; la conversión de GLP pasó de 46.0% a 650°C a 100.0% a 630°C.
El GLP favoreció la combustión de metano sobre MgO-CaO. La adición de 0.5% de GLP a una mezcla de 3.0% metano hizo que las temperaturas requeridas para su oxidación se redujeran entre 50 y 150°C.
El CO2 inhibió actividad catalítica para la oxidación de GLP. La adición de 10.0% de CO2 a la mezcla de hidrocarburos aumentó la temperatura requerida para lograr el mismo grado de conversión que sin CO2.
En la combustión de GLP se observó la mayor formación de CO, la cual fue mitigada por la presencia tanto de CH4 como de CO2; a temperaturas superiores a 650°C no se detectó CO.
El catalizador MgO-CaO preparado exhibe un potencial interesante como material activo, térmicamente estable, de fácil preparación y bajo costo, para ser usado en la depuración de emisiones de hidrocarburos livianos conteniendo hidrocarburos C1 a C4 bajo condiciones oxidantes típicas de sistemas de tubos de escape vehiculares y chimeneas industriales.
6. Agradecimientos
Los autores agradecen al CODI y al grupo GASURE de la Universidad de Antioquia por el apoyo económico y logístico para la realización de este proyecto.
7. Referencias bilbiográficas
Aigler, J. M. & Lunnsford, J. H. (1991). Oxidative Dimerization of Methane Over MgO and Li+/MgO Monoliths. Applied Catalysis A: General, 70 (1), 29-42. [ Links ]
Arai, H., Machida, M., & Eguchi, K. (1987). High temperature catalytic combustion over cation-substituted barium hexaaluminates. Chemistry Letters, 5, 767-770. [ Links ]
Arnone, G., Busca, G., Lisi, L., Milella, F., Russo, G., & Turco, M. (1998b). Catalytic combustion of methane over LaMnO3 perovskite supported on La2O3 stabilized alumina. A comparative study with Mn3O4, Mn3O4-Al2O3 spinel oxides. In proceedings Symposium (International) on Combustion, 27 (2), 2293-2299. [ Links ]
Arnone, S., Bagnasco, G., Busca, G., Lisi, L., Russo, G., & Turco, M. (1998a). Catalytic combustion of methane over transition metal oxides. Studies in Surface Science and Catalysis, 119, 65-70. [ Links ]
Artizzu-Duart, P., Brullé, Y., Gaillard, F., Garbowski, E., Guilhaume, N. & Primet, M. (1999). Catalytic combustion of methane over copper- and manganese-substituted barium hexaaluminates. Catalysis Today, 54 (1), 181- 190. [ Links ]
Baldi, M., Sánchez, V., Gallardo, J., Milella, F., & Busca, G. (1998). Characterization of manganese and iron oxides as combustion catalysts for propane and propene. Applied Catalysis B: Environmental, 17, L175-L182. [ Links ]
Berg, M., & Järas, S. (1994). Catalytic Combustion of Methane Over Magnesium Oxide. Applied Catalysis A: General, 114 (2), 227-241. [ Links ]
Berg, M., & Järas, S. (1995). High temperature stable magnesium catalyst for catalytic combustion of methane: a comparison with manganese-substututed barium hexaaluminate. Catalysis today, 26 (3-4), 223-229. [ Links ]
Burch, R., Urbano, F. J., & Loader, P. K. (1995). Methane combustion over palladium catalysts: the effect of carbon dioxide and water on activity. Applied catalysis A: General, 123, 173- 184. [ Links ]
Choudhary, T.V., Banerjee, V.R., & Choudhary, V.R. (2002). Catalyst for combustion of methane and lower alkanes. Applied Catalysis A: General, 234 (1-2), 1-23. [ Links ]
Cimino, S., Di Benedetto, A., Pirone, R., & Russo, G. (2003). CO, H2 or C3H8 assisted catalytic combustion of methane over supported LaMnO3 monoliths. Catalysis Today, 83, 33- 43. [ Links ]
Cimino, S., Lisi, L., Pirone, R., Russo, G., & Turco, M. (2000). Methane combustion on perovskites-based structured catalysts. Catalysis Today, 59 (1-2), 19-31. [ Links ]
Corro, G., Fierro, J. L. G., & Vásquez, O. (2006). Promotional effect of Sn addition to sulfated Pt/γ-Al2O3 catalysts on CH4 combustion. Effect of C3H8 addition. Catalysis Communications, 7, 436-442. [ Links ]
De Nevers, N. (1998). Ingeniería del control de la contaminación del aire (1 ed.). México D.F.: McGraw Hill. [ Links ]
Demoulin, O., Le Clef, B., Navez, M., & Ruiz., P. (2008). Combustion of methane, ethane and propane and of mixtures of methane with ethane or propane on Pd/g-Al2O3 catalysts. Applied Catalysis A: General, 344, 1-9. [ Links ]
Dubois, J. L., & Cameron, C. J. (1990). Common Features of Oxidative Coupling of Methane Cofeed Catalyst. Applied Catalysis A: General, 67, 49-71. [ Links ]
Eguchi, K., Takahara, K., Inoue, H. & Sekizawa, K. (1998). Catalytic Combustion of Methane Over Metal Oxide Catalysts. Materials Research Society Symposium Procedures, 549, 105-112. [ Links ]
Eguchi, K., Widjaja, H., Sekizawa, K., & Arai, H. (1999). Oxidation of methane over Pd/mixed oxides for catalytic combustion. Catalysis Today, 47, 95-101. [ Links ]
Froment, G. F., & Bischoff, K. B. (1990) Chemical Reactor Analysis and Design, (2 ed.). New York: J. Wiley. [ Links ]
Garetto, T.F., Rincón, E., & Apesteguía, C. R. (2007). The origin of the enhanced activity of Pt/zeolites for combustion of C2-C4 alkanes. Applied Catalysis B: Environmental, 73, 65-72. [ Links ]
Gómez, E., Jaramillo, A., Múnera, J. & Sánchez, M. (2006). Preparación, caracterización y evaluación de MgO para combustión sin llama de gas natural. Revista Facultad de Ingeniería, 37, 41-49. [ Links ]
Gómez, E., Sánchez, M. & Jaramillo, J. (2009). Cinética de la Combustión Sin Llama de Gas Natural sobre CaOMgO. Información Tecnológica, 20 (4), 63-74. [ Links ]
Gómez, E., Sánchez, M. & Jaramillo, J. (2008). Combustión sin Llama de Mezclas Pobres Metano-Aire sobre óxido de Magnesio Adicionado con óxido de Calcio. Información Tecnológica, 19 (6), 111-120. [ Links ]
Ito, T., Wang, J., Lin, C. H., & Lunsford, J. (1985). Oxidative Dimerization of Methane Over Lithium-Promoted Magnesium Oxide Catalyst. Journal of the American Chemistry Society, 107, 50-62. [ Links ]
Jones, R. (1996). Catalytic combustion effects of m-ZrO2 doped with various metal nitrates. Surface and coatings technology, 86-87, 127- 134. [ Links ]
Klvana, D., Kircnerová, J., Chaouki, J., Delval, J., & Yaici, W. (1999). Fiber-supported perovskites for catalytic combustion of natural gas. Catalysis Today, 47 (1-4), 115-121. [ Links ]
Lee, J. H., & Trimm, D. L. (1995). Catalitic combustion of methane. Fuel Processing Technology, 42, 339-359. [ Links ]
Machida, M., Eguchi, K., & Arai, H. (1989). Catalytic properties of BaMAl11O19-î± (M = Cr, Mn, Fe, Co, and Ni) for high-temperature catalytic combustion. Journal of Catalysis, 120 (2), 377-386. [ Links ]
Machida, M., Kawasaki, H., Eguchi, K., & Arai, H. (1988). Surface areas and catalytic activities of Mn-Substituted hexaaluminates with various cation compositions in the mirror plane. Chemistry Letters, 6, 1461-1465. [ Links ]
Machida, M., Sato, A., Kijima, T., Inoue, H., Eguchi, K., & Arai, H. (1995). Catalytic properties and surface modification of hexaaluminate microcrystals for combustion catalyst. Catalysis Today, 26 (3-4), 239-245. [ Links ]
Marti, P. E., Maciejewski, M., & Baiker, A. (1994). Methane combustion over La0.8Sr0.2MnO3+x supported on MAl2O4 (M = Mg, Ni and Co) spinels. Applied Catalysis B: Environmental, 4 (2-3), 225-235. [ Links ]
McCormick, R. L., Mowery, D., Graboski, M., & Ohno, T. (1999). Deactivation of PdO-Al2O3 oxidation catalyst in lean-burn natural gas engine exhaust: aged catalyst characterization and studies of poisoning by H2O and SO2. Applied Catalysis B: Environmental, 21, 157- 169. [ Links ]
Miller, J. A., & Kee, R. J. (1990). Chemical Kinetics and Combustion Modeling. Annu. Rev. Phys. Chem, 41, 345-387. [ Links ]
Milt, V. G., Ulla, M.A., & Lombardo, E. A. (2001). Zirconia-Supported Cobalt as a Catalyst for Methane Combustion. Journal of catalysis, 200 (2), 241-249. [ Links ]
Popescu, I., Redey, A., Marcu, I., Popescu, B., Mako, E., & Sandulescu, I. (2009). Catalytic combustion of methane over unsupported and î³-Al2O3 supported Sr2FeTaO6 and Sr2Fe0.7Co0.3TaO6 double perovskites. Revue Roumaine de Chimie, 54 (11-12), 1111-1117. [ Links ]
Prasad, R., Kennedy, L.A., & Ruckenstein, E. (1984). Catalytic Combustion. Catalysis Reviews Science and Engineering, 26 (1), 1-58. [ Links ]
Requies, J., Alvarez-Galvan, M. C., Barrio, V. L., Arias, P. L., Cambra, J. F., Güemez, M. B., Manrique-carrera, A., de la Peña O'shea, V. A., & Fierro, J. L. G. (2008). Palladium-manganese catalysts supported on monolith systems for methane combustion. Applied Catalysis B: Environmental, 79 (2), 122-131. [ Links ]
Sekizawa, K., Eguchi, K., Widjaja, H., Machida, M. & Arai, H. (1996). Property of Pd-supported catalysts for catalytic combustion. Catalysis Today, 28 (3), 245-250. [ Links ]
Spretz, R., Marchetti, S. G., Ulla, M. A., & Lombardo E. A. (2000). Fe/MgO formulations for the catalytic combustion of methane. Journal of Catalysis, 194 (2), 167-174. [ Links ]
Teng, F., Qu, W., Wen, G., Wang, Z., Tian Yang, X., Xu, P., Zhu, Y., & Xiong, G. (2008). Effect of the flowing gases of steam and CO2 on the texture and catalytic activity for methane combustion of MgO powders. Microporous and Mesoporous Materials, 111, 620-626. [ Links ]
Terribile, D., Trovarelli, A., De Leitenburg, C., Primavera, A., & Dolcetti, G. (1999). Catalytic combustion of hydrocarbons with Mn and Cudoped ceria-zirconia solid solutions. Catalysis Today, 47 (1), 133-140. [ Links ]
Ulla, M. A., Spretz, R., Lombardo, E. & Nnözinger, H. (2001). Catalytic combustión of methane on Co/MgO: characterization of active cobalt sites. Applied Catalysis B: Environmental, 29 (3), 217-229. [ Links ]
Zwinkels, M. F. M., Haussner, O., Menon, P. G., & Jaras, S.G. (1999). Preparation and characterization of LaCrO3 and Cr2O3 methane combustion catalysts supported on LaAl11O18- and Al2O3-coated monoliths. Catalysis Today, 47 (1-4), 73-82. [ Links ]
Zwinkels, M. F., Järas, S. G., & Menon, P. (1993). Catalytic Materials for High Temperature Combustion. Catalysis Reviews Science and Engineering, 35 (3), 319-358. [ Links ]

Revista Ingeniería y Competitividad por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento - Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.