Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y competitividad
Print version ISSN 0123-3033
Ing. compet. vol.14 no.2 Cali July/Dec. 2012
Crecimiento de nanotubos de carbono sobre el mineral limonita como catalizador
Growth of carbon nanotubes over Colombian natural limonite ore as catalysts
Germán A. Sierra
Escuela de Ingeniería de Materiales, Universidad Nacional de Colombia, Medellín, Colombia
E-mail: geasierraga@unal.edu.co
Diana M. Torres
Escuela de Ingeniería de Materiales, Universidad Nacional de Colombia, Medellín, Colombia
E-mail: dmtorresho@unal.edu.co
Eje temático: Ingeniería de materiales / Materials engineering
Recibido: Diciembre 14 de 2011
Aceptado: Noviembre 19 de 2012
Resumen
Nanotubos de carbono multicapa (MWCNTs) fueron sintetizados usando metano como fuente de carbono y el mineral colombiano limonita como precursor del catalizador. El catalizador fue evaluado en forma reducida en la descomposición del metano a 700°C. Los nanotubos de carbono obtenidos fueron del tipo multicapa, los cuales fueron caracterizados con Difracción de rayos X (DRX), Microscopía electrónica de transmisión (TEM), microscopía electrónica de barrido (SEM) y análisis termogravimétrico (TGA). Las micrografías TEM mostraron que los MWCNTs poseen diámetros internos que van desde 5 hasta 30 nm y diámetros externos de hasta 60 nm y varias micras de longitud.
Palabras clave: Descomposición de metano, Limonita, Nanomateriales, Nanotubos de carbono.
Abstract
Multi-walled carbon nanotubes were synthesized using methane as carbon source and Colombian natural limonite ore as catalyst precursor. Catalyst was evaluated in reduced form in the reaction decomposition of methane at 700°C. Multi walled carbon nanotubes were characterized by X-ray diffraction (XRD), transmission electron microscopy (TEM), scanning electron microscopy (SEM) and thermogravimetric analysis (TGA). Finally, TEM micrographs showed that the MWCNTs have inner diameters ranging from 5 to 30 nm and outer diameters up to about 60 nm, and several microns in length.
Keywords: Carbon nanotubes, Colombia's Limonite ores, Nanomaterials, Methane decomposition.
1. Introducción
Los minerales basados en hierro ocupan el 4º lugar en abundancia entre todos los elementos en la corteza terrestre. Entre los más abundantes están la magnetita, siderita y limonita. La limonita es un mineral natural compuesto por óxidos hidratados de hierro (III) en su mayoría goethita, su contenido de hierro está entre el 20 y el 45% y su fórmula genérica es frecuentemente escrita como FeO(OH)·nH2O.
Este mineral es una atractiva alternativa como catalizador por su alto contenido en hierro porque no es costoso y es un recurso abundante Souza et al. (2007).
Se han realizado muchos estudios utilizando como catalizador la limonita, por ejemplo en la licuefacción directa de carbón Kaneko et al. (2002), la descomposición de amoniaco Tsubouchi et al. (2008), la oxidación orgánica, hidrocraqueo Matsumura et al. (2005), entre otros; sin embargo, no hay ningún reporte de su potencial catalítico para el crecimiento de nanotubos de carbono.
El término nanotubo de carbono se relaciona normalmente con una estructura con los planos basales del carbono paralelos al eje del tubo. Las "nanofibras de carbono" (CNFs) son un término más general que se refiere a las estructuras de grafito con otras orientaciones del plano de grafeno, por lo que los CNTs se pueden considerar como un caso especial de las CNFs. Los nanotubos de carbono y nanofibras de carbono tienen muchas propiedades únicas, tales como alta resistencia a los ácidos y bases fuertes, alta conductividad eléctrica, alta área superficial y una alta resistencia mecánica Xie et al (2000). Estas propiedades hacen que losnanotubos de carbono posean un gran nuero de aplicaciones, tales como soportes de catalizadores, agentes de adsorción selectiva, almacenamiento de hidrógeno, refuerzo en materiales compuestos, dispositivos nano-electrónicos y nano-mecánicos y dispositivos de emisión de campo, etc Lozano & Barrera (2001).
Existen varios métodos para producir nanotubos de carbono, tales como descarga de arco Iijima (1991), ablación laser Kusaba et al (2006), deposición catalítica en fase de vapor (CVD) Li et al (1996), entre otros Terrones et al (1998). El método CVD normalmente es preferido debido a su simplicidad y a que permite la obtención de cantidades grandes de producto.
Los catalizadores para la producción de MWCNTs por el método CVD son usualmente basados en metales de transición (Fe, Co, Ni) soportados en óxidos inorgánicos. Hidrocarburos gaseosos como metano, etanol y ferroceno son usados como fuente de carbono Gallego et al (2011), Chaisitsak et al (2007). Pero por lo general la síntesis de los catalizadores es complicada y costosa ya que es necesario reactivos de alta calidad y condiciones especiales de síntesis. Sin embargo, el costo de producción de los nanotubos de carbono podría reducirse si se utiliza el método de CVD con un material natural como catalizador lo cual haría que el proceso fuera más amigable con el medio ambiente.
En este trabajo se presenta la síntesis de nanotubos de carbono de capa múltiple (MWCNTS) por el método de CVD usando CH4 como fuente de carbono y limonita como precursor catalítico.
2. Metodología
2.1 Preparación del catalizador El mineral limonita se empleó como catalizador. La muestra de limonita en polvo fue calcinada en atmosfera de aire a 800°C durante 7 horas. Para estos experimentos se utilizó mineral con un tamaño de partícula inferior a los 60µm
2.2 Reacción de descomposición de metano
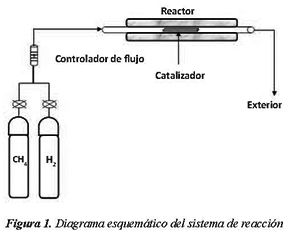
El diagrama esquemático del sistema de reacción se muestra en la Figura 1. La descomposición del metano fue llevada a cabo en flujo continuo en un reactor de cuarzo de 25mm de diámetro interno a una temperatura de 700°C a presión atmosférica.
Aproximadamente 50 mg del catalizador se introdujeron en el reactor y luego se sometió a tratamiento térmico bajo atmosfera de H2 (20mL/min) a 700°C durante 60 minutos, con el objetivo de formar Fe° metálico.
Luego de la reducción a 700°C, 20 mL/min de CH4 (99.995% de pureza) fueron introducidos al reactor a 700 °C y se mantuvo a esta temperatura por 4 horas.
Los nanotubos de carbono obtenidos fueron purificados por tratamiento con acido para disolver el catalizador. Los MWCNTs fueron tratados con H2SO4 95.9%, por una hora bajo continua agitación. El producto fue filtrado y lavado con agua des ionizada. El residuo fue luego secado a 100 °C por 24 h.
2.3 Caracterización
El catalizador fue caracterizado por difracción de rayos X (DRX) usando un difractómetro de rayos X marca Palytical referencia X´PERT PRO MPD con ánodo cerámico de Cu con radiación CuKa1= 1,5406 å, operado con una potencia de 45 kV y 40 mA. Se hizo un barrido en 2 theta entre 4° a 70° con un paso de 0,013° y un tiempo de 59s/paso con rotación (spinning) de 90°/s.
El análisis en el microscopio electrónico de transmisión (TEM) fue llevado a cabo en un equipo Philips CM120, con filamento de LaB6 y equipado con un analizador de rayos X (EDX). Las imágenes TEM fueron tomadas después de la purificación de los MWCNTs.
La microscopia electrónica de barrido (SEM) se llevó a cabo en un microscopio JEOL JSM 840.
Experimentos de TPR se realizaron en un equipo NETZSCH STA 409 CD TGA con 20 mg de la muestra bajo atmosfera de hidrógeno a 50 mL/min con velocidad de calentamiento de 10°C/min.
El análisis termogravimétrico (TGA) de los nanotubos de carbono se llevó a cabo en el mismo equipo NETZSCH STA 409 CD equipo TGA. Las muestras se colocaron en una porta muestras de alúmina en cantidades entre 5 a 8 mg y se calentó a 10°C/min desde temperatura ambiente hasta 900°C en atmósfera de aire.
3. Resultados y discusión
3.1 Difracción de rayos X de la limonita
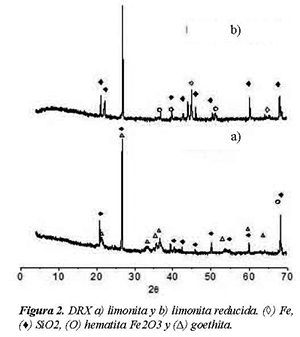
El patrón de difracción de rayos X (DRX) para el mineral limonita calcinada antes y después de reducción es mostrado en la Figura 2.
El patrón de difracción reveló los picos característicos de la goethita y SiO2, lo que mostró que el mineral limonita se compone de una mezcla de estas dos fases principalmente.
Después del tratamiento en atmosfera de hidrógeno a 700°C, se observan las líneas de difracción características de la hematita y del Fe°.
Este resultado concuerda con el TPR (sección 3.2), mostrando que la limonita puede ser reducida parcialmente a una temperatura de 1200°C bajo atmosfera de H2 puro.
3.2 Reducción a temperatura programada (TPR) de la limonita
Experimentos de TPR se realizaron en un equipo NETZSCH STA 409 CD TGA con 20 mg de la muestra bajo atmosfera de hidrógeno a 50 mL/min con velocidad de calentamiento de 10°C/min.
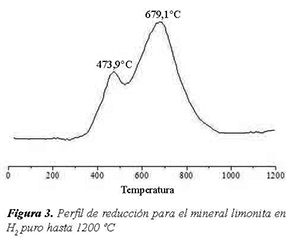
El perfil de reducción a temperatura programada (TPR) del mineral limonita es presentado en la Figura 3, donde se observan dos eventos principales. El primer evento es pequeño y está centrado aproximadamente a 450°C. Este evento corresponde a la modificación de la estructura de la goethita para dar una mezcla de hematita y hierro metálico, ver Ec. (1)
El segundo evento, es un pico ancho desde 520 °C hasta 900 °C, el cual corresponde a varios eventos simultáneos: la continuación de la reducción parcial de la goethita para producir hematita, hierro metálico y agua; y a la reducción de la hematita para dar magnetita, metálico y agua Ec. (2).
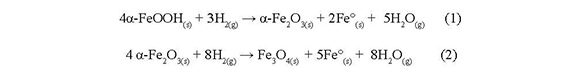
Después de reducir a 1200°C, se realizó difracción de rayos X (No presentados en este trabajo), los cuales mostraron la presencia de óxidos de hierro en la muestra reducida, lo que sugiere que solo una porción del hierro contenido en la goethita es reducido hasta Fe°, el resto permanece en la estructura de la hematita y magnetita. Sería necesario reducir a más de 1200°C para reducir totalmente la muestra mineral.
3.3 Análisis elemental del mineral limonita
La tabla 1 muestra el análisis elemental del mineral limonita. En la limonita, el Fe es el mayor constituyente (alrededor del 25% Fe2O3) seguido por Si (20% SiO2), Al (4% Al2O3). Trazas de elementos como Mg, Zn se encontraron también.
3.4 Microscopía de barrido electrónica (SEM) de la limonita
Las imágenes de microscopia electrónica de barrido (SEM) del mineral limonita son mostradas en la Figura 4. En esta Figura puede observarse que este mineral no tiene una superficie muy porosa. De igual forma se observan particulas esfericas de alrededor 500 micras.
3.5 Microscopia electrónica de Barrido (SEM) y de transmisión (TEM) de los nanotubos de carbono
Después de reacción los MWCNTs obtenidos fueron purificados por tratamiento con H2SO4-95,9% para remover las partículas del catalizador. Después de esta purificación se realizaron los estudios de microscopia electrónica de barrido y transmisión. Las micrografías SEM se muestran en la Figura 5, las cuales muestran la formación de filamentos carbonosos. Para verificar la formación de nanotubos de carbono se realizó Microscopía electrónica de transmisión (ver Figura 6). Las micrografías TEM proveen una clara evidencia de la formación de nanotubos multicapa durante la reacción de descomposición de metano, los cuales poseen varias micras de longitud.
Los diámetros interiores van desde 11 nm a 28 nm y un diámetro exterior de hasta alrededor de 47 nm. En estas micrografías electrónicas se observaron partículas metálicas encapsuladas, tal como se ha reportado en la literatura para el mecanismo de crecimiento durante el método CVD, Sierra et al (2010).
3.5.1 Caracterización termogravimétrica de los MWCNTs
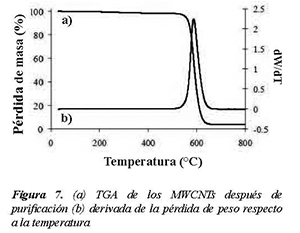
Después de purificación con acido un análisis termogravimétrico fue llevado a cabo para estudiar el comportamiento en la oxidación de los MWCNTs. El análisis se realizó con una velocidad de calentamiento de 10°C/min hasta 800°C en atmosfera de aire. El perfil de la oxidación se presenta en la Figura 7.
Una pérdida inicial del 0.5% ocurre desde temperatura ambiente hasta los 200 °C, la cual es atribuida a la remoción de agua fisisorbida o CO2. Una segunda pérdida del 3.5% se observa hasta los 550 °C, la cual puede ser atribuida a la oxidación de carbono amorfo conteniendo especies CHx o nanotubos con defectos en su estructura Djaidja et al (2006), Misra et al (2006). Esta pérdida es muy pequeña sugiriendo que la cantidad de carbono con estructuras desordenadas es muy baja.
La oxidación total de los nanotubos de carbono ocurre entre los 550 y 620°C. Después de la oxidación aproximadamente un 5% de la masa original queda como residuo, proveniente tal vez de las partículas metálicas que quedaron encapsuladas en el carbón y que no pudieron ser disueltas con el ácido. La derivada de la pérdida de peso presenta un solo evento de oxidación con un máximo a los 590 °C. Esta temperatura de oxidación de los MWCNTs (590°C) es menor a la reportada por Ajayan de 700°C para MWCNTs preparados por descarga de arco Ajayan et al (1993), y mucho mayor que la reportada por Kukovitskii de 420°C para MWCNTs preparados por descomposición de propileno Kukovitskii et al (1997). La pureza de los MWCNTs fue estimada alrededor de 96% ya que durante los procesos de purificación no hubo pérdida de peso, y en la oxidación con aire en el TGA perdió menos del 4% hasta los 500°C.
4. Conclusiones
El mineral limonita después del proceso de reducción con H2 mostró actividad catalítica para la descomposición del metano hacia nanotubos de carbono. Los nanotubos obtenidos fueron multicapa, con diámetros internos que van desde 11 nm a 28 nm y diámetro exterior de hasta 47 nm como se observó en las micrografías TEM.
Análisis TGA mostró que la pureza de los MWCNTs era aproximadamente del 96 %, y su temperatura de oxidación esta alrededor de 590 °C. Esta temperatura de oxidación sugiere que los MWCNTs poseen un alto grado de grafitación y orden estructural comparados con los MWCNTs preparados por métodos catalíticos reportados en la literatura.
5. Agradecimientos
Los autores agradecen a la Universidad Nacional de Colombia y a la Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República por la financiación el proyecto "MODIFICACIóN DEL COEFICIENTE DE FRICCIóN ENTRE ACEROS INOXIDABLES USANDO NANOTUBOS DE CARBONO OBTENIDOS POR VIA CATALíTICA" con código 2.668.
6. Referencias bibliográficas
Ajayan, P., Ebbesen, T., Ichihashi, T., Iijama, S., Tanigaki, K., & Hiura, H. (1993). Opening carbon nanotubes with oxygen and implications for filling. Nature, 362 (6420), 522-525. [ Links ]
Chaisitsak, S., Nukeaw, J., & Tuantranont, A. (2007). Parametric study of atmosphericpressure single-walled carbon nanotubes growth by ferrocene-ethanol mist CVD. Diamond and Related Materials, 16 (11), 1958-1966. [ Links ]
Djaidja, A., Libs, S., Kiennemann, A., & Barama, A. (2006). Characterization and activity in dry reforming of methane onNiMg/ Al and Ni/MgO catalysts. Catalysis Today, 113 (3-4), 194-200. [ Links ]
Gallego, J., Sierra, G., Mondragon, F., Barrault, J., & Batiot-Dupeyrat, C. (2011). Synthesis of MWCNTs and hydrogen from ethanol catalytic decomposition over a Ni/La2O3 catalyst produced by the reduction of LaNiO3. Applied Catalysis A: General, 397 (1-2), 73-81. [ Links ]
Kaneko, T., Sugita, S., Tamura, M., Shimasaki, K., Makino, E., & Silalahi, L. (2002). Highly active limonite catalysts for direct coal liquefaction. Fuel, 81 (11-12), 1541-1549. [ Links ]
Kukovitskii, E., Chernoszatonskii, L., L'vov, S., & Mel'nik, N. (1997). Carbon nanotubes of polyethylene. Chemical Physics Letters, 266 (3- 4), 323-328. [ Links ]
Kusaba, M., Tsunawaki, Y., (2006). Production of single-wall carbon nanotubes by a XeCl excimer laser ablation. Thin Solid Films, 26 (506-507), 255-258. [ Links ]
Li, W., Xie, S., Qian, L., Chang, B., Zou, B., Zhou, W., Zhao, R., & Wang, G. (1996). Largescale synthesis of aligned carbon nanotubes. Science, 274 (5293), 1701-1703. [ Links ]
Lijima. S. (1991). Helical microtubules of graphitic carbon. Nature, 354, 56-58. [ Links ]
Lozano, K., & Barrera, E. (2001). Nanofiberreinforced thermoplastic composites. I. Thermoanalytical and mechanical analyses. Journal of Applied Polymer Science, 79 (1), 125-133. [ Links ]
Matsumura, A., Sato, S., Kondo, T., Saito, I. & Souza, W. (2005). Hydrocracking Marlim vacuum residue with natural limonite. Part 2: Experimental cracking in a slurry-type continuous reactor. Fuel, 84 (4), 417-421. [ Links ]
Misra, A., Tyagi, P., Singh, M., & Misra, D. (2006). FTIR studies of nitrogen doped carbon nanotubes. Diamond and Related Materials, 15 (2-3), 385-388. [ Links ]
Sierra, G., Barrault, J., Batiot-Dupeyrat, C., & Mondragón, F. (2010). Production of hydrogen and MWCNTs by methane decomposition over catalysts originated from LaNiO3 perovskite. Catalysis Today, 149 (3-4), 365-371. [ Links ]
Souza, W., Guimarães, I., Oliveira, L., Guerreiro, M., Guarieiro, A., & Carvalho, K. (2007). Natural and H2-reduced limonite for organic oxidation by a Fenton-like system: Mechanism study via ESI-MS and theoretical calculations. Journal of Molecular Catalysis A: Chemical, 278 (1-2), 145-151. [ Links ]
Terrones, M., Grobert, N., Olivares, J., Zhang, J., Terrones, H., Kordatos, K., Hsu, W. et. al. (1998). Preparation of aligned carbon nanotubes catalysed by laseretched cobalt thin films. Chemical Physics Letters, 285 (5-6), 299-305. [ Links ]
Tsubouchi, N., Hashimoto, H., & Ohtsuka, Y. (2008). Sulfur tolerance of an inexpensive limonite catalyst for high temperature decomposition of ammonia. Powder Technology, 180 (1-2), 184-189. [ Links ]
Xie, S., Li, W., Pan, Z., Chang, B. & Sun, L. (2000). Mechanical and physical properties on carbon nanotube. Journal of Physics and Chemistry of solids, 61 (7), 1153-1158. [ Links ]

Revista Ingeniería y Competitividad por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento - Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.