Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y competitividad
Print version ISSN 0123-3033
Ing. compet. vol.14 no.2 Cali July/Dec. 2012
Efecto fotocatalítico del TiO2-Au sobre células de cáncer de cuello uterino
Photocatalytic Effect of TiO2-Au on cells of cervical cancer
R. J. Camargo-Amado
Escuela de Ingeniería Química, Universidad del Valle, Cali, Colombia
E-mail: ruben.camargo@correounivalle.edu.co
Eje temático: Ingeniería química / Chemical engineering
Recibido: Mayo 28 de 2012
Aceptado: Noviembre 19 de 2012
Resumen
Los fotocatalizadores han abierto las puertas a múltiples aplicaciones en ciencia y medicina, entre ellas el TiO2 en presencia de luz ultravioleta UV-A se está abriendo espacio en el futuro tratamiento de diferentes tipos de cáncer. En este trabajo se determinó el efecto fotocatalítico de los compuesto TiO2 y TiO2-Au sobre células de cáncer de cuello uterino (HeLa) y células sanas de ovario de hámster chino (CHO). Se variaron las concentraciones de los compuestos, los tiempos de exposición a la luz UV-A y la presencia o ausencia de luz UV-A. Para cada caso se midió la citotoxicidad de los compuestos sobre las células HeLa y CHO a través de la prueba lactatodeshidrogenasa (LDH). El mayor porcentaje de citotoxicidad en células HeLa fue 43.2 %, mientras la citotoxicidad en células CHO fue negativa en todos los casos. Los compuestos no causan efecto citotóxico sobre la línea celular CHO.
Palabras clave: CHO, HeLa, Fotocatálisis, TiO2-Au, TiO2.
Abstract
Photocatalysts have opened the possibilities to many applications in science and medicine. The TiO2 in presence of ultraviolet UV-A is opening up space in the future treatment of various cancers. In this work we determined the effect of the composite photocatalytic TiO2 and TiO2-Au on cells of cervical cancer (HeLa) and healthy cells of Chinese hamster ovary (CHO) cell lines. Was varied compound concentration, the exposure time to UV-A and the presence or absence of UV-A. Was measured cytotoxicity of the compounds on HeLa and CHO cells with Lactatedeshydrogenase test (LDH). The highest cytotoxicity in HeLa cells was 43.2 %, while the cytotoxicity in CHO cells in all cases was negative. The compounds causes no cytotoxic effect on CHO cell lines.
Keywords: Cervical cancer, Photocatalysis, TiO2-Au, TiO2.
1. Introducción
El cáncer es uno de los principales problemas de salud pública a nivel mundial, encabeza la lista de causas de mortalidad más frecuentes. Los métodos más comunes para el tratamiento del cáncer son: la quimioterapia (utilización de fármacos), la radioterapia (usando fuentes radioactivas), la cirugía o la combinación de estos métodos. Estos aunque tienen efectividad, igualmente causan fuertes efectos secundarios como daño celular y alteraciones celular, Sohl et al (2009).
El dióxido de titanio (TiO2) es un buen fotocatalizador frente a otros semiconductores, debido a que posee un adecuado valor de banda prohibida (~3.2 eV) con lo que se posibilita que fotones de luz ultravioleta tengan la energía suficiente para generar pares electrón-hueco. La fototerapia de células malignas, utilizando el TiO2, ha sido reconocido como un potencial agente foto-sensibilizador de la terapia fotodinámica (PDT por sus siglas en ingles) debido a su efecto foto-tóxico, López et al (2010), Allison et al (2008). Algunos trabajos se han orientado a la determinación del mecanismo de acción del TiO2 en la célula. Thurn et al (2011), estudiaron la endocitosis del TiO2 nonoparticulado en células de cáncer prostático PC-3M.
Liu et al (2003), estudiaron la posibilidad de mejorar las propiedades mecánicas del TiO2 agregando nanopartículas de oro. Nguyen et al (2006), sintetizaron por el método sol-gel, partículas de TiO2-Au para usarlas como catalizadores para reducción selectiva de NOx. Igualmente el oro en conjunto con el TiO2 mejora la actividad fotocatalítica porque facilita la separación de los pares electrón-hueco, Luo et al (2011). Por otro lado las nanopartículas de oro han tenido su aplicación en cáncer, se ha demostrado que sirven para diagnosticar células de cáncer de cuello uterino de la línea celular HeLa, Zhang et al (2010). En el presente trabajo su determinó el efecto fotocatalítico de partículas de TiO2 y TiO2-Au, sobre células HeLa y sobre células sanas de la línea celular CHO.
2. Metodología
Para determinar el efecto que tiene la presencia de radiación UV, el tiempo de exposición a la radiación y la concentración de los compuestos sobre células cancerígenas de cuello uterino, se planifico un desarrollo metodológico que partió de la construcción de un reactor fotocatalítico, luego se sintetizaron los materiales. Posteriormente se hace el tratamiento fotónico de las células HeLa y CHO con la luz ultravioleta en presencia de compuestos a base de TiO2 y finalmente se hace la determinación de la citotoxicidad.
2.1 Fotorreactor
Se construyó un reactor fotocatalitico con sistema de control de temperatura y del tiempo de prueba, el cuerpo del reactor se fabricó en aluminio refractivo. El foto-reactor se construyó provisto de ocho lámparas ultravioleta Sen-Lite FT8/potencia de 18W cada una, ubicadas en la parte superior del reactor, las lámparas emiten preferencialmente a los 365 nm (Veáse figura 1).
2.2 Síntesis de materiales
A temperatura ambiente y bajo agitación moderada, se solubiliza Tetrabutóxido de Titanio (TBT), Ti(OBu)4- en alcohol etílico anhidro, posteriormente en forma lenta se adiciona agua destilada y desionizada al medio, en el proceso se da la hidrólisis y policondensación, finalmente el sol obtenido se llevó a un desecador por 72 h, dando tiempo a la terminación de la reacción de condensación. Posteriormente se seca a 100 °C, se precalcinó a 200°C y se calcinó a 500ºC para obtener fase anatasa del TiO2, Vargas et al (2011).
Para la síntesis de TiO2-Au se parte del TiO2 previamente sintetizado y sobre el cual se deposita oro por pulverización catódica. A 0.5 g de TiO2 en polvo se le expuso a vapor de oro generado por la acción de plasma de argón sobre un blanco de oro, el procedimiento se llevó a cabo durante 6 min dentro de un equipo Denton Vacuum Sputter Coater, a 200 miliTor de vacio y con una corriente de 30 mA. Para la caracterización del TiO2 y del TiO2Au se realizó espectroscopia Infrarroja con Transformada de Fourier (FTIR) y Difracción de rayos X (DRX).
2.3 Proceso fotodinámico en las células HeLa y CHO
En la presente investigación se trabajaron cinco variables con dos niveles cada una, las variables fueron tipo de célula, tipo de compuesto o fotocatalizador, concentración del compuesto, tiempo y luz UV.
Se usaron las líneas HeLa 229 y CHO-K1 del centro de cultivos celulares American Type Culture Collection (ATCC). Las células HeLa y CHO fueron descongeladas, cultivadas y sembradas en las placas de cultivo un día antes de la prueba experimental.
Con base en pruebas realizadas preliminarmente se determino trabajar con concentraciones de 100 µg/ml y 200 µg/ml tanto para el TiO2 como para el TiO2-Au. Igualmente en pruebas preliminares de determinó trabajar con tiempos de 20 min y 40 min con presencia de luz UV y en ausencia de luz UV.
Para dispersar el compuesto en el medio de cultivo, las soluciones de TiO2 y TiO2-Au se mantuvieron en ultrasonido por 30 minutos. En microplacas Falcon de 96 pozos se sembraron 5.000 células por pozo y se agregó 200 μL medio de cultivo HMEM con 10% de suero fetal bovino en cada pozo. Luego se incubaron por 24 horas A 37°C, 5% de CO2 en ambiente de humedad. Todos los procedimientos se realizaron en cabina de flujo laminar tipo A2B3 y en todos los casos se realizaron 3 replicas de cada ensayo.
30 minutos antes de ser ingresadas al reactor fotocatalitico, se descarta el medio de cultivo de las células y se reemplaza por medio de cultivo con TiO2 o TiO2-Au, se dejan en reposo y en la oscuridad. Es importante anotar que una réplica de todas microplacas introducidas al reactor, fueron protegidas de la luz UV, para analizar el comportamiento de las células en presencia de compuestos pero en ausencia de luz UV.
Se usaron dos controles para esta prueba, control bajo que consta de medio de crecimiento con células. Control alto: que consta de medio de crecimiento con células y Triton X-100 al 2% (agente citotóxico). Los dos controles se trabajaron con las dos concentraciones, los dos compuestos, con los dos tiempos y con y sin luz UV.
2.4 Pruebas
Para analizar el efecto citotóxico sobre las líneas celulares, se midió la citotoxicidad haciendo uso de la prueba comercial registrada Roche de lactato deshidrogenasa (Kit LDH). En este procedimiento el cambio de color de la solución está relacionado con el aumento de células muertas o citotoxicidad, el color se mide en un equipo lector de Elisa (STAT FAX - 2100, AWARE TECHNOLOGY INC), con lo que se cuantifica finalmente la citotoxicidad.
Luego de aplicar la terapia fotodinámica se adicionaron 50 µL a cada pozo la solución reactiva LDH. Para la preparación de la solución reactiva de LDH se diluyó el polvo de catálisis (ROCHE) en 1 mL de agua destilada estéril, se adicionó 250 µL de esta solución a 11.25 mL de solución de dilución (dye solution ROCHE). Los cultivos fueron incubados media hora antes de ser llevadas al lector de placas ELISA y medir los resultados de citotoxicidad.
Los controles utilizados en las pruebas LDH fueron: Control blanco: consta de 200µl medio de cultivo sin células y 50µl de LDH. Control bajo: consta de 200µl medio de crecimiento con células no tratadas y 100µl de LDH. Control alto: consta de 100 µl medio de crecimiento con células, 100 µl de LDH y Triton X-100 al 2% (agente citotóxico para máxima citotoxicidad)
3. Resultados y discusión
3.1 Análisis FTIR
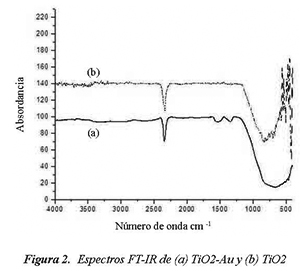
En la Figura 2 se observa el espectro de (a) TiO2-Au y (b) TiO2. Se detecta el cumulo de las bandas características del TiO2 entre 500 y 1000 cm-1, que se caracterizan por formar un domo casi continuo de señal. Igualmente se puede observar la banda en 2350 cm-1, que identifica al TiO2 en su fase anatasa, dichas bandas son reportadas en la literatura sobre FTIR (Wu & Cheng en 2006, Téllez et al en 2004).
En el espectro de TiO2-Au se observan dos bandas una a 1532 cm-1 y otra a 1340 cm-1 atribuibles a la presencia de Au, igualmente reportadas por Lin et al (2004).
Los espectros FTIR dan indicios claros de la formación de durante la síntesis TiO2 y de la presencia del oro, en el caso del TiO2-Au, sin embargo se busco una técnica diferente que sirviera para corroborar la información y por tal razón se hicieron pruebas de difracción de rayos X (DRX), que son mostrados a continuación.
3.2 Análisis de DRX
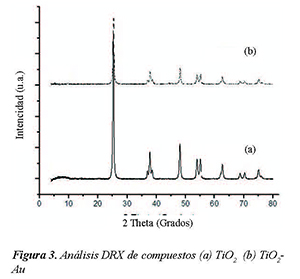
En la Figura 3 se observa el DRX de (a) TiO2 y de (b) TiO2-Au. El análisis del difractograma (a) mostró que los ángulos corresponden a los picos característicos de TiO2 anatasa con cristalografía hexagonal. El análisis del difractograma (b) mostró la presencia de dos fases, una hexagonal correspondiente a TiO2 anatasa y un 1% de fase cúbica correspondiente a oro.
Los resultados de caracterización FTIR y DRX demostraron que los compuestos sintetizados son efectivamente TiO2 y TiO2-Au, igualmente se comprobó que el TiO2 está en fase anatasa, dicha fase es la más activa fotocatalíticamente debido a su menor ancho separación de la banda prohibida de 3.0 eV.
3.3 Análisis de citotoxicidad
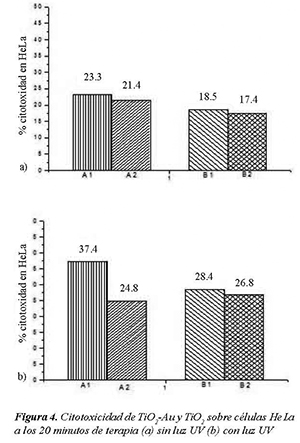
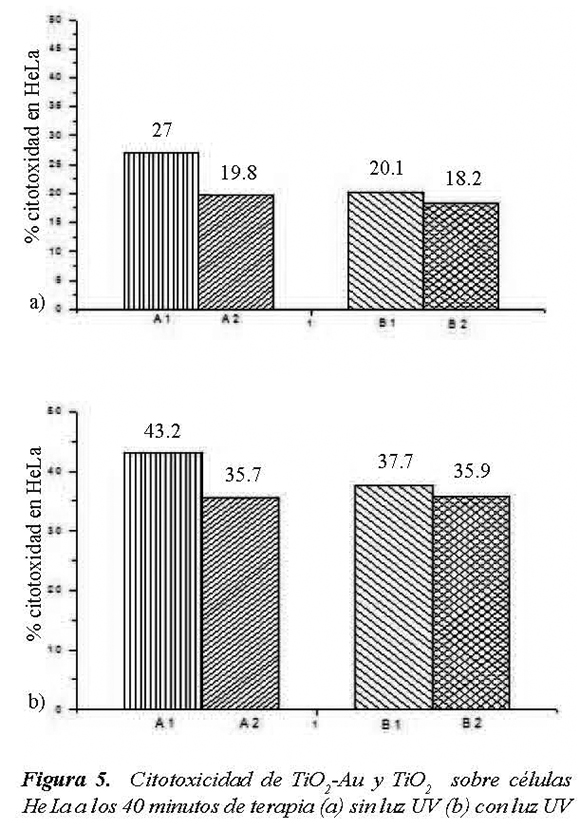
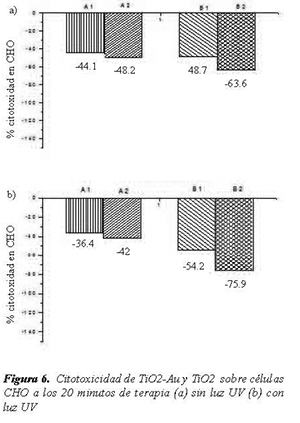
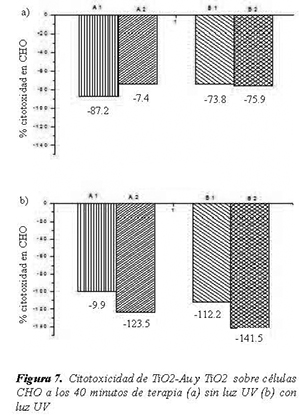
Se realizaron pruebas de citotoxicidad por LDH tanto a células HeLa como a células CHO. En la nomenclatura utilizada se denominó A1 al TiO2- Au a 200 ppm, A2 al TiO2-Au a 100 ppm, B1 al TiO2 a 200 ppm y B2 al TiO2 a 100 ppm.
En la Figura 4 y la Figura 5 se resumen los resultados de citotoxicidad generada sobre células HeLa para todos los casos trabajados con 20 minutos de terapia (Figura 3), y con 40 minutos de terapia (Figura 4).
En la Figura 6 y la Figura 7 se resumen los resultados de citotoxicidad generada sobre células CHO para todos los casos trabajados con 20 minutos de terapia (Figura 6), y con 40 minutos de terapia (Figura 7).
De las pruebas microbiológica de citotoxicidad, se tiene en general dos grandes grupos de pruebas, las realizadas a células HeLa y las realizadas a células CHO. La línea celular HeLa son células cancerígenas, mientras la línea celular CHO son células no cancerígenas. Dicho de otra manera se realizaron pruebas en células que representan células cancerosas y pruebas en células que representan células sanas.
La citotoxicidad en general para las células cancerígenas dio positiva y mayor al 17 %. La mínima citotoxicidad para las células HeLa se dio al exponerlas durante 20 minutos a una solución con 100 ppm de TiO2, sin presencia de luz UV. Al aplicar simultáneamente la luz UV y los compuestos se generaron aumentos paulatinos de la citotoxicidad hasta llegar a un máximo experimental de 43.2 % para células HeLa expuestas durante 40 minutos al TiO2-Au de 200 ppm y con presencia de luz UV, con lo que se está cerca de la dosis letal 50.
Se pudo igualmente observar que en general el TiO2-Au generó una mayor citotoxicidad para HeLa que la generada por el TiO2 sin modificar. El resultado se puede relacionar con el reportado por Liu et al (2009), ellos encontraron que el TiO2-Au fue más efectivo que el TiO2, en el ataque de carcinoma mamario EMT6, ellos usaron radiación de rayos X en vez de luz UVA. Los rayos X son mucho más energéticos que la luz UV, razón por la cual pueden ser perjudiciales para la salud, hasta el punto de provocar cáncer.
En general el aumento en la concentración del compuesto generó un aumento de la citotoxicidad, esto debido al aumento de partículas de fotocatalizador y el aumento en el área disponible que repercute en un aumento de la actividad del fotocatalitica. Igualmente dicha tendencia permite inferir una mayor efectividad del ataque fotocatalítico sobre las células HeLa a concentraciones por encima de las 200 ppm.
Una posible razón para que al adicionar partículas de Au al TiO2, se logre un aumento en potencia del ataque fotocatalítico del compuesto sobre las células cancerígenas HeLa, traducida en mayor citotoxicidad, está en que los metales nobles como el Au atenúan la recombinación de pares electrón-hueco, como lo explica en su trabajo Abdulla-Al-Mamun, y colaboradores (2011), ellos en su trabajo aplicaron fotocatálisis con TiO2 y con TiO2-Ag para atacar células Hela, de acuerdo con su teoría las partículas de plata conducen parcialmente a los electrones del par electron-hueco y los llevan a los niveles de Fermi, disminuyendo la posible recombinación de los pares y permitiendo una mayor actividad fotocatalitica.
El segundo grupo de pruebas de citotoxicidad realizado a células CHO, mostró un resultado muy interesante y es que la citotoxicidad en todos los casos dio negativa, en términos prácticos significa que las células sanas CHO no se ven afectadas por la presencia de luz UV-A de 365 nm, ni por la presencia partículas de TiO2 o TiO2-Au. El material y el tratamiento no son citotóxicos para las células CHO, bajo las condiciones experimentadas en el presente trabajo. Con las evidencias obtenidas en el presente trabajo no es posible explicar la razón fundamental para que las células CHO no se vean afectadas por la acción de los fotocatalizadores, igualmente en la literatura no existe un reporte definitivo sobre el mecanismo de acción de de tales compuestos en la célula. Para dilucidar un mecanismo preciso se hace necesario estudiar la interacción de la membrana, de la múltiple cantidad de células existentes y con el compuesto, así como la interacción de la membrana con las especies oxidantes que se generan. Es más, se hace necesario estudiar si los compuestos entran a las células, y de ser así estudiar si interactúan con la membrana nuclear, o con los orgánulos, o con las proteínas o finalmente con el ARN o con el mismo ADN. Solo cuando se tenga claridad en el mecanismo se podrá explicar la diferencia en la respuesta citotóxica de HeLa y de CHO. Es importante aclarar que este es un trabajo exploratorio que genera un interesante resultado pero que genera muchas preguntas e inquietudes.
4. Conclusiones
a nivel in-vitro de células cancerígenas HeLa, la muerte fue medida en términos de citotoxicidad, el tratamiento no afecta la viabilidad de células sanas CHO, dicho resultado abre la posibilidad y la necesidad de explorar este campo para la aplicación de terapia foto dinámica con TiO2 modificado para el ataque del cáncer.
La presencia de oro como modificador del TiO2 mejora el efecto en el ataque fotodinámico de células cancerígenas, la posible causa es el la desaceleración de las recombinaciones de los pares electrón-hueco debido a la presencia del metal; esto explica el mayor efecto citotóxico del TiO2-Au comparado con el TiO2 sobre células HeLa. Sin embargo no hay evidencia o análisis que explique porque no se genera citotoxicidad sobre células CHO, esto se debe a que en el momento no hay claridad en cuanto al mecanismo de acción del TiO2 y sus modificaciones con metales sobre células cancerígenas y no cancerígenas.
5. Agradecimientos
Se agradece por el apoyo financiero a la Universidad del Valle y a COLCIENCIAS proyecto "Muerte fotocatalítica de células cancerígenas de útero por efecto del Oxido de Titanio (TiO2) y radiación ultravioleta".
6. Referencias Bibliográficas
Abdulla-Al-Mamun, Yoshihumi, K., Tohfatul, Z., & Shariful, I. (2011). Synergistic cell-killing by photocatalytic and plasmonic photothermal effects of Ag@TiO2 core-shell composite nanoclusters against human epithelial carcinoma (HeLa) cells. Applied Catalysis A: General, 398, 134-142. [ Links ]
Allison, R., Mota, H., Bagnato, V., & Sibata, C. (2008). Bio-nanotechnology and photodynamic therapy-State of the art review. Photodiagnosis and Photodynamic Therapy, (5), 19-28. [ Links ]
Lin, Sh., Gluhoi, A. & Nieuwenhuys, B. (2004). Ammonia oxidation over Au/MOx/-Al2O3- activity, selectivity and FTIR measurements. Catalysis Today, (90), 3-14. [ Links ]
Liu, Ch., Yang, Y., Wang, Ch., Chien, Ch., Chen, Sh., Wang, Ch., Leng, W., et. al. (2009). Enhanced photocatalysis, colloidal stability and cytotoxicity of synchrotron X-ray synthesized Au/TiO2 nanoparticles. Materials Chemistry and Physics, (117), 74-79. [ Links ]
Liu, W., Chen, Y., Kou, G., Xua, T. & Sun, D. (2003). Characterization and mechanical/tribological properties of nano Au-TiO2 composite thin films prepared by a sol-gel process. Wear, (254), 994-1000. [ Links ]
López, T., Ortiz, E., Alvarez, M., Navarrete, J., Odriozola, J., Martinez-Ortega, F., et. al. (2010). Study of the stabilization of zinc phthalocyanine in sol-gel TiO2 for photodynamic therapy applications. Nanomedicine: Nanotechnology, Biology, and Medicine, (6), 777-785. [ Links ]
Luo, Sh., Xiao, Y., Yang, L., Liu, Ch., Su, F., Li, Y., Cai, Q., & Zeng, G. (2011). Simultaneous detoxification of hexavalent chromium and acid orange 7 by a novel Au/TiO2 heterojunction composite nanotube arrays. Separation and Purification Technology, (79), 85-91. [ Links ]
Nguyen, L., Salim, Ch., & Hinode, H. (2008). Performance of nano-sized Au/TiO2 for selective catalytic reduction of NOx by propene. Applied Catalysis A: General, (347), 94-99. [ Links ]
Sohl, S., Schnur, J., & Montgomery, G. (2009). A Meta-Analysis of the Relationship Between Response Expectancies and Cancer Treatment- Related Side Effects. Journal of Pain and Symptom Management, 38 (5), 775-784. [ Links ]
Téllez, L., Rubio, F., Peña-Alonso, R., & Rubio, J. (2004). Seguimiento por espectroscopia infrarroja (FT-IR) de la copolimerización de TEOS (tetraetilortosilicato) y PDMS (polidimetilsiloxano) en presencia de tbt (tetrabutiltitanio). Boletín de la Sociedad Española de Cerámica y Vidrio, 43 (5), 883-890. [ Links ]
Thurn, K., Arora, H., Paunesku, T., Wu, A., Brown, E., Doty, C., Kremer, J., et. al. (2011). Endocytosis of titanium dioxide nanoparticles in prostate cancer PC-3M cells. Nanomedicine: Nanotechnology, Biology, and Medicine, (7), 123-130. [ Links ]
Vargas, M., Ochoa, Y., Ortegón, Y., Mosquera, P., Rodríguez, & Camargo-Amado, R. J. (2011). Nanopartículas de tio2, fase anatasa, sintetizadas por métodos químicos. Ingeniería & Desarrollo, 29 (2), 186-201. [ Links ]
Wu, J. & Cheng, Y. (2006). In situ FTIR study of photocatalytic NO reaction on photocatalysts under UV irradiation. Journal of Catalysis, (237), 393-404. [ Links ]
Zhang, Z., Jia, J., Lai, Y., Ma, Y., Weng, J., & Sun, L. (2010). Conjugating folic acid to gold nanoparticles through glutathione for targeting and detecting cancer cells. Bioorganic & Medicinal Chemistry, 18, 5528-5534. [ Links ]

Revista Ingeniería y Competitividad por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento - Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.