Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y competitividad
versão impressa ISSN 0123-3033
Ing. compet. vol.16 no.1 Cali jan./jun. 2014
Obtención de carbones activados a partir de semillas de eucalipto, por activación química con H3PO4. Caracterización y evaluación de la capacidad de absorción de fenol desde solución acuosa
Obtaining of activated carbon from seeds of eucalyptus by chemical activation with H3PO4. Characterization and evaluation of adsorption capacity of phenol from aqueous solution
Nelson G. Rincón-Silva
Facultad de Ciencia y Tecnología, Departamento de Química, Universidad Pedagógica Nacional de Colombia, Bogotá, Colombia
E-mail: giovannyservo@hotmail.com
Wandy M. Ramirez-Gomez
Facultad de Ciencia y Tecnología, Departamento de Química, Universidad Pedagógica Nacional de Colombia, Bogotá, Colombia
E-mail: sara2716@hotmail.com
Lizeth C. Mojica-Sánchez
Facultad de Ciencia y Tecnología, Departamento de Química, Universidad Pedagógica Nacional de Colombia, Bogotá, Colombia
E-mail: licarozelina_9@hotmail.com
Diego A. Blanco-Martínez
Facultad de Ciencia y Tecnología, Departamento de Química, Universidad Pedagógica Nacional de Colombia, Bogotá, Colombia
E-mail: dablancom12@yahoo.com
Liliana Giraldo
Facultad de ciencias, Departamento de Química, Universidad Nacional de Colombia, Bogotá, Colombia
E-mail: lgiraldogu@unal.edu.co
Juan C. Moreno-Piraján
Facultad de ciencias, Departamento de Química, Grupo de Investigación de sólidos porosos y calorimetría, Universidad de Los Andes, Bogotá, Colombia
E-mail: jumoreno@uniandes.edu.co
Eje temático: Ingeniería química / Chemical engineering
Recibido: 28 de noviembre de 2011
Aceptado: 4 de octubre de 2013
Resumen
Se sintetizo carbón activado a partir de cáscara de semillas de eucalipto (Eucalyptus globulus Labil), por el método de activación química empleando como agente activante ácido fosfórico, a dos diferentes concentraciones; 30 y 80 % v/v. Los carbones se caracterizaron texturalmente mediante fisisorción de N2, se determinó la superficie específica aparente por el método B.E.T., donde se obtuvieron valores de 2009 y 1027 m2 g-1, se utilizó la ecuación Dubinin-Radushkevich para obtener el volumen de microporo donde se reportan valores de 0.65 y 0.32 cm3 g-1. Se determinó mediante el método Bohem que los carbones son de carácter ácido, aspecto corroborado por la determinación del pH en el punto de carga cero. Se establecieron interacciones energéticas de los sólidos frente a soluciones de HCl y NaOH mediante calorimetría de inmersión, encontrando gran correlación con el contenido de grupos ácidos y básicos de los sólidos. Finalmente se evaluó la capacidad de adsorción de los sólidos con fenol desde solución acuosa, ya que este es un contaminante prioritario, donde se evidenció gran capacidad de adsorción de los dos carbones debido a las amplias áreas superficiales, volúmenes de microporo y la química superficial de los sólidos.
Palabras clave: Carbón activado, adsorción, fenol, entalpia de inmersión, área superficial aparente, acidez y basicidad superficial.
Abstract
Activated carbons were prepared from shell Eucalyptus (Eucalyptus globulus Labil) by chemical activation using as activating agent solutions of phosphoric acid, at two different concentrations; 30 and 80% v/v. Carbons were texturally characterized by N2 physisorption, the apparent surface area was determined by B.E.T., method, values obtained were 2009 and 1027 m2 g-1. Dubinin-Radushkevich equation was used to obtain the micropore volume with values of 0.65 and 0.32 cm3 g-1. Boehm method established that the carbons are acidic aspect confirmed by determining the point of zero charge. Solid energetic interactions against HCl and NaOH solutions were established by immersion calorimetry finding great correlation with the content of acidic and basic groups of the solids. Finally, the adsorption capacity of the solid was evaluated with phenol from aqueous solution since this is a priority pollutant, where high adsorption capacity of the two carbons was evident due to the large surface area, micropore volume and surface chemistry of solids.
Keywords: Activated carbon, adsorption, phenol, immersion enthalpy, apparent surface area, surface acidity and basicity.
1. Introducción
El carbón activado es un material poroso carbonáceo con gran área superficial, es capaz de adsorber una gran diversidad de sustancias tanto gaseosas como líquidas, y es conocido desde principios del siglo pasado, por sus propiedades absorbentes. En la actualidad es ampliamente utilizado para remover el color, olor, sabor y un sin número de impurezas orgánicas durante el tratamiento de agua para el uso doméstico e industrial. También se usa en la recuperación de solventes, en la remoción del color en diversas esencias azucaradas, en el control de la contaminación ambiental, en la industria farmacéutica y médica. Martínez (2001).
La obtención de carbones activados a partir de material lignocelulósico es ampliamente usado en la industria química, debido al bajo costo y a la abundancia de este tipo de materiales en la naturaleza. Este tipo de precursores son también muy importantes, pues permiten la obtención de carbones activados con variedad de tamaños y distribuciones de poro, variando las condiciones de preparación tales como temperaturas y tiempos de activación. Marco et al (2005).
Durante el proceso de activación del carbón se presentan reacciones de oxidación y degradación de matrices de carbón, así como reordenamientos estructurales en los precursores, que permiten la acomodación de los átomos de carbono en dichas capas aromáticas, las cuales con frecuencia se agrupan formando pilares de algunas capas que estructuran unos pequeños cristales dentro de la disposición carbonosa de la matriz general. Huidobro et al. (2001).
En esta investigación se obtuvieron dos muestras de carbón activado mediante activación química, las cuales se caracterizaron por adsorción física de nitrógeno a 77 K, donde se determinaron sus propiedades texturales, y se caracterizaron sus propiedades químicas, además se evaluaron las interacciones energéticas de los sólidos frente a soluciones ácidas y básicas, mediante calorimetría de inmersión, los carbones activados obtenidos se aplicaron en la adsorción de fenol desde solución acuosa ya que este es un contaminantes prioritario, utilizado en un gran número de procesos industriales, farmacéuticos, petroquímicos, etc, por tanto es necesario removerlo del medio ambiente, se han estudiado una gran cantidad de técnicas para remover contaminantes del agua, tales como oxidación, intercambio iónico, etc, una de las más empleadas actualmente es la adsorción mediante sólidos carbonosos, Kumar et al (2007), proceso empleado en la presente investigación.
2. Metodología
En esta investigación se evaluó el efecto de la concentración del agente impregnante H3PO4 en la preparación de carbones activados por el método de activación química, para ello se fijó un tamaño de partícula comprendido entre 3.5 y 4.0 mm del material lignocelulosico, y se utilizaron dos concentraciones de agente activante 30 y 80 % V/V, seguido las muestras se carbonizaron en atmosfera de nitrógeno, además se evaluó la capacidad de adsorción de los carbones obtenidos en la remoción de fenol presente en disolución acuosa, variando la cantidad de fenol en un rango comprendido 50 a 1500 mg L-1. Los ensayos de caracterización y adsorción se efectuaron por triplicado.
2.1 Tratamiento del precursor
El precursor utilizado en esta investigación fue material lignocelulósico, específicamente semillas de eucalipto, estas fueron recolectadas en Bogotá (Colombia). Las semillas fueron secadas a una temperatura de 90 °C y posteriormente trituradas mecánicamente para después tamizarlas a un tamaño de partícula entre 3.5 y 4.0 mm, adecuado para la preparación de carbón activado en presentación granular. Reinoso (2007).
2.2 Activación de las Muestras
La cáscara de semilla de Eucalipto se impregnó con disoluciones de H3PO4 por un tiempo de 12 horas con agitación constante, empleando dos concentraciones diferentes del ácido. Las condiciones controladas en la impregnación fueron:
- Concentración del ácido: 30 y 80 % v/v.
- Relación de impregnación del ácido y la muestra: 200 mL de ácido/100 g Muestra.
Seguido se procedió a la carbonización de las muestras en atmósfera de nitrógeno, en un horno horizontal Thermolyne F79300. Empleando una celda de acero inoxidable para contener las muestras, estas fueron carbonizadas a 600 °C con flujo de nitrógeno de 100 cm3 min-1 y una velocidad de calentamiento lineal de 5 °C min-1, por un tiempo de residencia de dos horas. Los residuos generados durante el proceso de carbonización, principalmente son alquitranes, estos se controlaron mediante trampas de recolección empleado soluciones de bases fuertes, para posteriormente ser recolectadas en frascos de plástico adecuadamente etiquetados para su control, disminuyendo el impacto ambiental que generar estos alquitranes si son vertidos sin ningún tipo de control en la atmosfera. De esta manera se sintetizan carbones activados sin generar grandes problemas ambientales.
2.3 Caracterización
2.3.1 Análisis Termogravimétrico del precursor
Se tomó 0.100 g de la semilla de Eucalipto y se llevó hasta 1000 °C, con una rampa de temperatura de 10 °C min-1 y un flujo de nitrógeno de 100 cm3 min-1. El análisis se realizó en un equipo TGDSC Netzsch STA 409 PC, obteniendo valores de porcentaje de pérdida de masa en función de la temperatura, y se escoge la temperatura óptima para llevar a cabo el proceso de carbonización.
2.3.2 Análisis próximo del precursor y de los carbones obtenidos
La determinación de humedad de las muestras se realizó de acuerdo a la norma ASTM 2867 revisión 2004. El análisis del contenido de materia volátil de las muestras se realizó de acuerdo con la norma ASTM 5832 revisión 2003. El contenido total de cenizas se determinó de acuerdo con la norma ASTM 2866 revisión 2004. El contenido de carbono fijo se determinó por diferencia respecto a los demás ensayos del análisis próximo.
2.3.3 Química superficial
Se empleó el método de las titulaciones selectiva Boehm para la determinación de sitios básicos y ácidos en la superficie del carbón. Boehm (1994). El pH en el punto de carga cero se determinó usando un pH meter CG840B Schott. Moreno et al. (2007). Finalmente se realizó análisis infrarrojo en un equipo Termo-Nicolet FT- IR Nexus para evaluar la química superficial de dichas muestras.
2.3.4 Caracterización textural de los carbones
Se desorbieron 100 mg de cada una de las muestras durante 3 h, hasta alcanzar una presión de vacío específica. Posteriormente se tomaron isotermas de adsorción de nitrógeno a 77 K, estas fueron tomadas en un equipo Autosorb 3B, Quantachrome Co. A partir de los resultados obtenidos, se calcularon algunas propiedades texturales como el área superficial aparente aplicando el modelo B.E.T, el volumen de microporos, el volumen total de poros, el diámetro de poro y la superficie de microporos, usando el modelo de Dubinin-Radushkevich Czerny et al. (2005). y por último se evaluó el volumen de microporos y la superficie externa empleando el método αS. Reinoso 2007.
2.3.5 Calorimetría de inmersión
Las calorimetrías de inmersión se realizaron en un calorímetro de conducción de calor tipo Calvet. La muestra y el líquido de mojado permanecen sin contacto para que la señal del potencial eléctrico sea constante, posteriormente el sólido entra en contacto con el líquido captando el calor de inmersión mediante la conexión de un multímetro de alta precisión Agilent 3471A, lo que genera un pico de inmersión, dado por el potencial en función del tiempo, después se aplica trabajo eléctrico al sistema y se obtiene el pico de calibración. Navarrete et al. (2005). Los líquidos empleados en las mediciones calorimétricas fueron soluciones previamente estandarizadas de ácido clorhídrico 0.1 N e hidróxido de sodio 0.1 N.
2.4 Aplicación del Carbón Activado
La capacidad de adsorción del carbón obtenido se evaluó utilizando como adsorbente fenol desde disolución acuosa, ya que este compuesto es hoy en día uno de los más peligrosos y uno de los más utilizados en todo el mundo. Moreno (1995). Se emplearon soluciones de fenol a diferentes concentración, la concentración de fenol en equilibrio en cada solución después de la adsorción fue determinada usando como referencia una curva de calibración de soluciones de fenol conocidas, en un equipo espectrofotométrico UV -VIS Milton Roy Co, SpectronicGenesys SN. Qing-Song et al (2010). Durante el estudio de adsorción se efectuaron mediciones constantes de pH en todas las concentraciones de las isotermas en solución, el cual es uno de los factores clave que controla la adsorción de electrolitos orgánicos en materiales de carbón ya que determina las interacciones electrostáticas entre el adsorbato y el adsorbente. Moreno-Castilla (2004).
3. Resultados y Discusión
3.1 Análisis Termogravimétrico del precursor
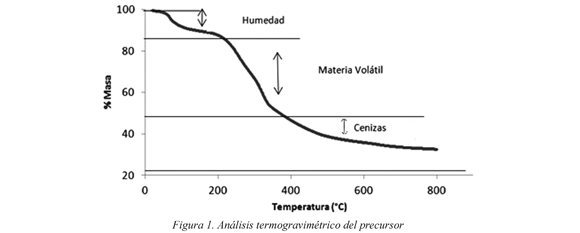
En la figura 1 se muestra el porcentaje de masa perdida del precursor en función de la temperatura.
En esta figura se observan tres perdidas de masa considerables, la primera ocurre a una temperatura alrededor de los 100 °C que se asocia a la perdida de humedad del material y equivale aproximadamente a una pérdida de masa del 12 %. Seguida a ésta, se observa una pérdida de masa equivalente al 42 % del material, la cual ocurre a una temperaturaaproximada de 300 °C. Ésta pérdida generalmente se asocia a la descomposición por pirolisis del material precursor y permite inferir que se presenta una alta pérdida del material, lo que afecta el rendimiento que se pueda obtener en los procesos de carbonización y activación. Finalmente hacia los 600°C se observa el contenido de cenizas que no excede el 5 % del material, a esta temperatura se observa un porcentaje aproximadamente de 38% en masa, por tanto se elige esta temperatura como optima para el proceso de carbonización de las muestras. Para temperaturas más elevadas continua la pérdida del material hasta llegar a 800 °C, temperatura a la que se obtiene el residual final del material que es aproximadamente de 30 % de masa.
3.2 Análisis Próximo del precursor
La cáscara de semilla de eucalipto presenta un contenido relativamente bajo de humedad, datos que se reporta en la tabla 1, esto indica que no absorbe gran cantidad de agua del ambiente. Sánchez & Noemí (2007) el bajo contenido de cenizas 3.40%, confirma una pequeña presencia de contenido inorgánico. Se encuentra un bajo porcentaje de materia volátil 4.60% debido a su alto contenido de heteropolisacaridos (hemicelulosa y lignina) aspecto que se representa en su alto porcentaje de carbono fijo 78.44 %.
3.3 Análisis próximo del carbón activado
En la Tabla 2, se observa que el contenido de humedad varía entre 6.53 y 11.13 %. Los contenidos de humedad se deben principalmente a las condiciones ambientales y de almacenamiento del carbón activado, pues al ser un sólido poroso adsorbente retiene la humedad del aire en su superficie. El bajo contenido de cenizas en las muestras, se justifica debido a que ocurre disolución de algunos componentes inorgánicos durante la impregnación con el ácido. Sin embargo se observa que para la muestra CAE30 se obtuvo mayor contenido de cenizas con un valor de 3.61 % en comparación con la muestra CAE80 que presento 1.81 % esto se debe, a que esta muestra tiene mayor concentración de agente impregnante y por tanto su efecto será más pronunciado en la disolución de especies inorgánicas contenidas en el precursor. Es de suma importancia el efecto que pueda tener este contenido de compuestos inorgánicos sobre el proceso de adsorción sobre el carbón activado ya que éstos modifican las interacciones de la superficie del carbón con la molécula que se quiere adsorber. Briceño et al. (2007).
Las dos muestras activadas presenta bajo contenido de materia volátil entre 13.16 y 12.21 % debido a la eliminación de algunos grupos superficiales por parte del ácido durante su activación. Esto se manifiesta en la eliminación de oxígeno, y explica también su alto contenido de carbono fijo 72.10 y 79.45 % para las muestras CAE30 y CAE80, respectivamente.
3.4 Caracterización textural de los carbones
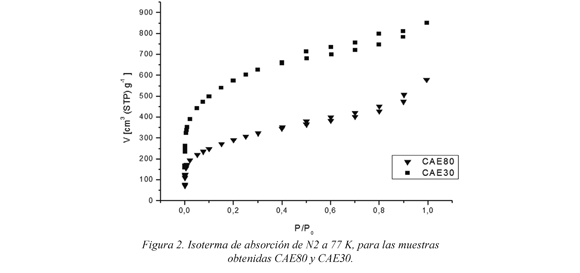
El área superficial de las muestras, fue calculada con el método B.E.T, el cual considera las fuerzas de atracción de van de Waals como responsables del proceso de adsorción, haciendo referencia al fenómeno de fisisorción. En la figura 2 se muestran las isotermas de adsorción de nitrógeno para las dos muestras, se puede observar que los carbones obtenidos, se ajustan a la isoterma Langmuir o tipo I de acuerdo a la clasificación de la IUPAC, donde se observa un mayor volumen adsorbido a presiones relativas bajas, característica de sólidos microporosos. La siguiente parte de la isoterma no es completamente lineal, fenómeno que indica la continuación del proceso de adsorción a presiones relativas altas debido a la presencia de mesoporosidad generada por el tipo de activación. Lovera (2004). El área superficial de las muestras obtenidas se calculó mediante la ecuación B.E.T., la cual se presenta en la ecuación 1:
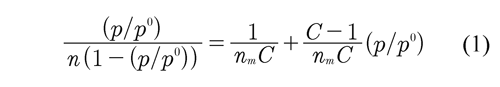
En donde nm es la capacidad de monocapa, p es la presión de equilibrio de cada punto experimental, p0 la presión de saturación del gas a la temperatura de adsorción y C es una constante que se relaciona con la entalpia de adsorción. La representación de (p ⁄ po) ⁄ [n(1 - (p / po)] en función de p / po debera ser una línea recta con una pendiente igual a (C -1) ⁄ nm ), de donde se deduce el valor de nm Para carbones activados, el intervalo de linealidad de la representación de esta ecuación está limitado a presiones relativas en el intervalo de 0.05 - 0.15. Rodríguez & Linares (1989).
Para calcular el volumen de microporo se utilizó la ecuación Dubinin-Radushkevich (DR), la cual se establece de la siguiente manera:
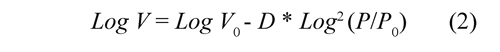
Este es un modelo aplicado para sólidos microporosos, en el que se determina el volumen de microporosos del sólido. En este modelo, V es el volumen de gas adsorbido a la presión de equilibrio, Vo es el volumen de microporos y D es una constante que puede relacionarse con el tamaño medio de los poros; el rango de presión relativa no debe ir mas alla de 0.3. Martin (1990).
En la tabla 3, se muestra el área superficial aparente calculada por el método B.E.T., y la distribución de tamaños de poro es decir; el volumen de microporos, mesoporos y volumen total de poros, calculados por el método Dubinin-Radushkevich, de donde también se calcula la energía característica, el diámetro de poros y la superficie de microporos, adicionalmente se presentan otros parámetros texturales como el volumen de microporo y la superficie externa mediante el método αS. Los resultados muestran que las muestran activadas con ácido fosfórico a diferentes concentraciones presenta cambios en las características texturales de los materiales carbonosos. Se observa que para la muestra CAE30 el área superficial aparente es muy grande del orden de 2009 m2 g-1, mientras que para la muestra CAE80 es de 1027 m2 g-1, aunque también es un valor grande para el área superficial aparente difiere bastante respecto a la otra muestra, con una diferencia del 51%.
Los resultados de volumen de microporo obtenidos por la ecuación DR muestran la misma tendencia para las muestras carbonosas, ya que para la muestra CAE30 se obtuvo un volumen de microporo de 0.65 cm3 g-1, y para la muestra CAE80 el valor obtenido fue de 0.32 cm3 g-1, por tanto la superficie de microporos para la muestra CAE30 será mayor con un orden de 84.28 m2 g-1, por otro lado el volumen de mesoporos aumenta para la muestra CAE80 con un valor de 0.84 cm3 g-1, mientras que la muestra CAE30 presenta un valor más bajo de mesoporos con 0.51 cm3 g-1, este comportamiento puede atribuirse a que la baja concentración del agente activante en la muestra CAE30 favorece el desarrollo de microporosidad mientras que el aumento de concentración produce un ensanchamiento de los microporos y desarrollo de mesoporosidad tal como se evidencia en los resultados. Reinoso (2007). Los resultados obtenidos desde la aplicación del método alfa, también se presentan en la tabla 3 donde se evidencia que el volumen de microporo es muy relacionado con los datos arrojados por el modelo DR, de esta manera la muestra que contiene mayor volumen de microporos, también es la CAE30 con un valor de 0.85 cm3 g-1, para el parámetro de la superficie externa, se evidencia gran similitud entre las dos muestras pero con mayor orden para la muestra CAE80 con valor de 323.68 m2.
3.5 Química superficial
3.5.1 Titulación Boehm y Punto de carga cero
Para la determinación de la química superficial del carbón activado obtenido, se realizaron las titulaciones ácido-base correspondientes y se correlacionaron con el pH del punto de carga cero, los resultados encontrados se muestran en la tabla 4.
Los carbones sumergidos en HCl, determinan la cantidad de sitios básicos totales, encontrando que la mayor concentración de estos la tiene la muestra CAE30 con 0.052 meq g-1, y la muestra CAE80, posee la menor concentración de sitios básicos con un valor de 0.022 meq g-1. Por otro lado, los carbones sumergidos en NaOH, permiten determinar la concentración de sitios ácidos totales, encontrando que la muestra CAE30 contenía la mayor concentración de sitios ácidos totales, 0.135 meq g-1, mientras la otra muestra tiene un valor de
0.122 meq g-1, se sugiere, que a una mayor cantidad del ácido el volumen de la porosidad es mayor, y produce un desarrollo de meso y macroporosidad que disminuye la acidez del material, lo que describe el comportamiento obtenido para la muestra CAE80. Reinoso (2007). en general los carbones obtenidos presentan mayor contenido de grupos ácidos de ahí que presenten valores para el pH en el punto de carga cero relativamente ácidos, con valores de 5.66 para la muestra CAE30 y 6.10 para la muestra CAE80, tanto los valores calculados con el método Boehm como los obtenidos con el demuestran que las muestras tienen mayores pHPCC grupos superficiales ácidos comportamiento que se esperaba ya que fueron activas con ácido fosfórico. Reinoso (2007).
3.5.2 Calorimetría de inmersión
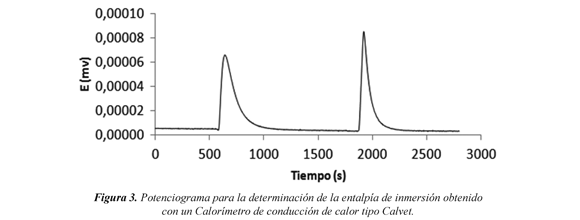
En la figura 3, se muestra un potenciograma obtenido en la calorimetría de inmersión, en donde se muestra la gráfica de potencial en función de tiempo. El primer pico corresponde al calor generado por la inmersión del sólido poroso en el respectivo líquido de inmersión y el segundo corresponde al pico de calibración eléctrico, aplicando un trabajo eléctrico conocido durante un tiempo exactamente medido. Por una relación entre las áreas bajo los picos es posible determinar el valor de la entalpía de inmersión del sólido. Giraldo et al (1994).
El carbón activado se caracterizó calorimétricamente al determinar las entalpías de inmersión en disoluciones ácidas y básicas, cuyos valores se pueden relacionar con las propiedades químicas del carbón, ya que estas afectan las interacciones energéticas entre los sólidos y los diferentes líquidos de inmersión. Giraldo et al (1994).
Los datos obtenidos en la inmersión de las muestras de carbón activado en disolución de NaOH 0.1 N y disolución de HCl 0.1 N, se muestran en la Tabla 5, -ΔHinm es la entalpía experimental de inmersión determinada microcalorimétricamente y expresada en J g-1, los resultados demuestran que para la muestra CAE80, se presenta una mayor entalpía en solución básica (122.27 J g-1) causada por la naturaleza ácida del carbón en comparación con la entalpía en solución ácida (88.29 J g-1), lo anterior muestra una correlación entre la entalpía y el punto de carga cero dado que para este carbón mostró tendencia ácida (pHPCC = 6.10) y si se ponen en contacto con soluciones cuyo pH sea mayor que el pHPCC, la carga de su superficie será en promedio negativa lo cual se evidencia en la disociación de los grupos ácidos en la superficie del carbón, el cual es igual a 0.122 meq g-1. Moreno et al. (2007).
Para la otra muestra es decir el carbón CAE30 no se evidencia relación directa entre la entalpía de inmersión básica (71.99 J g-1) respecto al comportamiento ácido del carbón ya que la entalpía de inmersión en ácido es mayor (97.65 J g-1), y tampoco se evidencia una correlación con el valor del punto de carga cero, (pHPCC = 5.66), esto posiblemente se deba a la compleja naturaleza química de la muestra que afecta las interacciones que se dan entre esta y las disoluciones empleadas. Navarrete et al (2005)
3.5.3 Espectroscopia de Infrarrojo
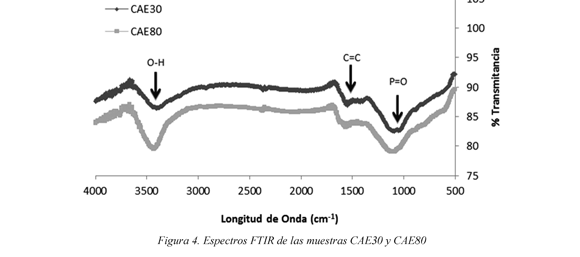
Los espectros obtenidos para las muestras de carbón se muestran en la figura 4, se evidencian los siguientes espectros del carbón activado obtenido: a 3400 cm-1 se observa una banda ancha atribuida a los grupos hidroxilo (OH-); la banda presentada a 1600 cm-1 es el resultado de anillos aromáticos o enlaces dobles carbono-carbono. La absorción cerca de 11001000 cm-1 indica la existencia de enlaces de C=O en ácidos carboxílicos, que le dan características superficiales acidas a las muestras como ya se menciono anteriormente. También se presentan enlaces P = O, O - C y P - O - C. Estos enlaces presentados son causados por la impregnación con el ácido fosfórico. Guo et al. (2007).
3.7 Adsorción de Fenol
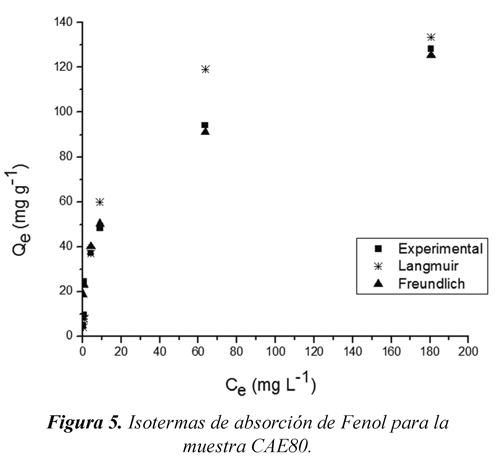
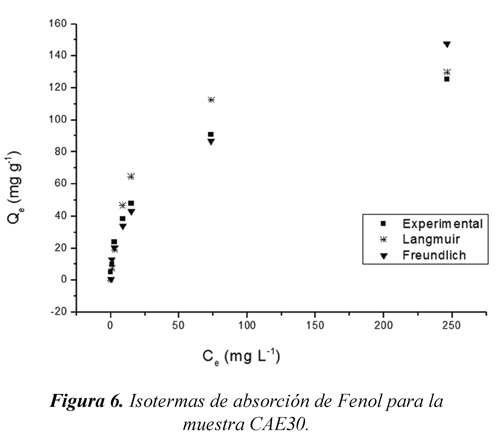
En las figuras 5 y 6 se muestran las isotermas de adsorción en disolución acuosa experimental, y las isotermas del ajuste a los modelos de Langmuir y Freundlich, para las muestras CAE80 y CAE30 respectivamente, donde se evidencia la capacidad de adsorción de fenol (Qe) expresada en mg de fenol retenido por gramo de carbón activado. Las isotermas que se exhiben en las figuras 5 y 6 de forma experimental no sigue el comportamiento del modelo de Langmuir porque la masa de fenol adsorbido, en un amplio rango de concentraciones como el considerado en este trabajo 50 a 1500 mg L-1, no se hace asintótica a altas concentraciones, sino continúa incrementando cuando se aumenta la concentración, las isotermas del ajuste a los modelos de Langmuir y Freundlich, siguen este mismo comportamiento. Leyva (2007).
Los datos experimentales de las isotermas de adsorción se ajustaron con los modelos de Langmuir y Freundlich. Qing-Song et al (2010). Estos modelos se expresan en su forma no lineal en las ecuaciones 3 y 4, respectivamente:
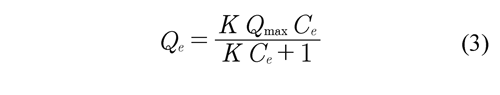
En la ecuación de Langmuir, Ce se refiere a la concentración de soluto en el equilibrio mg L-1, Qe es la masa de soluto adsorbido por unidad de masa del adsorbente mg g-1, Qmax es la máxima masa de soluto que se adsorbe sobre el adsorbente mg g-1, K es la constante de la isoterma de adsorción de Langmuir relacionada con el calor de adsorción dada en L mg-1.
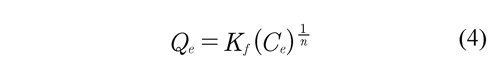
El modelo de Freundlich, ha demostrado que se puede aplicar a adsorbentes que tienen superficies energéticamente heterogéneas, en este modelo Kf es la constante de la isoterma Freundlich relacionada con la capacidad de adsorción dada en mg1-1/nL1/ ng-1, n es la intensidad de la adsorción.
En la tabla 6 se encuentran los parámetros resultantes de la linealización de los datos aplicando los modelos. Para el modelo de Freundlich, se observa que el valor de Kf es mayor para la muestra CAE80 lo que supone que esta muestra tienen mayor capacidad de adsorción con un valor de 25.58 mg1-1/nL1/ng-1, mientras que para la muestra CAE30 el valor es menor con valor de 13.11 mg1-1/nL1/ng-1. El valor de 1/n es una medida de la heterogeneidad de la superficie, un valor cercano a 0 indica una superficie heterogénea, cuando el valor de 1/n es menor que 1 se dice que el proceso de adsorción es favorable, nuevamente se encuentra comportamiento antes mencionado para las dos muestras.
Cuando se aplica el modelo de Langmuir, se observa que Qmax es de gran magnitud para las dos muestras, no obstante es mayor para la muestra CAE80, con un valor de 142.86 mg g-1 lo que confirma que esta muestra presenta mejor capacidad de adsorción, el valor de K también es mayor para la muestra CAE80 demostrando mayor interacción energética en la interface adsorbato-adsorbente, el modelo de Langmuir ajusta considerablemente los datos, por tanto se puede calcular el área superficial aparente S en m2 g-1 mediante la ecuación 5. Moreno (2007)
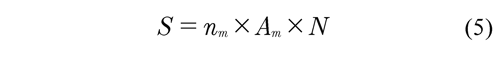
Donde nm es el valor de la capacidad de adsorción por monocapa en mol g-1, Am es el área del adsorbato en m2 molecula-1 y N es el número de Avogadro en moléculas mol-1.
Teniendo en cuenta que el área para el adsorbato es 45*10-20 m2 molecula-1 , se determinó mediante la aplicación de esta ecuación que el área superficial aparente para la muestra CAE80 es de 422.34 m2 g-1 y para la muestra CAE30 es de 400.04 m2 g-1, valores muy distantes de los calculados mediante la ecuación B.E.T., aspecto explicado debido al gran tamaño del fenol en comparación con el del nitrógeno, además la adsorción de fenol está directamente relacionada con las interacciones entre los grupos superficiales oxigenados con la molécula del fenol y con la competencia de los sitios de adsorción entre las especies presentes en la solución y el agua que actúa como solvente que van a depender del pH de la solución, por lo que la adsorción de fenol va a ser menor, no obstante se evidencia que hay relación entre los datos obtenidos desde la ecuación 5 y los obtenidos mediante la ecuación B.E.T., ya que el área superficial aparente para la muestra CAE80 siempre es mayor que el área de la muestra CAE30. Blanco et al (2009).
Se observa claramente que los datos obtenidos se ajustan mejor al modelo de Freundlich según el coeficiente de correlación lineal, ya que están muy próximos a la unidad y los bajos valores de porcentaje de desviación que no superan el 1.2 % de desviación, lo que supone que el adsorbente tiene superficies energéticamente heterogéneas, además la masa de fenol adsorbido sobre los carbones continua aumentando cuando se eleva la concentración de soluto en el equilibrio como se evidencio en las figuras 5 y 6, y no se hace asintótica a altas concentraciones como ocurre con la isoterma de Langmuir. Leyva (2007).
Finalmente otro aspecto importante para estudiar en el proceso de adsorción es el pH de la solución, ya que este además de interactuar con la carga del sólido, indica la concentración de las especies fenólicas presentes en solución, a partir del diagrama de especiación para el fenol, se conoce que hay mayor presencia de las especies protonadas a bajos valores de pH y mayor presencia de especies desprotonadas a altos valores de pH. Los valores de pH experimentales para las isotermas de fenol en este estudio estaban en el rango de 6.56 a 7.86, con estos datos y el comportamiento de la distribución de especies se demuestra que el proceso se realizo para la especie protonada de fenol, es decir no estaba disociado, y el proceso lo favorecen fuerzas de dispersión, pues si las soluciones se encontraran en medio básico la adsorción hubiera disminuido, a causa de las repulsiones electrostáticas entre la carga negativa de la superficie y los aniones fenolatos y entre estos entre sí. Leyva (2007). Este comportamiento se comprueba con el valor de pKa del fenol (9.89) el cual es mayor que los datos obtenidos del pH de solución experimentales, lo que comprueba que las especies adsorbidas estaban en su forma protonada. Ahmaruzzaman & Sharma (2005).
4. Conclusiones
Las semillas de Eucalipto (Eucalyptus globulus Labill), son materiales lignocelulósicos adecuados para la obtención de carbones activados, con adecuadas propiedades texturales en muestras activadas químicamente.
Se sintetizaron dos muestras de carbones activados mediante activación química, los cuales presentaron grandes áreas superficiales aparentes, del orden de 2009 m2 g-1 para CAE30 y del orden de 1027 m2 g-1 para CAE80, estas grandes aéreas se reflejaron en la gran capacidad de adsorción de fenol, no obstante el valor del área superficial no es preponderante en el proceso de adsorción de fenol, ya que la muestra con mayor superficie es la que menor cantidad de fenol retiene, aspecto relacionado directamente con la distribución de tamaños de poro, química superficial de las muestras y de manera determinante el pH de la solución.
Los resultados muestran que los dos carbones activados obtenidos, presentan cambios apreciables en las características texturales, en las propiedades electroquímicas de la superficie y variaciones en la capacidad de remoción de fenol presente en disolución acuosa. Por lo cual estos materiales sintetizados pueden ser utilizados en la remoción de compuestos de moléculas orgánicas de gran tamaño que se obtienen como subproductos de la industria química y alimentaría.
Según el método de valoración selectiva se encontró que los carbones activados contienen alta concentración de grupos ácidos, comportamiento que se relaciona con los datos obtenidos para el pHPCC, además se confirmó este conducta mediante espectroscopia infrarroja, esto se debe al agente activante utilizado durante la activación de las muestras.
A partir de las entalpías de inmersión se comprueba la naturaleza acida de las superficies de las muestras obtenidas, además se confirma que esta técnica da una mayor caracterización de las muestras ya que determina directamente las interacciones en la interface solido-liquido en función del calor generado a presión constante.
Las isotermas de adsorción de fenol se ajustan mejor al modelo de Freundlich lo que determina que este adsorbente tiene superficies energéticamente heterogéneas, adicionalmente explica el comportamiento de la adsorción de fenol, el cual continúa aumentando cuando se eleva la concentración de soluto en el equilibrio.
5. Agradecimientos
Los autores expresan un agradecimiento especial a la Universidad de los Andes, donde se llevo a cabo el proceso de caracterización de las muestras, a la Universidad Nacional de Colombia donde se realizaron las pruebas calorimetrías, y a la Universidad pedagógica nacional donde se evalúo la capacidad de adsorción del carbón activado.
Esta investigación se desarrollo en el trabajo de grado para optar al título de licenciados en química de algunos autores, que le expresan su agradecimiento al continuo apoyo y dirección al Dr. Juan Carlos Moreno, a la Dra. Liliana Giraldo y al Profesor Diego Blanco.
6. Referencias Bibliográficas
Ahmaruzzaman, M. & Sharma, D. (2005). Adsorption of phenols from wastewater. Colloid and Interface Science , (4) 287, 14-24. [ Links ]
Blanco, D.A., Giraldo-Gutiérres, L., & Moreno-Piraján, J.C. (2008). Estudio de la entalpía de inmersión y de la adsorción de fenoles hidroxilados desde solución acuosa sobre carbón activado. Afinidad , (LXVI), 314-319. [ Links ]
Boehm, H. P. (1994). Some aspects of the surface chemistry of carbon blacks and other carbons. CARBON , (5) 759-769. [ Links ]
Briceño, N.O., Guzman, M.Y., & Diaz, J. (2007). Grupos Superficiales en materiales Carbonosos. Caracterizacion por diferentes Tecnicas. Revista Colombiana de Quimica , 36 (1), 121-130. [ Links ]
Giraldo, L., Moreno, J.C., Gomez, A. & Polania, L.(1994). Caracterización de carbón activado por calorimetría de inmersión. Revista Colombiana de Quimica , 23 (1), 27-32. [ Links ]
Guo, Y., & Rockstraw, D. (2007). Physicochemical properties of carbons prepared from pecam shell by phosphoric acid activation. Bioresource Technology , 1513-1521. [ Links ]
Huidobro, A., Pastor, A., & Rodríguez- Reinoso, F. (2001). Preparation of activated Carbon Cloth from Viscous Rayon. Part IV. Chemical Activation. Carbon , 39 (3), 389-398. [ Links ]
Kumar A., Kumar, S., Kumar, Su., & Gupta, D. (2007). Adsortion of phenol and 4-nitrofenol on granular activated carbon in basal salt medium: Equilibrium and kinetics. Journal of Hazardours Materials , 147, 155-166. [ Links ]
Leyva-Ramos, R. (2007). Importancia y aplicaciones de la absorción en fase liquida. En, J. Moreno-Pirajan. Sólidos Porosos: preparación, Caracterización y Aplicaciones (pp. 155-211). Bogotá, Colombia: Ediciones Uniandes. [ Links ]
Lovera-Garcia, R. (2003). Caracterización Textural de Adsorbentes. Ingeniare. Rev. chil. Ing , 6, 24-28. [ Links ]
Marco. J.P, Suárez. F., Cazorla, D. & Linares, A. (2005). Aumento del rendimiento del proceso de activación de precursores lignocelulósicos por modificación de la etapa de carbonización. En VII reunión del grupo español del carbón (pp. 157-158). Universidad de Granada. Granada, España. [ Links ]
Martín-Martínez, J. (1990). Generalidades sobre adsorción física de gases y vapores en carbones. Adsorción Física de Gases y Vapores por Carbones. Alicante, España: Secretariado de Publicaciones de la Universidad de Alicante. [ Links ]
Moreno, J. C., Navarrete, L., Giraldo, L., & García, V. (2007). Adsorción de Fenol y 3-Cloro Fenol sobre Carbones Activados mediante Calorimetría de Inmersión. Informacion Tecnológica , 18 (3), 71-80. [ Links ]
Moreno-Castilla, C. (2004). Adsorption of organic molecules from aqueous solutions on carbon materials. CARBON , 42, (1). 83-94. [ Links ]
Navarrete, L.F., Giraldo-Gutiérres, L., & Moreno-Piraján, J.C. (2005). Carbón activado: efecto del lavado con ácido sulfúrico del precursor lignocelulósico, cuesco de palma africana, sobre los procesos de carbonización y activación. Revista Colombiana de Quimica , 34 (1) 67 - 78. [ Links ]
Peralta, J., Sun Kou, M. d., & Bendezú, S. (2008). Preparation, Characterization of Activated Carbons with KOH and H3PO4 and Application in Cd (II) Adsorption. Revista de la Sociedad Química de Perú , 74 (4), 220-232. [ Links ]
Puziy, A., Poddubnaya, O., & Ziatdinov, A. (2006). On the Chemical Structure of Phosphorus Compounds in Phosphoric Acid-Activated Carbon. Applied Surface Sciencie , 252 (23) 8036-8038. [ Links ]
Qing-Song, L., Tong, Z., Peng, W., Ji-Ping, J., & Nan, L. (2010). Adsorption isotherm, kinetic and mechanism studies of some substituted phenols on activated carbon fibers. Chemical Engineering Journal , 157 (3) 348-356. [ Links ]
Rodriguez-Reinoso, F. (2007). El Carbón Activado como Adsorbente Universal. En, J. Moreno-Pirajan. Sólidos Porosos: preparación, Caracterización y Aplicaciones (pp. 1-43). Bogotá, Colombia: Ediciones Uniandes. [ Links ]
Rodríguez-Reinoso, F., & Linares-Solano, A. (1989). Microporous structure of activated carbons as releaved by adsorption methods. Chemistry and Physics of carbon , 21, 140-146. [ Links ]
Sánchez, C. & Noemí, R. (2007). El Eucalipto: Una Opción de Alta Rentabilidad. M y M El mueble y la Madera , 17, 23 - 30. [ Links ]

Revista Ingeniería y Competitividad por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento - Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.