Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y competitividad
versão impressa ISSN 0123-3033
Ing. compet. vol.16 no.2 Cali jul./dez. 2014
Selección de soportes magnéticos para la inmovilización de Ureasa
Magnetic supports selection for Urease inmobilization
Hugo A. Rojas
E-mail: hugo.rojas@uptc.edu.co
José J. Martínez
E-mail: jose.martinez@uptc.edu.co
Annie Y. Vargas
E-mail: annie.vargas@uptc.edu.co
Escuela de Ciencias Químicas. Facultad de Ciencias. Grupo de Catálisis (GC-UPTC). Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
Eje temático: INGENIERíA QUíMICA / CHEMICAL ENGINEERING
Recibido: 16 de Octubre de 2013
Aceptado: Octubre 20 de 2014
Resumen
Sólidos magnéticos tipo Fe3O4, Fe3O4-NH2, Fe3O4@SiO2 y Fe3O4@SiO2-NH se usaron como soportes en la inmovilización de la ureasa, estos sólidos fue caracterizados por análisis de fisisorción de N2 a 77K, curvas de magnetización y FTIR. La actividad enzimática se evaluó por descomposición de la urea. Los sólidos presentan características magnéticas que les permite fácilmente ser separados. La enzima inmovilizada mejoró notablemente su actividad enzimática comparada con la enzima libre. Para los sólidos Fe3O4-NH2, y Fe3O4@SiO2-NH2 se observó una mayor cantidad de enzima acoplada.
Palabras clave: APTES, inmovilización, magnetita, soportes, ureasa.
Abstract
Fe3O4, Fe3O4-NH2, Fe3O4@SiO2 y Fe3O4@SiO2-NH2 as magnetic supports were studied for the urease immobilization. The solids were characterized by N2-physical adsorption at 77 K, magnetization curves and FTIR. Activity assays were evaluated by urea decomposition. The magnetic properties of solids allow an easy separation. The immobilized enzyme improved the enzymatic activity compared to the free enzyme. In Fe3O4-NH2 and Fe3O4@SiO2-NH2 was observed allows a greater amount of enzyme coupled.
Keywords: APTES, immobilization, magnetite, supports, urease.
1. Introducción
Las enzimas poseen excelente actividad catalítica, expresan mayor regio y enantioselectividad (Demir, A. S. et al., 2011), mayor especificidad (Tomotani and Vitolo, 2006), permiten realizar procesos a bajas temperaturas, generan menor cantidad de desechos tóxicos, contaminantes, emisiones y subproductos en comparación con los procesos químicos convencionales, por lo que son ampliamente utilizadas a nivel industrial (Tomotani, E. J. et al., 2007). Así las enzimas son parte fundamental en la biocatálisis, tecnología clave para la síntesis orgánica moderna, en especial de productos químicos finos y productos farmacéuticos.(Bolivar et al., 2013)
A pesar de esto, las enzimas sufren de numerosos problemas al momento de la aplicación práctica, como pérdida de la estabilidad frente a pH, calor u otros factores, difícil recuperación y re-uso en un sistema de reacción, que ocasionan altos costos de operación. Estas deficiencias evitan la explotación eficaz de las ventajas técnicas y económicas de las enzimas, especialmente en una amplia variedad de reacciones de bio-transformación (Demir et al., 2011, Cao et al., 2012)). Hay técnicas que permiten mejorar la estabilidad de la enzima tales como la inmovilización, la modificación enzimática, ingeniería de proteínas, entre las cuales la inmovilización es el método más frecuentemente utilizado para mejorar las características de estas (Cao, et al., 2012).
En los últimos años, se han utilizado nanopartículas como soportes para la inmovilización de enzimas, puesto que proporcionan una gran área superficial, mejorando la eficiencia catalítica de las enzimas inmovilizadas, sin embargo la recuperación de la enzima inmovilizada en nano partículas es a menudo limitada (Hong et al., 2009, Ansari and Husain, 2012, Cao et al., 2012, Ashtari et al., 2012, Jiang et al., 2009). Recientemente, el uso de nanopartículas magnéticas ha tomado gran auge debido a sus interesantes propiedades químicas y físicas tales como la estabilidad, biocompatibilidad y superparamagnetismo, baja toxicidad, reducción de la auto agregación y fácil separabilidad de la mezcla de reacción mediante la aplicación de un campo magnético (Netto, C. G. C. M. et al., 2013). Poseen además una amplia gama de aplicaciones en la inmovilización de células y enzimas, sistemas de bioseparación, inmunoensayos, administración de fármacos y biosensores (Ashtari, K. et al., 2012).
Las nanopartículas magnéticas pueden ser funcionalizados por grupos especiales (por ejemplo -OH , -COOH , -NH2 ) (Feng, B. et al., 2008) apto para otras modificaciones por la unión de varias moléculas bioactivas en distintas aplicaciones (Cao, M. et al., 2012, Zhao, G. et al., 2011).
Sin embargo, una de las desventajas principales de las nanopartículas magnéticas radica en que no son estables por lo cual son fácilmente oxidables y las hace vulnerables a perder el magnetismo. Otras de las desventajas es que son propensas a agregarse, muestran pobre dispersión en agua y en disolventes orgánicos. Así las estrategias de protección, y conservación de estas nanopartículas magnéticas durante y después de la síntesis, es la estabilización química a partir de recubrimientos en capas con compuestos orgánicos o inorgánicos. Para el caso de recubrimientos inorgánicos se utilizan por lo general sistemas porosos para estabilizar las partículas magnéticas, como la sílice. Las nanopartículas magnéticas recubiertas de sílice proporcionan muchos grupos reactivos en la superficie, a través de grupos silanoles los cuales son empleados directamente en la posterior funcionalización de la superficie.
Una enzima modelo para la inmovilización de enzimas es la ureasa, altamente eficaz para la hidrólisis de la úrea. La principal aplicación de la ureasa se encuentra en el análisis del contenido de úrea en sangre, tratamiento en bebidas alcohólicas y desarrollo de sensores (Luo and Fu, 2010, Sahoo et al., 2011, Krishna et al., 2011), entre otras. Sin embargo, la búsqueda de un medio sencillo para separar la enzima del proceso, permitiría el reuso de la enzima. En este sentido, el uso de nanopartículas magnéticas sería muy eficaz para inmovilizar la enzima y facilitar su separación por uso de un campo magnético externo (Tartaj et al., 2005). En cada una de las aplicaciones anteriores, la inmovilización de la enzima se constituye en un importante reto científico.
Algunos resultados muestran que es posible inmovilizar ureasa en nano-partículas magnéticas, obteniendo un aumento en el tiempo de almacenamiento por períodos más largos y en su estabilidad térmica, así mismo la actividad de la enzima inmovilizada no es afectada por el cambio en rangos amplios de pH, sin perder su actividad catalítica inicial (Sahoo et al., 2011). En este trabajo se pretendió evaluar la inmovilización de ureasa en partículas de Fe3O4 modificadas con APTES o sílice con el fin de seleccionar dentro de estos soportes magnéticos cual permitiría una mayor inmovilización de la enzima sin alterar su comportamiento catalítico.
2. Experimental
2.1 Materiales
La enzima utilizada es la ureasa de Canavalia ensiformis (Jack bean, EC 3.5.1.5, 5 UI). Los cloruros de hierro FeCl3.6H2O, FeCl2.4H2O, aminopropiltrietoxisilano al 99% (APTES), tetraetilortosilicato (TEOS), purpura de bromocresol, son de Sigma aldrich, NaH2PO4 y Na2HPO4 de Mobs Labs , NaOH de Panreac , HCl de Riedel-de Haen, NH4OH de E.M, etanol de J.T Baker y agua desionizada.
2.2 Síntesis de las nanopartículas de Fe3O4
Las nanoparticulas magnéticas fueron sintetizadas mediante una co-precipitación alcalina de sales de hierro (Soo Y., 1996). El procedimiento de preparación inició con la disolución de FeCl3•6H2O y FeCl2•4H2O (Acros 99%) en una mezcla de agua (burbujeada previamente con N2) y ácido clorhídrico, bajo agitación mecánica hasta total disolución, luego se adicionó hidróxido de sodio con agitación continua, y se dejó decantar, se le acercó un imán externo y se comprobó su carácter paramagnético, al precipitado obtenido se le adicionó HCl para neutralizar los cargas aniónicas de las nanopartículas. Se lavó repetidas veces con agua desionizada y se secó al vacío a 333 K.
2.3 Síntesis de Fe3O4@SiO2
El procedimiento de encapsulación de las microesferas magnéticas con SiO2 se realizó a través del método de Stöber (Luo et al., 2010). En el que se tomó las nanopartículas de Fe3O4 sintetizadas previamente y se dispersaron en una mezcla de etanol, agua desionizada y solución de amoniaco acuoso concentrado (28% en peso). Esta mezcla se llevó a ultrasonido por 1h. Posteriormente tetraetil ortosilicato (TEOS) como fuente de sílice fue adicionada gota a gota a la mezcla, dejando en agitación por 3h, bajo atmosfera de nitrógeno. Los productos fueron recogidos, lavados con agua desionizada y secados a vacío a 333 K. La relación entre las partículas magnéticas y la fuente de sílice se mantuvo 1:1.
2.4 Funcionalización con APTES de Fe3O4 y Fe3O4@SiO2
Los sólidos Fe3O4 y Fe3O4@SiO2 se funcionalizaron con APTES siguiendo el método propuesto por Diez, et al., (Díez et al., 2012) en donde las nanopartículas magnetitas se dispersaron por sonicación en una mezcla de etanol y agua, posteriormente se le adiciona 3-aminopropiltrietoxisilano (APTES), y se agitó mecánicamente por 7h en atmosfera de nitrógeno, luego se decantaron magnéticamente, se lavaron con una mezcla de agua-etanol, y secaron con una a temperatura ambiente, para la obtención de Fe3O4-NH2 y Fe3O4@SiO2-NH2, respectivamente.
2.5 Inmovilización de ureasa
Para la inmovilización de la ureasa, la enzima se disolvió en una solución de buffer fosfatos manteniendo el pH en 5,8, a la cual se le adicionó una proporción de cada soporte magnético manejando una relación 1:2, se agitó por 24 h y se mantuvo el sistema a 4 °C, para lograr esta temperatura el agitador orbital se mantuvo en un refrigerador convencional. En este proceso se espera que la enzima se impregne en el soporte. Posteriormente, se centrifugó y se lavó varias veces el soporte con solución buffer fosfatos, para retirar la enzima residual.
2.6 Evaluación de la proteína acoplada
El primer sobrenadante obtenido, se utilizó para la determinación de proteína por el método de Bradford utilizando azul de Coomassie G250 a 595nm en un espectrofotómetro UV-VIS GBC-911.
2.7 Evaluación de la actividad enzimática
Se evaluó la actividad enzimática por el método colorimétrico basado en la hidrólisis de la urea, monitoreando el cambio de pH con tinte púrpura de bromocresol (Zong, J. et al., 2011). La reacción enzimática se monitorizó siguiendo la absorción de colorante a 588 nm en un espectrofotómetro UV-VIS GBC-911.
2.8 Caracterización de los sólidos
La evaluación magnética de los sólidos se realizó a temperatura ambiente (19 °C) en un magnetómetro Versalab. La superficie específica, el diámetro de poro y el volumen de poro de los sólidos preparados fueron determinados desde las isotermas de adsorción - desorción de N2 a 77K obtenidas en un Micromeritics ASAP 2020. Análisis por Infrarrojo (FTIR) fueron realizados en un Nicolet 6300.
3. Resultados y discusión
3.1 Caracterización de los sólidos
Las isotermas de adsorción-desorción se muestran en la figura 1 y los resultados de superficie específica, tamaño y volumen de poro se pueden observar en la tabla 1. Las isotermas obtenidas de adsorción son de tipo IV, características de sólidos mesoporosos, sin embargo los distintos ciclo de histéresis sugieren que la incorporación del APTES y de la sílice a las partículas de Fe3O4 modifican las propiedades texturales. Las partículas magnéticas de Fe3O4 presentan una baja área superficial y la superficie aumenta a medida que se funcionaliza con APTES o se incorpora sílice. El incremento del valor de área superficial (SBET) en Fe3O4-NH2 puede explicarse debido a que el APTES sirve de agente dispersante de las partículas de Fe3O4, lo que ocasiona un cambio de la distribución de poros como se observa en la figura 1b. El aumento de la superficie específica y la distribución de poros bimodal en SiO2@Fe3O4 (figura 1c) se explica por un recubrimiento parcial de las partículas de Fe3O4 con sílice. Al incorporar el APTES a la superficie de SiO2@Fe3O4 (Fe3O4@SiO2-NH2: figura 1d), es posible que se dispersen las partículas de Fe3O4 o se ocluyan algunos poros de la sílice. En consecuencia, el modo de actuar del APTES dependerá de la superficie donde se ancla.
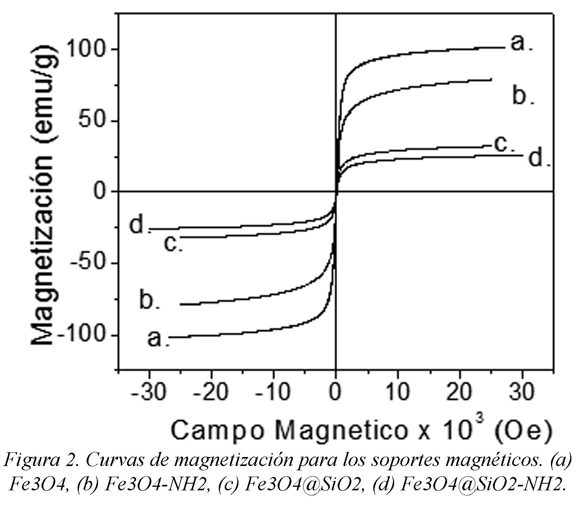
En la figura 2 se observan las curvas de magnetización en función del campo magnético de los sólidos estudiados. La dependencia del campo magnético aplicado para estos sistemas confirma la respuesta ferromagnética de estos materiales. Se observa que todas las curvas pasan por el origen, lo que se traduce en que se pueden volver a dispersar fácilmente cuando el campo magnético aplicado es retirado. Por tanto explica la razón por la cual en los sólidos de Fe3O4@SiO2 y Fe3O4@SiO2-NH2 donde existe un posible recubrimiento de sílice de las partículas magnéticas, esta respuesta magnética permanece, pudiendo ser fácilmente separadas con un imán. La respuesta magnética de la magnetita funcionalizada con APTES (Fe3O4-NH2) no cae tan bruscamente como las magnetitas recubiertas con sílice, dado que la funcionalización afecta solamente la superficie de estas partículas.
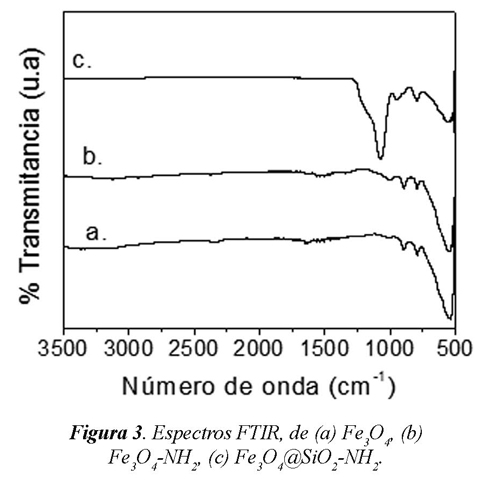
La figura 3 muestra los espectros para los soportes obtenidos. La banda de absorción en 590 cm-1 en la figura 3a ha sido asociada al enlace Fe-O de la magnetita (Waldron, 1955, Ma et al., 2003) Las señales observadas en 1625 cm1, se atribuyen a las vibraciones de los enlaces N-H (Ma et al., 2003) lo que permite afirmar que se obtuvo partículas magnéticas funcionalizadas con APTES (Fig. 3 (b) y 3 (c)). El encapsulamiento de la magnetita con SiO2 (Fig. 3c) se presenta con la absorción de los grupos silanoles en la superficie de las partículas magnéticas y se observa en las bandas entre 1111 y 1049 cm-1 que corresponden a los grupos SiO-H y Si-O-Si. Las bandas de absorción entre 750 y 900 cm-1, corresponden a las bandas de estiramiento de los grupos Si-O-H y vibraciones de los grupos -OH de la superficie de la magnetita.
3.2. Evaluación de la proteína acoplada
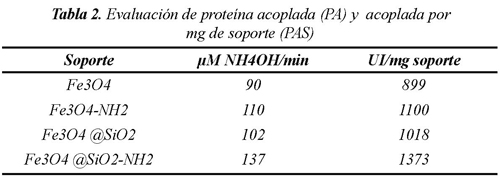
Se determinó el nivel de proteína acoplado (PA), por medio de la diferencia entre la proteína del sobrenadante y de la enzima libre (238 µg/mL). En la tabla 2, se comparan la cantidad de proteína acoplada en los soportes evaluados, siendo los soportes modificados con APTES, los que mayor cantidad de proteína acoplaron, hecho que se atribuye a que la modificación con APTES asegura una mayor densidad de grupos amino que permite una mayor interacción con los grupos carboxílicos de la proteína. De igual manera, se calculo la proteína acoplada por cantidad de soporte utilizado (PAS), este dato corrobora que la cantidad de soporte no influye en la cantidad de proteína adherida y que esta depende solamente de la cantidad de grupos superficiales del soporte que permiten la adsorción de esta. Frente a los soportes que no se funcionalizaron con APTES, los valores bajos de cantidad proteína acoplada se debe a la lixiviación por las débiles fuerzas electroestáticas que unen a la enzima con el soporte, ocasionando que toda la proteína quedara en el sobrenadante.
3.3 Evaluación de la actividad enzimática
Para la actividad enzimática, se evaluó la producción de amoniaco en la hidrolisis de urea catalizada por la enzima por seguimiento colorimétrico a 588 nm. La tabla 2, resume los resultados de actividad enzimática expresada en unidades internacionales (UI) de la enzima inmovilizada y UI/mg de soporte. Estos valores se comparan con el valor de actividad obtenido de la ureasa libre. Puede observarse que no hay relación directa entre proteína acoplada y actividad enzimática, dado que pequeñas cantidades de enzima inmovilizada hidrolizan en un rango similar la urea. Los valores son comparables a la enzima libre (130 µM NH4OH/min) y la funcionalización con APTES que permite una mayor adsorción de enzima, no necesariamente se refleja en una elevada actividad catalítica. Una explicación del porque no hay una relación directa entre proteína acoplada y actividad catalítica, se explica en términos de la conformación adoptada por la enzima al momento de inmovilizarse. En todos los casos, la inmovilización mejora notablemente la actividad enzimática y los soportes empleados resultan promisorios para la inmovilización de enzimas, lo que permitiría estudiar la cinética y evaluar su aplicabilidad en un proceso industrial.
4. Conclusiones
En todos los soportes magnéticos empleados, la inmovilización de la ureasa mejoró notablemente su actividad enzimática. Con una muy pequeña cantidad de ureasa inmovilizada es posible lograr una actividad similar a la de la enzima libre. El comportamiento magnético de los sólidos ofrece una clara posibilidad de fácil separación una vez sean empleados.
5. Agradecimientos
Se agradece el soporte financiero de la Dirección de investigaciones de la Universidad Pedagógica y Tecnológica de Colombia, bajo el proyecto SGI Nº 1125.
6. Referencias
Ansari, S. A., & Husain, Q. (2012). Potential applications of enzymes immobilized on/in nano materials: A review. Biotechnology Advances, 30 (3), 512-523. [ Links ]
Ashtari, K., Khajeh, K., Fasihi, J., Ashtari, P., Ramazani, A., & Vali, H. (2012). Silica-encapsulated magnetic nanoparticles: Enzyme immobilization and cytotoxic study. International Journal of Biological Macromolecules, 50 (4), 1063-1069. [ Links ]
Bolivar, J. M., Consolati, T., Mayr, T., & Nidetzky, B. (2013). Shine a light on immobilized enzymes: real-time sensing in solid supported biocatalysts. Trends in Biotechnology, 31 (3), 194-203. [ Links ]
Cao, M., Li, Z., Wang, J., Ge, W., Yue, T., Li, R., et. al. (2012). Food related applications of magnetic iron oxide nanoparticles: Enzyme immobilization, protein purification, and food analysis. Trends in Food Science & Technology, 27 (1), 47-56. [ Links ]
Demir, A. S., Talpur, F. N., Betul Sopaci, S., Kohring, G. W., & Celik, A. (2011). Selective oxidation and reduction reactions with cofactor regeneration mediated by galactitol, lactate, and formate dehydrogenases immobilized on magnetic nanoparticles. Journal of Biotechnology, 152 (4), 176-183. [ Links ]
Díez, P., Villalonga, R., Villalonga, M. L., & Pingarrón, J. M. (2012). Supramolecular immobilization of redox enzymes on cyclodextrin-coated magnetic nanoparticles for biosensing applications. Journal of Colloid and Interface Science, 386 (1), 181-188. [ Links ]
Feng, B., Hong, R., Wang, L. S., Guo, L., Li, H. Z., Ding, J. et. al. (2008). Synthesis of Fe3O4/APTES/PEG diacid functionalized magnetic nanoparticles for MR imaging. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 328 (1-3), 52-59. [ Links ]
Hong, Y., Li, J., Zhang, S., Li, H., Zheng, Y., Ding, J., & Wei, D.-G. (2009). Preparation and characterization of silica-coated Fe3O4 nanoparticles used as precursor of ferrofluids. Applied Surface Science, 255 (6), 3485-3492. [ Links ]
Jiang, Y., Guo, C., Xia, H., Mahmood, I., Liu, C., & Liu, H. (2009). Magnetic nanoparticles supportedionic liquids for lipase immobilization: Enzyme activity in catalyzing esterification. Journal of Molecular Catalysis B: Enzymatic, 58 (1-4), 103-109. [ Links ]
Krishna, L., Singh, N., Patra, S., & Dubey, K. (2011). Purification, characterization and immobilization of urease from Momordica charantia seeds. Process Biochemistry, 46 (7), 1486-1491. [ Links ]
Luo, B., Song, J., Zhang, F., Xia, A., Yang, L., Hu, H. (2010). Multi-functional thermosensitive composite microspheres with high magnetic susceptibility based on magnetite colloidal nanoparticle clusters. Langmuir, 26 (3), 1674-1679. [ Links ]
Luo, Z., & Fu, X. (2010). Immobilization of urease on dialdehyde porous starch. Starch-Stärke, 62 (12), 652-657. [ Links ]
Ma, M., Zhang, Y., Yu, W., Shen, H., Zhang, H., & Gu, N. (2003). Preparation and characterization of magnetite nanoparticles coated by amino silane. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 212 (2-3), 219-226. [ Links ]
Netto, M., Toma, E., & Andrade, H. (2013). Superparamagnetic nanoparticles as versatile carriers and supporting materials for enzymes. Journal of Molecular Catalysis B: Enzymatic, 85-86 (1), 71-92. [ Links ]
Sahoo, B., Sahu, K., & Pramanik, P. (2011). A novel method for the immobilization of urease on phosphonate grafted iron oxide nanoparticle. Journal of Molecular Catalysis B: Enzymatic, 69 (3-4), 95-102. [ Links ]
Soo, Y. R. S., Rabolt, J., & Stroeve, P. (1996). Synthesis and characterization of nanometer Size Fe3O4 and y-Fe2O3. Chem. Mater, 8 (9), 2209-2211. [ Links ]
Tartaj, P., Morales, M. P., González-Carreño, T., Veintemillas-Verdaguer, S., & Serna, J. (2005). Advances in magnetic nanoparticles for biotechnology applications. Journal of Magnetism and Magnetic Materials, 290-291 (4), 28-34. [ Links ]
Tomotani, E. J., & Vitolo, M. (2006). Catalytic performance of invertase immobilized by adsorption on anionic exchange resin. Process Biochemistry, 41 (6), 1325-1331. [ Links ]
Tomotani, E. J., & Vitolo, M. (2007). Production of high-fructose syrup using immobilized invertase in a membrane reactor. Journal of Food Engineering, 80 (2), 662-667. [ Links ]
Waldron, R. D. (1955). Infrared Spectra of Ferrites. Physical Review, 99 (6), 1727-1735. [ Links ]
Zhao, G., Wang, J., Li, Y., Chen, X., & Liu, Y. (2011). Enzymes Immobilized on Superparamagnetic Fe3O4@Clays Nanocomposites: Preparation, Characterization, and a New Strategy for the Regeneration of Supports. The Journal of Physical Chemistry C, 115 (14), 6350-6359. [ Links ]
Zong, J., Zhu, Y., Yang, X., & Li, C. (2011). Preparation of monodispersed mesoporous silica spheres with tunable pore size and pore-size effects on adsorption of Au nanoparticles and urease. Materials Science and Engineering: C, 31 (2), 166-172. [ Links ]

Revista Ingeniería y Competitividad por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento - Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.