1. Introducción
El hidrógeno, fue descubierto y aislado por Henry Cavendish en 1781. Poco después se le dio el nombre de hidrógeno molecular, que pudo ser observado por Theophrastus von Hohenheim, también conocido como Paracelso, quien notó que el ataque de ácidos fuertes hacia metales producía un gas inflamable 1. Sus propiedades más relevantes (Tabla 1), fueron descritas por Cavendish en 1776. Posteriormente en 1783, Antoine Lavoisier observó en colaboración con Simon Laplace, que, al quemar el hidrógeno molecular en el aire, se producía agua. De allí que etimológicamente, la palabra hidrógeno haga referencia a la formación de agua (hydro = “agua”; genes = “formación”) 2,3.
El hidrógeno es característico por exhibirse en condiciones estándar, como una sustancia gaseosa incolora, inodora, insípida e inflamable, que se enciende fácilmente produciendo una llama color azul pálido, y cuyos vapores son más ligeros que el aire 4. Sin embargo, a temperaturas muy bajas, y/o presiones muy elevadas, el gas se vuelve líquido o sólido 5. Los puntos de fusión y de ebullición tan bajos, son evidencia de las débiles fuerzas de atracción que existen entre las moléculas de hidrógeno. Este fenómeno, también se verifica por el hecho de que cuando el gas hidrógeno se expande de alta a baja presión a temperatura ambiente, su temperatura se incrementa, mientras que la temperatura de los demás gases disminuye. De acuerdo con los principios de la termodinámica, esto implica que las fuerzas repulsivas rebasan las fuerzas atractivas entre moléculas de hidrógeno a temperatura ambiente; de lo contrario, la expansión enfriaría el hidrógeno 6.
Incluso a -68.8°C predominan las fuerzas atractivas, y por tanto el hidrógeno al dejarse expandir por debajo de esa temperatura logra enfriarse 5,6. Debido a estas propiedades, el hidrogeno se ha utilizado desde el siglo XIX, en la invención de electrolizadores y celdas de combustión, mucho antes del descubrimiento del petróleo. De forma posterior a estos hechos, surge el interés por emplear hidrógeno como energía alterna, debido a las crisis petroleras de los años 1970’s.
Desde entonces, se han investigado tecnologías de producción, almacenamiento y utilización de hidrógeno 7. Hoy por hoy, se estima que la producción mundial de hidrógeno está en torno de 60 millones de toneladas por año 8. No obstante, apenas una pequeña parte se emplea para la producción de energía, especialmente en aplicaciones espaciales. Generalmente, la mitad se usa para la producción de fertilizantes basados en amoníaco. También se emplea hidrógeno en la generación de alcohol metílico y el peróxido de hidrógeno. Adicionalmente, se utiliza para "hidrogenar" aceites orgánicos comestibles derivados de vegetales, tales como soja, cacahuetes, cereales y pescado, además de refrigerar motores y generadores. Pero realmente, donde mayor impacto de utilidad ha generado el hidrógeno, es en la industria petroquímica, que hace bastante tiempo se utiliza como materia prima de una amplia gama de productos derivados del petróleo para reducir la cantidad de partículas, aromáticos y, sobre todo, azufre presentes en la gasolina y el gasóleo 8,9.
Tabla 1 Propiedades fisicoquímicas del hidrógeno molecular 2,3.
| Longitud de enlace | 0.7416 |
| Energía de disociación (25 °C) | 104.19 Kcal/mol |
| Potencial de ionización | 15.427 eV |
| Densidad del sólido | 0.08671 g/cm3 |
| Calor de fusión | 28 cal/mol |
| Densidad del líquido | 0.007099 g/cm3 (-252.78°C) |
| Punto de ebullición | -252.77°C |
| Punto de fusión | -259.20°C |
| Calor de vaporización | 216 cal/mol |
| Densidad crítica | 0.0310 g/cm3 |
| Coeficiente de difusión | 0,61 cm2/s |
| Calor de combustión al agua (g) | -57.796 Kcal/mol |
Las aplicaciones potenciales del hidrógeno son muy diversas. Desde la industria hasta el sector del transporte, el hidrógeno puede abordar una amplia gama de necesidades. Se encuentra anualmente implicado de forma cuantitativa en la industria de la refinería. El refinado, es un proceso muy complejo que involucra una serie de reacciones químicas, y en ocasiones, requiere hidrógeno como insumo tal como en el hidrocraqueo, hidrotratamiento y desulfuración; o lo puede generar como subproducto en el craqueo catalítico o térmico y en el reformado catalítico 9.
Además de ser usado en los procesos de refinamiento, también es utilizado en la estabilización de moléculas y atmósferas controladas para la producción de semiconductores, vidrio flotado, y aleaciones, en la producción de nuevos combustibles, entre otros 9,10. Así mismo, se han realizado distintos estudios que han demostrado la aplicabilidad del hidrógeno como fuente de energía alterna, en el funcionamiento de motores de combustión interna alternativos de gasolina, para su funcionamiento con hidrógeno como biocombustible 11.
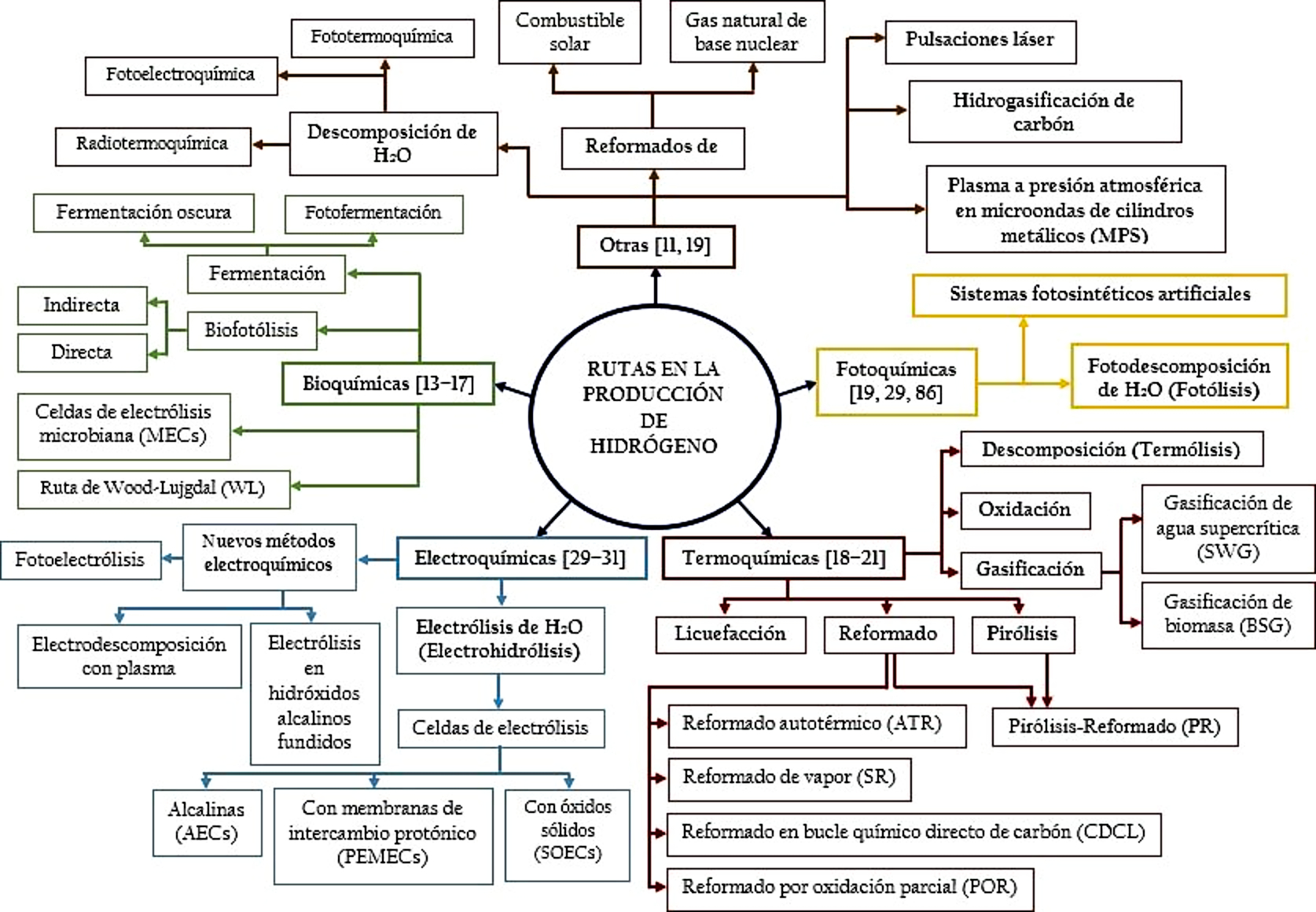
Dada la amplia gama de aplicaciones que continuamente surgen al utilizar el hidrógeno como un precursor alterno de energía, actualmente se conocen varias formas de producción, al igual que otros métodos no tan comunes (Figura 1), los cuales se caracterizan por involucrar varias rutas de producción tradicionales 12. Tradicionalmente, el hidrógeno puede producirse por rutas electroquímicas, bioquímicas, termoquímicas y fotoquímicas, partiendo de biomasa y combustibles fósiles (combustibles carbonosos) 13-15.
Dentro de los métodos bioquímicos, que se encuentran implicados en la generación de hidrógeno, se conocen la biofotólisis directa, en la que se aprovecha la energía solar, para producir hidrógeno a partir del agua; y la biofotólisis indirecta, en el que el hidrógeno es producido por la conversión de carbohidratos por la mediación catalítica de deshidrogenasas en condiciones anaeróbicas 14. Así mismo, se conoce la fotofermentación, para la cual, se produce la conversión de los sustratos en hidrógeno, por procesos fermentativos asistidos por la luz; y la fermentación oscura, que por el contrario se lleva a cabo en ausencia de luz 15. Adicionalmente, también se han desarrollado métodos que consisten en la aplicación de celdas de electrólisis microbiana, con las que se induce corriente eléctrica externa para producir hidrógeno a partir de materiales orgánicos 16,17.
Por otra parte, dentro de las rutas termoquímicas, destacan los procesos como el reformado, referido a la conversión de combustibles carbonosos en hidrógeno, utilizando diversas técnicas 18. Cuando los combustibles son tratados con vapor u oxígeno, a elevadas temperaturas, las reacciones producidas se conocen como reacciones de reformado, pero si se tratan con vapor únicamente se le conoce como reformado con vapor, o, reacción de oxidación, en caso de que solo se utilice oxígeno para la conversión de los combustibles 19,20. Aunque, también se puede realizar por combinación de estos dos procesos mencionados anteriormente. A este proceso se le conoce como reacción de reformado autotérmico 21.
Dado que las fuentes de obtención del hidrógeno no son únicamente del tipo fósil, sino también de la biomasa, la generación de hidrógeno desde biomasa con la ruta de reformado por pirólisis (PR) de dos etapas, ha ganado mayor atención recientemente 22. Esto se debe a que este método permite realizar modificaciones a la temperatura de forma independiente entre las etapas separadas de transformación y reformado, además que evita el contacto entre la materia prima y sus impurezas con el catalizador de reformado (usualmente es el Ni, utilizado sobre todo para la producción del gas de síntesis, más que para la generación de hidrógeno) 23. Así mismo, la gasificación por vapor de biomasa (BSG) se ha estudiado en los últimos años 24. Esto se debe a que los gases pueden utilizarse directamente como productos intermedios para la producción a gran escala de combustibles y productos químicos 25.
Por lo general, el proceso tiene lugar a temperaturas entre 700 y 1200°C usando aire, oxigeno, vapor o mezclas de estos como agente gasificante, dando productos gaseosos como H2, CO, CO2, CH4, entre otros hidrocarburos; y su característica principal es que, al utilizar vapor, permite mejorar la formación de hidrógeno y dar un gas de calentamiento libre de nitrógeno 26,27. Por otro lado, también figura la gasificación de agua supercrítica, en el que se emplean temperaturas superiores a los 374°C y presiones superiores a 22,1 MPa, y donde la producción de hidrógeno se ve favorecida a temperaturas superiores a 600°C 28.
Además de las rutas bioquímicas y termoquímicas, también se han empleado distintas rutas fotoquímicas, en las cuales se involucran a su vez distintos fotocatalizadores soportados, con el fin de producir hidrógeno por el proceso de fotodivisión del agua gracias a la mediación lumínica y la radiación electromagnética 29. Por otro lado, dentro de los métodos electroquímicos, se destacan, la electrólisis del agua, y una serie de formas novedosas que se han implementado, como la descomposición con plasma, y los procesos de fotoelectrólisis. La electrólisis del agua es un proceso fundamentado en el movimiento de electrones que son apoyados por un circuito externo. Actualmente, los electrolizadores de agua alcalinos, de membrana de intercambio protónico (PEM), y de óxido sólido (SO), han sido las tecnologías claves dentro de la producción electroquímica de hidrógeno 30. Así mismo, el Pt que, como catalizador, se ha implementado en la superficie de los electrodos dentro del electrolizador 31.
Al igual que los métodos tradicionales, también se han analizado y desarrollado métodos no tan comunes en la producción de hidrógeno. La mayoría de estos otros métodos o rutas, son procesos híbridos, que resultan por la combinación de dos o más rutas tradicionales y, por lo tanto, son relativamente conocidos. Por ejemplo, en la década de 1970, en la Universidad Nacional de Yokohama, Japón, se desarrolló el primer ciclo fotoelectrotermoquímico de separación de agua, ahora llamado Yokohama Mark 32. También se conoce la radiólisis, como el proceso de división del agua en hidrógeno y oxígeno, asistido por radiación nuclear de alta intensidad (radiación alfa, beta y gamma), y por lo general, no se obtienen altas eficiencias 33. Otra ruta interesante, es la hidrogasificación del carbón mineral, basada en el calor de proceso derivado de los reactores nucleares; y el reformado de gas natural de base nuclear, para la producción de hidrógeno 19.
Durante los últimos 7 años, se ha evidenciado que los métodos electroquímicos para la producción de hidrógeno han sido los más estudiados con respecto a los demás métodos, y por lo tanto, es la ruta de la que mayor número de publicaciones por año se han realizado, alcanzando un máximo de 1426 publicaciones para el año 2020 (Figura 2).
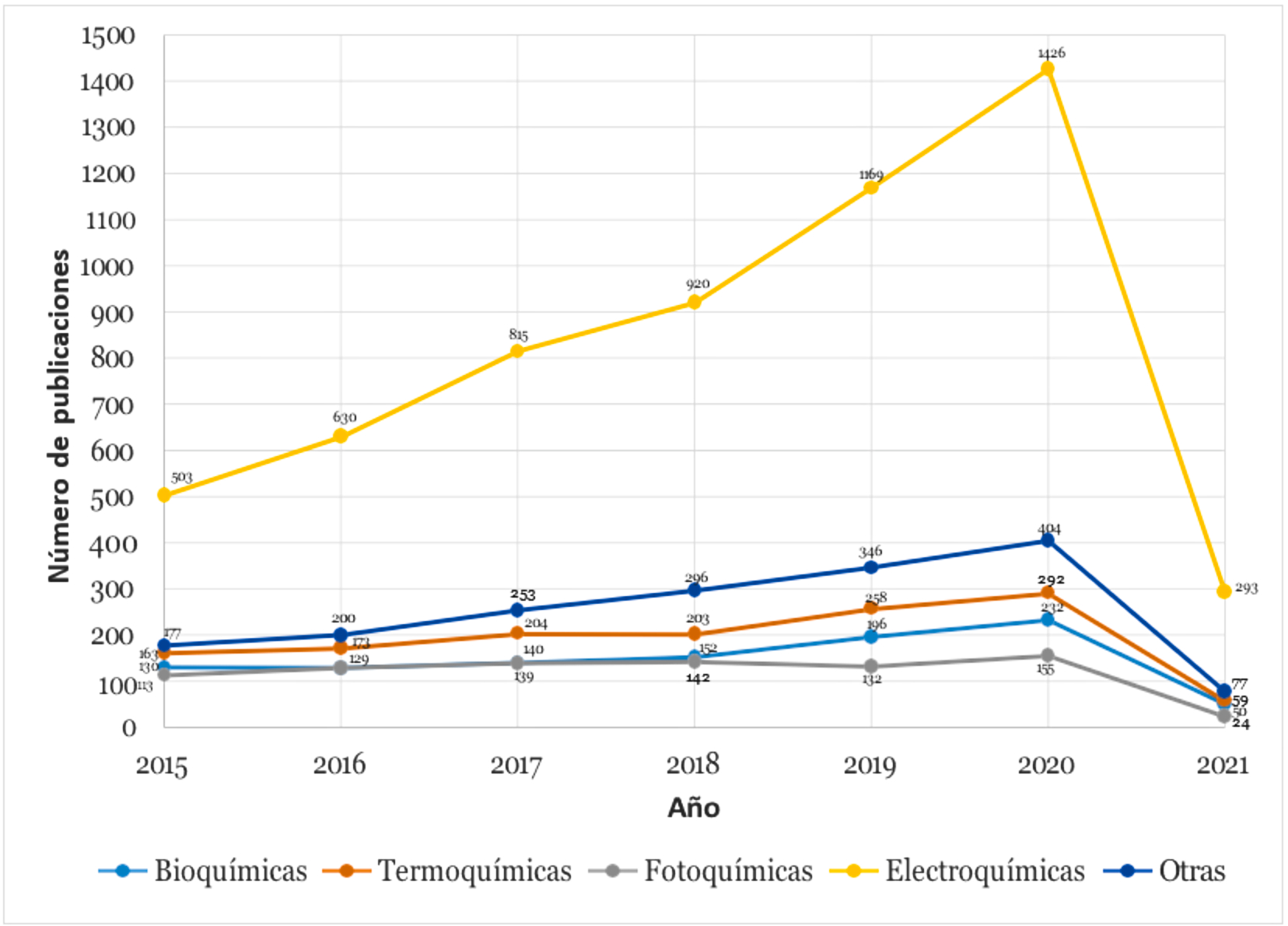
Figura 2 Número de publicaciones por cada ruta en la producción de hidrógeno (Tomado de Web of Science).
Desde este contexto, el principal objetivo de esta revisión es mostrar los avances que se han llevado a cabo dentro de los métodos de producción de hidrógeno, durante los últimos 7 años. Para tal fin, se discuten diferentes investigaciones llevadas a cabo, dentro de las rutas tradicionales (bioquímicas, termoquímicas, electroquímicas y fotoquímicas) y no tan convencionales (procesos no catalíticos y procesos híbridos) en la producción de hidrógeno. Finalmente, se plantean las perspectivas y futuras investigaciones, dentro de las principales rutas en la producción de hidrógeno.
2. Estado del arte
Dada la necesidad que ha surgido, por encontrar diferentes métodos de producción de hidrógeno, para dar abasto con la demanda energética mundial, se han desarrollado diversas investigaciones (Tabla 2), por las rutas convencionales (bioquímicas, termoquímicas, electroquímicas y fotoquímicas), como por las rutas no convencionales (procesos no catalíticos y procesos híbridos), partiendo de fuentes fósiles y de biomasa 11,19.
2.1. Rutas bioquímicas
Las rutas bioquímicas son características porque los catalizadores implicados en la producción de hidrógeno son microorganismos. Por lo general, estas rutas involucran metodologías de producción adecuadas, para instalaciones descentralizadas de pequeña escala, que se encuentran adyacentes a fuentes de biomasa o residuos biológicos. Estos procesos, pueden ser llevados a cabo por bacterias anaeróbicas, algas o una combinación de ambos, y las características, pueden diferir entre los microorganismos y sustratos utilizados 11. Por lo tanto, las condiciones de reacción (pH, temperatura), dependerán directamente de la naturaleza de los microorganismos empleados en cada proceso 34.
Las rutas bioquímicas han sido de gran atención debido a que, en conjunto con procesos electroquímicos y fotoquímicos, se han podido favorecer y mejorar metodologías de producción ya existentes. Zhang y Col. 35, describieron el mejoramiento de un sistema de microelectrólisis de carbón activado con hierro de valencia cero (ZVIAC), para la generación de hidrógeno por fermentación oscura partiendo de glucosa de un conjunto bacteriano mixto. Como principal resultado indicaron que, al implementar este tipo de carbón activado, podría mejorarse en casi un 40% la tasa de producción, dado a que junto con el sistema de microelectrólisis se podrían optimizar los factores ambientales y la estructura de la comunidad microbiana para la producción de hidrógeno fermentativo.
Al igual que los esfuerzos que se han hecho por optimizar procesos con el propósito de encontrar un mejoramiento en la eficiencia del proceso de producción de hidrógeno, también se han estudiado microorganismos que puedan ser candidatos potenciales en dicho proceso. Liu y Col. 36, indicaron que las bacterias del tipo foto-fermentativo Rhodopseudomas sp. nov. (Cepa A7), pueden llegar a ser estos candidatos, al igual que Xia y Col. 37, destacaron entre sus estudios más recientes, las bacterias hidrolíticas Acinetobacter, Comamonas, Intestinimonas y algunas bacterias de fermentación, incluidas Macellibacteroides, dada su utilidad en la conversión del carbón mineral, por un proceso de triple fase en la producción de hidrógeno. Como resultado final indicaron que el análisis del estado trifásico en el proceso sería útil para estudiar el mecanismo de producción de hidrógeno por fermentación del carbón desde diferentes perspectivas.
Dada la capacidad que tienen los residuos orgánicos procedentes de biomasa del tipo lignocelulósico, como sustratos principales para la producción de hidrógeno microbiológicamente, se han tratado de implementar tecnologías, que permiten la recuperación de energía y recursos en el tratamiento de estos residuos. Por tal razón, Zhang y Col. 38, fabricaron una celda de electrólisis microbiana de doble cámara (MEC), para investigar la producción de hidrógeno por sacarificación y fermentación simultáneas (SSF) partiendo de tres materiales lignocelulósicos que incluyeron paja de arroz, desechos vegetales y una mezcla de ambos materiales, monitoreando el rendimiento de gas hidrógeno, pH, concentraciones de ácidos orgánicos y azúcar reductor, y calculando la eficiencia de recuperación energética en cada experimento. Finalmente, pudieron mostrar que el rendimiento máximo de hidrógeno fue de 2,56 mmol con una eficiencia de recuperación de energía del 215,33% en un MEC de doble cámara, reafirmando que los materiales lignocelulósicos se pueden emplear como sustrato de partida, para la obtención de hidrógeno.
Wang y Col. 39,40, en su búsqueda de nuevos equipos y dispositivos para la producción de hidrógeno, propusieron y desarrollaron un diseño de un biofotoreactor con un papel plano de vidrio transparente con rejilla en columna de metacrilato de metilo (PMMA), con el fin de favorecer el crecimiento de la biopelícula con Rhodopseudomonas palustris GCA009, y propiciar una tasa elevada de producción continua de hidrógeno fotofermentativo partiendo de glucosa. De esta manera, pudieron observar que, a determinada intensidad de luz, concentración de sustrato y velocidad de flujo cruzado, se podía lograr un rendimiento de hidrógeno de 1,15 moles de H2/mol de glucosa y una eficiencia de conversión de luz de 5,34%; demostrando que el biofotoreactor puede mejorar satisfactoriamente la producción de hidrógeno. De igual forma, en investigaciones posteriores, aislaron una nueva cepa de Rhodopseudomonas sp. (Cepa WR-17), para la producción de hidrógeno fotofermentativo, y su capacidad de producción al emplear subproductos líquidos principales de tres tipos de fermentación oscura en cultivo por lotes. De este modo, se obtuvo un rendimiento máximo de hidrógeno de 2,42 moles de H2/mol de acetato cuando el acetato se utilizó como única fuente de carbono; y consiguieron demostrar que los metabolitos de tipo ácido butírico como sustrato, son adecuados para producir hidrógeno en altos rendimientos, mediante la combinación de la foto-fermentación.
Así mismo, en investigaciones más recientes, Wang y Col. 41, también exploraron la presencia de nitrato, para mejorar la generación de hidrógeno desde la fermentación oscura de residuos de lodos activados (WAS). De este modo, determinaron que, al adicionar mayores cantidades de nitrato, la producción máxima de hidrógeno de la fermentación ácida (pH 5.5) de WAS aumentaba de 12.6 ± 0.5 a 19.3 ± 0.9 mL por gramo de sólidos suspendidos volátiles (VSS). Adicionalmente, al estudiar los mecanismos de reacción, observaron que la presencia de nitrato promovía el proceso de solubilización, y causaba una mayor inhibición en los procesos de consumo de hidrógeno, que en los procesos de producción.
Por otro lado, se ha podido observar que los rendimientos de hidrógeno de la fermentación oscura son limitados debido a la necesidad de producir también productos secundarios reducidos, y que la fotofermentación, una alternativa, está limitada por la necesidad de luz. Una estrategia relativamente nueva, es la fermentación microaeróbica oscura, la cual podría potencialmente superar ambas limitaciones. Lazaro y Col. 42, demostraron por primera vez una producción significativa de hidrógeno a partir de lactato, por parte de una bacteria fotosintética (Rhodopseudomonas palustris GCA009). Para dicho estudio, utilizaron la metodología de superficie de respuesta (RSM), para optimizar la concentración de sustrato y oxígeno, así como el inóculo, usando tanto cultivos discontinuos regulares como cultivos discontinuos alimentados con O2. De este modo, encontraron el mayor rendimiento de hidrógeno para un lote regular (1,4 ± 0,1 mol) de H2/mol de lactato), y la mayor producción de hidrógeno (173,5 µmol de H2) se logró utilizando un lote de alimentación de O2. Al comparar los rendimientos obtenidos, determinaron que estos eran cercanos a los que se reportan en la condición mucho más estudiada, la fotofermentación.
Srivastava y Col. 43, por su parte, investigaron la producción de hidrógeno utilizando la paja de arroz hidrolizada y Clostridium pasteurianum (MTCC116). Dentro de su estudio, La paja de arroz (1,0% pretratada con álcali) se sometió a hidrólisis enzimática, mediante celulasa fúngica bruta tratada con nanocompuestos (NCs) de Fe3O4/Alginato termoestable, obtenida de Aspergilluls fumigatus AA001. Los azúcares monoméricos de mayor liberación, alrededor de 54,18 g/L en forma de hidrolizado de paja de arroz, también se emplearon como sustratos para la generación de hidrógeno a través de la fermentación oscura por Clostridium pasteurianum, utilizando el proceso separado de hidrólisis y fermentación (SHF). De esta manera, se produjo un total de 2580 mL/L de hidrógeno acumulado en 144 h, con un aumento de la biomasa bacteriana de 1,5 g/L y con un pH inicial favorable de 6,6. Adicionalmente, resaltaron el hecho de que los azúcares liberados más altos y la presencia de NCs de Fe3O4/Alginato en el medio, podrían causar una mayor producción de hidrógeno fermentativo.
Por otra parte, Cai y Col. 44, investigaron la producción de hidrógeno en co-cultivo empleando una bacteria fotofermentativa marina tolerante a los ácidos, Rhodovulum sulfidophilum TH-102. De esta forma, un consorte bacteriano fermentativo oscuro y Rhodovulum sulfidophilum TH-102, fueron cultivados individualmente o co-cultivados, en un medio con alto contenido de sal para la producción de hidrógeno. Así, pudieron notar que todos los co-cultivos produjeron más hidrógeno que el cultivo individual de foto o fermentación oscura; y que el mayor rendimiento de hidrógeno (1694 ± 21 mL/L), se conseguía con una proporción de co-cultivo bacterias oscuras/fotos 1:10. Estos resultados revelaron de forma concluyente, que la presencia de bacterias foto-fermentativas en el co-cultivo, puede estimular el crecimiento de biomasa y la producción de hidrógeno.
De igual forma, An y Col. 45, han investigado la viabilidad y el rendimiento de la generación de hidrógeno a partir de lodos de papel (PS) sin inoculación en condiciones termofílicas. Esto se debe a que la valorización de PS para la producción de hidrógeno por fermentación oscura ofrece un gran potencial tanto para la producción de combustible limpio, como para la eliminación de residuos. Partiendo de esta premisa, su estudio se enfoca a observar y analizar los cambios dinámicos en las poblaciones bacterianas durante la producción de hidrógeno, encontrando que los géneros Ruminiclostridium y Thermoanaerobacterium jugaron un papel clave en la hidrólisis del sustrato y la generación de hidrógeno; lo cual pudieron respaldar al inocular Clostridium thermocellum obteniendo un aumento significativo en el rendimiento de hidrógeno, el rendimiento de inoculación y la tasa de degradación de la holocelulosa en un 96,80%; 103,19% y 32,95%, respectivamente. Con estos resultados, pudieron demostrar que Clostridium thermocellum, representa una visión prometedora sobre la producción anaeróbica de hidrógeno a partir de PS, que proporciona un ejemplo de generación eficiente de hidrógeno a partir de biomasa residual.
Por otro lado, la producción de biohidrógeno a partir de melaza de remolacha azucarera utilizando Rhodobacter capsulatus YO3 inmovilizado en agar, fue investigada por Sagir y Col. 46; para lo cual, emplearon un fotobiorreactor de panel (1,4 L), y evaluaron el impacto de varias concentraciones iniciales de melaza en la producción, el rendimiento y la productividad de hidrógeno. De esta manera, encontraron que en estudios interiores, la mayor productividad de hidrógeno se obtenía a lo largo de 20 días de operación, y sus valores correspondían con 0,64 ± 0,06 mmol H2 L-1.h-1 y rendimiento de 12,2 ± 1,5 mol H2/mol sacarosa. Mientras que, para los estudios exteriores, la producción de hidrógeno continuó durante 40 días, incluidas 10 rondas consecutivas, dando una productividad y rendimiento máximos de hidrógeno de 0,79 ± 0,04 mmol H2 L-1.h-1 y 5,2 ± 0,4 mol H2/mol sacarosa respectivamente. Con este estudio, demostraron que el sistema propuesto es prometedor para la producción de biohidrógeno a partir de melazas en condiciones naturales a gran escala.
En investigaciones más recientes, se han tratado de estudiar los rendimientos en la generación de hidrógeno a partir de alimentos, empleando inóculo de los residuos digeridos anaeróbicos de porcinos (PADR). En los estudios abordados por Wang y Col. 47, se investigaron los PADR como candidatos de inoculación en los procesos de fermentación oscura, variando la temperatura y el pH como parámetros de control.
Además, se evaluaron otras variables como, la tasa de carga orgánica (OLR) y el tiempo de retención hidráulica (HTR). Así, pudieron observar que las variaciones producidas en los parámetros de control tenían un impacto significativo en la producción de hidrógeno y la estructura de la comunidad microbiana (Thermoanaerobacterium, que se mostró como la más estable durante la fermentación termofílica), dando distintos rendimientos en la producción de hidrógeno. De este modo, se pudo proporcionar una visión más profunda del proceso de producción de biohidrógeno.
Actualmente, la energía verde ha ganado un interés considerable como fuente de energía económica. Comparando con otras fuentes de energía alternativas, el hidrógeno tiene un potencial respetuoso con el medio ambiente considerable. Se han investigado microorganismos que poseen capacidad de producción de hidrógeno. Se ha demostrado que la mezcla directa de nano-metales con microorganismos en crecimiento suspendido, aumenta la producción de hidrógeno. Partiendo de esta premisa, Wannapokin y Col. 48, propusieron un nuevo enfoque de co-inmovilización de nano-metales y microorganismos productores de hidrógeno (para tal fin emplearon Clostridium pasteurianum). La producción y composición de gas acumulativo, mostró que la co-inmovilización con níquel nano-metálico (NP-Ni) y hierro (NP- Fe), mejoró el rendimiento del sistema, dando porcentajes de composición de hidrógeno gaseoso a 46,90% y 42,03% respectivamente. Por lo tanto, los resultados demostraron que, Clostridium pasteurianum co-inmovilizado con partículas de nanometales seleccionadas, podría ser un método factible para aumentar la producción de hidrógeno.
De igual forma, las celdas de electrólisis microbiana (MEC), han proporcionado enfoques efectivos para la generación de hidrógeno a partir de aguas residuales y biomasa renovable, a pesar de que mejorar la eficiencia de la recuperación de energía a partir de desechos sigue siendo un desafío. Li y Col. 49, informaron las interacciones de alimentación cruzada entre Ethanoligenens harbinense productor de hidrógeno y Geobacter sulfurreducens electroactivo en MEC y la fermentación anaeróbica, utilizando glucosa como donante de electrones. Los resultados mostraron que, G. sulfurreducens podría oxidar el acetato producido por E. harbinense y transferir electrones extracelularmente al electrodo de MEC, lo que también mejoró la producción de hidrógeno por E. harbinense, a través de la mitigación de la inhibición por retroalimentación metabólica y la mejora de la transferencia de electrones entre especies. Los co- cultivos definidos, mostraron tasas de producción de hidrógeno de 2,5 a 2,9 veces más altas en comparación con los monocultivos, mientras que los MEC mejoraron aún más la eficiencia de conversión del sustrato y convirtieron la energía eléctrica en energía de hidrógeno. Estos hallazgos dan una nueva perspectiva de las interacciones sintróficas, y ofrecen una estrategia eficaz para mejorar la producción de H2 y dirigir los productos metabólicos de las bacterias fermentativas.
Por otro lado, los desechos agrícolas de las fábricas, la melaza y las aguas residuales de las plantas de destilación de etanol, han sido uno de los focos principales en la búsqueda de nuevos métodos para la generación de hidrógeno. Para superar la limitación de la producción de bio-H2, la selección directa de sustratos de desecho para un productor eficiente utilizando la técnica libre de co-cultivo, es una opción interesante. Desde este punto de vista, Lertsriwong y Glinwong 50, seleccionaron especies competentes con capacidad para producir H2 y valiosos ácidos volátiles como el ácido acético. Se aislaron varias bacterias (de desechos ricos en azúcares reductores como en aguas residuales) y se identificaron sus especies mediante análisis de secuencia de 16S ADNr microbiano y análisis filogenético, mediante el método de máxima verosimilitud.
Para la aplicación de bio-H2 en este criterio, se seleccionó el potente productor de hidrógeno natural B. coagulans MO11 y C. beijerinckii CN para probar la capacidad de crecimiento en diferentes sustratos (dióxido de carbono, L-arabinosa, D-xilosa, D-glucosa, D -fructosa, sacarosa, maltosa, celobiosa, almidón y otros). Dentro de sus resultados se menciona que, entre todos, Bacillus coagulans MO11, podría producir gas hidrógeno utilizando melaza y aguas residuales de refinerías de etanol de manera efectiva (1,634 mol H2/mol hexosa), que fue el rendimiento máximo en este estudio. En comparación, el experimento realizado con B. coagulans MO11 y C. beijerinckii CN alimentados con agua residual de melaza diluida 40X, mostró una mejor producción de H2 en Clostridium beijerinckii CN durante las últimas 72 horas de recolección de gas (79 mL/L y 125 mL/L respectivamente). Los resultados apuntaron en la misma dirección al reemplazar la melaza diluida 40X, por aguas residuales de refinería diluidas 5X suplementadas con oligoelementos.
Cieciura-Włoch y Col. 51, por otro lado, evaluaron el impacto de tres compuestos de hierro diferentes (Fe2O3, FeSO4, FeCl3) en la generación de hidrógeno a través de la fermentación oscura mesofílica (DF) de pulpa de remolacha azucarera hidrolizada (SBP). En las pruebas por lotes, el rendimiento máximo de hidrógeno de más de 200 dm3 H2/ kg solidos volátiles (VS), se logró con la adición de 0,1 g Fe2O3/dm3, que fue dos veces mayor que el control. En experimentos semicontinuos, la producción de hidrógeno más alta de 52,11 dm3 H2/ kg VS, combinada con un rendimiento de metano de 19,4 dm3 CH4 kg VS, se obtuvo a una dosis de 1 g Fe2O3/dm3.
Los ácidos acético, láctico y caproico, fueron los principales productos metabólicos de DF. Los estudios microbiológicos mostraron cierto equilibrio entre los microorganismos productores de hidrógeno del orden Clostridiales y los productores de ácido láctico (LAB), afiliados a los órdenes Lactobacillales y Coriobacteriales. Además, también se documentó la presencia de metanógenos afiliados a los géneros Methanobrevibacter y Methanosphaera. Adicionalmente, reportaron un hallazgo interesante correspondiente a la aparición de bacterias raras del género Caproiciproducens, responsable del aumento de la producción de ácido caproico.
2.3. Rutas termoquímicas y electroquímicas
Los procesos termoquímicos de producción de hidrógeno implican reacciones químicas asistidas térmicamente, que consecuentemente liberan H2 y gases ricos en H2. Se pueden emplear biomasa, combustibles nucleares y fósiles, para producir hidrógeno a través de este proceso, y dependiendo del tipo de fuente, las rutas termoquímicas, pueden ser variadas 11, por lo tanto, las condiciones de operabilidad (temperatura, presión) de cada ruta, estarán determinadas por la fuente de partida, para la producción de hidrógeno 52. Además, los procesos termoquímicos, como la gasificación, la pirólisis y la descomposición, se caracterizan por su escalabilidad a unidades industriales, donde el gas de síntesis y el biocombustible obtenido como productos intermediarios, pueden convertirse en valiosos combustibles y productos químicos 53. Por otro lado, los procesos electroquímicos, se basan en el uso de celdas galvánicas, y por lo tanto de una fuerza electromotriz que permita la transferencia de electrones, hacia la generación de hidrógeno a partir de un sustrato. De esta forma, las condiciones de operación, como el potencial voltaico, dependerán del sustrato de partida 54.
2.4. Catálisis heterogénea
Al igual que los procesos fermentativos como métodos de obtención de hidrógeno, también se han realizado estudios que recurren a procesos termoquímicos mediados por materiales portadores de oxígeno (OMCs), característicos por ser materiales con elevada capacidad redox y, por tanto, permitir el intercambio de oxígeno entre corrientes gaseosas, en procesos de bucle químico 55,56). Uno de estos casos, es el uso de óxidos con propiedades termodinámicas favorables, como las perovskitas del tipo La0.7Sr0.3Fe3-δ (LSF731), las cuales se han sugerido como excelentes OMCs junto con el Fe2O3/Al2O3, puesto a que han favorecido una producción constante de H2, en las reacciones de desplazamiento de agua-gas en procesos de bucle químico 57, y por lo tanto se han estudiado como candidatos para la producción de hidrógeno. Es por esta misma razón que Dueso y Col. 58, promovieron el uso de OMCs, hechos de racimos de óxido de hierro incrustados en una matriz LSF731, en este tipo de reacciones, debido a que la matriz de la perovskita, facilita el transporte de oxígeno a los grupos de óxido de hierro, al tiempo que evita la aglomeración. Finalmente, pudieron notar que la producción de hidrógeno era estable y 8 veces mayor al emplear la perovskita modificada, que con sus componentes de forma separada.
Así mismo, el rendimiento de las perovskitas como materiales redox para la generación de hidrógeno termoquímico solar y el almacenamiento de energía, han sido estudiados teóricamente por varios autores, pero existen pocos estudios experimentales sobre ellos. De acuerdo a lo presentado por Orfila y Col. 59, se evaluaron materiales comerciales de perovskita del tipo La1-xSrxMeO3 (Me = Mn, Co y Fe) para la descomposición termoquímica de agua. Las perovskitas involucradas dentro de este estudio, mostraron propiedades redox adecuadas para el almacenamiento de oxígeno en análisis termogravimétrico (TGA) en presencia de aire, aunque solo el material Co-perovskita (LSC) exhibió capacidad de ciclabilidad. Por otra parte, los experimentos de separación termoquímica del agua revelaron la producción de hidrógeno, con rendimientos crecientes con perovskitas sustituidas con Mn, Fe y Co, respectivamente. Estos resultados, demostraron experimentalmente la idoneidad de la producción de hidrógeno solar basada en ciclos termoquímicos de La1-xSrxMeO3. Además, las temperaturas requeridas para la producción de hidrógeno (230°C), fueron más bajas que las reportadas para los ciclos de óxido de MenOy “puro” (500°C), lo que hace que los ciclos basados en perovskita, sean una alternativa prometedora. De este modo, pudieron confirmar que la perovskita LSC, promete ser un material potencial para la generación de hidrógeno por división termoquímica de agua impulsada por energía solar.
Además de las perovskitas, también se han desarrollado otros materiales que han demostrado ser competitivos en la generación de hidrógeno termoquímico. Shen y Lua 60, sintetizaron por el método de ¨nanocasting¨ (o “repetición de plantillas”, es el proceso en el que una plantilla nueva con estructuras relevantes en escala nanométrica, se llena con otro material, y la plantilla inicial se elimina posteriormente 61) un nuevo tipo de carbono poroso con un sistema de poros trimodal interconectado, utilizando partículas de sílice micro-mesoporosas bimodales nanoparticuladas como plantilla, y confirmaron que el carbono resultante, puede ser utilizado como catalizador para la generación de hidrógeno a través la descomposición térmica del metano, puesto a que presentó rendimientos mucho más altos (1,16 mmol H2/g catalizador), que los materiales de carbono comerciales (0,42 y 0,89 mmol H2/g catalizador), atribuyendo el resultado de su actividad catalítica, a la estructura jerárquica de poros trimodal, en la que los intra-mesoporos y microporos en el catalizador de carbono, proporcionaron grandes sitios activos abundantes y espacios libres para la deposición de carbono, mientras que los inter- mesoporos, sirvieron como una vía para el transporte de moléculas de metano.
Adicionalmente, Singh y Col. 62, propusieron un nanomaterial de óxido de níquel poroso separable magnéticamente con una distribución uniforme de Ni, que tiene una gran superficie y sitios de Si dispersos atómicamente, para mejorar la generación de hidrógeno a partir de desechos orgánicos. En su investigación, determinaron que el catalizador mostró una tasa de producción diez veces mayor a partir de volátiles durante la carbonización de desechos orgánicos y carbón, que en ausencia del catalizador. El catalizador de Ni/NiO reducido, mostró una producción de hidrógeno dos veces mayor en comparación con el catalizador tradicional de Ni/Al2O3, haciéndolo un material muy favorable, además de su alta reciclabilidad y su economía durante el proceso de generación, en comparación con catalizadores de Ni comerciales.
Por otro lado, también se ha destacado el uso de combustibles fósiles para dar abastecimiento a la demanda energética dada por el hidrógeno. Es así como la oxidación catalítica parcial de metano ha prometido ser un proceso eficiente para la producción de hidrógeno y gas de síntesis, además del reformado con vapor de metano, la tecnología líder. Figen y Baikara 63, estudiaron catalizadores para la oxidación parcial de metano en términos de propiedades estructurales y desempeño químico. Para tal propósito, dentro de la investigación prepararon catalizadores de Co, Co-Ni, Co-Ru, Co-Ni-Ru, y Ni, sobre soportes monolíticos cerámicos de cordierita, mediante el método de impregnación sol-gel modificado. Acorde con la metodología, emplearon pruebas de actividad catalítica, las cuales fueron llevadas a cabo en un reactor tubular. Como resultado principal, observaron que el catalizador con mayor éxito fue el de Co-Ni-Ru, dando valores de selectividad de 93,10% de H2 y 93,81% de CO, y conversión de metano de 98,71% y eficiencia de producción de hidrógeno de 95,89% a 850 °C. Complementariamente, aclararon la necesidad de estudiar la estabilidad de estos catalizadores a largo plazo con el fin de mejorar la eficiencia de generación de hidrógeno.
Así como el metano, el metanol también ha sido empleado en investigaciones para la producción de hidrógeno por oxidación parcial catalítica. Zulowski y Berkowicz 64, estudiaron esta posibilidad, utilizando N2O como oxidante, sobre un catalizador comercial de hierro-cromo en forma de lecho fluidizado. De esta forma, lograron rendimientos de hidrógeno de hasta el 95% a 350 °C, reflejando como resultado las ventajas más importantes de las soluciones propuestas como: la posibilidad de utilización de biometanol renovable y N2O residual; fácil control de la temperatura del proceso y, por tanto, control de la distribución del producto mediante la introducción de un catalizador en estado fluidizado; uso de un catalizador industrial barato, disponible, estable y de larga duración; alta resistencia a la compresión y resistencia a la abrasión.
Por su parte, Zardin y Pérez 65, examinaron la influencia de la activación catalítica para la descomposición del metano, sobre los óxidos mixtos Co-Al derivados de hidrotalcitas. Para tal fin, prepararon las muestras por coprecipitación y se caracterizaron mediante mediciones del área de superficie y reducción programada por temperatura. Adicionalmente, los catalizadores gastados y el carbono producido en la reacción se caracterizaron por difracción de rayos X (DRX), oxidación a temperatura programada (TPO), y microscopía electrónica de barrido (SEM). Como resultado, pudieron notar que el área superficial disminuye a medida que aumenta la relación Co/Al, que está relacionada con el aumento de la fase Co3O4 en lugar de los óxidos mixtos Co-Al. Adicionalmente, se verificó la reducción de cuatro tipos de especies de Co: especies de Co3+ y Co2+ de Co3O4 y Co de espinela inversa (Co2AlO4) y espinela normal (CoAl2O4). Es así, como las muestras reducidas con H2, mostraron grandes cristalitos de Co, que aumentaron con la relación Co/Al. Finalmente, mencionaron que la activación del catalizador Co-Al bajo flujo de metano, conduce a un tamaño de cristalito más bajo y una mayor estabilidad térmica para la producción de hidrógeno por descomposición de metano
De forma similar, también se han estudiado procesos que recurren al reformado catalítico como tentativa en la producción de hidrógeno, en contraste a los métodos de oxidación y descomposición catalítica. Gao, Han y Quan (66, estudiaron el efecto de la relación Ni/Co, sobre el rendimiento catalítico del catalizador de espuma cerámica de Ni-Co para la producción de hidrógeno mediante reformado con vapor de alquitrán de hulla real, encontrando que la reducibilidad de los óxidos metálicos en los catalizadores bimetálicos de espuma cerámica/Ni-Co, estaba influenciada por la relación Ni/Co, y que el rendimiento de hidrógeno aumentó primero y luego disminuyó con la disminución de la relación Ni/Co. De esta forma, se obtuvo el rendimiento de hidrógeno más alto de 31,46 mmolg-1 y la deposición de coque más baja de 0,34% cuando la relación Ni/Co fue 5/5, además de que la prueba de vida útil mostró que el catalizador mantuvo la actividad catalítica después de 14 ciclos (28 h), lo cual indicó que el reformado con vapor de alquitrán de hulla sobre catalizador de espuma cerámica/Ni-Co, es un método prometedor para la generación de hidrógeno.
Otra investigación relacionada con el método de reformado catalítico, fue abordada por Nabgan y Col. (67, en la cual emplearon el fenol, con el fin de producir hidrógeno en términos del catalizador bimetálico de Ni-Co soportado sobre CeO2, ZrO2, La2O3, γ-Al2O3 y α-Al2O3 (cada catalizador formado con un 5% en peso de Ni y 5% en peso de Co sobre el soporte, todos preparados por el método de impregnación). Por lo demás, también investigaron el efecto de diferentes soportes sobre las propiedades y el comportamiento catalítico, con el propósito de producir hidrógeno. Por ello, para dar cumplimiento a dicho propósito, los catalizadores se probaron en un microreactor de lecho fijo, en un rango de temperatura de 500-800 °C. De esta manera, los investigadores resaltaron el hecho de que la actividad de los catalizadores sobre la conversión de fenol y el rendimiento de hidrógeno, depende del sitio básico y ácido de los catalizadores, así como de la interacción del metal con el soporte, dando como resultado después de varios experimentos en actividad catalítica, la reafirmación en el hecho de que se obtuvo una mayor producción de H2 en presencia de una alta absorción de CO2 y un consumo de H2 que se caracterizan por análisis de basicidad y reducibilidad respectivamente. Finalmente, concluyeron que el catalizador más activo fue el de Ni-Co/ZrO2, debido a que tiene la estructura de fase tetragonal que es favorecida en los procesos de reformado, fuerte interacción metal-soporte, alta área de superficie, menor formación de coque y seis días de estabilidad de reformado; dando una conversión de fenol del 75,9% y un rendimiento de hidrógeno del 80,7%.
Por otra parte, la generación de hidrógeno en bucle químico directo de carbón (CDCL), es una tecnología innovadora desarrollada para producir hidrógeno con captura de CO2 in situ. La mayoría de los candidatos a OMCs, para otros procesos de bucle químico no son adecuados para la tecnología, principalmente, porque la circulación de OMCs, puede obviar el contacto entre el carbón y el agente oxidante utilizado. Desde este contexto, Liu y Col. 68, realizaron investigaciones, con el objetivo de preparar OMCs de Fe2O3/Al2O3 modificados con potasio. Así mismo, realizaron experimentos en un reactor de lecho fijo, para evaluar el rendimiento redox y cíclico de los OMCs. Estos compuestos, se caracterizaron y los resultados mostraron que los rangos de partículas apropiados fueron 425 µm - 600 µm para OMCs y menos de 75 µm para carbón. De forma general, pudieron encontrar que la disminución del contenido de potasio en los OMCs, explica la disminución de la conversión de carbono y el rendimiento de hidrógeno, además que el suplemento de K2CO3, podría recuperar la reactividad de los OMCs.
Así mismo, Liu y Col. 69, han sugerido que la generación de hidrógeno mediante el proceso de CDCL con OMCs a base de hierro, es una opción atractiva para producir H2. Sin embargo, la baja tasa de reducción y la alta endotermicidad, son las dos principales dificultades de este proceso. Por tal motivo, la tasa de reducción de los OMCs K-Fe-Al por carbón carbonizado, el efecto del Al2O3 en la propiedad endotérmica, y la sinterización de los OMCs durante la reducción, fueron investigados por TGA, DRX, SEM y calorimetría diferencial de barrido (DSC). La viabilidad de este proceso, se analizó preliminarmente usando un reactor de lecho fijo simulando diferentes pasos de reacción. De este modo, determinaron que la tasa de reducción de los OMCs, aumentaba notablemente con una mayor cantidad de potasio, pero disminuía al aumentar la cantidad de Al2O3. Sin embargo, la adición de Al2O3 en el portador de oxígeno no solo pudo mitigar la sinterización, sino que también alivió la endotermicidad de la reducción por la formación exotérmica de FeAl2O4. Este análisis de viabilidad preliminar, sugirió que es posible producir H2 usando CDCL con los OMCs K-Fe-Al.
Por otro lado, en investigaciones posteriores realizadas por Lin, Leu y Lee 70, también estudiaron la generación directa e indirecta de biohidrógeno mediante rutas bioquímicas y termoquímicas, específicamente por fermentación oscura mesofílica (35 °C), y reformado de metano a temperatura ambiente (25 °C), respectivamente, para maximizar la producción de biohidrógeno a partir de aguas residuales de una manera respetuosa con el medio ambiente. En la fermentación oscura a escala de laboratorio, emplearon un sustrato de aguas residuales de bebida para la producción de biohidrógeno, y su efluente se introdujo en un reactor de producción de biometano. Por otra parte, en el reformado de metano, utilizaron un reformador de metano asistido por plasma hecho en laboratorio, que utiliza un catalizador de seda de acero. De esta manera, pudieron verificar que el hidrógeno gaseoso producido tanto de forma directa como indirecta, no contenía CO. Adicionalmente, mencionaron que el método de reformado empleado, tenía una eficiencia de 0,0048 L/min-W, lo que indica que es comparable con otros métodos de productividad energética correspondiente al hidrógeno.
2.5. Reacciones de descomposición
Dentro de la catálisis heterogénea, los procesos de descomposición han llamado la atención puesto a que permiten la conversión efectiva de materias primas para la generación de hidrógeno y el abastecimiento de energía. Uno de estos procesos es la electrólisis de agua, en la que se emplea la electricidad para descomponer el agua en moléculas de oxígeno e hidrógeno (Ec. 1).
La energía total requerida para descomponer el agua viene dada por el negativo del calor de combustión del hidrógeno y la energía eléctrica mínima por el cambio en la energía libre de Gibbs 71.
Por otro lado, también se ha mencionado el proceso endotérmico de descomposición de metanol 72, en el que ocurre la disociación de las moléculas de metanol, dando lugar a la obtención de hidrógeno y monóxido de carbono (Ec. 2).
Adicionalmente, también se han realizado estudios en los que se emplea etanol como molécula plataforma, para la obtención de hidrógeno (Ec. 3), mediante pulsaciones eléctricas 73.
Así mismo, también se ha reportado el uso del metano 74 (Ec. 4), etanol 75) (Ec. 5), y propano 76) (Ec. 6), como promotores en la generación de hidrógeno por el proceso de descomposición catalítica.
Estos procesos, recientemente se han llevado a cabo con el uso de una gran variedad de materiales y catalizadores soportados, con el fin de favorecer la producción de hidrógeno libre de hidrocarburos y mejorar las selectividades hacia la obtención de hidrógeno como producto deseado 76-79. Por su parte, el amoniaco también ha sido de interés, puesto a que también se considera como una de las moléculas plataforma para la obtención de hidrógeno. La descomposición catalítica de amoníaco (Ec. 7) ha sido bastante estudiada, y actualmente, se conocen gran variedad de catalizadores con los que este proceso se lleva a cabo 80,81.
Al igual que los alcanos y los alcoholes, los ácidos carboxílicos, también se encuentran dentro del grupo de compuestos promotores en la producción de hidrógeno. Actualmente, se conocen bastante bien los procesos de descomposición a partir de los ácidos fórmico (Ec. 8) y acético (Ec. 9) 82-85.
Las reacciones de descomposición de hidrocarburos y moléculas modelo de biomasa (por ejemplo, CH4, C2H6, CH3COOH, etc.) se utilizan principalmente para la producción de materiales derivados del carbono, como los nanotubos de carbono. El H2 es un interés y, a veces, el único subproducto. Esta ruta es muy interesante, ya que se pueden obtener dos importantes productos de valor agregado (producción de hidrógeno y nanotubos de carbono) 82.
2.6. Producción Fotoquímica
Los procesos fotoquímicos, para la generación de hidrógeno, se agrupan en cuatro procesos, de acuerdo con las condiciones en las que se llevan a cabo: conversión eléctrica, conversión térmica, conversión indirecta y conversión de fotones. La conversión eléctrica, se produce por electrólisis oscura del agua mediante electricidad, que, por lo general, es producida por celdas fotovoltaicas.
Por su parte, en la conversión térmica, la radiación solar se concentra para producir calor a alta temperatura, y esta energía calórica, posteriormente es aprovechada para llevar a cabo procesos térmicos. Así mismo, en la conversión indirecta, también se genera energía calórica, pero esta es almacenada, y sucesivamente transformada en energía mecánica y eléctrica, que posteriormente puede aprovecharse en procesos electroquímicos. En la conversión de fotones, a diferencia de los tres procesos mencionados anteriormente, los fotones se capturan y sirven como fuerza impulsora sin pasos intermedios para producir hidrógeno 86. Al igual que los procesos bioquímicos y termoquímicos se han estudiado varias formas de producción fotoquímicamente. Bashiri y Col. 87, en su investigación, prepararon fotocatalizadores de Cu/TiO2 al 10% en moles variando las relaciones molares de H2O:Alcóxido en 8, 16, 32 y 64, con el fin de buscar alternativas en la producción de hidrógeno.
Su estudio se enfocó en investigar la influencia de la velocidad de hidrólisis, sobre las propiedades fisicoquímicas y la producción de hidrógeno fotocatalítico, mediante la fotodescomposición del agua en una solución acuosa de NaOH-glicerol. De esta forma, encontraron que el fotocatalizador con la relación molar H2O:Alcóxido de 32, da como resultado la producción acumulada de hidrógeno más alta. Este hecho fue atribuido a una buena cristalinidad, una absorción visible de amplio rango, una menor energía de banda prohibida y la coexistencia de Cu2O y CuO juntos. Además, el efecto sinérgico del glicerol y los grupos hidroxilo en el medio de reacción, pudo mejorar la fotooxidación del glicerol, reduciendo la desactivación de los fotocatalizadores y la reacción inversa de O2 y H2, dando como resultado una mayor producción de hidrógeno.
Por su parte Chang y Col. 88, mencionan el uso de grafeno similar a una flor (FG), preparado mediante un método de deposición de vapor químico mejorado con plasma acoplado a transformador, como soporte para la preparación de fotocatalizadores compuestos potenciales, para mejorar los procesos de producción de hidrógeno. Por tal razón, elaboraron pequeñas partículas de ZnS en la superficie de FG, mediante un proceso hidrotermal con precursores de ZnCl2 y Na2S. Como resultado final, pudieron notar que la tasa máxima de producción de hidrógeno del fotocatalizador compuesto FG-ZnS ZS-G0.02, fue de 11600 µmolg-1h-1 bajo irradiación de luz ultravioleta a una relación en peso de grafeno/precursor de ZnCl2 de 0,02. Estos resultados fueron atribuidos a que, la estructura similar a una flor de FG puede ayudar a la absorción de luz, adsorción de agentes sacrificantes en la solución y separación de portadores fotogenerados. Además, mencionan que en comparación con el fotocatalizador de ZnS prístino, los nanocompuestos de FG-ZnS exhiben una actividad mejorada de producción de hidrógeno fotocatalítico.
Del mismo modo, se ha implementado el uso de fotocatalizadores a escala nanométrica, con el fin de diversificar las rutas comúnmente empleadas en la generación de hidrógeno. Chang y Col. (89, investigaron el rendimiento de producción de hidrógeno fotocatalítico de nanopartículas de ZnO/ZnS dopadas con Ce a partir de polisulfuros de sacrificio. Los efectos del tratamiento de dopaje y calcinación en la química de la superficie, los niveles de energía de la banda de conducción absoluta y la banda de valencia, la morfología, las propiedades cristalinas y la actividad de producción de hidrógeno fotocatalítico de los fotocatalizadores, fueron investigados combinando el microscopio electrónico de barrido de emisión de campo (FESEM), espectroscopia fotoelectrónica de rayos X (XPS), espectroscopia de reflectancia difusa (TDRS), gráficos de Mott Schottky y pruebas de producción de hidrógeno. Por tanto, es precisamente a partir de los espectros de XPS, que se pudieron evidenciar un estado de valencia mixto Ce3+ y Ce4+ en los fotocatalizadores. Este hecho, dio como resultado una alta tasa de producción de hidrógeno fotocatalítico optimizada de los fotocatalizadores ZnO/ZnS dopados con Ce, a partir de una solución acuosa de NaCl con polisulfuros de sacrificio (Na2S y Na2SO3), alcanzando los 1200 μmol/g/h, resultado que es 5,2 veces mayor que la del fotocatalizador ZnO/ZnS no dopado.
Así mismo, dentro del estudio y diseño de materiales catalíticos, Tay y Col. 90, mencionaron una producción mejorada de hidrógeno por el acoplamiento del polímero g-C3N4 con nanopartículas de TiO2 anatasa/brookita de dos fases, para formar múltiples heterouniones, prometiendo ser un candidato para la producción de hidrógeno solar. Sin embargo, resaltaron el hecho de que, su tasa de producción de hidrógeno fue baja cuando se usa solo, debido a la rápida recombinación de pares electrón-hueco fotogenerados.
Recientemente, la nanoestructura híbrida compuesta por metales plasmónicos (característicos por tener propiedades ópticas de resonancia de plasmón superficial localizado (LSPR)) y diferentes dieléctricos (materiales de baja conductividad eléctrica), ha atraído mucha atención, dado a que se ha demostrado que al introducir metales plasmónicos, la eficiencia fotocatalítica puede mejorar mediante la absorción de luz. Wu y Col. 91, han demostrado excelentes propiedades fotocatalíticas para la generación de hidrógeno, utilizando matrices de nanocristales híbridos de Au/TiO2 de núcleo-capa hexagonal. Bajo luz ultravioleta y visible, consiguieron un aumento significativo en la producción de hidrógeno a partir de la división de una solución de metanol (20%), con las matrices híbridas de nanocristales de Au/TiO2, en comparación a una película delgada de TiO2, así como con los nanocristales de Au/TiO2 distribuidos aleatoriamente.
Así mismo, se han construido matrices de nanotubos de TiO2 modificadas con hetero-nanopartículas de SrTiO3-TiO2 (ST-TiO2 NTAs), de acuerdo con los pasos metodológicos propuestos por Wu y Col. 92, como resultado de la experimentación, evidenciaron que la tasa de producción de hidrógeno fotoelectrocatalítico de los NTAs de TiO2, se puede mejorar significativamente modificando las heteropartículas de SrTiO3-TiO2, dando lugar a un valor muy promovido de 314,9 µmol.cm-2.h-1, que fue 2,1 veces mayor que el de los NTA de TiO2 sin modificar. Además, hicieron notar que las matrices de nanotubos de TiO2 modificadas con hetero-nanopartículas de SrTiO3-TiO2, exhibieron una estabilidad excelente y fueron fáciles de reutilizar de manera segura. De esta forma, se pudo verificar la mejora de la eficiencia de producción de hidrógeno fotocatalítico, la cual fue atribuida a la diferencia del potencial de la banda de conducción entre TiO2 y SrTiO3 en hetero-nanopartículas de SrTiO3-TiO2, impulsando así la transferencia y separación de los pares de electrón-hueco fotogenerados.
De forma complementaria, en el desarrollo de nuevos materiales a implementar en los procesos de producción de hidrógeno, Sfaelou y Col. 93, investigaron los procesos de construcción de fotoánodos de WO3, mediante un sencillo procedimiento de química blanda, con los que produjeron películas nanocristalinas mesoporosas eficientes. En su estudio, mencionan que estos fotoánodos absorbieron luz visible, y por ello, podrían emplearse de manera eficiente para la producción de hidrógeno fotoelectroquímico bajo polarización eléctrica. Es entonces cuando se hace efectivo este hecho, al producirse un aumento de corriente y de la tasa de producción de hidrógeno, dado a que esta última se triplicó en presencia de una pequeña cantidad de etanol, lo que demuestra que esos fotoánodos pueden utilizarse con éxito en instalaciones fotoelectroquímicas alternativas, para la producción de combustible solar mediante el consumo de desechos orgánicos. Así mismo, posteriores investigaciones realizadas por Monfort y Col. 94, han demostrado la eficiencia del BiVO4 nanocristalino depositado sobre electrodos de FTO, para construir fotoánodos sensibles a la luz visible, y de esta manera, producir hidrógeno fotoelectroquímico por descomposición del agua.
Del mismo modo, la búsqueda de co-catalizadores libres de metales nobles, continúa siendo una parte difícil en la reacción de desprendimiento de hidrógeno fotocatalítico (HER), ya que la mayoría de estos catalizadores contienen metales nobles, que resultan bastante costosos económicamente. Por esta razón, Gulton y Col. 95, mostraron un método de síntesis viable de un nanocompuesto de Zn(O,S)/GO, con óxido de grafeno (GO), como un co-catalizador más económico. De esta manera, lograron una mayor tasa de producción de hidrógeno fotocatalítico (2480 µgh-1), con respecto al catalizador libre de GO, cuya tasa fue dos veces menor. Por otro lado, demostraron que el mecanismo cinético para mejorar la tasa de producción de hidrógeno se atribuyó a la menor resistencia a la transferencia de carga, y luego los pares de electrones y huecos fotogenerados migraron individualmente en la superficie del catalizador, así como a una recombinación de carga más lenta.
Recientemente, se han tratado de diseñar fotocatalizadores con altos rendimientos fotocatalíticos. El CdCO3, ha demostrado tener propiedades fisicoquímicas especiales, y dado a que, en su forma natural, presenta el defecto de la recombinación de huecos de electrones fotogenerados, se han estudiado diversos compuestos que permitan dar solución a dicha problemática, para incrementar la eficiencia catalítica. Los quatum dots (QDs) de CdS, han mostrado ser una alternativa prometedora y por eso, Li y Col. 96, prepararon el fotocatalizador CdCO3/CdS (QDs), e investigaron su rendimiento de producción de hidrógeno fotocatalítico, encontrando que bajo irradiación con luz visible, se alcanza una tasa de producción de 1,93 mmol.h-1.g-1. Con este estudio, pudieron demostrar que el método de deposición in situ de CdS QDs, da una perspectiva mejorada para la síntesis de fotocatalizadores.
La producción de hidrógeno fotocatalítico eficiente, estable y de bajo costo a partir del ácido fórmico, también ha sido un desafío abrumador y ha atraído el intenso interés de muchos investigadores 97. Duan y Col. 98, diseñaron y sintetizaron fotocatalizadores compuestos de Ni2P/Zn3In2S6 (ZIS6) y MoP/ZIS6. Además, informaron su desempeño catalítico para la producción de hidrógeno a partir de ácido fórmico, bajo irradiación de luz visible. Al sintetizar los fotocatalizadores en diferentes proporciones de peso, mediante los métodos hidrotermal y solvotermal, y evaluar sus rendimientos catalíticos, encontraron que las muestras al 1,5% de Ni2P/ZIS6 y al 0,25% de MoP/ZIS6, mostraban la mayor actividad de producción de hidrógeno en sus respectivas series de catalizadores.
En estudios más recientes, se han evaluado los calcogenuros metálicos como candidatos potenciales en la obtención de hidrógeno fotoquímico. Con el fin de incrementar la producción de hidrógeno, Akyüz y Col. 99, sintetizaron nanofotocatalizadores basados en CdZnS, que incluyeron óxido de grafeno reducido dopado con heteroátomos (N, B y P), (RGO-Cd0.60Zn0.40S), por el método solvotermal. De este modo, notaron que el dopaje con heteroátomos de los nanofotocatalizadores, permitía obtener mayor fotoactividad de luz visible en contraste con los no modificados. Consecuentemente, determinaron que el fotocatalizador N- RGO-Cd0.60Zn0.40S, mostraba la tasa de producción de hidrógeno fotocatalítico más alta de 78 µmolh-1 (1114 µmol-1g-1) con 17,8% de eficiencia cuántica (QE), y que los métodos de obtención de los nanofotocatalizadores, variaban los rendimientos de hidrógeno.
Por otro lado, la deposición de nanopartículas (NP) de Pt con dispersión y morfologías preferidas en TiO2, ha sido el foco de estudios en la producción de hidrógeno fotocatalítico y fotoelectroquímico. La síntesis verde de nanocompuestos de TiO2/Pt, con una distribución de tamaño estrecha de NP de Pt, sigue siendo un desafío. Es desde esta perspectiva que, Lin y Wang 100, desarrollan su investigación, empleando sacarosa como fuente de biomasa, para dar lugar a los co-catalizadores esféricos de TiO2/Pt. Al realizar su estudio comparativo con un fotocatalizador similar preparado mediante fotodeposición, observaron que la eficiencia fotocatalítica aumentaba en un 15,5% al emplear la sacarosa como precursor del fotocatalizador de TiO2/Pt. De esta forma, demostraron un enfoque fácil y de bajo costo para fabricar un sistema de generación de hidrógeno fotocatalítico, basado en biomasa soluble.
Así mismo, en el esfuerzo de diseñar nuevos fotocatalizadores, selectivos a la producción de hidrógeno fotocatalítico, Iervolino y Col. 101, evaluaron por primera vez la producción de hidrógeno renovable por la degradación fotocatalítica de glucosa, sobre el fotocatalizador tipo perovskita LaFeO3 dopado con Ru bajo radiación UV o visible. Para tal fin, la perovskita se sintetizó por el método de combustión en solución, y posteriormente fue caracterizado y evaluado, variando distintos parámetros de reacción, como la cantidad de rutenio, la concentración inicial de glucosa, la configuración del reactor y la fuente de luz. Finalmente, encontraron que la producción de hidrógeno se puede mejorar (2179 μmol/gcat después de 4 horas de irradiación UV) usando una cantidad específica de rutenio (0,47% en moles de Ru) en LaFeO3, y que el resultado en la producción de hidrógeno, se encuentra estrechamente relacionado con la configuración del reactor, dando como recomendación el uso de reactores cilíndricos con diámetros pequeños, puesto a que proporcionan un flujo mejorado de fotones que interceptan las partículas de fotocatalizadores, dispersas en la solución de glucosa.
De igual forma, Carrasco-Jaim y Col. 102, han sintetizado por reacción en estado sólido, los materiales de perovskita AgMO3 (M = Ta, Nb, V) modificados mediante la deposición de partículas de CdS y NiO como co-catalizador, para la producción de hidrógeno fotocatalítico. Estos materiales fueron caracterizados por: DRX, SEM, espectroscopia UV-vis (UV-vis) y análisis de adsorción física por el método BET; y evaluados bajo luz UV en una solución acuosa de Na2SO3. De esta forma, determinaron las eficiencias de conversión de energía solar a hidrógeno (STH), y el orden de las actividades fotocatalíticas para la producción de hidrógeno (AgTaO3> AgNbO3> AgVO3) de acuerdo con sus energías de banda de conducción adecuadas, para la reducción de H+ en H2. Además, determinaron que la actividad fotocatalítica más alta, se obtuvo con perovskita AgTaO3 cargada con 5% en peso de co- catalizador de CdS (4645 µmolg-1 y una STH de 4,76%), 2,5 veces mayor que el 2% en peso de co- catalizador de NiO (1847 µmolg-1 y una STH de 1,89%). Este estudio demostró, que una selección adecuada del fotocatalizador y el co-catalizador basada en las posiciones de sus bandas, y en un método de deposición homogéneo, conduce a mejorar la actividad fotocatalítica.
Igualmente, Han y Col. 103, fabricaron un nuevo tipo de nanocompuestos de CdSe/CaTiO3 con actividades fotocatalíticas mejoradas, mediante síntesis acuosa y el método hidrotermal. Dentro de sus resultados más relevantes, destacan que la modificación de los puntos cuánticos semiconductores coloidales (QDs) de CdSe en la superficie de CaTiO3, aumentan eficazmente la absorción de luz visible, mejoran la separación y transferencia de electrones fotoinducidos y previene la recombinación de pares de electrones y huecos, mejorando así significativamente el rendimiento de producción de hidrógeno fotocatalítico (48 veces mayor), en contraste al rendimiento obtenido por QDs de CdSe y CaTiO3 por separado. Además, los nanocompuestos CdSe/CaTiO3 mostraron una alta estabilidad y reciclabilidad, lo cual, es beneficioso para la aplicación de producción de hidrógeno fotocatalítico.
Markovskaya y Col. 104, por su parte, prepararon y caracterizaron los fotocatalizadores Cd0.3Zn0.7S modificados con Ni(OH)2. Los fotocatalizadores obtenidos se ensayaron, en el desprendimiento de hidrógeno fotocatalítico a partir de soluciones acuosas de etanol, bajo irradiación de luz visible (λ = 450 nm), encontrando que los fotocatalizadores modificados con níquel eran más activos que los modificados con zinc. Además, obtuvieron las dependencias de la tasa de producción de hidrógeno de las concentraciones de etanol y NaOH por encima de Pt 1%/Ni(OH)2 10%/ Cd0.3Zn0.7S, determinando que el valor más alto de la actividad fotocatalítica fue 27 mmol.h-1.g-1 (con etanol 50% v/v, NaOH 1 M). De esta forma, demostraron que este tipo de fotocatalizadores, poseen actividades más altas que los del tipo Cd1-xZnxS.
Tabla 2 Estudios e investigaciones sobre la producción de hidrógeno.
| Rutas | Año | Método | Catalizadores | Fuente |
|---|---|---|---|---|
| Bioquímicas | 2015 | Fermentación oscura | Carbón activado con Fe (0) (ZVI-AC) | 35 |
| 2015 | Fotofermentación | Rhodopseudomonas sp. nov. cepa A7 | 36 | |
| 2017 | Fermentación microaeróbica oscura | Rhodopseudomonas palustris GCA009 | 42 | |
| 2017 | Fermentación oscura | Clostridium pasteurianum y Nanocompuestos (NCs) de Fe3O4/Alginato | 43 | |
| 2018 | Fotofermentación | Rhodovulum sulfidophilum TH-102 | 44 | |
| 2018 | Fermentación oscura | Clostridium thermocellum | 45 | |
| 2018 | Fotofermentación | Rhodobacter capsulatus YO3 | 46 | |
| 2019 | Fotofermentación | Rhodopseudomonas palustris GCA009 | 39 | |
| 2019 | Fotofermentación | Rhodopseudomonas sp. (Cepa WR-17) | 40 | |
| 2019 | Fermentación oscura | NaNO3 | 41 | |
| 2020 | Fermentación | Acinetobacter, Comamonas, Intestinimona, Macellibacteroides | 37 | |
| 2020 | Fermentación oscura | Thermoanaerobacterium | 47 | |
| 2020 | Fermentación oscura | Clostridium pasteurianum CH5 y nanopartículas de Fe y Ni | 48 | |
| 2020 | Electrólisis microbiana | Ethanoligenens harbinense y Geobacter Sulfurreducens | 49 | |
| 2020 | Fermentación | Bacillus coagulans MO11 y Clostridium beijerinckii CN | 50 | |
| Termoquímicas | 2015 | Combustión química en bucle | OMCs de Fe2O3/Perovskita La0.7Sr0.3Fe3-δ (LSF731) | 58 |
| 2015 | Oxidación parcial de metano | Co, Co-Ni, Co-Ru, Co-Ni-Ru, y Ni/ Cordierita | 63 | |
| 2016 | Reformado catalítico | Ni-Co/CeO2, ZrO2, La2O3, γ-Al2O3 y α- Al2O3 | 67 | |
| 2016 | Descomposición de agua | Perovskitas tipo La1-xSrxMeO3 (Me = Mn, Co y Fe) | 59 | |
| 2016 | Descomposición de metano | Carbono poroso con un sistema de poros trimodal interconectado | 60 | |
| 2017 | Oxidación parcial de metanol | Catalizador de Fe-Cr (TZC-3/1) | 64 | |
| 2017 | Descomposición de metano | Óxidos mixtos de Co-Al derivados de Hidrotalcitas | 65 | |
| 2018 | Bucle químico directo de carbón (CDCL) | Fe2O3/Al2O3 modificado con K2CO3 | 68 | |
| 2018 | Reformado catalítico | Espumas cerámicas de NiO-Co3O4 | 66 | |
| 2018 | Bucle químico directo de carbón (CDCL) | OMCs de K-Fe-Al | 69 | |
| 2019 | Reformado por pirolisis | Ni/NiO | 62 | |
| Fotoquímicas | 2015 | Fotodescomposición de agua | Cu/TiO2 | 87 |
| 2015 | Fotodescomposición de agua | Nanopartículas de ZnO/ZnS dopadas con Ce | 89 | |
| 2015 | Fotoelectrólisis de agua | matrices de nanotubos de TiO2 modificadas con hetero-nanopartículas de SrTiO3-TiO2 (ST-TiO2 NTAs) | 92 | |
| 2016 | Fotodescomposición de metanol | Nanocristales de Au/TiO2 | 91 | |
| 2016 | Descomposición de agua | Polímero g-C3N4 con nanopartículas de TiO2 anatasa/brookita | 90 | |
| 2016 | Descomposición de etanol | WO3 | 93 | |
| 2016 | Descomposición de agua | BiVO4 | 94 | |
| 2017 | Fotodescomposición de agua | Grafeno FG-ZnS | 88 | |
| 2017 | Degradación fotocatalítica de glucosa | Perovskita LaFeO3 dopada con Ru | 101 | |
| 2018 | Fotodescomposición de agua | Perovskitas de AgMO3 (M = Ta, Nb, V) modificadas mediante la deposición de partículas de CdS y NiO | 102 | |
| 2018 | Fotodescomposición y Fotoelectrólisis de agua | Nanocompuestos de CdSe/CaTiO3 | 103 | |
| 2018 | Fotodescomposición de etanol | Cd0.3Zn0.7S modificado con Ni(OH)2 | 104 | |
| 2019 | Fotodescomposición de agua | Nanocompuesto de Zn(O,S)/óxido de grafeno (GO) | 95 | |
| 2019 | Irradiación con luz visible | CdCO3/Quantum dots (QDs) de CdS | 96 | |
| 2019 | Fotodescomposición de ácido fórmico | Ni2P/Zn3In2S6 (ZIS6) y MoP/ZIS6 | 98 | |
| 2019 | Fotodescomposición y Fotoelectrólisis de agua | (X-Óxidos de Grafeno (RGO)- Cd0.60Zn0.40S), (X = N, B y P) | 99 | |
| 2019 | Fotodescomposición de sacarosa | Nanopartículas de TiO2/Pt | 100 |
2.7. Otros métodos de obtención
Al igual que los métodos comúnmente empleados en la producción de hidrógeno, también se han estudiado métodos no convencionales, que también han permitido robustecer las vías posibles en la obtención de hidrógeno, partiendo de biomasa y combustibles fósiles. La mayor parte de estos procesos, se basan en la combinación de dos o más rutas tradicionales, dando como resultado un proceso híbrido, o también, se llevan a cabo sin la presencia de un catalizador. Independientemente, de cuál sea el caso, las condiciones de operación, estarán determinadas por la naturaleza de los sustratos de partida 18,105. Actualmente, se sabe que la diversidad en la composición química de las materias primas lignocelulósicas puede afectar las tecnologías de conversión empleadas para la generación de hidrógeno. Es por esta razón, que se han evaluado las actividades de gasificación y cogasificación de biomasa lignocelulósica, hidrolizado de biomasa y carbón para la producción de gas rico en hidrógeno. De acuerdo con Seçer y Col. 105, son los hidrolizados de materiales de biomasa, los que muestran el mejor comportamiento para la gasificación. Los resultados de sus investigaciones indicaron que los hidrolizados de biomasa de origen lignocelulósico, eran más sensibles a la degradación y, por lo tanto, producían más hidrógeno y productos gaseosos que los de la biomasa lignocelulósica.
Por otro lado, Czylkowski y Col. 106, investigaron experimentalmente la eficiencia de la generación de hidrógeno a partir de etanol, en plasma a presión atmosférica, generado en una fuente de plasma por microondas basada en cilindros metálicos (MPS), suministrada por guía de ondas. De esta forma, mostraron que el rendimiento energético de la producción de hidrógeno fue bastante alto, logrando una conversión de etanol de hasta el 99%. Por otro lado, mencionan que el método de plasma de microondas presentado puede ser utilizado con éxito para la generación de hidrógeno no solo a partir de etanol, sino también a partir de diferentes compuestos líquidos como gasolina, aceites pesados y biocombustibles, además de que este método, no requiere el uso de algún catalizador.
En lo relacionado con el estudio de nuevos materiales como potenciales en la producción de hidrógeno, Zhang y Col. 107,108, sintetizaron sulfuros de MoS2 estructurados de manera diferente, incluidos los de tipo flor, esférico y poroso, como electrocatalizadores para la producción de hidrógeno. Posteriormente presentaron una celda electrolítica de amoniaco con Ni50Cu50/C, como catalizador de ánodo para la producción de hidrógeno, demostrando que el electrocatalizador, puede funcionar con un voltaje de celda bajo con el fin de ahorrar energía en el proceso de producción
Por otro lado, Tsoncheva y Col. 109, desarrollaron un enfoque inteligente para la producción de energía limpia, mediante la valorización de subproductos de residuos industriales. El esquema propuesto, se basó en la preparación de catalizadores soportados en carbón activado obtenido de biomasa, para la descomposición de metanol como fuente de hidrógeno. El efecto específico del soporte de carbono sobre la formación de la fase de ferrita activa cargada NixZn1-xFe2O4 (x = 0; 0.2; 0.8; 1), se estudia por la caracterización del material, con la cual encontraron que, los carbones activados modificados con NixZn1-xFe2O4 obtenidos de subproductos del tratamiento del carbón, poseen un potencial significativo para la protección ambiental sostenible, como catalizadores económicos y eficaces para la generación de hidrógeno.
Recientemente, la gasificación de agua supercrítica (SWG), ha atraído una gran atención por la conversión eficiente y limpia del carbón. Es por eso que Ge, Guo y Jin 110, presentan un nuevo modelo cinético de oxidación parcial no catalítica de carbón en agua supercrítica (SCW), que describe la formación y el consumo de productos gaseosos (H2, CO, CH4 y CO2). Dentro de las etapas metodológicas de la investigación, se da a conocer que el modelo comprende 7 reacciones, y las constantes de velocidad de reacción se obtienen ajustando los datos experimentales. El análisis de la energía de activación indicó que el reformado con vapor de carbono fijo (FC), es el paso que determina la velocidad para la gasificación completa del carbón. Es así, como una vez que el CH4 se produce por pirólisis del carbón, el reformado con vapor de CH4, se convierte en el paso determinante de la velocidad para la producción direccional de hidrógeno. De ahí, la importancia que ha producido estas investigaciones dada la selectividad que puede producirse, hacia la obtención de hidrógeno dentro de los procesos multietápicos, que se desarrollan a partir de fuentes fósiles.
Es así como el hidrógeno molecular, liberado por la combustión del carbón, está estrechamente relacionado con la seguridad de las minas. De esta forma, Wang y Col. 111, introdujeron por primera vez una evaluación de las características de emisión de hidrógeno en el proceso de oxidación del carbón a baja temperatura (T≤200°C), en el uso de reactores discontinuos. Para tal fin, se investigaron sistemáticamente los efectos del rango del carbón, la temperatura del carbón y el tamaño de las partículas sobre la liberación de hidrógeno. Los resultados mostraron que, la liberación de hidrógeno a baja temperatura estaba linealmente relacionada con el consumo de oxígeno, y no dependía realmente de la masa de carbón. Por otro lado, se menciona el hecho de que las muestras de carbón con un rango más alto, y bajo la condición de temperatura más alta, produjeron más cantidad de hidrógeno. Así mismo, mencionaron que cuando el tamaño de partícula era grande, la tasa de liberación de hidrógeno dependía del tamaño de partícula, mientras que para las muestras de carbón con partículas muy finas (menos de 0,12 mm de diámetro), era mucho más difícil liberar hidrógeno e incrementar la tasa de hidrógeno.
De forma complementaria, también se han realizado otros estudios en cuanto al uso del carbón mineral como precursor del hidrógeno. Tal es el caso de las investigaciones realizadas por Seyitliyev y Col. 112, quienes presentaron una forma sencilla de obtener hidrógeno gaseoso de varios rangos de carbón, coque y grafito, utilizando pulsos de láser de nanosegundos en diferentes condiciones, como agua, aire y atmósfera de argón. De forma directa, observaron que los pulsos de láser de 532 nm eran más efectivos que los pulsos de 1064 nm en la generación de gas, y ambos estaban correlacionados de manera no lineal con respecto a la densidad de energía del láser. Por otro lado, pudieron notar que se generaron principalmente hidrógeno y monóxido de carbono. Es así, como la proporción de hidrógeno a monóxido de carbono, muestra que el rango de eficiencia más alto fue el carbón de antracita, con una proporción promedio de 1.4 debido a su alto contenido de carbono fijo, y cantidad relativamente alta de hidrocarburos.
Así mismo, Siriwardane y Col. 113, demostraron la producción de H2 por oxidación con vapor con ferrita de calcio (CaFe2O4), después de la gasificación del carbón para producir CO con varios tipos de carbones. Todos los tipos de carbón reaccionaron con CaFe2O4 para producir CO, y notaron que el carbón subbituminoso y el carbón de lignito, tuvieron mejor reactividad con CaFe2O4 que el carbón bituminoso. Luego de una prueba de diez ciclos realizada con carbón Wyodak/ CaFe2O4 a 800°C, mostró una producción estable de H2 durante la oxidación con vapor. Además, una prueba de oxidación con vapor de 25 ciclos, realizada después de la reducción de CaFe2O4 con carbón de lignito, también mostró un rendimiento muy estable.
Çokay 114, por su parte, investigó la producción de hidrógeno mediante electrohidrólisis de residuos de alimentos, debido a su alto contenido orgánico. Para tal fin, empleó un enfoque estadístico de Box- Behnken, para investigar la producción de gas H2 y para determinar el tiempo de reacción, el voltaje y el contenido de sólidos más adecuados, para maximizar el contenido de gas hidrógeno, el volumen acumulativo de gas hidrógeno y la eliminación de carbono orgánico total (TOC). De acuerdo con los resultados experimentales, se pudo determinar que el tiempo de reacción y el voltaje aplicado, tienen efectos significativos en la producción de gas H2 y la eliminación de TOC. El voltaje/ tiempo de reacción/ contenido de sólidos óptimos, que dieron el mayor contenido de hidrógeno gaseoso (99%), el mayor volumen acumulativo de hidrógeno gaseoso (7000 mL) y la eliminación de TOC (33%) fueron 5 V/ 75 h/ 20%. En estas condiciones experimentales, se logró una tasa de producción de gas hidrógeno de 2240 mL.d-1, y un rendimiento de hidrógeno de 493 mL H2.g-1 TOC. De este modo, se pudo verificar el método de electrohidrólisis, como una alternativa eficaz para producir gas hidrógeno casi puro (99%) a partir de desechos alimentarios.
2.8. Perspectivas y futuras investigaciones
El uso del hidrógeno se encuentra dentro de los proyectos ambientales sostenibles para el asunto de la movilidad, y se ha construido en una apuesta mundial; la implementación del hidrógeno contribuirá a la disminución en las emisiones de gases de efecto invernadero, así como, en la generación de calor en los procesos de creación de energía, ya que, en términos de eficiencia, el hidrógeno tiene el más alto contenido de energía por unidad de peso que cualquier otro combustible 115. Desde esta perspectiva, se han realizado bastantes esfuerzos por implementar día a día nuevas tecnologías, que permitan dar abasto con la demanda energética, que se encuentra representada por la producción de hidrógeno. Estos esfuerzos, han involucrado el uso de fuentes renovables preferentemente de biomasa, y así mismo, el uso de fuentes minerales que abundan en distintas zonas del mundo, procurando mantener siempre procesos limpios y ecoeficientes 116,117.
La compatibilidad de los modos actuales con la necesidad de preservar el medio ambiente implicará sin duda el uso generalizado de hidrógeno, y los avances tecnológicos en este sentido han sido significativos durante los últimos 20 años. La disociación de desechos es la principal tecnología comercial para la generación de hidrógeno en la actualidad. Los principales avances en el campo se han dirigido hacia nuevos materiales resistentes y menos costosos para electrodos (electrólisis), y la búsqueda de nuevos catalizadores para operar a condiciones de temperatura y presión más suaves (fotólisis y termólisis) 118.
A corto plazo, los combustibles fósiles dominan debido a las infraestructuras existentes y al bajo costo. La descomposición termoquímica del agua es el proceso de producción de hidrógeno más sostenible, pero también se ha encontrado que la descomposición autocatalítica del metano, es eficiente en términos de tasas de H2 más altas que la descomposición de H2O y un desempeño ambientalmente benigno 119. Una vez que se logran mayores eficiencias en el uso de energía solar en los procesos de producción de H2, esta alternativa puede ser prometedora para la implementación comercial. Además, encontrar los materiales de almacenamiento más adecuados para el almacenamiento de H2, que sean baratos, más abundantes y posean una mayor densidad volumétrica, sería un gran avance 120. Así mismo, las investigaciones de procesos termoquímicos se han orientado principalmente en el uso eficiente de la energía gastada, mediante la combinación de tecnologías de producción de energía, especialmente la pirólisis (121.
Por su parte, la producción bioquímica, y el desarrollo de procesos biológicos, han llamado bastante la atención, debido a que tienen menos afecciones sobre el medio ambiente. Específicamente, la producción fotobiológica de H2, utilizando microorganismos fotosintéticos como bacterias, algas y cianobacterias, es un tema interesante para la investigación, y promete ser uno de los métodos más empleados para generar H2 libre de carbono, limpio y puro, a partir de abundantes recursos naturales como el agua y la luz solar 122. Sin embargo, se ha requerido una exploración comercial y factible, para obtener un mejor rendimiento de H2. Además, se siguen haciendo esfuerzos para mejorar los microorganismos fotosintéticos, mediante ingeniería metabólica o genética. Se han propuesto algunas ideas para mejorar la producción fotobiológica de H2. Algunas de las que se han propuesto, y que se han estudiado, involucran la identificación de los microorganismos más adecuados, y la incorporación de hidrogenasas y nitrogenasas en microorganismos seleccionados; la optimización de las condiciones de cultivo; la estabilización de los fotobiorreactores y la mejora de las materias primas, al igual que el desarrollo de análisis comparativos de la producción fotobiológica de H2; la optimización del rendimiento de H2, utilizando materias primas baratas o rentables; el estudio de nuevas especies de microorganismos fotosintéticos, que utilizan mejor energía solar para mejorar la producción de H2; y la adecuación de los fotobiorreactores, para una mejor propagación de microalgas para una producción eficaz de H2123.
Finalmente, se espera que, en un futuro, también se tengan mayores investigaciones en los métodos de producción de hidrógeno no tan comunes, puesto a que pueden ser una alternativa en términos de economía y ecoeficiencia, para el desarrollo de los métodos tradicionales 124. Se tiene de ellos cierta perspectiva, en el uso de algunos ciclos híbridos de separación de agua, como los métodos fototermoquímico, fotoelectroquímico y radiotermoquímico, además de los procesos de hidrogasificación del carbón con base nuclear, y reformado de gas natural con base nuclear, como dos métodos potenciales para la generación de hidrógeno a gran escala 125. También se han mencionado procesos de reformado de combustible solar, para la generación de hidrógeno con una aplicación potencial a escalas de producción pequeñas e intermedias. Algunos combustibles previstos para este proceso son: el gas natural o el gas natural sintético, el metanol y la urea 126.
En la actualidad, la producción de H2 en combinación con captura y almacenamiento de carbono (CCS), ha llamado la atención por ser una solución prometedora, para reducir las emisiones de carbono 127. A largo plazo, las energías renovables se ven como posibles candidatos fuertes y competitivas, para reemplazar las fuentes de combustible convencionales. Ya se ha logrado un progreso significativo en la producción de H2 de base biológica, a partir de diferentes fuentes renovables. El almacenamiento de energía H2 de manera eficiente y económica, proporciona una solución sostenible en la economía del hidrógeno. Múltiples sistemas de energía distribuida a pequeña escala pueden alimentar celdas de combustible y otros dispositivos de conversión de energía de manera eficiente. Sin embargo, en el escenario actual, la infraestructura H2, se enfrenta a serios desafíos en la producción y distribución en unidades descentralizadas 128.
Se ha informado de amplios estudios sobre la producción de hidrógeno, utilizando diferentes materias primas. El H2 se puede producir catalíticamente a partir de muchas fuentes de desechos y subproductos de diversas industrias y, finalmente, alimentar a los dispositivos de pila de combustible. Aun así, la catálisis química, es la clave en la producción de H2 hasta un gran avance en la fotocatálisis. La intensificación de procesos y rectores en la producción de H2 se ha estudiado activamente, y los reactores de membrana han logrado resultados prometedores en la integración de la reacción, separación y purificación de H2. La utilización de CO2 en la producción de H2 mediante reformado en seco, ofrece una vía para mitigar las emisiones de CO2129.
La catálisis, es decir, la catálisis heterogénea, bioquímica, electroquímica y fotoquímica, allana el camino para el cumplimiento de los enfoques de bio-economía y economía circular, y forma una base sólida para la producción de combustible limpia, innovadora y sostenible, es decir, H2. La catálisis, también juega un papel importante en la utilización de las emisiones, al brindar posibilidades de emplear compuestos existentes en corrientes gaseosas (Gases de combustión, de proceso y de escape) y líquidas (de proceso y aguas residuales) en la producción de, H2. Materiales y estructuras catalíticas novedosas, materiales y métodos híbridos, así como el uso innovador de tecnologías antiguas, allanan el camino hacia procesos catalíticos industriales, que producen H2 como su producto principal. Estos enfoques, están beneficiando el desarrollo sostenible a través de materiales y eficiencia energética en la industria y las sociedades, y se espera que, en un futuro, puedan ser promotores en la sostenibilidad energética mundial.
Por último, se espera que, por medio de los diferentes métodos de producción de hidrógeno, se implementen nuevos procesos en los sectores industriales, agrícolas, energéticos y ambientales. Desde las rutas termoquímicas, se espera integrar reactores nucleares, considerando los ciclos termoquímicos de cloro y azufre, para la producción en masa de hidrógeno, por la descomposición del agua y diferentes fuentes de biomasa 130. Por otro lado, se espera que, dentro de las rutas bioquímicas, se sigan estudiando especies y técnicas que brinden mejores rendimientos de hidrógeno, como la técnica de inmovilización y la generación de biogránulos 131. Por su parte, en las rutas fotoquímicas, se espera que se puedan implementar nuevos fotocatalizadores que permitan optimizar la separación, la movilidad y el tiempo de vida, de las cargas fotogeneradas bajo irradiación de luz visible, para aumentar la eficiencia fotocatalítica de hidrógeno 132. Así mismo, se espera que, dentro de los métodos electroquímicos y métodos no convencionales, se puedan establecer nuevos procesos híbridos y procesos no catalíticos, que favorezcan la producción de hidrógeno, ya sea por la combinación de varias rutas tradicionales, o por la búsqueda de procesos que no requieran el uso de catalizadores, y que, por el contrario, puedan ofrecer alternativas más económicas y ambientalmente sostenibles (133.
3. Conclusiones
Dentro de las estrategias que actualmente se están tomando con el fin de reducir el impacto ambiental, producido por el calentamiento global como resultado del incremento anual en la concentración de gases de efecto invernadero, se ha realizado gran cantidad de investigaciones para la generación de hidrógeno como vector energético. De igual forma se han estudiado varias rutas de producción de hidrógeno, empleando fuentes renovables como la biomasa.
Dentro de los estudios abordados, las rutas bioquímicas, se han caracterizado por el uso de microorganismos para la conversión biológica de biomasa, principalmente mediante procesos de fermentación oscura, dado a las ventajas que proporciona (condiciones suaves de reacción). De igual manera, también se han evidenciado desventajas, las cuales se relacionan directamente con la tasa lenta de conversión para la producción de hidrógeno y con el costo de los reactores y cepas, que son requeridos para desarrollar dichos procesos. Por tanto, en las mejoras futuras, se deberían desarrollar sistemas de producción mayor eficiencia, que involucren nuevas cepas bacterianas más económicas.
Así mismo, las rutas termoquímicas se han caracterizado por emplear procesos catalíticos heterogéneos, principalmente enfocados al uso de fuentes fósiles. Estos procesos tienen la ventaja de fácil adaptación a escala industrial, aunque se requiere de materiales catalíticos de alto costo. Por lo tanto, dentro del contexto de aquellos procesos catalíticos como no catalíticos, en un futuro se debería establecer métodos que impulsen el uso de fuentes renovables y desarrollar nuevos materiales catalíticos que resulten beneficiosos en aspectos operativos, económicos y ambientales. Por otro lado, las rutas fotoquímicas también han resultado como métodos alternativos para la obtención de hidrógeno. Dentro de las últimas investigaciones, se han involucrado procesos que se llevan a cabo en su mayoría por fotodescomposición de agua, por lo tanto, sería adecuado que en un futuro se potenciara el uso de la biomasa dentro de estos procesos, con el fin de establecer métodos más eficientes y económicos.
Recientemente, se han incrementado las investigaciones que se relacionan con el estudio de otros métodos de obtención de hidrógeno, específicamente, los procesos electroquímicos, han ganado bastante atención, dado que ofrecen resultados prometedores en términos de rendimiento a escala de laboratorio e implican un gasto energético mínimo, comparado con los procesos híbridos (no tradicionales) que resultan muy eficientes en términos de conversión y rendimiento de hidrógeno, pero que implican un gasto energético mayor.
Al describir de forma generalizada las investigaciones relacionadas con cada una de las principales rutas en la producción de hidrógeno, se puede tener una perspectiva a futuro, y por lo tanto, se espera que a mediano plazo, puedan contribuir al desarrollo de métodos más eficientes, que involucren el uso de fuentes renovables y que se encuentren basados en los principios de la química verde, con el fin de establecer procesos de menor impacto ambiental que favorezcan la producción de hidrógeno a nivel local, nacional e internacional.