1. Introducción
El crecimiento industrial produce una gran cantidad de residuos, lo que se ha convertido en una problemática ambiental a nivel mundial, debido a que su generación está creciendo de forma exponencial 1. El plomo es un metal de gran demanda en diversas industrias, principalmente para la elaboración de baterías plomo-ácido (BPA) para automóviles. La producción de plomo proviene de dos sistemas, primario y secundario; el sistema primario consiste en el proceso de recuperación del metal a partir de un concentrado extraído de una mina natural, mientras que el sistema secundario utiliza el plomo contenido en equipos al final de su vida útil, principalmente del reciclaje de BPA 2.
La fundición de plomo secundario se considera como una alternativa, ya que se disminuye la extracción de recursos naturales, requiere menos procesos y por ende menos energía, además genera menor cantidad de residuos; por lo tanto, se considera sostenible en términos económicos como ambientales, y por ello predomina frente a la producción primaria desde el año 2012 hasta la actualidad 3,4.
Las BPA al final de su vida útil se consideran residuos peligrosos, además son residuos generados en gran cantidad, por lo que ha surgido la necesidad de reciclarlas. El reciclaje de BPA consiste en un proceso de recuperación de sus componentes, siendo el plomo el de mayor interés comercial; su recuperación consiste en un proceso de fundición secundaria. En este proceso de fundición, se genera escoria de plomo secundario, la cual es clasificada como residuo peligroso debido a su contenido de componentes metálicos tóxicos 5. Por lo tanto, este residuo debe tener una disposición especial en celdas de seguridad, donde estas estructuras, además de representar un gasto adicional para las empresas, demandan grandes extensiones de terreno. Sin embargo, la mayor preocupación radica en que estas celdas se pueden degradar con el paso del tiempo y liberar los contaminantes confinados; lo que representa un potencial peligro de contaminación de los suelos, las aguas superficiales y subterráneas a sus alrededores 6.
La escoria de plomo secundario ha sido objeto de varias investigaciones para su estabilización y/o aprovechamiento, entre estas se encuentran, la recuperación de metales valiosos mediante procesos de extracción ácida y alcalina, y extracción por medios magnéticos. Sin embargo, dichos métodos presentan limitaciones debido a la contaminación secundaria y costos elevados 7. Otra forma de aprovechamiento de estas escorias es emplearla como agregado a materiales de construcción, siendo una forma de estabilizar la escoria en matrices de cemento Portland, así como la elaboración de ladrillos; sin embargo, estas matrices pueden generar lixiviados porque no constituyen una estabilización totalmente segura 8,9.
Por otro lado, existen diferentes técnicas para estabilizar residuos peligrosos, facilitando el aprovechamiento o disposición final de los mismos. Entre estas técnicas se encuentra la vitrificación, la cual consiste en un proceso térmico a altas temperaturas que permite la destrucción de componentes orgánicos y, la inmovilización de componentes minerales tóxicos en un material vítreo químicamente estable, dificultando la liberación o lixiviación de elementos peligrosos 10,11. Esta técnica cuenta con varias ventajas, además de la inmovilización o inertización de componentes tóxicos, entre ellas se encuentran una reducción del volumen y cantidad de los residuos; lo que es favorable en términos económicos como ambientales.
La producción de vidrios o vitrificación ha sido ampliamente evaluada como técnica de inertización de componentes peligrosos, tales como escorias de fundición de la industria de acero, cenizas de incineración de residuos municipales peligrosos, lodos de minería de cobre, incluso residuos radioactivos 12-14. Los productos resultantes (vitrificados o vidrio), pueden ser aprovechados como materias primas de materiales de construcción o de vidrios cerámicos 15-17. Adicionalmente, se presenta una reducción del volumen de los residuos al finalizar la vitrificación; lo que es favorable en términos tanto económicos como ambientales.
El objetivo de este estudio es realizar una evaluación preliminar de un proceso de vitrificación de una escoria de fundición de plomo secundario, con el fin de estabilizarla y de esta manera facilitar su manejo y disposición final. Para ello inicialmente se realizó la caracterización del residuo de escoria, que comprendió el análisis de las características físicas, químicas y mineralógicas, así como el análisis de toxicidad. Seguidamente, se plantearon los parámetros del proceso de vitrificación para aplicarlo a nivel laboratorio y, finalmente la escoria después del proceso de vitrificación fue analizada con el fin de evaluar la efectividad de este proceso.
2. Metodología
2.1 Caracterización de los residuos
Los residuos del presente estudio comprenden una escoria de fundición de plomo secundario y un residuo de arena. La escoria de fundición de plomo secundario proviene de la recuperación de plomo a partir de fuentes secundarias como las BPA; la muestra para el estudio se tomó directamente en la planta de fundición sin aplicarle ningún proceso adicional de oxidación, siendo éste el que usualmente se aplica antes de enviarlo a disposición. Por otra parte, el residuo de arena se genera en un proceso de refinación o purificación de arena utilizada en una industria de productos de vidrio. Este residuo se utilizó como fuente de sílice para el proceso de vitrificación.
La caracterización de los residuos se realizó a través de los siguientes ensayos: análisis de tamaño de partícula mediante Granulometría Láser, con el analizador de partículas Mastersizer 2000 Malvern Instruments, utilizando agua como dispersante. La composición química, se obtuvo por Fluorescencia de rayos X de dispersión por longitud de onda (WDXRF), con un espectrómetro MagixPro PW-2440 Philips equipado con un tubo de rodio, con una potencia máxima de 4 W. El análisis cuantitativo excluyó H, C, Li, Be, B, N, O y los elementos transuránicos. La composición mineralógica se realizó mediante Difracción de Rayos X (DRX), con un Difractómetro de rayos X marca PANalytical modelo X´PERT PRO MPD, equipado con un tubo generador de rayos X con ánodo de cobre de longitud de onda de 1.54 Å, en un ángulo 2Ɵ de 10º- 80º. Adicionalmente, se realizó un análisis ambiental de la escoria mediante el procedimiento de lixiviación característica de toxicidad (TCLP por sus siglas en inglés, Método 1311 de la EPA) para los metales Pb, Se y As.
Las características físicas y químicas de los residuos se muestran en la Tabla 1, donde se observa que la escoria se compone principalmente de óxidos de hierro (Fe2O3), azufre (SO3) y sodio (Na2O), el primero como resultado de los aditivos reductores como el hierro, el segundo por los compuestos de azufre presentes en las BPA y el último por el fundente carbonato de sodio (Na2CO3). Considerando que la escoria contiene una cantidad significativa de Na2O, que actúa como fundente, es posible manejar temperaturas moderadas en el proceso de vitrificación, contribuyendo además a una mejor trabajabilidad, debido a que también disminuye la viscosidad de la masa fundida 18,19. Por otra parte, el bajo contenido de sílice (5.05%) indica que no es posible vitrificar la escoria sin la adición de agentes formadores de vidrio como la sílice.
En cuanto a las características de toxicidad de la escoria, se considera que el contenido de plomo (Pb) del 3,17%, es un indicativo de posible lixiviación, esto lo confirmó el ensayo de toxicidad realizado mediante el procedimiento de lixiviación TCLP.
Tabla 1 Características de los residuos.
| Composición química (% peso) | Escoria | Arena |
|---|---|---|
| SiO2 | 5.05 | 96.29 |
| Fe2O3 | 33.19 | 0.64 |
| SO3 | 31.94 | 0.49 |
| Na2O | 23.36 | 0.5 |
| Pb | 3.17 | 46 ppm |
| CaO | 0.78 | 0.07 |
| Al2O3 | 0.56 | 1.11 |
| TiO2 | 0.05 | 0.53 |
| Sn | 0.44 | - |
| Ba | 0.31 | 0.02 |
| Sb | 0.26 | - |
| Cu | 0.18 | - |
| As | 0.04 | |
| Se | 0.0084 | |
| Tamaño medio de partícula, µm | 49.11 | 543.49 |
Fuente: elaboración propia
En la Tabla 2, se muestran los resultados de la corrosividad y lixiviación de la escoria, la cual presenta una concentración de plomo en lixiviado, mayor al nivel máximo permisible de 5 mg/L, establecido en el Decreto 4741 de 2005 del Ministerio de Ambiente y Desarrollo Sostenible en Colombia 20. Por lo tanto, es necesario un proceso de inertización, en este caso mediante vitrificación. Por otra parte, el residuo de arena está compuesto principalmente por óxido de silicio (SiO2) con un contenido de 96.29%; y en menor proporción se presentan óxidos de aluminio, hierro y titanio (Al2O3, Fe2O3 y TiO2). El contenido de sílice mencionado es mayor que el reportado en arena y residuos silíceos empleados en la producción de vidrio y la vitrificación de residuos peligrosos en varios estudios 21-26 6. Por lo tanto, el residuo de arena es un potencial agente formador de vidrio en el proceso de vitrificación.
Tabla 2 Corrosividad y lixiviación de acuerdo con el ensayo de TCLP, en la escoria.
| Corrosividad pH | Plomo (mg(L) | Arsénico (mg/L) | Selenio (mg/L) | |
|---|---|---|---|---|
| Resultado | 5.03 | 7.1 | 0.04 | 0.07 |
| Nivel máximo permisible* | 2<pH<12.5 | 5 | 5 | 1 |
*Decreto 4741 16. Fuente: elaboración propia.
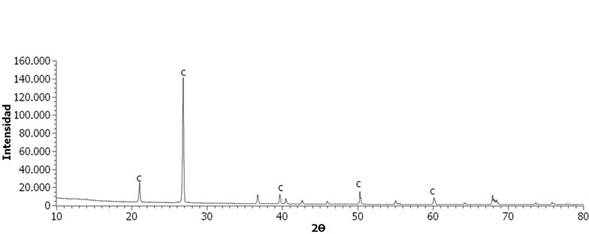
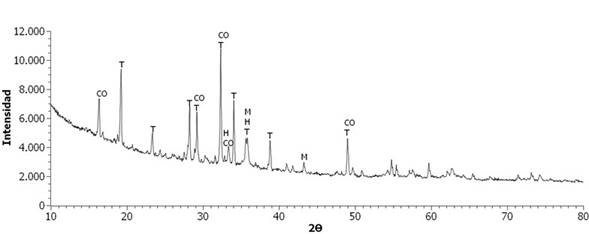
En la Figura 1 se presenta el difractograma de rayos X de la escoria, donde se puede observar que presenta una estructura parcialmente amorfa, debido al levantamiento de la línea base; por tal razón es posible que la escoria pueda reaccionar durante el proceso de vitrificación, llevando a la encapsulación de los metales pesados 17. Se presentan también fases cristalinas que corresponden a los minerales Tenardita (Na2SO4), Magnetita (Fe3O4), Coesita (SiO2) y Hematita (Fe2O3).
En la Figura 2 se presenta el DRX del residuo de arena, donde se observa que la estructura es cristalina por el plano recto y ordenado, siendo la principal fase cristalina el Cuarzo (SiO2). Para lograr una buena interacción de la arena con la escoria en el proceso de vitrificación, se debe tener en cuenta que la temperatura sea la adecuada para que ésta pueda fundir la mezcla y, de esa forma tome una estructura amorfa, propia de los vidrios 18.
Fuente: propia
Figura 1 Difractograma de Rayos X de la escoria de fundición. T: Tenardita, CO: Coesita, H: Hematita, M: Magnetita.
2.2 Proceso de vitrificación a nivel de laboratorio
Las condiciones de operación para este proceso fueron seleccionadas con base en la composición química de la escoria y reportes de la literatura basados en residuos industriales estabilizados mediante vitrificación, entre los que se encuentran, residuos de polvo de horno ricos en hierro 8, residuos tóxicos ricos en hierro y plomo 27, y residuos del proceso de flotación de cobre compuestos principalmente por hierro y sílice 28.
Se formularon mezclas de 50 g, con diferentes composiciones de escoria en el rango de 50 a 65%, arena 30 a 40% y fundente Na2CO3 entre 0 a 10% (ver Tabla 3) en porcentaje peso. Las mezclas se sometieron a temperaturas de 1000, 1100 y 1200 ºC y 2 horas de sostenimiento, empleando un horno eléctrico con una velocidad de calentamiento de 10 ºC/min. Las muestras fueron enfriadas rápidamente al aire y se conservaron en los crisoles de porcelana usados en el proceso.
Tabla 3 Composición lotes experimentales
| Lote | E60A40 | E60A30N10 | E60A35N5 | E65A35 | E65A30N5 | E50A40N10 | E55A40N5 | E55A35N10 | |
|---|---|---|---|---|---|---|---|---|---|
| Composición (%W) | Escoria | 60 | 60 | 60 | 65 | 65 | 50 | 55 | 55 |
| Arena | 40 | 30 | 35 | 35 | 30 | 40 | 40 | 35 | |
| Na2CO3 | - | 10 | 5 | - | 5 | 10 | 5 | 10 | |
Fuente: propia.
Por último, los productos vitrificados fueron caracterizados mediante las técnicas de Espetroscopía Infrarroja por transformada de Fourier (FTIR), DRX y a través del ensayo de toxicidad TCLP, con el fin de evaluar la efectividad del proceso de vitrificación.
3. Resultados
Las muestras obtenidas del proceso de vitrificación se observaron de una manera cualitativa, encontrándose en algunos casos texturas quebradizas y heterogéneas. Por lo cual se tomó la decisión de analizar los productos con apariencia más homogénea. A continuación, se presentan los resultados.
3.1 Caracterización de los productos obtenidos
3.1.1. Análisis por Infrarrojo
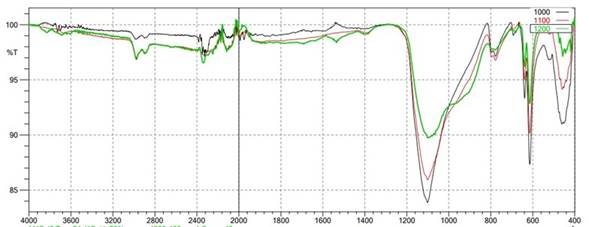
Inicialmente se analizaron los productos obtenidos de la referencia E60A40 a temperaturas de 1000, 1100 y 1200 ºC; debido a que fueron los productos que presentaron mayor homogeneidad en su coloración.
De manera general para este tipo de muestras sometidas al proceso de vitrificación se espera que se presenten bandas representativas de SiO2, en el rango de 400 a 460 cm-1, correspondientes a la vibración de flexión O-Si-O y Si-O-Si; en el rango de 600 a 800 cm-1 para las vibraciones de estiramiento simétrico de Si-O-Si de los puentes de oxígeno entre los tetraedros y, por último, las bandas alrededor de 950 y 1100 cm-1 relacionadas con el estiramiento asimétrico de Si-O-Si con oxígenos no híbridos, de acuerdo a reportes de la literatura 26,29.
En la Figura 3, se presentan los espectros de la muestra E60A40 sometida a 1000, 1100 y 1200ºC, donde se evidencia que las bandas alrededor de 450, 600, 800 y 1100 cm-1, se ensanchan y pierden intensidad con el aumento de la temperatura, además, a 1200ºC aparece un hombro entre 900 y 950 cm-1, el cual no se presenta a las otras temperaturas de tratamiento. Este comportamiento se debe a la transformación de la sílice de su estado cristalino a vítreo 30,31. En un reporte de Conde 32, se menciona que las bandas a 800 y 1100 cm-1 son intensas en la sílice cristalina (cuarzo) y débiles en la sílice vítrea; basado en esta afirmación se puede observar que, a la temperatura de 1200 °C, solamente se conserva una pequeña proporción de fase cristalina proveniente de la arena.
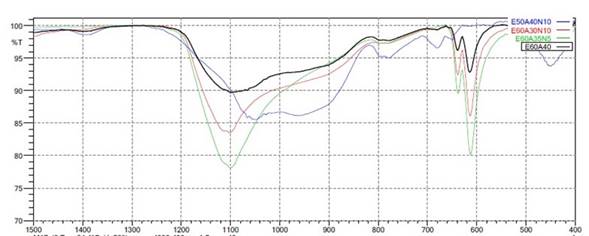
De acuerdo con el análisis anterior, la temperatura a la que los productos presentaron una estructura más vítrea o amorfa fue a 1200 ºC. Debido a esto, se seleccionaron las muestras E50A40N10, E60A40, E60A35N5 y E60A30N10 a dicha temperatura, para determinar la influencia de la composición en la estructura de los vitrificados.
En la Figura 4, se presentan fotografías de productos generados a 1200 ºC para las muestras seleccionadas, donde se puede observar que E50A40N10 fue homogéneo en la mayor parte de su estructura, pero presentó un remanente de color amarillo crema (como se indica con las flechas rojas). Así mismo, E60A40 presentó una apariencia homogénea, E60A35N5 mostró porciones de color naranja opaco; y adicionalmente E60A30N10 fue homogéneo en la mayor parte de su estructura, con un remanente de color amarillo crema (como se indica en la Figura 4).
En la Figura 5, se presentan los espectros IR de las muestras seleccionadas, donde se puede observar que las bandas a 650 y 1100 cm-1 características del SiO2, son más intensas en las muestras E60A35N5 y E60A30N10 con relación a E60A40. Estas bandas no se presentan en la muestra E50A40N10, lo que indica que estos dos últimos productos presentaron una estructura más vítrea que los dos primeros 30. La muestra E50A40N10 presenta un comportamiento diferente a las demás en las bandas alrededor de 450, 700 y 800 cm-1, las cuales son más pronunciadas, además, la banda a 650 cm-1 se suaviza y la de 1100 cm-1 se amplia y se desvía hacia frecuencias menores entre 1000 y 1100 cm-1. Este comportamiento se puede relacionar con el menor contenido de hierro que tiene este producto como consecuencia de un menor contenido de escoria, tal como se reporta en un estudio de obtención de vidrios con alto contenido de hierro 33.

Fuente: propia
Figura 4 Productos obtenidos a 1200ºC. a) E50A40N10, b) E60A40, c) E60A35N5, d) E60A40N10.
Por otro lado, el sodio presente en el fundente generalmente actúa como modificador de la red vítrea, en ese caso, las bandas de los productos se deben suavizar, debido a que la intensidad de los enlaces entre Si y O se reducen con la adición de fundente 32. Este comportamiento no se observa en la Figura 5, ya que las bandas de las mezclas que tienen adición de fundente (Na2CO3), son más intensas que las que no la contienen. Por lo tanto, en este caso, el fundente no está actuando como modificador de la red vítrea, lo que explica su presencia como remanente en los vitrificados con adición de fundente.
3.1.1 Análisis por Difracción de Rayos X
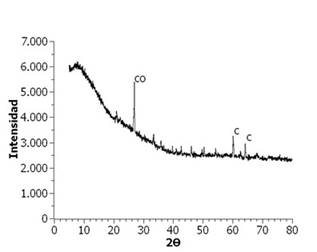
El análisis DRX se realizó a las muestras E50A40N10, E60A40, E60A35N5 y E60A30N10 tratadas a 1200 ºC. En la Figura 6, se encuentra el difractograma del producto E50A40N10, donde se puede observar que es parcialmente amorfo, ya que presenta fases cristalinas correspondientes a Sulfato de sodio, Tenardita, Coesita y Cuarzo. En la Figura 7, se presenta el difractograma del producto E60A40, donde se puede observar que es principalmente amorfo, aunque presenta pocas fases cristalinas de Coesita y Cuarzo. Lo anterior debido posiblemente, a la temperatura de tratamiento y que, al no tener carbonato de sodio en su formulación, fue suficiente con el contenido de éste en la escoria para que ocurriera la formación de un producto amorfo en alta proporción 34.
Fuente: propia
Figura 6 Difractograma de Rayos X de vitrificado E60A40 a 1200ºC. CO: Coesita, C: Cuarzo.

Fuente: propia
Figura 7 Difractograma de Rayos X de vitrificado E60A40 a 1200ºC. CO: Coesita, C: Cuarzo.
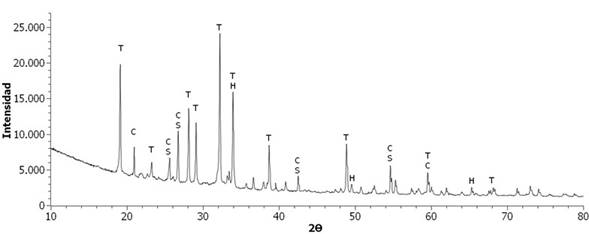
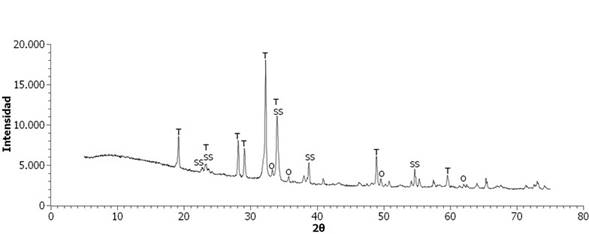
Así mismo, la muestra tratada E60A35N5 presentó partes de color naranja (ver en la Figura 4), relacionada posiblemente con la cristalización de compuestos de hierro, como se confirmó en el difractograma presentado en la Figura 8, donde se pueden apreciar fases cristalinas de óxido de hierro como Hematita, además de otras fases como Cuarzo, Silicato de Calcio y Tenardita. Por último, las principales fases cristalinas en el producto E60A30N10 fueron Sulfato de Sodio y Tenardita como se puede observar en la Figura 9.
Las fases cristalinas Hematita, Tenardita y Coesita presentes en los productos, proceden de la escoria de fundición. Así mismo, la presencia de Cuarzo se atribuye a la arena empleada como agente vitrificante, lo que puede indicar que la escoria y la arena no reaccionaron completamente durante el proceso de vitrificación. Por otra parte, el Sulfato de Sodio presente en los productos E50A40N10 y E60A30N10, se puede relacionar con la interacción de los compuestos de azufre de la escoria y el fundente Na2CO3, lo que indica que éste no interactuó totalmente con toda la mezcla, debido a que la cantidad de fundente fue más de la necesaria y, por ello se presentó como un remanente en dichos productos.
Fuente: propia
Figura 8 Difractograma de Rayos X de E60A35N5 a 1200°C. T: Tenardita, C: Cuarzo, H: Hematita, S: Silicato de Calcio.
Fuente: propia
Figura 9 Difractograma de Rayos X de E60A30N10 a 1200°C. T: Tenardita, SS: Sulfato de Sodio, O: Óxido de hierro (Fe2O3).
Adicionalmente, los productos E60A35N5 y E60A30N10 presentaron fases cristalinas de óxido de hierro y, su mineral Hematita en mayor proporción que el producto E50A40N10; esto se puede relacionar con un menor contenido de sílice procedente de la arena en las mezclas E60A35N5 y E60A30N10. Este comportamiento se ha reportado en vidrios a partir de residuos ricos en hierro, donde los productos vitrificados presentaron cristalización de hematita, debido a que el contenido del residuo en la formulación fue muy alto con relación al agente vitrificante 34.
3.1.2 Análisis de toxicidad
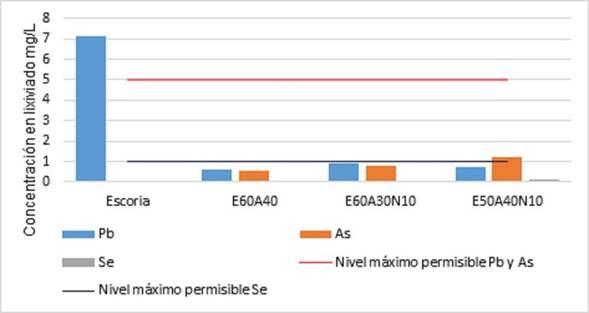
En la Figura 10 se presentan los resultados de lixiviación de los metales plomo (Pb), arsénico (As) y selenio (Se), analizados en las muestras tratadas a 1200 ºC, tales como E50A40N10, E60A40 y E60A30N10. Los análisis se realizaron de acuerdo con el ensayo de TCLP de lixiviación.
En primer lugar, se evidencia que la concentración de Pb en el lixiviado de los 3 vitrificados fue mucho menor que la concentración en el lixiviado de la escoria de plomo secundario (7 mg/L) antes de la vitrificación (ver Tabla 2). Por lo tanto, la vitrificación de la escoria fue efectiva, ya que se presentó una reducción significativa de lixiviación de Pb, lo que a su vez reduce su carácter peligroso, debido a que la concentración de Pb en el lixiviado de los 3 productos vitrificados es mucho menor al límite máximo permisible de Pb en lixiviado de 5 mg/L 28.
Se puede apreciar además la diferencia entre las concentraciones de Pb en el lixiviado de los 3 productos vitrificados. La menor concentración de plomo en lixiviado la presentó el producto E60A40 con 0,61 mg/L, seguido de E50A40N10 con 0,73 mg/L y por último el E60A30N10 0,81 mg/L; esto puede estar asociado a que E60A40 contiene mayor cantidad de arena que los otros dos vitrificados, es decir hay mayor cantidad de sílice, lo que confiere mayor estabilidad química ya que es un formador de la red vítrea. Por lo tanto, a mayor contenido de sílice, se va a presentar menor lixiviación y por ende mayor estabilidad química 35,36.
Por otro lado, las concentraciones de As y Se en el lixiviado de los tres vitrificados se incrementaron con relación a la escoria antes de la vitrificación. Las concentraciones de As y Se no presentaron el mismo comportamiento que Pb, ya que el E60A40 presentó la menor concentración de As y Se con 0,54 y 0,07 mg/L respectivamente, seguido del E60A30N10 con concentraciones de As y Se de 0,78 y 0,05 mg/L y las mayores concentraciones de As y Se se presentaron en el E50A40N10 con 1,2 y 0,13 mg/L. Aunque las concentraciones de estos metales aumentaron en los vitrificados, no sobrepasan los límites máximos permisibles de As y Se de 5 y 1 mg/L, respectivamente 29. Adicionalmente, el incremento de la concentración de As en el lixiviado de los vitrificados se puede atribuir a la cristalización de compuestos de Fe durante el tratamiento térmico, lo que dificulta la unión entre Fe y As; de esta manera se presenta entonces una mayor liberación de As 35, comportamiento que también se evidenció en el análisis DRX donde se presentaron fases cristalinas de óxido de hierro.
Considerando la observación física y análisis por FTIR se evidenció que la temperatura más adecuada del proceso fue de 1200ºC, ya que fue posible obtener algunos productos vitrificados homogéneos y con una textura vítrea y homogénea. Lo anterior se confirmó con los espectros de infrarrojo, donde se encontró que la transformación de estado cristalino a vítreo durante el proceso de vitrificación fue más efectiva a 1200ºC que a las otras temperaturas.
El producto vitrificado E6040, siendo el más homogéneo a 1200ºC, presentó la estructura más vítrea, sin embargo, aún persiste una parte cristalina de cuarzo. Se evidenció que la adición de fundente induce a una estructura menos vítrea en los productos, debido a que el fundente fue más del necesario y quedaron algunos remanentes, presentándose como una fase cristalina. De igual forma, el producto vitrificado E60A40 presentó características similares a un vidrio debido a que fue el más amorfo, así como presentó las concentraciones más bajas de los metales lixiviables Pb, As y Se, las cuales cumplen con el límite permitido.
De acuerdo a los resultados obtenidos, el proceso de vitrificación fue efectivo para inertizar la escoria de fundición; sin embargo, se debe evaluar la posibilidad de reemplazar la arena sílice por otro agente vitrificante como por ejemplo vidrio reciclado 36; debido a que el cuarzo aún sigue presentándose como una fase cristalina en los productos vitrificados. Se sugiere además hacer una evaluación del manejo de temperaturas mayores a 1200ºC, con el fin de obtener una mejor interacción de la mezcla. Adicional a esto, se requieren llevar a cabo estudios futuros sobre la adición del fundente Na2CO3 posiblemente en menores proporciones, ya que se presentó como un remanente o excedente en los productos vitrificados, presentándose más separaciones cristalinas que el vitrificado que no contenía fundente.
La experimentación llevada a cabo en el presente estudio es de gran interés, ya que se presenta como una posibilidad efectiva para el manejo y aprovechamiento de residuos peligrosos. En Colombia son pocos los estudios realizados sobre la vitrificación de residuos peligrosos 37,38; por esta razón se sugiere seguir avanzando en el análisis de las condiciones del proceso.
4. Conclusiones
Del presente estudio realizado a nivel de laboratorio sobre el proceso de vitrificación se concluye que:
La temperatura de tratamiento idónea para este caso fue de 1200 ºC, ya que se obtuvieron productos con mayores características vítreas o amorfas, lo cual se demostró a partir de los resultados de IR y DRX.
El producto vitrificado E60A40 presentó características similares a un vidrio, tanto en el análisis Infrarrojo como el análisis por DRX, donde los productos fueron principalmente amorfos. Sin embargo, aún se presentan fases cristalinas provenientes de la escoria y de la arena, por lo cual será importante evaluar otro agente vitrificante o aumentar la temperatura del proceso de vitrificación.
Los productos con mayor contenido de fundentes presentaron separaciones cristalinas en mayor proporción a los que no lo contenía. En el caso de la escoria estudiada, al tener en su composición un contenido representativo de óxido de sodio (23.36%), el fundente debe ser reducido en la formulación, de tal manera que se obtengan productos homogéneos.
Para las muestras analizadas, los resultados de toxicidad confirmaron que las concentraciones de Pb, As y Se en los lixiviados, cumplieron con los límites máximos permisibles, a excepción del As para la muestra E50A40N10. Por lo tanto, el proceso de vitrificación fue efectivo para la estabilización de la escoria de fundición de plomo secundario.
Los resultados obtenidos en el presente estudio son de gran interés desde el punto de vista medioambiental; debido a que en un futuro esta técnica aplicada a nivel industrial para este residuo podrá facilitar su manejo y/o encaminar a la búsqueda de diversas aplicaciones para el producto vitrificado. Por lo tanto, se debe seguir investigando alrededor del tema del proceso de vitrificación, aplicado a residuos industriales peligrosos.