1. Introducción
El uso industrial de los colorantes sintéticos se ha convertido en unos de los principales problemas de contaminación, ya que se descargan grandes volúmenes de agua contaminada y esto provoca una coloración no deseada de los cuerpos de agua y afecta su calidad. En la literatura se encuentran diversas investigaciones para el tratamiento de las aguas residuales contaminadas por colorantes, esto, debido al gran efecto negativo y a la problemática ecológica que estos generan en los cuerpos de agua, ya que limitan la penetración de los rayos solares, incluso a bajas concentraciones, afectando el crecimiento de microorganismos fotosintéticos, además de ser muy resistentes a la degradación 1-3. Se debe tener en cuenta que, en general, el uso de colorantes implica una contaminación del entorno en caso de entrar en contacto directo con los vertimientos de aguas residuales, lo cual se relaciona con una problemática a nivel ambiental si no se cuenta con el debido tratamiento.
Los colorantes sintéticos son ampliamente utilizados en la industria, un ejemplo de esto es el cristal violeta que es empleado con frecuencia en procesos de tinción, tinción histológica, agente dermatológico, medicina forense, y ha sido catalogado como un colorante catiónico altamente tóxico, incluso a concentraciones muy bajas 4; mientras que el colorante Azul Brillante FCF es ampliamente utilizado en la industria alimentaria; este colorante también presenta usos en la industria cosmética, farmacéutica, además de teñir productos para el cuidado de la salud oral como los enjuagues bucales y ser utilizado para el control de plantas acuáticas 5.
Existen diversas técnicas físicas y químicas para tratar aguas contaminadas con colorantes sintéticos, como: coagulación y floculación combinadas con filtración y flotación, precipitación-floculación, oxidación con ozono, filtración con membranas, ósmosis inversa, entre otras, las cuales producen efluentes que cumplen con las normas de vertimiento, pero la mayoría de estas técnicas son costosas 6. La adsorción es uno de los métodos físicos mayormente empleado en el tratamiento de efluentes contaminados, principalmente para la remoción de aquellos contaminantes que son fácilmente biodegradables, convirtiéndose en una alternativa adecuada para la eliminación de colorantes, sin embargo, el empleo de carbón activado comercial es un proceso sumamente costoso 7. Por esta razón se buscan otras alternativas de tratamiento, como la utilización de desechos agroindustriales modificados químicamente.
Georgin et al. 8 utilizaron la cáscara de Caesalpinia echinata modificada mediante tratamiento químico con ácido, con el fin de eliminar azul brillante y azul de metileno de soluciones acuosas que contenían algunas sales y colorantes para simular las aguas industriales; W. Astuti et al., usaron cenizas de carbón para remover violeta de metilo, en este proceso intervinieron tanto la adsorción física como la química, esto debido a la composición del adsorbente 9; C. Lavado et al., estudiaron la biosorción del azul de metileno usando los cladodios de la tuna, en su investigación, estudiaron la influencia de los parámetros que afectan el proceso de adsorción 10. Por otra parte, la modificación de la biomasa con diferentes ácidos se ha utilizado para remover sustancias como colorantes y metales pesados: se han utilizado el ácido fosfórico 11, el ácido cítrico 12,13, ácido oxálico 12, y biomasas sin modificar 13,14.
En este trabajo se determinaron aspectos termodinámicos y cinéticos del proceso de adsorción, en solución acuosa, de los colorantes azul brillante y violeta de metilo sobre cáscara de yuca modificada con ácido fosfórico.
2. Metodología
2.1. Preparación de la cáscara de yuca
La cáscara de yuca fue obtenida en el municipio de Malambo-Atlántico-Colombia. Se lavó y posteriormente secó al sol durante 72 horas. Las muestras se molieron en un triturador de alimento, se tamizaron y se utilizó la fracción de tamaños de partículas entre 0.25 - 0.50 mm. A continuación, se lavó con agua desionizada hasta obtener un pH constante (pH inicial= 3-4, pH final= 6). Finalmente, se secó a 110 °C durante 24 horas en un horno de convección forzada con termorregulador (Esco Isotherm, modelo OFA-32-8) y luego se almacenó en bolsas con cierre hermético 15,16.
2.2. Caracterización de la cáscara de yuca
La composición de la biomasa se determinó a través de los análisis próximo y último. El análisis próximo proporciona el contenido de humedad (ASTM D3302), materia volátil (ASTM D3175), ceniza (ASTM D3174) y carbono fijo (ASTM D3172). El análisis último sirve para evaluar la constitución elemental de una muestra. Para esto se siguió la norma ASTM D3176 (1974), donde se incluyen la determinación del hidrógeno, nitrógeno, azufre, ceniza y el cálculo de oxígeno.
2.3. Selección de las condiciones óptimas de modificación
La determinación de las mejores condiciones de modificación se realizó a través de un diseño experimental factorial multinivel con ayuda del software Statgraphics XVI. Se estudiaron las variables, temperatura de modificación (127, 136, 144, 153, 171 y 170 °C) y relación cáscara de yuca/H3PO4 (1:0.5; 1:1 y 1:1.5). Los rangos de estudios se tomaron teniendo en cuenta los resultados de 11. Se utilizaron como variables de respuesta el porcentaje de remoción y la capacidad de adsorción de azul de metileno 17.
2.3.1. Modificación de la cáscara de yuca
Las muestras de cáscara de yuca se mezclaron con ácido fosfórico en relación en peso variable y luego se calentaron en un horno a temperaturas también variables, según el diseño experimental, durante un tiempo de reacción constante de 14 horas. Posteriormente, cada lote se lavó con agua destilada y una solución de bicarbonato de sodio toda la noche para remover el ácido residual. Las muestras se secaron en un horno de convección forzada (Esco Isotherm, modelo OFA-32-8) donde se reguló la temperatura a 80 °C por 3 horas y se tamizaron, escogiéndose la fracción con tamaños de partícula entre 0.250 - 0.5 mm 11.
2.3.2. Preparación de la solución de azul de metileno
Se pesaron 800 mg del colorante azul de metileno en una balanza analítica, se disolvió en un beaker agregándole 200 mL de agua destilada y luego se transfirió a un matraz aforado de 1000 mL y se completó el volumen con agua destilada para obtener una solución correspondiente a la solución stock de 800 mg/L. La curva de calibración se preparó realizando diluciones de la solución stock con agua destilada para obtener soluciones a diferentes concentraciones conocidas (1 - 15 mg/L). A cada solución, se le midió la absorbancia en un espectrofotómetro UV-vis Evolution 60S (Thermo Scientific) 11,14.
2.3.3. Pruebas de remoción de azul de metileno
Para evaluar cada uno de los lotes de cáscara de yuca modificada, se realizaron pruebas de remoción con azul de metileno y se determinó la capacidad de adsorción y porcentaje de remoción a través de la Ec.1 y Ec.2, respectivamente 9:
Donde 𝑞 es la cantidad de colorante adsorbida en el equilibrio (mmol/g), 𝑉 el volumen de la solución de colorante (L), 𝐶𝑖 la concentración inicial del colorante (mmol/L), 𝐶𝑓 la concentración final del colorante (mmol/L) y 𝑚 la masa de adsorbente (g) 5.
La solución stock se diluyó para crear soluciones de concentraciones conocidas (100 - 800 mg/L), luego se tomaron 20 mL de cada una de estas soluciones en Erlenmeyer de 100 mL y se le adicionaron 0.2 gramos de un lote de cáscara de yuca modificada y se agitaron a 150 rpm en un shaker durante 3 horas 11. Esta prueba se realizó para cada lote de yuca modificada por triplicado.
2.4. Caracterización de la cáscara de yuca modificada
La cáscara de yuca modificada y no modificada se caracterizaron usando espectroscopia IR por el método de la pastilla de KBr. La captura del espectro se realizó en un espectrofotómetro (FTIR Shimadzu IRaffinity-1), en el rango de 500 a 4000 cm-1 (16. Adicionalmente, a la cáscara de yuca modificada se le determinó el punto de carga cero empleando el método usado por F. Amaringo et al. Se añadieron 20 mL de agua destilada a Erlenmeyers de 100 mL, luego se ajustó el pH con la ayuda de HCl 0.1 M y NaOH 0.1 M. A cada una de las soluciones, se le añadieron 0.2 g de cáscara de yuca modificada y se sometió a agitación constante por 48 horas a temperatura ambiente. Luego se midió el pH a cada solución. Los datos resultantes obtenidos fueron graficados en un plano cartesiano; el punto de carga cero correspondió al punto donde la curva de pH final en función del pH final corta la diagonal 17.
2.5. Curvas de calibración
Se prepararon soluciones stock para el violeta de metilo y el azul brillante con concentraciones de 100 mg/L y 102 mg/L, respectivamente. Posteriormente, se realizaron las curvas de calibración. Para esto se prepararon diluciones a diferentes concentraciones conocidas. La preparación de las soluciones stock para el violeta de metilo y el azul brillante se realizaron con agua destilada y buffer pH 2.0, respectivamente. A cada solución, se le midió la absorbancia en un espectrofotómetro UV-Vis (Evolution 60S Thermo Scientific) usando una longitud de onda de 585 nm, para el violeta de metilo, y de 630 nm para el azul brillante y se graficaron los datos y determinó la curva que relaciona la concentración y la absorbancia 5. Cada dilución se hizo por duplicado.
2.6. Cinética de adsorción
La medición de la cinética de adsorción se llevó a cabo utilizando 20 mL de colorante con una concentración de 100 mg/L. Se añadieron 0.2 g de cáscara de yuca modificada y se sometió a agitación constante. A medida que transcurría el tiempo, se retiraron y filtraron alícuotas para determinar las concentraciones finales por espectrofotometría UV-Vis.
2.7. Modelos cinéticos de adsorción
Para determinar el mecanismo de adsorción del colorante con la cáscara de yuca modificada con ácido fosfórico, se ajustaron los datos experimentales a los modelos cinéticos de adsorción en su forma linealizada.
2.7.1. Modelo de pseudo primer orden
Se basa en que a cada ion le corresponde un sitio de adsorción en la matriz del adsorbente y en que la transferencia de masa es la etapa controlante en el proceso. Además, plantea que la adsorción se da por el diferencial de concentraciones del adsorbato en solución y en superficie 18. La Ec.3 es la ecuación linealizada que corresponde a este modelo:
Donde, 𝑞𝑒𝑞 cantidad de adsorbente en el equilibrio (𝑚𝑚𝑜𝑙/𝑔), 𝑞(𝑡) cantidad de adsorbente en el tiempo t (min), y 𝑘1 la constante de cinética (𝑚𝑖𝑛-1).
2.7.2 Modelo de pseudo segundo orden
Este modelo señala que la adsorción se da en más de un sitio activo del adsorbente 18 y su forma linealizada se muestra es la Ec.4.
Donde, 𝑞𝑒𝑞 cantidad de adsorbente en el equilibrio (𝑚𝑚𝑜𝑙/𝑔), 𝑞(𝑡) cantidad de adsorbente en el tiempo t (min), 𝑘2 constante de velocidad (𝑔/𝑚𝑚𝑜𝑙∙ 𝑚𝑖𝑛).
2.8. Isotermas de adsorción
Para estas pruebas se tomaron muestras de solución de colorantes a diferentes concentraciones (20, 40, 60, 80 y 100 mg/L), se añadieron 0.2 g de cáscara de yuca modificada y se sometió a agitación constante a 150 rpm y temperatura también constante hasta el tiempo de equilibrio. Estas pruebas se repitieron variando la temperatura de operación (20, 25, 30 y 35 ˚C) 5. Los resultados obtenidos se ajustaron a los siguientes modelos de isotermas de adsorción.
2.8.1. Langmuir
Este modelo describe cuantitativamente la formación de una monocapa de adsorbato en la superficie externa del adsorbente. El modelo Langmuir (Ec.5) representa la distribución de equilibrio de adsorbato entre las fases sólida y líquida 19.
Donde, 𝐶 es la concentración de equilibrio del adsorbato (mmol / L), 𝑞 indica la cantidad de adsorbato adsorbida por gramo de adsorbente en equilibrio (mmol / g), 𝑄0 representa la capacidad de cobertura monocapa (mmol / g), 𝐾𝐿es la constante de isoterma de Langmuir (L / mmol).
2.8.2. Freundlich
El modelo de Freundlich, describe una adsorción de múltiples capas en una superficie heterogénea. Su expresión linealizada, se presenta en la Ec.6. (20,21)
Donde, 𝐾𝑓 es la constante de la isoterma de Freundlich 𝑚𝑚𝑜𝑙-1(1/𝑛)𝐿(1/𝑛)𝑔-1), 𝑦 n𝑓 es la intensidad de adsorción.
2.8.3. Temkin
Este modelo presenta un factor que considera la interacción adsorbente - adsorbato y, además, supone que el calor de adsorción disminuye linealmente en todas las moléculas presentes en la capa de adsorción al aumentar la capacidad de adsorción 22. En la Ec.7 se presenta la forma linealizada de la ecuación de Temkin.
Donde, 𝐾𝑡 es la constante de la isoterma de Temkin (𝐿/𝑚𝑜𝑙), 𝑏𝑡 es la constante relacionada con el calor de adsorción (g J/mol2), 𝑅 es la constante universal de los gases (𝐽/𝑚𝑜𝑙∙𝐾) y 𝑇 la temperatura absoluta (𝐾).
2.9. Análisis termodinámico
Para determinar la espontaneidad del proceso de adsorción, y si este requiere adsorber energía (endotérmico) o liberarla (exotérmico), se determinaron los parámetros termodinámicos, tales como la energía libre de Gibbs, entalpia y entropía. El valor de la constante de equilibrio se estima aproximándolo a la constante de Langmuir, 𝐾𝑐≅𝐾𝐿 (23-26. Entonces, la energía libre de Gibbs se calcula a partir de la Ec.9.
Donde, 𝑅 es la constante de gas ideal, 𝑇 es la temperatura absoluta y 𝐾𝐿 es la constante de Langmuir.
Lo anterior es válido para soluciones diluidas de adsorbato cargados, soluciones con cualquier concentración de adsorbato sin carga o soluciones con cualquier concentración de adsorbato con carga débil 27-29.
La energía libre de Gibbs se relaciona con la entalpía y la entropía mediante la Ec.10:
Igualando las Ec.9 y Ec.10, se obtiene la Ec.11:
Las propiedades termodinámicas de los procesos de adsorción del violeta de metilo y azul brillante en la cáscara de yuca modificada con ácido fosfórico se estimaron con la Ec.11, realizando un gráfico de ln KL en función de T-1 usando los valores de la constante de Langmuir previamente determinados.
3. Resultados
3.1. Caracterización de la cáscara de yuca sin modificar
En la Tabla 1 se encuentran resumidos los resultados de los análisis próximo y último de la cáscara de yuca sin modificar. Se puede apreciar que la biomasa presenta un alto contenido de materia volátil y carbono, y bajo contenido de nitrógeno y azufre, valores que concuerdan con los reportados por Albis et al. 14. En los análisis próximos se puede observar que la cáscara de yuca tiene un bajo contenido de humedad lo que favorece la molienda y disminuye la formación de posibles aglomeraciones.
Tabla 1 Resultados de análisis próximo y últimos de la cáscara de yuca no modificada.
| Propiedad | Valor |
|---|---|
| Análisis próximo | |
| Humedad % | 6.22 |
| Ceniza % | 6.81 |
| Materia volátil % | 72.4 |
| Carbono fijo % | 14.57 |
| Poder calorífico (kcal/kg) | 3968 |
| Análisis último | |
| Azufre % | 0.08 |
| Carbono % | 44.4 |
| Nitrógeno % | 1.63 |
| Hidrógeno % | 5.78 |
| Oxígeno % | 40.85 |
Fuente: propia
3.2. Selección de condiciones óptimas de modificación de la cáscara de yuca
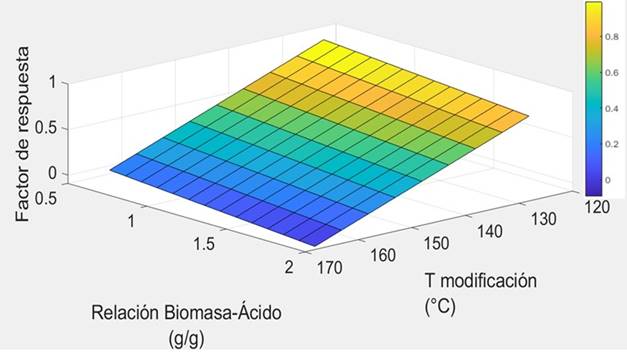
Para observar el efecto de las variables de temperatura de modificación y la relación de biomasa:ácido sobre el porcentaje de remoción, se realizó una curva de superficie de respuesta (Figura 1). Se observa que existe un pico en las coordenadas 127°C y relación 1:1.5 donde se obtiene un valor de 99.954% de colorante removido, sin embargo, en las coordenadas 127°C y relación 1:1, se obtiene un valor muy similar de remoción, 99.946%.
Para seleccionar la relacion biomasa:ácido óptima usada en la modificación de la cáscara de yuca, se analizaron los resultados obtenidos en la remoción de azul de metileno utilizando los lotes de cáscara de yuca modificada a 127 °C. En la Tabla 2 se muestran los porcentajes de remoción obtenidos para cada ensayo y se puede evidenciar que el valor más alto se obtiene con una relacion de 1:1.5, sin embargo, en este trabajo se seleccionó la relación 1:1 ya que con esta, se utiliza menor cantidad de ácido y los resultados obtenidos con este lote, son muy parecidos a los obtenidos con la relacion 1:1.5 (Tabla 2) . De esta forma no sólo obtenemos una buena remoción, sino que también se ahorran recursos ya que se disminuye en un 33 % el consumo de ácido fosfórico usado en la modificación de la cáscara de yuca.
Fuente: propia
Figura 1 Superficie de respuesta con variables dependientes de temperatura de modificación y relación Biomasa-Ácido.
Tabla 2 Valores de ensayos de remoción usando lotes de cáscara de yuca modificada a 127 °C
| T (°C) | Biomasa/H3PO4 | Concentración (mg/L) | Porcentaje de remoción (%) | q(mg/g) |
|---|---|---|---|---|
| 127 | 1:1.5 | 100 | 99.954 | 9.996 |
| 127 | 1:1 | 100 | 99.946 | 9.995 |
| 127 | 1:1.5 | 400 | 99.874 | 39.950 |
| 127 | 1:1.5 | 300 | 99.872 | 29.961 |
| 127 | 1:1 | 400 | 99.855 | 39.942 |
| 127 | 1:1 | 300 | 99.844 | 29.953 |
| 127 | 1:1.5 | 500 | 99.838 | 49.919 |
| 127 | 1:1.5 | 200 | 99.825 | 19.965 |
| 127 | 1:1 | 200 | 99.805 | 19.961 |
| 127 | 1:1.5 | 600 | 99.797 | 59.878 |
| 127 | 1:1 | 500 | 99.790 | 49.895 |
| 127 | 1:1 | 600 | 99.789 | 59.874 |
| 127 | 1:1.5 | 100 | 99.769 | 9.979 |
| 127 | 1:1.5 | 600 | 99.686 | 59.812 |
| 127 | 1:1.5 | 700 | 99.644 | 69.751 |
Fuente: propia
3.3. Espectrometría FTIR de la cáscara de yuca modificada y no modificada
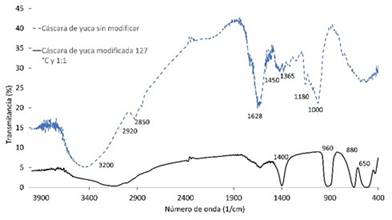
En el espectro FTIR realizado para la cáscara de yuca sin modificar (Figura 2) se puede observar la banda OH entre 3600-3200 cm-1, lo que indica presencia de alcoholes y humedad en la muestra; esto último se confirma con la flexión presentada en 1628 cm-1 que corresponde al estiramiento O-H. Los picos observados en 2920 y 2850 cm-1 son producidos por los grupos alifáticos C-H al igual que los observados entre 1450 y 1365 cm-1. La banda que se encuentra entre 1180 y 1000 cm-1 representa el estiramiento C-O-C destacando la presencia de ésteres 11,12,14.
En el espectro FTIR de la cáscara de yuca modificada encontramos menor presencia de alcoholes y de humedad en la muestra, además desaparece la banda que destaca la presencia de ésteres, la posible causa de la destrucción de estos grupos podría ser la impregnación de la muestra con ácido fosfórico. Por el contrario, aparecen nuevos estiramientos correspondientes a enlaces C-P en 650 cm-1 y CP-H en 1400 cm-1, además de una banda entre 880 y 960 cm-1 que podría ser un estiramiento simétrico del enlace P-O-C. Lo anterior confirma la modificación de la muestra a causa del ácido fosfórico 30-32.
3.4. Punto de carga cero
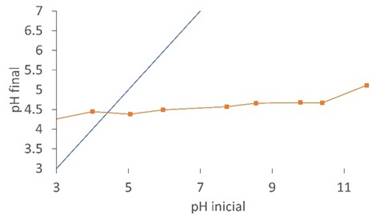
El punto de carga cero indica el pH donde la superficie del adsorbente adquiere una carga neutra. Esto quiere decir que, si el adsorbente se encuentra en una solución con pH mayor al punto de carga cero, su superficie será negativa, atrayendo iones de carga positiva de la solución; de igual manera si el pH es menor, su superficie será positiva y atraerá iones de carga negativa. En la Figura 3, se observa que la curva interseca la diagonal en un valor cercano a 4.38, el cual corresponde al punto de carga cero.
Este valor nos indica que la cáscara de yuca modificada con ácido fosfórico posee carga neutra a este pH, de ahí que, para realizar las pruebas de remoción del colorante azul brillante, se modificó el pH a la solución por debajo del punto de carga cero debido a la naturaleza aniónica del colorante.
Fuente: propia.
Figura 2 Espectro FTIR de la cáscara de yuca y cáscara de yuca modificada a 127°C y relación biomasa:ácido 1:1.
3.5. Cinética de adsorción
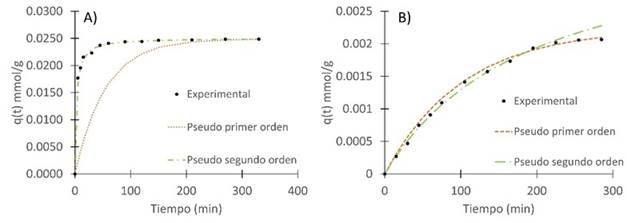
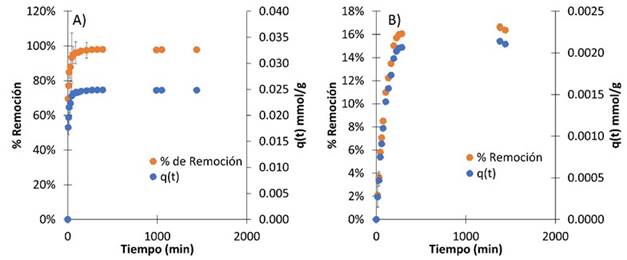
En la Figura 4 se muestran la adsorción de los colorantes violeta de metilo y azul brillante en función del tiempo. Se puede notar que después de un tiempo, tanto el porcentaje de remoción como la capacidad de adsorción permanecen prácticamente constantes; a este punto se le denomina punto de equilibrio, el cual indica el tiempo al que se ha alcanzado la capacidad máxima de adsorción.
Se puede evidenciar que el equilibrio en la remoción con el colorante violeta de metilo se alcanza a los 330 min, llegando a valores cercanos a lo 98 % de remoción y 0.0249 mmol/g (9.810 mg/g) de capacidad de adsorción. Cabe anotar que a partir de los 45 min ya se obtienen remociones superiores al 93 % y después de 150 min superiores al 97 %, lo que significa un buen rendimiento en menor cantidad de tiempo. Por el contrario, los valores obtenidos con el azul brillante no son muy buenos, ya que se obtuvieron valores inferiores al 17% en cuanto a porcentaje de remoción y una capacidad máxima de remoción de 0.00214 mmol/g (1.70 mg/g) en 23 horas, la cual es 10 veces inferior a la obtenida en la remoción del violeta de metilo.
Fuente: propia
Figura 4 Cinética de adsorción de colorantes usando cáscara de yuca modificada con H3PO4 con relación biomasa:ácido de 1:1 a 127 °C, dosis de biomasa: 10 g/L, Temperatura: 25°C A) Violeta de metilo, Concentración inicial: 100 mg/L, B)azul brillante, pH:2.1, Concentración inicial: 102 mg/L.
3.6. Ajustes a los modelos cinéticos de adsorción
En la Figura 5 se reflejan los datos experimentales ajustados a los modelos cinéticos de adsorción de Pseudo primer orden y Pseudo segundo orden. Se puede evidenciar que para ambos casos se obtiene un mejor ajuste en el modelo de Pseudo segundo orden. Esto indica que la adsorción química controla el proceso, lo que implica que estén actuando fuerzas de atracción debido al intercambio de electrones entre la cáscara de yuca modificada y el colorante 12.
En la Tabla 3 se muestran los parámetros calculados para cada modelo cinético y el ajuste de cada uno de ellos a los datos experimentales. Los coeficientes de correlación muestran que el modelo de pseudo primer orden ajusta mejor para la adsorción de azul brillante, sugiriendo un proceso de adsorción física, mientras que el modelo de pseudo segundo orden ajusta mejor los datos de la adsorción de violeta de metilo, sugiriendo en este caso una adsorción más fuerte, de tipo químico. Estos resultados contrastan con los reportados en otras investigaciones, donde se utilizaron borra de café y corteza de naranja para remover azul brillante, obteniéndose un mejor ajuste con el modelo de pseudo segundo orden 5. En el caso de la adsorción de violeta de metilo sobre carbón activado a partir de cáscara de coco 33, los resultados concuerdan con los obtenidos en nuestro trabajo, observándose un mejor ajuste utilizando el modelo de pseudo segundo orden.
Tabla 3 Parámetros del ajuste a los modelos cinéticos
| Modelo | Colorante | qeq (mmol/g) | K (min-1) | R2 |
|---|---|---|---|---|
| Pseudo primer orden | Violeta de metilo | 0.0249 | 0.0184 | 0.9098 |
| Azul brillante | 0.00224 | 0.00981 | 0.9908 | |
| Pseudo segundo orden | Violeta de metilo | 0.0251 | 14.8 | 0.9999 |
| Azul brillante | 0.00384 | 1.33 | 0.9815 |
Fuente: propia
3.7. Isotermas de adsorción
En la Tabla 4 se observan los parámetros obtenidos para cada modelo de isoterma de adsorción y el coeficiente de correlación obtenido en cada caso. Se aprecia que el mejor ajuste se obtiene aplicando la isoterma de Freundlich, lo que sugiere la formación de varias capas de adsorbato sobre la superficie del adsorbente después de haberse formado la primera capa 12; resultados similares, se obtuvieron en investigación realizada por Aljeboree, donde se ajustaron los datos experimentales de equilibrio a los modelos de Temkin, Langmuir y Freundlich, obteniendo con este último modelo los mejores resultados 33. La variable n f nos indica la favorabilidad de la adsorción: para valores de n f < 1 la adsorción es desfavorable, para n f = 1 la adsorción es lineal, mientras que para n f > 1 la adsorción se considera favorable 14. De lo anterior se puede concluir que para cada colorante la adsorción es favorable y dicha favorabilidad aumenta a medida que se incrementa la temperatura.
Cabe resaltar que también se obtiene un buen ajuste a los datos experimentales con la isoterma de Langmuir, ya que los valores de R2 son superiores a 0.9289 en la remoción del azul brillante y 0.9756 para el violeta de metilo; además en el caso de la remoción del violeta de metilo a 25 y 30 °C se obtiene un mejor ajuste usando este modelo de isoterma. El buen ajuste a los modelos de Freundlich y Langmuir muestra que cualquiera de los dos puede utilizarse para describir los resultados de las isotermas de adsorción 34.
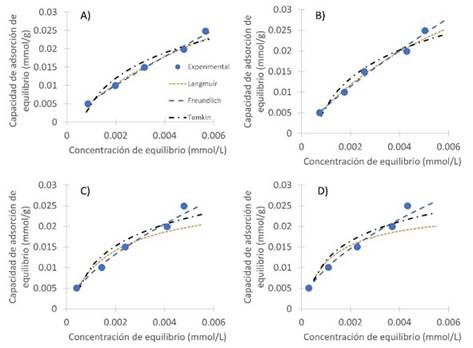
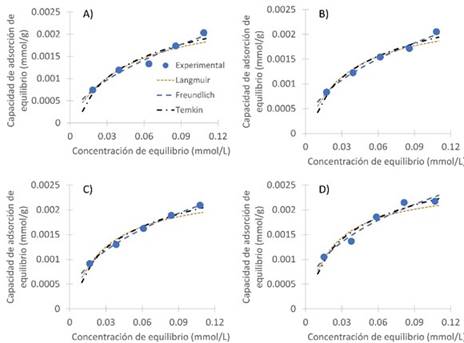
En la Figura 6 y 7 se observa el ajuste de las isotermas de Langmuir, Freundlich y Temkin a la curva experimental en la adsorción de cada colorante. En ellas se puede constatar la cercanía de cada uno de los modelos a los datos experimentales, confirmando además el ajuste que se obtuvo con cada uno ellos.
3.8. Parámetros termodinámicos
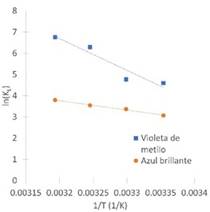
De la Figura 8 se obtuvieron los valores de la constante de Langmuir necesarios para determinar los parámetros de entropía y entalpía del proceso de adsorción de los colorantes violeta de metilo y azul brillante, mientras que los valores de energía libre de Gibbs se calculan usando la Ec.11. Los resultados se pueden observar en la Tabla 5. Para ambos colorantes, los valores de energía libre de Gibbs fueron negativos, lo que significa que el proceso es espontáneo, además se puede observar que los valores de ΔG disminuyen a medida que aumenta la temperatura indicando que la espontaneidad se ve favorecida.
Tabla 4 Parámetros de los modelos de adsorción
| Violeta de metilo | ||||
|---|---|---|---|---|
| Temperatura (°C) | 25 | 30 | 35 | 40 |
| Langmuir | ||||
| Q0 (mmol/g) | 0.0629 | 0.0616 | 0.0272 | 0.0243 |
| KL (L/mmol) | 99.0 | 118.3 | 540.8 | 860.3 |
| R2 | 0.9981 | 0.9965 | 0.9761 | 0.9746 |
| Freundlich | ||||
| KF (mmol1-1/nL1/ng-1) | 1.79 | 1.86 | 0.682 | 0.517 |
| nf | 1.20 | 1.22 | 1.58 | 1.74 |
| R2 | 0.9978 | 0.9931 | 0.9907 | 0.991 |
| Temkin | ||||
| bt x 10-6(g J/mol2) | 0.24788 | 0.25433 | 0.33978 | 0.38175 |
| Kt (L/mmol) | 1652 | 1916 | 3775 | 5551 |
| R2 | 0.9383 | 0.9437 | 0.906 | 0.902 |
| Azul brillante | ||||
| Langmuir | ||||
| Q0 (mmol/g) | 0.00259 | 0.00244 | 0.00246 | 0.00251 |
| KL (L/mmol) | 21.55 | 29.10 | 34.62 | 44.61 |
| R2 | 0.9748 | 0.982 | 0.9764 | 0.9289 |
| Freundlich | ||||
| KF (mmol1-1/nL1/ng-1) | 0.00660 | 0.00580 | 0.00570 | 0.00560 |
| nf | 1.84 | 2.09 | 2.24 | 2.45 |
| R2 | 0.9768 | 0.9946 | 0.999 | 0.964 |
| Temkin | ||||
| bt x 10-6(g J/mol2) | 3624 | 3982 | 4073 | 4120 |
| Kt (L/mmol) | 146 | 196 | 233 | 307 |
| R2 | 0.9353 | 0.9674 | 0.9804 | 0.9454 |
Fuente: propia
Fuente: propia
Figura 6 Representación de los modelos de isotermas ajustados a las temperaturas a. 25 °C, b. 30 °C, c. 35 °C y d. 40 °C para la remoción de violeta de metilo en cáscara de yuca modificada con ácido fosfórico. Dosis de biomasa: 10 g/L, Temperatura: 25°C.
Fuente: propia
Figura 7 Representación de los modelos de isotermas ajustados a las temperaturas a. 25 °C, b. 30 °C, c. 35 °C y d. 40 °C para la remoción de azul brillante en cáscara de yuca modificada con ácido fosfórico. Dosis de biomasa: 10 g/L, Temperatura: 25°C, pH: 2.1.
Fuente: propia
Figura 8 Diagrama de van’t Hoff para la adsorción de a) violeta de metilo y b) azul brillante sobre cáscara de yuca modificada con ácido fosfórico.
Tabla 5 Parámetros termodinámicos de la adsorción de violeta de metilo y azul brillante sobre cáscara de yuca.
| Violeta de metilo | ||||
|---|---|---|---|---|
| T (K) | KL (L/mol) | ΔG (J/mol) | ΔS (J/mol K) | ΔH (J/mol) |
| 298 | 98.97 | -10.89 | 0.45 | 124 |
| 303 | 118.27 | -13.15 | ||
| 308 | 540.75 | -15.42 | ||
| 313 | 860.33 | -17.68 | ||
| Azul brillante | ||||
| T (K) | KL (L/mol) | ΔG (J/mol) | ΔS (J/mol K) | ΔH (J/mol) |
| 298 | 21.6 | -7.66 | 0.15 | 36.6 |
| 303 | 29.1 | -8.40 | ||
| 308 | 34.6 | -9.14 | ||
| 313 | 44.6 | -9.88 | ||
Fuente: propia
Los valores positivos de la entalpía indica que la adsorción de ambos colorantes sobre la cáscara de yuca modificada con ácido fosfórico es un proceso endotérmico, y que es favorable para la adsorción el aumento de la temperatura, obteniéndose mayores valores de porcentajes de remoción y capacidad de adsorción, lo que concuerda con lo reportado por Aljeboree et al. 33, donde se utiliza cáscara de coco para remover violeta de metilo. Generalmente, la magnitud del cambio de la entalpía estándar para la adsorción física está en el rango de los 0 kJ/mol a 20 kJ/mol, mientras que la quimisorción está en el rango de los 80-200 kJ/mol; de 20 kJ/mol a 80 kJ/mol existe tanto la adsorción física como la química 23,24. En este trabajo, para el violeta de metilo se observa un valor de 124 kJ/mol indicando que se da un proceso de quimisorción; por otro lado, para el azul brillante el valor del cambio de entalpia fue de 36.6 kJ/mol, indicando que coexisten tanto la fisisorción como la quimisorción.
Por otro lado, el valor positivo de ΔS obtenido en las pruebas de adsorción del violeta de metilo y azul brillante, refleja la afinidad del adsorbente por el colorante en solución y algunos cambios estructurales en el adsorbato, adsorbente y el solvente, lo que favorece la adsorción.
4. Conclusiones
En este trabajo se evaluó la capacidad de adsorción de la cáscara de yuca modificada con ácido fosfórico en la remoción de los colorantes violeta de metilo y azul brillante. Se encontró que para el violeta de metilo se presenta una buena adsorción, ya que se alcanzan valores cercanos al 98 % de remoción con una capacidad máxima de adsorción de 0.0249 mmol/g en 285 min. Por otro lado, el porcentaje de remoción y la capacidad de adsorción que se presentan con el azul brillante son muy bajas, logrando valores de tan sólo 17 % y 0.00214 mmol/g alcanzando el equilibrio en 330 min, indicando que para este caso no es favorable utilizar cáscara de yuca modificada con H3PO4 para remover este colorante.
El punto de carga cero de la cáscara de yuca modificada fue de 4.38, lo que indica que la superficie de la cáscara de yuca a este pH adquiere carga neutra. Debido a esto, al ser el azul brillante un colorante de naturaleza aniónica, se hizo necesario modificar el pH de la solución a 2.1 por debajo del punto de carga cero; de esta forma, superficie de la cáscara se cargó positivamente y se pudo remover un poco de este colorante. Sin embargo, la remoción la remoción de azul brillante fue muy baja (17 %); ya que al parecer la cantidad de cargas positivas en la superficie de la cáscara de yuca modificada no fue suficiente.
Se encontró que la cáscara de yuca modificada con relación biomasa/acido de 1:1 a 127 °C presenta el mejor comportamiento en la remoción del azul de metileno obteniéndose valores cercanos 99.95 % de porcentaje de remoción. Además, se observó que no es necesario aumentar la cantidad de ácido fosfórico utilizado en la modificación para aumentar la remoción, ya que se obtienen valores muy cercanos al anterior por lo que no se justifica un mayor consumo de este reactivo.
Se evidencia que, para la remoción de ambos colorantes, la isoterma de Freundlich presenta un mejor ajuste a los datos experimentales a diferentes temperaturas con un R2 varía entre 0.9910 a 0.9978 para el violeta de metilo y 0.9640 a 0.9990 para el azul brillante. Además, los valores de nf indican que los procesos son favorables y dicha favorabilidad aumenta a medida que se incrementa la temperatura de 25 a 40 °C, ya que el valor de nf para el violeta de metilo pasa de 1.2 a 1.74 y para el azul brillante de 1.84 a 2.45.
Los valores de energía libre de Gibbs fueron negativos para la adsorción del violeta de metilo y el azul brillante, lo que significa que el proceso es espontáneo y se favorece al aumentar la temperatura. Los valores positivos de la entalpía indican que ambos procesos son de naturaleza endotérmica, además se confirma el predominio de la adsorción química ya que los valores obtenidos están por encima de 20 kJ/mol. Los valores positivos del cambio de entropía, indica la probabilidad de que se presente reversibilidad en el proceso.