1. Introducción
El copoazú (Theobroma grandiflorum) es un árbol nativo de la Amazonía brasileña, de la familia Malvaceae la misma del cacao (Theobroma cacao L.) 1. El fruto contiene de 20 a 50 granos rodeados de pulpa, que representa hasta el 43% del peso total 2. La pulpa se utiliza para la elaboración de mermeladas, jugos, yogurt, néctares, dulces y helados 3. Los granos son usados para la elaboración de un producto similar al chocolate, conocido como copolate; mientras la manteca, se ha empleado como sustituto de la manteca de cacao y como ingrediente cosmético 4. Por lo anterior, sumado a su excelente aroma, sabor, textura y alto valor nutricional; el copoazú ha sido catalogado como un fruto promisorio y de potencial económico e industrial 5.
La pulpa de copoazú presenta un pH de 3.4 y su contenido de azúcar es de 10.7 °Brix; posee un alto contenido de ácido ascórbico (96-111 mg/100 g), compuestos fenólicos totales (4.9 - 5.4 mg de catequina/g), actividad antioxidante (26 - 28 µmol eq Trolox/g) y proantocianidinas derivadas principalmente de epicatequina 6. Dichos compuestos químicos se han asociados con la disminución del riesgo de enfermedades como ciertos tipos de cáncer, enfermedades cardiovasculares, cataratas, degeneración macular y enfermedades neurodegenerativas 7. Es fuente natural de ácidos grasos, especialmente de ácido palmítico, linoleico y α-linolénico 2. Asimismo, se ha reportado que la fracción de pectina de la pulpa de copoazú es igual al 7%, lo cual es superior comparado con las pectinas de Citrus depressa (4.1%) y maracuyá amarilla (2.9%) 8. Una alta concentración de pectina forma una dispersión coloidal, que provoca turbidez durante el procesamiento de zumo de frutas y causa muchas dificultades para filtrar el zumo a una claridad aceptable 9. Debido a esto, la hidrólisis de la pectina es un paso esencial en el procesamiento de productos a base de pulpa 10.
En el proceso de obtención de jugos de frutas se generan subproductos ricos en fibra dietaría 11. La ingesta de esta sustancia tiene efectos positivos para la salud humana debido a que reduce los niveles de colesterol y azúcar en la sangre 12), previene el cáncer de colon y la diabetes 13. A pesar de estos múltiples beneficios, los desechos generados del procesamiento de frutas siguen siendo infrautilizados debido a la falta de tecnologías apropiadas para su valorización eficiente 14. No obstante, algunos subproductos de manzana, remolacha azucarera y de los cítricos se incorporan a los alimentos por sus propiedades nutricionales, funcionales y tecnológicas 15. En el procesamiento de la pulpa de copoazú se genera un subproducto, que es fuente potencial de fibra dietaria, principalmente fibra soluble; el cual puede ser considerado como ingrediente para el desarrollo de alimentos funcionales 16.
Varios estudios han descrito la aplicación de enzimas pectinolíticas en diferentes tipos de frutas como banano 17, mango 18 y piña 19. Los resultados de estas investigaciones indican que el uso de pectinasas en el procesamiento de frutas aumenta el rendimiento de extracción de jugo, reduce la viscosidad de la pulpa, incrementa la claridad y el contenido de sólidos solubles del jugo. Para el caso de la extracción del jugo de copoazú, se destaca el estudio realizado por 20, donde encontraron una menor viscosidad y turbidez en el jugo producido mediante la adición de un extracto de enzima cruda de Aspergillus japonicus 586. Sin embargo, hay pocas publicaciones sobre el efecto del tipo de enzima, variaciones de temperatura y tiempo de incubación en el proceso de licuefacción enzimática de la pulpa de copoazú.
El objetivo del presente estudio fue evaluar el efecto de dos preparaciones de enzimas pectinolíticas comerciales, diferentes temperaturas y tiempos de incubación sobre las características fisicoquímicas y reológicas de los subproductos, jugo clarificado de copoazú, capacidad de hinchamiento, capacidad de retención de agua y capacidad de absorción de moléculas orgánicas de los sólidos procedentes del proceso de licuefacción.
2. Metodología
2.1. Material vegetal
Los frutos de copoazú fueron colectados en estado óptimo de madurez, bajo los lineamientos señalados en la Resolución 1466 del 03 de diciembre de 2014, en el municipio de Belén de los Andaquíes (Caquetá, Colombia); a una altura de 280 m.s.n.m, con temperatura promedio de 28 °C, humedad relativa de 87.2% y precipitación anual de 3,650 mm. Los frutos fueron transportados hasta el Laboratorio de Ciencias Agroalimentarias del Centro de Investigación Nataima de AGROSAVIA (km 9 vía Espinal - Ibagué, departamento del Tolima).
2.2. Obtención de pulpa de copoazú
Los frutos fueron lavados, cortados y desgranados de forma manual. La pulpa de copoazú fue obtenida tras un proceso de despulpado mecánico realizado con una despulpadora de frutas con capacidad de 500 kg/h (marca COMEK, Colombia), separando la pulpa de la almendra 21.
2.3. Tratamiento enzimático
Las enzimas pectinolíticas comerciales estudiadas fueron Rapidase® LIQ Plus (pectinasa, celulasa y hemicelulasa) y Rapidase® Citrus Cloudy (pectinasa) de DSM (Países Bajos). Se tomaron 320 g de pulpa de copoazú que fue mezclada con una cantidad determinada de enzima en la misma proporción (0.02 % p/p) por cada tratamiento (Tabla 1). Las muestras se agitaron constantemente variando el tipo de enzima (Rapidase® LIQ Plus y Rapidase® Citrus Cloudy y mezcla de enzimas (Rapidase® LIQ Plus y Rapidase® Citrus Cloudy) en proporción 50:50), tiempo (2, 3.5 y 5 h) y temperatura de incubación (15, 30 y 45 °C). Posteriormente, la enzima se inactivó calentando la suspensión a 90 °C durante 5 min. El jugo obtenido se centrifugó a 10,000 rpm durante 15 min. El sobrenadante se filtró utilizando papel filtro Whatman Nº 1, el jugo filtrado y la fibra, subproductos de la licuefacción se utilizaron para análisis posteriores. Todos los tratamientos se realizaron por triplicado.
Tabla 1 Tratamientos enzimáticos estudiados
| Nº | Tiempo (h) | Temperatura (ºC) | Enzima |
|---|---|---|---|
| 1 | 5 | 45 | Rapidase® Citrus Cloudy |
| 2 | 2 | 15 | Rapidase® LIQ Plus |
| 3 | 5 | 15 | Rapidase® LIQ Plus |
| 4 | 2 | 45 | Rapidase® LIQ Plus |
| 5 | 5 | 45 | Rapidase® LIQ Plus |
| 6 | 2 | 15 | Rapidase® Citrus Cloudy |
| 7 | 2 | 15 | Rapidase® LIQ Plus |
| 8 | 5 | 15 | Mezcla |
| 9 | 5 | 45 | Rapidase® LIQ Plus |
| 10 | 3.5 | 30 | Mezcla |
| 11 | 2 | 45 | Mezcla |
2.4. Análisis fisicoquímico del jugo de copoazú
Las muestras de jugo de copoazú se analizaron para determinar su acidez (expresada como porcentaje de ácido cítrico) y sólidos solubles totales (°Brix) mediante los métodos descritos en AOAC (2005) 22. El rendimiento porcentual del jugo se calculó dividiendo el peso de jugo filtrado obtenido por el peso inicial de pulpa para el tratamiento enzimático multiplicado por 100 23.
2.5. Análisis de calidad y preparación del subproducto sólido
El subproducto sólido del proceso de licuefacción de pulpa de copoazú se secó en un horno (GALLENKAMP, UK) a 45 °C por 5 h. Posteriormente, se trituró en un molino de cuchillas utilizando un tamiz de 0.5 mm, con el fin de obtener un tamaño de partícula homogéneo que garantice alta solubilidad.
2.6. Capacidad de hinchamiento (CH)
Se pesaron 2.0 g de muestra en una probeta graduada, se adicionaron 10 mL de agua destilada y se agitó manualmente durante 5 min. Esta mezcla se dejó en reposo durante 24 h a temperatura ambiente. Posteriormente, se midió el volumen final (V 1) (mL) de la fibra 24. La CH se calculó mediante la siguiente ecuación:
Donde 𝑉1 es el volumen de la fibra después de absorber agua (mL), 𝑉0 es el volumen inicial de la fibra (mL) y 𝑚0 representa el peso de la fibra seca (g).
2.6.1. Capacidad de retención de agua (CRA)
Se pesaron 0.5 g de muestra en un tubo de centrífuga previamente pesado, se agregaron 10 mL de agua destilada y se agitó durante 10 min. Luego se dejó reposar por 24 h a temperatura ambiente. Después de este tiempo, se centrifugó la muestra a 3,000 rpm durante 10 min, inmediatamente se retiró el sobrenadante y se pesó el sedimento (24). La CRA se calculó mediante la siguiente ecuación:
Donde 𝑚1 es el peso después de la absorción de agua (g) 𝑚0 y es el peso inicial de la fibra seca (g).
2.6.2. Capacidad de absorción de moléculas orgánicas (CAMO)
Se pesaron 0.5 g de muestra en un tubo de centrífuga previamente pesado, se adicionó 10 mL de aceite de girasol comercial y se agitó durante 10 min. Luego se dejó en reposo durante 24 h a temperatura ambiente y se centrifugó a 3,000 rpm durante 10 min; posteriormente, se retiró el sobrenadante y se pesó el sedimento 24. La CAMO se calculó a través de la siguiente ecuación:
Donde 𝑚1 es el peso de la fibra después de la absorción de aceite (g) y 𝑚0 es el peso de la fibra seca (g).
2.7. Diseño experimental
Se generó un diseño experimental que minimizara la varianza de los coeficientes de regresión de primer orden de fracciones de la serie 2k mediante el paquete estadístico Design-Expert software v.13.0.5.0 (Stat Ease Inc., Reino Unido). El análisis de datos se realizó determinado las diferencias en los tratamientos a un nivel del 95% de confianza.
Tabla 2 Tabla resumen diseño experimental
| Factores | Rango de trabajo | Variables de respuesta | |
|---|---|---|---|
| Jugo | Residuo sólido | ||
| Tiempo | 2 h - 5 h | Rendimiento Sólidos solubles Acidez total | Capacidad de hinchamiento (CH) Capacidad de retención de agua (CRA) Capacidad de absorción de moléculas orgánicas (CAMO) |
| Temperatura | 15 °C - 45 °C | ||
| Tipo de enzima | Rapidase® LIQ Plus | ||
| Rapidase® Citrus Cloudy | |||
| Mezcla relación 1:1 | |||
3. Resultados
El rendimiento promedio, contenido de sólidos solubles y acidez titulable del jugo de copoazú extraído enzimáticamente se presentan en la Tabla 3. El coeficiente de regresión lineal y los resultados para términos lineales y de interacción se muestran en la Tabla 4. El análisis estadístico reveló que el modelo propuesto fue adecuado, con valores de R2 satisfactorio para todas las respuestas. Los valores de R2 para rendimiento, sólidos solubles y acidez titulable fueron 0.8375, 0.8185 y 0.9734, respectivamente.
Tabla 3 Efecto del tratamiento enzimático sobre características fisicoquímicas del jugo de copoazú
| Tratamiento | Rendimiento (%) | Sólidos solubles (º Brix) | Acidez (% de ácido cítrico) |
|---|---|---|---|
| 1 | 85.78 | 8.30 | 2.77 |
| 2 | 84.33 | 13.20 | 2.71 |
| 3 | 85.42 | 12.60 | 2.70 |
| 4 | 83.96 | 13.15 | 2.70 |
| 5 | 74.88 | 13.95 | 2.87 |
| 6 | 78.51 | 12.75 | 2.59 |
| 7 | 87.96 | 12.55 | 2.67 |
| 8 | 86.51 | 12.20 | 2.62 |
| 9 | 75.97 | 13.85 | 2.85 |
| 10 | 81.78 | 12.35 | 2.71 |
| 11 | 79.24 | 14.25 | 2.77 |
Tabla 4 Modelo estadístico para la extracción enzimática del jugo de copoazú
| Variables Factores | Rendimiento (%) | Sólidos solubles (° Brix) | Acidez (% ácido cítrico) |
|---|---|---|---|
| Constante | +87.18061* | +13.21744 | +2.6804 * |
| x1Tiempo de acción (h) | +0.19198 | -0.19535 | -3.55260E-003 |
| x2Temperatura (°C) | +0.084693 * | -7.23514E-003* | -1.39789E-003 * |
| x3 Enzima (200g/Ton) | -0.21372 | -8.25581E-004 | -8.90513E-004 * |
| x 1 x x 2 | -0.087098 | +8.73385E-003 | +9.21428E-004 * |
| x 1 x x 3 | +0.066936 * | -5.00000E-003 | -5.05444E-004 * |
| x 2 x x 3 | +5.66667E-004 | +6.68820E-005 * | |
| R2 | 0.8375 | 0.8185 | 0.9734 |
* Significativo al 95% de confianza
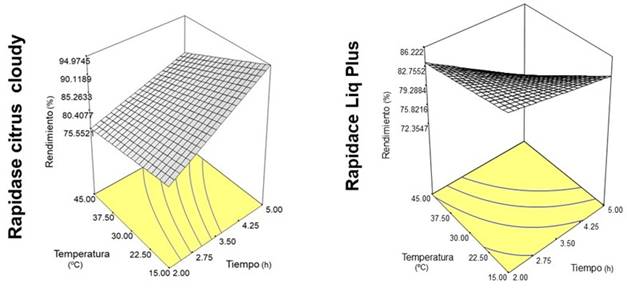
3.1. Efecto del tratamiento enzimático sobre el rendimiento de extracción del jugo de copoazú
El modelo estadístico reveló que el rendimiento se relacionó positivamente con el efecto lineal de la temperatura (p < 0.05) (Tabla 4). También, se observó que existe un efecto de interacción entre el tiempo de incubación y el tipo de enzima (p < 0.05). Autores como 20, reportaron un alto rendimiento (94%) de jugo de copoazú utilizando un tratamiento enzimático con extracto crudo de enzima producida por Aspergillus japonicus 586, temperatura de 50°C y tiempo de incubación de 1 h. El aumento en el rendimiento del jugo se atribuye a la hidrólisis de la pectina que conduce a la reducción de la capacidad de retención de agua de la pulpa, por lo que el agua se libera en el sistema 25.
En la Figura 1, la superficie de respuesta del tratamiento enzimático sobre el rendimiento de extracción del jugo de copoazú muestra un comportamiento ascendente con el tiempo de incubación; para la enzima Rapidase® Citrus Cloudy. Los hallazgos de 17 son comparables con el resultado del presente estudio quienes informaron que el rendimiento del jugo de banano aumenta hasta cierto nivel en el tiempo de incubación. La temperatura y el tiempo de incubación aumentan la actividad enzimática al aumentar la energía cinética dentro de las moléculas y acelera la reacción 26. Los principales componente de la pared celular primaria de pulpas de frutas y vegetales son polisacáridos como celulosa, hemicelulosa, pectinas y agua; el efecto del tiempo de incubación y temperatura fue diferente con la enzima Rapidase® LIQ Plus al mostrar poca influencia en el rendimiento, esto generado por la presencia de enzimas de tipo pectinasa, hemicelulasa y celulasa en este preparado enzimático, que permite diferentes interacciones de los sitios activos de la enzima con la pared celular de la pulpa de copoazú, disminuyendo la energía del estado de transición y una menor energía de activación de las reacciones catalizadas. Los resultados de este estudio indican que la adición de enzimas pectinolíticas aumenta el rendimiento de extracción del jugo de copoazú.
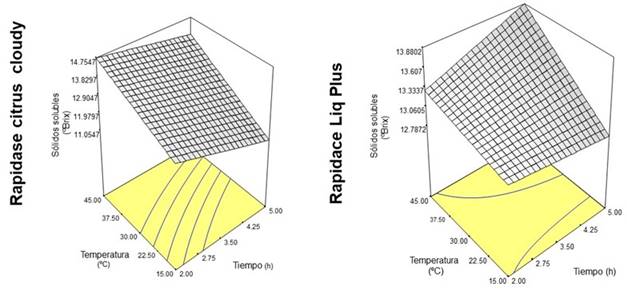
3.2. Efecto del tratamiento enzimático sobre el contenido de sólidos solubles totales del jugo de copoazú.
El tratamiento enzimático aumenta el contenido de sólidos solubles totales (SST) de jugo de diversas frutas. La Tabla 3 muestra que el contenido de SST del jugo osciló entre 8.30 y 14.25 °Brix, siendo el valor más alto con la mezcla de enzimas, a 45 °C y 2 h de incubación; lo cual está relacionado con un mayor grado de degradación de los tejidos, que liberan más compuestos como azúcares y ácidos 9 y la presencia de varias enzimas en diferentes combinaciones aumenta el contenido de SST del jugo 25. Singh et al. 27 utilizaron una mezcla de enzimas (Pectinex Ultra SP. L, Celluclast y Rapidase C. PE) para la licuefacción enzimática del jugo de mango por 2 h a 40 °C. El contenido de SST final (15.4 °Brix) del jugo de mango fue mayor comparado con el contenido de SST inicial (14.4 °Brix) del proceso. En la Figura 2, se presenta el efecto de la interacción de la temperatura y tiempo de incubación sobre el contenido de SST con la preparación enzimática Rapidase® LIQ Plus y Rapidase® Citrus Cloudy. Con la primera enzima, se encontró el mayor contenido de SST a alta temperatura (45 °C) y tiempo de incubación (5 h), tiempo superior al sugerido por la casa comercial quien reporta hasta 3 horas de acción, a temperatura entre 10 y 55 °C y que están altamente influenciadas por las condiciones bioquímicas de la pulpa. De forma similar, el máximo contenido de SST utilizando Rapidase® Citrus Cloudy se alcanzó al mismo nivel de temperatura, siendo un factor determinante en la velocidad de reacción. Sin embargo, las fluctuaciones térmicas y temperaturas fuera del rango tolerable de las enzimas, puede afectar los enlaces químicos en el sitio activo y evitar la unión con los sustratos. No obstante, el mejor tiempo de incubación fue de 2 h. Los resultados muestran que la temperatura de 45 °C provocó un aumento del contenido de SST en todos los tratamientos enzimáticos. También, el tiempo de incubación fue importante en el proceso de licuefacción enzimática. Sin embargo, el comportamiento varió según el preparado enzimático, debido al tipo de enzimas presente en cada uno y la especificidad del sitio activo para unirse con la molécula objetivo del sustrato 9).
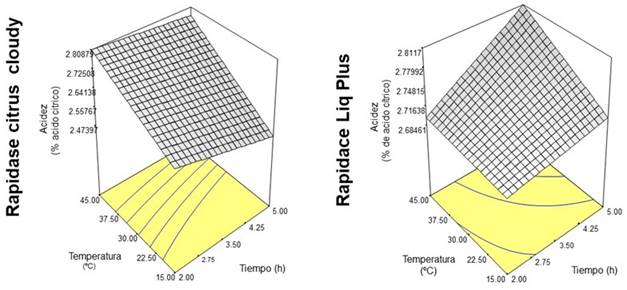
3.3. Efecto del tratamiento enzimático sobre la acidez titulable del jugo de copoazú
Los contenidos de acidez titulable del jugo de copoazú variaron entre 2.59 % y 2.87 % (Tabla 3). El aumento en la acidez titulable debido al tratamiento enzimático fue reportado previamente para copoazú y otras variedades de frutas 18,20. Esto puede atribuirse a la liberación de grupos carboxilo de las moléculas pécticas 27. La Tabla 4 muestra que la acidez titulable se relacionó negativamente con los efectos lineales de temperatura (p < 0.05) y tipo de enzima (p < 0.05). Mientras que los efectos de interacción entre temperatura y tiempo de incubación y entre la temperatura y tipo de enzima fueron positivos (p < 0.05). Los gráficos de interacción entre la temperatura y tiempo de incubación sobre la acidez titulable del jugo con las enzimas Rapidase® LIQ Plus y Rapidase® Citrus Cloudy se muestran en la Figura 3. Con la primera enzima, se obtuvo mayores valores de acidez titulable al ser sometida a tiempos de incubación prolongada (5 h). El pH de la pulpa puede afectar la función enzimática y catálisis de las reacciones. El rango de pH sugerido para las enzimas evaluadas se encuentra entre 3 y 5, la pulpa de copoazú registro valores promedio de pH antes de ser tratada enzimáticamente de 3,22, muy cercana al límite de acidez volátil, que pueden afectar la unión de los sitios activos de las enzimas con el sustrato, prolongando los tiempos de proceso o incluso evitando la generación de productos por la desnaturalización de las enzimas 8. En contraste, el tratamiento enzimático con Rapidase® Citrus Cloudy mostró el máximo valor de acidez titulable a bajo nivel de tiempo de incubación (2 h). En ambos tratamientos enzimáticos se presentaron mayores valores de acidez a 45 °C. Desde el punto de vista del procesamiento, la acidez contribuye al desarrollo del sabor manteniendo una proporción adecuada de azúcar y ácido; y ayuda a actuar como un conservante suave 28.
3.5. Análisis de calidad de la fibra
El subproducto sólido extraído de los tratamientos enzimáticos de la pulpa de copoazú fue utilizado para determinar las características de calidad, obteniendo un porcentaje de fibra dietaría total de 42.48% en base húmeda. Lo cual es superior comparado con la fibra dietaría total en las cáscaras de limón (14.0%), el limón pelado (7.34%), el orujo de pera (44%) y kiwi (26%) 14. Por lo anterior, se infiere que el subproducto seco de la licuefacción enzimática del copoazú es fuente de fibra dietaría que puede ser utilizada como ingrediente funcional en productos alimentarios y farmacéuticos.
Tabla 5 Resultados de pruebas de calidad realizadas a la porción fibrosa de los tratamientos estudiados.
| Tratamiento | CH (g agua/g materia seca) | CRA (g agua/g materia seca) | CAMO (g aceite/g materia seca) |
|---|---|---|---|
| 1 | 3.50 | 3.94 | 2.25 |
| 2 | 3.85 | 1.99 | 1.78 |
| 3 | 3.55 | 3.65 | 1.94 |
| 4 | 2.22 | 2.94 | 1.78 |
| 5 | 2.32 | 3.66 | 2.25 |
| 6 | 2.04 | 2.61 | 1.93 |
| 7 | 2.35 | 2.85 | 1.82 |
| 8 | 2.82 | 3.46 | 1.97 |
| 9 | 3.55 | 3.70 | 1.90 |
| 10 | 3.09 | 3.48 | 2.01 |
| 11 | 2.27 | 2.91 | 1.76 |
3.5.1. La capacidad de hinchamiento (CH)
La capacidad de hinchamiento registrada en los tratamientos de este estudio presentó el subproducto sólidos de la licuefacción enzimática del tratamiento dos como el de mayor capacidad para aumentar su volumen (3.85 g de agua /g de materia seca) (Tabla 4), encontrándose este valor entre el intervalo registrado para fibras dietarías micropulverizadas de maíz (7.1 g de agua /g de materia seca), avena (2.3 g de agua /g de materia seca) y manzana (3.4 g de agua /g de materia seca) las cuales son utilizadas a nivel industrial como aditivo alimentario 24.
3.5.2. La capacidad de retención de agua (CRA)
Se define como la cantidad de agua que es retenida por 1 g de fibras secas en condiciones específicas de temperatura, tiempo de remojo y duración y velocidad de centrifugación 29. La CRA alcanzó valores de hasta 3.94 g de agua / g de materia seca para el tratamiento uno, confirmando la calidad de la fibra estudiada. La capacidad de retención de agua se correlaciona con la cantidad de fibra insoluble y con la granulometría de los coproductos 15. El residuo de copoazú presentó un mayor CRA comparado con el trigo duro (1.5 - 2.1 g de agua / g de fibra) 30. La alta capacidad de retención de agua (CRA) de residuos agroindustriales confiere propiedades tecnológicas que permite su utilización como ingredientes para reducir calorías, evitar la sinéresis y modificar la viscosidad y textura de los alimentos formulados 31.
3.5.3. Capacidad de adsorción de moléculas orgánicas (CAMO)
Es una propiedad tecnológica relacionada con la estructura química de los polisacáridos vegetales y depende de su estructura química y física 15. Los valores obtenidos de CAMO para el subproducto sólido de la licuefacción enzimática de pulpa de copoazú osciló entre 2.25 g de aceite / g de materia seca y 1.76 ml de aceite / g de materia seca según los tratamientos estudiados (Tabla 5), mostrando una baja capacidad de retención de aceite comparado con fibras industriales que alcanzan hasta los 11.7 ml de aceite / g de materia seca. Los resultados de este estudio indican que la fibra dietaría de copoazú tendría poca capacidad para la estabilización de emulsiones y productos alimenticios ricos en grasas debido a su bajo CAMO 29.
4. Conclusiones
La licuefacción enzimática es una estrategia biotecnológica promisoria para la adaptación fisicoquímica y reológica de la pulpa de copoazú, fácilmente implementadas en zonas apartadas donde se produce el fruto y con potencial impacto positivo, haciendo uso de la enzima Rapidase® LIQ Plus, utilizada a 15 °C y un tiempo de incubación de 2 h. Bajo estas condiciones, se obtuvieron rendimientos de 87.96% y un contenido de sólidos solubles totales de 12.55 °Brix del jugo de copoazú. El subproducto sólido procedente de la clarificación enzimática de pulpa de copoazú mostró altos valores de capacidad de hinchamiento y capacidad de retención de agua comparado con diferentes residuos agroindustriales. Adicionalmente, exhibió baja capacidad de retención de aceite. Los resultados del presente estudio sugieren que este residuo tiene alto potencial para ser usado como aditivo alimentario, específicamente como espesante y gelificante, pero no como estabilizante en alimentos ricos en grasas.