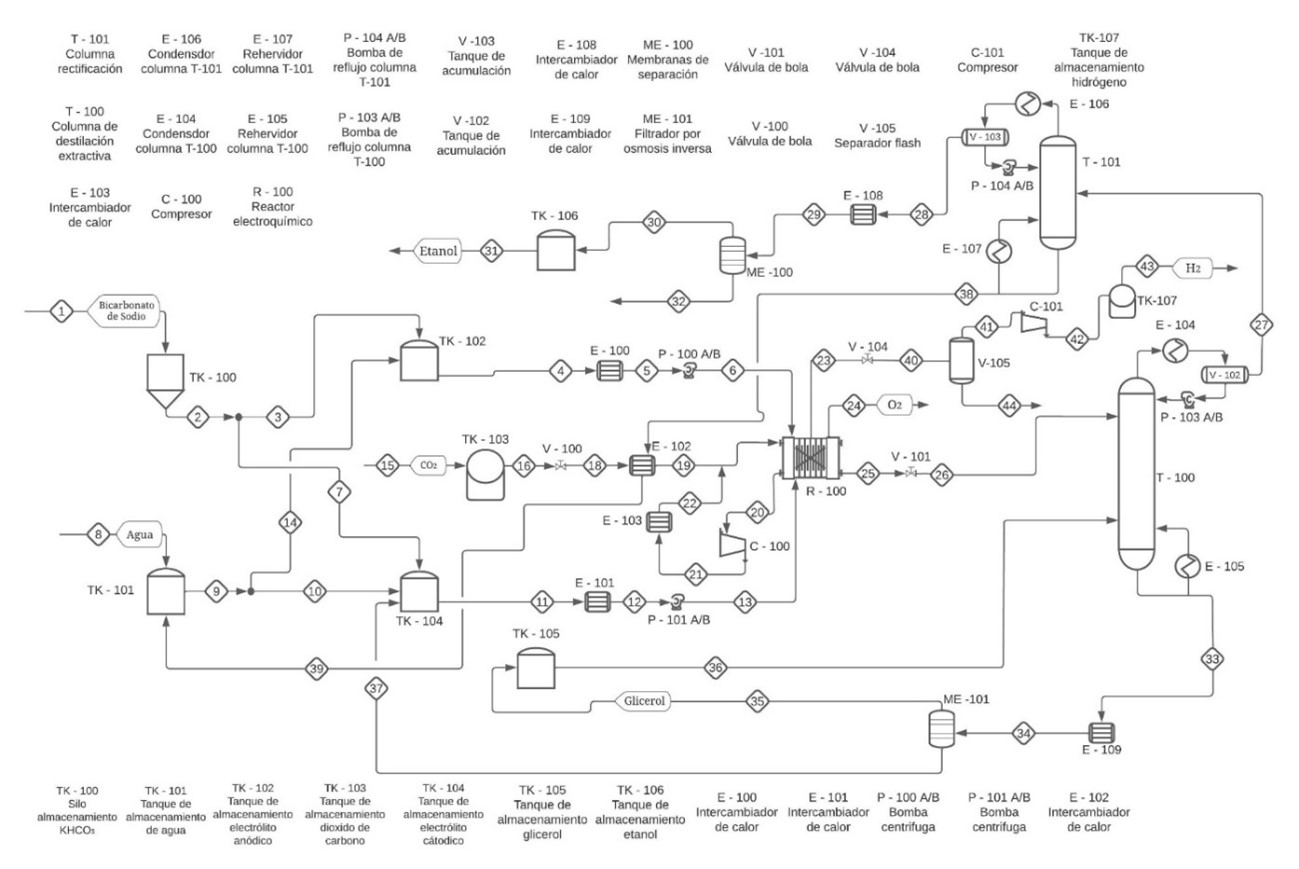
Introducción
En la actualidad las emisiones de gases de efecto invernadero (H2O, CO2, CH4, ozono, N2O y clorofluorocarbonados) traen consecuencias desastrosas para el futuro de la humanidad debido a que estos gases ocasionan un desequilibrio natural del clima del planeta, generando periodos prolongados de lluvia o sequía, además de incendios forestales e incremento en los niveles de los océanos, entre otros. Vaidyanathan 2, afirma que el dióxido de carbono es el gas de efecto invernadero que tiene el periodo de vida más extenso, por ello se ha convertido en el foco de estudio de cientos de investigaciones y proyectos para evitar que sus niveles de concentración en la atmósfera sigan incrementando y poder generar con esto un cambio a largo plazo de la calidad de vida de las personas.
Los principales sectores causantes de las emisiones de dióxido de carbono son el sector industrial y el de producción eléctrica, en este último se emitieron cerca de 35.7 Gt de dióxido de carbono en el mundo durante el 2016 por la quema de combustibles fósiles, tales como, carbón o el gas natural, esto debido a que es la forma menos costosa y más confiable para generar electricidad. Sin embargo, la quema de combustibles fósiles es una de las causantes de que los niveles de concentración de CO2 en la atmósfera lleguen a superar los 410 ppm, niveles que no se habían alcanzado en la tierra desde hace 3 millones de años en una época en donde el nivel de los océanos era 15 metros superior a los conocidos hoy en día.
Según el Ministerio de Ambiente y Desarrollo Sostenible en Colombia 3, el sector industrial fue responsable del 20% de las emisiones de gases de efecto invernadero totales en el país, de las cuales el 80% de ellas corresponden a dióxido de carbono. En la industria, el CO2 se genera a partir de los procesos de fermentación, plantas de tratamiento de aguas y combustión de material fósil en calderas, hornos, turbinas de gas, entre otros.
Particularmente, los procesos fermentativos para la producción de bioetanol emiten millones de toneladas de CO2 cada año. Según el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM), en el Valle del Cauca se emiten anualmente cerca de 12.95 millones toneladas netas, debido a que el 50% de los productos finales del proceso corresponde al dióxido de carbono 4.
Teniendo en cuenta que los procesos de captura y almacenamiento de CO2 conllevan dificultades económicas, legales y geográficas, expertos han estudiado la posibilidad de aprovechar las emisiones de dióxido de carbono como insumo para obtener productos de valor agregado. Entre las técnicas estudiadas actualmente, se encuentra la electroquímica la cual ha ganado preferencia por la diversidad de compuestos que se pueden obtener y las ventajas del control que se puede ejercer sobre las reacciones involucradas a través del ajuste de potenciales del electrodo.
Yaashikaa 5 afirma que la reducción electroquímica del dióxido de carbono es un proceso multietapa en donde generalmente se involucran dos, cuatro u ocho rutas de electrones. Este proceso ocurre en ambientes cercanos a la interfase del electrodo y consiste en tres pasos principales: a) el CO2 es absorbido químicamente por el catalizador, b) se transfieren electrones para formar enlaces carbono-oxígeno o carbono-hidrógeno y c) por último se reorganizan los productos formados para liberarse de la superficie del catalizador y difundirse en el electrolito o solvente. De la cantidad de electrones transferidos depende el producto a obtener de la reacción.
A pesar de que esta técnica es altamente estudiada con el fin de incrementar la conversión del producto deseado variando las aleaciones del material de electrodo o tipos de electrolitos, actualmente no se ha llevado a cabo a gran escala ya que que desconoce la rentabilidad de este proceso. Debido a ello, el propósito de este estudio es medir la viabilidad tecno-económica de la producción del etanol carburante a partir del dióxido de carbono por medio de un proceso electroquímico.
Metodología
Cinética electroquímica
De acuerdo con Yuan 1, la reacción electroquímica de reducción del dióxido de carbono a etanol, tiene lugar de la siguiente forma:
Compartimiento anódico
Compartimiento catódico
Otras reacciones que ocurren en el sistema por causa de la disociación del bicarbonato de potasio son las siguientes
Simulación en Aspen Plus
Los procesos electroquímicos son aquellos que consisten en reacciones de oxidación - reducción en donde la energía liberada por una reacción espontánea es convertida en electricidad para hacer que una reacción no espontánea se lleve a cabo. En Aspen Plus V11 se tuvieron en cuenta ciertos factores en el desarrollo y simulación del proceso, principalmente en su configuración, en la cual hay que tener presente los iones como un flujo de componente para que actúen directamente en la reacción. En el apartado de Elec Wizard se especifican los componentes involucrados (H2O, H+, O2, CO2, C2H5OH, KHCO3), reacciones de equilibrio, como las de desionización, el tipo de ion hidrógeno que actúa en el componente cinético (H+) y el método termodinámico (ELECNRTL) debido a que es el método con propiedades electrolíticas más versátil y usado para bajas concentraciones.
En la Figura 1 se ilustra el proceso, el cual inicia con una sección de dilución del bicarbonato de potasio para cada una de las cámaras electroquímicas, las cuales se consideraron en bloques separados para especificar las reacciones que ocurren en cada una de ellas. En el ánodo ingresan 20,953.2 kmol/h de una solución de KHCO3 a una concentración de 0.29 molar, para generar la oxidación del electrolito y producir H+ el cual es transportado a través de una membrana polimérica Nafion 117 hacia la cámara catódica en donde ingresan 32,964.4 kmol/h del electrolito a una concentración de 0.6 molar. Al cátodo ingresan también 214.08 kmol/h de dióxido de carbono para llevar a cabo la reducción obteniendo etanol y H2. El hidrógeno producido (43.89 t/día) es concentrado por medio de un separador Flash y almacenado en un tanque a 15 MPa para su posterior venta. Por otro lado, los productos líquidos son transportados hacia una columna de destilación extractiva que utiliza glicerol como solvente en donde se recupera el etanol, este entra a una columna de rectificación y por último es concentrado con un separador de membranas, obteniendo un flujo de 105.36 t/día de etanol al 99% v/v. Por otro lado, el glicerol se recupera por medio de osmosis inversa para ser reincorporado al proceso nuevamente.
Estimación de costos
Para la estimación de costos de operación y capital se usó el programa Aspen Process Economic Analyzer (APEA), tomando como punto de partida la estimación de costos de los equipos realizado en Aspen Plus V11. Se consideró que la inversión total de capital se cubre con un préstamo para ser amortizado y cancelado durante la vida operativa del proyecto (10 años), a una tasa de interés del 15% anual. Las condiciones estimadas para la viabilidad económica del proyecto como los costos operativos y de materia prima especificadas en el APEA se muestran en la Tabla 1.
Tabla 1 Condiciones para análisis económico en Aspen Process Economic (APEA)
| Parámetros económicos generales: | |
|---|---|
| Año base | 2022 |
| Vida de la planta | 10 años |
| Horas de operación anual de la planta | 8,280 |
| Tasa de interés anual | 15% |
| Tasa de impuestos | 30% |
| Valor de salvamento | 10% |
| Capital de trabajo | 10% |
| Costos de materia prima: | |
| Agua | $0.177/t |
| Glicerol | $1.85/kg |
| KHCO3 | $1.19/kg |
| Membrana de Nafion N117 | $221/m2 |
| Costos de servicios industriales: | |
| Electricidad | $0.08/kW h |
Resultados y discusión
Cinética electroquímica
Para hallar la cinética asociada a la reducción electroquímica del dióxido de carbono a etanol, se considera solo la reacción cinética en el compartimiento catódico ya que según Mbah 6 es donde se experimenta significativamente la polarización de la celda. El desarrollo de la cinética se realizó mediante los datos del experimento preliminar descrito por Yuan 1, para esto se tuvo en cuenta una densidad de corriente jo igual a 2.36x10-4 mA/cm2, un coeficiente de transferencia α igual a 0.5; n=1, relación área volumen (S) de 0.08 cm2/cm3, un sobrepotencial catódico 𝜂𝑐 igual a 0.34V y concentración de saturación de CO2 igual a 3.9293x10-5 mol/cm3. Ya que la velocidad de reacción en procesos electroquímicos depende solamente de la concentración del soluto 7, se asume una cinética homogénea de primer orden, expresada en términos de la ecuación de Butler Volmer para altos sobrepotenciales, se tiene:
Por igualación de términos se obtuvieron los valores para el factor pre-exponencial ko=8.8306x10-6s1, energía de activación Ea= -44.1118 kJ/mol. Dado que la Ec. (6) involucra la concentración del CO2 en la pared del electrodo, fue necesario encontrar una relación entre dicha concentración y la concentración del dióxido de carbono en el seno del fluido, al usar la Ley de Fick, ilustrada en la Ec. (7), que describe el comportamiento de la concentración del CO2 desde una zona de alta concentración (pared del electrodo) a una región de baja concentración (seno del fluido), se obtiene:
Para desarrollar la Ec. (7), se estimó un espesor de la capa límite de concentración similar al espesor de la capa límite hidrodinámica, ya que la concentración en el seno del fluido será siempre constante en el límite hidrodinámico. Se define el espesor de la capa límite hidrodinámica (𝛿), como:
Teniendo en cuenta que el espesor de la capa límite hidrodinámica, se define como la distancia perpendicular del electrodo, hasta el punto donde la velocidad del fluido es el 99% de la velocidad en el seno del fluido, el valor para el espesor de la capa límite corresponde a 5.6747x10-4 (m) y a una velocidad V∞=0.3 m/s (Figura 2).
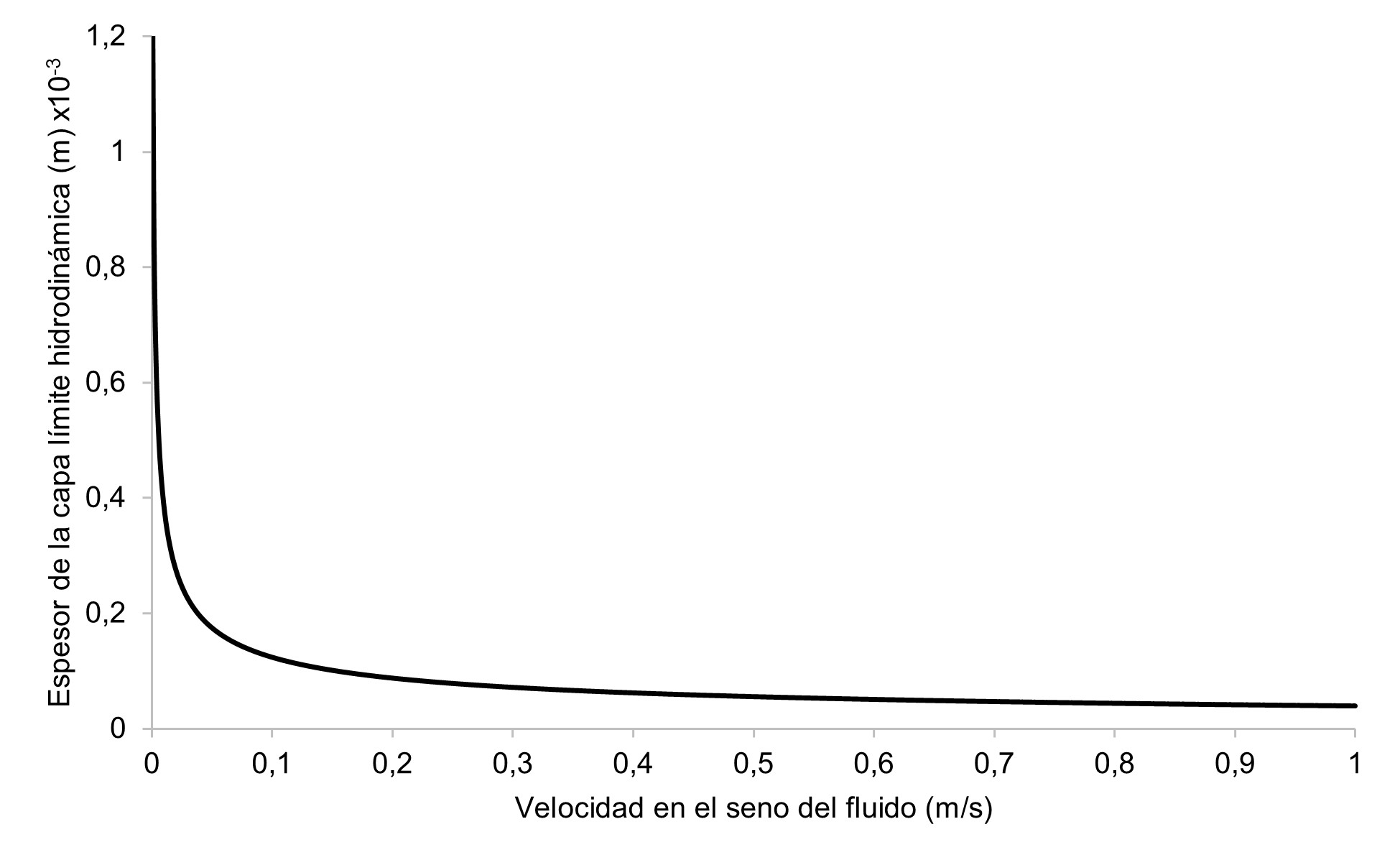
Figura 2 Variación del espesor de la capa límite hidrodinámica y la velocidad en el seno del fluido.
Por medio de la Ec. (7), se obtuvo la concentración del dióxido de carbono en la pared del electrodo, Cw CO2=4.0967 mol/m3. Esto dio como resultado una cinética de orden cero para la electrorreducción del CO2 a etanol igual a rCO2=460.2401 s-1. Al tener una cinética de este orden, la velocidad de reacción está determinada por la concentración en la pared del electrodo y limitada por su área superficial.
Finalmente, para determinar el consumo energético de la celda electroquímica, se empleó la Ec. (9):
Para resolver la Ec. (9) se consideraron los potenciales anódico y catódico de equilibrio: Eeqanó=1.230V y Eeqcát=0.135V, el sobrepotencial anódico obtenido por Wu et al 8 𝜂anódico =0.537V y el catódico de Yuan 1 𝜂catódico = -0.250V y la resistencia ohmnica de la membrana Nafion117 reportada por Xu et al 9 Rohm =0.4 Ωcm2. Teniendo en cuenta estos valores, se obtuvo que Vcelda =1.384 V. Este valor de potencial de celda es comparable con lo reportado por Kauffman 10 en la electroreducción de dióxido de carbono en diferentes alcoholes e hidrocarburos en donde Vcelda = 1.480 V.
De acuerdo con la ley de ohm y la corriente dada por Yuan 1 I= 4.571 mA/cm2 tuvo una potencia de la celda de 1,581 mW.
Bloque de reacción
En la simulación el reactor electroquímico se consideró en dos unidades, un reactor estequiométrico para la cámara anódica, en donde sucede la oxidación del agua conforme la Ec. (1). Y para la cámara catódica se consideró un reactor cinético tipo CSTR en el que se llevó a cabo la reacción de reducción del CO2 (Ec. (2)) y se genera H2 como producto no deseado (Ec. (3)).
Las tres principales condiciones de operación que afectan directamente el proceso son la presión, la temperatura y el pH de las cámaras electroquímicas; para fines del presente estudio se analizaron las condiciones del cátodo debido que en este se lleva a cabo la reacción de interés y conforme a sus resultados se replicó las mismas condiciones para el ánodo (1 MPa, 25°C y pH 8.1) que fueron determinadas bajo factores como la solubilidad del CO2 y las concentraciones de especies iónicas como el carbonato. Al finalizar la simulación se obtuvo una conversión del 98.74% y una selectividad del 8.85% la cual se debe a factores estequiométricos de la reacción que favorece mayor producción molar de agua tal y como se demuestra en la Ec. (2).
Efecto de la presión y la temperatura
Según Zhang 11 en las soluciones iónicas la relación temperatura y presión influye directamente en la transferencia de masa, de tal forma que a presiones bajas la solubilidad decrece con el aumento de la temperatura y a presiones altas la solubilidad decrece con la disminución de la temperatura.
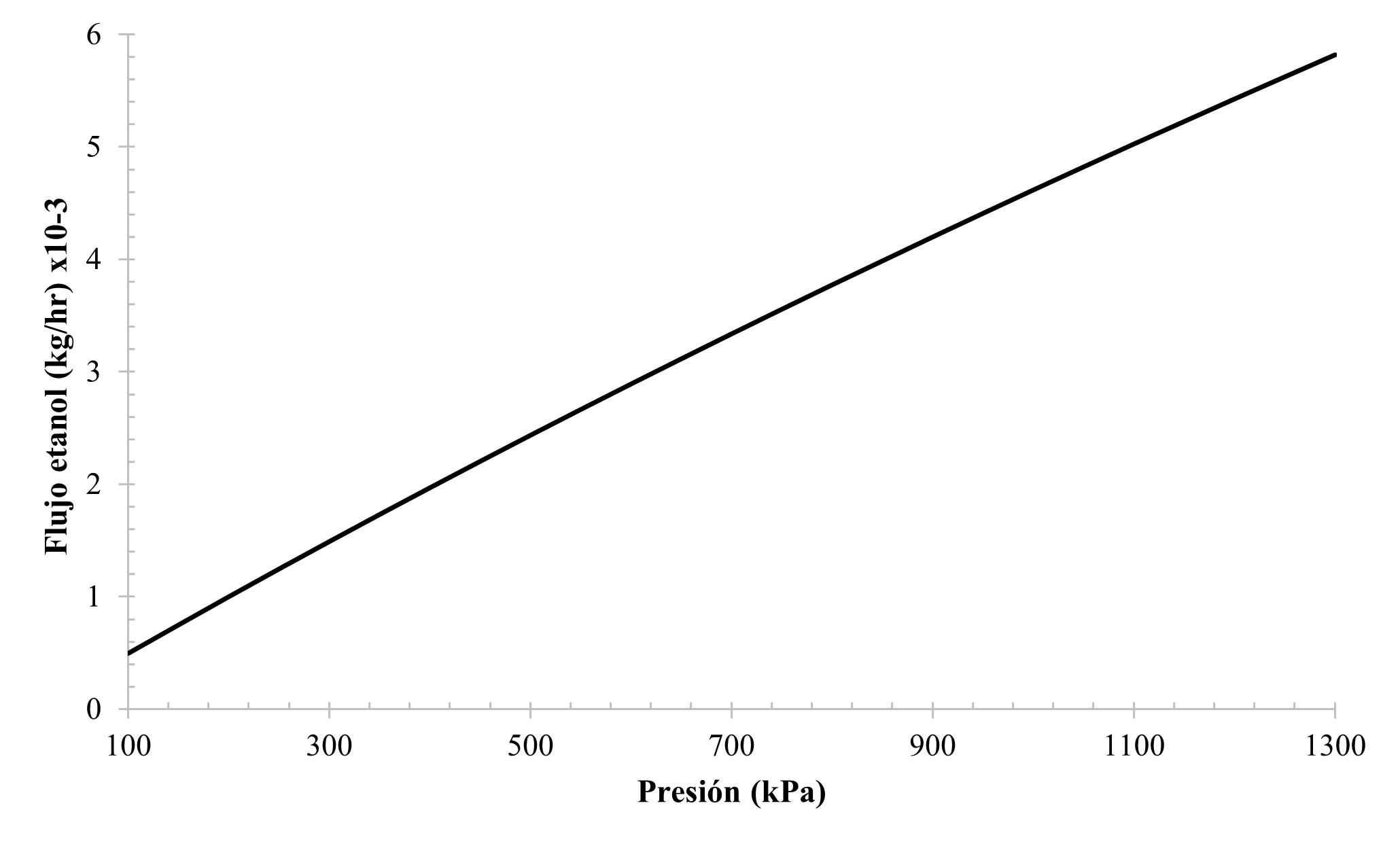
Al realizar un análisis de sensibilidad en el simulador, se varió la presión al interior del bloque del compartimiento catódico de 100 a 1,300 kPa, se encontró que el flujo másico de etanol es directamente proporcional (Figura 3), esto se debe al aumento de la solubilidad del CO2 en la fase líquida. La presión en sistemas electroquímicos aumenta la concentración de CO2 en el seno del fluido incrementando así la conversión de la reacción 12.
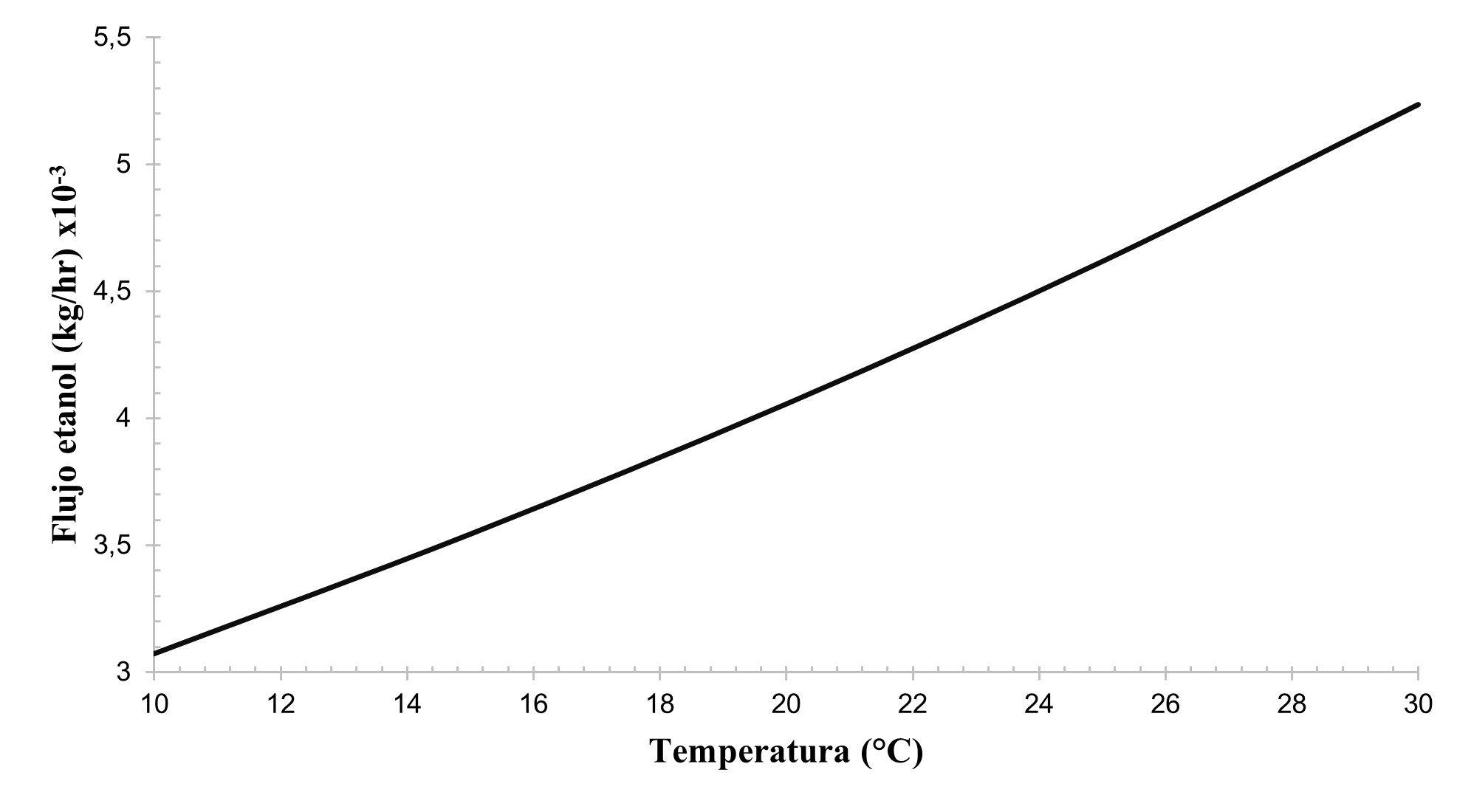
En la Figura 4 se ilustra que a medida que aumentó la temperatura incrementó el flujo másico de etanol en el producto, pero su afectación en el flujo fue 26 veces menor a la relacionada con el efecto de la presión, por ello no se tuvo en cuenta la variación obtenida por la temperatura en la elección de las condiciones operativas del reactor. Loodts 13 encontró que a temperatura ambiente (20°C a 30°C) su afectación genera variaciones solo por decimales y por ello no es necesario controlar esta variable.
Efecto del pH
Controlar el pH de la cámara catódica asegura la presencia o ausencia del ion bicarbonato (HCO3 2-) el cual actúa en las reacciones en equilibrio (Ec. (4)). Según Morrison et al 12 al mantener un pH básico alrededor de ocho aseguró la mayor existencia del ion bicarbonato y con eso a medida que disminuye el pH se obtiene una mayor conversión (Figura 5).
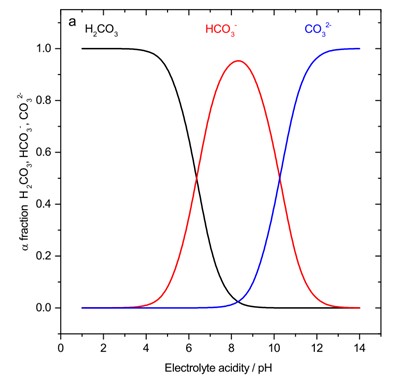
Figura 5 Variación de la fracción de los iones con respecto al pH. Extraída de Morrison et al (2019).
Por otro lado, Morrison et al 12 afirmó que factores como la presión y la concentración de la sal influye en la variación del pH, a mayor concentración del bicarbonato de potasio (KHCO3) se incrementa el pH del electrolito catódico. Con presiones entre 100 a 1,000 kPa se obtuvo un pH aproximado de ocho, partiendo del análisis realizado en la sección 3.2.1. en donde se observó que a mayores presiones aumenta la solubilidad del CO2, se decidió operar el cátodo a 1,000 kPa.
Bloque de separación
Para la separación y purificación del etanol se llevó a cabo un proceso de destilación extractiva debido a que es utilizada para mezclas binarias azeotrópicas; para la elección del solvente se debe tener en cuenta factores como la solubilidad, toxicidad y costos, además, según López 14 el agente material de separación debe cumplir con algunas de las siguientes características: habilidad para alterar el equilibrio de la mezcla, alta capacidad para disolver los componentes a separar, baja volatilidad y buena separabilidad para su posterior recuperación. Teniendo en cuenta los anteriores criterios, en un estudio realizado por Guerra et al 15 se determinó que el etilenglicol es el solvente con las mejores características, sin embargo, para el actual estudio se decidió tomar como prioridad el valor de compra, por ello se determinó el glicerol como agente separador durante el proceso al ser un 24% más económico que el etilenglicol y fue el segundo con mejores características de separación según Guerra et al 15.
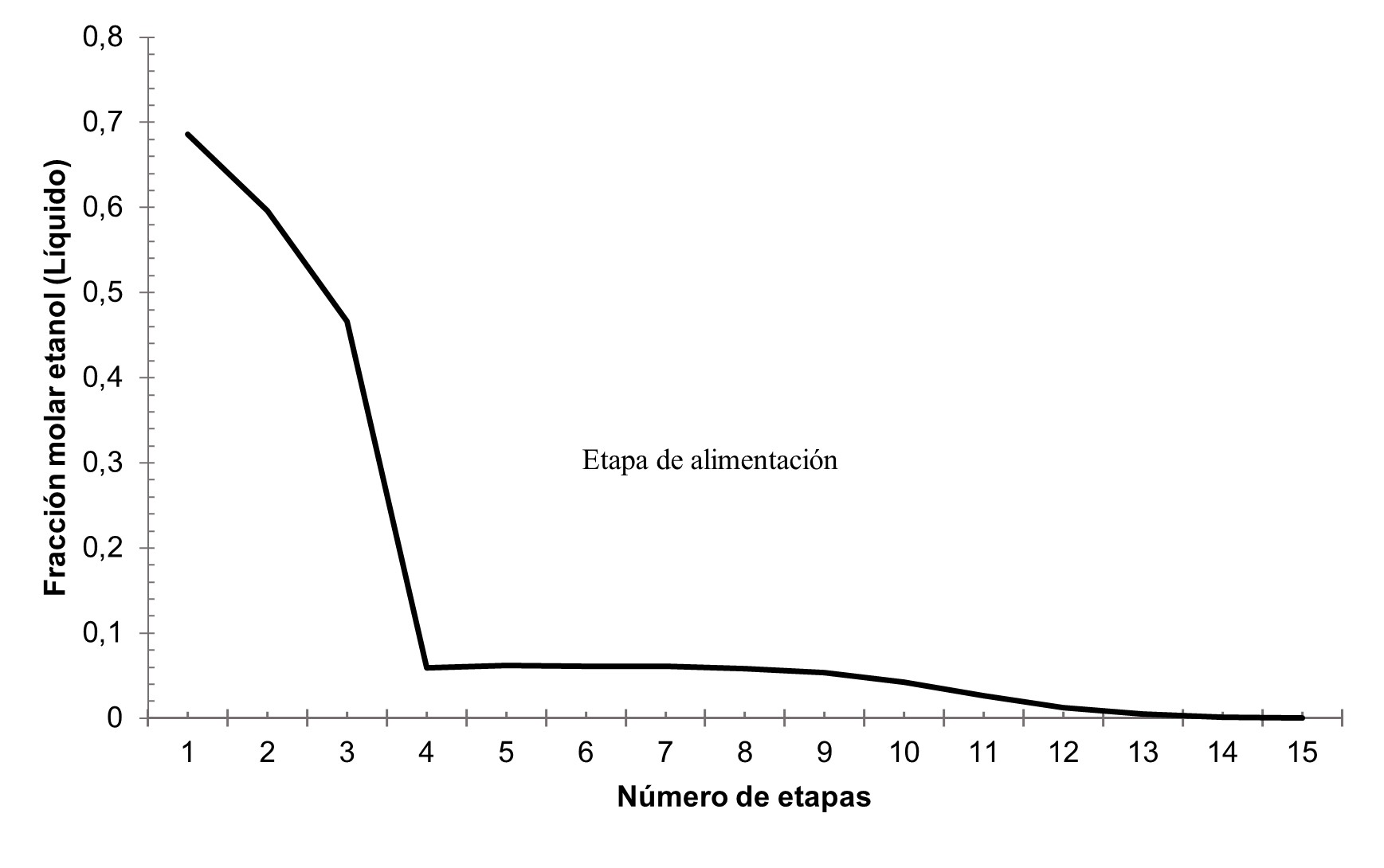
A partir del comportamiento de la fracción molar del etanol en el líquido a lo largo de la columna, ilustrado en la Figura 6, la concentración se acercó a cero en la etapa 14 obteniendo el valor mínimo en la etapa 15, partiendo de esa idea, tener un mayor número de etapas sobredimensionaría la columna. Según Uyazán et al 16 a medida que la etapa de alimento se acerca al rehervidor aumenta los gastos energéticos de la columna, por ello, se alimenta a etapas cercanas al condensador.
Priorizando el ahorro de gastos energéticos de la columna, se realizó el análisis del costo de vapor del rehervidor con respecto a la relación de reflujo ilustrado en la Figura 7 en donde se observa que ambas variables son directamente proporcionales, sin embargo, el cambio total de la variación de la relación del reflujo influyó solo un 5.5% en costo de vapor del rehervidor, por lo tanto, no se considera un factor decisivo para determinar el valor operativo de la columna. Uyazán et al 16 afirma que valores de la relación de reflujo de 0.6 satisface condiciones como la composición del destilado y gastos energéticos, debido a ello se optó por determinar este valor para el desarrollo de la columna extractiva.
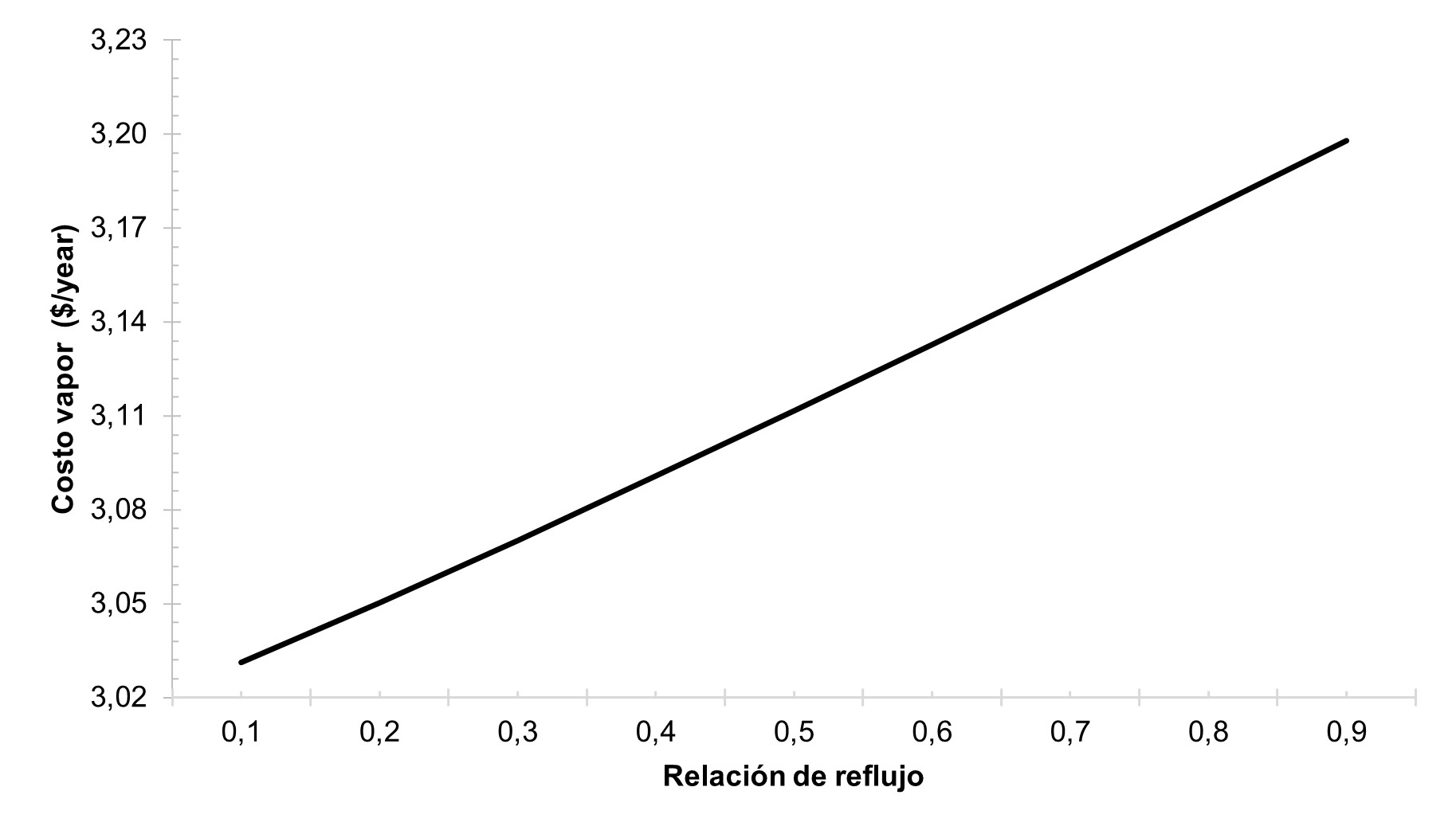
Figura 7 Variación del costo del vapor del rehervidor en millones de dólares con respecto a la relación de reflujo.
De la columna extractiva se obtiene un flujo de destilado con una concentración molar de etanol de 0.6; el cual entra a una columna de rectificación y después a un separador de membrana para llegar a un flujo másico de etanol de 4,390.18 kg/h y una concentración molar de 0.99.
Por último, para la recuperación del solvente se propuso una separación mediante osmosis inversa, un proceso en el cual se reduce el caudal a través de una membrana semipermeable que utiliza una presión osmótica para lograr separar sustancias que se encuentren mezcladas con el agua. El factor de separación fue tomado de estudios realizados por Mah et al 17 que afirma que el mayor permeado obtenido fue de 99.81% para separar glicerol de una solución acuosa.
Análisis económico
La Tabla 2 muestra la descomposición de los costos para la planta de producción de etanol a partir de dióxido de carbono, el costo total del proyecto es de USD$68,166,093 millones. Los costos de operación y mantenimiento son USD$1,128,150 millones por año. Los costos operativos incluyen: gastos por materiales para el proceso, servicios industriales, mano de obra, mantenimiento de equipos, gastos generales, pólizas de seguros, entre otros.
Tabla 2 Análisis económico de la electroreducción de CO2 a Etanol (en USD$)
| Costo total del proyecto | 68,166,093 |
|---|---|
| Costo total de materia prima | 458,909 |
| KHCO3 | 924 |
| Glicerol | 435,236 |
| Agua | 22,749 |
| Costo venta Etanol - H2 | 145,361,944 |
| Costo total de servicios industriales | 12,768,632 |
| Costo total de mantenimiento y mano de obra | 1,343,430 |
| Mantenimiento | 1,128,150 |
| Mano de obra | 173,880 |
| Supervisión | 41,400 |
| Gastos generales | 651,015 |
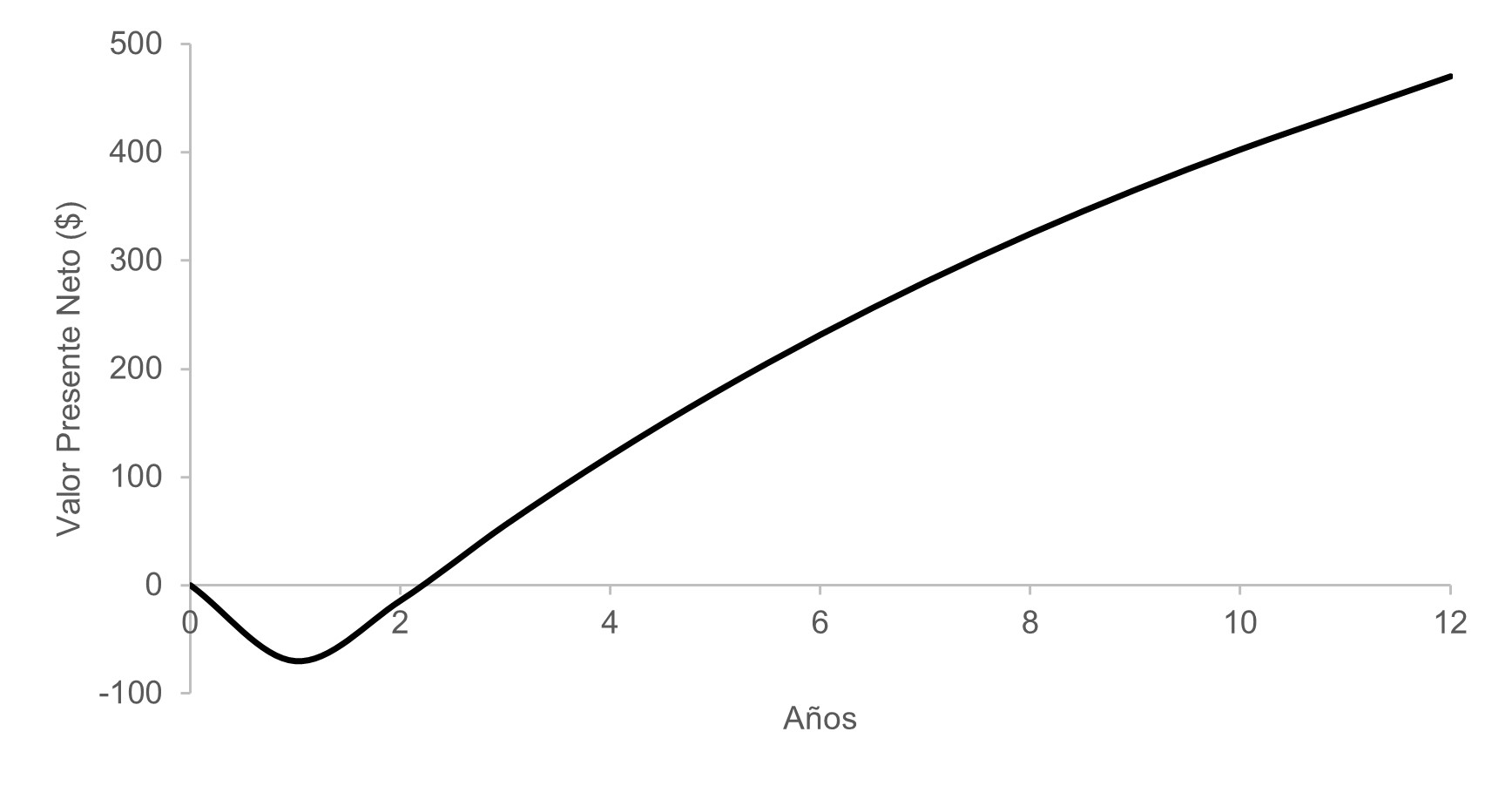
Para verificar la prefactibilidad económica del proyecto se realizó el cambio del Valor Presente Neto en el tiempo. De acuerdo con la Figura 8 el punto de equilibrio se alcanza a los 2.20 años de iniciado el proyecto. La Tasa Interna de Retorno (TIR) del proyecto es de 85.18%, lo que convierte el proceso viable económicamente.
Conclusiones
A partir de los datos cinéticos reportados por Yuan 1 y validados en el presente estudio, se diseñó un proceso electroquímico para obtener 135.44 m3/día de etanol y 12,232.92 m3/día de hidrógeno a partir de CO2 empleando el simulador Aspen Plus V11. Se encontró que la producción de alcohol carburante a partir de dióxido de carbono usando como electrolito una solución acuosa de bicarbonato de potasio es viable técnica y económicamente. El proyecto tendría un valor de inversión cercano a USD$68 millones, materia prima USD$458,909 y una venta anual de etanol e hidrógeno de USD$145,361,944, como análisis de inversión se logró una TIR igual al 85.18% y un retorno de inversión a partir de los 2.20 años de iniciado del proyecto.
Se determinó la expresión cinética de orden cero rCO2=460.2401 s-1 la cual se ajusta a los parámetros experimentales y tiene en cuenta los comportamientos físicos que ocurren durante la reacción. De acuerdo con esto, se estableció mediante análisis de sensibilidad las condiciones de operación del proceso según la transferencia de masa, desionización de sales, costos de servicios industriales y materias primas para obtener una conversión de 98.74% y una selectividad de 8.85% que corresponde a un flujo másico de etanol al 99% de 4.390.18 kg/h.