Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.12 no.1 Manizales Jan./Dec. 2008
José F. Ospina-Arango1
Fabricio I. Pardo-Rodríguez1
Ricardo Álvarez-León1
*Recibido 25 de julio de 2007, aceptado 24 de junio de 2008.
1Fundación Maguaré. Manizales (Caldas), Colombia. alvarez_leon@hotmail.com
Se describe el estado de madurez gonadal de algunas especies ícticas presentes en la Bahía de Cartagena. Se recolectaron 1431 individuos pertenecientes a 79 especies, durante el período de 10 meses, registrando 11 nuevas especies para el área de estudio. Se encontró una proporción hembra-macho de 1,4:1, 270 juveniles y 68 indiferenciados. De acuerdo a la distribución porcentual, se hizo una relación con respecto a la proporción hembra-macho de las 18 especies más significativas y representadas por: Haemulon bonariense (17,93%) 1,09:1, 2 juveniles y 1 indiferenciado; Elops saurus (14,1%) 1:4,6 y 162 juveniles; Scomberomorus brasiliensis (9,77%) 1:2,1 y 2 juveniles; Cathorops spixii (7,19%) 6,91:1, 4 juveniles y 4 indiferenciados; Archosargus rhomboidalis (4,54%) 1:1,37; Chloroscombrus chrysurus (4,12%) 1:1,9, 2 juveniles y 17 indiferenciados; Bagre marinus (3,42%) 3:1; Oligoplites saurus (2,72%) 2,5:1, 2 juveniles y 1 diferenciado; Caranx latus (2,3%) 1 hembra y 32 juveniles; Mugil tricodon (2,16%) 8,3:1, 1 juvenil y 1 indiferenciado; Opisthonema oglinum (2,02%) 1,87:1; Mugil liza (1,61%) 1,4:1 y un juvenil; Centropomus undecimalis (1,61%) 1:1,5 y 2 juveniles; Ariopsis bonillai (1,4%) 4:1, 1 juvenil y 1 indiferenciado; Gerres cinereus (1,33%) 3,4:1, 2 juveniles y 2 indiferenciados; Scomberomorus cavalla (1,33%) 1:1 y 1 juvenil; Caranx hippos (1,19%) 17 juveniles, Trichiurus lepturus (1,12%) 6,5:1 y 1 indiferenciado.
Peces, estado madurez gonadal, pesca experimental, Bahía de Cartagena, Colombia.
This research describes the gonadal maturity stage of some fish species of the Cartagena Bay, with the recollection of 1431 individuals, belonging to 79 species, during a 10-month period, with 11 new species reported in the study area. A female-male ratio of 1.4:1 was found, as well as 270 in juvenile stage and 68 in an undetermined stage. According to percentage distribution, the female-male ratio was recorded for the 18 most representative species as follows: Haemulon bonariense (17.93%) 1.09:1, 2 juveniles and 1 undetermined; Elops saurus (14.1%) 1:4.6 and 162 juvenile; Scomberomorus brasiliensis (9.77%) 1:2.1 and 2 juveniles; Cathorops spixii (7.19%) 6.91:1, 4 juveniles and 4 undetermined; Archosargus rhomboidalis (4.54%) 1:1.37; Chloroscombrus chrysurus (4.12%) 1:1.9, 2 juveniles and 17 undetermined; Bagre marinus (3.42%) 3:1; Oligoplites saurus (2.72%) 2.5:1, 2 juveniles and 1 undetermined; Caranx latus (2.3%) 1 female and 32 juveniles; Mugil tricodon (2.16%) 8.3:1, 1 juvenile and 1 undetermined; Opisthonema oglinum (2.02%) 1.87:1; Mugil liza (1.61%) 1.4:1 and 1 juvenile; Centropomus undecimalis (1.61%) 1:1.5 and 2 juveniles; Ariopsis bonillai(1.4%) 4:1, 1 juvenile and 1 undetermined; Gerres cinereus (1.33%) 3.4:1, 2 juveniles and 2 undetermined; Scomberomorus cavalla (1.33%) 1:1 and 1 juvenile; Caranx hippos (1.19%) 17 juveniles, Trichiurus lepturus (1.12%) 6.5:1 and 1 undetermined.
Fish, gonadal maturity stage, experimental fishing, Cartagena Bay, Colombia.
INTRODUCCIÓNLa Bahía de Cartagena, está situada al sur del Mar Caribe entre los 10° 16" y los 10° 26" N y los 75° 36" W (PAGLIARDINI et al., 1982) (Fig. 1).
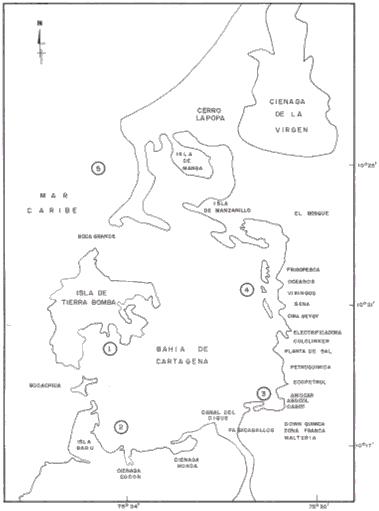
Se considera por definición geológica una Bahía (SCHAUS, 1974); sin embargo tiene una fuente significativa de aguas fluviales provenientes del Canal del Dique, que aporta aguas del Río Magdalena por el extremo sur de la Bahía; orientadas en tal forma que el aporte fluvial afecta a la Bahía dependiendo de la época del año. Presenta dos (2) entradas de renovación de aguas oceánicas, Bocachica y Bocagrande (URBANO-ROSAS, 1992).
La Bahía de Cartagena se encuentra conectada con el mar de manera permanente y se encuentra influenciada por las condiciones climáticas e hidrográficas locales, posee un área aproximada de 72 km2 y una profundidad media de 21 m, lo que la convierte en un semi-embalse de 1.600 millones de m3 de agua, que poseen un importante aporte de residuos contaminantes (GARAY-TINOCO, 1986).
La Bahía de Cartagena de diciembre a abril está sometida al régimen de los vientos que soplan regularmente del nordeste con una intensidad importante lo que determina una estación seca; de septiembre a noviembre los vientos disminuyen su intensidad dando lugar a una estación húmeda; presenta un período de transición de mayo a agosto, con altas temperaturas y algunas lluvias de poca intensidad (ANDRADE-AMAYA et al., 1988).
La Bahía posee relictos coralinos de poca extensión, dentro de los cuales se encuentran las siguientes especies: Porites porites, Agaricia spp, Meandrina meandrites, Acropora cervicornis, A. palmata, Montastrea spp, encontrándose tanto en los bajos como en la parte supra-litoral de las orillas bordeadas por las terrazas arrecifales del Cuaternario (PAGLIARDINI et al., 1982).
Las lagunas costeras, ciénagas y bahías albergan una gran variedad de especies que las utilizan como áreas de protección, crianza y alimentación, y es por esta razón que durante las diferentes épocas de muestreo se evidencia su presencia (YAÑEZ-ARANCIBIA et al., 1980; YAÑEZ-ARANCIBIA & SÁNCHEZ-GIL, 1986).
La madurez sexual en los peces marinos del Caribe colombiano, se ha determinado en algunas de las especies de mayor interés pesquero y comercial, proporcionando valiosa información que, como en el caso de la acuicultura, permiten un adecuado manejo en confinamiento. Otras circunstancias diferentes y ajenas al comportamiento biológico de los peces, ha sido evaluada parcialmente tratando de establecer el impacto en dichos organismos, fenómenos como el de la contaminación incidental o crónica de ecosistemas costeros (ÁLVAREZ-LEÓN, 1985).
Precisamente ante un incidente ocurrido en la Zona Industrial de Mamonal, al vertirse accidentalmente a la Bahía de Cartagena la sustancia química Clorpirifos, la autoridad ambiental programó una serie de estudios de evaluación sobre los efectos inmediatos y a corto plazo en la ictiofauna residente y visitante. Para el primer objetivo, realizó una serie de bioensayos, y para el segundo faenas de pesca, así como estudios que como el presente, permitieron evaluar el estado de las poblaciones de peces, tradicionalmente aprovechadas artesanalmente (ÁLVAREZ-LEÓN, 1998).
La evaluación de la madurez sexual se ha realizado mediante diferentes métodos definidos en las décadas de los 70 y 80. Básicamente se basan en: (1) la determinación de estados gonadales de desarrollo, al disecar los ejemplares capturados; (2) comprobación mediante cortes histológicos de las gónadas; (3) la comprobación del estado por presión abdominal; (4) realizando biopsia ovárica.
Los dos primeros métodos son usados en los estudios biológicos y pesqueros, los dos siguientes en los estudios y desarrollos de la acuicultura. En todo caso la determinación del desarrollo gonadal en los peces, permite evaluar las características óptimas para su procreación (GÓMEZ-ALFARO et al., 2006).
MATERIALES Y MÉTODOS Estaciones
Se establecieron cinco estaciones de muestreo: cuatro influenciadas por la hidrodinámica de la Bahía y una fuera de la Bahía como referencia, las cuales fueron muestreadas durante los diez meses que duró el estudio (junio 1992-marzo 1993) (Fig. 1).
Estación 1: entre Caño de Loro y Bocachica. Influenciada por aguas marinas que penetran por Bocachica, siendo aguas claras y el sustrato en su gran mayoría es limo.
Estación 2: en el Canal del Varadero. Influenciada por aguas marinas que penetran por Bocachica así como también por las aguas que aporta el Canal del Dique; el sustrato está entre limo y arena gruesa.
Estación 3: frente a la Zona Franca Industrial. Influenciada directamente y en forma permanente por las aguas y descargas que aporta el Canal del Dique; el sustrato está compuesto por limo y lodo.
Estación 4: entre PROPILCO y CORELCA. Influenciada por las aguas del Canal del Dique dependiendo de la época del año, el sustrato esta compuesto por gravilla, coral muerto y arena gruesa.
Estación 5: Al norte de la Isla de Tierra Bomba, frente de Marbella. Influenciada por aguas totalmente marinas; el sustrato se compone de arena fina.
Artes y Métodos de Captura
En las cinco estaciones de muestreo se utilizaron siete trasmallos: tres de 100 m de longitud cada uno, con 10 m de altura, con un ojo de malla estirada de 10 cm; cuatro trasmallos de 100 m de longitud por 5 m de altura, con un ojo de malla de 4 cm cada uno. Las faenas se realizaron con la ayuda de una lancha de fibra de vidrio de 29 pies de largo por 7 pies de ancho, con un motor fuera de borda de 60 HP.
Se realizó un muestreo mensual, a través de faenas de pesca nocturna por estación durante los últimos cinco días de cada mes, durante los períodos julio-diciembre de 1992 y febrero-marzo de 1993.
De acuerdo a la ubicación de las estaciones, al excesivo tránsito de las lanchas o a la longitud de los trasmallos, se calaban o colocaban las redes en forma diferente: en las estaciones 1 y 2 se colocaron en posición perpendicular a la línea de costa, en la 3 y 4 se colocaron paralelas a la línea de costa, y en la 5 a la ronza (a la deriva). En las cuatro estaciones de la Bahía se procedió a amarrar un extremo del trasmallo a la costa (a un manglar), y al otro extremo se ubicaba la lancha.
Se hacían dos revisiones durante la faena: en las estaciones dentro de la bahía se revisaban los trasmallos a las 12 a.m. y luego a las 5 a.m.; en la estación 5 se recogía el trasmallo a las 11 p.m., se procedía a calar a las 12 a.m. y se volvía a recoger a las 5 a.m.; cada faena tenía una duración de 12 horas (5 p.m.- 5 a.m.).
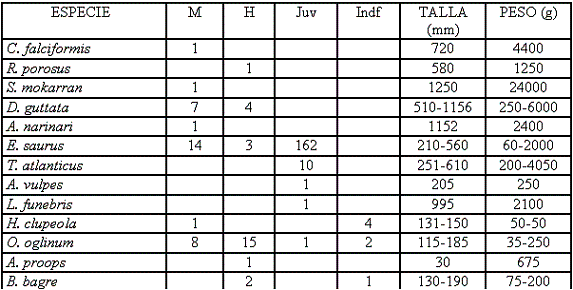
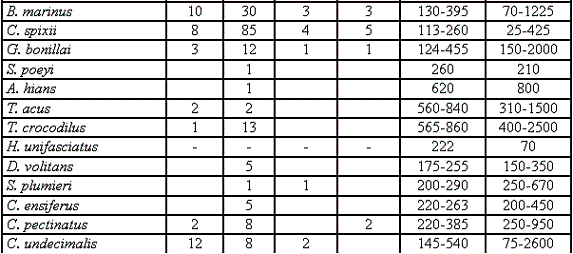
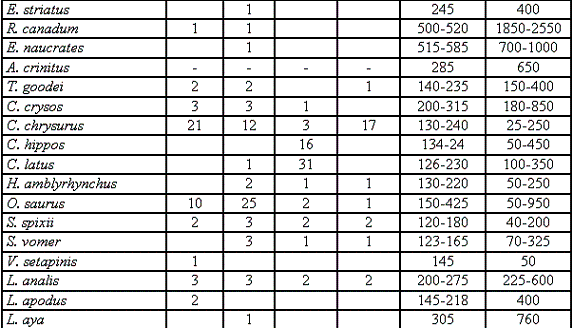
A cada uno de los peces capturados se les separaba por familia y especie y se les determinaba la longitud estándar (Lst.), la longitud total (Lt.), el peso húmedo, el sexo (macho, hembra, juvenil e indiferenciado) y el estado de madurez gonadal. La longitud estándar y total se midió con un ictiómetro convencional de un metro con aproximación de un milímetro; el peso húmedo se tomó con una balanza de reloj universal con 5 gramos de aproximación, para establecer el sexo y estado de madurez gonadal se utilizó la Tabla 1 basada en VEGAS-VÉLEZ (1987) y modificada para este estudio, debido a las diferentes especies halladas. Las gónadas también fueron pesadas en la descrita y medidas con un nonio MAUB con una micra de aproximación.
Para la identificación de los peces capturados se utilizó a nivel de Especies las claves de BÖHLKE & CHAPLIN (1968), DAHL (1971), INP (1976), FISCHER (1978), DAROVEC (1983), ACERO-PIZARRO & GARZÓN-FERREIRA (1985), FRANKE-ANTE & ACERO-PIZARRO (1990), SÁNCHEZ (1991), CERVIGÓN-MARCOS (1991, 1993, 1994); para las Familias, FISCHER (1978); para los Géneros, ESCHMEYER (1990); y para los Órdenes, NELSON (2006). Igualmente para los nombres vernaculares de los peces se adoptaron los criterios de ACERO-PIZARRO et al. (1986).
Metodología de Gabinete
Se determinó el estado de madurez gonadal, según VEGAS-VÉLEZ (1987), estableciendo cuatro estados para cada uno de los sexos.
Machos:
Estado I: gónadas pequeñas, aplanadas, transparentes, ligeramente rojizas o algo grisáceas.
Estado II: gónadas pequeñas, rojo blanquecinas, con vasos sanguíneos; cuando se presionan no sale líquido.
Estado III: gónadas totalmente opacas, blancas; liberan esperma cuando se presionan.
Estado IV: gónadas rojas o gris rojizas, muy cortas; paredes muy suaves con muchos vasos sanguíneos; no liberan esperma.
Hembras:
Estado I: ovario turbio o vidrioso, cilíndrico, transparente, paredes tirantes y pequeñas; óvulos no se ven a simple vista.
Estado II: ovario opaco, anaranjado o rojo grisáceo; los óvulos pueden verse a simple vista, con vitelo el cual da un color naranja o rojo blancuzco.
Estado III: ovario opaco, anaranjado o rojo blancuzco, haciéndose algo transparente con algunos puntos anaranjados; se presentan vasos sanguíneos y las paredes se arrugan.
Estado IV: ovario de color rojo y transparente, paredes muy suaves, rugosas con vasos sanguíneos, óvulos blancos un poco aplastados y en reabsorción.
Para estimar el tamaño de madurez gonadal, se utilizaron los criterios de BÁEZ et al. (1982) se siguiendo los siguientes criterios: (a) factor de condición medio por clase de longitud; (b) porcentaje de individuos maduros por clase de longitud en la época de reproducción, tomando el largo correspondiente a un determinado porcentaje de individuos maduros; (c) el menor individuo de cada sexo con gónadas maduras.
Para estimar la temporada de desove se tuvo en cuenta: (a) estudio macroscópico de las gónadas y las variaciones porcentuales de las mismas a través del año; (b) las variaciones a través del año del factor de condición k (NIKOLSKY, 1963).
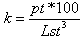
Donde, k: Factor de condición; pt: Peso total del pez (húmedo); Lst: Longitud estándar.
El estudio de las variaciones del índice gonadosomático o de madurez gonadal (I. Gs) e índice gonádico (I. Gd) a través del año se realizaron de acuerdo a MOSER (1967).
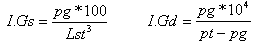
Donde pg: Peso de la gónada; pt: Peso total del pez; Lst: Longitud estándar.
Así mismo, se utilizó el índice de Jaqcard, para establecer las relaciones de presencia-ausencia de los miembros de cada especie en las áreas muestreadas.
Inventario
Se recolectaron 1431 individuos, representados en 37 familias, 57 géneros y 79 especies, 11 de los cuales son nuevos registros para la Bahía de Cartagena y sus áreas de influencia de acuerdo a la síntesis de ALVAREZ-LEÓN & BLANCO-RACEDO (1991).
El registro de las 11 especies nuevas para la Bahía puede deberse a factores tales como: (1) la faena de pesca (nocturna), (2) arte de pesca (trasmallo), (3) época de muestreo, y (4) condiciones abióticas de la Bahía (PARDO-RODRÍGUEZ et al., 2003).
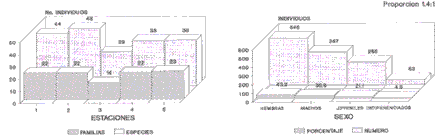
En las cinco estaciones, de acuerdo a la representatividad de familias y especies, se registró el siguiente porcentaje de ocurrencia (Fig. 2): 43 especies (54,4%) pertenecientes a 22 familias (59,6%) fueron aportadas por la estación 1; 48 especies (60,75%) de 22 familias (59,46%) por la estación 2; 29 especies (36,71%) de 14 familias (37,84%) corresponden a la estación 3; 38 especies (48,1%) de 22 familias (59,46%) en la estación 4 y 38 especies (48,1%) de 23 familias (62,16%) se encontraron en la estación 5 (Figs. 2a, 2b).
Se observó además que las estaciones localizadas en la entrada de la Bahía (estaciones 1, 2 y 4) aportaron el mayor número de familias así como de especies, debido a que están ubicadas en el área de paso de los diferentes organismos de mar abierto y de las bocas de intercambio con la Bahía de Cartagena. La estación 3 por su parte mostró el más bajo número de familias y de especies, posiblemente debido al comportamiento de la hidrodinámica de la Bahía, a la localización dentro del área de muestreo y al vertimiento de aguas residuales por la Zona Industrial de Mamonal, ratificando lo encontrado por LINDEN et al. (1980) y MERCADO-SILGADO (1981).
Composición por Sexo
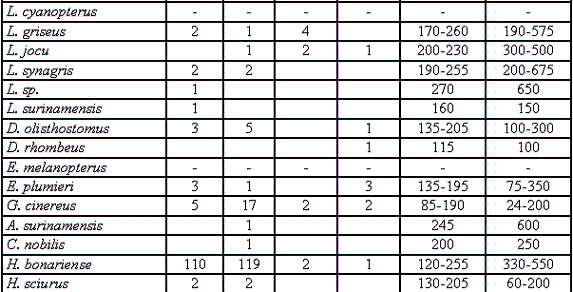
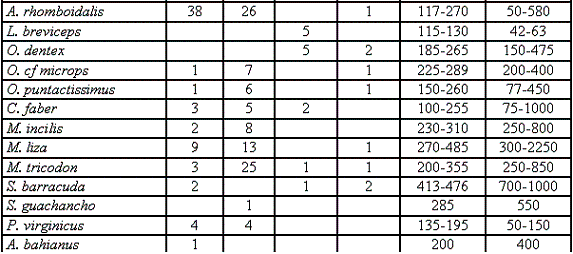
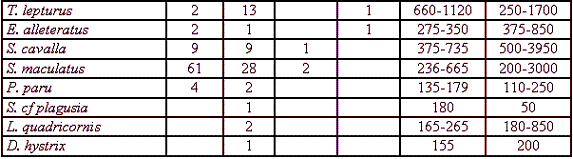
En el Tabla 1 se registran las 79 especies, especificando sus rangos de longitud, peso y número de individuos por sexo; registrando un total de 1262 individuos, representados en 387 machos (30,6%), 546 hembras (43,2%), 266 juveniles (21,1%) y 69 indiferenciados (6,9%), teniendo una proporción hembra-macho de 1,4:1 (Figura 2b).
Estado Gonadal
Las Figuras 3a, 3c, 4a, 4c y 5a muestran el total de especies recolectadas en relación con el estado de madurez gonadal, porcentaje y número de individuos. Cada una de ellas hace referencia a las 5 estaciones.
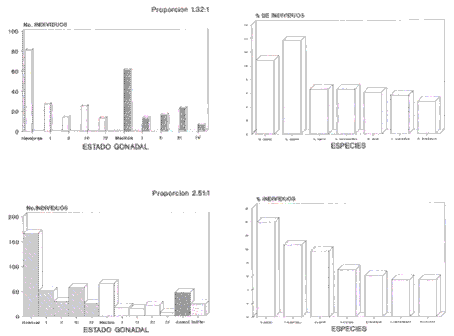
Para la estación 1 (Figs. 3a, 3b) se recolectaron 212 individuos (43 especies), 81 hembras de las cuales 27 estaban en estado I, 14 en II, 25 en III y 13 en IV; 61 machos, 13 en estado I, 16 en II, 23 en III y 6 en IV, presentando una proporción hembra-macho 1,32:1. Las especies más representativas en esta estación fueron: Oligoplites saurus (10,85%), Elops saurus (13,68%), Cathorops spixii (6,6%), Archosargus rhomboidalis (6,6%), Caranx latus (6,13%), Tylosurus crocodilus (5,66%) y Haemulon bonariense (4,72%) (Fig. 3b).
En la Figura 3c se registran 331 individuos (48 especies) de la estación 2. Se capturaron 166 hembras, de las cuales 51 se encontraron en estado I, 30 en II, 58 en III y 26 en IV; en cuanto a los machos se capturaron 66, 18 en estado I, 15 en II, 22 en III y 7 en IV, para una proporción hembra-macho de 2,51:1, también se encontraron 47 juveniles y 24 indiferenciados. Las especies más representativas fueron Elops saurus (13,9%), Haemulon bonariense (10,57%), Cathorops spixii (9,67%), Bagre marinus (6,95%), Chloroscombrus chrysurus (6,04%), Archosargus rhomboidalis (5,44%) y Mugil tricodon (5,43%) (Fig. 3d).
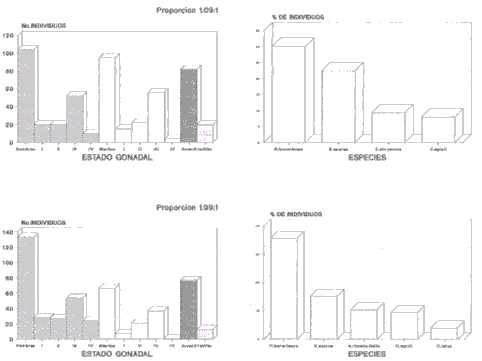
En la Figura 4a se observa un total de 332 individuos pertenecientes a 29 especies presentes en la estación 3. Se capturaron 104 hembras: 20 en estado I, 20 en II, 52 en III, 10 en IV; 95 machos: 15 en estado I, 22 en II, 56 en III, 2 en IV, para una proporción de 1,09:1. También se capturaron 82 juveniles y 20 indiferenciados. Las especies más dominantes en la estación 3 fueron: Haemulon bonariense (35,78%), Elops saurus (22,59%), Chloroscombrus chrysurus (9,34) y Cathorops spixii (8,13%) (Fig. 4b).
En la Figura 4c se registran 313 individuos pertenecientes a 38 especies en la estación 4. Se capturaron 133 hembras: 28 en estado I, 27 en II, 54 en III, 24 en IV; 67 machos: 8 en estado I, 21 en II, 37 en III, 1 en IV, para una relación hembra-macho de 1,99:1, 77 juveniles y 13 indiferenciados. Las especies más predominantes de la estación 4 fueron Haemulon bonariense (35,78%), Elops saurus (15,34%), Archosargus rhomboidalis (10,54%), Cathorops spixii (9,58%) y Caranx latus (4,15%) (Fig. 4d).
En la Figura 5a se registran las especies encontradas en la estación 5 para un total de 239 individuos de 38 especies. Se capturaron 87 hembras: 18 en estado I, 18 en II, 31 en III y 20 en IV; 87 machos: 6 en estado I, 18 en II, 57 en III y 6 en IV, para una proporción hembra-macho de 1:1, también se encontraron 10 juveniles y 5 indiferenciados. Las especies predominantes en la estación 5 fueron: Scomberomorus brasiliensis (54,73%), Opisthonema oglinum (7,82%), Scomberomorus cavalla (7,82%) y Bagre marinus (4,53%) (Fig. 5b).
El análisis de similitud entre estaciones de acuerdo a la presencia-ausencia (índice de Jaqcard) de especies, muestra 2 grupos claramente definidos. El grupo A conformado por las estaciones 3 y 4, las cuales se agrupan por tener un alto número en común de especies; y el grupo B conformado por las estaciones 1 y 2, las cuales tienen el mayor número de especies presentes, 43 y 48 respectivamente.
Se observa una asociación alta (0,55) entre los dos grupos por poseer especies en común, lo cual se puede explicar por encontrarse dichas estaciones dentro de la Bahía de Cartagena y por poseer características similares. La estación 5 tiene una baja asociación con las demás estaciones de la Bahía.
Especies Representativas
Con base en la ocurrencia de especies se definió su representatividad de acuerdo a su distribución porcentual partiendo desde el 17,13% hasta el 1,12%, obteniendo un total de 18 especies más abundantes y significativas, representadas por: Haemulon bonariense (17,93%), Elops saurus (14,1%), Scomberomorus brasiliensis (9,77%), Cathorops spixii (7,19%), Archosargus rhomboidalis (4,54%), Chloroscombrus chrysurus (4,12%), Bagre marinus (3,42%), Oligoplites saurus (2,72%), Caranx latus (2,3%), Mugil tricodon (2,16%), Opisthonema oglinum (2,02%), Gerres cinereus (1,82%), Mugil liza (1,61%), Centropomus undecimalis (1,61%), Ariopsis bonillai (1,4%), Scomberomorus cavalla (1,33%), Caranx hippos (1,19%), Trichiurus lepturus (1,12%).
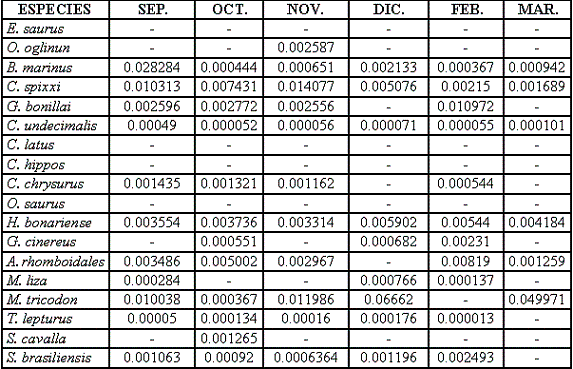
De las 18 especies seleccionadas se registran a continuación: su índice gonádico (Tabla 2), su índice de madurez (Tabla 3), datos sobre el estado gonadal y algunas notas ecológicas:
Elops saurus Linnaeus, 1766
De los 179 individuos analizados para el estado de madurez gonadal se encontraron 162 juveniles correspondiendo al 90,5%, 14 machos con un 7,82%, 5 en estado I (2,79%), 7 en II (3,91%), 1 en III (0,56%) y 1 en IV (0,56%); 3 hembras con un 1,68%, 1 en estado I (0,56%) y 2 en IV (1,12%), con una proporción hembra-macho de 1:4,7. En junio se encontraron 14 individuos con estado de madurez diferente (4 machos en estado I, 6 en estado II, 1 en III, 1 en IV y 2 hembras en IV). Esta especie fue recolectada durante toda la época de muestreo, en mayor número de individuos juveniles, los cuales tomaron la Bahía como área de crianza, aunque CERVIGÓN-MARCOS (1991) plantea que los organismos maduros pueden entrar a los estuarios. Entre septiembre y octubre se presentó mayor número de individuos juveniles, coincidiendo con la época de lluvia. En estos meses el mayor aporte de individuos fue por parte de las estaciones 3 y 4, esto se puede deber a los nutrientes provenientes del Canal del Dique, ya que en un área rica en alimento es de esperarse que se encuentre gran cantidad de organismos que pueden ser presa de esta especie.
Con base en la frecuencia de tallas, la Figura 17 muestra que en el intervalo 259-296 mm se encontró un máximo de 83 individuos equivalentes a un 43,01%, seguido por los intervalos 221-258 mm y 297-334 mm con 54 (27,98%) y 29 (15,03%) individuos, respectivamente. Cuando fueron capturados estos individuos se observó que siempre formaban cardúmenes, por esto la mayoría poseen la misma longitud y estado de madurez sexual, además de la selectividad del arte de pesca, confirmando lo encontrado por WHITHEAD & VERGARA (1978).
Según se observó, el factor de condición va aumentando de junio hasta llegar a su máximo valor en septiembre, coincidiendo con la época de lluvia y la temporada donde más se alimenta esta especie.
Opisthonema oglinum (LeSueur, 1818)
Se capturaron 8 machos (30,7%), 3 en estado I (11,5%), 2 en estado II (7,69%), 3 en III (11,5%); 15 hembras con un 57,6%, 1 en estado I (3,84%), 4 en II (15,3%), 4 en III (15,3%) y 6 en IV (23,1%), con una proporción hembra-macho de 1,87:1. Se encontraron individuos desovados en junio, julio, agosto y noviembre, siendo junio el mes con mayor número de individuos. La mayor cantidad de individuos que evidenciaban algún estado de madurez se presentó entre julio y agosto. Se observa que podría haber dos épocas de desove en esta especie, la primera entre julio y agosto y la segunda en noviembre, confirmando lo encontrado por MADURO (1971); según WHITEHEAD & VERGARA (1978), el período de desove está entre mayo-junio.
El mayor número de peces capturados fue en la estación, encontrándose la mayoría desovados y es estado de madurez (III), lo que indica que esta especie en la etapa de madurez se dirige a mar abierto y en etapa de desarrollo se encuentra en la Bahía.
El valor más elevado del factor de condición se encuentra en julio debido a que la mayoría de organismos están en los estados de madurez gonadal I y II. Según la frecuencia de tallas el intervalo fue 159-166 mm con 9 individuos (34,62%), seguido por el intervalo 165-182 mm con 7 individuos (26,92%). En la estación 5 se observó que el promedio de tallas en las hembras es mayor que en los machos.
Ariopsis bonillai Milles, 1945
En 17 individuos el estado gonadal se distribuyó en 3 machos (17,6%), 1 en estado I (5,8%), 2 en II (11,7%); 12 hembras (70,5%), 4 en estado I (23,5%), 3 en II (17,6%), 4 en III (23,5%) y 1 en IV (5,8%); un juvenil (5,8%) y un indiferenciado (5,8%), con una proporción hembra-macho de 4:1.
La talla mínima encontrada en las hembras capturadas fue de 280 mm de longitud estándar y un peso de 450 g. La única hembra en estado gonadal IV fue capturada en octubre. TORO-SUÁREZ & VILLA-NAVARRO (1983) capturaron una hembra madura (estado III) con una talla de 233 mm de longitud estándar. Esta diferencia de tallas puede ser consecuencia del arte de pesca utilizado.
Los índices de madurez y gonádico, presentaron sus mayores valores en febrero y un menor valor para el factor de condición, esto debido a lo mencionado anteriormente para especies de esta familia. En el intervalo 256-289 mm se presentó un mayor número de individuos que abarca el 50% de la población capturada (10 individuos).
Bagre marinus (Mitchill, 1815)
Se encontraron 49 individuos de los cuales 10 eran machos (21,7%), 7 en estado I (15,2%), 3 en II (6,5%); 30 hembras (65,2%), 20 en estado I (43,4%), 1 en II (2,1%), 2 en III (4,3%) y 7 en IV (15,2%); 3 juveniles (6,9%) y 3 indiferenciados (6,9%), con una proporción hembra-macho de 3:1. El mayor número de hembras desovadas se presentó en marzo, seguido por los meses de junio, noviembre y febrero, concordando con lo observado por MISHIMA & TANGI (1983), en el Atlántico brasileño.
Los índices de madurez y gonádico presentan un valor alto en diciembre y un factor de condición bajo debido a que esta especie reduce sus hábitos alimenticios, éste presenta sus valores máximos en junio y septiembre. Los intervalos de frecuencia fueron 317-343 mm con 14 individuos (28,57%), seguido por 209-235 mm con 6 individuos (12,24%).
Cathorops spixii (Agassiz, 1829)
De los 103 individuos, 12 machos (11,6%); 12 en estado I (11,6%); 83 hembras (80,5%), 27 en estado I (26,21%), 18 en II (17,47%), 21 en III (20,3%) y 19 en IV (18,44%); 4 juveniles e indiferenciados (3,88%), con una proporción hembra-macho de 6,91:1.
Septiembre y octubre son los meses que más aportan individuos en los diferentes estados gonadales. La menor talla de madurez para una hembra fue de 140 mm de longitud estándar (estado III) con un peso de 65 g. MISHIMA & TANGI (1983) capturaron una hembra de 96 mm (estado III); por su parte CERVIGÓN-MARCOS (1991) encontró como talla mínima 149 mm. Las diferencias encontradas pueden deberse tanto al arte de pesca como al ojo de malla.
Se encontraron 2 hembras en estado IV en junio, 4 en septiembre, 5 en octubre, 1 en noviembre, 1 en diciembre, 2 en febrero y 4 marzo. Según esto, el comportamiento de desove se presenta a lo largo del año, sin embargo entre septiembre-octubre y febrero-marzo el número de individuos fue mayor. Según CERVIGÓN-MARCOS (1991) la reproducción ocurre entre julio-octubre, y según MISHIMA & TANGI (1983) el desove empieza en noviembre y termina en enero. Las épocas de desove pueden cambiar de acuerdo a las condiciones medioambientales del área de estudio, pero con los resultados obtenidos por estos trabajos se puede decir que la especie desova a lo largo del año.
Se observó que esta especie presenta un comportamiento de cuidado parental, especialmente en los machos, los cuales llevan los huevos en la boca, debido a este comportamiento se encontraron individuos con el estómago vacío en el momento en que presentan el máximo valor del índice de madurez y gonádico. Bajan sus requerimientos alimenticios cuando se encuentran en estado de madurez (estado III). En cuanto a la frecuencia de tallas, las más representativas fueron 142-156 mm, 157-171 mm, con un 24,77% cada uno.
Centropomus undecimalis (Bloch, 1792)
De los individuos capturados 2 eran machos (54,54%), 7 en estado I (31,81%), 3 en II (13,63%), 1 en III (4,5%) y 1 en IV (4,5%); 8 hembras en estado I (36,36%) y 2 juveniles (9,09%), con una proporción hembra-macho de 1:1,5.
El único macho encontrado en estado III fue capturado en junio, con 470 mm de longitud estándar y 2150 g de peso. CERVIGÓN-MARCOS (1991) encontró una talla muy similar (435 mm) para un macho maduro. Según las frecuencias de tallas hay 2 intervalos significativos: 343-382 mm y 383-422 mm, cada uno con 6 individuos (26,09%).
Caranx hippos (Linnaeus, 1766)
Todos los organismos capturados eran juveniles, al igual que en la especie anterior, lo cual probablemente haya sido causado por el arte de pesca utilizado y a su ojo de malla. De acuerdo con los datos recolectados y por observaciones hechas durante la época de muestreo, esta especie utiliza la Bahía como área de crianza y de alimentación, actividades que también registran RÍOS-RODRÍGUEZ (1975), BERRY & SMITH-VANIZ (1978), DUQUE-TOBÓN & GÓMEZ-RANGEL (1983), SÁNCHEZ-GIL et al. (1991) y CERVIGÓN-MARCOS (1991, 1993).
Caranx latus Agassiz, 1831
La mayoría de los organismos capturados eran juveniles, posiblemente debido al arte de pesca y al ojo de malla del trasmallo utilizado, que no sobrepasaba los 10 cm de longitud. Se recolectó una hembra en estado I con una longitud estándar de 175 mm y un peso de 200 g, en septiembre. Por su parte, el intervalo fue de 190 a 200 mm, con 7 individuos (21,21%) (Fig. 39).
Según las observaciones realizadas en este estudio, esta especie forma cardúmenes al igual que lo registrado por ACERO-PIZARRO (1977) y BERRY & SMITH-VANIZ (1978).
Chloroscombrus chrysurus (Linnaeus, 1766)
De 52 individuos analizados 21 eran machos (40,3%), 1 en estado I (1,9%), 3 en II (5,7%), 14 en III (26,92%) y 3 en IV (5,7%); 11 hembras (21,1%), 2 en estado II (3,8%), 6 en III (11,53%) y 3 en IV (5,7%); 2 juveniles (3,8%) y 17 indiferenciados (32,6%), con una proporción hembra-macho de 1:1,9.
Se encontraron individuos en estado IV en junio, octubre, noviembre y febrero, lo cual demuestra que esta especie podría desovar más de una vez por año. Para CERVIGÓN-MARCOS (1991) la época de reproducción es de noviembre a diciembre. En noviembre se presentaron los valores más altos para los índices de madurez y gonádicos.
La talla mínima encontrada para una hembra madura (estado III) fue de 140 mm de longitud estándar y 50 g de peso, y para un macho maduro (estado III) de 174 mm de longitud estándar y 100 g de peso. Las frecuencias de tallas mostraron que el intervalo fue 198-209 mm, con 13 individuos (22,03%).
Se observa que en las épocas de transición y lluvias para esta área la especie se ubica en las estaciones 2 y 3, donde existe la influencia del Canal del Dique debido posiblemente al aporte de nutrientes y alimento que aporta dicha área. Cuando la época es seca, se ubica en las entradas de la Bahía (estaciones 1 y 2), donde según el trabajo realizado es una zona de transición de muchas especies que les pueden servir de alimento. Esto confirma lo propuesto por SÁNCHEZ-GIL et al. (1981) con respecto a la influencia de los aportes fluviales sobre esta especie.
Oligoplites saurus (Bloch & Schneider, 1801)
Del total de los organismos capturados 10 eran machos (17,24%), 1 en estado I (1,7%), 4 en III (6,8%) y 5 en IV (8,6%); 25 hembras (43,1%), 18 en estado III (31,03%) y 7 en IV (12,06%); 2 juveniles (3,4%) y 1 indiferenciado (1,7%), con una proporción hembra-macho de 2,5:1.
En junio y julio se capturaron 2 machos y 5 hembras en estado IV, 3 machos y 2 hembras en estado IV, respectivamente; el segundo mes presentó un mayor número de individuos (3 machos y 15 hembras). Según lo anterior la época de desove estaría entre estos meses.
Las tallas mínimas de maduración fueron: para hembras de 195 mm de longitud estándar y 70 g de peso (estado III), y en machos de 195 mm de longitud estándar y 100 g de peso. Se observan 2 intervalos de tallas predominantes: 204-231 mm con 22 individuos (56,41%) y 176-203 mm con 12 individuos (30.77%).
Se capturó una hembra desovada (estado IV) con 425 mm de longitud estándar y un peso de 950 g, en julio (estación 2). Existe una característica secundaria de dimorfismo sexual, en los machos se presenta un color amarillento en el vientre, mientras que en las hembras es blanco.
Gerres cinereus (Walbaum, 1792)
De los 26 individuos capturados 5 eran machos (19,2%), de los cuales 3 se encontraron en estado I (11,5%), 2 en II (7,6%); 17 hembras con un 65%, 12 en estado I (46,1%), 3 en II (11,5%), 1 en III (93,8%), 1 en IV (3,8%); 2 juveniles (7,6%) y 2 indiferenciados (7,6%), con una proporción hembra-macho de 3,4:1. El único ejemplar maduro fue capturado en julio con una longitud estándar de 145 mm y un peso de 100 g, y un individuo desovado (hembra) en octubre de una longitud estándar de 140 mm y con un peso de 100 g.
Otros autores afirman que la especie desova en octubre, lo cual concuerda con el mes en que la hembra desovada fue recolectada, esto podría demostrar que en octubre también se produce el desove para esta zona del estudio.
Haemulon bonariense Cuvier, 1829
Para el estado gonadal se analizaron 233 individuos de los cuales 110 eran machos con un 47,2%, 5 en estado I (2,1%), 24 en II (10,3%), 81 en III (34,7%); 120 hembras con un 51,5%, 8 en estado I (3,4%), 26 en II (11,1%), 70 en III (30,04%), 16 en IV (6,8%); 2 juveniles (0,85%) y un indiferenciado (0,42%), con una proporción hembra-macho de 1,09:1. Se encontraron hembras en estado IV de junio y septiembre hasta marzo, siendo más abundante en septiembre y marzo, lo cual demuestra que esta especie tiene más de un desove anual. Desde julio a marzo se capturaron individuos en estado maduro, teniendo su mayor representatividad en febrero, seguido de octubre y septiembre.
Las tallas mínimas capturadas de machos y hembras en estado III fueron de: 172 mm de Lst. con un peso de 150 g, y 168 mm de Lst. con un peso de 125 g, respectivamente. Estos registros coinciden con los comentarios de que madura entre los 150 y 175 mm de Lst. Según la Tabla 3 se observa un valor máximo en febrero del índice de madurez y gonádico, siendo este mes en el que se capturó mayor número de individuos maduros y observando un valor de condición bajo. En los individuos maduros este factor baja, por la cercanía a su madurez sexual.
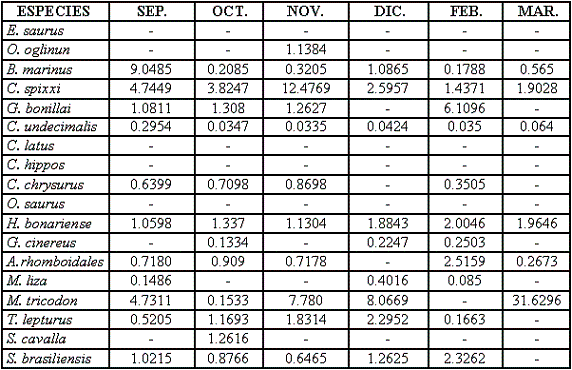
Archosargus rhomboidalis Linnaeus, 1758
Para el estado gonadal se encontró que de los 65 individuos capturados 37 eran machos con un porcentaje del 56,9%, de los cuales 2 se encontraron en estado I (3,07%), 13 en II (20%), 21 en III (32,3%), 1 en IV (1,53%); 27 hembras con un 41,53%, 9 en estado II (13,84%), 15 en III (23,07%), 3 en IV (4,61%); 1 indiferenciado (1,53%), con una proporción hembra-macho de 1:1,37. Los individuos desovados fueron capturados desde agosto con un sólo individuo (macho) y las 3 hembras capturadas en septiembre, octubre y noviembre.
En septiembre se capturó mayor número de individuos en algún estado gonadal, con una proporción aproximada de hembra-macho de 1:1. Se encontró además en febrero-marzo una gran proporción de individuos maduros, en los cuales dominaron los machos en febrero con una proporción de 1:1,4 y para marzo de 1:3. Según las hembras y machos desovados capturados, se puede decir que sucede un desove prolongado desde octubre-septiembre y otro en agosto, pudiendo desovar más de una vez por año.
Se observa según las Tablas 2 y 3 que el mayor valor del índice de madurez y gonádico se presenta en febrero y un bajo factor de condición (Tabla 1), el cual coincide con los resultados donde el mayor número de individuos maduros capturados fue en febrero, pero con un factor de condición bajo, demostrando lo dicho en especies anteriores.
Mugil liza Valenciennes, 1836
De los individuos capturados 9 eran machos con un 39,13%, y todos se encontraban en estado I; 13 hembras con un 56,52%, 10 en estado I (43,47%), 1 en II (4,3%), 1 en III (4,3%), 1 en IV (4,3%), y 1 juvenil (4,3%), con una proporción hembra-macho de 1,4:1.
Se encontró una hembra desovada en diciembre con una longitud estándar de 410 mm y un peso de 1300 g, también se capturó una hembra madura en este mes con una longitud de 485 mm y un peso de 2250 g. En junio, agosto y septiembre se capturaron animales en estado gonadal I y en diciembre se presentaron animales en todos los estados de madurez. Se observa que para esta especie esta es una zona de crianza donde los individuos de los primeros estados gonadales y juveniles van a protegerse y a buscar alimentación. MARTÍNEZ (1983) establece una época de desove entre enero y febrero. VELASCO-MORA & VILLEGAS-RODRÍGUEZ (1985) observaron que la época de reproducción de los mugílidos (desove en mar abierto) se presentó entre noviembre y marzo (época seca).
Mugil tricodon Poey, 1876
De los 30 capturados 3 eran machos con un 10%, 2 en estado II (6,7%), 1 en III (3,3%); 25 eran hembras con un 83,3%, 1 en estado I (3,3%), 4 en II (13,1%), 15 en III (50%), 5 en IV (16,6%); 1 indiferenciado (3,3%) y 1 juvenil (3.3%), con una proporción hembra-macho de 8,3:1. Se presentaron hembras desovadas desde junio-agosto, octubre-noviembre, observando 2 épocas de desove. En Cuba para M. curema existen dos épocas de desove, una entre julio-agosto y otra de noviembre a enero, aunque es más evidente el desove en verano.
Las tallas mínimas encontradas en organismos maduros tanto para hembra como para macho fueron: 245 mm Lst. y un peso de 450 g y 265 mm Lst. con un peso de 300 g, respectivamente. Algunos autores discuten que el tamaño, para la madurez de M. curema, se presente a los 310 mm longitud horquilla para ambos sexos, y que el menor individuo de gónadas maduras o desovadas es de 230 mm de longitud horquilla para hembra y macho de 240 mm de longitud horquilla.
Trichiurus lepturus Linnaeus, 1758
De los 16 individuos capturados 2 eran machos en estado gonadal III con un 12,5%; 13 hembras con un 81,25%, 2 en estado I (12,5%), 3 en II (18,75%), 6 en III (37,5%), 2 en IV (12,5%); 1 indiferenciado (6,25%), con una proporción de hembra-macho de 6,5:1. Se encontraron 2 hembras desovadas en junio y marzo. También se recolectaron individuos maduros en los meses de junio hasta diciembre.
Las tallas mínimas para hembras y machos maduros fueron: hembra de 660 mm de Lst. con un peso de 1700 g difiriendo en lo reportado por ROS & PÉREZ (1978), los cuales encuentran tallas menores para machos y hembras maduros esto debido a la diferencia del arte de pesca que se utilizó. En diciembre se presenta el valor más alto del índice de madurez y gonádico (Tablas 2 y 3), siendo el factor de condición muy bajo (Tabla 1) debido al único organismo capturado en este mes, siendo la talla un peso muy bajo, presentando un estado gonadal III (macho maduro).
Scomberomorus brasiliensis Colette et al., 1978
De los 92 individuos analizados para el estado gonadal se encontraron 61 machos con un 66,3%, 12 en estado II (13,04%), 48 en III (52,17%), 1 en IV (1,08%); 29 hembras con un 31,52%, 4 en estado I (4,34%), 8 en II (8,69%), 10 en III (10,86%), 7 en estado IV (7,6%) y 2 juveniles (2,17%), con una proporción hembra-macho de 1:2,1. Los organismos desovados se capturaron en junio, julio y agosto, con una hembra en cada mes; en septiembre y noviembre 2 hembras, y el único macho desovado fue capturado en marzo; se observa que esta especie desova más de una vez por año, siendo este desove asincrónico.
Se observó que los individuos capturados en la Bahía se encontraban en los primeros estados gonadales, demostrando que esta área es una zona de crianza para esta especie. En el estado gonadal I los organismos capturados solamente fueron hembras; en el estado II la proporción hembra-macho fue de 1:1,71, mientras que en el estado III la proporción fue de 1:4,8 y en el estado IV la proporción fue de 7:1. Entre julio y agosto fue encontrado el mayor número de organismos en algún estado gonadal.
Las tallas mínimas para hembra-machos fueron: de 365 mm con un peso de 550 g y 325 mm con un peso de 400 g, respectivamente. Se encontró que el 75,86% (44 individuos) estaban en estado III, capturados entre junio y octubre, correspondiendo a la época de transición e invierno. Por la no consecución de datos en los índices de madurez y gonádico no se puede inferir una época de desove, sin embargo las Tablas 2 y 3 muestran un valor alto para estos índices en febrero, debido a que solamente se capturaron 3 individuos de los cuales 2 se encontraban en estado III y 1 juvenil.
Scomberomorus cavalla (Cuvier, 1829)
Del total capturados, 9 eran machos en estado III, con un porcentaje 47,36%; 9 eran hembras con un 47,36%, 6 en estado I (31,57%), 3 en II (15,78%), y 1 juvenil (5,26%), siendo la proporción hembra-macho de 1:1. Solo se presentaron durante julio, agosto y octubre, siendo el mayor número en agosto con 5 hembras en estado I, 2 en II, 5 machos maduros y 1 juvenil; todos los individuos fueron recolectados en la estación 5 mostrando que son estrictamente marinos.
La talla encontrada para el macho en estado maduro, fue 475 mm de Lst. con un peso de 2000 g. Se observó que las hembras en estado gonadal I van de un rango de 415 mm de Lst. con un peso de 750 g hasta 465 mm y un peso de 1100 g, las hembras en estado II desde 470 mm con un peso de 1100 g hasta 500 mm y un peso de 1300 g.
CONCLUSIONESLa Bahía de Cartagena se comporta como un área de refugio y crianza para la gran mayoría de las especies capturadas, las cuales encuentran allí alimento para individuos que se encuentran en sus diferentes estadíos gonadales. Teniendo en cuenta la distribución porcentual y la relación hembra-macho de las 18 especies más significativas, fue evidente que:
Entre los Elopiformes, Elops saurus presentó individuos juveniles en un porcentaje significativamente alto (90,5%); esta especie se encuentra en época de lluvias alrededor de las estaciones 3 y 4, las que reciben influencia directa de las aguas del Canal del Dique.
Entre los Clupeiformes, Opisthonema oglinum mostró un actividad diurna, y se encontraron individuos desovados en junio, julio, agosto y noviembre.
Entre los Siluriformes, Bagre marinus presentó varios desoves al año; el mayor número de individuos de esta especie se encontró en las estaciones 2 y 5, las cuales tienen influencia de aguas marinas. Cathorops spixii, desova a lo largo del año, pero durante septiembre y octubre se recolectó un número mayor de individuos desovados, y se comprobaron además las características de cuidado parental propias de esta especie.
Entre los Perciformes, Oligoplites saurus presentó una característica secundaria para diferenciar el sexo, los machos tienen un color amarillento en el vientre, mientras que en la hembra el vientre es blanco. Chloroscombrus chrysurus y Haemulon bonariense, mostraron más de un desove por año. Archosargus romboidalis, presentó un desove prolongado, que abarcó entre agosto y noviembre. Mugil liza, presentó entre junio y septiembre ejemplares en los primeros estados de desarrollo gonadal, y en diciembre ejemplares en todos los estados de madurez, lo cual indica que su desarrollo general transcurre en la Bahía. Mugil tricodon, presenta dos épocas de desove, una de junio-agosto y otra de octubre-noviembre, y el mayor número de individuos se capturó en la estación 3, donde es marcada la influencia directa del Canal del Dique.
Ante la ausencia de estudios sobre la madurez gonadal en los peces en la Bahía de Cartagena, entre 1995 y el 2005, se resalta la importancia de este aporte al conocimiento de las especies que tradicionalmente se han capturado por los pescadores artesanales de la región (Boquilla, Bocagrande, Bahía de Cartagena, Isla de Tierrabomba e Isla Barú).
BIBLIOGRAFÍA ACERO-PIZARRO, A., 1977.- Observaciones ecológicas de la ictiofauna de la pradera de Thalassia de la orilla oriental de la Bahía de Nenguange (Parque Nacional Tayrona, Santa Marta). Tesis profesional. Fac. Biol. Mar. Univ. de Bogotá Jorge Tadeo Lozano, 61 pp. [ Links ]
ACERO-PIZARRO, A. & J. GARZÓN-FERREIRA., 1985.- Los pargos (Pisces: Perciformes: Lutjanidae) del Caribe colombiano. Rev. Actualidades Biológicas, 14 (53): 89-99. [ Links ]
ACERO-PIZARRO, A., J. GARZÓN-FERREIRA & R. ÁLVAREZ-LEÓN, 1986.- Peces comerciales del Caribe colombiano, sin incluir los de las islas cayos y bajos del Caribe occidental (Propuesta para la unificación de sus nombres vernaculares). UBJTL - Inf. Museo del Mar, 31: 1-15. [ Links ]
ÁLVAREZ-LEÓN, R., 1985.- Evaluación de los recursos demersales del Caribe y Pacífico colombiano, Cap. 11, pp. 511-570. In: A. Yañez-Arancibia (ed.) Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. INP/UNAM/PUAL/ICML. México D.F. (México), [ Links ] 748 pp.
ÁLVAREZ-LEÓN, R., 1998.- Los bioensayos con organismos acuáticos y la protección ambiental en Colombia. Rev. AINSA, 31: 10-15. [ Links ]
ÁLVAREZ-LEÓN, R. & J. BLANCO-RACEDO, 1985.- Composición de las comunidades ictiofaunísticas de los complejos lagunares y estuarinos de la Bahía de Cartagena, Ciénaga de Tesca y Ciénaga Grande de Santa Marta, Caribe Colombiano, Cap. 25, pp. 535-556. In: Yañez-Arancibia, A. (ed.) Fish community ecology in estuaries an coastal lagoons. Towards an ecosystem integration, UNAM-ICML. México D. F. [ Links ], 653 pp.
ANDRADE-AMAYA, C., F. ARIAS-ISAZA, & F. THOMAS, 1988.- Nota sobre la turbidez, circulación y erosión en la región de Cartagena (Colombia). DIMAR-Bol. Cient. CIOH, 8: 78-81. [ Links ]
BÁEZ, M., L. ÁLVAREZ-LAJONCHERE & E. OJEDA, 1982.- Reproducción del caballerote, Lutjanus griseus (Linnaeus) en Tunas de Zaza, Cuba. Rev. Invest. Mar., 3 (1): 43-85. [ Links ]
BERRY, F. H. & F. SMITH-VANIZ, 1978.- Carangidae. In: Fischer, W (ed.). FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic (Fishing Area 31) FAO, Roma (Italy), Vol. III. [ Links ]
BÖHLKE, J. E. & C. C. G. CHAPLIN, 1968.- Fish of the Bahamas and adjacent tropical waters. Livingston Publ. Co. Wynnewood (Pa.) USA, 771 pp. [ Links ]
CERVIGÓN-MARCOS, F., 1991.- Los peces marinos de Venezuela. Fundación La Salle de Ciencias Naturales. Vols. I y II (Monogr. 11 y 12). Caracas (Venezuela), 951 pp. [ Links ]
CERVIGÓN-MARCOS, F., 1993.- Los peces marinos de Venezuela. 2ª ed. Fund. Los Roques. Vol. I, Caracas (Venezuela), 425 pp. [ Links ]
CERVIGÓN-MARCOS, F., 1994.- Los peces marinos de Venezuela. 2ª ed. Fund. Los Roques. Vol. II, Caracas (Venezuela), 497 pp. [ Links ]
COGUA-ROMERO, P., G. DUQUE-NIVIA & N. H. CAMPOS-CAMPOS, 2006.- Contaminación por mercurio en peces de la Bahía de Cartagena, Caribe colombiano. II Congr. Colomb. de Zoología. Santa Marta (Mag.) Colombia. [ Links ]
DAHL, G., 1971.- Los peces del norte de Colombia. Min. Agricultura/INDERENA. Bogotá D. E. (Colombia), 391 pp. [ Links ]
DAROVEC, J. E. Jr., 1983.- Sciaenid fishes (Osteichthyes: Perciformes) of Western peninsula Florida. Mem. Hourglass Cruises, 6 (3): 1-73. [ Links ]
DUQUE-TOBÓN, F. & C. A. GÓMEZ-RANGEL, 1983.- El archipiélago de San Bernardo y su fauna íctica. Tesis Profesional. Fac. Biol. Mar. Univ. de Bogotá Jorge Tadeo Lozano, 264 pp. [ Links ]
ESCHMEYER, W. N., 1990.- Catalog of the Genera of recent fishes. California Academy of Sciences. San Francisco (USA), 501 pp. [ Links ]
FISCHER, W., (ed.). 1978.- FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic (Fishing Area 31). FAO, Roma (Italy), Vol. I-VII. [ Links ]
FRANKE-ANTE, R. & A. ACERO-PIZARRO, 1990.- Rémoras (Pisces: Echeneidae) conocidas de los mares colombianos. UBJTL-Rev. Bol. Ecotropica: Ecosistemas Tropicales, (23): 23-30. [ Links ]
GARAY-TINOCO, J. A., 1986.- Concentración y composición de hidrocarburos derivados del petróleo en aguas, sedimentos y peces de la Bahía de Cartagena. DIMAR-Bol. Cient. CIOH, 6: 41-62. [ Links ]
GÓMEZ-ALFARO, C., A. PÉREZ DE LA MOTTA & M. WILLIMAS DE CASTRO, 2006.- Aspectos reproductivos del pejerrey Odontesthes regia regia (Humboldt, 1821) en la zona del Pisco durante el período 1996-97 y mayo-julio de 2002, relacionados con su conservación. Ecología Aplicada, 5 (1,2): 141-147. [ Links ]
INP, 1976.- Catálogo de peces marinos mexicanos. Instituto Nacional de Pesca Secretaría de Industria y Comercio. Subsecretaría de Pesca, México D.F. (México), 462 pp. [ Links ]
JIMÉNEZ-REYES, M. F., 2007.- Caracterización trófica con énfasis en los hábitos alimenticios de algunos peces de la Bahía de Cartagena. Inf. Curso Biol. Marina. Fac. de Biol. Marina, Univ. de Bogotá Jorge Tadeo Lozano. [ Links ]
LINDEN, O., H. ARANGO, L. LINDESTROM & A. JERNELOV, 1980.- Observations of estuarine fishes a semi-polluted tropical estuary. I. V. L. Cartagena (Bol.), Colombia. Final Draft, 10 pp. [ Links ]
MADURO-BUSTOS, V. E., 1971.- Contribución al conocimiento de la biología y merística del machuelo Opisthonema oglinum (Le Sueur) (Pisces: Clupeidae) del Caribe colombiano. Tesis Profesional. Fac. Biol. Mar. Univ. de Bogotá Jorge Tadeo Lozano, 28 pp. [ Links ]
MERCADO-SILGADO, J. E., 1981.- Inventario preliminar de la fauna íctica de la Bahía de Cartagena y algunas consideraciones ecológicas. INDERENA-Rev Divulgación Pesquera, 16 (1-2): 1. [ Links ]
MISHIMA, M. & S. TANJI, 1983.- Maturacào e desova dos bagres marhinos (Osteichthyes: Ariidae) do complexo estuarino lagunar de Cananéia (25° S, 48° W). Bol. Inst. Pesca, Sao Paulo, 10: 129-141. [ Links ]
NELSON, J. S., 2006.- Fishes of the world. 4th Edition. Wiley Inter Science John Wiley and Sons Inc., New York (USA), 601 pp. [ Links ]
NIKOLSKY, G., 1963.- The ecology of fishes Academic Press. London (U.K.), 352 pp. [ Links ]
PAGLIARDINI, J. L., M. GÓMEZ, H. GUTIÉRREZ, S. ZAPATA, A. JURADO, J. GARAY & G. VERNETT,. 1982.- Síntesis del proyecto Bahía de Cartagena (Cartagena, Colombia). DIMAR-Bol. Cient. CIOH, (4): 49-110. [ Links ]
PARDO-RODRÍGUEZ F. I., J. F. OSPINA-ARANGO & R. ÁLVAREZ-LEÓN, 2003.- Evaluación de los hábitos alimenticios de la ictiofauna hallada en la Bahía de Cartagena, Colombia. Dahlia (Rev. Asoc. Colomb. Ictiol.), 6: 69-78. [ Links ]
RÍOS-RODRÍGUEZ, C. E., 1975.- Contribución al estudio biológico del jurel Caranx hippos. INDERENA-Rev. Divulgación Pesquera, 5 (1): 1-28. [ Links ]
ROS, R. & M. PÉREZ, 1978.- Contribución al conocimiento de la biología del pez sable Trichurus lepturus Linnaeus, 1758. Inv. Mar. Cienc. Univ. de La Habana, Serie 8 (7): 2-33. [ Links ]
SÁNCHEZ, J., 1991.- Catalogo dos principais peixes marinhos da Republica da Guiné-Bissau. Edt. INIP. Lisboa (Portugal), 347 pp. [ Links ]
SÁNCHEZ-GIL, P., A. YAÑEZ-ARANCIBIA & F. AMEZCUA-LINARES, 1981.- Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales en la Sonda de Campeche (Verano, 1978). An. Inst. Cienc. Mar y Limnol. Univ. Nal. Autón. México, 8 (1): 209-240. [ Links ]
SCHAUS, R. H., 1974.- Estimación del período de renovación de aguas en un estuario o bahía, con aplicaciones en la Bahía de Cartagena de Indias. ARC-DIMAR/DIVOC, Bogotá D.E. (Colombia), Inf. Técnico, 27 pp. [ Links ]
TAYLOR, W. R. & N. A. MENESES, 1978.- Ariidae. In: Fischer, W., (ed.). FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic (Fishing Area 31) FAO. Roma (Italy). Vol 1. [ Links ]
TORO-SUÁREZ, M. & F. VILLA-NAVARRO, 1983.- Algunos aspectos de la historia de Ariopsis bonillai (Milles) (Pisces: Ariidae) en la Ciénaga de Tesca. Tesis Profesional. Fac. Biol. Mar. Univ. de Bogotá Jorge Tadeo Lozano, 55 pp. [ Links ] URBANO-ROSAS, J., 1992.- Estado actual de la Bahía de Cartagena. DIMAR-Bol. Cient. CIOH, 10: 3-12. [ Links ]
VEGAS-VÉLEZ, M., 1987.- Ictiología. Edit. Consejo Nal. de Cienc. y Tecnol. Lima (Perú), 271 pp. [ Links ]
VELASCO-MORA, A. & P. VILLEGAS-RODRÍGUEZ, 1985.- Biología de Mugil incilis, M. liza y M. curema en la Ciénaga de Tesca. Tesis Profesional. Fac. Biol. Mar. Univ. de Bogotá Jorge Tadeo Lozano, 55 pp. [ Links ]
WHITHEAD, P. J. & R. VERGARA, 1978.- Elopidae. In: Fischer, W. (ed.). FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic (Fishing Area 31). FAO, Roma (Italy), Vol. II. [ Links ]
YAÑEZ-ARANCIBIA, A. & P. SÁNCHEZ-GIL, 1986.- Ecología de los recursos demersales marinos. A. G. T. 1ª edición. México D. F. (México), 228 pp. [ Links ]
YAÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES & J. W. DAY, 1980.- Fish community structure and function in Términos Lagoon a tropical estuary in the Southern Gulf of Mexico. pp. 465-482 In: V. Kennedy (ed.), Estuarine perspectives. Academic Press Inc., New York (USA). [ Links ]













