Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.15 no.2 Manizales July/Dec. 2011
EFECTS OF FERMENTATION OF SWINE MANURE IN SOLID STATE ON THE PATHOGENS PERSISTENCE IN SILAGE
* FR: 18-VIII-2011. FA: 26-X-2011.
1 Ph.D. Universidad de Caldas, Instituto de Biotecnología Agropecuaria. Calle 65 No. 26-10, Manizales, Colombia. E-mail: jestrada@ucaldas.edu.co
2 Ph.D. Colegio de Posgraduados - Campus Tabasco, Director Laboratorio de Ciencia Animal. Periférico Carlos A. Molina S/S Carr. Cárdenas Himanguillo Km 3, H. Cárdenas, Tabasco, México. E-mail: earanda@colpos.mx
3 Ph.D. Pontificia Universidad Católica de Chile, Facultad de Agronomía e Ingeniería Forestal, Departamento de Ciencias Animales. Avda. Libertador Bernardo O'Higgins 340, Santiago, Chile. E-mail: gpichard@uc.cl
4 Ph.D. Universidad de Caldas, Instituto de Biotecnología Agropecuaria, Director Doctorado Ciencias Agrarias. Calle 65 No. 26-10, Manizales, Colombia. E-mail: fhenao@ucaldas.edu.co
En este trabajo se probó el efecto de la fermentación en fase sólida de una mezcla de porcinaza fresca con caña de azúcar integral molida (CAIM), sobre la calidad sanitaria (microbiológica, parasitaria y viral) del producto resultante. Se realizó en los laboratorios del Instituto de Biotecnología Agropecuaria de la Universidad de Caldas. En una primera etapa se evaluó la presencia de patógenos parasitarios y microbianos al día 21 de fermentación, en diferentes mezclas de CAIM con porcinaza fresca; los organismos evaluados fueron: lactobacilos, mohos, levaduras, Coliformes totales y fecales, Salmonella, Clostridium sulfito reductor, Staphylococo de tipo coagulasa positivo, y parásitos. En la segunda etapa se estudió el efecto del tiempo de fermentación en fase sólida de una mezcla de CAIM con 40% de porcinaza con vitafert, a los 0, 3, 6, 9, 12, 15, 18 y 21 días, sobre la calidad sanitaria del ensilaje, mediante un diseño de bloques completos al azar, con tres replicaciones por tratamiento y un microsilo de PVC, de 2,5 kg, como unidad experimental. En esta etapa se realizó, además de los mismos recuentos de la etapa anterior, al día 21 de fermentación el recuento de mohos y la evaluación por PCR en tiempo real del virus del síndrome reproductivo y respiratorio porcino (PRRS) y por PCR multiplex, la presencia de los siguientes virus: parvovirus porcino (PVP), circovirus porcino tipo I (PCV-I), circovirus porcino tipo II (PCV-II), y herpesvirus porcino tipo I (HVP-I) o virus de la enfermedad de Aujeszky. Complementariamente se evaluó la presencia de bacterias, mohos, levaduras y parásitos, en la mezcla de 21 días de fermentación, los días 22, 23, 26, 27 y 28, con el propósito de analizar lo sucedido en la semana siguiente a la apertura del microsilo, para lo cual se cerró el recipiente sin restablecer el vacío, como ocurre en la práctica.
Los huevos de parásitos presentes en la porcinaza fresca, fueron inactivados a partir del tercer día de fermentación. Ninguna muestra evidenció crecimiento de mohos y levaduras. Los Coliformes totales y fecales se redujeron a niveles aceptables (menos de 1000 NMP/g MS) para la alimentación animal, desde el sexto día. La carga de Salmonella, Clostridium sulfito reductor, Staphylococo de tipo coagulasa positivo, encontrada en la porcinaza fresca desapareció por efecto de la fermentación, desde el tercer día. Las muestras fueron negativas para los cinco virus evaluados. En concordancia con lo expuesto anteriormente, se puede afirmar que en este estudio se ha probado la inocuidad del ensilaje de CAIM enriquecido con porcinaza y la viabilidad de su uso en alimentación de animales.
Palabras clave: porcinaza, ensilaje, inocuidad, alimentación animal.
AbstractIn this work the effects of fermentation in solid state of fresh swine manure with whole ground sugar cane (WGSC) on sanitary quality (microbiological, parasitic and viral) on the resulting product was established.. The study was conducted in the Institute of Agricultural Biotechnology laboratories at Universidad de Caldas. In the first phase, the presence of parasitic and microbial pathogens by the 21st day of fermentation, of different mixes of WGSC with fresh swine manure was evaluated; the evaluated organisms were: lactobacilli, molds, yeasts, total and fecal Coliforms, Salmonella, sulphite reductive Clostridium, coagulasepositive type Staphylococcus, and parasites. In a second phase the effect of fermentation time in solid phase (FTSP) of a mixture of WGSC with 40% fresh swine manure with vitafert at 3, 6, 9, 12, 15, 18 and 21 days, on the sanitary quality of the silage was studied using a complex block design at random with three replicas per treatment and a 2.5 Kg PVC microsilo as experimental unit. Besides the same re-counts carried out in the previous stage, in this stage the re-count of molds and evaluation of the porcine reproductive and respiratory syndrome (PRRS) virus by PCR in real time was carried out on the 21st day and by neans of multiplex PCR the presence of the following viruses was detected: porcine parvovirus (PPV), porcine circovirus type I (PCV-I), porcine circovirus type II (PCV-II), and porcine herpervirus type I (PHV-I) or Aujeszky's disease virus. Complementary, the presence of bacteria, molds, yeasts and parasites was evaluated in the 21 days fermentation sample on days 22, 23, 26, 27, and 28 with the purpose of analyzing what had happened the week after the microsilo opening. For this purpose the recipient was closed without reestablishing the vacuum, as it happens in real practice.
The eggs of parasites present in the fresh swine manure were inactivated from the third day of fermentation. No sample evidenced mold and yeast growth, The total and fecal Coliforms reduced to acceptable levels (less than 1.000 NMP/g MS) for animal feed from the sixth day. The charge of Salmonella, sulphite reductive Clostridium and coagulase-positive type Staphylococcus , found in the fresh swine manure disappeared because of fermentation effect, from the third day. The samples were negative for the five viruses evaluated. In accordance with has been presented above, it can be said that this study has demonstrated the innocuous of CAIM silage enriched with swine manure and, therefore, the feasibility of use in animal feeding.
Key words: swine manure, silage, innocuousness, animal feeding.
Las excretas animales y particularmente las de cerdo y aves de corral ocasionan graves problemas de contaminación, debido particularmente a la facilidad con que sus componentes se integran al agua y a los olores que generan. Las excretas pueden convertirse, por tanto, en una barrera para la producción animal. Una de las estrategias de solución a esta problemática podría ser la utilización de excretas en la alimentación animal (BARRÓN et al., 2000), especialmente bajo la forma de ensilaje para el ganado vacuno y otros rumiantes (GARCÍA et al., 2007).
A pesar de que el uso de excretas frescas y procesadas en la alimentación animal se ha convertido en una práctica común (CAMPABADAL, 2003; OGUNBANWO et al., 2003; BOUCURT et al., 2006), es preciso considerar que a pesar de que aportan pequeñas cantidades de nutrientes, poseen una carga microbiológica y parasitaria muy elevada, potencialmente agresiva para las poblaciones animales y humanas. La evaluación de la presencia de estos organismos en las diferentes vías de utilización de excretas en alimentación animal cobra gran importancia, y constituye actualmente un requisito ineludible (ESPINOZA et al., 2009). En investigaciones realizadas por SOLLINS et al. (1984) se comprobó que en estiércoles frescos y fermentados bajo condiciones caracterizadas por: temperaturas muy bajas, pH ácido, falta de agua y de oxígeno, ocurre siempre la destrucción de microorganismos y parásitos. Además, en múltiples investigaciones (MARTÍNEZ-GAMBA et al., 2001; RAMÍREZ et al., 2005; SERRANO et al., 2008), se ha comprobado mediante métodos de cultivo convencionales y técnicas moleculares, que organismos como: Salmonellas, Escherichia coli, Campylobacter spp., Yersinia spp., Listeria spp., Clostridium, virus de Aujeszky y virus causante de ojo azul, son destruidos durante el proceso de fermentación en fase sólida de excretas de cerdo.
Los huevos de los parásitos presentes en la porcinaza son muy susceptibles a temperaturas superiores a los 30°C y a un pH cercano a 4 (REYES, 1963; NÚÑEZ et al., 1987). NÚÑEZ et al. (1987) encontraron que a 35°C y a pH próximo a 4, se inactivan todos los huevos de parásitos, con la excepción del 78,6% de los huevos de Ascaris; en una experiencia similar, REYES (1963) registró un descenso de la viabilidad de los huevos de Ascaris hasta el 8%, cuando aumentó la T° a 38°C. La persistencia de los huevos de Ascaris es explicada por estos mismos autores por las características particulares de la cutícula de los huevos de estos parásitos.
Para la identificación o cuantificación de agentes infecciosos como los virus de la familia de los Herpesvirus, virus respiratorios, enterovirus, virus JC, virus BK, etc., se cuenta con pruebas moleculares como la PCR en tiempo real (COSTA, 2004) y la PCR multiplex (HUANG et al., 2004). Del mismo modo existen desarrollos similares para bacterias que no crecen, crecen mal o crecen muy lentamente en medios de cultivo.
El presente trabajo se realizó con el propósito de establecer la calidad sanitaria (microbiológica, viral y parasitaria) de ensilajes de mezclas de caña de azúcar integral con diferentes niveles de incorporación de porcinaza fresca.
MATERIALES Y MÉTODOSEste trabajo se desarrolló en el Instituto de Biotecnología Agropecuaria de la Universidad de Caldas, en Manizales, ubicado a 05°04" latitud N - 75°31" longitud O, con temperatura media de 18°C, humedad relativa media de 80% y 2150 msnm de altitud. Se uso porcinaza recién emitida colectada manualmente de cerdos de 40 a 60 kg de peso vivo, alimentados con una dieta basada en maíz, sorgo, torta de soya, harina de arroz, aceite acidulado, carbonato de calcio R 35, sal, bentonita, núcleo cerdos sulfato de cobre, zinc, biosure L, metionina liquida, L-lisina.
El estudio se desarrolló en dos etapas. En la primera etapa, se realizó un arreglo factorial de 3x2 (20, 30 y 40% de porcinaza en base húmeda, con y sin FP de 48 horas), en un diseño de bloques completos al azar (se bloqueó por la fecha de inicio del experimento), con 3 replicaciones por tratamiento y un microsilo como unidad experimental. De acuerdo con este diseño, a la caña de azúcar integral previamente picada con molino de martillo (CAIM), se le adicionó 20, 30 y 40% de porcinaza, y se sometió a fermentación durante 21 días, al cabo de los cuales se realizó la evaluación microbiológica y parasitaria en muestras de 120 g.
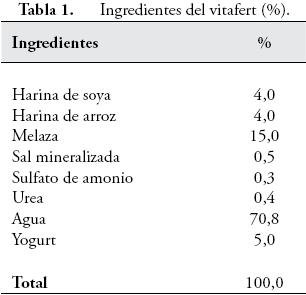
Se utilizó porcinaza con 36,16% de MS, enriquecida con vitafert, un producto biológico de color oscuro, olor agradable, obtenido como resultado de la FLS de la mezcla referida en la Tabla 1, preparado de acuerdo con ARIAS (2010). Este aditivo es un probiótico rico en bacterias lácticas, levaduras y sus metabolitos, que estimula la producción de ácidos orgánicos de cadena corta (láctico, acético, propiónico, succínico, y pirúvico), de vitaminas y enzimas; además, disminuye el pH, incrementa y estabiliza la proteína, aumenta la digestibilidad de la materia seca y disminuye la fracción de la pared celular (ELÍAS & HERRERA, 2010). El aditivo fue agregado a razón de 0,4 kg por kilo de porcinaza fresca, en base húmeda, es decir con un 28,6% de vitafert en la mezcla final de porcinaza enriquecida.
La prueba se realizó en 18 microsilos de PVC de 2,5 kg de capacidad, con válvula de vacío y cierre hermético. Cada uno de los microsilos fue llenado con la mezcla correspondiente, compactado, tapado y sellado con cinta adhesiva, y a todos se les realizó extracción del aire (vacío) con una aspiradora Karcher®, por 10 segundos.
En la segunda etapa se realizó un diseño completamente al azar, con 3 replicaciones por tratamiento y un microsilo como unidad experimental, para evaluar el efecto del tiempo de fermentación en fase sólida (TFFS), a los 3, 6, 9, 12, 15, 18 y 21 días, de una mezcla de CAIM con 40% de porcinaza con vitafert que fue sometida a fermentación aeróbica previa de 48 horas. Este ensilaje fue seleccionado en un estudio previo (ESTRADA et al., 2011), por sus características físico-químicas. Se realizaron evaluaciones microbiológicas y parasitarias, en muestras de 120 g de porcinaza fresca, de la mezcla antes de iniciar la fermentación, y de la mezcla en cada uno de los días de fermentación.
La prueba se realizó en 21 microsilos de PVC de 2,5 kg de capacidad, con válvula de vacío y cierre hermético, llenados de manera similar a la primera etapa.La mezcla con 21 días de fermentación fue evaluada, además, a los 22, 23, 26, 27 y 28 días, con el propósito de analizar lo sucedido en la semana siguiente a la apertura del miocrosilo; para lo cual se cerró el recipiente sin restablecer el vacío, como ocurre en la práctica de campo.
En la primera etapa se evaluó la presencia de huevos de parásitos, lactobacilos, levaduras, Coliformes totales y fecales, Salmonella, gérmenes del género Clostridium, de tipo sulfito reductores, y gérmenes del género Staphylococo, de tipo coagulasa positivos. En la segunda etapa se evaluó, además de los organismos anteriores, la presencia de mohos.
La metodología empleada para las evaluaciones anteriores fue la siguiente: recuento de huevos de parásitos por el método de Vajda, en cámara de McMáster, y por flotación en solución salina saturada (VÉLEZ, 1995); determinación de lactobacilos y levaduras en agar RMS (DE MAN et al., 1960); recuento de mohos y levaduras en agar rosa de bengala adicionado de cloranfenicol (MARSHALL, 1993); recuento de Coliformes totales y fecales en caldo Fluorocult® LMX-Broth (OSSMER, 1993; MANAFI, 1996), mediante el índice del número más probable por gramo de materia seca (NMP/g MS) (MORENO et al., 2009; ANDINO & CASTILLO, 2010); recuento de gérmenes del género Salmonella en agar Rambach® (RAMBACH, 1990; OSSMER, 1992); recuento de gérmenes del género Clostridium, de tipo sulfito reductores por el método de PASCUAL & CALDERÓN (2000) [ISO 6888 construida por DE BUYSER (2003)]; recuento de gérmenes del género Staphylococo, de tipo coagulasa positivo por el método de BAIRD-PARKER (1962).
Se evaluó la presencia del virus del síndrome reproductivo y respiratorio porcino (PRRS), del parvovirus porcino (PVP), circovirus porcino tipo I (PCV-I), circovirus porcino tipo II (PCV-II), y herpesvirus porcino tipo I (HVP-I) o virus de la enfermedad de Aujeszky. El análisis se hizo mediante PCR en tiempo real, para virus de PRRS (COSTA, 2004) y PCR multiplex, para los demás virus (HUANG et al., 2004).
El análisis estadístico se realizó mediante el paquete estadístico R-project.
RESULTADOS Y DISCUSIÓNLos valores de pH encontrados fluctuaron entre 3,74 y 3,97 y los de T°, entre 18,3 y 19,3°C, los cuales confirman las óptimas condiciones físico-químicas de las preparaciones.
ParásitosEn la porcinaza fresca, antes de ser mezclada con vitafert, se encontró un recuento de 45 quistes de Eimeria spp., 21 huevos de Hyostrongylus spp. y 15 huevos de Oesophagostomum spp. por gramo de muestra; lo cual concuerda con ALCAÍNO et al. (1989), quienes determinaron que en la porcinaza fresca es común encontrar huevos y larvas de Nemátodos como: Choerostrongylais pudendotectus, Metastrongylus apri y M. salmi, Hyostrongylus rubidus, Physocephalus sexalatus, Asearops strongylina, Ascaris suum, Oesophagostomum dentatum y O. longicaudum, Trichuris suis, Strongyloides ransomi y protozoos intestinales como: Isospora suis (Balantidium coli y diversas Coccidias del género Eimeria). En la primera etapa se detectaron huevos infértiles en 22 microsilos (equitativamente repartidos en los seis tratamientos probados). En la segunda etapa, al tercer día de fermentación se encontraron 10 quistes de Eimeria spp., 9 huevos de Hyostrongylus spp. y 6 huevos de Oesophagostomum spp. por gramo de muestra. A partir de este momento todas las muestras fueron negativas a parásitos. Estos resultados son similares a los reportados por autores como NÚÑEZ et al. (1987), MORAIS et al. (1999), BARRÓN et al. (2000) y OLIVA et al. (2004), quienes detectaron que en ensilajes con excretas, los huevos de los parásitos desaparecen a consecuencia del descenso del pH. Se corrobora, por tanto, la efectividad de la fermentación en fase sólida para lograr inocuidad parasitaría en la incorporación estratégica de estiércoles, como la porcinaza, en mezclas para producción de ensilajes. Es de resaltar que en este estudio, la eliminación de los parásitos se logró a partir del tercer día de fermentación.
Coliformes totales y fecalesLa porcinaza fresca (sin vitafert), registró un valor ≥2400 NMP/g de MS, tanto para Coliformes totales como fecales; este resultado es concordante con OLIVA et al. (2004), quienes reportan 1 x 10-7 NMP/g de MS de Coliformes fecales en porcinaza fresca. Para Coliformes totales, se registró solo en una repetición un valor >1100 NMP/g de MS, que según el CODEX ALIMENTARIUS (2000), es superior a lo permitido en la Norma Oficial Mexicana, NOM-EM-034-FITO-2000, la cual establece que tanto los Coliformes totales como los fecales deben estar en los alimentos orgánicos por debajo de 1000 NMP/g de MS. Sin embargo, este resultado carece de trascendencia en razón a que para Coliformes fecales, todos los valores registrados fueron <23 NMP/g de MS, o sea las muestras se podrían considerar inocuas (CODEX ALIMENTARIUS, 2000). Lo anterior se asemeja a lo registrado por BERGER et al. (1981), quienes evidenciaron ausencia total de Coliformes, a consecuencia del proceso de fermentación durante el ensilaje, adicionalmente, BOUCOURT et al. (2006) encontraron que los Coliformes totales y fecales disminuían cuando decrecía la cantidad de excreta en la mezcla.
En la segunda etapa, al día tres de fermentación, se encontró un valor de 210 NMP/g de MS de Coliformes totales y de <23 NMP/g de MS para fecales. Después del sexto día de fermentación los valores para Coliformes totales oscilaron entre 4 y 500 NMP/g de MS y para E. coli de <3 NMP/g de MS. En la evaluación realizada el día 23, o sea, dos días después de haber destapado los microsilos, se encontró una muestra con 500 NMP/g de MS de Coliformes totales, pero con <3 NMP/g de MS para E. Coli, probablemente debido a falta de homogeneidad del material ensilado y a las particularidades de la fermentación en fase sólida. Entre el día 24 y el 28 los resultados fueron de <23 NMP/g de MS para Coliformes totales y <3 NMP/g de MS para E. Coli. Investigaciones recientes señalan que en las fermentaciones anaeróbicas se da un proceso de ajuste ecológico, donde unos microorganismos surgen como dominantes, y otros disminuyen en su número o desaparecen, debido a la competencia por los nutrientes y a la producción de sustancias antimicrobianas, como algunos ácidos orgánicos, las bacteriocinas y el peróxido de hidrógeno (ROBREDO & TORRES, 2000; OGUNBANWO et al., 2003).
En el presente estudio se ha comprobado, por tanto, que es posible obtener un producto inocuo para Coliformes, al someter a fermentación anaeróbica la mezcla de CAIM con 20 a 40% de porcinaza, adicionada con vitafert y con fermentación aeróbica previa de 48 horas.
Bacterias del género Clostridium, de tipo sulfito reductoresEn la etapa uno, solo en una repetición, se encontró un valor de 20 x 10-1 UFC/g de bacterias del género Clostridium, de tipo sulfito reductores; este resultado pudo haberse generado en una excesiva exposición al aire durante la extracción de la muestra, lo cual produce un deterioro aeróbico, generando como consecuencia su contaminación con microorganismos, potencialmente del género evaluado (ANDRADE & MOHAMAD, 2010). Los demás valores encontrados en la etapa uno fueron <10 UFC/g, que indican inocuidad de las muestras. El tercer día de fermentación en la segunda etapa experimental, se determinó que el material se encontraba altamente contaminado con Clostridium, de tipo sulfito reductores, debido a que se encontró un número incontable de colonias en la dilución 10-1, tres colonias en la dilución 10-2 y dos colonias en la dilución 10-3. Después del día seis de fermentación, todas las muestras analizadas arrojaron valores <10 UFC/g, o sea, inocuas para la salud animal y humana. En consecuencia, es posible afirmar que la fermentación anaeróbica del material evaluado en este estudio elimina, desde el sexto día, el riesgo de contaminación con bacterias del género Clostridium, de tipo sulfito reductores.
Bacterias del género Staphylococcus, de tipo coagulasa positivoLos recuentos registrados en ambas etapas experimentales, para bacterias del género Staphylococcus, de tipo coagulasa positivo, fueron <100 UFC/g. El mismo resultado fue obtenido por GARCÍA et al. (1991), al analizar muestras fermentadas de excreta porcina. Este resultado, nos indica valores compatibles con la salud animal y humana, y por tanto, que el proceso de ensilaje es útil para prevenir la transmisión de este tipo de gérmenes, en mezclas en las cuales se ha incorporado hasta un 40% de porcinaza.
Bacterias del género Salmonella spp.A pesar de que en la porcinaza fresca se encontraron recuentos de 130 colonias/g de Salmonella spp. en las dos etapas experimentales se confirmó la ausencia de la bacteria. Este resultado coincide con lo reportado por BERGER et al. (1981) y por HENRY et al. (1995), quienes confirmaron que la Salmonella no sobrevive expuesta a un pH de 4,0, por más de 24 horas.
Para el caso de esta bacteria, se confirma también en este estudio que la fermentación en fase sólida puede ser el medio para prevenir su transmisión a través de la porcinaza.
Bacterias ácido lácticas (BAL), levaduras y mohosEn las 144 muestras de la primera etapa, se encontraron recuentos mayores a 50000 UFC/g de BAL, lo cual es un buen indicador de la calidad de la fermentación ocurrida en los microsilos, o sea un proceso con adecuada producción de ácido láctico, estabilidad del pH en niveles ácidos, factores que garantizan la muerte de los organismos patógenos y la proliferación de microorganismos benéficos para la fermentación (BAL) (BERGER et al., 1981; ROBREDO & TORRES, 2000). En esta misma etapa, se encontraron 31 muestras positivas a levaduras (6 y 9 para 20%, 4 y 7 para 30% y 3 y 2 para 40% de IP con y sin fermentación previa, respectivamente), estos datos señalan que a menor cantidad de porcinaza en su incorporación, se encuentra una mayor cantidad de levaduras, seguramente debido a lo planteado por RANDBY et al. (1999), quienes encontraron que bajo condiciones tanto aeróbicas como anaeróbicas las levaduras son indeseables, por fermentar los azúcares (de la caña de azúcar), produciendo etanol y CO2. En la segunda etapa, solo se encontraron levaduras en una de las muestras tanto del día tres (52, 31, 23, 19, 8 y 1 colonias para las diluciones 10-2 a 10-7), como del día 26 (>200 UFC/g para las diluciones 10-2 y 10-3, y 199, 111, 86 y 31 UFC/g para las diluciones 10-4 a 10-7) de fermentación. Observaciones realizadas para levaduras por ANDRADE & MOHAMAD (2010), determinaron en ensilajes recién expuestos al aire, recuentos cercanos a 100.000 levaduras por gramo, las cuales pueden doblar su recuento en aproximadamente 2 horas y llegar a 1 millón en 4 a 5 horas de exposición. Lo anterior señala la importancia de analizar rápidamente la muestra, después de su toma.
VirusLas evaluaciones realizadas para determinar la presencia del virus del síndrome reproductivo y respiratorio porcino (PRRS), el parvovirus porcino (PVP), los circovirus porcino tipo I y II (PCV-I y PCV-II), y el herpesvirus porcino tipo I (HVP-I) o virus de la enfermedad de Aujeszky, arrojaron resultados negativos, confirmándose por tanto que ensilaje de 21 días de fermentación, con 40% de incorporación porcinaza, y con fermentación previa de 48 horas, es un medio en el cual no se han transmitido estos patógenos. MARTÍNEZ-GAMBA et al. (2001), realizaron un experimento donde inocularon los virus de Aujeszky y el causante de ojo azul, en ensilajes que incluían porcinaza, demostrando su total eliminación durante el proceso de fermentación en fase sólida. Lo anterior nos permitiría avizorar que a través del ensilaje, se puede lograr la destrucción de los virus presentes en la porcinaza fresca.
CONCLUSIONES Y RECOMENDACIONESEl presente estudio determinó, que a partir del tercer día de fermentación, se logró la eliminación total de los parásitos presentes en la porcinaza fresca.
Así mismo, se obtuvo un producto inocuo para Coliformes totales y fecales, al someter a fermentación anaeróbica la mezcla de CAIM con 20 a 40% de porcinaza, adicionada con vitafert y con fermentación aeróbica previa de 48 horas.
También se puede afirmar que desde el sexto día de fermentación, las bacterias del género Clostridium, de tipo sulfito reductores, son totalmente eliminadas del ensilaje.
Los resultados obtenidos para Staphylococcus, de tipo coagulasa positivo, nos indican valores compatibles con la salud animal y humana, y por tanto, es posible su incorporación hasta el 40% de porcinaza.
Para Salmonella spp. se confirma también en este estudio que la fermentación en fase sólida puede ser el medio para prevenir su transmisión a través de la porcinaza.
El presente estudio ratifica que a través del ensilaje se elimina la presencia de los cinco virus analizados (PRRS, PVP, PCV tipo I y II y HVP-I).
En este estudio se logró verificar por medios moleculares, la ausencia de cinco virus de los más importantes para la salud porcina en Colombia [virus del PRRS, el parvovirus porcino (PVP), los circovirus porcino tipo I y II (PCV-I y PCV-II), y el herpesvirus porcino tipo I (HVP-I)].
En todas las muestras analizadas se encontró un número de bacterias ácido lácticas compatible con una buena fermentación y su correspondiente disminución del pH a niveles cercanos a 4,0. Para levaduras, se halló que el 22% de las muestras presentaron una tendencia a ser más frecuentes en bajos niveles de incorporación de la porcinaza.
Se sugieren estudios adicionales de la porcinaza con otras materias primas, para desmitificar su utilización como subproducto en la alimentación a través del ensilaje y adicionalmente mitigar su impacto ambiental.
AGRADECIMIENTOSAgradecimientos a la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas por los recursos asignados al primer autor para la realización de sus estudios Doctorales.
ALCAINO, N., LAVAL, E., GOR T., PINOCHET L. & DIAZ L. Isosporiosis y Criptosporidiosis en cerdos de criaderos industriales de la región metropolitana de Chile. Areh. Med. Vet. 21. 131-135.1989. [ Links ]
ANDINO, F. & CASTILLO, Y., 2010.- Microbiología de los alimentos: Un enfoque práctico para la inocuidad alimentaria. Capítulo 4: Métodos de detección de contaminación microbiana: 46-59. [ Links ]
ANDRADE R. & MOHAMAD L., 2010.- Estrategias para mejorar la estabilidad aeróbica del ensilaje (en) Producción y manejo de forrajes conservados. [en línea] Sitio Argentino de Producción Animal, 18 (219): 58-62. Obtenido el 27 de septiembre de 2011, desde http://www.produccionbovina.com [ Links ]
ARIAS, F.T., 2010.- Efectos de los niveles de vitafert y melaza en la pollinaza fermentada aeróbica: Tesis de Maestría, Colegio de postgraduado - Campus Tabascos, Cárdenas - México. [ Links ]
BAIRD-PARKER, AC., 1962.- An improved diagnostic and selective medium for isolating coagulase positive staphylococci. J. appl. Bacterol., 25: 12-16. [ Links ]
BARRÓN, A., ROSEMBERG, M. & MENDOZA, E., 2000.- Utilización de porcinaza en la elaboración de ensilado de pasto elefante enano (Pennisetum purpureum cv. Mott). Anales científicos, XLIV. Universidad Nacional Agraria La Molina, Perú [ Links ].
BERGER, J.C.A., FONTENOT, J.P., KOMEGAY, E.T. & WEBB, KE., 1981.- Feeding swine waste. I. Fermentation characteristics of swine waste ensiled with ground hay or ground corn grain. J. Anim. Sci., 52: 1388-1403. [ Links ]
BOUCOURT, R., CARRASCO, E., LÓPEZ, A., RODRÍGUEZ, Z. & GUTIÉRREZ, O., 2006.- Microbiota aerobia en caña fermentada con excreta vacuna como alternativa alimentaria. Rev. Cubana de Cienc. Agríc., 40 (3): 279-282. [ Links ]
CAMPABADAL, C., 2003.- El valor nutritivo de la porcinaza y su uso en la alimentación del ganado de carne: 23-42 (en) Memorias Segundo Seminario Internacional de Porcicultura y Medio Ambiente. Asociación Colombiana de Porcicultores. [ Links ]
COMISIÓN DEL CODEX ALIMENTARIUS., 2000.- Normas de aplicación de residuos animales en México. Manual de procedimientos NOM-EM-034-FITO-2000. Diario Oficial de la Federación, del 15 de noviembre de 2000. México D.F. [ Links ]
COSTA, J., 2004.- Reacción en cadena de la polimerasa (PCR) a tiempo real. Capítulo 12. Puesta al día en métodos microbiológicos para el diagnóstico clínico, 32 (1): 88-93. [ Links ]
DE BUYSER, M.L.; LOMBARD, B., SCHULTEN, S.M., IN'T VELD, P.H., SCOTTER, S.L., ROLLIER, P. & LAHELLEC, C., 2003.- Validation of EN ISO standard methods 6888 Part 1 and Part 2: 1999-Enumeration of coagulase-positive Staphylococci in foods. Int. J. of Food Microbiol., 83: 185-194. [ Links ]
DE MAN, J.D., ROGOSA, M. & SHARPE, M.E., 1960.- A Medium for the Cultivation of Lactobacilli. J. Appl. Bacteriol., 23: 130-135. [ Links ]
ELÍAS, A. & HERRERA, F.R., 2010.- Producción de alimento para animales a través de procesos biotecnológicos sencillos con el empleo de Microorganismos Eficientes Benéficos Activados (MEBA). Vitafert, La Habana, Cuba. [ Links ]
ESPINOZA, Y., HERNÁNDEZ, M.J., BARRERA, T.V. & OBISPO, N.E., 2009.- Efecto de la alimentación animal sobre la calidad microbiológica de estiércoles usados como fertilizantes. Zootec. Tróp., 27 (2): 151-161. [ Links ]
ESTRADA, J., ARANDA, E.M., PICHARD, G. & HENAO, F.J., 2011.- Ensilaje de caña de azúcar integral enriquecido con porcinaza fresca. Rev. MVZ Córdoba., En arbitraje. [ Links ]
GARCÍA, E.P., SOLORZANO, I.R. & VÁZQUEZ, E.G., 1991.- Aislamiento de micro-organismos patógenos (aerobios) en estiércol fresco de cerdo antes y después de ser utilizado como integrante en la dieta de toretes. I Encuentro Universitario de Investigación. Universidad Michoacana de San Nicolás de Hidalgo, México. p. 91-92. [ Links ]
GARCÍA, Y., ORTIZ, A. & LON WO, E., 2007.- Efecto de los residuales avícolas en el ambiente. Instituto de Ciencia Animal, La Habana, Cuba. [ Links ]
GUTIÉRREZ, E. & PRESTON, T.R., 1995.- ¿El reciclaje del estiércol fresco de cerdo en la alimentación de rumiantes conduce a la producción sostenible? LRRD, 6 (3). [ Links ]
HUANG, C., HUNG, J.-J., WU, C.-Y. & CHIEN, M.-S., 2004.- Multiplex PCR for rapid detection of pseudorabies virus, porcine parvovirus and porcine circoviruses. Vet. Microbiol., 101: 209-214. [ Links ]
MANAFI, M., 1996.- Fluorogenic and chromogenic enzyme substrates in culture media and identification tests. Int. J. Food Microbiol., 31: 45-58. [ Links ]
MARSHALL, RT., 1993.- Standard methods for the examination of dairy products. 16th ed. American Public Health Association, Washington, DC. [ Links ]
MARTÍNEZ-GAMBA, R., PRADAL-ROA, P., CASTREJÓN, F.P., HERRADORA, M., GALVÁN, E. & MERCADO, C., 2001.- Persistence of Escherichia coli, Salmonella choleraesuis, Aujeszky's Disease virus and blue eye disease virus in ensilages base on the solid fraction of pig. J. Appl. Microbiol., 91: 750-758. [ Links ]
MORAIS, M.G., TOMICH, T.R., AMORIN, J.R.P. & GONÇALVES, L.C., 1999.- Consumo voluntário e digestibilidade da silagem de milho associada ao esterco de poedeiras. Arq. Bras. Med. Vet. Zoot., 51: 115-121. [ Links ]
MORENO, B., DÍEZ, V., GARCÍA, M.L., MENES, I., GUTIÉRREZ, L.M. & POLLEDO, J.J., 2009.- Microorganismos de los alimentos. Bacterias Coliformes. Vol. 1. 2da ed. Editorial Acribia, S.A. p. 131-145. [ Links ]
NÚÑEZ, F., URRUTIA, F., URCELAY, S. & OVIEDO, P., 1987.- Estudio microbiológico de excretas de cerdo sometidas a biodigestión anaeróbica en laboratorio. Avanc. Cienc. Vet., 2 (1): 37-41. [ Links ]
OGUNBANWO, S.T., SANNI, A.I. & ONILUDE, A.A., 2003.- Characterization of bacteriocin produced by Lactobacillus plantarum F1 and Lactobacillus brevis OG1. Afr: J. Biotechnol., 2: 21-29. [ Links ]
OLIVA, M., ELASCO, D., BALLINAS, E., SALVADOR, M. & GUTIÉRREZ, F., 2004.- Estudios de eliminación de microorganismos patógenos de residuales porcinos en un biorreactor con tiempo de retención corto. Rev. Comp. Prod. Porcina, 2 (Supl. 1). [ Links ]
OSSMER, R., 1992.- Salmosyst and Rambach-agar. A rapid alternative for the detection of Salmonella. Congress-Poster - Salmonella and Salmonellosis. Ploufragan/Saint-Brieux - France. [ Links ]
________., 1993.- Simultaneous detection of total coliforms and E. coli - Florocult LMX broth. Food Microbiol., 93: 202-209. [ Links ]
PASCUAL, M. del R. & CALDERÓN, V., 2000.- Investigación y recuento de Clostridium sulfito reductor: 73-76 (en) Microbiología alimentaria: Metodología analítica para alimentos y bebidas. 2a ed. Díaz de Santos, Madrid. [ Links ]
RAMBACH, A., 1990.- New plate medium for facilitated differentation of Salmonella spp. From Proteus spp. And other enteric bacteria. Appl. Environ. Microb., 56: 301-303. [ Links ]
RAMÍREZ, G., MARTÍNEZ, R., HERRADORA, M., CASTREJÓN, F. & GALVAN, R., 2005.- Isolation of Salmonella spp. from liquid and solid excreta prior to and following ensilage in ten swine farms located in central Mexico. Bioresource Technol., 96: 587-595. [ Links ]
RANDBY, A.T., SELMER-OLSEN, I. & BAEVRE, L., 1999.- Effect of ethanol in feed on milk flavor and chemical composition. J. Dairy. Sci., 82: 420-428. [ Links ]
REYES, M., 1963.- The effect of aerobic and anaerobic digestion on eggs of Ascaris lumbricoides var. suum in night soil. Am. Trop. Med. Hyg., 12: 46-55. [ Links ]
ROBREDO, B. & TORRES, C., 2000.- Bacteriocin production by Lactobacillus salivgarius of animal origin. J. Clin. Microbiol., 38: 10-16. [ Links ]
SERRANO, E., CASTREJÓN, F., HERRADORA, M.A., RAMÍREZ, A.H., ANGELES, S. & BUNTINX, S.E., 2008.- Fungal survival in ensiled swine faeces. Bioresource Technol., 99: 3850-3854 [ Links ]
SOLLINS, P., SPYCHER, G. & GLASSMAN, C.A., 1984. Virus del síndrome reproductivo y respiratorio porcino (PRRS), el parvovirus porcino (PVP), los circovirus porcino tipo I y II (PCV-I y PCV-II), y el herpesvirus porcino tipo I (HVP-I) o virus de la enfermedad de Aujeszky, - Net nitrogen mineralization from light and heavy fraction soil organic matter. Soil Biol. Biochem., 16 (1): 31-37. [ Links ]
VÉLEZ, A., 1995.- Guías en parasitología Veterinaria. La coprología y otras técnicas de diagnóstico. Capítulo II. Métodos de Vajda, Mc Máster y Koffoyd y Barber. 2da ed. Ed. Exitodinamica, Medellín, Colombia. p. 75-104. [ Links ]














