Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.15 no.2 Manizales July/Dec. 2011
POPULATION DENSITY OF RANITOMEYA OPISTHOMELAS ASOCIATED TO ENVIRONMENTAL AND HABITAT VARIABLES IN FOUR FOREST IN THE CENTRAL ANDES, COLOMBIA
* FR: 12-I-2011. FA: 22-VI-2011.
1 Ingeniera Ambiental. Universidad Católica de Oriente. E-mail: catalinarios@uco.edu.co
2 Ingeniera Ambiental. Universidad Católica de Oriente. E-mail: leidypuerta@uco.edu.co
3 Docente Investigador Universidad Católica de Oriente. E-mail: jsierra@uco.edu.co
El presente estudio determinó la asociación entre la densidad poblacional de Ranitomeya opisthomelas con las variables ambientales y de hábitat en cuatro bosques del oriente antioqueño. Para ello se realizaron cuatro muestreos por sitio, en temporadas secas y de lluvia. Se registró el número de individuos así como las variables ambientales y de hábitat en cada localidad (temperatura ambiental, porcentaje de cobertura de dosel, número de bromelias, porcentaje de herbáceas, número de troncos caídos, número de árboles con DAP>10 y humedad ambiental en cada bosque). Los datos se procesaron estadísticamente con regresiones logísticas y análisis de correspondencia canónica. Los resultados indicaron que la densidad poblacional de R. opisthomelas fue muy variable, la Isla del Sol presentó el mayor número de individuos seguida de El Carmen, Isla Cantarina y Guatapé, respectivamente. La densidad poblacional en el periodo húmedo fue diferente respecto al seco solo en Guatapé y la Isla Cantarina. Finalmente, el análisis de correspondencia canónica muestra que al parecer no hay una asociación entre la densidad de ranas y tipo el bosque.
Palabras clave: Ranitomeya opisthomelas, anfibios, regresión logística, Canoco.
AbstractThis study determined the association between the population density of Ranitomeya opisthomelas with the environmental and habitat variables in four forests. Four samples per site were carried out in dry and rainy seasons. The number of individuals, and the environmental and habitat variables (environemntal temperature, canopy coverage percentage, amount of bromeliads,, the herbaceous percentage, amount of fallen logs, ampunt of trees with CHD>10 and environmental humidity in each forest) were registered. Data were statistically processed with logistics regression and canonical correspondence analysis. Results indicated that R. opisthomelas population density was very variable; Isla del Sol showed the greatest number of individuals followed by El Carmen, Isla Cantarina and Guatapé respectively Population density in the rainy season was different from that in the dry season in Guatapé and Isla Cantarina,. Finally, the canonical correspondence analysis shows that apparently there is no association between density of frogs and types of forest.
Key words: Ranitomeya opisthomelas, amphibians, logistics regression, Canoco.
Uno de los problemas ambientales más relevantes a escala global es la reducción de la diversidad biológica asociada a los efectos de pérdida, fragmentación y transformación del hábitat como consecuencia de las actividades humanas (HANKEN, 1999; KNUTSON et al., 1999, 2000). Muchas poblaciones animales, confinadas en bosques fragmentados, desaparecen con el paso del tiempo porque no alcanzan a mantener una población mínima viable. La persistencia de las poblaciones en tales casos depende de las características intrínsecas de la especie y es asociada a las condiciones ambientales y al tamaño del bosque o fragmento (ROBINSON & RAMÍREZ, 1982; LOVEJOY et al., 1986; COLLINS & STORFER, 2003; POUNDS et al., 2006). Sin embargo, para reconocer las causas locales o globales responsables del fenómeno de disminución de poblaciones, debe considerarse la realización de estudios a largo plazo que provean información confrontable y comprobable de parámetros indicadores de su estado, tales como su distribución y abundancia, el rango de condiciones bajo las cuales viven y cómo estas fluctúan con las variables ambientales (DONNELLY, 1998; PARRIS, 1999).
En este sentido, en Colombia, los bosques montanos caracterizados por su alta diversidad y endemismos, albergan el 60% del total de especies de anuros del país. Dichos bosques han sido reducidos a pequeños fragmentos que en la mayoría de los casos no sobrepasan las 50 ha (ETTER & VAN WYNGAARDEN, 2000). El departamento de Antioquia, en su Cordillera Central, no es ajeno a esta problemática, en donde se presenta intervención antrópica de hábitats que afecta los ecosistemas boscosos por factores como el aislamiento de los fragmentos, alteración de las condiciones ambientales iniciales de los hábitats y efectos biológicos directos sobre la distribución y abundancia de especies, provocados por variaciones en las condiciones físicas (MURCIA, 1995; MARSH & PEARMAN, 1997; TOCHER et al., 1997).
La rana dardo venenosa (R. opisthomelas) es una especie que no es ajena a esta problemática, la cual fue catalogada por la IUCN (2008) como una especie vulnerable, debido a que su distribución es menor a 20000 km² y los bosques donde habita, al norte de la Cordillera Central, presentan una continua disminución en su extensión a causa de los fuertes procesos de deforestación (GALEANO & URBINA, 2003; GUTIÉRREZ-C., 2005). Dicha vulnerabilidad se debe a las características fisiológicas y comportamentales de esta especie, ubicándola como posible indicadora de cambios ambientales y de la calidad del hábitat, por tanto, puede permitir dilucidar más acerca de los cambios en las variables ambientales en diferentes ecosistemas (ACOSTA et al., 2005).
Por tal motivo, en el presente estudio se pretende identificar la asociación de la densidad poblacional de Ranitomeya opisthomelas con variables ambientales y de hábitat en cuatro bosques del oriente antioqueño con diferente intervención.
MATERIALES Y MÉTODOSÁrea de estudio. El proyecto se realizó en la región del altiplano del oriente antioqueño, localizada en el extremo norte de la Cordillera Central Andina colombiana (5°45' a 6°20' N y 75°05' a 75°35' O). La región posee un rango altitudinal entre 2120-2500 msnm y una temperatura media que varía entre 13 y 18°C. Las condiciones climáticas y biofísicas preponderantes corresponden a la alta montaña andina tropical (SIERRA et al., 2005). El esquema de variación estacional regional es bimodal con dos periodos húmedos con intensidades de lluvia muy semejantes, el primero se sitúa entre abril y mayo y el segundo entre agosto y octubre, la precipitación media anual es de 1698 mm. Separados por un periodo seco. El periodo marcadamente seco tiene lugar entre diciembre y febrero (Centro de investigaciones ambientales y de ingeniería, 1993).
Selección de sitios. Se seleccionaron cuatro bosques de muestreo con diferente estado sucesional, ubicados en tres municipios donde se registró la presencia de R. opisthomelas: El Carmen, El Peñol y Guatapé. El primer sitio, localizado en el municipio de El Carmen de Viboral (6°5'0'' N - 74°20'02'' W), vereda Rivera, a una altitud de 2300 m, con un área de 85 ha. Se encuentra inmerso en una matriz del paisaje dominada por usos agrícolas y pecuarios para pastoreo de animales domésticos. Posee áreas de rastrojos medios en recuperación y zonas dedicadas a reforestación con especies nativas y foráneas, es una zona protegida por el acueducto multiveredal Rivera La Palma Altogrande, ya que de esta toman sus aguas. El segundo sitio, se localiza en la vereda El Tronco (6°18'0'' N - 75°07'20'' O) del municipio de Guatapé en un rango de altitud entre los 1850 y los 2000 m y un área de 440 ha. Es un bosque maduro, particularmente dinámico, con un gran número de árboles caídos naturalmente y deslizamientos de tierra en las laderas, causados por la alta precipitación de la zona.
El tercer y cuarto sitio está representado por dos islas ubicadas en el embalse El Peñol - Guatapé a una altitud de 1900 m. La primera, llamada Isla del Sol (6°15'36'' N - 75°10'59' 'W) posee un área de 8,5 ha, el 70% de la isla está cubierta por bosque secundario, un 10% por plantación de pino pátula (Pinus patula) y el 20% restante por pastos. La segunda, Isla Cantarina (6°15'36'' N, 75°10'45'' O) se encuentra a una distancia de 100 metros de la Isla del Sol, posee un área aproximada de 18 ha. El 40% está cubierto por bosque secundario, un 30% por plantaciones sin mantenimiento de pino pátula, y un 30% por pastos y rastrojos bajos. Las islas se originaron en 1978 a causa de la construcción del embalse hidroeléctrico El Peñol.
Método de muestreo. En cada sitio de estudio se trazaron 120 transectos de 25 x 2 m establecidos de forma aleatoria (CRUMP, 1971) en un periodo de 15 meses (dos temporadas secas y dos húmedas) para un total de 480 transectos.
Debido al comportamiento de R. opisthomelas se realizó búsqueda activa diurna en cada transecto, para ello se removió la hojarasca, troncos caídos, piedras y se observó la vegetación hasta 180 cm de altura en búsqueda de individuos de la especie. Durante el recorrido sobre el transecto se capturaron y guardaron los animales en bolsas plásticas sellables. Al finalizar cada transecto, los individuos se marcaron por medio del método de corte de falanges, a partir del esquema sugerido por SUTHERLAND (1996), y posteriormente se liberaron, esto con el objetivo de evitar sobrestimaciones en el tamaño de la población.
Densidad poblacional. La densidad poblacional se calculó como el número de individuos por unidad de área, para ello se aplicó el método sugerido por OJASTI & DALLMEIER (2000), donde se tomó el número de individuos encontrados en cada transecto por el área del transecto (50 m²).
Variables ambientales y de hábitat. Se midieron variables ambientales (temperatura ambiental y porcentaje de humedad con un termohigrómetro Pen Type max-min, a poca altura sobre el suelo), como también la cuantificación de las características de hábitat. En todos los transectos se estableció una parcela de 1 m² en la que se registro el número total de troncos caídos, el número de bromelias (en árboles y en suelo), el porcentaje de herbáceas recorriendo la totalidad de la parcela contando plántulas y adultos de estas; número de árboles con DAP>10 cm cuya medición se realizó con cinta métrica; y la cobertura del dosel calculada mediante estimación visual con cuadrícula de 1 m².
Análisis de datos. Para establecer la relación entre las variables estructurales y ambientales evaluadas y la presencia/ausencia (1/0) de la rana, se realizaron regresiones logísticas para cada localidad con la ayuda del Statgraphics Plus 5.1 (STATISTICAL GRAPHICS CORP., 1994-2000). En la selección de las variables relacionadas se tuvo en cuenta la bondad de ajuste del modelo, la razón de verosimilitud de las variables, el análisis de desvianzas y el R² ajustado de acuerdo con CASTAÑO (2004). Además, se excluyeron las variables redundantes para reducir la multicolinealidad. La determinación de la asociación entre la densidad poblacional y los cuatro sitios de estudio con diferente intervención se realizó mediante Análisis de correspondencia canónica con el programa estadístico Canoco 4.5 (Canoco for Windows), en el cual se construyó una matriz con la densidad de las ranas en cada unos de los sitios y momentos versus la matriz con las diferentes variables ambientales para cada uno de los sitios y momentos.
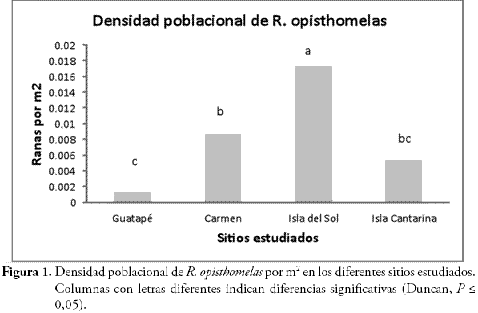
RESULTADOSLa densidad poblacional fue muy variable entre los sitios, por ejemplo la Isla del Sol presentó el mayor número de individuos de R. opisthomelas seguido del bosque de El Carmen, la Isla Cantarina y el bosque continuo de Guatapé, respectivamente, existiendo diferencias significativas entre algunos sitios (Figura 1).
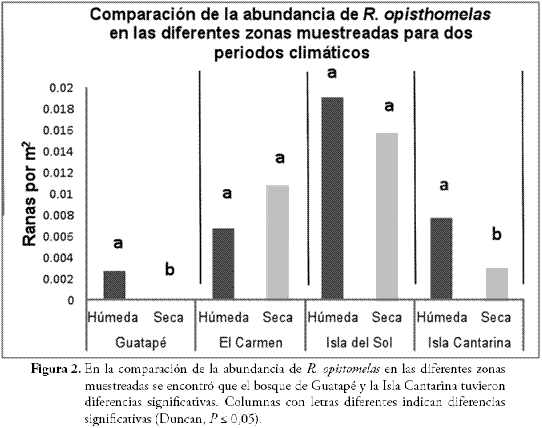
Tal como se mencionó anteriormente, los muestreos se realizaron en dos periodos: seco y húmedo; al respecto, cuando se comparó la abundancia de la R. opisthomelas en cada sitio, se encontró que Guatapé y la Isla Cantarina tuvieron diferencias significativas entre los dos periodos climáticos, nótese que en estos sitios la abundancia de la rana disminuyó en el periodo seco. Los valores P fueron de 0,0180 y 0,0470 para Guatapé y la Isla Cantarina, respectivamente. Por el contrario El Carmen y la Isla del Sol no tuvieron diferencias (Figura 2). Se esperaba mayor abundancia en todos los sitios cuando se realizaron los muestreos en periodos húmedos, ya que la literatura reporta esta tendencia en estudios similares (LA MARCA & LÖTTERS, 1997; POUNDS, 1997; LA MARCA, 2005; URBINA & GALEANO, 2009).
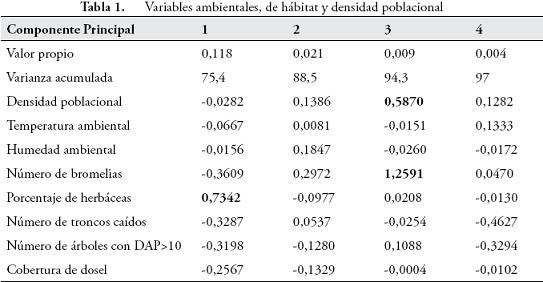
Relaciones entre las variables estructurales y ambientales y la densidad poblacional de Ranitomeya opisthomelas. Del análisis estadístico fueron extraídos cuatro componentes que representan el 97% de la variabilidad. La densidad poblacional de las ranas fue importante, solo para el tercer componente, mientras que para las variables ambientales el porcentaje de herbáceas fue la variable que mejor explica la variación del primer componente principal, mientras que el número de bromelias tienen mayor peso sobre el tercer componente (Tabla 1). Estos resultados están relacionados en la Figura 3, donde la densidad poblacional de R. opisthomelas disminuye a medida que aumenta el porcentaje de herbáceas, y su aumento está determinado por el número de bromelias.
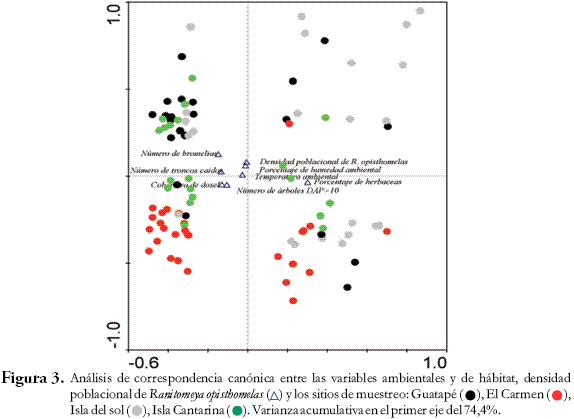
En la Isla del Sol, la presencia/ausencia de la rana en los transectos estuvo relacionada al número de bromelias, porcentaje de herbáceas y la cobertura del dosel (X² > 4,32 gl = 1 p < 0,03), para la Isla Cantarina esta relación se dio con el porcentaje de herbáceas (X² = 4,30 gl = 1 p = 0,04), en el bosque Guatapé con el porcentaje de humedad ambiental (X² = 6,21 gl = 1 p = 0,01) y la cobertura del dosel (X² = 4,99 gl = 1 p = 0,02). En El Carmen no se registraron relaciones.
Relación entre los sitios de estudio y la densidad poblacional de R. opisthomelas. La densidad poblacional de R. opithomelas no depende de los sitios de muestreo (Figura 3), las islas (Sol y Cantarina) y el bosque en Guatapé se asemejan en los resultados de las variables ambientales y de hábitat, mientras que El Carmen forma un grupo aislado de los demás sitios. El análisis de correspondencia canónica para cada uno de los sitios y momentos de muestreo y en el cual se analizaron las variables ambientales versus la densidad de las ranas, mostró que la densidad de estas se asocia principalmente a las variables ambientales y no al sitio de estudio. Como se observa en la Figura 3 no hay una asociación con los sitios de colecta mas sí con variables ambientales tales como porcentaje de humedad ambiental, temperatura ambiental y porcentaje de herbáceas (Figura 3).
DISCUSIÓN
La población de R. opisthomelas no presenta afinidad por un sitio en especial, aunque no se ha reportado en áreas completamente deforestadas o pastizales (Rivera et al., en preparación); la densidad poblacional fue similar en Guatapé, la Isla Cantarina y El Carmen, por el contrario la Isla del Sol presentó la mayor densidad de los cuatro sitios que conforman el área de estudio (Figura 1). En el caso de las ranas, la respuesta de las especies a la fragmentación depende más de los requerimientos específicos de la especie (bromelias, troncos caídos) (Malcolm, 1997) y del microclima que del área del fragmento en sí (Primack et al., 2001); un resultado análogo obtuvieron VARGAS & BOLAÑOS (1999) en selva lluviosa tropical, en el que las poblaciones dependieron del microclima al interior del bosque y no de los sitios en específico.
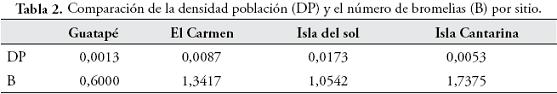
Se ha reportado que hembras de algunas especies de ranas venenosas como Dendrobates pumilio, tienen preferencias por áreas con buena disponibilidad de recursos entre los que se incluyen especies de bromelias donde las hembras colocan sus huevos (PRÖHL & BERKE, 2001). En este sentido, se esperaba que hembras de R. opisthomelas que depositan también sus huevos en bromelias, tuvieran mayor densidad poblacional en las áreas con mayor presencia de estas, lo cual no se evidenció al relacionar la densidad poblacional y el número de bromelias (Tabla 2).
Los resultados obtenidos pueden brindar indicios de la habilidad y plasticidad de R. opisthomelas al cambio en las variables de hábitat. Este mismo comportamiento se presentó con especies de anfibios en la Isla Gorgona, en un estudio realizado por URBINA & LONDOÑO (2003) en el que se encontraron cambios en las dinámicas poblacionales, manifestando la adaptación de algunas especies a ambientes fragmentados o intervenidos.
Aunque R. opisthomelas está incluida en el apéndice II del CITES, donde se incluyen las especies que podrían llegar a encontrarse amenazadas de extinción, debido al comercio y la fragmentación (UNEP-WCMC, 2005), el análisis multivariado sugiere que no hay variaciones en la densidad poblacional con los sitios de estudio que presentan diferente estado sucesional. Sin embargo, los presentes resultados deben ser tomados con cautela, debido a que no fue posible conseguir otros fragmentos y bosques continuos que permitieran un análisis más profundo de las poblaciones.
RECOMENDACIONESAunque en las islas no se evidenció un deterioro en la densidad poblacional, se debe seguir un monitoreo para determinar el estado de la población en el tiempo, esto facilitaría a futuro la implementación de medidas para la conservación de esta especie.
Por otra parte, en este tipo de poblaciones es necesario adelantar análisis moleculares que permitan evidenciar el nivel de estructuración y diferenciación genética que pueden presentar las poblaciones aisladas debido a la insularización causada por la construcción de embalses.
AGRADECIMIENTOSQueremos manifestar nuestro agradecimiento a Sandra Galeano y a Gustavo Trujillo, biólogos de la Universidad de Antioquia, por orientarnos en los primeros cimientos de este trabajo. Además, a la Dirección de Investigación y Desarrollo de la Universidad Católica de Oriente por financiar esta investigación (código de proyecto 14736). Y a las correcciones y sugerencias de evaluadores anónimos.
ACOSTA, R., VERA, R. & A. NÚÑEZ, A., 2005.- Fauna de anuros en la ciudad de Salta, Argentina. Rev. Biol. Trop., 53 (3-4): 569-575. [ Links ]
CANOCO., 1998.- Software for canonical community ordination (version 4.5). Microcomputer Power. [ Links ]
CASTAÑO, G.J., 2004.- Evaluación del Riesgo de Extinción de Aves en Hábitats Fragmentados a Largo Plazo Mediante el Análisis de sus Características Ecológicas: Tesis Maestría, Universidad Nacional de Colombia, Medellín. [ Links ]
CENTRO DE INVESTIGACIONES AMBIENTALES Y DE INGENIERÍA., 1993.- Identificación de la dinámica hidrobiológica que permita planificar actividades de desarrollo pesquero y turístico en el embalse El Peñol. Volumen I. Informe final. Universidad de Antioquia, Seccional Medellín. [ Links ]
COLLINS, J. & A. STORFER., 2003.- Global amphibian declines: Sorting the hypotheses. Diversity Distribution, 9: 89-98. [ Links ]
CRUMP, M., 1971.- Quantitative analysis of the ecological distribution of a tropical herpetofauna. Occasional Papers of the Museum of Natural History of the University of Kansas, 3: 1-62. [ Links ]
DONNELLY, M., 1998.- Potential effects of climate change on two neotropical amphibian assemblages. Climatic Change, 39: 541-561. [ Links ]
ETTER, A. & VAN WYNGAARDEN, W., 2000.- Patterns of landscape transformation in Colombia, with emphasis in the Andean Region. Ambio, 29 (7): 443-450. [ Links ]
GALEANO, S.P. & URBINA, J.C., 2003.- Efecto del tamaño de fragmento sobre la diversidad y tamaño corporal de anuros andinos en Antioquia - Colombia: Tesis, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Medellín. [ Links ]
GUTIÉRREZ-C., P.D., 2005.- Geographic distribution: Cochranella susatamai. Herpetological Review, 36: 73. [ Links ]
HANKEN, J., 1999.- Why are there so many new amphibian species when amphibians are declining? Tree, 14 (1): 7-8. [ Links ]
IUCN., 2008.- Red List of Threatened Species. Disponible en: www.iucnredlist.org [ Links ]
KNUTSON, M., SAUER, J.R., OLSEN, D.A., MOSSMAN, M.J., HEMESATH, L.M. & LANNOO, M.J., 1999.- Effects of landscape composition y wetland fragmentation on frog y toad abundance y species richness in Iowa y Wisconsin, USA. Conservation Biology, 13 (6): 1437-1446. [ Links ]
________., 2000.- Landscape associations of Frog y Toad species in Iowa y Wisconsin, USA. J. Iowa. Acad. Sci., 107 (3): 134-145. [ Links ]
LA MARCA, E. 2005.- Estatus de poblaciones de ranas de la familia Dendrobatidae (Amphibia: Anura) en sus localidades tipo en los Andes de Venezuela. Herpetotropicos, 2 (2): 73- 86. [ Links ]
LA MARCA, E. & LÖTTERS, S., 1997.- Population declines in Venezuelan Atelopus (Amphibia: Anura: Bufonidae): 207-213 (en) BÖHME, W., BISCHOFF, W., ZIEGLER, T. (eds.) Herpetologia Bonnensis. Bonn, Germany. [ Links ]
LOVEJOY, T. E., R. O. BIERREGAARD, A. B. RYLANDS , J. R. MALCOLM, C. E. QUINTELA, L. H. HARPER, K. S. BROWN, A. H. POWELL, G. V. N. POWELL, H. O. R. SCHUBART, AND M.B. HAYS. 1986. Edge and other effects of isolation on Amazon forest fragments. Pages 257-285 in M. E. Soulé, ed. Conservation biology: the science of scarcity and diversity. Sinauer Associates, Inc., Sunderland, Massachusetts. [ Links ]
MALCOLM, J.R., 1997.- Biomass and diversity of small mammals in Amazonas forest fragments: 207-221 (en) LAURENCE, W.F., BIERREGARD, R.O. (comps.) Tropical forest remnants: Ecology, Management, and conservation of fragmented communities. University of Chicago Press, Chicago. [ Links ]
MARSH, D. & PEARMAN, P., 1997.- Effects of habitat fragmentation on the abundance of two species of Leptodactylid frogs in an Andean montane forest. Conservation Biology, 11: 1323-1328. [ Links ]
MURCIA, C., 1995.- Edge effects in fragmented forests: implications for conservation. Trends in Ecology and Evolution, 10: 58-62. [ Links ]
OJASTI, J. & DALLMEIER, F. (eds.)., 2000.- Manejo de fauna silvestre neotropical. si/mab. Serie # 5. Smithsonian Institution/MAB Biodiversity program, Washington D.C. 290p. [ Links ]
PARRIS, M., 1999.- Review: amphibian surveys in forest and woodlands. Contemporary Herpetology, 1: 1-14. [ Links ]
POUNDS, J.A., 1997.- Golden toads, null models, and climate change. Froglog, 23: 1-2. [ Links ]
POUNDS, A., BUSTAMANTE, M., COLOMA, L., CONSUEGRA, J., FOGDEN, M., FOSTER, P., LAMARCA, E., MASTERS, K., MERINO, A., PUSCHENDORF, R., RON, S., SÁNCHEZ, A., STILL, C. & YOUNG, B., 2006.- Widespread amphibian extinctions from epidemic disease driven by global warming. Nature, 439: 161-167. [ Links ]
PRIMACK, R., ROZZI, R., MASSARDO, F. & FEINSINGER, P., 2001.- Destrucción y degradación del Hábitat: 183-224 (en) PRIMACK, R., ROZZI, R., FEINSINGER, P., DIRZO, R., MASSARDO, F. (eds.) Fundamentos de conservación biológica. Perspectivas latinoamericanas. Fondo de Cultura Económica, México. 797p. [ Links ]
PRÖHL, H. & BERKE, O. 2001.- Spatial distributions of male and female strawberry poison frogs and their relation to female reproductive resources. Oecologia, 129: 534-542. [ Links ]
RIVERA-CORREA, M., URBINA, J.C. & GALEANO, S.P., En preparación.- Ranitomeya opisthomelas Boulenger, 1899 (en) RUEDA-A., J.V., RODRÍGUEZ-M., J.V. (eds.) Ranas Venenosas del Neotrópico. Series Libretas de Campo. Conservación Internacional. [ Links ]
ROBINSON, J.G. & RAMÍREZ, C.J., 1982.- Conservation biology of neotropical primates: 329-344 (en) GENOWAYS, H.H., MARES, M.A. (eds.) Mammalian biology in South America. The Pymatuning Symposia on Ecology, Vol. 6. University of Pittsburg, Pittsburg. [ Links ]
SIERRA, J.A., ALZATE, F., SOTO, H., DURÁN, B. & LOSADA, L.M., 2005.- Plantas silvestres con potencial ornamental de los bosques montano bajos del oriente antioqueño, Colombia. Rev.Fac.Nal.Agr., Medellín, 58 (1): 2651-2663. [ Links ]
STATISTICAL GRAPHICS CORP., 1994-2000.- Enterprise editions. Statgraphics Plus 5.0. Statistical Graphics Corporation. Copyright© 1994-2000. [ Links ]
SUTHERLAND, W.J. (ed.)., 1996.- Ecological census techniques: a handbook. Cambridge University Press, Cambridge. [ Links ]
TOCHER, M.D., GASCON, C. & ZIMMERMAN, B.L., 1997.- Fragmentation effects on a Central Amazonian frog community: a ten- year study: 124-137 (en) LAURENCE, W.F., BIERREGAARD, R.O. (comps.) Tropical Forest Remnants: Ecology, Management and Conservation of Fragmented Communities. The University of Chicago Press, Chicago and London. [ Links ]
UNEP-WCMC., 2005.- Checklist of herpetofauna listed in the CITES appendices and in EC Regulation 338/97. 10th edition. JNCC Report No. 378. [ Links ]
URBINA, J. & GALEANO, S., 2009.- Abundance, activity patterns and microhabitat of Rhinella macrorhina, an endemic toad from the cloud forests of the Colombian Central Andes. Herpetological Journal, 19: 35-40. [ Links ]
URBINA-C J.N. & M.C. LONDOÑO-M. 2003 Distribución de la comunidad de herpetofauna asociada a cuatro áreas con diferente grado de perturbación en la Isla Gorgona, Pacífico colombiano. Rev. Acad. Colomb. Cienc. 27(102):105-113. 2003. ISSN 0370-3908. [ Links ]
VARGAS, F. & BOLAÑOS, M.E., 1999.- Anfibios y reptiles presentes en hábitats perturbados de selva lluviosa tropical en el bajo Anchicayá, Pacífico colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23: 499-511. [ Links ]














