Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.15 no.2 Manizales July/Dec. 2011
SEX DETERMINATION IN BIRDS OF FURNARIDAE FAMILY BY MOLECULAR TECHNIQUES
* FR: 10-III-2011. FA: 24-VIII-2011.
1 Grupo de Investigación Genética, Biodiversidad y Fitomejoramiento, GEBIOME. Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales, Universidad de Caldas. E-mail: dmoreno86@hotmail.com; beatrizhenao17@gmail.com; german.lopez@ucaldas.edu.co; fredy.rivera@ucaldas.edu.co
2 Grupo de Investigación Ecosistemas Tropicales, Universidad de Caldas. E-mail: gabriel.castano_v@ucaldas.edu.co
La familia Furnariidae constituye uno de los grupos de aves con mayor riqueza de especies en el Neotrópico y es considerada como vulnerable ante eventos de perturbación de su hábitat. En esta familia el sexaje de sus individuos es complejo, ya que no presentan dimorfismo sexual aparente, lo cual limita la investigación en estudios de dinámica poblacional y evolutivos. En este trabajo, se analizó el ADN obtenido del cálamo de plumas, por el método fenolcloroformo-alcohol isoamílico, de 15 especies de furnáridos capturados en cuatro localidades del departamento de Caldas entre agosto del 2009 y marzo del 2010. La amplificación por PCR de los genes CHD-Z y CHD-W con los iniciadores P2-P8 y 2550F-2718R, permitieron la diferenciación de machos y hembras de siete especies (Synallaxis azarae, S. brachyura, Xenops minutus, Dendrocincla tyrannina, Lepidocolaptes lacrymiger, Campylorhampus trochilirostris, C. pusillus), de las cuales no se tenían reportes de su sexaje molecular. Se demostró la eficacia (80,65%) de la fuente para la extracción de ADN (cálamo de plumas), como método no invasivo, de fácil manipulación y almacenaje; que puede ser aplicado en estudios de dinámica poblacional, estructura genética, sistemas reproductivos y de comportamiento, y de manera amplia, en el manejo y conservación de esta familia.
Palabras clave: furnáridos, gen CHD, sexaje molecular de aves.
AbstractThe Furnariidae family is one of the most diverse groups of birds in the Neotropics, and it is considered as a vulnerable to habitat disturbance group. The sexing of individuals in this family is complex due the lack of clear sexual dimorphism which limits the research in population dynamics and evolutionary studies. In this study, the DNA was extracted from the quill of the feathers using the phenol-chloroform-isoamyl alcohol method in 15 furnarids species captured in four localities from the Department of Caldas between August 2009 and March 2010. The PCR amplification of CHD-Z and CHD-W genes with primers P2-P8 and 2550F-2718R, allowed the differentiation of males from females of seven species (Synallaxis azarae, S. brachyura, Xenops minutus, Dendrocincla tyrannina, Lepidocolaptes lacrymiger, Campylorhampus trochilirostris, C. pusillus), from which there was not previous report of molecular sexing. The efficiency of the source for DNA extraction (80.65%) from feathers as a non-invasive, easy to use, handle and storage method that can be used in population dynamics, genetic structure, reproductive systems and behavioral studies, and in a wider way, in the management and conservation of this family was demonstrated.
Key words: fumarids, CHD gen, molecular sexing of birds.
La familia Furnariidae constituye un grupo de aves exclusivo del nuevo mundo. Se distribuye desde el norte de México hasta la Patagonia (HEIMERDINGER, 1995; MEZQUIDA, 2001), y dentro de la avifauna mundial, representa una de las familias con mayor riqueza de especies (REMSEN, 2003). Se la encuentra en bosques tropicales, matorrales densos, marismas, pantanos, llanuras abiertas de escasa vegetación y sistemas rocosos con presencia de herbáceas (SKUTCH, 1969; WILLIS, 1991). En general, los furnáridos son organismos de tamaño mediano (9-30 cm de longitud), con plumaje pardo (-grisáceo, -rojizo), bastante similar en machos y hembras (FJELDSÅ & KRABBE, 1990; RIDGELY & TUDOR, 1994), y con escaso o nulo dimorfismo sexual (ligeras diferencias en el tamaño y coloración del plumaje entre sexos de algunas especies) (REMSEN, 2003). En Colombia, algunos autores han descrito esta familia como vulnerable ante la perturbación de su hábitat y como un grupo en el que se han registrado extinciones locales a través de los Andes (KATTAN et al., 1994; RENJIFO, 1999; CASTAÑO, 2004; CASTAÑO & PATIÑO, 2007, 2008). Así mismo, algunas de sus especies se encuentran incluidas dentro de las categorías de amenaza nacional e internacional (RENJIFO et al., 2002).
En la familia Furnariidae, como en muchas especies de aves, la determinación del sexo se dificulta debido a su monomorfismo sexual, y los métodos tradicionales de sexaje, como la endoscopía, determinación de niveles hormonales, cariotipo y la observación del comportamiento, presentan ciertas desventajas por ser traumáticas y estresantes, sumado a que generalmente son protocolos extensos e ineficientes para establecer el sexo de juveniles (LIZA et al., 2008; MATTA et al., 2008; CARDONI et al., 2009). El descubrimiento en aves del gen CHD-W, exclusivo para hembras y CHD-Z, presente en ambos sexos (hembras, ZW; machos, ZZ), ha permitido desarrollar un método universal de su sexaje, que consiste en localizar los dos genes conservados CHD (chromo-helicase-DNA-binding), ubicados en los cromosomas sexuales, exceptuando Ratitae, donde se plantea que estos no sufrieron ningún tipo de mutación previa a la divergencia aviar, y por ello son indistinguibles y morfológicamente similares a los cromosomas autosómicos (GRIFFITHS et al., 1998; FRIDOLFSSON & ELLEGREN, 1999).
GRIFFITHS et al. (1998), a través de la amplificación de los genes CHD-Z y CHD-W, diferenciaron el sexo en aves de una pareja de cada una de las 28 especies que analizaron distribuidas en 23 familias, método que ha sido ampliamente documentado en varios grupos, entre los que se destacan Pipridae (RYDER & DURÃES, 2005; ANCIÃES & NASSIF, 2002), Accipitridae (DONOHUE & DUFTY, 2006), Cinclidae (CAMPOS et al., 2005), Psittacidae (CAPARROZ et al., 2001) y Strigidae (DOUBLE & OLSEN, 1997). La utilidad de la técnica es evidente en especies de escaso o nulo dimorfismo sexual, aunque también puede ser necesaria en especies en las que a pesar de existir un claro dimorfismo sexual en adultos, en los estadios juveniles, son controversiales (GRIFFITHS & KORN, 1997). En esta investigación se utilizó ADN extraído del cálamo de plumas de aves de la familia Furnariidae y la amplificación por PCR de los genes CHD-W y CHD-Z, como herramientas para determinar el sexo, y a su vez, resaltar un método no invasivo que reduce el impacto sobre el bienestar de las aves, particularmente aquellas con algún grado de amenaza.
MATERIALES Y MÉTODOSEl trabajo de campo se realizó en cuatro localidades del departamento de Caldas, en la vertiente occidental de la Cordillera Central: I. Reserva forestal protectora bosques CHEC S.A. E.S.P., ubicada entre los municipios de Manizales y Villamaría (5°1'27,2'' N - 75°24'48,3'' W), comprende altitudes desde 2000 hasta 3500 m, y un área de 3890 ha (SALAZAR-RAMÍREZ, 2010); II. Jardín Botánico Universidad de Caldas, ubicado al sureste de la ciudad de Manizales (5°4'12'' N - 75°31'14'' W), a 2150 m, y un área de 15 ha (GALLEGO, 2000); III. Ecoparque Alcázares-Arenillo, ubicado dentro del casco urbano de Manizales (5°4' N - 75°32' W), entre 1730 y 1960 m de altitud, y un área de 70 ha (ARANGO-B. et al., 2007); IV. Vereda San Juan, corregimiento Berlín, municipio de Samaná, a 700 msnm.
En las cuatro localidades se realizó la captura de aves empleando 10 redes de neblina (12 x 2,5 m x 36 mm), con un esfuerzo total de muestreo de 2432 horas/red. Los furnáridos capturados se marcaron con anillos plásticos tipo celuloide de colores, y se clasificaron de acuerdo a REMSEN et al. (2011). De cada uno de los individuos se recolectaron rémiges primarias y rectrices, que se almacenaron en tubos Eppendorf de 1,5 ml con 0,5 ml de etanol al 70%, para la posterior obtención del ADN (DONOHUE & DUFTY, 2006; CONSTANTINI et al., 2008).
El ADN fue extraído del cálamo de plumas, por el método fenol-cloroformoalcohol isoamílico, de acuerdo a la metodología propuesta por BELLO et al. (2001). La cantidad y calidad del ADN se midió con un espectrofotómetro (NanoVue 80-2140-00, ®General Electric). La amplificación de los genes CHD-Z y CHD-W, se realizó mediante un PCR utilizando los iniciadores P2 (5'TCTGCATCGCTAAATCCTTT3'), P8 (5'CTCCCAAGGATGAGRAAYTG3') descritos por GRIFFITHS et al. (1998), y 2550F (5'GTTACTGATTCGTCTACGAGA3'), 2718R (5'ATTGAAATGATCCAGTGCTTG3') desarrollados por FRIDOLFSSON & ELLEGREN (1999). Las condiciones de amplificación, tanto para la mezcla de reacción como para el perfil térmico, se realizaron según CARDONI et al. (2009) con modificaciones. Los productos de amplificación se visualizaron en geles de poliacrilamida al 4 y 6%, coloreados con nitrato de plata (SANGUINETTI et al., 1994). Los controles positivos correspondieron a muestras de Gallus gallus, y como controles negativos y de reacción, se utilizó agua destilada-desionizada.
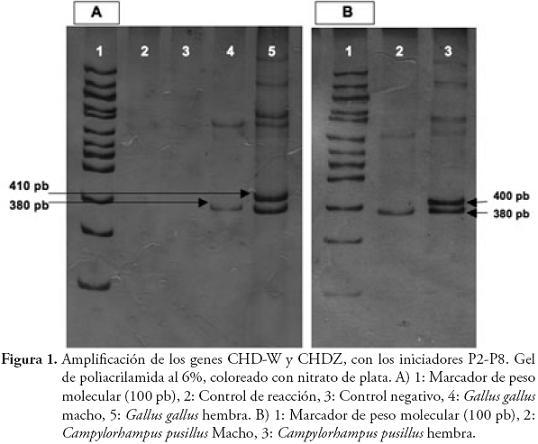
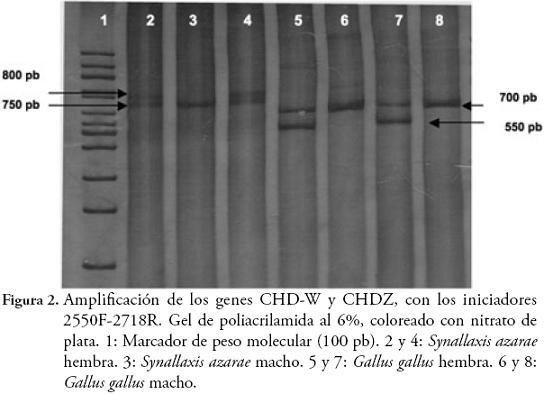
RESULTADOSLas herramientas moleculares empleadas, permitieron la separación entre machos y hembras de 7 especies de Furnariidae (3 especies de la subfamilia Furnariinae y 4 de Dendrocolaptinae): Synallaxis azarae, S. brachyura, Xenops minutus, Dendrocincla tyrannina, Lepidocolaptes lacrymiger, Campylorhampus trochilirostris, C. pusillus. La eficiencia de la reacción de PCR, para amplificar los genes CHD-Z y CHD-W, fue del 80,65% (25 de 31 individuos con amplificaciones positivas) (Tabla 1). En estas 7 especies los iniciadores P2-P8 y 2550F-2718R, mostraron pesos moleculares exclusivos y claramente diferenciables para machos y hembras, particularmente donde la eficiencia de los iniciadores es especie-específico (Tabla 1, Figuras 1 y 2). Sin embargo, las especies Cranioleuca erythrops, Premnoplex brunnescens, Thripadectes holostictus, Dendrocincla fuliginosa y Glyphorynchus spirurus, no presentaron amplificación positiva, y algunas, aunque mostraron amplificación, no permitieron la diferenciación del sexo (Anabacerthia striaticollis, Xiphocolaptes promeropyrhinchus y Dendrocolaptes picummus). En términos globales, la eficiencia de la reacción de PCR, para amplificar los genes CHD-Z y CHD-W para el total de individuos capturados, fue del 66% (29 de 44 individuos con amplificaciones positivas). La utilización de plumas de individuos adultos de Gallus gallus, como fuente de ADN, tanto para la estandarización de las pruebas moleculares, como fuente de control positivo, resultó exitosa ya que favoreció la obtención de ADN de buena cantidad y calidad (Figura 1).
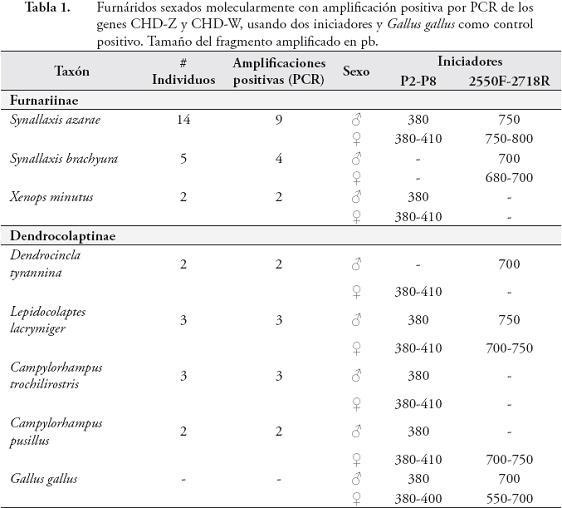
El estudio reveló la diferenciación molecular entre machos y hembras en 7 de las 15 especies de furnáridos evaluados, usando como fuente de ADN el cálamo de las plumas. En las otras 8 especies no se logró una clara diferenciación sexual, lo que puede explicarse por la evaluación molecular de un solo individuo por especie (Anabacerthia striaticollis, Cranioleuca erythrops, Dendrocincla fuliginosa, Thripadectes holostictus), análisis molecular de individuos de un solo sexo (Dendrocolaptes picummus), o por la falta de eficiencia de los iniciadores para lograr la amplificación de los genes CHD-Z y CHD-W en el caso de las especies Glyphorynchus spirurus, Premnoplex brunnescens, Xiphocolaptes promeropyrhinchus.
En Colombia, estos son los primeros resultados que comprueban que machos y hembras de especies de la familia Furnariidae, son claramente distinguibles a través de la amplificación de los genes CHD-Z y CHD-W, y se demuestra el polimorfismo de tamaño (peso molecular), entre estos genes, como ha sido reportado en otras especies y grupos de aves (DOUBLE & OLSEN, 1997; GRIFFITHS et al., 1998; CAPARROZ et al., 2001; ANCIÃES & NASSIF, 2002; CAMPOS et al., 2005; RYDER & DURÃES, 2005; DONOHUE & DUFTY, 2006), permitiendo una clara diferenciación génica (y sexual, en este caso), contrario a lo reportado en Ratitae, donde los genes CHD-Z y CHDW, son indistinguibles (GRIFFITHS et al., 1998; FRIDOLFSSON & ELLEGREN, 1999). La utilización de los iniciadores P2-P8, permitió visualizar un amplicón correspondiente al gen CHD-W más pesado (400 pb para furnáridos y 410 pb para Gallus gallus) que el CHD-Z (380 pb). Con los iniciadores 2550F-2718R, se comprobó el amplio polimorfismo presente en los cromosomas sexuales de aves. El tamaño de los amplicones con los dos iniciadores, presentaron diferencias entre machos y hembras, con variaciones dependiendo de la especie, lo que es concomitante con lo encontrado por GRIFFITHS et al. (1998). De igual forma, FRIDOLFSSON & ELLEGREN (1999) y JENSEN et al. (2003), reportaron que con la utilización de los iniciadores 2550F-2718R, se obtienen diferencias en un rango de 150 a 250 pb; mientras que para los iniciadores P2-P8 oscilan entre 10 y 80 pb, aspectos similares a nuestros resultados; es decir, las diferencias evidentes en los amplicones se presentaron con los iniciadores 2550F-2718R.
El ADN extraído del cálamo de plumas de algunas especies de aves, constituye una fuente de buena cantidad y calidad, resultados similares a los obtenidos por HARVEY et al. (2006) y SILVEIRA (2009). Las plumas constituyen un material biológico clave para el sexaje en aves pequeñas como los furnáridos (otras investigaciones obtienen muestras de sangre de la vena braquio-femoral, ver MORENO et al., 2007), debido a que se reduce notablemente el tiempo de manipulación de las aves y por lo tanto el estrés asociado con este procedimiento. Aunque varios autores manifiestan que las plumas proporcionan un ADN de menor cantidad y calidad que el obtenido a partir de sangre o tejidos (BELLO et al., 2001; PALMA et al., 2001; DE VOLO et al., 2008; GEBHARDT & WAITS, 2008), el método posee ventajas para estudios de especies vulnerables o con algún grado de amenaza, al ser una técnica no invasiva, no requiere entrenamiento especial, se reduce el tiempo de manipulación del ave, no genera residuos peligrosos, permite un almacenaje sencillo y facilita la tarea de muestreo, tal como lo registran DONOHUE & DUFTY (2006) y HARVEY et al. (2006). Así mismo, el uso de Gallus gallus como control positivo, hace el procedimiento fácilmente replicable, sumado a que es una especie común, de fácil acceso y con un claro dimorfismo sexual en estado adulto.
Las parejas de iniciadores no siempre fueron eficientes para el sexaje de las aves, ya que en varias ocasiones algunos individuos solo presentaron productos de amplificación con solo un iniciador. Esto puede explicarse por las cantidades limitadas y la degradación natural e inestabilidad del ADN, debido a la congelación y descongelación de las muestras, que puede ser un motivo para la no amplificación (PALMA et al., 2001). De igual manera, el uso de un protocolo de extracción universal como el fenol-cloroformo-alcohol isoamílico, puede influir en la obtención de un ADN de mayor calidad. WATSON et al. (2004), encontraron que de 80 individuos analizados usando plumas como fuente de ADN, el 6,25% no mostraron amplificación. Por su parte, GEBHARDT & WAITS (2008) encontraron que en faisanes de cuello dorado con los iniciadores P2-P8 el 38,5% de las muestran no amplificaron, y sugieren, al igual que GRANT (2001), que la baja amplificación puede correlacionarse con una menor cantidad y calidad del ADN presente en las muestras, o a una PCR con condiciones subóptimas. Se debe tener en cuenta que el grado de error puede variar según las especies y que existen iniciadores que resultan más exitosos para algunas de ellas; también puede ocurrir por el polimorfismo de algunos individuos (diferencias mutacionales en los sitios del cebador), tal como lo reportan GEBHARDT & WAITS (2008), lo que puede contrarrestarse en parte, con la búsqueda y uso de iniciadores más conservados y universales.
Finalmente, aunque la familia Furnariidae es una de las de mayor riqueza de especies en el Neotrópico (REMSEN, 2003), son pocos los estudios que han tratado de resolver la identidad sexual de sus especies, y los que se han realizado se han enfocado en comparaciones morfométricas y del plumaje de machos y hembras (WILLIS, 1972; WINKER et al., 1994; REMSEN, 2003; ROPER & HUTSON, 2003; FARIA et al., 2007; MORENO et al., 2007; CARDONI et al., 2009), y muy pocos han abordado la tipificación molecular (FARIA et al., 2007; MORENO et al., 2007; CARDONI et al., 2009). Estos factores, han limitado la investigación en este grupo, especialmente en temas relacionados con dinámica poblacional, selección sexual, conflicto de sexos y comportamiento reproductivo (i.e. cuidado parental), todos ellos claves para apreciar la evolución y conservación de esta gran familia. El sexaje molecular de 7 especies de furnáridos en las cuales se logró una clara diferenciación entre machos y hembras (Tabla 1), se convierte en una herramienta básica para su estudio, especialmente en Colombia, que alberga la mayor riqueza de especies de esta familia.
AGRADECIMIENTOSA la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas, por la financiación de este proyecto. A Carlos Arturo Franco, líder Gestión Ambiental de la Central Hidroelectríca de Caldas S.A. E.S.P. A José Humberto Gallego, Director del Jardín Botánico Universidad de Caldas, y a Yohany López, coordinador Ecoparque Alcázares-Arenillo. A Carmen Dussan Lubert, Juan Alejandro Morales y Jhon Albert Guevara, por su asesoría en el desarrollo del proyecto.
ANCIÃES, M. & NASSIF, S., 2002.- Sex identification of pin-tailed manakins (Ilicura militaris: Pipridae) using the polymerase chain reaction and its application to behavioral studies. Ornitología Neotropical, 13: 159-165. [ Links ]
ARANGO-B., L., MONTES-R., J.M., LÓPEZ-P., D.A. & LÓPEZ-P., J.O., 2007.- Mariposas (Lepidoptera: Papilionoidea, Hesperoidea), escarabajos coprófagos (Coleoptera: Scarabaeinae) y hormigas (Hymenoptera: Formicidae) del Ecoparque Alcázares-Arenillo (Manizales, Caldas - Colombia). Bol. Cient. Mus. Hist. Nat. U. de Caldas, 11(1): 390-409. [ Links ]
BELLO, N., FRANCINO, O. & SÁNCHEZ, A., 2001.- Isolation of genomic DNA from feathers. Journal of Veterinary diagnostic investigation, 13: 162-164. [ Links ]
CAMPOS, F., GUTIÉRREZ, F., LÓPEZ, J. & HERNÁNDEZ, M., 2005.- Un nuevo criterio para sexar Mirlos Acuáticos Cinclus cinclus en la Península Ibérica. Revista Catalana de Ornitología, 21: 43-46. [ Links ]
CAPARROZ, R., ROBADO, N., BIANCHI, C. & WAYNTAL, A., 2001.- Analysis of the genetic variability and breeding behaviour of wild populations of two macaw species (Psittaciformes, Aves) by DNA fingerprinting. Ararajuba, 9 (1): 43-49. [ Links ]
CARDONI, D.J., MALDONADO, J. & ISACCJ, R.G., 2009.- Subtle sexual dimorphism in the bay-capped wrenspinetail (Spartonoica maluroides; Furnariidae) uncovered through molecular sex determination. Ornitologia Neotropical, 20: 347-355. [ Links ]
CASTAÑO, G.J., 2004.- Evaluación del riesgo de extinción de aves en hábitats fragmentados a largo plazo mediante el análisis de sus características ecológicas: Tesis Maestría, Universidad Nacional de Colombia, Sede Medellín. [ Links ]
CASTAÑO, G.J. & PATIÑO, J.C., 2007.- Composición de la comunidad de aves en bosques fragmentados en la región de Santa Elena. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 11: 47-60. [ Links ]
________., 2008.- Extinciones locales de aves en fragmentos de bosque en la región de Santa Elena, Andes Centrales, Colombia. El Hornero, 23 (1): 23-34. [ Links ]
CONSTANTINI, V., GUARICCI, A.C., LARICCHIUTA, P., RAUSA, F. & LACALANDRA, G.M., 2008.- DNA sexing in Humboldt Penguins (Spheniscus humboldti) from feather samples. Animal Reproduction Science, 106: 162-167. [ Links ]
DE VOLO, S.B., REYNOLDS, R., DOUGLAS, M.R. & ANTOLIN, M.F., 2008.- An improved extraction method to increase DNA yield from molted feathers. The Condor, 110 (4): 762-767. [ Links ]
DONOHUE, K. & DUFTY, A., 2006.- Sex determination of Red-tailed Hawks (Buteo jamaicensis calurus) using DNA analysis and morphometrics. Journal of Field Ornithology, 77 (1): 74-79. [ Links ]
DOUBLE, M. & OLSEN, P., 1997.- Simplified polymerase chain reaction (PCR)-based sexing assists conservation of an endangered owl, the Norfolk Island Boobook Ninox novaeseelandiae undulate. Bird Conservation International, 7: 283-286. [ Links ]
FARIA, L., CARRARA, L. & RODRÍGUEZ, M., 2007.- Dimorfismo sexual de tamaño no fura-barreira Hylocryptus rectirostris (Wied) (Aves, Furnariidae). Revista Brasileira de Zoología, 24 (1): 207-212. [ Links ]
FJELDSÅ, J. & KRABBE, N., 1990.- Birds of the high Andes. Apollo Books y Zoological Museum, Svendborg y Copenhagen. [ Links ]
FRIDOLFSSON, A.K. & ELLEGREN, H., 1999.- A simple and universal method for molecular sexing of nonratite birds. Journal of Avian Biology, 30: 116-121. [ Links ]
GALLEGO, J., 2000.- Guía de especies cultivadas en el Jardín Botánico Universidad de Caldas. [ Links ]
GEBHARDT, K.J. & WAITS, L.P., 2008.- High error rates for avian molecular sex identification primer sets applied to molted feathers. Journal of Field Ornithology, 79 (3): 286-292. [ Links ]
GRANT, A., 2001.- DNA sexing of brown kiwi (Apteryx mantelli) from feather samples. DOC Science Internal Series, 13: 5-16. [ Links ]
GRIFFITHS, R., DOUBLE, M., ORR, K. & DAWSON, R., 1998.- A DNA test to sex most birds. Molecular Ecology, 7: 1071-1075. [ Links ]
GRIFFITHS, R. & KORN, R., 1997.- A CHD1 gene Z chromosome linked in the chicken (Gallus domesticus). Gene, 197: 225-229. [ Links ]
HARVEY, M.G., BOTER, D.N., STENZLER, L.M. & LOVETTE, I.J., 2006.- A comparison of plucked feathers versus blood samples as DNA sources for molecular sexing. Journal of Field Ornithology, 77 (2): 136-140. [ Links ]
HEIMERDINGER, M., 1995.- Body pterylosis of woodcreepers and ovenbirds (Dendrocolaptidae and Furnariidae). The Auk, 112 (3): 800-804. [ Links ]
JENSEN, T.F., PERNASETTI, F. & DURRANT, B., 2003.- Conditions for rapid sex determination in 47 avian species by PCR of genomic DNA from blood, shell-membrane blood vessels, and feathers. Zoo Biology, 22: 561-571. [ Links ]
KATTAN, G., ÁLVAREZ-LÓPEZ, H. & GIRALDO, M., 1994.- Forest fragmentation and bird extinctions: San Antonio eighty years later. Conservation Biology, 8: 138-146. [ Links ]
LIZA, J., MATURRANO, L. & ROSADIO, R., 2008.- Determinación del sexo por ADN en cinco especies de guacamayos. Revista de Investigaciones veterinarias de Perú, 19 (1): 31-36. [ Links ]
MATTA, N., RAMÍREZ, N., ZÚÑIGA, B. & VERA, V., 2008.- Determinación de sexo en aves mediante herramientas moleculares. Acta Biológica Colombiana, 13 (3): 27-40. [ Links ]
MEZQUIDA, E., 2001.- La reproducción de algunas especies de Dendrocolaptidae y Furnariidae en el desierto del monte central, Argentina. Hornero, 16 (1): 23-30. [ Links ]
MORENO, J., MERINO, S., LOBATO, E., RODRÍGUEZ, M. & VÁSQUEZ, R., 2007.- Sexual dimorphism and parental roles in the thorn-tailed rayadito (Furnariidae). The Condor, 109: 313-120. [ Links ]
PALMA, L., MIRA, S., CARDIA, P., BEJA, P., GUILLEMAUD, T., FERRAND, N., CANCELA, M.L. & CANCELA DA FONSECA, L., 2001.- Sexing Bonelli's Eagle nestlings: morphometrics versus molecular techniques. Journal of Raptor Research, 35 (3): 187-193. [ Links ]
REMSEN, J.V., 2003.- Family Furnariidae (Ovenbirds): 162-357 (en) DEL HOYO, J., ELLIOT, A., CHRISTIE, D.A. (eds.) Handbook of the Birds of the World. Vol. 8. Broadbills to Tapaculos. Lynx Ediciones, Barcelona. [ Links ]
Remsen, J.V.JR., Cadena, C.D., Jaramilo, A., Nores, M., Pacheco, J.F., Pérez-Emán, J., Robins, M.B., Stiles, F.G., Stotz, D.F. & ZIMMER, K.J., 2011.- A classification of the bird species of South America. American Ornithologists' Union. Disponible en: http://www.museum.lsu.edu/~Remsen/SACCBaseline.html [ Links ]
RENJIFO, L.M., 1999.- Composition changes in a subandean avifauna after long-term forest fragmentation. Conservation Biology, 13: 1124-1139. [ Links ]
RENJIFO, L.M., FRANCO-MAYA, A.M., AMAYA-ESPINEL, J.D., KATTAN, G.H. & LÓPEZ-LANÚS, B. (eds.)., 2002.- Libro rojo de aves de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Ministerio del Medio Ambiente. Bogotá, Colombia. 554p. [ Links ]
RIDGELY, R.S. & TUDOR, G., 1994.- The birds of South America. Vol. 2. University of Texas Press, Austin. [ Links ]
ROPER, J.J. & HUTSON, A., 2003.- Ovenbirds: 438-441 (en) PERRIS, C.M. (ed.) The new encyclopedia of birds. Oxford University Press, Oxford. [ Links ]
RYDER, T. & DUARAES, R., 2005.- It's not easy being green: using molt and morphological criteria to age and sex greenplumage Manakins (Aves: Pipridae). Ornitologia Neotropical, 16: 481-491. [ Links ]
SALAZAR-RAMÍREZ, L., 2010.- Estratificación vertical de aves frugívoras y nectarívoras en plantaciones de aliso y bosque secundario: Trabajo de grado, Universidad de Caldas, Manizales, Caldas, Colombia. 34p. [ Links ]
SANGUINETTI, C.J., DIAS NETO, E. & SIMPSON, A.J., 1994.- Rapid silver straining and recovery of PCR products separated on polyacrylamide gels. Biotechniques, 17: 915-919. [ Links ]
SILVEIRA, P., BASTOS, E., MANNAN, R.W. & GUEDES-PINTO, H., 2009.- Polymerase chain reaction-single strand conformation polymorphism applied to sex identification of Accipiter cooperii. Molecular and Cellular Probes, 23: 115-118. [ Links ]
SKUTCH, A., 1969.- Families Cotingidae, Pipridae, Formicaridae, Furnariidae, Dendrocolaptidae and Picidae. Life histories of Central American Birds III. Berkeley, California. 580p. [ Links ]
WATSON, H.K., MOGG, R.J. & BOND, J.M., 2004.- Sexing Eurasian Oystercatchers Haematopus ostralegus from breast feathers collected when ringing. Wader Study Group Bulletin, 105: 87-89. [ Links ]
WILLIS, E.O., 1972.- The behavior of plain-brown woodcreepers, Dendrocincla fuliginosa. The Wilson Bulletin, 84 (4): 377-420. [ Links ]
________., 1991.- The Ovenbirds: 162-163 (en) FORSHAW, Joseph (ed.) Encyclopedia of Animals: Birds. Merehurst Press, London. [ Links ]
WINKER, K., VOELKER, G.A. & KLICKA, J.T., 1994.- A morphometric examination of sexual dimorphism in the Hylophilus, Xenops, and an Automolus from southern Veracruz, Mexico. Journal of Field Ornithology, 65 (3): 307-323. [ Links ]














