Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.1 Manizales Jan./June 2012
HONGOS DÉRMICO SAPRÓFITOS DE DENDROPSOPHUS COLUMBIANUS (HYLIDAE) EN CALOTO, COLOMBIA*
DENDROPSOPHUS COLUMBIANUS (HYLIDAE) SAPROPHYTIC INTEGUMENTARY MOLDS FROM CALOTO, COLOMBIA
Ángela María Mendoza1, Lina Aguirre-Rojas2, Maryory Sarria3, Alan Giraldo4
* FR: 2-III-2012. FA: 4-IX-2012.
1 Facultad de Ciencias Naturales y Exactas, Departamento de Biología, Universidad del Valle. Email: am.mendozah@gmail.com.
2 Facultad de Ciencias Naturales y Exactas, Departamento de Biología, Universidad del Valle.
3 Facultad de Ciencias Naturales y Exactas, Departamento de Biología, Universidad del Valle.
4 Grupo de investigación en: "Ecología Animal", Facultad de Ciencias Naturales y Exactas, Departamento de Biología, Universidad del Valle. Email: ecologia@univalle.edu.co.
Resumen
Se ha reportado ampliamente, que los microorganismos presentes en el suelo o en el agua, tienen un fuerte impacto sobre la viabilidad de las poblaciones naturales de los anfibios. Sin embargo, en las zonas rurales con actividad pecuaria, la composición natural de la comunidad de microorganismos edáficos, puede llegar a verse altamente alterada, debido a la movilidad del ganado, llegando incluso, a que las pezuñas de dichos animales, sean un medio efectivo para su crecimiento y dispersión. En este artículo, se muestran los resultados de los aislamientos de hongos presentes en la piel de Dendropsophus columbianus, en una zona silvopastoril, con actividad pecuaria en el norte del departamento del Cauca (Colombia), comparados con los aislamientos de hongos del suelo y de las pezuñas del ganado vacuno, presentes en la zona de estudio. En total, se aislaron diez géneros de ascomicetos y un zigomiceto, de los cuales cuatro fueron encontrados en la piel de D. columbianus, cinco en las pezuñas del ganado vacuno y nueve en las muestras del suelo. Algunos de los géneros encontrados, han sido previamente reportados como hongos patógenos y dermatofítos para anfibios, aunque su efecto negativo en la piel de las ranas, puede llegar a ser atenuado, tanto por el sistema inmune del organismo, como por la misma comunidad microbiana simbionte de la piel del anuro. Sin embargo, la movilización continua del ganado, puede llegar a ser un factor de dispersión de algunos de los hongos aislados, por lo que, bajo las condiciones de actividad pecuaria, es necesario considerar un espectro mayor de patógenos que potencialmente, pueden afectar la piel de los anuros.
Palabras clave: anuros, ganadería, simbiosis, suelo.
Abstract
It has been widely reported that microorganisms present in soil or in water have a strong impact on the viability of amphibians' natural populations. However, in rural areas with livestock activities, the natural composition of the soil microorganism community can be highly altered by cattle mobility to the point that cattle hooves can be an effective means for microorganisms' growth and spread. This paper presents the results of fungal isolation in the skin of Dendropsophus columbianus in a silvopastoral area with livestock activities in northern Cauca department (Colombia), compared with fungal soil and cattle hooves isolation in the area studied. In total, ten genera of ascomycetes and one zygomicete were isolated from which four were found in D. columbianus' skin, five in cattle hooves and nine in soil samples. Some of the genera found have been previously reported as pathogenic fungi and dermatophytic for anurans, although their negative effect on the skin of frogs can be mitigated by both the natural immune system or the microbial symbiotic community found in the anuran skin. However, the continuous movement of livestock can become a dispersion factor of some isolated fungi, reason why under the livestock activity conditions it is necessary to consider a wider scope of pathogens which potentially might affect anurans' skin.
Key words: anurans, cattle raising, symbiosis, soil.
INTRODUCCIÓN
Los hongos afectan la piel, el pelo y las uñas de todos los vertebrados. Estas afecciones por hongos se denominan genéricamente: dermatofitosis. Además de las especies de hongos dermatofítos asociadas a los humanos, se han identificado cerca de 14 especies de hongos dermatofitos asociados a los animales (zoofílicos) y 16 especies asociadas al suelo (geofílicos) (MOLINA DE DIEGO, 2011).
Los anfibios son organismos vulnerables a la acción de microorganismos a través de la piel, como los hongos saprofitos, que pueden llegar a ser potencialmente patogénicos y capaces de reducir la viabilidad de las poblaciones (LIPS et al., 2005). En este contexto, gran parte de la investigación reciente, está enfocada en el efecto del hongo Batrachochytrium dendrobatidis (Bd) (LONGCORE et al., 1999), sobre diversos organismos. En Colombia, registros de esta afección, han sido reportados para los departamentos de: Santander, Boyacá y Cundinamarca en la cordillera oriental (ACOSTA-GALVIS et al., 2006; RUIZ & RUEDA, 2008), mientras que en el departamento del Valle del Cauca, en la cordillera occidental (VELASQUEZ et al., 2008).
El efecto que tienen los hongos saprófitos, incluido el Bd, sobre la viabilidad de las poblaciones naturales de anuros, pone de manifiesto la necesidad de incrementar nuestro conocimiento sobre este tema en particular (YOUNG et al., 2001; BELDEN & HARRIS, 2007; SOHDI et al., 2008). Estudios recientes de la comunidad microbiana de la piel de los anfibios, han demostrado que ciertas bacterias inhiben el crecimiento del Bd (WOODHAMS et al., 2007a). Además, hay casos en los que, si el ensamble de hongos presente en la dermis de las ranas no es perjudicial para el individuo, puede actuar como un efectivo agente que limita el impacto de parásitos y hongos infecciosos, convirtiéndose en la primer línea de defensa natural (PESSIER, 2002). En el entorno natural, tanto el suelo, como el agua, son las principales fuentes de microorganismos para los anuros. Sin embargo, en ambientes con actividades pecuarias, la movilización continua del ganado, no sólo afecta drásticamente la estructura del hábitat (SOVELL et al., 2000; MAECHA, 2002; PARUELO et al., 2005; TRAVIESO-BELLO et al., 2005; CINGOLANI et al., 2008), sino que presenta, un gran impacto en la comunidad de hongos y parásitos al favorecer su diseminación (BLANCO & GARCÍA, 2010).
Aunque conocer la composición de la fauna de microorganismos potencialmente patógenos para los ensambles de anuros en cada localidad, es un componente clave para generar estrategias de manejo conducentes a controlar las enfermedades que se generan (HARRIS et al., 2009; HILL et al., 2010), la información específica sobre la estructura de estos ensamblajes y el efecto potencial de los vectores de movilización activos como el ganado, es escaso.
Con el propósito de avanzar en el conocimiento disponible sobre esta temática para Colombia, en este artículo, se identifican los hongos saprófitos presentes en la epidermis de Dendropsophus columbianus (BOETTGER, 1892), en un ambiente silvopastoril del municipio de Caloto, Cauca, el cual posee una alta actividad pecuaria y se compara con el ensamblaje de los hongos presentes en el suelo y las pezuñas del ganado vacuno (Bos taurus Linnaeus, 1758) de la zona de estudio.
MATERIALES Y MÉTODOS
Dendropsophus columbianus, es una especie endémica de Colombia. Habita entre 950 y 2300 metros sobre el nivel del mar, en las dos vertientes de la cordillera occidental y en la vertiente occidental de la cordillera central, en los departamentos de: Cauca, Quindío, Risaralda y Valle del Cauca. Se encuentra asociada a ambientes naturales, como los bordes de lagos y lagunas, así como a ambientes artificiales como son los jardines y estanques. Es común en humedales de zonas bajas asociados a pastizales o potreros (RUIZ-CARRANZA et al., 1996; CASTRO-HERRERA et al., 2007; BOLIVAR & RENGIFO, 2011).
El estudio se realizó en la vereda Morales (02º 59.98'N - 76º24.60' W), del municipio de Caloto, departamento del Cauca (Figura 1), en una zona silvopastoril, con actividad pecuaria ubicada a 1199 metros sobre el nivel del mar. Se realizaron capturas de D. columbianus durante la noche, en un sector inundable, dominado principalmente, por vegetación herbácea, frecuentada continuamente por ganado vacuno de la zona (Figura 2A). Cada individuo capturado fue inmediatamente aislado en una bolsa Ziploc, para su posterior tratamiento.Figura 2A
Considerando que las lesiones causadas por hongos en ranas, generalmente, se concentran en la superficie ventral del cuerpo y las extremidades (DESMORE & GREEN, 2007; PESSIER 2002), se realizó un frotis epidérmico en la zona ventral y las patas anteriores de cada espécimen capturado, utilizando un hisopo estéril humedecido completamente con agua peptonada (Figura 2B). Cada hisopo se colocó en un tubo de ensayo esterilizado con 5ml de agua peptonada y se selló con un tapón de rosca. Finalmente, se rotuló con el número y el lugar de la muestra de donde fue tomado el individuo y se refrigeró para su transporte al laboratorio. Todo el procedimiento se realizó en el sitio de captura, sobre una hoja extendida de papel Craft esterilizada, junto a un mechero encendido para minimizar la contaminación de las muestras por agentes externos. Todos los individuos capturados, fueron liberados en la zona de estudio después de realizado el frotis de epidermis. Es importante destacar que, esta localidad, no ha sido aún analizada para detectar la presencia de Bd.

Adicionalmente, se realizaron frotis de las pezuñas del ganado vacuno (B. taurus), siguiendo el mismo protocolo previamente descrito (Figura 2C) y se colectaron muestras de suelo equivalentes a 5 cm3 en el área de captura, para evaluar la presencia de hongos saprófitos mediante la técnica de dilución. Esta técnica, consiste en obtener una suspensión de la mezcla de microorganismos y hacer diluciones seriadas que se vierten en una placa Petri hasta conseguir colonias aisladas. En el laboratorio, las muestras de D. columbianus y B. taurus se diluyeron hasta una concentración final de 10-3, mientras que las muestras de suelo, fueron diluidas hasta una concentración final de 10-5, a partir de la mezcla de 10 g de suelo en 9 ml de agua peptonada.
Para la proliferación de los hongos, se realizaron sembrados en profundidad utilizando un 1 ml de cada dilución en medio de cultivo tibio de papa-dextrosa-agar (PDA), en cajas de Petri previamente esterilizadas (Figura 2D). Todas las incubaciones se realizaron durante cinco días a temperatura ambiente (27 ºC). Finalmente, se realizó la identificación hasta el nivel de género de los hongos presentes siguiendo a GONÇALVES et al. (2006), en el laboratorio de microbiología de la Universidad del Valle. Cuando la esporulación no era posible en medio PDA, los hongos fueron resembrados en: Agar-Tierra, Agua, Avena, Clavel y Caléndula, para estimular la fase de esporulación.
RESULTADOS Y DISCUSIÓN
En total, se procesaron siete muestras para cada uno de los tres tipos de fuente: frotis de D. columbianus, pezuñas de ganado y suelo. Todos los sembrados fueron positivos para hongos. Se identificaron diez géneros de ascomicetos y un zigomiceto, de los cuales cuatro se encontraron en la piel de D. columbianus, cinco en las pezuñas de B. taurus y nueve estuvieron presentes en el suelo (Tabla 1).
Dos géneros (Penicillium y Trichoderma) fueron encontrados en las tres unidades muestreadas. Paecilomyces y Cladosporium, estuvieron presentes, tanto en D. columbianus, como en el suelo, mientras que: Eupenicillium, Fusarium, Gliocladium, Mucor y Verticillium, sólo se encontraron en las muestras de suelo y el Metarhizium, sólo se encontró, en las pezuñas de ganado (Figura 3). Aspergillus niger, fue el único hongo posible de determinar hasta nivel de especie. Adicionalmente, entre las muestras de suelo, se encontró un hongo basidiomiceto, el cual no pudo ser identificado. Nueve morfotipos de hongos no esporularon en ninguno de los medios utilizados. No se observó ninguna lesión cutánea en los especímenes de D. columbianus, capturados durante este trabajo.
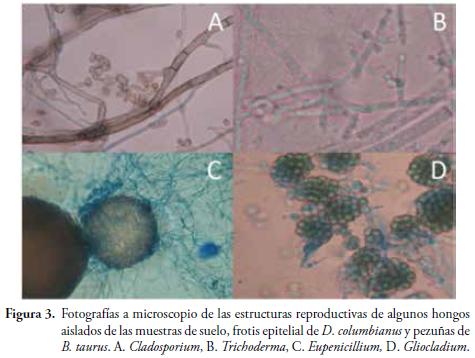
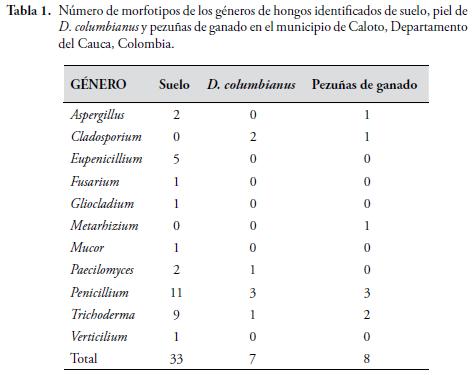
La pequeña proporción de géneros de hongos encontrados en la piel de D. columbianus, con respecto a la cantidad de hongos detectados en el suelo (Tabla 1), puede ser un indicio de la existencia de factores en la piel de los anuros, que previenen el establecimiento de algunos microorganismos. Probablemente, el accionar conjunto del sistema inmune de este anuro contra hongos patógenos sumado al efecto natural de la comunidad microbiana que se encuentra en la piel de D. columbianus en esta localidad, podría estar desplazando las especies agresoras por competencia de espacio y/o recursos, como ha sido reportado para otras especies de anfibios (HARRIS et al., 2009; POULIN, 1999; WOODHAMS et al., 2007a, 2007b).
Es necesario tener en cuenta que, los hongos identificados en esta investigación, pueden llegar a ser oportunistas y parásitos potenciales de anuros y otros vertebrados (TAYLOR, 1999). Por ejemplo, aunque la presencia de los géneros Penicillium y Trichoderma, en los tres sistemas, concuerda con la tendencia ampliamente conocida de estos géneros de ser ubicuos (COOPER & HAYCOCKS, 2000; RIFAI, 1969). Penicillium, ha sido reportado como patógeno en la piel de Aldabrachelys gigantea (OROS et al., 1996) y Alligator mississippiensis (JASMIN & BAUCOM, 1967), así como mutualista para Dipodomys spectabilis (HAWKINS, 1999), mientras que Trichoderma, ha sido reportado en casos de dermatitis micótica en ranas en cautiverio (CRASHAW). Otros géneros aquí encontrados, como: Gliocladium, Fusarium, Metarhizium y Verticillium, han sido reportados como micoparásitos para otros organismos diferentes a anuros (LEAL & VILLANUEVA, 1962; BARNETT & LILLY, 1962; DAYAL & BARON, 1970), siendo los tres últimos, entomopatógenos oportunistas (OSBORNE, 1992; ZHIOUA et al., 1997).
Los hongos del género Cladosporium, han sido asociados con el desarrollo de chromomicosis en ranas (MILLER et al., 1992; JUOPPERI et al., 2002), que conlleva a la muerte de los individuos afectados (DENSMORE & GREEN, 2007). El hallazgo de este género de hongo, tanto en la piel de D. columbianus, como en las pezuñas del ganado de la zona de estudio, no solo apoya la idea del efecto del ganado como posible vector de hongos en la zona, sino que también, pone de manifiesto la necesidad de ampliar el espectro de búsqueda de hongos dérmicos que podrían estar afectando la viabilidad de las poblaciones de anfibios en Colombia.
En síntesis, a pesar que los individuos muestreados, no presentaron señales de infección o daño, hay que tener cautela y proyectar una evaluación específica relacionada con la actividad patógena, que pueden llegar a tener, estos hongos saprófitos, con el anuro hospedero, por lo que debe prestarse especial atención a regiones en donde la actividad pecuaria tiene un fuerte impacto sobre el paisaje, toda vez que podrían convertirse en un vector de dispersión de estos agentes.
AGRADECIMIENTOS
A Neyla Benites, por su apoyo durante la fase de laboratorio. A María Inés Álvarez y a Luz Dary Caicedo del Laboratorio de Micología de la Universidad del Valle, por su colaboración para la determinación de los hongos. Lina Castaño proporcionó valiosos aportes para delimitar el diseño experimental utilizado. Andrés Quintero y al señor Miller, por su invaluable ayuda durante la fase de campo. Un reconocimiento especial a los revisores anónimos de este documento por sus valiosos aportes y comentarios. Esta investigación, fue financiada por el grupo de investigación: "Ecología Animal", el Departamento de Biología y el Departamento de Micología de la Universidad del Valle.
BIBLIOGRAFÍA
ACOSTA-GALVIS, A., RUEDA, J. V., VELÁSQUEZ, A. A., SÁNCHEZ, S. J. & PEÑA, J. A., 2006. - Descubrimiento de una especie de Atelopus (Bufonidae) para Colombia: ¿Una luz de esperanza o el ocaso de los sapos arlequines? Rev. Acad. Colomb. Cienc., 30 (115): 280-290. [ Links ]
BARNETT, H. L. & LILLY, V. G., 1962.- A destructive Mycoparasite, Gliocladium roseum. Mycologia, 54 (1): 72-77. [ Links ]
BELDEN, L. K. & HARRIS, R. N., 2007.- Infectious diseases in wildlife: the community ecology context. Front. Ecol. Environ., 5 (10): 533-539. [ Links ]
BELSCHNER, H. G. & MARSHALL, E. F., 1984.- Cattle diseases. 5. ed. Angus & Robertson. Sydney. 378p. [ Links ]
BLANCO, J. L. & GARCÍA, M. E., 2010.- Animal as reservoir of fungal diseases: zoonoses?: 46-70 (in) AHMAD, I., OWAIS, M. & SHAHID, M. (eds.) Combating fungal infections: problems and remedy, Springer, Netherland. [ Links ]
BOLÍVAR, W. & RENGIFO, J. M., 2011.- Dendropsophus columbianus. (in) IUCN red list of threatened species. [en línea] desde www.iucnredlist.org. [ Links ]
CASTRO-HERRERA, F., BOLIVAR-GARCÍA, W. & HERRERA-MONTES, M. I., 2007.- Guía de los anfibios y reptiles del bosque de Yotoco, Valle del Cauca, Colombia. Grupo de Investigación Laboratorio de Herpetología, Universidad del Valle. Cali, Colombia. 70 p. [ Links ]
CINGOLANI, A. M., NOY-MEIR, I., RENISON, D. D. & CABIDO, M., 2008.- La ganadería extensiva: ¿es compatible con la conservación de la biodiversidad y de los suelos? Ecol. Austral, 18 (3): 253-271. [ Links ]
COOPER, C. & HAYCOCKS, N., 2000.- Penicilliummarneffei: an insurgent species among the Penicillia. J. Eukaryot. Microbiol., 47 (1): 24-28. [ Links ]
DAYAL, R. & BARRON, G. L., 1970.- Verticillium psalliotaeas a parasite of Rhopalomyces. Mycologia, 62 (4): 826-830. [ Links ]
DENSMORE, C. L. & GREEN D. E., 2007.- Diseases of amphibians. ILAR J., 48 (3): 235-254. [ Links ]
GONÇALVES, A. B., PATERSON, R. R. M. & LIMA, N., 2006.- Survey and significance of filamentous fungi from tap water. Int. J. Hyg. Environ.-Health, 209 (3): 257-264. [ Links ]
HARRIS, R. N., BRUCKER, R. M., WALKE, J. B., BECKER, M. H., SCHWANTES, C. R., FLAHERTY, D. C., LAM, B. A., WOODHAMS, D. C., BRIGGS, C. J., VREDENBURG, K., MINBIOLE, P. 2009.- Skin microbes on frogs prevent morbidity and mortality caused by a lethal skin fungus. ISME J, 3: 818-824. [ Links ]
HAWKINS, L. K. 1999.- Microfungi associated with the Banner-Tailed Kangaroo Rat, Dipodomys spectabilis. Mycologia, 91 (5): 735-741. [ Links ]
HILL, W. A., NEWMAN, S. J., CRAIG, L., CARTER, C., CZARRA, J. & BROWN, P. 2010.- Diagnosis of Aeromonas hydrophila, Mycobacterium species, and Batrachochytrium dendrobatidis in an African Clawed Frog (Xenopus laevis). J Am. Assoc. Lab. Anim. Sci. 49 (2): 215-220. [ Links ]
JASMIN, A. M., CARROLL, J. M. & BAUCOM, J. N. 1968.- Pulmonary Aspergillosis of the American Alligator (Alligator mississippiensis). Am. J. Vet. Clin. Path, 2: 93. [ Links ]
JUOPPERI, T., KARLI, K., DEVOE, R. & GRINDEM, C. B., 2002.- Granulomatous dermatitis in a spadefoot toad (Scaphiopus holbrooki). Vet. Clin. Path., 31 (3): 137-13. [ Links ]
LEAL, J. A. & VILLANUEVA, J. R. 1962.- Fungilytic activity of a species of Verticillium. Science, New Series, 136 (3517): 715-716. [ Links ]
LIPS, K. R., BORROWES, P. A., MENDELSON, J. R. & PARRA-OLEA, G. 2005.-Amphibianpopulation declines in Latin America: A Synthesis. Biotropica, 37 (2): 222-226. [ Links ]
MAECHA, L. 2002.- El silvopastoreo: una alternativa de producción que disminuye el impacto ambiental de la ganadería bovina. Rev. Col. Cienc. Pec., 15 (2): 226-231. [ Links ]
MILLER, E. A., MONTALI, R. J., RAMSAY, E. C. & RIDEOUT, B. A. 1992.- Disseminated Chromoblastomycosis in a Colony of Ornate-Horned Frogs (Ceratophry sornata). J. Zoo. Wildl. Med., 23 (4): 433-438. [ Links ]
MOLINA DE DIEGO, A. 2011.- Aspectos clínicos, diagnósticos y terapéuticos de la dermatofitosis. Enferm. Infecc. Microbiol. Clin., 29 (Supl. 3): 33-39. [ Links ]
OROS, J., RAMIREZ, A. S., POVEDA, J. B., RODRÍGUEZ, J. L. & FERNÁNDEZ, A. 1996.- Systemicmycosis caused by Penicillium griseofulvum in a Seychelles giant tortoise (Megalochelys gigantea). Vet. Rec., 139 (12): 295-296. [ Links ]
OSBORNE, L. S. & LANDA, Z. 1992.- Biological control of whiteflies with Entomopathogenic Fungi, Fla. Entomol, 75 (4): 456-471. [ Links ]
PARUELO, J. M., GUERSCHMAN, J. P. & VERÓN, S. R. 2005.- Expansión agrícola y cambio en el uso de suelos. Ciencia Hoy., 15 (87): 14-23. [ Links ]
PESSIER, A. P. 2002.- An overview of amphibian skin disease. Semin. Avian. Exotic. Pet. Med., 11 (3): 162-174. [ Links ]
POULIN, R. 1999.- The functional importance of parasites in animal communities: many roles at many levels? Int. J. Parasitol., 29 (6): 903-914. [ Links ]
RIFAI, M. A. 1969.- A revision of the genus Trichoderma. Mycol. Pap., 116: 1-56. [ Links ]
RUIZ, A. & RUEDA-ALMONACID, J. V. 2008.- Batrachochytriumdendrobatidis and chytridiomycosis in anuran amphibians of Colombia. Eco Health, 5 (1): 27-33. [ Links ]
RUIZ-CARRANZA, P. M., ARDILA-ROBAYO, M. C. & LYNCH, J. D. 1996.- Lista actualizada de la fauna de Amphibia de Colombia. Rev. Acad. Colomb. Cienc., 20 (77): 365-415. [ Links ]
SODHI, N. S., BICKFORD, D., DIESMOS, A. C., LEE, T. M., KOH, L. P., BROOK, B. W., SEKERCIOGLU, C. H. & BRADSHAW, C. J. A. 2008.- Measuring the meltdown: drivers of global amphibian extinction and decline. PLoS ONE, 3: e1636. [ Links ]
SOVELL, L., VONDRACEK, A., FROST, K. & MUMFORD, G. 2000.- Impacts of rotational grazing and riparian buffers on physicochemical and biological characteristics of southeastern Minnesota, USA, streams. Environ. Mgmt., 26 (6): 629-641. [ Links ]
TAYLOR, S. K., WILLIAMS, E. S., PIER, A. C., MILLS, K. W. & BOCK, M. D. 1999.- Mucormycosis dermatitis in captive adult Wyoming toads. J. Wildlife Dis., 35 (1): 70-74. [ Links ]
TRAVIESO-BELLO, A. C., MORENO-CASASOLA, P. & CAMPOS, A. 2005.- Efecto de diferentes manejos pecuarios sobre el suelo y la vegetación en humedales transformados a pastizales. INCI, 30 (1): 12-18. [ Links ]
VELÁSQUEZ-E, B. E., CASTRO, F., BOLIVAR-G, W. & HERRERA, M. I. 2008.- Infección por el hongo Batrachochytrium dendrobatidis en anura de la Cordillera Occidental de Colombia. Herpetotrópicos, 4 (2): 65-70. [ Links ]
WOODHAMS, D. C., ARDIPRADJA, K., ALFORD, R. A., MARANTELLI, G., REINERT, L. K. & ROLLINS-SMITH, L. A. 2007a.- Resistance to chytridiomycosis varies among amphibian species and is correlated with skin peptide defenses. Animal Conservation, 10 (4): 425-428. [ Links ]
WOODHAMS, D. C., VREDENBURG, V. T., SIMON, M. A., BILLHEIMER, D., SHAKHTOUR, B., SHYR, Y., BRIGGS, C. J., ROLLINS-SMITH, L. A. & HARRIS, R. N. 2007b.- Symbiotic bacteria contribute to innate immune defenses of the threatened mountain yellow-legged frog, Rana muscosa. Biol. Conserv., 138 (3-4): 390-398. [ Links ]
YOUNG, B. E., LIPS, K. R., REASER, J. K., IBAÑEZ, R., SALAS, A. W., CEDENO, R., COLOMA, L. A., RON, S., LA MARCA, E., MEYER, J. R., MUÑOZ, A., BOLAÑOS, F., CHÁVEZ, G. & ROMO, D. 2001.- Population declines and priorities for amphibian conservation in Latin America. Conserv. Biol., 15 (5): 1213-1223. [ Links ]
ZHIOUA, E., BROWNING, M., JOHNSON, P. W., GINSBERG, H. S. & LEBRUN, R. A. 1997.- Pathogenicity of the Entomopathogenic Fungus Metarhizium anisopliae (Deuteromycetes) to Ixodes scapularis (Acari: Ixodidae). J. Parasitol., 83 (5): 815-818. [ Links ]













