Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.1 Manizales Jan./June 2012
IDENTIFICACIÓN DE POBLACIONES MICROBIANAS EN COMPOST DE RESIDUOS ORGÁNICOS DE FINCAS CAFETERAS DE CUNDINAMARCA
IDENTIFICATION OF MICROBIOLOGICAL POPULATIONS IN ORGANIC WASTE COMPOST FROM COFFEE FARMS IN CUNDINAMARCA (COLOMBIA)
Natalia Escobar Escobar1, Jairo Mora Delgado2, Néstor Jaime Romero Jola3
* FR: 27-V-2012. FA: 3-IX-2012.
1 Docente investigador. Grupo de Investigación Sistemas Agroforestales Pecuarios. Facultad de Ciencias Agropecuarias, Universidad de Cundinamarca. Fusagasugá, Cundinamarca. Email: nnaescobar@hotmail.com.
2 Profesor Asociado. Grupo de Investigación Sistemas Agroforestales Pecuarios. Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Ibagué, Tolima. Email: jrmora@ut.edu.co.
3 Investigador. Facultad de Ciencias Agropecuarias, Universidad de Cundinamarca. Email: nesrom34@gmail.com.
Resumen
Los residuos orgánicos agrícolas, pueden aprovecharse, si se tiene en cuenta, que son una fuente reutilizable de nutrientes y energía, por tal motivo, procesos como el compostaje, pueden mejorar la calidad de estos, mediante la descomposición aeróbica. En un proceso de compostaje de material orgánico, proveniente de fincas cafeteras, ubicadas en el departamento de Cundinamarca (pulpa de café, banano, gallinaza y bovinaza), se caracterizaron cualitativa y cuantitativamente, las poblaciones de bacterias, actinomicetos y hongos. La caracterización de poblaciones microbianas, se realizó mediante la aplicación, de técnicas de dilución seriada, en medios de cultivo selectivos y técnicas de microscopia y macroscopia. Los microorganismos de mayor importancia, encontrados en sustratos puros, como en sus mezclas, fueron: para las bacterias, los géneros Pseudomonas y Bacillus; para actinomicetos, Streptomyces y para hongos, Aspergillus y Penicillum.
Palabras claves: abonos orgánicos, compostaje, microorganismos.
Abstract
Agricultural organic waste can be taken advantage of if one takes into account that it is a reusable source of nutrients and energy, reason why processes such as composting can improve its quality through aerobic decomposition. In an organic material composting process from coffee farms located in the Department of Cundinamarca (coffee pulp, bananas, manure and bovine manure) populations of bacteria, Treponema, and fungi were qualitatively and quantitatively characterized. The characterization of microbial populations was carried out through the application of techniques of serial dilution in selective culture ways and microscopy and macroscopia techniques. Micro-organisms of greatest importance found in pure substrates and their mixes were: for bacteria, the genera Pseudomonas and Bacillus; for Treponema Streptomyces and fungi, Aspergillus and Penicillium.
Key words: organic fertilizers, composting, microorganisms.
INTRODUCCIÓN
El compostaje, es la conversión, de un material orgánico inestable, a un producto estabilizado, a través de respiración aerobia (ADAMS et al., 2007), dicho proceso, involucra la conversión biológica, de material orgánico sólido, en productos útiles, tales como: fertilizantes, substratos para la producción de champiñones o biogás (metano). Independientemente del producto, las poblaciones microbianas, son el componente activo de los procesos de biodegradación y conversión durante el compostaje. Sin embargo, la optimización de la calidad del compost, está directamente relacionada, con su composición y la sucesión de comunidades microbiales, durante el proceso, lo que genera, una dinámica poco conocida (PETERS et al., 2000).
En las fincas cafeteras, el cultivo principal articulado a la economía de mercado, es el café, el cual generalmente, está asociado con musáceas; de esta asociación, la producción de residuos es considerable. Así, la pulpa, mucilagos, aguas mieles, cascarilla, hojarasca y leña (RODRÍGUEZ, 1999), además de la fruta de rechazo de las musáceas, el pseudotallo y las hojas, poseen una importante carga de nutrientes, que bien podrían reutilizarse en el sistema, mediante aplicaciones como abono orgánico o componente de la dieta de animales.
En la zona cafetera, la producción de residuos orgánicos provenientes de las actividades pecuarias, es significativa. ESTRADA & PERALTA (2001), dan cuenta de deyecciones por el orden de 5,5 %; 8,5 % y 10 %, de los pesos vivos de aves, porcinos y vacunos, respectivamente.
Durante el compostaje, la materia orgánica, es biotransformada en condiciones aeróbicas, mediante reacciones de óxido-reducción catalizadas por enzimas microbianas. En este proceso, los microorganismos utilizan la materia orgánica como nutriente para su desarrollo, produciendo su descomposición (mineralización), hasta moléculas orgánicas e inorgánicas, más sencillas, siendo el proceso de humificación, el paso en el cual, se crean nuevas macromoléculas, a partir de moléculas sencillas, formadas en la descomposición. El proceso en conjunto, produce fundamentalmente calor, CO2, H2O y compuestos húmicos (MORENO & MORAL, 2008).
Con base en lo anterior, el presente estudio, espera dar respuesta al interrogante: ¿Qué microorganismos (bacterias, hongos y actinomicetos) benéficos y patógenos, se encuentran presentes en el producto final del proceso de compostaje?
MATERIALES Y MÉTODOS
La presente investigación, inició con la fase de diagnóstico y cuantificación de residuos orgánicos, producidos en sistemas agropecuarios, ubicados en pisos térmicos entre 1000 y 2000 msnm de Cundinamarca y Tolima, para ello, se utilizó la información obtenida en dos proyectos. El primero, denominado: "Flujo de masas y energía en fincas campesinas de la zona cafetera: vínculos entre la racionalidad campesina y el reciclaje de materiales y energía", desarrollado en los municipios de Líbano, Fresno e Icononzo (Tolima), en el cual se encontró que, en diferentes tipos de fincas, los sustratos más frecuentes eran: pulpa de café (cacota), residuos de musáceas, hojarasca, forrajes residuales residuos de bovinos (bovinaza), porcinos (porquinaza) y aves de corral (gallinaza). El segundo proyecto "Desarrollo e innovación tecnológica en ganadería ecológica y eficiente en la provincia del Sumapáz en los sectores productivos y educativos", permitió generar una base de datos, de 202 fincas, localizadas en la franja altitudinal, antes mencionada, del municipio de Fusagasugá (Cundinamarca). Con esta base de datos, se estimó la cantidad de heces producidas por finca anualmente, siguiendo la metodología de COLORADO STATE UNIVERSITY (2009), que consiste, en hacer cálculos de heces, con base en el número y tipo de animales presentes en el predio, el peso vivo en edad adulta y el tiempo, que permanecen en el sistema productivo.
Por medio de la anterior información y tomando como base los residuos orgánicos, que eran más relevantes en las fincas analizadas, se estableció una réplica experimental de microcomposteras con el objeto de hacer un monitoreo en un ambiente controlado al proceso de descomposición. Las microcomposteras se establecieron en la Quinta, Villamaría, ubicada en el municipio de Fusagasugá bajo condiciones agrometeorológicas (temperatura, humedad, altitud), similares, a las de la ubicación de las fincas analizadas. Se usaron sustratos obtenidos en tres fincas de Cundinamarca: La Esperanza, La Honda y El Bananero. Los tres predios, se ubican en el municipio de Fusagasugá, entre los 4º 21' 00'' latitud norte y los 74º 24' 00'' de longitud occidental (Lat: 004º 20' 38'' N / Long: 074º 22' 04'' O), a una altura promedio, de 1720 msnm (Figura 1). El municipio de Fusagasugá, se localiza, a una distancia de 64 kilómetros (39,76 millas), al sur-occidente de Bogotá, en el departamento de Cundinamarca, siendo la capital, de la provincia del Sumapáz (POT, 2004).
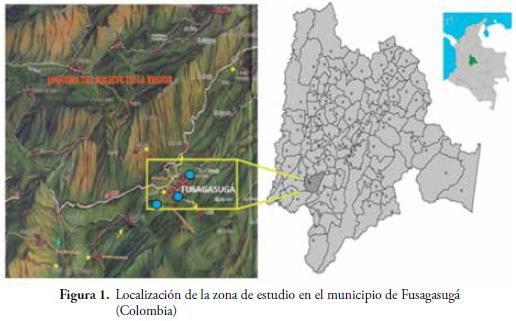
Diseño de los experimentos
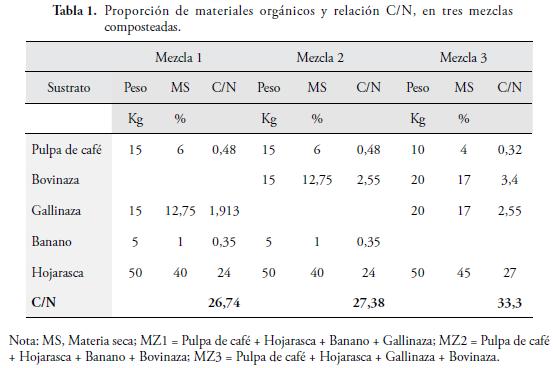
Tres tipos de abonos orgánicos, fueron preparados y evaluados, con base en la mezcla, de residuos orgánicos más relevantes en la zona: banano (BN), bovinaza (BV), pulpa de café (CA) y gallinaza (GZ), según la relación C/N, de la Tabla 1.
Preparación de las mezclas
Una vez obtenido el material en las fincas, se procedió a preparar los tratamientos. Se revisó la homogeneidad de los sustratos, evitando de esta manera, el procesamiento de masas aglutinadas o residuos extraños. Los residuos de banano, fueron picados con machete para reducir el tamaño de las partículas; a las muestras de bovinaza y gallinaza, se les adicionó agua, para establecer una óptima humedad; seguidamente, se realizó la mezcla de los materiales. A cada tratamiento, se le adicionó 10 g de melaza, diluida por cada 100 g de muestra; igualmente, se adicionó, 10 g de inóculo (compost terminado de gallinaza), por cada 100 g de muestra, para promover la actividad microbiana. Finalmente, se procedió a llenar bultos de lona, hasta una altura de 90 cm, con el propósito de garantizar un aumento adecuado de temperatura; cada tratamiento, se identificó mediante rótulos con abreviaciones.
Caracterización microbiológica
Para la identificación de microorganismos en el día 90, del proceso de compostaje, se aplicaron técnicas de macroscopía y microscopia, en el Laboratorio de Microbiología de la Universidad de Cundinamarca, teniendo en cuenta, la Norma Técnica Colombiana (NTC 4491-2) sobre procedimientos microbiológicos.
Bacterias
Macroscopía
Se hizo la caracterización macroscópica, con base en los siguientes criterios: tamaño de las colonias (puntiforme, pequeñas, medianas, grandes); color; forma (regulares, redondas, ovaladas, irregulares, filamentosas, rizoides); elevación de las colonias (plana, elevada, convexa monticular); bordes (entero, ondulado, aserrado, filamentoso y rizado); superficie; olor (amoniacal, fétido, dulzón) y crecimiento (abundante, moderado, escaso).
Microscopia
Se realizó la tinción de Gram (MADIGAN et al., 2000) y se utilizó el método miniaturizado de identificación, mediante el kit BBL Crystal (Marca B. D. Diagnostic Systems Europe) fundamentado en la utilización y degradación de sustratos específicos por parte de los microorganismos detectados, por distintos sistemas indicadores (MACFADDIN, 2000), para bacilos Gram (-), que pertenecen a la familia Enterobacteriaceae, así como los más frecuentes aislamientos de bacilos Gram (-), no fermentadores de glucosa. Además, se usó un kit para organismos Gram (+) (cocos y bacilos).
Hongos
Para la identificación del género y posible especie de los hongos, en los tratamientos, fue necesario la utilización de claves taxonómicas, para esto, se tuvo en cuenta, las características macro y microscópicas, es así, como fue preciso examinar los aislamientos de cada una de las cepas y contrastar con la literatura.
Macroscopía
En este paso, se utilizaron las mismas pautas de lectura y descripción de colonias bacterianas.
Microscopía
Para la observación microscópica, se utilizó la técnica de cinta pegante. Esta técnica, es una de las más usadas, debido a que conserva la yuxtaposición original de las esporas y segmentos de hifas (KONEMAN, 2001). Para su realización, se hizo un doblez de una tira de 4 cm, con el lado adhesivo hacia afuera y se sostuvo, con pinzas. El lado adhesivo, se presionó firmemente, contra la superficie de la colonia del hongo, a estudiar. El micelio aéreo, se une a la superficie adhesiva, por lo cual, es fácilmente separado de la colonia. La tira de cinta con la muestra, se colocó sobre una gota de azul de lactofenol, con un portaobjeto y se prosiguió, con las observaciones.
Método de microcultivo
Para lograr más precisión en la observación de estructuras fúngicas in situ (ARENAS (2003) se tomo una caja de petri con un caballete de vidrio en u, para evitar la desecación; se depositaron 5 ml de agua estéril en la caja; se ubicó un portaobjetos sobre el caballete y con una pipeta estéril, se colocó una capa de agar, en la superficie de la lámina, finalmente, se sembró en el centro, un poco del cultivo y se llevó a incubar, a 25 ºC de 48 por 72 horas (CASAS, 1989).
Actinomicetos
Para la identificación del género de los actinomicetos, de los siete tratamientos, se requirió la utilización de claves taxonómicas, para esto, se tuvo en cuenta, las características macro, microscópicas y los reportes encontrados, en la literatura. Macroscopía
En este paso, se utilizaron las mismas pautas de lectura y descripción de colonias bacterianas y fúngicas.
Microscopía
Para la identificación de los géneros, se tuvieron en cuenta las características microscópicas observadas en muestras con coloración de Gram, como fragmentación del micelio en formas cocoides, bacilares o artroconidiales, presencia de espirales y bucles, formación de esporangios, presencia de esporas terminales, en pares o grupos, en el micelio (SYLVIA et al., 1999).
A partir de los aislamientos primarios, se hicieron repiques en agar para actinomicetos, de cada uno, de los morfotipos identificados. Los cultivos, se incubaron en posición invertida por un periodo de 8-10 días, a 28 ºC.
Métodos estadísticos
Con el propósito de conocer la proporción y distribución de especies microbianas finales (día 90), identificadas y caracterizadas, en los 7 tratamientos evaluados, se diseñaron tablas de frecuencia en EXCEL versión 2007.
RESULTADOS Y DISCUSIÓN
Caracterización microbiológica en sustratos simples
Bacterias
Las bacterias identificadas (Tabla 2), en sustratos simples, corresponden a microorganismos, comúnmente encontrados, en el proceso de compostaje (ARBEIT et al., 2000).
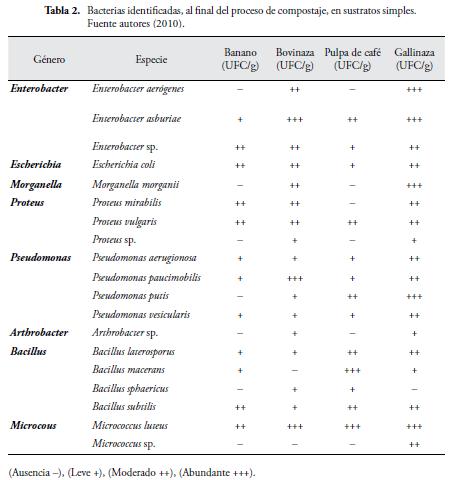
Se aislaron 5 géneros del grupo de bacterias Gram negativas (Enterobacter, Escherichia, Morganella, Proteus, y Pseudomonas). El género más representativo, fue el de Pseudomonas.
Se aislaron 3 géneros de bacterias Gram positivas (Arthrobacter, Bacillus y Micrococcus). El género más representativo, fue Bacillus. Estos géneros, también se encuentran en el proceso de compostaje (ARBEIT et al., 2000).
En un estudio realizado por ADEGUNLOYE et al. (2007), sobre el análisis microbiano de compostaje, utilizando estiércol de vaca como inoculo, reportaron, que las poblaciones bacterianas más frecuentes, son: Micrococcus luteus, Bacillus pumilus, Bacillus macerans, Bacillus spaericus, Bacillus laterosporus, Pseudomona aeruginosa, Enterobacter aerogenes y Proteus mirabilis, muchas de las cuales, también fueron identificadas, en este estudio.
Por otro lado, REBODILLO et al. (2008), en una investigación, sobre poblaciones microbianas, durante el proceso de compostaje de residuos orgánicos sólidos municipales, encontraron que el grupo de bacterias, estuvo representado, en aerobias Gram-negativos del género: Pseudomonas, Azotobacter, Azospirillum; en aerobias Gram-positivas, el género Micrococcus y formadoras de esporas como Bacillus, géneros similares, a los encontrados en esta investigación.
Actinomicetos
Los actinomicetos identificados, se observan en la Tabla 3 correspondientes a dos géneros (Nocardia y Streptomyces). El principal género del grupo, es Streptomyces, cuyas especies, suelen generar antibióticos, producen un olor característico a tierra mojada, debido a la emisión de compuestos volátiles (PRESCOTT, 2002), así mismo, fue el género más frecuentemente aislado, en las muestras de sustratos simples.
Los actinomicetos, constituyen un importante grupo de organismos procarióticos, habitantes del suelo y del material vegetal compostado (KONEMAN, 2001; PRESCOTT, 2002). En general, son capaces de degradar sustancias complejas, como lignocelulosa, quitina y peptidoglicanos, contribuyendo notablemente, a la mineralización de estos compuestos en el suelo y en el compostaje (LACEY, 1973).
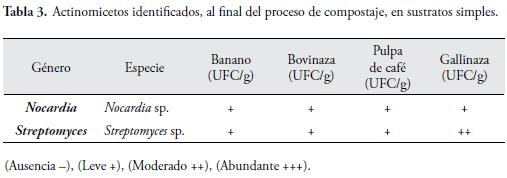
Los actinomicetos, también han sido descritos como agentes de biocontrol por la capacidad de producir enzimas biodegradativas, como: quitinasas, glucanasas, peroxidasas y otras, involucradas en el papel del micoparasitismo, que llevan a cabo estos microorganismos (FRANCO-CORREA, 1999; TOKALA et al., 2002; MÁRQUEZ et al., 2003). El género Streptomyces, ha sido descrito como colonizador de la rizosfera, capaz de ejercer biocontrol, sobre hongos fitopatógenos, promover la nodulación y ayudar a los bacteriodes de Rhizobium, a la asimilación del hierro, en la fijación de nitrógeno, en leguminosas, lo cual contribuye, indirectamente, a estimular el crecimiento vegetal (TOKALA et al., 2002).
REBODILLO et al. (2008), en una investigación, sobre poblaciones microbianas en el proceso de compostaje, de residuos orgánicos sólidos municipales, encontraron del grupo de actinomicetos, bacterias Gram-positivas, como: Streptomyces, Actinomyces, el género Streptomyces, fue el más frecuentemente encontrado, así como en los tratamientos evaluados, en este estudio.
Hongos
Los hongos identificados (Tabla 4), en los tratamientos simples, han sido descritos anteriormente, como parte de los sistemas de biotransformación, de materia orgánica (VILLENA & GUTIÉRREZ, 2003).
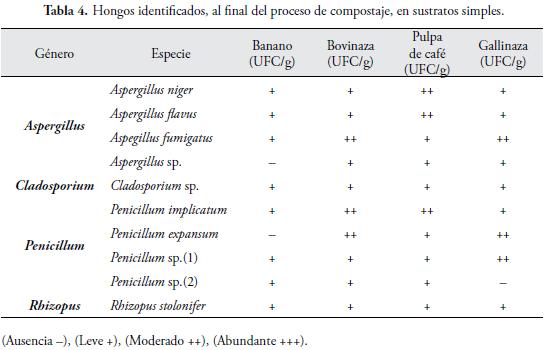
Se registraron 4 géneros (Aspergillus, Cladosporium, Penicillium y Rhizopus), los más frecuentemente encontrados, son: Aspergillus y Penicillium, estos hongos, se aislaron en casi todos los tratamientos simples. Al respecto, ATLAS & BARTHA (2005), afirman que, las especies más corrientemente encontradas, de hongos celulolíticos, en los materiales de los compost, son los géneros Aspergillus, Penicillium, Fusarium y Trichoderma. Aunque, la celulosa y hemicelulosa, son degradados, más lentamente que los azúcares o el almidón, la lignina, es el residuo orgánico más resistente y normalmente, el último producto que se degrada de la cadena alimenticia. Los Basidiomyces, juegan un papel importante, en la degradación de la lignina.
En un estudio realizado por ADEGUNLOYE et al. (2007), sobre el análisis microbiano de compostaje, utilizando estiércol de vaca como inoculo, reportaron, que la población de hongos Aspergillus niger, fue el más predominante, le siguieron: Aspergillus flavus, Aspergillus rapens, Rhizopus stolonifer, Mucor mucedo, Fusarium, Aspergillus fumigatus, Varicosporium. En este trabajo, los géneros Aspergillus y Penicillium, fueron los más frecuentemente aislados, de los sustratos simples.
Caracterización microbiológica de mezclas
Las bacterias identificadas (Tabla 5), en las mezclas, corresponden a microorganismos comúnmente encontrados, en el proceso de compostaje (MORENO & MORAL, 2008).
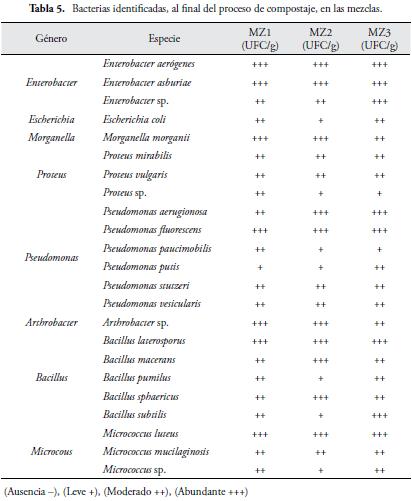
Se aislaron 5 géneros del grupo de bacterias Gram negativas (Enterobacter, Escherichia, Morganella, Proteus y Pseudomonas). Siendo el género más representativo, Pseudomonas. Las especies anteriormente reportadas, fueron las mismas, que se encontraron, en los sustratos simples, en este grupo de Gram negativas adicionalmente, se identificó: Pseudomonas fluorescens y Pseudomonas stutzeri. Ademas, se aislaron 3 géneros del grupo de bacterias Gram positivas (Arthrobacter, Bacillus y Micrococcus). El género más representativo, fue Bacillus. Estos géneros, se encuentran normalmente, durante el proceso de compostaje (ARBEIT et al., 2000). Las especies anteriormente reportadas, fueron las mismas encontradas, en los sustratos simples, en este grupo de Gram positivas adicionalmente, se identificaron: Bacillus pumilus y Micrococcus mucilaginosis.
Actinomicetos
Los actinomicetos identificados (Tabla 6), en las mezclas, corresponden, a microorganismos comúnmente encontrados, en el proceso de compostaje (YAÑEZ et al., 2007).

Se identificaron tres géneros (Actinomyces, Nocardia, Streptomyces). El principal género del grupo, fue Streptomyces, cuyas especies, suelen generar antibióticos (PRESCOTT, 2002), los 3 géneros, fueron frecuentemente aislados en las mezclas. Las especies anteriormente reportadas, fueron las mismas encontradas, en los sustratos simples, sin embargo, en las mezclas, se identificó, además, el género Actinomyces.
Hongos
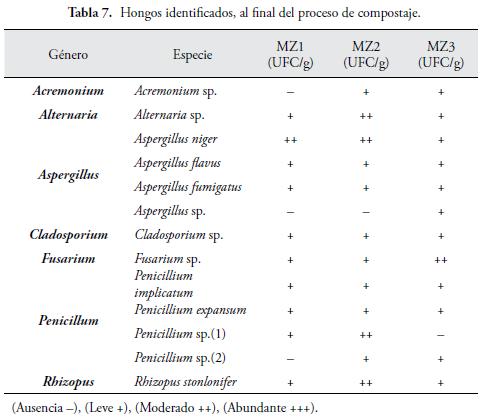
Los hongos identificados (Tabla 7) en mezclas, han sido anteriormente, descritos como parte de los sistemas de biotransformación de materia orgánica (VILLENA & GUTIÉRREZ, 2003).
Se registraron 7 géneros (Acremonium, Alternaria, Aspergillus, Cladosporium Fusarium, Penicillum y Rhizopus), los más frecuentemente encontrados, fueron Aspergillus y Penicillium, estos hongos, se aislaron en casi todas las mezclas. Las especies reportadas, fueron las mismas encontradas, en los sustratos simples, en las mezclas, se identificaron adicionalmente, 3 géneros (Acremonium, Alternaria y Fusarium).
En un estudio realizado por SALAZAR et al. (2004), sobre el aprovechamiento del estiércol, como alternativa nutricional en invernadero, utilizado en mezclas, mencionan, que las principales especies de hongos detectados, son: Mucorales, Discomycetes y Basidiomycetes. Esto debido, a que el estiércol, es un producto rico en carbono, el cual es una fuente nutrimental básica para los hongos encontrados. AGUIRRE & ULLOA (1983), encontraron resultados similares, indicando que el carbono, cuando esta en estructuras, fácilmente biodegradables, algunos tipos de hongos, como Ascomycetes y Basidiomycetes, pueden aparecer.
Se identificó mayor presencia de bacterias, tanto en sustratos simples, como en sus mezclas, este grupo, es el más diverso en el compostaje, debido a que se utiliza, un amplio rango de enzimas, que les permite degradar químicamente, una gran variedad de materiales orgánicos. Consecuentemente, las bacterias, son responsables de la mayor parte de descomposición inicial y de la generación de calor en el compostaje. En la mayoría de los casos, predominan las bacterias, unas 100 veces más, que los hongos. GOLUEKE (1977), CASTRILLÓN et al. (2006) y CALBRIX et al. (2007), estimaron, que al menos el 80-90 %, de la actividad microbiana en el compostaje, se debe a las bacterias.
La población real de bacterias, depende del tipo de material básico, de las condiciones locales y de las enmiendas utilizadas. La comunidad microbiana en los sustratos de partida, unidos a los que colonizan la pila de compostaje, desde el entorno circundante, constituyen el conjunto de agentes biológicos responsables del proceso de biotransformación. Como menciona MORENO & MORAL (2008), el tipo predominante de microorganismo, en cada fase, depende de su eficacia competitiva y de su capacidad de supervivencia, frente a las condiciones imperantes.
Como mencionan INSAM et al. (2002), la interacción, entre varios grupos funcionales de microorganismos, depende de los nutrientes disponibles y de cambios, en los mecanismos bioquímicos, durante la transformación de materia orgánica e inorgánica. La población de actinomicetos, fue más abundante, que la de hongos, en parte porque estos microorganismos, adoptan formas filamentosas, que dan lugar, a un pseudomicelio, parecido al de los hongos, se desarrollan más lentamente y tienen mayor capacidad para metabolizar compuestos orgánicos complejos, que las bacterias. Como indica MORENO & MORAL (2008), estos microorganismos, se detectan, en un número considerable, en todas las fases de compostaje, porque adicionalmente, incluyen representantes termófilos. PÉREZ et al. (2004), reportan que, en el análisis microbiológico, el grupo de actinomicetos, presentó menor variación, entre los sustratos de fuentes animales, con respecto, a los de fuentes vegetales. Los grupos mesofílicos, los hongos y levaduras, variaron más en las fuentes animales, con respecto a las vegetales.
ACUÑA et al (2006), indican, que los valores de colonias de bacterias y actinomicetos, al final del compost, resultaron ser mayores que los hongos, posiblemente, porque son microorganismos participantes de la nitrificación y amonificación, necesaria para la biota del suelo, resultados comparables, a los obtenidos en esta investigación, donde las poblaciones de bacterias y actinomicetos, fueron mayores a las de los hongos.
La gallinaza, mezcla 1 y 3 (compuestos de gallinaza), presentaron la mayor abundancia y diversidad de microorganismos; este resultado, puede estar asociado al contenido de nutrientes, como: nitrógeno, fósforo, potasio, calcio, magnesio, hierro, manganeso, zinc, cobre y boro; así mismo, es necesario, tener en cuenta su origen (producción de aves en jaula vs producción en piso) y su aporte de materia orgánica. MELÉNDEZ (2003), menciona, que estos nutrientes, permiten el crecimiento de poblaciones microbiológicas, especialmente, las bacterianas.
CONCLUSIONES
La gallinaza, fue el tratamiento, que más altos valores obtuvo, con respecto abundancia y diversidad microbiológica, lo cual se asocia, probablemente, a su composición química.
Los microorganismos de mayor importancia, encontrados, tanto en sustratos simples, como en sus mezclas, fueron para el caso de las bacterias, los géneros Pseudomonas y Bacillus; para actinomicetos, los pertenecientes al género Streptomyces y para los hongos, los géneros Aspergillus y Penicillium.
En general, las mezclas, presentaron mayor diversidad y abundancia de poblaciones microbiológicas, lo cual pone de manifiesto, la importancia de realizar mezclas, a partir de sustratos simples para obtener mejores resultados y optimizar, el uso de residuos orgánicos.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos, al Centro de Investigaciones de la Universidad del Tolima, a la Red Alma Mater y a la Universidad de Cundinamarca, por las facilidades y financiamiento otorgado para los estudios básicos, que dieron origen al presente artículo.
BIBLIOGRAFÍA
ACUÑA, O., PEÑA, W., SERRANO, E., POCASANGRE, L., ROSALES, F., DELGADO, E., TREJOS J. & SEGURA, A., 2006.- Importance of microorganisms for soils quality and health. Universidad de Costa Rica. pp. 56-59. [ Links ]
ADAMS, J. D. & FROSTICK, L. E., 2007.- Investigating microbial activities in compost using mushroom (agaricus bisporus) cultivation an experimental system. Bioresource technology, 99: 1097-1102. [ Links ]
ADEGUNLOYE, D. V., ADETUYI, F. C., AKINYOSOYE, F. A. & DOYENI, M. O., 2007.- Microbial Analysis of Compost Using Cowdung as Booster. Pakistan. Journal of Nutrition, 6 (5): 506-510. [ Links ]
AGUIRRE, E. & ULLOA, M., 1983.- Primer registro en México sobre la sucesión de hongos en el estiércol de vaca. Bol. Soc. Mex. Mic., 76-88. [ Links ]
ARBEIT, R. D., ARTHUR, M., DUNN, R., KIM, C., SELANDER, R. K. & GOLDSTEIN, R., 2000.- Resolution of recent evolutionary divergence among Escherichia coli from related lineages: The application of pulsed field electrophoresis to molecular epidemiology. J Infect Dis., 161: 230-235. [ Links ]
ARENAS, R., 2003.- Medical Micology. McGraw Hill. México. 397 p. [ Links ]
ATLAS, R. & BARTTHA, L., 2005.- Ecología microbiana y microbiología ambiental. Pearson Educación, S. A. Madrid. 677. [ Links ]
CALBRIX, R., BARRAY, S., CHABRERIE, O., FOURRIE, L. & LAVAL, K., 2007.- Impact of organic amendments on the dynamics of soil microbial biomass and bacterial communities in cultivated land. Appl. Soil Ecol., 35: 511-522. [ Links ]
CASAS, G., 1989.- Micología general. Ediciones de la Biblioteca. 488 p. [ Links ]
CASTRILLÓN, O., BEDOYA, O., MONTOYA, D. V., 2006.- Effect of pH on the growth of microorganisms during the maturation stage in static compost piles. Producción + Limpia, 1 (2): 8-12. [ Links ]
ESTRADA, M. E. & PERALTA, J. R., 2001.- Evaluación de dos tipos de fertilizantes orgánicos (gallinaza y estiércol vacuna) y un mineral en el crecimiento y rendimiento del cultivo de frijol común (Phaseolus vulgaris L.) variedad DOR-364, postrera: Tesis, Universidad Nacional Agraria, Facultad de Agronomía, Nicaragua. pp. 29-34. [ Links ]
FRANCO-CORREA, M., 1999.- Aislamiento, Caracterización y Evaluación de Actinomycetes inhibidores de algunos hongos fitopatógenos: Tesis, Maestría en Microbiología, Instituto de Biotecnología, Universidad Nacional de Colombia. 86 p. [ Links ]
GOLUEKE, C. G., 1977.- Biological reclamation of organic wastes. Rodale press, Emmaus, Pennsylvania, 249 p. [ Links ]
INSAM, H., RIDDECH, N. & KLAMMER, S., 2002.- Microbiology of composting. Springer second edition. pp. 9-108. [ Links ]
KONEMAN, E. W., 2001.- Diagnóstico Microbiológico: Texto y Atlas a Color. Quinta Edición. Médica Panamericana. Argentina. pp. 10-16. [ Links ]
LACEY, J., 1973.- Actinomycetes in soils, composts and fodders: 231-251 (in) SYKES, G., SKINNER, F. A. (eds.) Actinomycetales: Characteristics and Practical Importance. Academic Press, London. [ Links ]
MACFADDIN, J. F., 2000.- Biochemical tests for identification of medical bacteria. Lippincott. pp. 112-115. [ Links ]
MADIGAN, M., MARTINKO, J. M. & PARKER, J., 2000.- Brock Biology of microorganisms. Ninth edition. prentice hall. pp. 861-866. [ Links ]
MÁRQUEZ, M., MARTÍNEZ, M. & FRANCO, M., 2003.- Aislamiento de Trichoderma sp. y actinomycetes a partir de suelos de clavel (Dianthus caryophyllus) y evaluación de su capacidad antagónica in vitro sobre Fusarium oxysporum. Revista Agronomía Colombiana, XIX (1-2): 81-88. [ Links ]
MELÉNDEZ, G., 2003.- Indicadores químicos de calidad de abonos orgánicos: 50-63 (en) Abonos orgánicos: principios, características e impacto en la agricultura. Costa Rica. [ Links ]
MORENO, J., MORAL, R., 2008.- Compostaje. Ediciones Mundi-prensa. Madrid. pp. 78-85. [ Links ]
PÉREZ, A., CÉSPEDES, C. & NÚÑEZ, P., 2004.- Caracterización física-química y biológica de enmiendas orgánicas aplicadas en la producción de cultivos en República Dominicana. R.C. Suelo Nutr. Veg., 2: 10-29. [ Links ]
PETERS, S., KOSCHINSKY, S., SCHWIEGER, F. & TEBBE, C. C., 2000.- Succession of microbial communities during hot composting as detected by PCR-single-strand-conformation polymorphism-based genetic profiles of small-subunit rRNA genes. Applied and environmen. microbial, 66: 930-936. [ Links ]
PRESCOTT, L. M., 2002.- Microbiology. Editorial McGraw-Hill. Boston, USA. pp. 524-528. [ Links ]
REBOLLIDO, R., MARTÍNEZ, J., AGUILERA, Y., MELCHOR, K., KOERNER, R. & STEGMANN, R., 2008.- Microbial populations during composting process of organic fraction of municipal solid waste. Applied ecology and environmental research, 6 (3): 61-67. [ Links ]
RODRÍGUEZ, N., 1999.- Manejo de residuos en la agroindustria cafetera. Seminario internacional, gestión integral de residuos sólidos y peligrosos, siglo XXI. Cenicafé. pp. 44-45. [ Links ]
SALAZAR, E., LÓPEZ, J. D., ZÚÑIGA, R., VÁZQUEZ, C., FÓRTIZ, M. & SILVA, J., 2004.- Uso y aprovechamiento del estiércol como alternativa nutricional en invernadero. Bol. Soc. Mex., 44-48. [ Links ]
SYLVIA, D., FUHRMANN, J., HARTEL, P. & ZUBERER, D., 1999.- Principles and applications of soil microbiology. Prentice Hall. Nueva York. pp. 89-92. [ Links ]
TOKALA, K., STRAP, C. & JUNG, D., 2002.- Novel plant-microbe rhizosphere interaction involving Streptomyces lydicus WYEC108 and the pea plant (Pisum sativum). Applied and Environmental Microbiology, 68: 2161-2171. [ Links ]
VILLENA, G. & GUTIÉRREZ, M., 2003.- Biopeliculas de Aspergillus niger para la producción de celulasas: algunos aspectos estructurales y fisiológicos. Revista peruana de Biología, 2: 12. [ Links ]
YAÑEZ, P., LEVY, A. & AZERO, A., 2007.- Evaluación del compostaje de residuos de dos agroindustrias palmiteras del Trópico de Cochabamba en silos hiperventilados. Acta Nova, 3 (4): 20-24. [ Links ]













