Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.1 Manizales ene./jun. 2012
PROTOCOLS MONOGRAPH TO OBTAIN MONSEXUALTILAPIA NILÓTICA POPULATIONS (Oreochromis niloticus; TREW. 1983)
* FR: 10-II-2012. FA: 16-IV-2012.
1 Profesora del Departamento de Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia. E-mail: christine.hahn@ucaldas.edu.co
2 Profesor del Departamento de Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia. E-mail: alberto.grajales@ucaldas.edu.co
3 Estudiante de Medicina Veterinaria, Universidad de Caldas, Manizales, Colombia. E-mail: atanadir2@hotmail.com
El manejo de poblaciones monosexo de machos de tilapias es una solución para las dificultades productivas mostradas por esta especie gracias a su precocidad reproductiva y menores tasas de desarrollo de las hembras. Una población monosexo controla la reproducción indeseada y brinda mayor uniformidad a los lotes, repercutiendo en los ciclos productivos, ganancias superiores y mayor rentabilidad. Se recogen los diferentes protocolos en los campos investigativos y productivos, por los cuales es posible desarrollar poblaciones monosexo de machos de tilapia, como la androgénesis, ginogénesis y GMT, reversión sexual.
Palabras claves: androgénesis, Cichlidae, ginogénesis, GMT, reversión sexual.
AbstractThe management of male monosexual tilapia population is a solution to the production difficulties showed by this species due to its reproductive precociousness and low rates of female development. A monosexual population controls non-desired reproduction and provides higher levels of uniformity in each lot, having an impact on the productive cycles, higher profit and better profitability. Different protocols in the research and productive fields which allow monosexual tilapia male populations such as androgenesis, gynogenesis and GMT are gathered.
Key Words: androgenesis, Cichlidae, gynogenesis, GMT, sex reversion.
Las tilapias están ligados a regiones tropicales con temperaturas entre los 25ºC y 30ºC (HEPHER, 2005; INCODER, 2006; CCI, 2007), pueden resistir cambios de temperatura con bajos niveles de oxígeno, baja calidad del agua, considerados eurihalinas, producen carne de buena calidad (BEARDMORE et al., 2001), características que favorecen su distribución mundial y permite encontrarlos en más de 85 países (GUPTA & ACOSTA, 2004; PERÚ MINCETUR, 2004; ARBOLEDA-OBREGÓN, 2005; CHARO-KARISA et al., 2005; HURTADO, 2005). La madurez sexual de esta especie se encuentra influenciada por la edad, talla, factores ambientales y presencia o ausencia del sexo opuesto (FLÓREZ-MUÑOZ, 1994; POPMA & MASSER, 1999). Con la manipulación del fotoperíodo es posible regular la reproducción, contribuyendo con el control de la sobrepoblación de los sistemas dulceacuícolas (CAMPOS-MENDOZA et al., 2004; BISWAS et al., 2005). Según Peña-Mendoza et al. (2005), las tilapias presentan una madurez sexual entre los 3 y 6 meses con un promedio de 30 a 40 g. Una vez los huevos son fecundados pasan a cumplir con un proceso de cuidado hasta el nacimiento que varía para los géneros Tilapia, Oreochromis, Sarotherodon (SURESH, 2000; HEPHER, 2005; POPMA & MASSER, 1999; MACINTOSH & LITTLE apud MACINTOSH, 2008). La precocidad reproductiva de las tilapias trae como consecuencia bajos niveles de producción y rentabilidad (ARBOLEDA-OBREGON, 2005; GALE et al., 1999; HEPHER, 2005; MAIR et al., 1997b; MARJANI et al., 2009; MATEEN & AHMED, 2007; PHELPS et al., 1999; PHELPS & POPMA, 2000; SHEEHAN et al., 1999; SURESH, 2000). Las hembras en los estanques de producción aumenta la biomasa, disminuyendo la concentración ppm de oxígeno y espacio (PHELPS et al., 2000; PILLAY, 2004; BISWAS et al., 2005; HOMKLIN et al., 2009; CHAKRABORTY, 2010). La búsqueda de mejores rendimientos en el cultivo de peces comerciales se basa en resistencia a enfermedades, altas tasas de crecimiento, eficiente conversión alimenticia, resistencia a cambios en el medio ambiente (temperatura, salinidad, oxígeno), desarrollo de tecnologías como el manejo de poblaciones monosexo de peces (PANDIAN & SHEELA, 1995; MACLEAN, 1998; POPMA & MASSER, 1999; BEARDMORE et al., 2001; CHAKRABORTY & BANERJEE, 2009; CHAKRABORTY, 2010). Poblaciones monosexo de machos en tilapia muestran mejor rendimiento, uniformidad, conversión alimenticia al momento de la cosecha (MAIR et al., 1997b; MAIR et al., 1997a; TUAN et al., 1998; PHELPS et al., 1999; PHELPS et al., 2000; PHELPS & POPMA, 2000; HERRERA et al., 2001; DABROWSKI et al., 2004; DABROWSKI et al., 2005; LOGATO et al., 2004; MANOSROI et al., 2004; MACINTOSH, 2008; DRUMMOND et al., 2009; SURESH, 2000; MACLEAN, 1998; BEARDMORE et al., 2001; HEPHER, 2005).
Protocolos para la obtención de poblaciones monosexoSexaje manual: Separación de las hembras de los machos basados en su anatomía, observando sus papilas urogenitales (BAROILLER & JALABERT, 1989) la hembra presenta ano, oviducto y uretra en posición caudal a craneal mientras el macho presenta ano y uretra, posición caudal a craneal, para su visualización, se colorean con violeta de genciana, azul de metileno o colorante alimentario, se requiere que los alevinos estén en un peso promedio de 20 a 50 g. El grado de error de este protocolo es del 10% - 20%, dicho método es laborioso y poco preciso (POPMA & MASSER, 1999; LOGATO et al., 2004; PERÚ MINISTERIO DE LA PRODUCCIÓN, 2004; MAIR et al., 1997a; TUAN et al., 1998; BEARDMORE et al., 2001; PILLAY, 2004).
Hibridación: Obtenidos a partir del cruce de dos o más especies puras, genéticamente diferentes, para obtener progenies monosexo e incrementar vigor híbrido (BEARDMORE et al., 2001; BARTLEY et al., 2001; EZAZ, 2002; PERÚ MINISTERIO DE LA PRODUCCIÓN, 2004). Las tilapias, a partir del desarrollo de hibridación, han mostrado altos porcentajes de poblaciones sólo machos (Tabla 1). Según Beardmore et al. (2001), O. niloticus, considerada la especie de mejor característica para hibridación, las progenies resultantes indican un nivel de rendimiento menor que la especie original debido a la mezcla genética con otras especies, planteamiento contrario a lo propuesto por Pillay (2004) y Hepher (2005), quienes afirman que el uso de híbridos, con una descendencia monosexo (95%), brinda mejores características de adaptabilidad y producción. Las líneas genéticas empleadas en los protocolos de hibridación deben permanecer puras, de lo contrario los porcentajes de hembras en la progenie se incrementa (PHELPS & POPMA, 2000; LOGATO et al., 2004; LOVSHIN apud PILLAY, 2004).

Reversión Sexual: Técnica de manipulación genética no transgénica. El más común para la obtención de poblaciones monosexo en acuacultura (machos para tilapias), basado en productos hormonales (MAIR et al., 1997a; MACLEAN, 1998; PHELPS & POPMA, 2000; LÓPEZ et al., 2007; MATEEN & AHMED, 2007; MACINTOSH, 2008; DRUMMOND et al., 2009; MARJANI, et al., 2009), es el cambio generado en el fenotipo de la población de peces, conservando su genotipo original intacto (PHELPS & POPMA, 2000). Yamamoto (1951), APUD PHELPS & POMPA (2000), concluyeron que el uso de hormonas sexuales cambia las características sexuales secundarias de los peces y altera las gónadas. En la fase inicial de desarrollo tanto machos como hembras producen los mismos esteroides, la diferencia está en la capacidad de algunos de ellos por influir sobre la actividad celular, demarcando el desarrollo de la diferenciación sexual (ROWELL et al., 2002). Existen dos formas de definición sexual en peces, hermafroditas y gonocóricos, aspectos que hacen posible que el sexo sea manipulable por medio de hormonas (HURTADO, 2005). Las tilapias son gonocóricas indiferenciadas (sistema de determinación del sexo XX/XY), sus órganos sexuales durante los primeros días de vida no están determinados, independiente de su genotipo. Durante los días 5 y 6 pos eclosión se presenta una manifestación de genes (en ambas gónadas XX y XY) que influye sobre el paso de gónadas indiferenciadas a diferenciadas (IJIRI et al., 2008; LÓPEZ et al., 2007). Antes que el tejido gonadal de la hembra se diferencie en ovarios, el sexo de los animales no se ha determinado y es inestable, siendo susceptible a factores fisiológicos y ambientales (PHELPS & POPMA, 2000; DEVLIN & NAGAHAMA, 2002; HEPHER, 2005; LÓPEZ et al., 2007). El procedimiento de reversión sexual puede desarrollarse por inyección, inmersión o alimento (PANDIAN & SHEELA, 1995; MACLEAN, 1998; GALE et al., 1999).
Reversión por alimento hormonado: El mecanismo más efectivo y práctico es la administración de un andrógeno (generalmente 17a–metiltestosterona) en el alimento que se suministra a las larvas en sus primeros 20 a 30 días de vida, iniciando a partir del tercer día pos eclosión (BAROILLER & JALABERT, 1989; BEARDMORE et al., 2001; CONTRERAS-SÁNCHEZ et al., 2001d; TACHIBANA et al., 2004; MATEEN & AHMED, 2007; MACINTOSH, 2008; MARJANI et al., 2009; HOMKLIN et al., 2009). Los factores determinantes son: densidad, temperatura, presencia o ausencia de alimento vivo, dosis de hormona, tamaño, momento de inicio y duración (PHELPS & POPMA, 2000; MANOSROI et al., 2004; TACHIBANA et al., 2004; AGROCADENAS, 2005; HURTADO, 2005), uniformidad de la hormona en el alimento (ARSLAN & PHELPS, 2004; YASUI et al., 2007), y características genéticas de los individuos (TACHIBANA et al., 2004). Altas densidades en las poblaciones tratadas por el método de inmersión conllevan a una disminución en los porcentajes de reversión (FITZPATRICK et al., 1999). La duración del proceso se relaciona con la talla inicial, condiciones para su crecimiento (promedio ideal: 14 días de tratamiento, entre los 12 a 18 mm de talla), al iniciar el tratamiento hormonal o presencia del saco vitelino, es efectivo hasta los 18 a 20 mm (20 a 30 días de edad) de los animales (PHELPS & POPMA, 2000; HURTADO, 2005; BEARDMORE et al., 2001). Los rangos de temperatura adecuados están entre 28,5ºC y 31ºC; para mayor supervivencia y ganancia de peso (DRUMMOND et al., 2009), rangos menores a 24ºC afectan niveles de crecimiento, predisposición a enfermedades. Los animales revertidos sexualmente, por mecanismos hormonales, presentan mayor tasa de crecimiento que sin tratamiento, por sus efectos androgénicos y anabólicos (CHAKRABORTY, 2010; PANDIAN & SHEELA, 1995; RON et al., 1995; PHELPS & POPMA, 2000; MATEEN & AHMED, 2007; MACINTOSH, 2008; MARJANI et al., 2009). La acción androgénica de las hormonas implementadas para el proceso de reversión está determinada en la producción de tejido gonadal germinal y en la repoblación del tejido testicular por gonocitos (MANOSROI et al., 2004). No existe un valor de referencia estándar para la dosis de hormona necesaria en la producción de población monosexo de machos, está relacionada con las condiciones ambientales y tiempo de implementación (MATEEN & AHMED, 2007; PHELPS & POPMA, 2000) (Tabla 2.).
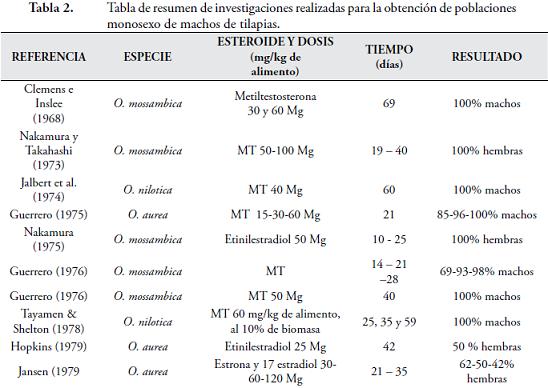

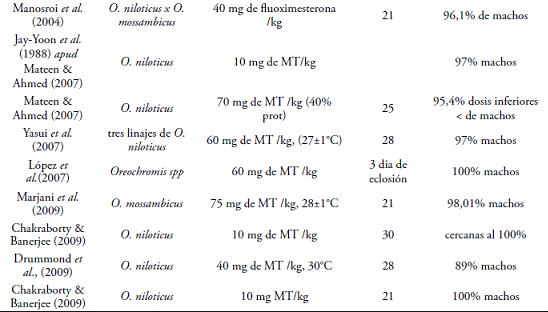
Altas dosis de MT, o tratamientos prolongados, pueden llevar a la presencia de porcentajes elevados de hembras en las poblaciones tratadas (PIFERRER et al., 1994 apud LI et al., 2006), lo que puede deberse al paso de andrógenos exógenos a estrógenos por el mecanismo de aromatización o por la inhibición de la biosíntesis de andrógenos endógenos en los machos genéticos (LI et al., 2006). (Tabla 3.)
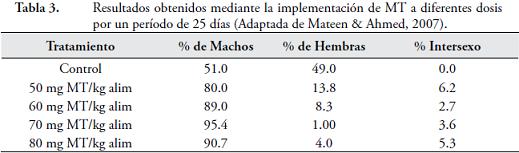
Al incrementar la dosis de fluocimesterona en el alimento, los porcentajes de machos en la progenie disminuyen y las tasas de intersexualidad incrementan (Tabla 4). La fluocimesterona, a diferencia de la MT, presenta eficiencia en cuanto a la reversión sexual de tilapias a dosis menores (MANOSROI et al., 2004).
La exposición de hembras genéticas a inhibidores de la aromatasa durante el período de diferenciación gonadal puede desencadenar el desarrollo de machos funcionales debido a la interrupción de la producción de los estrógenos endógenos a partir de las gónadas no diferenciadas de las hembras XX, necesarios para la formación de los caracteres fenotípicos propios de éstas (KOBAYASHI et al., 2003; DABROWSKI et al., 2005). Abad et al. (2007) utilizaron dosis de 100 mg de 17B-estradiol/kg de alimento disueltos en 0.8 L de etanol (95%), obtuvieron 77.1% de reversión sexual a hembras. Para obtener poblaciones de machos se han empleado aproximadamente 16 tipos de andrógenos (sintéticos y naturales) en unas 35 especies diferentes, el más implementado es la 17a–metiltestosterona (MT), diluyente en alcohol de alta pureza, utilizada en salmónidos, ciprínidos, cíclidos, entre otros (PANDIAN & SHEELA, 1995; PHELPS & POPMA, 2000; BEARDMORE et al., 2001; MACINTOSH, 2008). El alimento debe ser con buenos niveles de proteína (≥ 32-40%), molido y tamizado a 250 micras. La hormona en etanol se mezcla con el alimento, se seca a temperatura ambiente, sin rayos solares directos o en horno con temperatura promedio de 60ºC (POPMA & GREEN, 1990; DESPREZ et al., 2003b; LOGATO et al., 2004; HURTADO, 2005; HAHN et al., 2001; MATEEN & AHMED, 2007; LÓPEZ et al., 2007; PHELPS & POPMA, 2000). La preparación del alimento debe realizarse a una relación de 250 a 400 g por 1000 alevinos (PERÚ MINISTERIO DE LA PRODUCCIÓN, 2004; POPMA & GREEN, 1990). El alimento hormonado refrigerado a 4ºC garantiza la estabilidad de la hormona por tres meses; bajo condiciones de congelamiento (-20 a -40ºC) por 6 meses (BARRY et al., 2007); a temperatura ambiente de una semana (HURTADO, 2005; POPMA & GREEN, 1990). La hormona, por ser administrada en la etapa inicial del desarrollo de los peces, presenta eliminación rápida después de cesar el tratamiento, no acarrea problemas sobre la salud humana o el medio ambiente, siempre y cuando se implemente en las dosis recomendadas y en las primeras etapas de desarrollo de los peces (CONTRERAS-SÁNCHEZ et al., 2001c; MACINTOSH, 2008; JOHNSTONE et al., 1983; PIFERRER & DONALDSON, 1994; MANOSROI et al., 2004). Pero falta claridad en cuanto al proceso y tiempo de eliminación de los derivados de la biotransformación hormonal (CRAVEDI et al., 1993). Los residuos hormonales son biodegradables por microorganismos (bacterias y hongos) bajo condiciones aerobias (HOMKLIN et al., 2009) afectados por factores como temperatura y alta intensidad lumínica (PHELPS et al., 2000). POPMA & GREEN (1990) y PHELPS & POPMA (2000) plantearon que los alevinos deben ser alimentados durante 7 días de la semana a un 15%-20% de la biomasa. Para Shelton (APUD HURTADO, 2005) el alimento debe ser del 10% al 12% de la biomasa y DESPREZ et al. (2003a), sugiere el 30% de la biomasa la primera semana, 15% la segunda, 12% la tercera, y 10% las siguientes tres semanas. El margen de error permisible se ubica entre el 3% y el 5% de hembras (BEARDMORE et al., 2001).
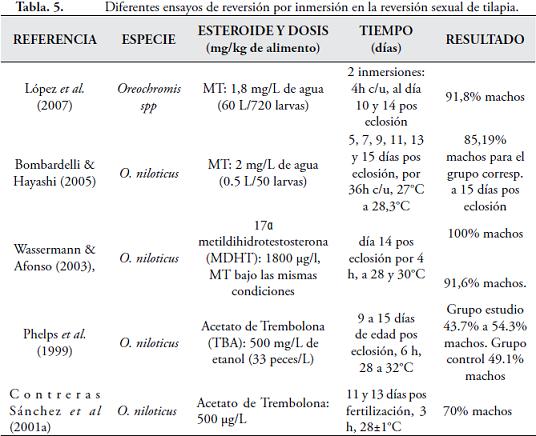
La Reversión por inmersión: en soluciones que contengan andrógenos, con reducción de riesgos para el operario y el medioambiente (CONTRERAS-SÁNCHEZ et al., 2001b), concentraciones hormonales bajas, menor presencia de residuos y menor tiempo de exposición de los peces a la hormona (LÓPEZ et al., 2007). (Tabla 5.) Temperatura y poblaciones monosexo. A pesar del efecto de la genética sobre la determinación del sexo de las tilapias (XX/XY), existen factores medioambientales, como la temperatura, en el que la acción coincide con el efecto de los factores hormonales, ya que inhiben el componente genético de la determinación sexual e invierten el sexo de la especie, generando fenotipos funcionales (ABUCAY et al., 1999; BARAS et al., 2001; TESSEMA et al., 2006; AZAZA et al., 2008; BAROILLER et al., 2009). La comprensión real del efecto de la temperatura sobre la determinación del sexo en las especies de tilapias, se ve obstaculizado por la falta de caracterización de los mecanismos de determinación de sexo de estas especies, estudios genéticos, fisiológicos o ecológicos, las tilapias presentan alta sensibilidad a la temperatura en el período de diferenciación sexual (BAROILLER et al., 1995; BEZAULT et al., 2007). Baroiller et al. (1995) lograron obtener 81% machos funcionales de O.niloticus a partir de poblaciones 100% hembras (XX) sometiendo los alevinos a temperaturas de 36ºC por 10 días a partir de los 13 días pos fertilización. Abucay et al. (1999), obtuvo de 100% hembras de O. niloticus, sometidas a altas temperaturas (36,54 ± 0,39ºC) por 21 días luego del primer alimento exógeno, 89,58% de machos (grupo control: 8,46%) a temperatura ambiente (27,87 ± 1,40ºC). Baras et al. (2001) sometieron alevinos de O. niloticus, a 37ºC durante 28 días posteriores a la primera alimentación exógena, obteniendo 91% de machos, cuestionan la viabilidad del proceso por la cercanía entre los niveles de temperatura necesarios para la masculinización de las poblaciones y los índices de temperatura letales (38,5–39ºC), no tan manifiesta en protocolos con temperaturas de 18ºC (AZAZA et al., 2008; TESSEMA et al., 2006). Altas temperaturas pueden masculinizar poblaciones de O. niloticus, O. mossambicus, O. aureus de manera eficaz iniciando el procedimiento del día 10 pos fertilización durante 10 días (TESSEMA et al., 2006; BAROILLER et al., 2009; BEZAULT et al., 2007; TSAI et al., 2007; AZAZA et al., 2008). Rangos de temperaturas de 18 a 19 ºC no afectan las tasas de sexo de las progenies (ABUCAY et al., 1999; BARAS et al., 2001; TESSEMA et al., 2006; AZAZA et al., 2008), pero rangos de temperatura inferiores a 17.5ºC desatan altas tasas de mortalidad. Al incrementarse los rangos de temperatura en los primeros 10-20 días de la tilapia, la aromatasa cerebral aumenta, pero los receptores a estrógenos no se afectan, factor que puede asociarse con un proceso cerebral de diferenciación sexual (masculinización) (TSAI et al., 2003). Azaza et al. (2008) obtuvieron 80% de machos a 36.83ºC, durante 20 días, iniciando al ser absorbido el saco vitelino, con tasas de supervivencia del 60%. La sensibilidad de la tilapia nilótica a la temperatura durante el período de diferenciación sexual no se manifiesta en toda la progenie, pero dicha sensibilidad (hembras genéticas a machos funcionales) puede ser heredable en un 90 a 93%, pudiendo ser seleccionado para este carácter (WESSELS & HÖRSTGEN-SCHWARK, 2007; TESSEMA et al., 2006; BAROILLER et al., 2009). Rougeot et al. (2008) obtuvieron 27,6% de machos a partir de poblaciones 100% hembras de O. mossambicus, con implementación de temperaturas entre los 34ºC–36ºC durante el período comprendido entre la incubación de los huevos y su eclosión (51 h). Los peces triploides, obtenidos en procedimientos basados en choques térmicos realizados a las ovas, previamente fertilizadas con esperma normal, con los cuales se genera retención del segundo cuerpo polar durante la división celular, el desarrollo gonadal es interrumpido o ausente (IHSSEN et al., 1990; GALBREATH & SAMPLES, 2000). Se ha determinado que en casos de triploidía se presenta un menor número de células en órganos y tejidos aunque de tamaño mayor (proporcional al incremento de ADN en su núcleo) a las de los diploides, esta relación celular demarca que no hay diferencias en cuanto a la talla de un pez triploide y uno diploide, pero el mecanismo responsable de la reducción del número celular en los peces triploides es desconocido (BENFEY, 1999; INSTITUTO DE ACUICULTURA DE STIRLING, 2007), pueden presentar mayor susceptibilidad a afecciones virales o bacterianas, en relación a los diploides, quizás debido a falencias en las células de defensa (menor número) o por el estrés (BENFEY, 1999). Introducir en la producción de peces ejemplares triploides estériles puede ser un mecanismo viable y útil para inhibir la reproducción precoz (FELIP et al., 2001b; INSTITUTO DE ACUICULTURA DE STIRLING, 2007). Según Sheehan et al. (1999) la triploidía en los peces disminuye considerablemente el desarrollo gonadal sin generar efectos adversos sobre la calidad de la carne, presentando mayor desarrollo somático. Dicha alteración en el desarrollo gonadal, según Benfey (1999), se da tempranamente en la gametogénesis en fase de meiosis. Una de las técnicas empleadas para la inducción de la triploidía consiste en la aplicación de un shock frío, caliente o de presión, suprimiendo la segunda meiosis, teniendo en cuenta el grado de desarrollo de los oocitos, la talla de los huevos, tiempo pos-fertilización cuando se inicia el shock (en minutos o intervalos de mitosis), la intensidad y duración del shock (Tº) (GALBREATH & SAMPLES, 2000), además encontraron que el incremento de la temperatura y el tiempo de duración del shock térmico reducen el porcentaje de supervivencia e incrementa los porcentajes de triploidía; al incrementar el tiempo de inicio del shock térmico (de 10 minutos pos fertilización a 22 minutos) el porcentaje de supervivencia incrementaba y el de triploidía disminuía.
Androgénesis: Sólo se hereda el genoma paterno. Se requiere varios procedimientos: Inactivar o eliminar el genoma de los huevos, activar el inicio del desarrollo embrionario mediante los espermatozoides y restaurar la diploidía, inhibiendo la primera división mitótica (PANDIAN & KOTEESWARAN, 1998; SHELTON, 2000; KIRANKUMAR & PANDIAN, 2003; KOMEN & THORGAARD, 2007). A partir de la androgénesis es posible el desarrollo de: supermachos (YY) viables de especies de machos heterogaméticos, líneas isogénicas (líneas consanguíneas isogénicas) y conservación de germoplasma (PANDIAN & KOTEESWARAN, 1998). La naturaleza genética de los espermatozoides, la calidad de los huevos y el adecuado manejo del proceso de irradiación UV, el método inductor empleado para la diploidización son factores importantes en la inducción satisfactoria de androgénesis y su rendimiento (BONGERS et al., 1994; PANDIAN & KOTEESWARAN, 1998). La androgénesis se ha trabajado en especies como Oncorhynchus mykiss (SCHEERER et al., 1986; THORGAARD et al., 1990), Ctenopharyngodon idella (STANLEY & JONES, 1976); y O. nilóticus x O. Aureus (MYERS et al., 1995). Para llevar a cabo la inhibición del genoma materno es necesaria la implementación de irradiación con rayos Gamma, UV o X sobre las ovas. Los rayos Gamma y X desencadenan daños como la desnaturalización de las proteínas, así la tendencia son rayos UV para asegurar una mayor viabilidad (PANDIAN & KOTEESWARAN, 1998; SHELTON, 2000). Los huevos infértiles son cubiertos con agua y se agitan al tiempo que son irradiados con luz UV, buscando inactivar el genoma nuclear materno (EZAZ et al., 2004). Inadecuados procesos de irradiación y/o la misma anatomofisiología de las ovas conllevan a fallas en la inactivación del genoma materno, obteniéndose progenies contaminadas con el ADN materno (MYERS et al. apud PANDIAN & KOTEESWARAN, 1998; KIRANKUMAR & PANDIAN, 2003). Bongers et al. (1994), empleando irradiación UV sobre huevos de Cyprinus carpio sumergidos en fluido ovárico sintético a razón de 250 mJ/cm², reportaron 100% de inactivación del genoma materno. La implementación de un shock (calor, presión o frío) reestablece la diploidía de huevos sometidos a radiación UV para inhibir el genoma materno y posteriormente son activados con semen normal, la confirmación del genoma paterno se puede realizar mediante la determinación de marcadores genotípicos como el color, la expresión del gen PFG, cariotipificación o test de progenie, en peces donde los machos son heterogaméticos (XY) el desarrollo de androgénesis favorece el desarrollo de grupos de supermachos (YY), base para el desarrollo de stocks comerciales de solo machos (PANDIAN & KOTEESWARAN, 1998; EZAZ et al., 2004; SHELTON, 2000; KIRANKUMAR & PANDIAN, 2003).
Ginogénesis: inducción sólo de la herencia del material genético materno en la descendencia. Para la obtención de poblaciones ginogenéticas viables es necesario producir peces ginogenéticos haploides mediante la eliminación de los cromosomas paternos sin alterar su supervivencia y motilidad (TVEDT et al., 2006; KOMEN & THORGAARD, 2007; JOHNSTONE & STET, 1995; PANDIAN & KOTEESWARAN, 1998; CAL et al., 2006). Se encuentra la restauración de la diploidía mediante la implementación de un shock, de presión o térmico, para duplicar los cromosomas maternos de los huevos al retener el segundo cuerpo polar (ginogénesis meiótica) o suprimir la primera división mitótica del cigoto (ginogénesis mitótica) (PANDIAN & KOTEESWARAN, 1998; LUCKENBACH et al., 2004; IHSSEN et al., apud TVEDT et al., 2006; LIN & DABROWSKI, 1996). Sarder et al. (1999) plantean que tras la implementación de semen irradiado y la manipulación de la primera división mitótica mediante choque de calor (41 a 42ºC durante 4 min), 27 a 29 min después de fertilización, es posible conseguir tilapias nilóticas ginogenéticas completamente homocigóticas. Por su parte, CAMPOS-RAMOS et al. (2003) con O. mossambicus, lograron producir ginogénesis al fertilizar ovas normales con semen irradiado, las cuales luego de 4,5 minutos pos-fertilización fueron sometidas a 39ºC durante tres minutos, obteniendo machos ginogenéticos desde hembras XX. En algunas ocasiones se ha evidenciado el desarrollo del síndrome de haploidía en la descendencia de peces teleósteos (sometidos a procesos de irradiación) (ARIAS-RODRÍGUEZ et al., 2004; PIFERRER et al., 2004; apud TVEDT et al., 2006), exceptuando la O. niloticus, los peces haploides mueren quizá a causa de la falta de parejas cromosómicas normales o manifestación de genes dañinos recesivos (TVEDT et al., 2006). La inactivación del genoma paterno por irradiación del DNA del núcleo consiste en inhibir el genoma paterno conservando su efectividad en cuanto a las tasas de fertilidad (JOHNSTONE & STET, 1995; PANDIAN & KOTEESWARAN, 1998; KOMEN & THORGAARD, 2007). Para una destrucción efectiva del DNA paterno mediante irradiación, debe tenerse en cuenta la intensidad de irradiación, tiempo de exposición, concentración de los espermatozoides (TVEDT et al., 2006; ARIAS-RODRÍGUEZ et al., 2004). Algunos autores reconocen los rayos gamma como los más efectivos por su homogeneidad, lo que favorece que la cantidad de espermatozoides a la cual se fracciona el DNA sea mayor, disminuyendo los riesgos de contaminación (THORGAARD et al. APUD KOMEN & THORGAARD, 2007). La irradiación UV presenta condiciones de manejo más simples y el rendimiento de los animales es superior, es necesario manipular la emisión de los rayos UV, su intensidad y tiempo. Al emplear rayos UV a 254 nm, es posible manipular muestras de 10 ml (PALTI, et al. apud KOMEN & THORGAARD, 2007; FOISIL & CLOUROS apud KOMEN & THORGAARD, 2007; KOMEN & THORGAARD, 2007). Según Johnstone & Stet (1995) el procedimiento para la irradiación del semen consiste en diluirlo, refrigerarlo y agitarlo constantemente. A dosis inferiores a 720 J/m² durante 2 min el material genético no es completamente destruido acarreando bajos niveles de supervivencia y malformación embrionaria, y tiempos superiores a 8 minutos reduce la habilidad de inseminación del esperma (LIN & DABROWSKI, 1996; ARIAS-RODRÍGUEZ et al., 2004). Los mayores porcentajes de fertilización se obtienen cuando se aplica presión a los huevos por 15 min pos activación (TVEDT et al., 2006). Los espermatozoides donantes, para desarrollar el procedimiento de activación de los huevos, pueden ser homólogos o heterólogos, siendo el semen de Cyprinus carpio el más empleado (PANDIAN & KOTEESWARAN, 1998). Para la duplicación del genoma materno, según ohm (apud IHSSEN et al., 1990), la primera división meiótica en huevos maduros es llevada a cabo antes del proceso de fertilización, la segunda división meiótica se completa posterior a la ovulación, y la fertilización puede ser inhibida al aplicar shock térmico sobre los huevos; base de la búsqueda de peces triploides, diploides y desarrollo de ginogénesis en laboratorio (IHSSEN et al., 1990; KOMEN & THORGAARD, 2007; CHOURROUT et al. apud PANDIAN & KOTEESWARAN, 1998). La ginogénesis meiótica produce ginogenéticos heterocigóticos, mientras que la ginogénesis mitótica ginogenéticos homocigóticos (PANDIAN & KOTEESWARAN, 1998). Una desventaja de la producción ginogenética es la ausencia de pureza genética, para establecer líneas de peces isogenéticos y homocigóticos, para la regulación genética del desarrollo y construcción de mapas genéticos, incrementar la producción de especies y la identificación de determinación del sexo (PANDIAN & KOTEESWARAN, 1998; SARDER et al., 1999; LUCKENBACH et al., 2004; CAL et al., 2006; TVEDT et al., 2006; CAL et al., 2006; TVEDT et al., 2006). Factores ambientales y densidad poblacional, pueden alterar las tasas de sexo obtenidas en ginogénesis (PANDIAN & KOTEESWARAN, 1998). El protocolo para producir ginogenéticos diploides es la dilución del semen en plasma seminal a proporciones de 1:80, inactivación de espermatozoides utilizando rayos UV a razón de 65 mJ/cm², implementación de tratamiento a presión para los huevos por 5 min a 8500 psi iniciando 15 min pos activación de los huevos a una temperatura de 5 a 6ºC. (TVEDT et al., 2006). La temperatura óptima para la duplicación del genoma depende de cada especie (KOMEN & THORGAARD, 2007). Para Cal et al. (2006), el choque de frío es aplicado cerca de los 0ºC para especies de aguas frías y temperaturas entre 8 y 11ºC para especies de aguas cálidas como la Tilapia sp y Cyprinus carpio (IHSSEN et al., 1990). El choque de presión (562 kg/cm² por unos cuantos minutos) arroja resultados más contundentes que el choque de temperatura para la obtención de descendencias ginogenéticas meióticas dip loides y triploides, un valor agregado es la esterilidad en los peces triploides (IHSSEN et al., 1990). La ginogénesis y la androgénesis favorece la obtención de individuos homocigóticos en la primera generación y líneas clonales puras en la segunda, por tanto, se disminuye el número de generaciones necesarias para obtener una línea pura y favorece la obtención de líneas homocigóticas diferenciándose con la hibridación tradicional. Las líneas clonales pueden ser conseguidas a partir de hembras homocigóticas sometidas a un proceso de ginogénesis o de machos homocigóticos sometidos a androgénesis (SARDER et al., 1999). Karayücel et al. (2004) produjeron líneas clonales de O. niloticus a partir de la ginogénesis en hembras encontrando presencia de machos en sus resultados lo cual fue asociado a influencia de locus durante el procedimiento.
Tilapias Genéticamente Machos (GMT) y/o Supermachos. En 1958 Yamamoto (APUD HERRERA, 2001) planteó el desarrollo de machos YY en peces, trabajando con Oryzias latipes mediante la implementación de la reversión sexual hormonal y la clasificación de las progenies. BAROILLER & JALABERT (1989) plantearon la obtención de stocks sólo machos de tilapia sin necesidad de realizar tratamiento hormonal directo, proceso replanteado por Mair et al. (1997b) y Toguyeni et al. (2002). Mair et al. (1997b) propuso obtener poblaciones GMT así: crear un grupo de tilapias monosexo de hembras mediante reversión sexual empleando estrógenos, de los cuales 50% son hembras fenotípicamente, pero con genotipo masculino (XY), una vez identificadas se cruzan con machos normales (XY), obteniendose 25% hembras (XX), 50% machos (XY) y 25% machos (YY). A esta descendencia con el test de progenie se separan los machos con doble cromosoma Y (YY), éstos se deben cruzar con hembras masculinizadas (XY). De este apareamiento resultará una descendencia 100% machos (50% XY y 50% YY), descendencia que se somete a reversión sexual hormonal empleando estrógenos para obtener una población monosexo de hembras con genotipo masculino (XY, YY), se aplica el test de progenie para separar las hembras (YY) que serán reproducidas con los machos YY obtenidos en el primer cruce, para conseguir un stock 100% machos (YY), que al ser cruzado con una hembra normal (XX) dará una descendencia 100% machos (XY) conocidos como tilapias genéticamente machos (GMT). Según TOGUYENI et al. (2002), MAIR et al. (1997b), PERSCHBACHER (2007) y HERRERA et al. (2001) el rendimiento de las poblaciones monosexo de machos XY es superior al presentado por poblaciones YY. El conteo espermático de machos androgenéticos (YY) es superior a los de machos normales (XY) (KIRANKUMAR & PANDIAN, 2003). HERRERA et al. (2001) y MAIR et al. (1997a) concluyeron que los machos XY que poseen un cromosoma Y, presentan mayores rendimientos que las hembras XX que no poseen cromosoma Y en su genotipo. Esta tecnología de machos YY tiene gran potencial para el mejoramiento de producción y su aplicación en los sistemas de cultivo de tilapia.
ABAD, Z.; GONZÁLEZ, R.; MENDOZA, I.; OLIVA, A.; PIMENTEL, E.; PIMENTEL, R.; MARTÍNEZ, R.; ESTRADA, M.P.; RAMÍREZ, Y. & ARENAL, A. 2007.- Production of a high percentage of male offspring in growthenhanced transgenic tilapia using Oreochromis aureus selected pseudofemales. Journal Aquaculture, 270: 541-545. [ Links ] [ Links ]
AGROCADENAS. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. 2005.- La cadena de la piscicultura en Colombia, una mirada global de su estructura y dinámica 1991-2005. Documento de trabajo Nº 106. Bogotá D.C., Colombia. [ Links ] [ Links ]
ARIAS-RODRÍGUEZ, L.; RODRÍGUEZ-IBARRA, L.E. & DEL VALLE- PIGNATARO, G. 2004.- Efecto de la radiación UV en la inactivación genética del esperma de Botete diana Sphoeroides annulatus (Jenyns, 1842). Journal Ciencias marinas, 30 (003): 391-402. [ Links ] [ Links ]
BARAS, E.; JACOBS, B. & MELARD, C. 2001.- Effect of water temperature on survival, growth and phenotypic sex of mixed (XX-XY) progenies of Nile tilapia Oreochromis niloticus. Journal Aquaculture, 192: 187-199. [ Links ] [ Links ]
BAROILLER, J.F.; CHOURROUT, D.; FOSTIER, A. & JALABERT, B. 1995.-Temperature and sex chromosomes govern sex ratios of the mouthbrooding Cichlid fish Oreochromis niloticus. Journal of Experimental Zoology, 273 (3): 216-223. [ Links ] [ Links ]
BARRY, T.P.; MARWAH, A. & MARWAH, P. 2007.- Stability of 17a methyltestosterone in fish feed. Journal Aquaculture, 271: 523-529. [ Links ] [ Links ]
BEARDMORE, J.A.; MAIR, G.C. & LEWIS, R.I. 2001.- Monosex male production in finfish as exemplified by tilapia: applications, problems, and prospects. Journal Aquaculture, 197: 283-301. [ Links ] [ Links ]
BEZAULT, E.; CLOTA, F.; DERIVAZ, M.; CHEVASSUS, B. & BAROILLER, J.F. 2007.- Sex determination and temperature-induced sex differentiation in three natural populations of Nile tilapia (Oreochromis niloticus) adapted to extreme temperature conditions. Journal Aquaculture, 272 (1):3-16. [ Links ] [ Links ]
BOMBARDELLI, R.A. & HAYASHI, C. 2005.- Masculinização de larvas de tilápia do Nilo (Oreochromis niloticus L.) a partir de banhos de imersão com 17 a-metiltestosterona. R. Bras. Zootec., 34 (2): 365-372. [ Links ] [ Links ]
CAL, R.M.; VIDAL, S.; MARTÍNEZ, P.; ÁLVAREZ-BLÁZQUEZ, B.; GÓMEZ, C.; & PIFERRER, F. 2006.- Growth and gonadal development of gynogenetic diploid Scophthalmus maximus. Journal of Fish Biology, 68: 401-413. [ Links ] [ Links ]
CAMPOS-RAMOS, R.; HARVEY, S.C.; McANDREW, B.J. & PENMAN D.J. 2003.-An investigation of sex determination in the Mozambique tilapia, Oreochromis mossambicus, using synaptonemal complex analysis, FISH, sex reversal and gynogenesis. Journal Aquaculture, 221: 125-140. [ Links ] [ Links ]
CHAKRABORTY, S.B. & BANERJEE, S. 2009.- Culture of monosex nile tilapia under different traditional and non-traditional methods in India. World Journal of Fish and Marine Sciences, 1 (3): 212-217. [ Links ] [ Links ]
CONTRERAS-SÁNCHEZ, W.M.; FITZPATRICK, M.S. & SCHRECK, C.B. 2001a..- Masculinization of tilapia by immersion in trenbolone acetate: growth performance of trenbolone acetate-immersed tilapia. In: A. Gupta, K. McElwee, D. Burke, J. Burright, X. Cummings, and H. Egna (Editors), Eighteenth Annual Technical Report. Pond Dynamics/Aquaculture CRSP, Oregon State University, 43-46. [ Links ] [ Links ]
CONTRERAS-SÁNCHEZ, W.M.; FITZPATRICK, M.S. & SCHRECK, C.B. 2001d.-Fate of methyltestosterone in the pond environment: impact of MT-contaminated soil on tilapia sex differentiation. In: A. Gupta, K. McElwee, D. Burke, J. Burright, X. Cummings, and H. Egna (Editors), Eighteenth Annual Technical Report. Pond Dynamics/Aquaculture CRSP, Oregon State University, 83-86. [ Links ] [ Links ]
CORPORACIÓN COLOMBIA INTERNACIONAL (CCI). 2007.- Sembramos a Colombia para el mundo. Cartilla sistemas agropecuarios. Encuesta nacional agropecuaria. [ Links ] [ Links ]
DABROWSKI, K.; RODRÍGUEZ, G.; ABIADO, M.A.; CONTRERAS-SÁNCHEZ, W. & CONTRERAS-GARCA, M. 2005.- Use of phytochemicals as an environmentally friendly method to sex reverse nile tilapia. In: Burright, J; Flemming, C. and Egna, H. (Editors), Twenty-Second Annual Technical Report. Aquaculture CRSP, Oregon State University, 287-303. [ Links ] [ Links ]
DESPREZ, D.; GÉRAZ, E.; HOAREAU, M.C.; MÉLARD, C.; BOSC, P. & BAROILLER, J.F. 2003a.- Production of a high percentage of male offspring with a natural androgen, 11B-hydroxyandrostenedione (11BOHA4), in Florida red tilapia. Journal Aquaculture, 216: 55-65. [ Links ] [ Links ]
DEVLIN, R.H. & NAGAHAMA, Y. 2002.- Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences. Journal Aquaculture, 208: 191-364. [ Links ] [ Links ]
EZAZ, M.T. 2002.- Analysis of sex determination in nile tilapia (Oreochromis niloticus L.): A molecular genetics approach: Thesis, University of Stirling, Stirling, Scotland, UK. [ Links ] [ Links ]
FELIP, A.; PIFERRER, F.; CARRILLO, M. & ZANUY, S. 2001a.- Comparison of the gonadal development and plasma levels of sex steroid hormones in diploid and triploid sea bass, Dicentrarchus labrax L. Journal of Experimental Zoology, 290: 384-395. [ Links ] [ Links ]
FITZPATRICK, M.S.; CONTRERAS-SÁNCHEZ, W.M.; MILSTON, R.H.; HORNICK, FEIST, R.W. & SCHRECK, C.B. 1999.- Effect of fish density on efficacy of masculinization by immersion in MDHT. In: K. McElwee, D. Burke, M. Niles, and H. Egna (Editors), Sixteenth Annual Technical Report. Pond Dynamics Aquaculture CRSP, Oregon State University, pp. 75-77. [ Links ] [ Links ]
GALBREATH, P.F. & SAMPLES, B.L. 2000.- Optimization of thermal shock protocols for induction of triploidy in brook trout. North American journal of aquaculture, 62: 249-259. [ Links ] [ Links ]
GUPTA, M.V. & ACOSTA, B.O. 2004.- A review of global tilapia farming practices. Journal Aquaculture Asia, 9 (1): 7-12. [ Links ] [ Links ]
HEPHER, B. 2005.- Cultivo de peces comerciales. Mexico, D.F.: Editorial Limusa S.A, pp. 63-94. [ Links ] [ Links ]
HOMKLIN, S.; WATTANODORN, T.; KEE-ONG, S. & LIMPIYAKORN, T. 2009.- Biodegradation of 17a-methyltestosterone and isolation of MT-degrading bacterium from sediment of Nile tilapia masculinization pond. Journal Water Science & Technology, 59 (2). [ Links ] [ Links ].
IHSSEN, P.E.; McKAY, L.R.; McMILLAN, I. & PHILLIPS, R.B. 1990.- Ploidy manipulation and gynogenesis in fishes: Cytogenetic and fisheries applications. American Fisheries Society, 119: 698-717. [ Links ]
IJIRI, S.; KANEKO, H.; KOBAYASHI, T.; WANG, D.S.; SAKAI, F.; PAUL- PRASANTH, B.; NAKAMURA, M. & NAGAHAMA, Y. 2008.- Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish, the nile tilapia Oreochromis niloticus. Journal Biology of Reproduction, 78 (2): 333-341. [ Links ] [ Links ]
INSTITUTO DE ACUACULTURA DE STIRLING. 2007.- Producción de Tilapia. Panorama acuícola magazine. Mayo-Junio. Desde http://www.panoramaacuicola.com [ Links ] R. & STET, R.J.M. 1995.- The production of gynogenetic Atlantic salmon, Salmo salar L. Journal Theor. Appl. Genet., 90: 819-826. [ Links ]
JOHNSTONE, R.; MACINTOSH, D.J. & WRIGHT, R.S. 1983.- Elimination of orally administered 17a-methyltestosterone by Oreochromis mossambicus (Tilapia) and Salmogairdneri (Rainbow trout) juveniles. Journal Aquaculture, 35: 249-257. [ Links ] [ Links ]
KOBAYASHI, T.; KAJIURA-KOBAYASHI, H. & NAGAHAMA, Y. 2003.- Induction of XY sex reversal by estrogen involves altered gene expression in a teleost, tilapia. Journal Cytogenetic and Genome Research, 101: 89-294. [ Links ] [ Links ]
LI, G.L.; LIU, X.C. & LIN, H.R. 2006.- Effects of aromatizable and nonaromatizable androgens on the sex inversion of red-spotted grouper (Epinephelus akaara). Journal Fish Physiology and Biochemistry, 32: 25-33. [ Links ] [ Links ]
LOGATO, P.V.R.; MURGAS, L.D.S. & DE SOUZA, F.O. 2004.- Estudio del efecto de la relación macho hembra en la puesta natural y dosis de 17-?-metiltestosterona en la reversión sexual de tilapia-del-nilo (Oreochromis niloticus) linaje tailandés. Journalan. Vet. (murcia), 20: 95-103. [ Links ] [ Links ]
LUCKENBACH, J.A.; GODWIN, J.; DANIELS, H.V.; BEASLEY, J.M.; SULLIVAN, C.V. & BORSKI, R.J. 2004.- Induction of diploid gynogenesis in southern flounder (Paralichthys lethostigma) with homologous and heterologous sperm. Journal Aquaculture, 37: 499-516. [ Links ] [ Links ]
MACINTOSH, D.J.; VARGHESE, T.J. & RAO-SATYANARAYANA, G.P. 1985.- Hormonal sex reversal of wildspawned tilapia in India. Journal of Fish Biology, 26(2): 87-94. [ Links ] [ Links ]
MAINARDES-PINTO, C.S.R.; FENERICH-VERANI, N.; DE CAMPOS, B.E.S. E LIVRAMENTO-DA SILVA, A. 2000.- Masculinização da tilápia do nilo, Oreochromis niloticus, utilizando diferentes rações e diferentes doses de 17 a-metiltestosterona. Rev. Bras. Zootec., 29 (3): 654-659. [ Links ] [ Links ]
MAIR, G.C.; DAHILIG, L.R.; MORALES, E.J.; BEARDMORE, J.A. & SKIBINSKI, D.O.F. 1997. Application of genetic techniques for the production of monosex male tilapia in aquaculture: Early experiences from the Philippines. Proceedings of the Fourth Central America Symposium on Aquaculture, Tegucigalpa, Honduras, April 22-24, 225-227. [ Links ] [ Links ]
MARJANI, M.; JAMILI, S.; MOSTAFAVI, P.G.; RAMIN, M. & MASHINCHIAN, A. 2009.- Influence of 17-alpha methyl testosterone on masculinization and growth in tilapia (Oreochromis mossambicus). Journal of fisheries and aquatic science, 4 (1): 71-74. [ Links ] [ Links ]
MYERS, J.M.; PENMAN, D.J.; RANA, J.K.; BROMAGE, N.; POWELL, S.F. & MCANDREW, B.J. 1995.- Applications of induced androgenesis with tilapia. Journal Aquaculture, 137: 150. [ Links ] [ Links ]
NGUYEN, H.N.; KHAW, H.L.; PONZONI, R.W.; HAMZAH, A. & KAMARUZZAMAN, N. 2007.- Can sexual dimorphism and body shape be altered in Nile tilapia (Oreochromis niloticus) by genetic means?. Journal Aquaculture, 272: 38-46. [ Links ] [ Links ]
PANDIAN, T.J. & KOTEESWARAN, R. 1998.- Ploidy induction and sex control in fish. Journal Hydrobiologia, 384: 167-243. [ Links ] [ Links ]
PEÑA-MENDOZA, B.; J.L. GÓMEZ-MÁRQUEZ, I.H.; SALGADO-UGARTE & D. RAMÍREZ-NOGUERA. 2005.- Reproductive biology of Oreochromis niloticus (Perciformes: Cichlidae) at Emiliano Zapata dam, Morelos, Mexico. Rev. Biol. Trop., 53 (3-4): 515-522. [ Links ] [ Links ]
PERÚ. MINISTERIO DE COMERCIO EXTERIOR Y TURISMO DEL PERÚ - MINCETUR. 2004.- Perfil de mercado y competitividad exportadora de la tilapia. 2004. Desde http://www.mincetur.gob.pe/comercio/otros/penx/pdfs/Tilapia.pdf [ Links ] R.P. & POPMA, T.J. 2000.- Sex reversal of tilapia. In: Costa-Pierce, B.A. & Rakocy, J.E. (Editors). Tilapia Aquaculture in the Americas. The World Aquaculture Society, 2: 34-59. [ Links ]
PHELPS, R.P.; ARNDT, J.T. & WARRINGTON, R.L. 1999.- Masculinization of tilapia fry by immersion in trenbolone acetate (TBA) at a production level. In: K. McElwee, D. Burke, M. Niles, and H. Egna (Editors), Sixteenth Annual Technical Report. Pond Dynamics/Aquaculture CRSP, Oregon State University., pp.79-80. [ Links ] [ Links ]
PIFERRER, F. & DONALDSON, E.M. 1994.- Uptake and clearance of exogenous estradiol-17-beta and testosterone during the early development of coho salmon Oncorhynchus kisutch, including eggs, alevins and fry. Journal Fish Physiol Biochem, 13(3): 219-232. [ Links ] [ Links ]
POPMA, T.J. & GREEN, B.W. 1990.- Aquaculture production manual: sex reversal of tilapia in earthen ponds. Research and Development Series No. 35. International Center for Aquaculture, Alabama Agricultural Experiment Station, Auburn University, AL, USA. [ Links ] [ Links ]
RON, B.; SHIMODA, S.K.; IWAMA, G.K. & GRAU, E.G. 1995.- Relationships among ration, salinity, 17a-methyltestosterone and growth in the euryhaline tilapia, Oreochromis mossambicus. Journal Aquaculture, 135: 185-193. [ Links ] [ Links ]
ROWELL, C.B.; WATTS, S.A.; WIBBELS, T.; HINES, G.A. MAIR, G. 2002.- Androgen and estrogen metabolism during sex differentiation in mono-sex populations of the nile Tilapia, Oreochromis niloticus. Journal General and Comparative Endocrinolog, 12: 151-162. [ Links ] [ Links ]
SCHEERER, P.D.; THORGAARD, G.H.; ALLENDORF, F.W. & KNUDSEN, K.L. 1986.- Androgenetic rainbow trout produced from inbred and outbred sperm sources show similar survival. Journal Aquaculture, 57: 289-298. [ Links ] [ Links ]
SHELTON, W.L. 2000.- Methods for androgenesis techniques applicable to tilapia. In: K. McElwee, D. Burke, M. Niles, X. Cummings, and H. Egna (Editors), Seventeenth Annual Technical Report. Pond Dynamics/Aquaculture CRSP, Oregon State University, pp. 51-55. [ Links ] [ Links ]
SURESH, V. 2000.- Últimos avances en el manejo de reproductores de tilapia. Revista acuatic, 10. [ Links ] [ Links ]
TAYAMEN, M.M. & SHELTON, W.L. 1978.- Inducement of sex reversal in Sarotherodon niloticus (Linnaeus). Journal Aquaculture, 14 (4): 349-354. [ Links ] [ Links ]
THORGAARD, G.H.; SCHEERER, P.D.; HERSHBERGER, W.K. & MYERS, J.M. 1990.- Androgenetic rainbow trout produced using sperm from tetraploid males show improved survival. Journal Aquaculture, 85: 215-221. [ Links ] [ Links ]
TSAI, C.L.; CHANG, S.L.; WANG, L.H. & CHAO, T.Y. 2003.- Temperature influences the ontogenetic expression of aromatase and oestrogen receptor mRNA in the developing tilapia (Oreochromis mossambicus) brain. Journal of Neuroendocrinology, 15: 97-102. [ Links ] [ Links ]
TSAI, C.L.; WANG, L.H.; SHIUE, Y.L. & CHAO, T.Y. 2007.- Influence of temperature on the ontogenetic expression of neural development-related genes from developing tilapia brain expressed sequence tags. Journal Marine Biotechnology, 9: 243-261. [ Links ] [ Links ]
TVEDT, H.B.; BENFEY, T.J.; MARTIN-ROBICHAUD, D.J.; McGOWAN, C. & REITH, M. 2006.- Gynogenesis and sex determination in Atlantic Halibut (Hippoglossushippoglossus). Journal Aquaculture, 252: 573-583. [ Links ] [ Links ]
WESSELS, S. & HÖRSTGEN-SCHWARK, G. 2007.- Selection experiments to increase the proportion of males in Nile tilapia (Oreochromis niloticus) by means of temperature treatment. Journal Aquaculture, 272 (1): 80-87. [ Links ] [ Links ]
YASUI, G.S.; DOS SANTOS, L.C.; SHIMODA, E.; PINTO-RIBEIRO-FILHO, O.; CALADO, L.L.; SARAIVA-FREITAS, A.; VAZQUEZ-VIDAL JR, M. E BARILE-FERREIRA, E. 2007.- Masculinização de três linhagens de tilápias do Nilo utilizando o andrógeno sintético 17-a-metil-testosterona. Journal Zootecnia Tropical, 25 (4): 307-310. [ Links ]













