Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.1 Manizales ene./jun. 2012
COMPARISON OF LIPID PROFILE IN DOMESTIC CAT BY GENDER AND AGE
* FR: 7-IV-2012. FA: 27-VII-2012.
1 Laboratorio de Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas, Manizales, Colombia. Email: jose.osorio_o@ucaldas.edu.co.
2 Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales, Colombia.
3 Laboratorio de Microbiología, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas, Manizales, Colombia.
Se compara y analiza, la correlación, entre las concentraciones lipídicas séricas de 6 grupos de felinos criollos o sus cruces (hembras jóvenes vs machos jóvenes; hembras adultas vs machos adultos; hembras jóvenes vs hembras adultas; machos jóvenes vs machos adultos; hembras vs machos y jóvenes vs adultos). Se obtuvieron, 96 muestras sanguíneas de gatos en estado de ayuno, diferenciados por género y edad (48 gatos menores de dos años: 19 hembras y 29 machos; y 48 gatos mayores de dos años: 18 hembras y 30 machos). Se determinaron los niveles de triglicéridos (TG), colesterol total (CT) y colesterol ligado a lipoproteínas de alta densidad (HDL-C), mediante el método enzimático colorimétrico; el colesterol ligado a lipoproteínas de muy baja densidad (VLDL-C) y de baja densidad (LDL-C), se determinaron usando las fórmulas de Friedewald. La media ± desviación estándar para los niveles de CT, TG, HDL-C, VLDL-C y LDL-C, en mg/dl, fueron de: 125,882 ± 48,775; 46,356 ± 74,987; 63,801 ± 24,425; 9,095 ± 14,973; 52,985 ± 26,313; respectivamente. Para el grupo de los felinos jóvenes vs adultos, hubo una diferencia estadísticamente significativa, en las variables CT y LDL-C, con P valores inferiores a 0,05 (0,0118 para CT y 0,0090 para LDL-C), con una confidencia del 95 %, así mismo, para el grupo de los machos adultos vs machos jóvenes, también hubo una diferencia estadísticamente significativa para CT y LDL, con un P- valor de 0,0125 y 0,0065, respectivamente. Para los demás grupos, los TG, HDL-C y VLDL-C, no fue significativo (P ≥ 0,05). Los resultados mostrados por los machos adultos, sugieren mayor predisposición, a presentar altas concentraciones en su perfil lipídico, el cual tiende a incrementarse con el paso del tiempo.
Palabras clave: colesterol, gatos, lípidos, metabolismo, obesidad, triglicéridos.
AbstractThe correlation between serum lipid concentrations of 6 groups native-born cats or their crosses (females young vs. young males, adult females vs. adult males, young females vs. adult females, young males vs. adult males, females vs. males and young vs. adults) are compared and analyzed. Blood samples on an empty stomach from 96 cats differentiated by gender and age (48 cats under two years: 19 females and 29 males and 48 cats over two years: 18 females and 30 males) were obtained. The levels of triglycerides (TG), total cholesterol (CT), and high density lipoprotein cholesterol (HDL-C) were measured using the enzymatic-colorimetric method; very low-density lipoprotein cholesterol (VLDL-C) and low-density lipoprotein cholesterol (LDL-C) were determined using the Friedewald equation. Mean ± standard deviation for CT, TG, HDL- C, VLDL-C and LDL- C in mg/dl were: 125,882 ± 48,775;46,356 ± 7 4,987;63,801 ± 24,425;9,095 ± 14,973;52,985 ± 26,313; respectively. For the young vs adult cats group there was a statistically significant difference in the CT y LDL-C variables with P values lower than 0,05 (0,0118 by CT and 0,0090 to LDL-C), with a confidence level of 95 %; likewise for the group of adult males vs. young males there was a statistically significant difference for CT and LDL- C with P value of 0,0125 and 0,0065, respectively. For the other groups the TG, HDL-C and VLDL-C were not significant (P ≥ 0,05).The results showed by adult males, suggest a greater trend to have high concentrations in lipid profile, which tends to increase overtime.
Key words: cats, cholesterol, lipids, metabolism, obesity, triglycerides.
El felino doméstico es una especie fisiológicamente adaptada, al alto consumo de grasas como fuente de energía, además de proporcionar palatabilidad, a los alimentos (BAUER, 1997). Su digestión comienza en el estómago, lugar donde las grasas, entran en contacto con el jugo gástrico y son sometidas a un proceso de agitación, conduciendo a la formación de glóbulos de grasa (CUNNINGHAM, 1999). De esta manera, los lípidos pasan al duodeno, incluidos en el quimo y allí, estimulan la secreción de la colecistocinina, hormona que provoca la expulsión de los ácidos biliares, con los cuales, se mezclan los lípidos haciéndolos solubles en agua y digeribles enzimáticamente. La colecistocinina, induce además, a la secreción del jugo pancreático, donde van incluidas las lipasas pancreáticas, fosfolipasas y colesterol éster hidrolasas, encargadas de la degradación de los lípidos de la dieta (FEINLE et al., 2001; RÍOS, 1997).
Para el transporte lipídico, es necesaria la re-esterificación de los ácidos grasos, a triglicéridos dentro del enterocito para la posterior formación, de los quilomicrones, los cuales viajan, a través del sistema linfático, desembocando en el sistema circulatorio (CUNNINGHAM, 1999). En este sitio, la lipoproteína lipasa, actúa sobre los triglicéridos, liberando ácidos grasos que se dirigen, hacia los diferentes tejidos periféricos.
Los carbohidratos por el contrario, no hacen parte de la dieta habitual del gato doméstico, debido a la baja capacidad enzimática para digerirlos y aprovechar su ingestión: ausencia de alfa-amilasa salival, reducida actividad de amilasas y disacaridasas pancreáticas e intestinales (QUINTANA, 2006); baja actividad a nivel hepático de glucocinasa (TAKEGUCHI et al., 2005); fructoquinasa (SPRINGER et al., 2009) y glucógeno sintetasa (ZORAN, 2002).
Los niveles de glucosa sanguínea en el felino, se encuentran provistos gracias a la liberación de pequeñas, pero persistentes cantidades de glucosa a largo plazo, como resultado del aporte gluconeogénico, a partir de las proteínas (ZORAN, 2002), un aporte muy activo y constante, en las especies carnívoras, a diferencia de otros animales, donde es activado únicamente, por una baja cantidad de carbohidratos (CASE et al., 2001).
El metabolismo proteico del gato es muy acelerado, es decir, las enzimas encargadas de catabolizar los compuestos nitrogenados, tienen una alta actividad, aún cuando la cantidad de proteína en la dieta sea baja (AMINLARI et al., 2007; RUSSELL et al., 2000), esta alta actividad, no permite la conservación del nitrógeno, por lo cual debe recurrir, al abastecimiento continuo de proteínas, a través de la ingesta.
La arginina, taurina, metionina, cisteína y carnitina, son aminoácidos elementales, en la dieta de estos carnívoros para el correcto funcionamiento de actividades, como: eliminación del nitrógeno (GOY-THOLLOT & ELLIOTT, 2008); emulsificación de los lípidos, a nivel intestinal (YANG et al., 2010); función cardiaca, retiniana y reproductiva (DAVENPORT, 2007). La carnitina, tiene un rol importante en el metabolismo lipídico, al mediar el transporte de ácidos grasos de cadena larga, a través de la membrana interna de la mitocondria para su oxidación (LACERA, 2004).
La obesidad, además de ser el trastorno nutricional más común en los animales de compañía (HATANO et al., 2010; MICHEL et al., 2005), se presenta, cuando el consumo de energía es mayor al requerido (CASE et al., 2001; HOENIG et al., 2006; NEVES & TUDURY, 2006), es un factor predisponente para la diabetes mellitus (HOENIG, 2002; RAND et al., 2004) y la lipidosis hepática (KOLOFFON et al., 2001), patologías, que cada día, ganan más fuerza en la especie felina, como respuesta a los cambios en el estilo de vida: incluidos la forma de alimentación, el ámbito social y la actividad física, influenciados, en gran medida por sus propietarios.
MATERIALES Y MÉTODOSToma de muestras
Se tomaron 96 muestras sanguíneas de felinos domésticos criollos o cruzados, en la ciudad de Manizales y en el municipio de Riosucio, del departamento de Caldas. 48 gatos menores de dos años (19 hembras y 29 machos) y 48 gatos mayores de dos años (18 hembras y 30 machos). Las muestras fueron tomadas por venopunción, en estado de ayuno de 12 horas y recolectadas en tubos de ensayo. Posteriormente, se centrifugaron las muestras a 3500 rpm durante 5 minutos, se obtuvieron los sueros y se conservaron, a -30 ºC, hasta su análisis. Los niveles de colesterol total (CT), fueron determinados, por medio del método enzimático colorimétrico, el colesterol ligado a lipoproteínas de alta densidad (HDL-C), fue precipitado en presencia de ácido fosfotúngstico y determinado, mediante el método enzimático-colorimétrico.
ProcedimientoLos sueros felinos y los reactivos, fueron expuestos a temperatura ambiente, durante 10 minutos para su descongelación, luego las muestras fueron homogenizadas. Para el cálculo de triglicéridos (TG), fueron pipeteados 10 ul de las muestras, los cuales se mezclaron con 1000 ul de reactivo de TG referencia 11529, después de agitar bien, se llevaron a baño maría a 37 ºC por cinco minutos y finalmente, se realizó, la lectura. Para la medición de CT, se llevó a cabo el mismo procedimiento, variando únicamente, el reactivo utilizado: Colesterol referencia 11506. Para calcular el HDL-C, fueron pipeteados 200 ul del suero de las muestras y mezclados con 500 ul de reactivo Col HDL referencia 11649, después de homogenizadas las muestras, se dejaron a temperatura ambiente por 15 min y ulteriormente, se centrifugaron a 4000 rpm, durante 15 min, para luego ser pipeteados 100 ul de sobrenadante de cada muestra. Este último, se mezcló con 1000 ul del reactivo Col referencia 11506, a continuación, se dejó a baño maría a 37 ºC por 10 min para finalmente, realizar su lectura.
Las determinaciones del colesterol ligado a lipoproteínas de muy baja densidad (VLDL-C) y de baja densidad (LDL-C), se estimaron mediante la fórmula de Friedewald: VLDL-C = TG/5 y para LDL-C = CT-(HDL-C + VLDL-C) (FRIEDEWALD et al., 1972). Este procedimiento, también ha sido aprobado en otras especies con patrón HDL, como: caninos, equinos, bovinos y ovinos (OSORIO & URIBE-VELÁZQUEZ, 2011). Se utilizaron los reactivos de la casa comercial BioSystems.
Análisis estadísticoLos resultados fueron analizados, a través del programa STATGRAPHICS Plus 5.1. Se establecieron 6 grupos de acuerdo al género y a la edad, de la siguiente manera: hembras jóvenes vs machos jóvenes; hembras adultas vs machos adultos; hembras jóvenes vs hembras adultas; machos jóvenes vs machos adultos; hembras vs machos y jóvenes vs adultos. La comparación entre determinados grupos, se llevó a cabo, por medio del análisis de varianza ANOVA simple, con el cual, se obtuvo: el promedio, la varianza, la desviación estándar y el rango mínimo y máximo, para cada una las siguientes variables: CT, TG, HDL-C, LDL-C y VLDL-C, en cada uno de los 6 grupos. Se aceptaba diferencia estadísticamente significativa, cuando P valor es < 0,05.
RESULTADOSLos valores equivalentes a la media ± desviación estándar, expresados en mg/dl para cada fracción lipídica correspondieron a: 125,882 ± 48,775 para CT; 46,356 ± 74,987 para TG; 63,801 ± 24,425 para HDL-C; 52,985 ± 26,313 para LDL-C; y 9,095 ± 14,973 para VLDL-C. De acuerdo con los valores obtenidos por los grupos descritos anteriormente, se encontró que los gatos adultos (hembras y machos), tenían mayores concentraciones séricas de TG, comparados con los gatos jóvenes, pero sin una diferencia estadísticamente significativa (57,4767 vs 35,2447 mg/dl). Sin embargo, este mismo grupo de gatos adultos, manifestó valores mayores que el de los gatos jóvenes para CT y LDL-C, con diferencias estadísticamente significativas, con el P- valor del test F inferior a 0,05 equivalente a 0,0118 para CT y 0,0090 para LDL-C (Tabla 1). Así mismo, el grupo de los machos adultos, alcanzó valores superiores, al grupo de machos jóvenes (65,186 vs 34,7558 mg/dl), para TG, sin una diferencia estadísticamente significativa, mientras que, para CT y LDL, si la hubo, con un P- valor de 0,0125 y 0,0065, respectivamente (Tabla 2). Adicional a esto, los machos adultos, obtuvieron valores superiores, a los de las hembras adultas (149,49 vs 119,652 mg/dl) para CT, pero sin una diferencia estadísticamente significativa.
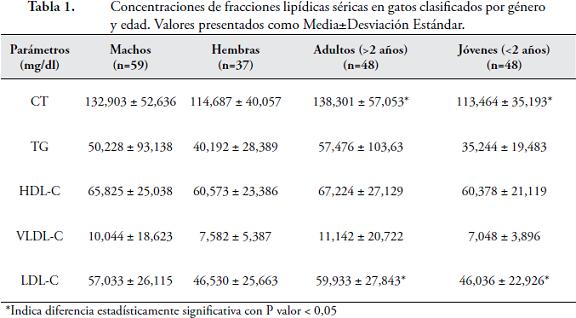
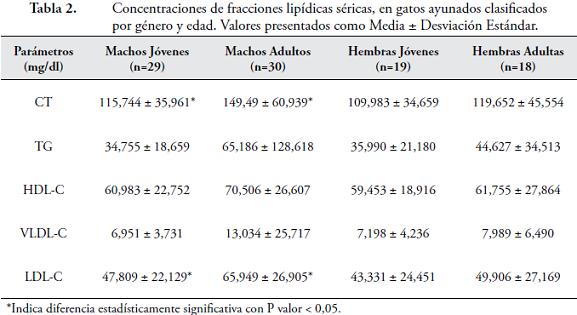
DISCUSIÓN
En este estudio, las concentraciones más altas de las fracciones lipídicas: CT, TG, HDL-C, LDL-C y VLDL-C, se presentaron en los machos adultos, pero únicamente, con diferencia estadísticamente significativa para CT y LDL-C. En otras investigaciones, también se reportan valores más altos para CT y TG, en los gatos adultos HATANO et al., 2010). Algunos autores reportan, además del incremento de CT y TG, el aumento de LDL-C, en animales mayores y una disminución para HDL-C (MURANAKA et al., 2010). En otra publicación, se evaluaron las concentraciones de TG y CT, sin hallar correlación entre el peso, edad, sexo o dieta. A pesar de que los gatos más viejos (mayores de 7 años), de tal investigación, expresaron menor actividad de lipoproteína lipasa (LPL) y lipasa hepática, este hecho, no tuvo ninguna repercusión en las concentraciones de TG (KLUGER et al., 2009). Aunque la menor actividad de estas enzimas, podría ser una causa de los valores más altos de TG en el presente estudio, se requieren pruebas posteriores. En los gatos la dislipidemia más conocida, es un defecto genético relativo a la deficiencia de LPL, causante de trigliceridemia postprandrial, en animales homocigotos. En los heterocigotos, sólo se puede diferenciar de gatos normales, después de realizar una prueba de tolerancia de grasa oral (KLUGER et al., 2010). Comparando los resultados de este estudio, con otros ensayos realizados en gatos obesos, encontramos, que para el CT y TG, los valores son mayores para los animales obesos, tanto jóvenes, como adultos. Cuando la comparación es entre gatos obesos jóvenes, con gatos sanos adultos, se hallan valores muy similares, entre ambos grupos. Esta situación sugiere, que la obesidad, acelera un fenómeno natural, donde las concentraciones lipídicas aumentan con el tiempo. En los animales obesos, se encuentran frecuentemente, alteraciones en el metabolismo lipídico, los niveles de glucosa y la resistencia a la insulina (MURANAKA et al., 2010). El uso de dietas altas en carbohidratos, junto con la falta de ejercicio y la esterilización, han conducido al desarrollo de la obesidad y a su vez, al desarrollo de diabetes mellitus (MAZZAFERRO et al., 2003). El aumento en la ingestión de alimentos, se ve influida por la alta palatabilidad, las influencias sociales o los cambios de las hormonas sexuales, producto de la gonadectomía (FETTMAN et al., 1998). Algunos autores, evaluaron el efecto de la castración y se encontró, que machos y hembras esterilizados, alcanzaron un importante aumento de peso corporal y de tejido adiposo acompañados además, por un aumento de TG, después de tres meses, a diferencia de machos y hembras intactos sexualmente. Este incremento de TG, coincide con la mayor ingesta de alimentos y mayor grasa corporal, después de la gonadectomia, debido a que éstas, favorecen ampliamente su síntesis hepática (HATANO et al., 2010) e intestinal (FETTMAN et al., 1997); mientras que, en otro estudio, también se evidenció, un aumento del peso corporal en gatas esterilizadas, que posteriormente desarrollaron obesidad, al recibir alimentación ad libitum. Cuando el felino es gonadectomizado, su tasa metabólica y sus necesidades energéticas, se reducen, pero aumenta el consumo de alimentos, aumentando a su vez, el peso corporal. Aún después de varias semanas, la ingesta alimentaria puede reducirse y el peso corporal, sigue aumentando (BLANCHARD et al., 2004). El autor de esta publicación, considera que la alimentación de los felinos debería ser ad libitum, debido a que en su estudio, cuando las gatas comían una vez al día, exponían valores de CT mayores, sugiriendo mayor sensibilidad de los gatos al ritmo de la dieta. Otros autores por el contrario, no encuentran ninguna diferencia, entre tres y nueve comidas durante el día, en pacientes hipercolesterolémicos (BLANCHARD et al., 2004). Como ya se mencionó, la obesidad es un factor de riesgo para la diabetes mellitus en gatos, ambas enfermedades, están asociadas con alteraciones en el metabolismo de los lípidos en los seres humanos; en las personas obesas, los cambios en las lipoproteínas, están asociados con la resistencia a la insulina. En los gatos ya fue comprobado que 1 kg de peso corporal, conduce a una disminución de la sensibilidad a la insulina, alrededor de un 30 % (JORDAN et al., 2008). La insulina cumple un papel elemental, al suprimir la producción de VLDL hepática postprandial y actuar sobre la LPL. De esta manera, debido a que la obesidad produce resistencia a la insulina, interfiere entonces, con la hidrólisis de los quilomicrones (QM), por parte de la LPL y conduce, a un mayor cumulo de VLDL y, por tanto, a una prolongada lipemia. Los gatos birmanos mayores de 6 años, han demostrado una tendencia a la intolerancia de la glucosa en comparaciones hechas con gatos de otras razas de la misma edad (KLUGER et al., 2009). Pacientes obesos humanos y felinos, han manifestado un incremento de TG, VLDL y LDL, de esta última, principalmente, partículas pequeñas, las cuales, han sido asociadas en humanos con enfermedad arterial coronaria. El aumento de HDL, en gatos obesos, ha sido considerado benéfico, debido a que la aterosclerosis, no se ha reportado en esta especie, sin embargo, las partículas pequeñas de HDL, también se han asociado con enfermedades cardiovasculares. En una publicación, se sugiere que mayor cantidad de partículas pequeñas HDL3 y menor de partículas HDL2, son una característica de obesidad, pero no de aterosclerosis en los felinos (JORDAN et al., 2008). En contraste, otros autores asocian la obesidad con un incremento de la concentración de HDL2. Además, explican que, la aterosclerosis, ha sido inducida en gatos alimentados con un alto contenido de colesterol en la dieta (BLANCHARD et al., 2004). En la comparación de nuestros resultados, con ensayos realizados sobre lipidosis hepática (LH), se evidencian mayores valores para los gatos con esta enfermedad y con significativos incrementos de TG (BROWN et al., 2000), VLDL y LDL (BLANCHARD et al., 2004). Estos resultados, son equivalentes a los reportados en seres humanos con síndrome del hígado graso, donde los ácidos grasos y los TG, son las fracciones lipídicas, que más se incrementan. Anteriores estudios han confirmado, que los TG, son los lípidos predominantes que se acumulan en los hepatocitos de gatos con LH (BROWN et al., 2000). Esta enfermedad, también es asociada con la disminución de HDL3, enriquecidas en colesterol, sugiriendo cantidades bajas de la proteína transportadora de ésteres de colesterol (CETP), no obstante, ya había sido reportado en gatos sanos, este hecho influye en la poca susceptibilidad de los gatos a la aterosclerosis (BLANCHARD et al., 2004).
CONCLUSIONESDe acuerdo a estos resultados, se puede concluir que, los machos felinos, están predispuestos a presentar mayores concentraciones en su perfil lipídico y éste, tiende a incrementar con el paso del tiempo. Aunque los rangos de edades utilizados en los diferentes estudios y los objetivos de los mismos, apuntaban en direcciones diferentes a las nuestras, de todos modos, fueron de gran utilidad para esclarecer todos los factores que influyen en el metabolismo lipídico, entre ellos, enfermedades, como: obesidad, diabetes mellitus, lipidosis hepática y las alteraciones, que éstas acarrean, como: aumento del peso corporal, la resistencia a la insulina y la intolerancia a la glucosa, así como la castración y el mayor consumo de alimentos que ésta, trae consigo. Siendo probablemente, algunos de estos trastornos, los causantes de los mayores valores, en nuestro estudio. El perfil lipídico al revelar la condición del metabolismo lipídico, es una valiosa herramienta diagnóstica de los trastornos concernientes a éste, incluyendo, las enfermedades antes mencionadas. De igual manera, las mediciones de componentes bioquímicos, como: la insulina, la glucosa, la adiponectina y los ácidos grasos, son de especial interés en el diagnóstico de los mismos.
Las variaciones en los resultados, frente a las demás investigaciones, obedecen a: las diferentes técnicas de laboratorio, composiciones dietarias, patrones de alimentación, razas, ámbitos sociales, esterilización, entre otros. Por tanto, se hace necesario llevar a cabo, investigaciones exhaustivas, que incluyan estas variables.
AMINLARI, M., SHAHBAZKIA, H. R., ESFANDIARI A., 2007.- Distribution of arginase in tissues of cat (Feliscatus). J Feline Med Surg., 9 (2): 133-139. [ Links ] [ Links ]
BLANCHARD, G., PARAGON, B. M., SÉROUGNE, C., FÉRÉZOU, J., MILLIAT, F., LUTTON, C., 2004.- Plasma lipids, lipoprotein composition and profile during induction and treatment of hepatic lipidosis in cats and the metabolic effect of one daily meal in healthy cats. J Anim Physiol Anim Nutr., 88 (3-4): 73-87. [ Links ] [ Links ]
CASE, L. P., CAREY, D. P., HIRAKAWA, D. A., DARISTOTLE, L., 2001.- Nutrición canina y felina. Harcourt, Madrid. pp. 211-320. [ Links ] [ Links ]
DAVENPORT, G. M., 2007.- Alimentar a los gatos como carnívoros (II). Argos., (90): 44. [ Links ] [ Links ]
FETTMAN, M. J., STANTON, C. A., BANKS, L. L., HAMAR, D. E., JOHNSON, D. E., HEGSTAD, R. L. et al., 1997.- Effects of neutering on body weight, metabolic rate and glucose tolerance of domestic cats. Res Vet Sci., 62 (2): 131-136. [ Links ] [ Links ]
FRIEDEWALD, W., LEVY, R., FREDRICKSON, D., 1972.- Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem., 18: 499-502. [ Links ] [ Links ]
HATANO, Y., MORI, N., ASADA, M., MORI, A., YAMAMOTO, I., MURANAKA, S. et al., 2010.- Hypertriglyceridemia with increased plasma insulin concentrations in cats. Res Vet Sci., 88 (3): 458-460. [ Links ] [ Links ]
HOENIG, M., MCGOLDRICK, J. B., DEBEER, M., DEMACKER, P. N., FERGUSON, D. C., 2006.- Activity and tissue-specific expression of lipases and tumor-necrosis factor a in lean and obese cats. Domest Anim Endocrino., 30 (4): 333-344. [ Links ] [ Links ]
KLUGER, E. K., HARDMAN, C., GOVENDIR, M., BARAL, R. M., SULLIVAN, D. R., SNOW, D. et al., 2009.- Triglyceride response following an oral fat tolerance test in Burmese cats, other pedigree cats and domestic crossbred cats. J Feline Med Surg., 11 (2): 82-90. [ Links ] [ Links ]
KOLOFFON, S., TRIGO, F. J., LÓPEZ, A., 2001.- Lipidosis hepática idiopática felina. Vet Méx., 32 (2): 109-116. [ Links ] [ Links ]
MAZZAFERRO, E. M., GRECO, D. S., TURNER, A. S., FETTMAN, M. J., 2003.-Treatment of feline diabetes mellitus using an alpha-glucosidase inhibitor and a low-carbohydrate diet. J Feline Med Surg., 5 (3): 183-189. [ Links ] [ Links ]
MURANAKA, S., MORI, N., HATANO, Y., SAITO, T. R., LEE, P., KOJIMA, M. et al., 2010.- Obesity induced changes to plasma adiponectin concentration and colesterol lipoprotein composition profile in cats. Res Vet Sci., 91 (3): 358-361. [ Links ] [ Links ]
OSORIO, J. H., URIBE-VELÁZQUEZ, L. F., 2011.- Comparison of direct versus Friedewald methods for determing LDL cholesterol levels in the horse. Rev MVZ Córdoba., 16 (2): 2549-2553. [ Links ] [ Links ]
RAND, J. S., FLEEMAN, L. M., FARROW, H. A., APPLETON, D. J., LEDERER, R., 2004.- Canine and feline diabetesmellitus: nature or nurture? J Nutr., 134 (8): 2072S-2080S. [ Links ] [ Links ]
RUSSELL, K., LOBLEY, G. E., RAWLINGS, J., MILLWARD, D. J., HARPER, E. J., 2000.- Urea kinetics of a carnivore, Felis silvestris catus. Br J Nutr., 84 (5): 597-604. [ Links ] [ Links ]
TAKEGUCHI, A., URABE, S., TANAKA, A., SAKO, T., WASHIZU, T., MORINAGA N. et al., 2005.- Activities of enzymes in some types of peripheral leucocytes may reflect the differences in nutrient metabolism between dogs and cats. Res Vet Sci., 78 (1): 21-24. [ Links ] [ Links ]
ZORAN, D. L., 2002.- The carnivore connection to nutrition in cats. J Am Vet Med Assoc., 221(11): 1559-1567. [ Links ]













