Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.2 Manizales July/Dec. 2012
PATOGENICIDAD DE DOS NEMÁTODOS ENTOMOPATOGENOS SOBRE METAMASIUS HEMIPTERUS SERICEUS (COLEOPTERA: CURCULIONIDAE)*
PATHOGENICITY OF TWO ENTHOMOPATHOGENIC NEMATODES ON METAMASIUS HEMIPTERUS SERICEUS (COLEOPTERA: CURCULIONIDAE)
James Alberto Jiménez1, Juan Carlos López N2 y Alberto Soto G3
* Fr: 13-VI-2011. FA: 21-VIII-2012.
1 Ingeniero Agrónomo. Gerente técnico Ecoflora. E-mail: ide@ecoflora.com
2 Microbiólogo. Investigador científico 1. Centro Nacional de Investigaciones de Café, Cenicafé. E-mail: juancarlos.lopez@cafedecolombia.com
3 I.A., M.sc., Ph.d. departamento de Producción Agropecuaria, Facultad de Ciencias Agropecuarias, universidad de Caldas. e-mail: alberto.soto@ucaldas.edu.co
Resumen
El picudo rayado Metamasius hemipterus sericeus es una plaga importante en la caña de azúcar y el plátano, causando perjuicio al destruir el tejido y debilitar la planta. Especies de nemátodos entomopatogenos de los géneros Steinernema y Heterorhabditis son agentes biológicos de control del insecto, con posibilidad de incorporarse a programas MIP. El objetivo del trabajo fue evaluar la virulencia de Steinernema carpocapsae y Heterorhabditis bacteriophora, sobre adultos y larvas de último instar de picudo. El bioensayo utilizado fue el de infección individual en platos multipozo con papel filtro, en concentraciones de 10, 100 y 1000 juveniles infectivos (JI)/25 ml. Con frecuencia de 12 h se registró el número de individuos muertos por plato. Los cadáveres se pasaron a cámara seca (desarrollo del nemátodo dentro del insecto) y posteriormente a cámara "white" (emergencia de JI). Las variables evaluadas fueron mortalidad de estados, multiplicación de JI y duración de emergencia. Bajo las condiciones evaluadas, tanto adultos como larvas fueron susceptibles al ataque de ambos nemátodos. Se evidenció sintomatología de infección y multiplicación en larvas, en las especies de nemátodos evaluadas. Condiciones como alta humedad en los pseudotallos de plátano favorables para la sobrevivencia de nemátodos, unidos a la mortalidad registrada y a la capacidad de desarrollarse especialmente en larvas, convierten a estos agentes en herramienta promisoria para el control de la plaga en campo.
Palabras clave: Picudo rayado, Steinernema carpocapsae, Heterorhabditis bacteriophora, plátano, MIP.
Abstract
The silky cane weevil Metamasius hemipterus sericeus is a major pest in sugar cane and bananas, causing damage on destroying the tissue and weakening the plant. Entomopathogenic nematodes (EN) species of the genera Steinernema and Heterorhabditis are biological control agents of the insect with the possibility of being incorporated into IPM programs. The objective of this study was to evaluate the virulence of Steinernema carpocapsae and Heterorhabditis bacteriophora on adults and last instar larvae of the weevil. The bioassay used was individual infection in multiple well plates with filter paper in concentrations of 10, 100, and 1.000 infective juveniles (IJ)/25 ml. Within a 12 h frequency, the number of dead individuals per plate was registered. The cadavers were put in a drying chamber (development of the nematode inside the insect) and later they were placed in a "white chamber" (emergence of IJ). The variables evaluated were mortality of the stages, IJ multiplication and emergence duration. Under the evaluated conditions, both adults and larvae were susceptible to the attack of both nematodes. Typical symptoms of infection and multiplication in larvae were observed for the nematode species evaluated. Conditions such as the high humidity in plantain pseudostems along with mortality registered and the capacity to develop especially in the larvae, make of these agents promising tools for the control of the pest in the field.
Key words: Silky cane weevil, Steinernema carpocapsae, Heterorhabditis bacteriophora, plantain, IPM
INTRODUCCIÓN
El picudo rayado del plátano Metamasius hemipterus sericeus (Olivier) (Coleoptera: Curculionidae), es un escarabajo barrenador considerado por algunos autores (CASTRILLÓN & HERRERA, 1986) como una plaga secundaria en cultivos de musáceas, mientras que otros lo reportan como plaga primaria no sólo en este tipo de plantaciones (CERDA et al., 1996), sino también en algunas especies de palmas tropicales como Phoenix canariensis, Ptychosperma macarthurii, Ravenia rivularis, Roystonia regia, Hyophorbe verschaffeltii y Washingtonia robusta y caña de azúcar (GIBLIN et al., 1996). Cuando las larvas se alimentan, construyen galerías y causan perjuicios al destruir el tejido y debilitar la planta (RESTREPO et al., 1982). Esta plaga se asocia a plantaciones de plátano que presenta heridas, desbalances nutricionales, fermentos o pudriciones (residuos de cosecha).
Debido a los problemas que representan los insecticidas sintéticos en el control de plagas, en la degradación ambiental y desarrollo de resistencia por parte de los insectos, se está evaluando el control biológico y los semioquímicos como parte de los programas de Manejo Integrado de Plagas. Actualmente el picudo rayado M. h. sericeus ha mostrado la habilidad de desarrollar resistencia a la mayoría de los insecticidas (GIBLIN et al., 1996; GOLD & MESSIAEN, 2002).
SALDARRIAGA (1981) registró algunos enemigos naturales de estados inmaduros de M. h. sericeus: Hololepta quadridentata (Coleoptera: Histeriidae), Camponotus spp. (Hymenoptera: Formicidae), Dactylosternum hidrophiloidae, D. abdominale (Coleoptera: Hydrophilidae), Chrysophilus ferruginosus (Diptera: Rhagionidae), Sarcodexia innata (Diptera: Sarcophagidae), Onthophagus sp. (Coleoptera: Scarabaeidae). Otros enemigos del picudo como hongos entomopatógenos (Beauveria bassiana (Balsamo) Vuillemin y Metarhizium anisopliae (Metsch.) Sorokin), nematodos entomopatógenos (Steinernema spp. y Heterorhabditis spp.) y especies de hongos endófitos no patogénicos (Fusarium spp.), se consideran como potenciales herramientas para diseñar estrategias de control de este insecto en varias regiones del mundo (GARCÍA ROA et al., 1994; GOLD, 2000; TREVERROW & BEDDING, 1993)
En Colombia se han utilizado los nematodos entomopatógenos para el control de plagas de importancia económica como Premnotrypes vorax (Coleoptera: Curculionidae) (GARZÓN et al., 1996); Anomala spp. y Phyllophaga spp. (Coleoptera: Scarabaeidae) (ZULUAGA, 2003); Cosmopolites sordidus (Coleoptera: Curculionidae); Aeneolamia varia (Homoptera: Cercopidae); Bemisia tabaci (Homoptera: Aleyrodidae) (CUTHBERTSON et al., 2003; HEAD et al., 2004); Otiorhynchus sulcatus (Coleoptera: Curculionidae) (KAKOULI & HAUGE, 1999); Tecia solanivora (Lepidoptera: Gelechiidae) (SÁENZ, 1998; SÁENZ & LUQUE, 2000); Spodoptera frugiperda (Lepidoptera: Noctuidae) (LEZAMA et al., 2001); Sagalassa valida (Lepidoptera: Glyphipterigidae) (MONTUFAR, 1993; ORTIZ, 1994); Cyparissius daedalus (Lepidoptera: Castniidae) (AYALA et al., 2004); Cyrtomenus bergy (Hemiptera: Cidnidae) (BARBERENA & BELLOTTI, 1998; CAICEDO & BELLOTTI, 1996), Bradysia agrestis (Diptera: Sciaridae) (KIM et al., 2004).
A los nemátodos entomopatogenos como agentes de control de M. h. sericeus se les reconoce su importancia, no sólo por buscar activamente su presa y matarla dentro de las primeras 48 h después de haberla alcanzado (KAYA & STOCK, 1997; KAYA et al., 2006), sino porque hasta el momento todas las especies descritas de steinernematidos y heterorhabditidos mantienen una asociación específica con bacterias gram-negativas de los géneros Xenorhabdus y Photorhabdus, respectivamente (GRIFFIN et al., 2005), que junto al nemátodo liberan toxinas e inhibidores en la hemolinfa de sus hospedantes que disminuyen los hemocitos del insecto, bajan el pH de la hemolinfa y paralizan al hospedante, el cual muere cuando todos los hemocitos han sido destruidos. De igual manera, produce proteasas que digieren los tejidos del insecto y antibióticos capaces de inhibir el crecimiento de colonizadores secundarios. Lo anterior hace que estos agentes sean uno de los controladores más letales a la hora de utilizarlos en programas de control biológico, siendo de mayor conveniencia que cualquier otro grupo de nemátodos (KAYA & STOCK, 1997; LOPEZ-NUÑEZ et al., 2007; RENN, 1998; WOUTS, 1991). Por lo anterior y debido a la disponibilidad y facilidad de multiplicación de los nemátodos entomopatogenos, se evaluó su efecto en larvas de último instar y adultos del picudo rayado del plátano M. h. sericeus.
METODOLOGÍA
El trabajo se desarrolló en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas. Las especies de nemátodos evaluadas fueron S. carpocapsae All strain, y Heterorhabditis bacteriophora, Poinar, 1975 suministrados por Cenicafé. Juveniles infectivos (JI) de ambos nemátodos se multiplicaron en larvas de último instar de Galleria mellonella (Linnaeus) (Lepidoptera: Pyralidae) y se almacenaron en frascos de vidrio transparente a 10 ± 2°C por un período no mayor a 30 días después de su multiplicación.
Para los bioensayos se utilizaron platos para cultivo de tejidos Falcon® de fondo plano con 12 celdas individuales por plato; los juveniles infectivos (JI) se acondicionaron a temperatura de 25 ± 2°C durante 48 h antes de realizar las infecciones. En el fondo de cada celda se colocaron dos rodajas de papel filtro Watmann # 1, sobre las que se aplicaron con micropipeta automática Eppendorf las concentraciones de JI a evaluar (10, 100 y 1000 JI) en 25 ul. Cada dosificación se ajustó previamente por recuentos al estereoscopio en una solución de agua estéril y detergente (Micro soap-Int. Prod.Corp 5%), para reducir la tensión superficial entre el agua y el nemátodo. Este procedimiento se realizó para las dos especies de nemátodos. Finalmente se colocó en cada celda una larva de último instar o un adulto (según el tratamiento) de M. h sericeus. Cada plato de cultivo se selló con Parafilm® y se guardó en una bolsa con cierre en la que se introdujo una toalla de papel humedecida para evitar la desecación; se llevaron a incubación a 25 ± 2°C en oscuridad constante.
El experimento se realizó bajo un diseño completamente aleatorio en arreglo factorial, conformado por 13 tratamientos (dos nemátodos x tres concentraciones de JI x dos estados de M. h. sericeus + testigo). Al tratamiento testigo se aplicaron 25 ul de solución de agua estéril y detergente según el bioensayo descrito. Cada tratamiento constó de cinco repeticiones y cada una estuvo conformada por 10 insectos, para un total de 50 individuos por tratamiento. Las evaluaciones de la mortalidad de adultos y larvas de M. h sericeus se realizaron cada 12 h, adicionando agua estéril en cada pozo para mantener la humedad.
Se estimó la proporción promedio de estados muertos por tratamiento, corregida por el testigo según Schneider y Orelly:
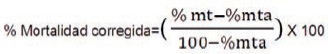
mt = mortalidad en el tratamiento.
mta = mortalidad en testigo absoluto.
Esta variable se asumió como carencia de movimiento del insecto cuando se presionó en el abdomen con una aguja de punta roma. Al morir los especímenes se colocaron de manera individual en cámara húmeda durante 48 h. Posteriormente el 40% de los individuos se pasaron a cámara "White" modificada, para evaluar la multiplicación de los nemátodos. El 60% restante de los individuos se disecaron para determinar el número de estados del nemátodo que lograron parasitar cada insecto.
En trabajos preliminares tendientes a desarrollar un sistema de bioensayo en donde los JI al interior del cadáver de la larva de M. h. sericeus pudieran desarrollarse, se realizaron evaluaciones sobre el tiempo y condiciones óptimas en las fases de infección y cámara seca. Estas evaluaciones mostraron que las condiciones de desarrollo recomendadas para G. mellonella (seis días en cámara seca a 25°C) (KAYA & STOCK, 1997), no fueron adecuadas para lograr un buen desarrollo en larvas de M. h. sericeus, debido a que aceleraban la desecación de los tejidos del insecto durante las 48 h posteriores a la muerte. De acuerdo con lo anterior, se optó por pasar la larva muerta a cajas Falcon iguales a las utilizadas en la fase de infección con papel filtro al que se le adicionó 25 ul de agua estéril cada 24 h (cámara semi-húmeda).
Para establecer las diferencias entre tratamientos se realizó un análisis de varianza al 95% de confiabilidad y para determinar el tratamiento de mayor efectividad se realizaron las pruebas de comparación de medias respectivas. Adicionalmente con el tratamiento de mayor efectividad para cada estado se obtuvo el tiempo letal 50 (TL50). Los análisis se realizaron mediante el programa SAS Version 9.1 (Statistical Analisis System).
RESULTADOS Y DISCUSIÓN
Efecto de nemátodos entomopatogenos sobre de M. h. sericeus. El porcentaje de mortalidad en los adultos de M. h. sericeus fue diferente (P=0,0001 para los dos nemátodos) entre las dosis, presentándose la mayor mortalidad en ambas especies de nemátodos (H. bacteriophora y S. carpocapsae) con la dosis de 1000 JI/adulto, seguido de 100 JI/adulto y de 10 JI/adulto. Se registró una mayor y más consistente patogenicidad de H. bacteriophora sobre estados adultos de M. h. sericeus, ya que los porcentajes de mortalidad fluctuaron para las concentraciones de J.I evaluadas entre 6.71 y 79.94%, mientras que para S. carpocapsae dichos valores estuvieron entre 19.02 y 55.34% (Tabla 1).
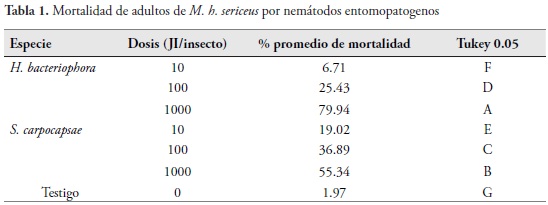
Las diferencias pudieron ser ocasionadas por la facilidad de entrar vía cuticular que posee H. bacteriophora y coincide con lo encontrado por algunos autores que registran mayor eficiencia de heterorhabdítidos sobre otros barrenadores como Otiorhynchus sulcatus (F.), O. ovatus (L.), Sphenophorus pulvurus Gyllenhal, 1838, Cylas formicarius (Fabricius) y otros insectos como Manaharva fimbriolata y Frankiniella sp. (BEDDING & MILLER, 1981; CHYZIK et al., 1996; DORSCHNER et al., 1989; LEITE et al., 2005; ROSALES & SUÁREZ, 1998). Sin embargo, la mortalidad para los adultos de M. h. sericeus fue mucho más baja que la registrada para sus estados inmaduros, lo que pudo deberse a la menor movilidad, a la exposición de sus espiráculos y al exoesqueleto menos quitinizado de la larva.
Teniendo en cuenta que el tratamiento en donde se obtuvo los mayores porcentajes de mortalidad para ambas especies de nemátodos fue 1000 JI/adulto, se determinaron los valores de TL20, 50, 70 y 90, iniciando S. carpocapsae la mortalidad del insecto a partir de las 2.47 h. El TL90 de H. bacteriophora fue de 197,82 h., mientras que para S. carpocapsae fue de 492.69 h (Tabla 2).

La mayor rapidez del género Steinernema para matar a su presa fue registrada igualmente para ninfas de Mahanarva fimbriolata (: Cercopidae) por LEITE et al., (2005). En algunos trabajos realizados sobre capacidad patogénica de nemátodos entomopatgenos (steinernemátidos y heterorhabdítidos) sobre adultos de Cosmopolites sordidus (: Curculionidae) se han registrado dosis de 1000 JI/adulto/ ml que después de 360 h de evaluación alcanzan porcentajes de mortalidad del 80 y 76% (H. bacteriophora y S. carpocapsae, respectivamente) (ROSALES & SUAREZ, 1998). En la disección de adultos se observaron porcentajes de penetración que oscilaron entre 3.12 y 8.75% para H. bacteriophora y entre 1.9 y 8.18% para S. carpocapsae (Tabla 3).
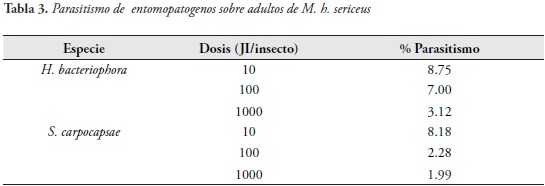
Efecto de nemátodos entomopatogenos sobre larvas de M. h. sericeus.
Con la modificación del sistema de bioensayo en todas las larvas sometidas a infecciones con JI se presentaron sintomatologías con cambio de coloración y consistencias gomosas para las dos especies de nemátodos. En las infecciones con S. carpocapsae las larvas se tornaron marrón, mientras que con H. bacteriophora, su coloración varió de rosado a rojo oscuro, sin diferencias entre las dosis utilizadas para cada nemátodo, lo que coincide con lo reportado por SÁENZ (2001) para varios insectos.
El porcentaje de mortalidad mostró diferencias significativas en relación con el testigo entre dosis (ANAVA, P = 0.0001) y en las interacciones entre dosis y tiempos de evaluación (P = 0.0001). Los porcentajes de mortalidad más altos se consiguieron con dosis de 1000 JI/25 ul para H. bacteriophora y para S. carpocapsae, seguido de las dosis de 100 y 10 JI/25 ul para ambas especies de nemátodos, corregidos por el testigo (Tabla 4).
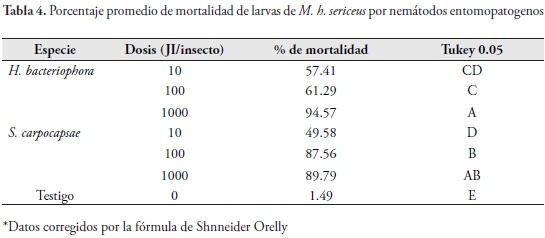
Observaciones similares sobre la mayor susceptibilidad de estados inmaduros de coleópteros a nemátodos entomopatogenos, comparada con los adultos, ha sido reportada en Otiorhynchus sulcatus, O. ovatus, Macronoctua onusta (GILL & RAUPP, 1997), Popillia japonica Newman (WANG & GAUGLER, 1998), Clavipalpus ursinus Blanchard (SÁENZ, 2001) y Tribolium castaneum (Herbst) (RAMOS-RODRÍGUEZ et al., 2006). La menor susceptibilidad de los adultos puede deberse a la dureza de los exoesqueletos de los escarabajos, al cubrimiento de los espiráculos por los élitros en algunos de los casos, a la facilidad de retirar a los nemátodos con las patas y en el caso específico de curculiónidos, a la incapacidad de los nemátodos de desplazarse a través de un rostro largo como en el de M. h. sericeus. Las larvas, por el contrario, son de movimiento más limitado, no tienen apéndices para locomoción ni defensa, son de cutícula suave y adicionalmente tienen boca, ano y espiráculos expuestos y disponibles para el ingreso de los nemátodos entomopatogenos, lo que las pudo hacer más susceptibles a la invasión e infección por éstos.
El porcentaje de mortalidad en las larvas de M. h. sericeus fue diferente (P =0,0001) para los dos nemátodos entre las dosis, presentándose la mayor mortalidad en ambas especies de nemátodos (H. bacteriophora y S. carpocapsae) con la dosis de 1000 JI/larva, seguido de 100 JI/larva y de 10 JI/larva. La mortalidad presentada por los dos nemátodos con la dosis de 1000 JI/larva fue similar estadísticamente, mientras que en S. carpocapsae la mortalidad ocasionada a las larvas con las dosis de 100 y 1000 JI/larva fue igual estadísticamente (Tabla 4). Los porcentajes de mortalidad fluctuaron para las concentraciones de J.I evaluadas entre 49.58 y 89.79% para S. carpocapsae, mientras que para H. bacteriophora estos valores estuvieron entre 57.41 y 94.57% (Tabla 4).
Se determinaron los valores de TL50 para cada uno de los tratamientos obteniendo 29.84 y 21.84 h para H. bacteriophora y S. carpocapsae, respectivamente (Tabla 5).
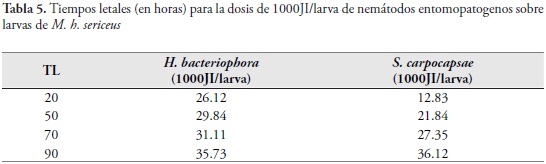
La mayor rapidez del género Steinernema para matar a su presa fue registrada igualmente para ninfas de M. fimbriolata por LEITE et al., (2005). ROSALES & SUÁREZ (1998) en su trabajo con C. sordidus registraron lapsos mayores con aislamientos nativos de Venezuela de S. carpocapsae y H. bacteriophora, lo que demuestra las diferencias entre dichos aislamientos y la potencialidad de los empleados en el presente estudio.
Durante las disecciones de larvas parasitadas se observó que pasadas 48 h de su muerte, hubo desarrollo de estados adultos de los nemátodos para las dos especies (hermafroditas para H. bacteriophora, hembras y machos para S. carpocapsae). El desarrollo y multiplicación de cada nemátodo en su insecto hospedante, facilitaría la selección del mejor entomopatógeno y su inclusión como controlador biológico, pues lograría causar epizootias en el hábitat de la plaga. Los dos nemátodos en todas las dosis evaluadas lograron multiplicarse y reproducirse en larvas de M. h. sericeus.
En cuanto a la multiplicación de las dos especies de nemátodos en las larvas de M. h. sericeus, se observó que el mayor promedio de multiplicación de H. bacteriophora se obtuvo el día 5 con 14049 JI con la dosis de 1000 JI/larva, mientras que para S. carpocapsae el mayor promedio fue de 13841 JI en el día 4. La multiplicación duró 15 y 14 días en H. bacteriophora y S. carpocapsae, respectivamente (Figura 1).
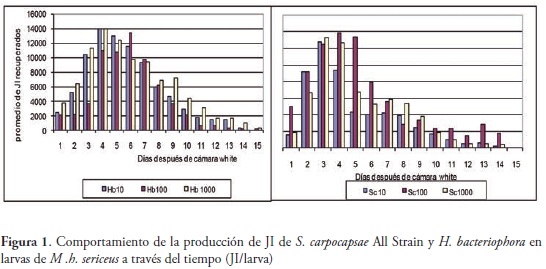
Las larvas infectadas con 10, 100 y 1000 JI/larva de H. bacteriophora produjeron un total de 813770, 466118 y 1195186 JI, respectivamente, mientras que aquellas infectadas con S. carpocapsae produjeron 328910, 1320810 y 869910 JI, para las mismas dosis. La mayor producción de JI de S. carpocapsae, fue similar a la encontrada en estados inmaduros de otros insectos (LEITE et al., 2005). Adicionalmente se observó que el inicio de la multiplicación de los nemátodos en H. bacteriophora a la dosis de 10 JI/larva tuvo un período de 6-8 días, en la dosis de 100 JI/larva de 5-7 días y en la dosis de 1000 JI/larva de 2-4 días, mientras que para S. carpocapsae fue de 5-6 días, 4-5 días y 1-4 días para las mismas dosis, respectivamente.
Cuando se utilizan menos nemátodos por larva, se presenta una mayor disponibilidad de nutrientes, lo cual retarda todo el proceso de desarrollo del nemátodo al interior del insecto. Esto se apreció claramente para las dos especies de nemátodos, ya que, los tiempos de emergencia indistintamente son mayores. La producción de los JI por larva, sumada a la capacidad de desplazamiento horizontal y vertical que poseen estos organismos, a la baja movilidad de las larvas al interior de las galerías en el plátano y a las condiciones de oscuridad y humedad que la planta ofrece, sugieren que al inyectarse al pseudotallo del plátano los JI podrían estar ocasionando mortalidad permanente de varias generaciones de la plaga.
CONCLUSIONES
La susceptibilidad de los estados de M. h. sericeus evidenciada en este trabajo indican que S. carpocapsae All Strain y H. bacteriophora podrían emplearse como una herramienta adicional en el manejo integrado de la plaga. Se observó claramente la patogenicidad y diferentes grados de virulencia de las especies utilizadas y la capacidad desarrollarse, especialmente en estados inmaduros (larvas), cumpliendo su ciclo completo y multiplicándose en larvas infectadas, características deseables en controladores biológicos. A estos resultados se puede agregar que la gran mayoría de nemátodos entomopatogenos son compatibles con todos los métodos de aplicación usados en la agricultura tradicional y que los JI de los nemátodos evaluados son compatibles con casi todos los agroquímicos bajo condiciones de campo, siendo habitantes naturales del suelo, lo que representa una ventaja más en la utilización de alternativas en el manejo integrado de M. h. sericeus.
BIBLIOGRAFÍA
AYALA, L.D., CALVACHE, H. & LEIVA, F.A., 2004.- Evaluación de técnicas de aplicación de Steinernema carpocapsae (Rhabditida: Steinernematidae) para el control del barrenador gigante de la palma Cyparissius daedalus Cramer en los Llanos Orientales de Colombia. Agronomía Colombiana (Colombia). 22 (2): 119-127. [ Links ]
BARBERENA, M.F. & BELLOTTI, A.C., 1998.- Parasitismo de dos razas del nemátodo Heterorhabditis bacteriophora sobre la chinche Cyrtomenus bergi (Hemiptera: Cydnidae) en laboratorio. Revista Colombiana de Entomología (Colombia). 24 (1-2): 7-11. [ Links ]
BEDDING, R.A. & MILLER, L.A., 1981.- Use of a nematode, Heterorhabditis heliothidis, to control black vine weevil, Otiorhynchus sulcatus, in potted plants. Annals of Applied Biology 99: 211-216. [ Links ]
CAICEDO, A.M. & BELLOTTTI, A.C., 1996.- Reconocimiento de nemátodos entomopatogenos nativos asociados con Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae) en ocho localidades de Colombia. Revista Colombiana de Entomología (Colombia). 22 (1): 19-24. [ Links ]
CASTRILLÓN, C. & HERRERA, J.G., 1986.- Los picudos negro y rayado del plátano y banano. Revista ICA Informa, Abril-Mayo- Junio: 11-14. [ Links ]
CERDA, H., LÓPEZ, A., SANOJA, O., SÁNCHEZ, P. & JAFFÉ, K., 1996.- Atracción olfativa de Cosmopolites sordidus Germar (1824) (Coleoptera: Curculionidae) estimulado por volátiles originados en musáceas de distintas edades y variedades genómicas. Agronomía Tropical 46 (4): 413-429. [ Links ]
CHYZIK, R., GLAZER, I. & KLEIN, M., 1996.- Virulence and efficacy of different entomopathogenic nematode species against western flower thrips (Frankliniella occidentalis). Phytoparasitica 24 (2): 103-110. [ Links ]
CUTHBERTSON, A.G., HEAD, J., WALTERS, K.F. & GREGORY, S.A., 2003.- The efficacy of the entomopathogenic nematode, Steinernema feltiae, against the immature stages of Bemisia tabaci. Journal of Invertebrate Pathology (Estados Unidos). 83 (3): 267-267. [ Links ]
DORSCHNER, K.W., AGUDELO-SILVA, F. & BAIRD, C.R., 1989.- Use of heterorhabditid and steinernematid nematodes to control black vine weevils in hop. Florida Entomologist 72: 544-556. [ Links ]
GARCÍA ROA, F., GÓMEZ, J.E. & BELALCAZAR, S., 1994.- Manejo biológico de Cosmopolites sordidus (Germar) en plátano. Reunión de la Asociación para la Cooperación en Investigación de Banano en el Caribe y en América Tropical. Memorias XI reunión en San José, Costa Rica. 13-18 de febrero. [ Links ]
GARZÓN, M.Y., AZA, B.O., JIMÉNEZ, J. & LUQUE, J.E., 1996.- Potencial del nematodo Steinernema sp., para el control biológico del gusano blanco de la papa. Revista Colombiana de Entomología (Colombia), 22 (1): 25-30. [ Links ]
GIBLIN, R.M., PEÑA J.E. & DUNCAN, R., 1996a.- Evaluation of entomogenous nematodes and chemical insecticides for control of Metamasius hemipterus sericeus (Olivier) (Coleoptera: Curculionidae). Journal of Entomological Science 31: 240-251. [ Links ]
GIBLIN, R.M., PEÑA, J.E., OEHLSCHLAGER, A.C. & PEREZ, A.L., 1996b.-Optimization of Semiochemical-based trapping of Metamasius hemipterus sericeus (Olivier) (Coleoptera: Curculionidae). Journal of Chemical Ecology 22: 1389-1410. [ Links ]
GILL, S.A. & RAUPP, M.J., 1997.- Evaluation of biological and chemical applications for control of iris borer. Journal Environmental Horticulture 15: 108-110. [ Links ]
GOLD, C.S., 2000.- Biology and integrated pest management of banana weevil Cosmopolites sordidus (Germar), pp. 28-33. En: Molina, A. B.; Roa, V. N.; Maghuyop, M. A. G. (eds.). Advancing banana and plantain R&D in Asia and the Pacific. Vol. 10. Proceedings of the 10th INIBAP-ASPNET Regional Advisory Commitee meeting held an Bankok, 2000/11/10-11, INIBAP- ASPNET, Los Baños. [ Links ]
GOLD, C.S. & MESSIAEN, S., 2002.- El picudo negro del banano Cosmopolites sordidus. Montepellier Cedex 5, Francia, Inibap. pp. 35- 40. [ Links ]
GRIFFIN, C.T., BOEMARE, N.E. & LEWIS, E.E., 2005.- Biology and Behaviour, pp. 47-64. En: Grewal, P. S.; Ehlers, R. U. Chapter 2 Nematodes as biocontrol agents. Shapiro-Ilan, D.I. Eds. CABI Publishing. Oxfordshire. U. K. [ Links ]
HEAD, J., LAWRENCE, A.J. & WALTERS, K.F., 2004.- Efficacy of the entomopathogenic nematode, Steinernema feltiae, against Bemisia tabaci in relation to plant species. Journal of Applied Entomology (Estados Unidos). 128 (8): 543-547. [ Links ]
KAYA, H. & STOCK, S., 1997.- Techniques in insect nematology, pp. 281-324. En: Lacey, L. A. (ed.) Manual of techniques in insect pathology. Biological techniques. Academic Press, Inc. San Diego. Chap. 6. [ Links ]
KAYA, H.K., AGUILERA, M.M., ALUMAI, A., CHOO, H.Y., TORRE, M. de la; FODOR, A., GANGULY, S.,HAZIR, S., LAKATOS, T., PYE, A., WILSON, M., YAMANAKA, S., YANG, H. & EHLERS, R-U., 2006.- Status of entomopathogenic nematodes and their symbiotic bacteria from selected countries or regions of the world. Biological Control 38: 134-155. [ Links ]
KAKOULI, T. & HAGUE, N., 1999.- Infection, development and reproduction of the entomopathogenic nematode Steinernema arenarium (Nematoda: Steinernematidae) in the black vine weevil Otiorhinchus sulcatus (Coleoptera: Curculionidae). Nematology. 1 (2): 149 –156. [ Links ]
KIM, H., CHOO, H.Y., KAYA, H.K., LEE, D.W., LEE, S.M. & JEON, H.Y., 2004.- Steinernema carpocapsae (Rhabditida: Steinernematidae) as a Biological Control Agent Against the Fungus Gnat Bradysia agrestis (Diptera: Sciaridae) in Propagation Houses. Biocontrol Science and Technology, (Estados Unidos).14 (2): 17–83. [ Links ]
LEITE, L.G., MACHADO, L.A., GOULART, R.M., TAVARES, F.M. & BATISTA FILHO, A., 2005.- Screening of entomopathogenic nematodes (Nemata: Rhabditida) and the efficiency of Heterorhabditis sp., against the Sugarcane Root Spittlebug Mahanarva fimbriolata (Fabr.) (Hemiptera: Cercopidae). Neotropical Entomology 34 (5): 785-790. [ Links ]
LEZAMA, R., HAMM, J.J., MOLINA, J., LÓPEZ, M., PESCADOR, A., GONZÁLEZ, R. & STYER, L., 2001.- Occurrence of entomopathogens of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the Mexican States of Michoacán, Colima, Jalisco and Tamaulipas. Florida Entomologist. (Estados Unidos). 84 (1): 23–30. [ Links ]
LÓPEZ-NÚÑEZ, J.C., CANO, L., GÓNGORA, C., STOCK, P., 2007.- Diversity and evolutionary relationships of entomopathogenic nematodes (Steinernematidae and Heterorhabditidae) from the Central Andean region of Colombia. Nematology 9 (3): 333-341. [ Links ]
MONTUFAR, E., 1993.- Efecto de tres concentraciones del nematodo Steinernema carpocapsae y del cubrimiento del plato radicular con raquis en el control del barrenador de raíces (Sagalassa valida Walker) de palma africana de Tumaco. Tesis de Ingeniero Agrónomo. Facultad de Agronomía. Universidad de Nariño, Pasto (Colombia). p.105 [ Links ]
ORTIZ, L. E., 1994.- Control microbiano de Sagalassa valida Walker (Lepidoptera: Glyphipterigidae) con el nematodo Steinernema carpocapsae en Tumaco Nariño. Tesis Ingeniero Agrónomo. Facultad de Agronomía. Universidad Nacional de Bogotá, Bogotá (Colombia). p 97. [ Links ]
RAMOS-RODRÍGUEZ, O., CAMPBELL, J.F. & RAMASWAMY, S.B., 2006.- Pathogenicity of three species of entomopathogenic nematodes to some major stored-product insect pests. Journal of Stored Products Research 42: 241–252. [ Links ]
RENN, N., 1998.- Routes of penetration of the entomopathogenic nematode Steinernema feltiae attacking larval and adult houseflies (Musca domestica). Journal of Invertebrate Pathology 72: 281- 287. [ Links ]
RESTREPO, L.G., RIVERA, F. & RAIGOSA, J., 1982.- Ciclo de vida, hábitos y morfometría de Metamasius hemipterus Olivier y Rhychophorus palmarum L. (Coleoptera: Curculionidae) en caña de azúcar (Saccharum officinarum L.). Acta Agronómica. 32 (114): 33-44. [ Links ]
ROSALES, L.C. & SUÁREZ, Z., 1998.- Nematodos entomopatógenos como posibles agentes de control del gorgojo negro del plátano Cosmopolites sordidus (Germar, 1824) (Coleoptera: Curculionidae). Boletín Entomología Venezolana 13 (2): 123-140. [ Links ]
SÁENZ, A., 2001.- Los nemátodos entomopatógenos: actualidad y perspectivas. Seminario regional en control biológico. Memorias primer seminario regional en control biológico. Santa Rosa de Cabal: Corporación Universitaria Santa Rosa de Cabal. [ Links ]
SÁENZ, A., 1998.- Steinernema feltiae Filipjev, 1934 cepa Villapinzón (Rhabditada: Steinernematidae): ciclo de vida, patogenicidad y métodos de cría. Tesis M. Sc. en Entomología. Facultad de Agronomía. Universidad Nacional de Bogotá. Bogotá (Colombia). p.130 [ Links ]
SÁENZ, A. & LUQUE, J.E., 2000.- Ciclo de vida del entomonematodo Steinernema feltiae Flipjev. Agronomía colombiana (Colombia). 17 (1-3): 17–24. [ Links ]
SALDARRIAGA, V.A., 1981.- Industrialización de la Caña. Instituto Colombiano Agropecuario ICA. Compendio Nº 42. Medellín, 154 –155. [ Links ]
TREVERROW, L.N. & BEDDING, R., 1993.- Development of a system for the control of the banana weevil borer, Cosmopolites sordidus with entomopathogenic nematodes, pp.41-47. En: Bedding, R.; Akhurst, R.; Kaya, H. K. (eds.) Nematodes and the biological control of pest. Melbourne Australia. [ Links ]
WANG, Y. & GAUGLER, H.M., 1998.- Host and penetration site location by entomopathogenic nematodes against Japanese beetle larvae. Journal of Invertebrate Pathology 72: 313-318. [ Links ]
WOUTS, W.M., 1991.- Steinernema (Neoaplectana) and Heterorhabditis species, pp. 855-897. In: Nickle, W. R. (ed.) Manual of agricultural nematology. New York: Marcel Dekker. [ Links ]
ZULUAGA,A. 2003.- Identificación de chizas (Coleoptera: Melolonthidae) asociadas a pasto ''Kikuyo'' (Pennisetum clandestinum Hoechst) y papa (Solanum tuberosum Linneo) y sus posibles enemigos naturales en Cundinamarca. Tesis de Ingeniero Agrónomo. Facultad de Agronomía. Universidad Nacional de Bogotá. Bogotá (Colombia). p.52 [ Links ]













