Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.2 Manizales July/Dec. 2012
CARACTERIZACIÓN CARIOLÓGICA DE TRES MONOS Aotus griseimembra (PRIMATES: Aotidae) MANTENIDOS EN CAUTIVERIO
KARYOLOGICAL CHARACTERISATION OF THREE MONKEYS Aotus griseimembra (PRIMATES: Aotidae) KEPT IN CAPTIVITY
Sandra Arenas D2., María Jimena Giraldo G2., Marta Lucia Bueno3, Fredy Arvey Rivera Páez4 y Germán Ariel López Gartner5
* FR: 10-VI-2011. FA: 20-VIII-2012.
1 Bióloga, Egresada de la Universidad de Caldas, E-mail: saardi@gmail.com
2 Bióloga, Egresada de la Universidad de Caldas, E-mail: mjimegi@gmail.com
3 Profesora Asociada, Departamento de Biología, Instituto de Genética, Universidad Nacional de Colombia (Bogotá), E-mail: mlbuenoa@unal.edu.co
4 Profesor, Departamento de Ciencias Biológicas, Grupo de Investigación GEBIOME, Facultad de Ciencias Exactas y Naturales, Universidad de Caldas.
5 Profesor, Departamento de Ciencias Biológicas, Grupo de Investigación GEBIOME, Facultad de Ciencias Exactas y Naturales, Universidad de Caldas. Autor para correspondencia: Departamento de Ciencias Biológicas, Universidad de Caldas, Calle 65 Nº 26-10, Manizales, Teléfono: (57) 6-8781500 ext. 13189, Fax (57) 6-8781500 ext. 12194, E-mail: german.lopez@ucaldas.edu.co
Resumen
Se estudiaron los cariotipos de tres individuos del género Aotus mediante técnicas de bandeo cromosómico que incluyeron bandas G, C y Q. La toma de sangre para los cultivos celulares se realizó a ejemplares mantenidos en cautiverio al interior del Centro de Rehabilitación de Fauna Silvestre del Oriente de Caldas (CRFSOC) de Victoria (Caldas). Los animales permanecen temporalmente en dicho centro luego de ser decomisados del tráfico ilegal de especies; las muestras fueron procesadas en el Laboratorio de Citogenética de la Universidad Nacional de Colombia (Bogotá). Se encontraron dos configuraciones cariológicas: 2n=52 XX; NF=72, 20 Bi, 32 A. y 2n=53 XX; NF=72, 20+1XX Bi, 30 A. Esta última presenta una fusión robertsoniana simple de los cromosomas 13 y 14. De acuerdo al tamaño y la morfología los cromosomas se clasificaron en tres grupos: A, metacéntricos, B, submetacéntricos y C, acrocéntricos. Se pudo concluir que los individuos analizados citogenéticamente, pertenecen al grupo de los "cuellos grises"; identificados como Aotus griseimembra, especie distribuida en áreas del Magdalena Medio, Colombia.
Palabras Clave: Aotus, citogenética, cariotipo, bandas cromosómicas, conservación.
Abstract
The karyotypes of three monkeys from the genus Aotus were studied by using banding techniques, including G, C and Q bands. The blood samples for cellular culture were taken from individuals kept in captivity at the "Centro de Rehabilitación de Fauna Silvestre del Oriente de Caldas (CRFSOC), La Victoria (Caldas)" where the animals were being kept temporarily after being confiscated from illegal species traffickers. The blood samples were processed at the Universidad Nacional de Colombia's Cytogenetics Laboratory in Bogotá. Two karyological configurations were found: 2n=52 XX; NF=72, 20 Bi, 32 A. and 2n=53 XX; NF=72, 20+1XX Bi, 30 A. The last one presented a simple robertsonian centric-fusion of chromosomes 13 and 14. The chromosomes were classified into three groups according to size and morphology: A metacentric, B submetacentric, and C acrocentric. It was concluded that the cytogenetically analyzed individuals belonged to the "gray necked" group identified as Aotus griseimembra, a species distributed throughout certain areas in the middle Magdalena river valley, Colombia.
Key words: Aotus, Cytogenetics, karyotype, chromosome band, conservation.
INTRODUCCIÓN
El género Aotus es uno de los más controvertidos entre los platirrinos vivientes, debido a sus caracteres particulares que generan confusas relaciones filogenéticas (TEJEDOR, 2001). Cariológicamente se han reportado varios cariotipos que reflejan una gran diversidad citogenética, tanto numérica como estructural y en ambos niveles, intra e interespecífica (CASTRILLÓN, 2009). El género fue descrito inicialmente por HUMBOLDT (1812), con una sola especie Aotus trivirgatus, cuya distribución abarcaba todo Centro y Suramérica. Posteriormente, HERSHKOVITZ (1983) señaló la problemática de la supuesta mono-especificidad del género, alentando la creencia de que existía más de una especie, sustentado por los trabajos de BRUMBACK et al. (1971); BRUMBACK (1973) y MA et al. (1976) con el descubrimiento de cariotipos polimórficos: 2n=52, 2n=53, 2n=54 en Colombia y 2n=54 en Perú. Adicionalmente, BRUMBACK (1974) reportó el hallazgo de un cariotipo, 2n=50, atribuible supuestamente a un ejemplar procedente de Paraguay, que resultó provenir del sector de Villavicencio (Departamento del Meta) en Colombia y que fue denominado por HERSHKOVITZ (1983) como Aotus brumbacki (DEFLER, 2003).
Existen evidencias que sugieren que en el género Aotus han ocurrido muchos rearreglos cromosómicos. Inicialmente se definieron por cariología siete taxones (GALBREATH, 1983). Posteriormente, PIECZARKA y NAGAMACHI (1988) afirman que son 12 los cariotipos diferentes con un número diploide que varía entre 46 a 56 cromosomas. Por su parte, GIRALDO et al. (1986), TORRES et al. (1998), citan una variación en el rango de 46 a 58 cromosomas. Además, se ha reportado la existencia de varios polimorfismos en dicho género, entre los cuales se encuentra la fusión del cromosoma Y con el par B12 (PIECZARKA y NAGAMACHI, 1988), entre otros. Los estudios de la diversidad cariológica de las poblaciones de Aotus indican, además de la existencia de varias especies para el género, una amplia distribución en Sur América que comprende el occidente de Venezuela, Amazonía Brasilera, Ecuador, Perú, oriente de Bolivia, Paraguay, Panamá y el territorio colombiano, exceptuando el nororiente de la Guajira, alturas superiores a 3200 msnm, Vichada al norte del río Tomo, oriente de Casanare y Arauca además de algunas áreas montañosas y de Sabana con arbustos en los departamentos de Guainía, Vaupés; Guaviare, sin registros para el departamento de Nariño (DEFLER, 2003; CASTRILLÓN, 2009).
En cuanto a la especie Aotus lemurinus, se encontró que está formada por un complejo de especies gemelas, siendo éste el único caso conocido en los primates neotropicales; se compone de: Aotus lemurinus (DEFLER y BUENO, 2003), A. zonalis (MA et al., 1978) y A. griseimembra (MA et al., 1976, TORRES et al., 1998). Dicho complejo es parte de "los cuellos grises" (el pelaje en los lados de la nuca varía desde color gris-anteado hasta anteado-castaño) y se encuentra principalmente al norte del río Amazonas (HERSHKOVITZ, 1983, RODRÍGUEZ-M. et al., 2006). Las especies del sur del río Amazonas se conocen como "los cuellos rojos".
El complejo Aotus lemurinus, junto con A. brumbacki, son las especies del género más amenazadas. A. griseimembra (categorizada nacionalmente por la IUCN como vulnerable "VU") se encuentra en dicho estado debido a la sobreexplotación o aprovechamiento no sostenible en su consumo doméstico y la comercialización para el mercado ilegal de pieles, como mascotas o como ejemplares de experimentación médica, con efectos negativos sobre la biodiversidad (RODRÍGUEZ-M. et al., 2006, GIRALDO et al., 1986).
Los ejemplares que son decomisados al tráfico ilegal son depositados en estaciones de paso donde es difícil la toma de decisiones sobre cuál será su destino, ya que, es poca la información disponible en cuanto a las variaciones filogeográficas dentro de las poblaciones, que permita la definición de sus lugares de origen, por lo que se crea la necesidad de implementar métodos como la caracterización citogenética para la implementación de planes de manejo adecuados (BUENO, 2003; DEFLER y BUENO, 2007).
En el caso de las especies que se encuentran en cautiverio, el análisis de su cariotipo se hace indispensable para prevenir la hibridación interespecífica, que puede conducir a la pérdida del genotipo original como a la extinción de subespecies y especies por el nacimiento de híbridos estériles (BARRAGÁN, 2005). Al mismo tiempo, para evitar los efectos deletéreos de la homocigosidad cromosómica, que puede generar infertilidad, se recomienda que los animales seleccionados para los programas de conservación ex situ, cría en cautiverio, reintroducción y proyectos de traslocación de especies, sean agrupados según la compatibilidad de los cariomórfos (BENIRSCHKE & KUMAMOTO, 1991).
En este trabajo se reportan los cariotipos de tres ejemplares de Aotus mantenidos en cautiverio en el Centro de Rehabilitación de Fauna Silvestre del Oriente de Caldas (CRFSOC). Se utilizaron métodos de bandeo cromosómico G, C, y Q haciéndose un análisis preliminar de los resultados con miras a apoyar la toma de decisiones para la reintroducción de los individuos al hábitat natural o para iniciar programas de reproducción ex situ.
MATERIALES Y MÉTODOS
Animales: para el análisis cariológico, se utilizaron dos hembras adultas y una juvenil, inicialmente asignadas por rasgos morfológicos al género Aotus sp., las cuales se nombraron como P80 (hembra adulta), P81 (hembra juvenil) y P82 (hembra adulta); cuyo origen geográfico es desconocido. Éstas fueron decomisadas (a causa del tráfico ilegal de especies), protegidas y llevadas al Centro de Rehabilitación de Fauna Silvestre del Oriente de Caldas (CRFSOC), donde proporcionaron las muestras de sangre para los análisis cariológicos.
Cariotipificación: De ejemplares P80 y P81 se extrajeron en tubos heparinizados 2 a 5 mL de sangre total de la vena femoral, empleada para los cultivos celulares necesarios para la obtención de los cromosomas metafásicos, de acuerdo a los protocolos estandarizados (MOORHEAD et al., 1960), con una modificación implementada en el Instituto de Genética de la Universidad Nacional de Colombia, Bogotá (Manual de Procedimientos de Laboratorio de Citogenética del Instituto de Genética de la Universidad Nacional de Colombia, MPLC-IGUN, Bogotá 2009). La modificación consistió en el empleo de 100 uL de favina (Sigma, St. Louis, MO) como mitógeno en lugar de la fitohemaglutinina comúnmente empleada en cultivos de linfocitos humanos. En el caso del ejemplar P82 no fue posible ni prudente obtener una muestra sanguínea superior a 1 mL, dado que se trataba de un individuo de bajo peso con mayor riesgo de muerte en cautiverio que los demás. De cada cultivo se procedió al extendido metafásico por goteo de cuatro o cinco láminas portaobjetos para su evaluación mediante las coloraciones diferenciales.
Para la tinción de bandas G se siguió el procedimiento desarrollado por SEABRIGHT (1971). Para la tinción de bandas C se siguió el procedimiento desarrollado por SUMNER (1972), ARRIGHI y HSU (1971). Para la tinción de bandas Q se siguió el procedimiento desarrollado por CASPERSSON et al. (1968).
De cada preparación en lámina se escogieron las mejores metafases según el extendido cromosómico y la definición de la imagen fotográfica. Los cariotipos fueron conformados mediante la organización de cromosomas homólogos, con la ayuda del software para cariotipificación Lucia Karyo (Lucia Cytogenetics, Laboratory Imaging s.r.o, Za Drahou 171/17, CZ-102 00 Praha 10-Hostivar).
Para la clasificación morfológica de los cromosomas se utilizaron los criterios de LEVAN et al. (1964). Los cromosomas se ordenaron con base en sus medidas (tamaño) y la posición del centrómero. Los cariotipos fueron impresos en imágenes ampliadas y se tomaron mediciones de los brazos cromosómicos. La morfología cromosómica fue estudiada a partir de la comparación de las longitudes del brazo largo (BL) y el brazo corto (BC). Para cada cromosoma se estimó la razón entre brazos (r), según la expresión r = BL/BC, y la longitud relativa (LR) expresada como porcentaje, dividiendo la longitud de cada cromosoma por la longitud total (LT) del complemento cromosómico haploide (LT = å BL + å BC), según la expresión LR = [(BL+BC)/LT]*100. También se estimó el índice centromérico (i), expresado como porcentaje, dividiendo la longitud del brazo corto por la longitud total del cromosoma (BL+BC), según la expresión: i = (BC/BL+BC)*100. Por simplicidad, los cromosomas fueron clasificados de acuerdo al rango de valor del índice centromérico en tres grupos así: en el grupo A de 37,5 a 50,0 metacéntricos (M), en el grupo B de 20,0 a 37,4 submetacéntricos (S) y en el grupo C de 0,0 a 19,9 acrocéntricos (A). En este trabajo se consideraron cromosomas de un solo brazo todos aquellos clasificados como acrocéntricos, incluyendo cromosomas telocéntricos y sub-telocéntricos, similar con el sistema de clasificación propuesto por TORRES et al., (1998).
Para cada cariotipo se estimó el número fundamental cromosómico (NF), como el número total de brazos autosómicos, contando el número de cromosomas (incluyendo el par sexual) con dos brazos (Bi) por dos más los acrocéntricos (A), de acuerdo a lo propuesto por NAGAMACHI et al. (2003), aunque éstos no incluyen el par sexual.
RESULTADOS
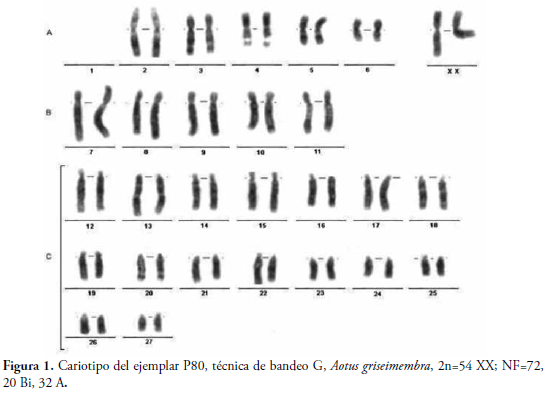
Análisis Cariológico: Se obtuvo el cariotipo para el ejemplar P80 correspondiente a una hembra adulta, mediante técnica de tinción de bandas G (Figura 1), con un número diploide total de 54 cromosomas y un número fundamental de 72, compuesto de 20 cromosomas de dos brazos y 32 cromosomas acrocéntricos (2n=54 XX; NF=72, 20 Bi, 32 A). Con el propósito de evitar confusión en la nomenclatura cromosómica, en donde la posición uno se reserva para la translocación 13/14, éste cariotipo no presenta dicho par.
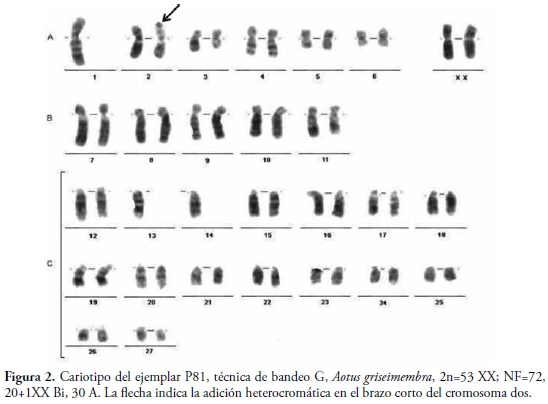
Para el ejemplar P81 se obtuvo su cariotipo con la técnica de tinción de bandas G (Figura 2), correspondiente a una hembra juvenil con un número diploide total de 53 cromosomas y un número fundamental de 72, compuesto de 20+1 autosomas y 2 X Bi y 30 cromosomas acrocéntricos (2n=53 XX; NF=72, 20+1XX Bi, 30 A).
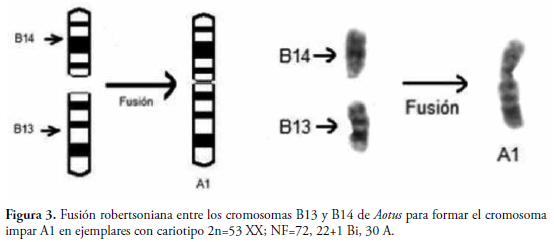
Interesantemente, en el cariotipo del ejemplar P81 se observó la ocurrencia de un cromosoma uno sin par homólogo, formado por una fusión robertsoniana simple de los cromosomas 13 y 14 (Figura 3), lo cual da como resultado otras dos monosomías para éstos cromosomas y a su vez, se hace evidente la presencia de cromosomas polimórficos en el par A2, por una banda terminal en brazos cortos.
Para el caso del ejemplar P82 no fue posible obtener el cariotipo completo, ya que se lograron observar pocas metafases, que además presentaron cromosomas sobrepuestos cuyos extendidos fueron difíciles de analizar morfológicamente. La escasez del volumen de la muestra de sangre disponible de dicho ejemplar no permitió realizar repeticiones del experimento de cultivo para intentar mejorar la calidad de las metafases. Sin embrago, se pudo establecer el número cromosómico diploide con un 2n=52 XX, con presencia de un par de cromosomas grandes correspondientes al par 1 en homocigosis para la traslocación robertsoniana antes descrita (t 13:14).
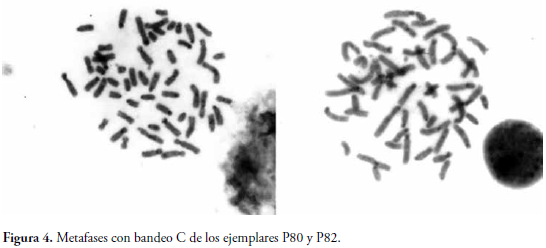
En cuanto al bandeo C para los ejemplares P80 y P82, se hizo evidente la presencia de pequeños bloques de heterocromatina constitutiva centromérica, la cual fue visible en casi todos los cromosomas del extendido mitótico (Figura 4).
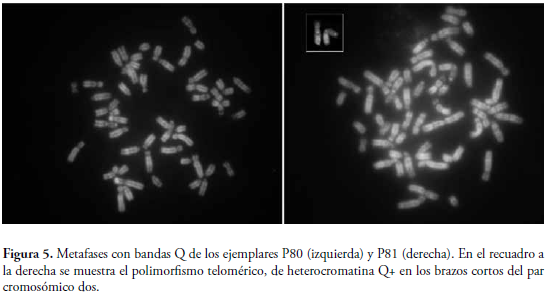
Finalmente, el patrón de bandas Q, es un patrón similar al G y muestra la presencia de heterocromatina terminal en los brazos cortos de muchos de los cromosomas del grupo C, para los tres ejemplares, éste a su vez reveló con claridad la presencia de bandas que corresponden a zonas de eucromatina ric as en AT de replicación tardía (Figura 5). Algunos telómeros sobresalen por su brillantez (Figura 5, recuadro), denotando la presencia de los polimorfismos heterocromáticos en los brazos cortos, previamente reportados para estas poblaciones del norte de Colombia (GIRALDO et al., 1986, TORRES et al., 1998).
Clasificación de los Cromosomas según Parámetros Morfológicos.
Para la conformación de cariotipos, se diferenciaron tres grupos principales de cromosomas (A, B y C), correspondientes a metacéntricos (M), submetacéntricos (S) y acrocéntricos (A) (Tabla 1), similar a lo propuesto por Torres et al. (1998).
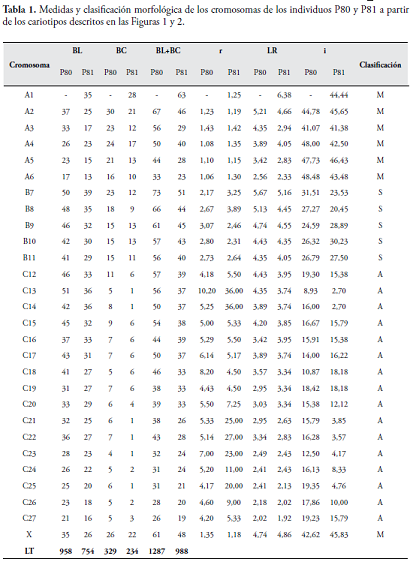
En el cariotipo de los Aotus estudiados, se encontraron tres grupos principales de cromosomas, clasificados según su morfología y tamaño. El grupo A está conformado por 7 cromosomas metacéntricos, (A1, A2, A3, A4, A5, A6 y X) variando intra-específicamente en el par A1, que puede no estar (Individuo P80, Figura 1 y Tabla 1), o presentarse como un elemento impar o par (Individuo P81, Figura 2 y Tabla 1). El grupo B se conforma de 5 pares de cromosomas submetacéntricos: B7, B8, B9, B10 y B11; el grupo C por 16 cromosomas acrocéntricos (C12-C27). En este grupo, nuevamente encontramos polimorfismos intra-específicos encontrándose cariotipos como el del individuo P81, con dos elementos impares (sin homólogo) en el C13 y C14, así como la no presencia de cromosomas C13 y C14 cuando la translocación robertsoniana es homocigota (individuo P82, cariotipo no mostrado). BL longitud del brazo largo en mm, BC longitud del brazo corto en mm, r razón entre brazos, LR longitud relativa, i índice centromérico, M, metacéntrico, S submetacéntrico, A acrocéntrico. Las estimaciones (en mm) y la clasificación cromosómica se realizaron como se indica en materiales y métodos.
DISCUSIÓN
El análisis cariológico permitió identificar claramente el número cromosómico de los tres individuos estudiados del género Aotus. Éstos presentan cariotipos correspondientes al grupo de cuello gris, que según GIRALDO et al. (1986) pertenecen a los cariotipos KIII y KIV (MA, 1981, DEFLER y BUENO, 2007), identificados como Aotus griseimembra. Los tres ejemplares pertenecen al cariomorfo 2 según el sistema de clasificación de TORRES et al. (1998), lo cual los ubica probablemente como individuos procedentes de poblaciones del Magdalena Medio hasta la zona costera norte del Atlántico colombiano.
Se pudieron conformar los cariotipos completos de dos individuos. El ejemplar P80 corresponde al grupo cariológico KIV, y se caracteriza por tener un número diploide de 2n=54 (NF= 72; 20 +XX Bi, 32 A) (Figura 1). Por su parte, el ejemplar P81 se pudo caracterizar como perteneciente al grupo cariológico (cariomórfo) KIII (Fig. 2), con 2n=53 (NF= 72; 20+1+XX Bi, 30 A). Interesantemente, se advierte en este cariotipo la ocurrencia de un cromosoma 1 formado por una fusión robertsoniana simple de los cromosomas 13 y 14, lo cual genera tres elementos sin homólogos, el 1, 13 y 14, (Figuras 2 y Figura 3), polimorfismo fijo, en esta población descrito previamente por MA et al., (1976). Aunque para el ejemplar P82 no se obtuvieron todas las tinciones cromosómicas propuestas, ni la calidad de las metafases permitió la conformación del cariotipo, dada la escases de muestra sanguínea, sólo fue posible determinar el número cromosómico, el cual corresponde al cariomórfo KII, 2n = 52, también característico de A. griseimembra.
Esto confirma la importancia que supone la determinación de descriptores confiables de la morfología cromosómica, por la posibilidad de utilizarlos como marcadores citogenéticos en el establecimiento de las poblaciones de origen, asimismo como indicadores de la diversidad cariológica que existe en el complejo de especies de Aotus.
El número fundamental cromosómico (NF) es un parámetro valioso desde el punto de vista citogenético y evolutivo, dado que sus variaciones pueden relacionarse con rearreglos cromosómicos notorios con consecuencias potencialmente importantes en la historia evolutiva de las especies de este género. Sin embargo, se sabe que las diferencias en el NF pueden depender seriamente del criterio de clasificación cromosómica y de las mediciones morfológicas que permiten diferenciar cromosomas de dos brazos y de un solo brazo (LEVAN et al., 1964; LORENZO y ROJAS, 2002).
Las variaciones entre cariotipos, tanto a nivel de morfología como de NF, pueden afectar las comparaciones entre poblaciones dentro de complejos de especies o incluso cariotipos de distintos individuos de la misma especie dentro de una misma población. Entre las principales fuentes de esta variación se mencionan aspectos biológicos como la morfología y el tamaño de los cromosomas, además de aspectos técnicos como los efectos de la colchicina sobre la constricción de éstos, la acción de los fijadores, el tamaño de los cromosomas al momento de ser fijados (estadio de división celular) y el criterio subjetivo para la clasificación (ARIAS-RODRÍGUEZ et al., 2006). Esto resalta la importancia de encontrar marcadores citogenéticos confiables, cuya detección sea menos susceptible a problemas técnicos o subjetivos. Entre estos marcadores se destacan las fusiones y fisiones cromosómicas, las bandas anchas heterocromáticas o eucromáticas, las constricciones cromosómicas, la determinación exacta del centrómero y los contrastes crómicos que se hacen evidentes al comparar métodos de bandeo.
En este trabajo fue posible identificar los elementos del complemento cromosómico de los individuos P80 y P81. En ambos cariotipos pudo observarse un marcador citogenético confiable que se presenta típicamente en el par A4 (Figura 1 y 2), consistente en una notable banda clara en la región telomérica del brazo largo, lo cual coincide con lo descrito por MA et al. (1976), quienes afirman que dicha banda en el par de homólogos A4 es un marcador del cariomórfo II por representar una constricción secundaria en el brazo largo de dicho cromosoma.
La técnica de tinción para bandas C permitió identificar la distribución de la heterocromatina constitutiva en los individuos P80 y P82 (Figura 4), los que exhiben un patrón de distribución característico en bloques pequeños, visible para casi todos los cromosomas, lo cual permitió identificar las zonas de heterocromatina pericentromérica, que son de gran ayuda para la caracterización morfológica de cada par cromosómico, permitiendo una ubicación exacta del centrómero.
En cuanto a el patrón de bandeo observado para los tres individuos en las metafases tratadas para bandas Q, se evidenció la presencia de telómeros brillantes, que según ORTIZ et al. (2005) debería corresponder con el patrón mostrado para las bandas G positivas. Este hecho sólo se pudo evidenciar en los telómeros del cromosoma dos (Figs. 2 y 5). Además se pudo observar en las metafases que todos los cromosomas presentaron las regiones centroméricas opacas.
En este trabajo se encontraron algunas dificultades para la determinación de ciertas medidas, en particular en lo que respecta a los brazos cortos del grupo C, debido a la corta longitud del brazo corto, la baja resolución de las imágenes y la posición espacial en que quedaron fijados algunos cromosomas. Por estas razones, el presente trabajo se decidió agrupar a todos los cromosomas con i£19.9 en un mismo conjunto denominado como el grupo C y clasificarlos como acrocéntricos, el cual incluye telocéntricos y algunos subtelocéntricos (Tabla 1). Ello concuerda con lo reportado por YUNIS et al. (1977).
Los análisis morfológicos de los cromosomas permitieron identificar en el individuo P80 (2n=54 XX; NF= 72; 20 Bi, 32 A) seis pares de cromosomas metacéntricos, incluyendo el par sexual XX, cinco pares submetacéntricos y 16 pares acrocéntricos, incluyendo algunos telocéntricos y subtelocéntricos, lo que concuerda con lo publicado por TORRES et al. (1998), para dicho cariotipo con cinco pares cromosómicos metacéntricos más el par sexual, cinco submetacéntricos y 16 acrocéntricos (Tabla 1).
En el mismo sentido, se identificaron para el individuo P81 (2n=53 XX; NF=72, 20+1XX Bi, 30 A) seis pares de cromosomas metacéntricos, incluyendo el par sexual XX, más un elemento impar debido a una fusión robertsoniana entre el 13 y el 14, cinco pares submetacéntricos y 14 pares acrocéntricos, más dos elementos impares 13 y 14 (Figura 3 y Tabla 1).
Esto concuerda con lo hallado por TORRES et al. (1998) y se acerca a los hallazgos de YUNIS et al. (1977), que describe un individuo 2n=53 con cuatro pares metacéntricos más un elemento impar, siete pares de submetacéntricos y 13 pares de acrocéntricos más dos elementos impares; dicho trabajo no clasificó el par sexual en ninguna categoría.
La evaluación del rol que desempeñan las traslocaciones robertsonianas en el proceso de especiación como mecanismo involucrado en el establecimiento de un aislamiento reproductivo de tipo cromosómico, necesariamente debe considerar en primera instancia el análisis teórico del comportamiento del re-arreglo durante la meiosis. (DESCAILLEAUX et al., 1990). Los resultados obtenidos indican un polimorfismo cromosómico en los elementos 13 y 14, derivado de una traslocación robertsoniana simple de estos cromosomas en el cariomórfo del individuo P81 con 2n=53. Dicha traslocación está ausente en el individuo P80 con 2n=54. Ello coincide con lo descrito por GIRALDO et al. (1986), donde igualmente se presenta una fusión telómero-telómero y se rechaza la propuesta por MA et al. (1976), que involucran una inversión-deleción adicional como modelo para explicar este rearreglo cromosómico.
Según lo citado por GIRALDO et al. 1986; TORRES et al. 1998 y DEFLER et al. 2001, se puede asumir que las tres hembras de Aotus griseimembra, provienen probablemente de poblaciones que hacen parte del Magdalena Medio hasta la costa Atlántica, lo cual es una información útil que facilitaría la reubicación de dichos individuos por parte de los centros de rehabilitación de fauna silvestre y estaciones de paso, encargadas de dicha labor, después de que los individuos son decomisados al tráfico ilegal de especies.
Otros estudios han demostrado que no existen barreras reproductivas evidentes en los cruces efectuados entre individuos del complejo Aotus griseimembra (GIRALDO et al., 1986). En el mismo sentido, existe evidencia de que las diferencias cariológicas son un simple polimorfismo que no influye en la reproducción y no parece existir presión selectiva eficaz contra alguno de los cariotipos, ni fertilidad reducida en los cruces heterólogos del grupo de Aotus (KII, KIII y KIV). Esto no excluye la existencia de otras razones de tipo genético que deban considerarse para minimizar el riesgo de incompatibilidad poblacional asociada a la reintroducción al hábitat silvestre de lo ejemplares capturados, considerando, por ejemplo, la importancia de mantener la mayor adaptabilidad posible (LACY, 1995). En este caso, los marcadores citogenéticos confiables se deben considerar únicamente como una herramienta adicional para la caracterización poblacional que, combinada con otros métodos como los moleculares, los de morfología y los de biogeografía, guíen de manera más racional el proceso de reubicación de ejemplares decomisados al tráfico ilegal de especies.
Los resultados del presente estudio permiten suponer que las hembras analizadas son óptimas para adelantar programas de conservación mediante reproducción ex situ, ya que éstas hacen parte de una sola especie, Aotus griseimembra, en la que no se presenta incompatibilidad reproductiva entre los cariomórfos que la constituyen. Es necesario que tanto zoológicos que llevan a cabo procesos de reproducción ex situ, así como los Centros de Atención y Valoración de Fauna Silvestre (CAVS) y los Centros de Rehabilitación de Fauna Silvestre (CRFS) en Colombia como sus homólogos en otros países, que adelanten planes de rehabilitación, conservación y liberación, implementen de manera obligatoria análisis genéticos que incluyan pruebas cariológicas y moleculares, con el fin de potenciar el éxito reproductivo; evitando cruces entre especies diferentes o la reubicación en zonas geográficas poco o nada compatibles con las características del origen y la distribución de los especímenes.
AGRADECIMIENTOS
A Carolina Arango, Laura Rengifo del laboratorio de Citogenética del Instituto de Genética de la Universidad Nacional-Bogotá, Alejandro Clavijo por su colaboración durante casi todo el tiempo de ejecución del proyecto. A Orlando Díaz, Bernardo Sánchez, Amparo Sánchez, Jorge Enrique Pérez, María Helena Álvarez y Margarita Díaz de la Universidad de Caldas, por el préstamo de equipos y espacios de laboratorio para realizar algunos procedimientos. A la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas como al Grupo de Investigación Genética, biodiversidad y fitomejoramiento (GEBIOME), por la financiación del proyecto.
BIBLIOGRAFÍA
ARIAS-RODRÍGUEZ, L., PÁRAMO-DELGADILLO, S., DURÁN- GONZÁLEZ, A. L., 2006.- Caracterización citogenética del pez tropical de agua dulce Parachromis managuensis (Pisces: Cichlidae). Rev. Biol. Trop. 54: 35-42. [ Links ]
ARRIGHI, F. E., HSU, T. C., 1971.- Distribution of constitutive heterochromatin in mammalian chromosomes Chromosoma (Berl.). Vol 34. pp. 243-253. [ Links ]
BARRAGÁN, K., 2005.- Citogenética en Cérvidos, con énfasis en Venado de Cola Blanca (Odocoileus virginianus). Revista de la Asociación de Veterinarios de Vida Silvestre. 1, (1): 3-9. [ Links ]
BENIRSHCKE, K., KUMAMOTO, A., 1991.- Mammalian cytogenetics and conservation of species. The Journal of Heredity. 82: 187-191. [ Links ]
BRUMBACK, R. A., 1973.- Two Distinctive Types of Owl Monkeys (Aotus). J. Med. Primatol. 2: 284- 289. [ Links ]
BRUMBACK, R. A., 1974. A third species of the owl monkey Aotus. Journal of Heredity 65:321-323. [ Links ]
BRUMBACK, R. A.; STATON, R. D; BENJAMIN, S.A., LANG, C. M., 1971.- The Chromosomes of Aotus trivirgatus Humboldt 1812. Folia Primatol 15: 264- 273. [ Links ]
BUENO, M. L., 2003.- Importancia de la caracterización genética de especies silvestres en Zoológicos, Unidades de Rescate de fauna y Centros de acopio. Lyonia .3, (1): 45-55. [ Links ]
CASPERSSON, T.; FABER, S.; FOLEY, G. E.; KUDYNOWSKI, J.; MODEST, E.J.; SIMONSSON, E.; WAGH, U.; ZECH, L., 1968.- Chemical Differentiation Along Metaphase Chromosomes. Experimental Cell Research. 49 (1): 219-22. [ Links ]
CASTRILLON, H. J., 2009.- Caracterización cariotípica del genero Aotus (Primates: Aotidae) depositados en el Centro de Atención y Valoración de Fauna Silvestre CAV, Departamento del Quindío Colombia. Trabajo de Grado, Universidad del Quindío pp. 23. [ Links ]
DEFLER, T. R., 2003. Primates de Colombia. Conservación Internacional. Serie de guías tropicales de campo. J. V. Rodríguez-Maecha, (ed.) Conservación Internacional, Bogotá, D. C., Colombia. 543. [ Links ]
DEFLER, T. R., BUENO, M. L., 2007.- Aotus Diversity and Species Problem. Primate Conservation. 22:55-70 [ Links ]
DEFLER, T. R., BUENO, M. L., HERNÁNDEZ-CAMACHO, J., 2001.- Taxonomic Status of Aotus hershkovitzi: Its Relationship to Aotus lemurinus lemurinus. Neotropical Primates 9 (2): 37- 52. [ Links ]
DEFLER, T. R., & M. L., BUENO., 2003.- Karyological guidelines for Aotus taxonomy. [abstract] Twenty Sixth Annual American Society of Primatology Conference, Calgary, Canada American Journal of Primatology. 60: Suppl.1:134-135. [ Links ]
DESCAILLEAUX, J.; FUJITA, R.; RODRÍGUEZ, L.A.; AQUINO, R.; ENCARNACION, F., 1990. Rearreglos Cromosómicos y Variabilidad Cariotípica del género Aotus (Cebidae: Platyrrhini). La Primatología en el Perú. En: Invetigaciones Primatológicas (1973–1985), Proyecto Peruano de Primatologia "Manuel Moro Sommo" (ed.), pp. 572–577. [ Links ]
GALBREATH, G. J., 1983.- Karyotypic evolution in Aotus. American Journal of Primatology. 4: 245-251. [ Links ]
GIRALDO, A.; BUENO, M. L.; SILVA, E.; RAMÍREZ, J.; UMAÑA, J.; ESPINAL, C. 1986.- Estudio Citogenético de 288 Aotus Colombianos. Biomedica. 6 (1- 2). [ Links ]
HERSHKOVITZ, P., 1983.- Two New Species of Night Monkeys, Genus Aotus (Cebidae: Platyrrhini): A Preliminary Report on Aotus Taxonomy. American Journal of Primatology. 4: 209-243. [ Links ]
LACY, R. C., 1995.- What is a Population (and Habitat) Viability Analysis?. Primate Population Viability Analysis Symposium. XVth Congress of The International Primatological Society, Bali, Indonesia, August 1994. Primate Conservation 1993-1994 (14-15): 27-33. [ Links ]
LEVAN, A.; FREDGA, K. & SANDBERG, A., 1964.- Nomenclature for Centromeric Position on Chromosomes. Hereditas 52: 201-220. [ Links ]
LORENZO, M. C. & ROJAS, V. R., 2002.- Diversidad de Pinnípedos, un enfoque cromosómico. Ciencia y. Desarrollo 26: 62-69. [ Links ]
MA, N. S. F., 1981.- Chromosome evolution in the owl monkey. American Journal of Physiology and Anthropolgy, 54: 294 –304. [ Links ]
MA, N. S. F.; JONES, T. C.; MILLER, A. C.; MORGAN, L. M.; ADAMS, E. A., 1976.- Chromosome Polyorphism and Banding Patterns in the Owl Monkey (Aotus). Laboratory Animal Science. 26 (6): 1022-1036 Part II of Two Parts. [ Links ]
MA, N. S. F.; ROSSAN, R. N.; KELLEY, S. T.; HARPER, S. J; BEDARD, M. T.; JONES, T. C., 1978.- Banding patterns of the chromosomes of two new karyotypes of the owl monkey Aotus captures in Panamá. J Med Primat; (7): 146-147. [ Links ]
Manual de Procedimientos de Laboratorio de Citogenética del Instituto de Genética de la Universidad Nacional de Colombia, Bogotá (MPLC-IGUN). 2009. [ Links ]
MOORHEAD, R.S.; HOWELL, P.C.; MELLMAN, W.J.; BATTEPS, D.M. & HUNDGERFORD, D.A., 1960.- Chromosomes preparations of leukocytes cultured from human peripheral blood. Experimental Cellular Research, 2: 613-616. [ Links ]
NAGAMACHI, C. Y.; RODRIGUEZ, L. R.; GALETTI, Jr. P. M.; MANTOVANI, M.; PISSINATI, A.; RISSINO, J. D.; BARROS, R. M. S. & PIECZARKA, J. C., 2003.- Cytogenetic studies in Callicebus personatus nigrifrons (Platyrrini, Primates). Caryologia. 56: 47-52. [ Links ]
ORTIZ, M. L.; RODRÍGUEZ, P. A.; BUENO, M. L., 2005.- Caracterización Citogenética de la Tortuga Sabanera Podocnemis vogli (reptilia: testudinata: podocnemididae). Acta Biólogica Colombiana. 10 (1): 19-33. [ Links ]
PIECZARKA, J. C & NAGAMACHI, C. Y., 1988.- Cytogenetic studies of Aotus from Eastern Amazonia: Y/ Autosome rearrangement. American Journal of Primatology. 14: 255-263. [ Links ]
RODRÍGUEZ-MAECHA, J. V.; ALBERICO, M.; TRUJILLO, F., & JORGENSON, J. (Eds.) 2006.- Libro Rojo de los Mamíferos de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Conservación Internacional Colombia y Ministerio de Ambiente, Vivienda y Desarrollo, Bogotá, Colombia, pp. 433 [ Links ]
SEABRIGHT, M., 1971.- A rapid banding technique for human chromosomes. Lancet 2: 971. [ Links ]
SUMNER, A. T., 1972.- A simple technique for demostrating centromeric heterochromatin. Experimental Cell Research . Vol. 75: 304-305. [ Links ]
TEJEDOR M, F., 2001.- Aotus y los Atelinae: Nuevas evidencias en la sistemática de los primates platirrinitos. Mastozoología Neotropical. 8 (1): 41-57. [ Links ]
TORRES, O. P.; ENCISO, S.; RUIZ, F.; SILVA, E.; IVAN, Y., 1998.- Chromosome diversity of the genus Aotus from Colombia. American journal of primatology. 44: 255-275. [ Links ]
YUNIS, E.; TORRES, O. M. de C.; RAMÍREZ, C., 1977.- Genus Aotus: Q and G-band karyotypes and natural hybrids. Folia Primatológica. 27: 165-177. [ Links ]













