Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.16 no.2 Manizales July/Dec. 2012
IDENTIFICATION OF PLANT PHYTOPARASITE NEMATODES IN YELLOW PITAHAYA (Selenicereus megalanthus HAW.)
* FR: 12-III-2011. FA: 14-V-2012.
1 M.sc. universidad de Caldas. Facultad de Ciencias Agropecuarias. Manizales, Caldas. Correo electrónico: oscar.guzman@ucaldas.edu.co
2, 3 Asociación de Productores de Pitahaya Amarilla. ASOPPITAYA. Roldanillo, Valle del Cauca. Correo electrónico: asoppitaya.tecnico@etb.net.co
Los nematodos fitoparásitos causan lesiones en el sistema radical de la pitahaya afectando su crecimiento vegetativo y reproductivo. El objetivo de este estudio fue caracterizar los fitonematodos que afectan el sistema radical de la pitahaya amarilla en fincas afiliadas a la Asociación de Productores de Pitahaya Amarilla (ASOPPITAYA). Se recolectaron muestras de raíces y suelo en 22 fincas de los departamentos de Quindío, Risaralda y Valle del Cauca. Se realizó la extracción de fitonematodos por el método de centrifugación y flotación en azúcar, además de su identificación con claves taxonómicas. Se identificó la especie Helicotylenchus dihystera y los géneros Meloidogyne, Dorylaimus, Tylenchus, Aphelenchus y Pratylenchus, con una frecuencia del 100, 50, 27, 23, 14 y 5%, respectivamente. H. dihystera presentó la población mayor con 12.360 individuos/100g de raíces y suelo; seguido por Meloidogyne con 2.742 estados juveniles (J2)/100g de raíces y suelo. Se demostró que H. dihystera es el nematodo fitoparásito más limitante en pitahaya, haciéndose necesario monitorear sus poblaciones e implementar medidas de manejo integrado.
Palabras clave: Fitonematodos, frecuencia, Helicotylenchus dihystera, Meloidogyne.
AbstractThe phytoparasite nematodes cause lesions in the pitahaya roots system affecting both the vegetative and reproductive growth. The objective of this study was to characterize the phytonematodes affecting the roots system of yellow pitahaya in farms affiliated to the Association of Producers of Yellow Pitahaya (ASOPPITAYA). Samples of roots and soil were collected in 22 farms of the departments of Quindío, Risaralda and Valle del Cauca. The phytonematodes samples were extracted following the centrifugation and flotation in sugar method, and identified using taxonomic keys. The specie Helicotylenchus dihystera was identified and the genera Meloidogyne, Dorylaimus, Tylenchus, Aphelenchus and Pratylenchus were also recognized , with a frequency of 100, 50, 27, 23 and 5%, respectively. H. dihystera presented the highest population with 12,360 individuals/ 100g of roots and soil; followed by Meloidogyne with 2,742 juvenile stages (J2)/100g of roots and soil. It was demonstrated that H. dihystera is the most limitant phytoparasite nematode of pitahaya, requiring monitoring of its populations to implement integrated management practices.
Key words: Phytonematodes, frequency, Helicotylenchus dihystera, Meloidogyne.
La pitahaya (Selenicereus megalanthus Haw.) es una fruta exótica originaria de América tropical que fue observada por primera vez en forma silvestre por los conquistadores españoles en México, Colombia, Centroamérica y las Antillas, quienes le dieron el nombre de pitahaya que significa fruta escamosa. Es una planta de la familia Cactácea, xerofítica, caracterizada por ser un cactus trepador que crece soportada en emparrado, con tallos triangulares largos y con flores encarnadas de belleza espectacular. La planta produce frutos ovoides comestibles que antes de ser cosechados tienen espinas en sus mamilas, son de color verde al comienzo y amarillos en la madurez, con un peso entre 150 y 380g. Su pulpa es blanca y aromática con semillas pequeñas de color negro que son comestibles (ESSO AGRÍCOLA, 1988). Es una fruta dulce con 13 a 16% de azúcar, posee además vitamina C, fibra, carbohidratos y agua en un 80%. La fruta permite ser consumida como producto fresco o procesado en jugos, cocteles, helados, yogur y mermeladas; sus semillas tienen efecto digestivo (ANGELFIRE, 2009).
La pitahaya amarilla, se comenzó a cultivar comercialmente en Colombia al inicio de la década de los 80's, principalmente con fines de exportación, promovida como cultivo de diversificación en zonas cafeteras por el Programa de Desarrollo y Diversificación de la Federación Nacional de Cafeteros (1987). Actualmente, Colombia es el principal productor de pitahaya amarilla a nivel mundial con 827 ha, seguida por Israel, Brasil, Ecuador, Perú y Guatemala con 100, 35, 20, 18 y 14 ha, respectivamente (AGRONET, 2009). En Colombia, existen aproximadamente 400 productores de pitahaya con 827 ha, con cultivos que tienen más de 973.599 plantas con una producción de 1.550 ton año-1 (UNIVERSIDAD NACIONAL, 2008), de las cuales 236 ha están sembradas en el Valle del Cauca con una producción de 12.5 ton ha-1, que es el principal productor, seguido por Boyacá, Bolívar, Huila y Santander con un área y producción de 333 ha y 7,5 ton ha-1; 75 ha y 11,1 ton ha-1; 67 ha y 8 ton ha-1 y 49 ha y 7,9 ton ha-1, respectivamente (AGRONET, 2009).
En Colombia, la transición rápida de la pitahaya amarilla como planta silvestre a cultivo comercial, sin que se dispusiera de un paquete tecnológico adecuado debido a que no existía investigación sobre el cultivo, conllevó a grandes problemas de manejo, especialmente en aspectos fitosanitarios, que ocasionaron una disminución de la productividad y calidad de la fruta y, por ende, una menor rentabilidad del cultivo (ANGELFIRE, 2009). Dentro de los principales problemas fitosanitarios del cultivo de pitahaya están la mosca del botón floral (Dasiops spp.), la pudrición basal del fruto y marchitez (complejo Fusarium oxysporum - Fusarium oxysporum f. sp. melonis), la Antracnosis (Colletotrichum gloeosporioides) y los nematodos fitoparásitos (Meloidogyne spp., Helicotylenchus spp., Pratylenchus spp., y Tylenchorhynchus spp.) (CASTAÑO & SALAZAR, 1987; RINCÓN et al., 1989; ARAUJO & MEDINA, 2008; ROJAS et al., 2008).
Según RINCÓN et al. (1989), VARÓN (2006), ARAUJO & MEDINA (2008) y ROJAS et al., (2008), en los cultivos de pitahaya amarilla del Valle del Cauca, el nematodo del nudo radical Meloidogyne spp., es el más importante por su tasa de reproducción, amplio rango de hospedantes y adaptación a diferentes ambientes. En el sistema radical, los síntomas primarios ocasionados por Meloidogyne spp., son ramificaciones anormales con raíces hinchadas "engrosadas" y con agallas o nudosidades donde se encuentran las hembras del nematodo. Producto de este daño, después de Reconocimiento de nematodos fitoparásitos en pitahaya amarilla 151 los 6 meses de establecido el cultivo, en la parte aérea se presentan síntomas secundarios como tallos amarillos y angostos, flacidez y raquitismo de pencas, muerte de brotes, detención del crecimiento y menor producción (RINCÓN et al., 1989; VIDAL & NIETO, 1989; DE WAELE & DAVIDE, 1998; VARÓN, 2006; ROJAS et al., 2008; PERRY et al., 2009).
El nematodo espiral Helicotylenchus spp., es polífago (LUC et al., 2005), y también ha sido registrado parasitando el sistema radical de la pitahaya (RINCÓN et al., 1989; ARAUJO & MEDINA, 2008). Biológicamente y dependiendo del hospedante, el hábito alimenticio de Helicotylenchus spp., se caracteriza por ser ectoparásito, semiendoparásito o endoparásito de raíces. Todos los estados pueden ser encontrados en el córtex de las raíces, pero la migración a través del tejido no ha sido registrada. Producto del parasitismo, en la epidermis de las raíces se forman lesiones pequeñas circulares de color café obscuras tornándose negras, las cuales pueden llegar a ser necróticas. La mayoría de especies son partenogenéticas aunque una de las más comunes y dañinas, H. multicinctus, es amphimictica (LUC et al., 2005).
Otro fitonematodo registrado en la pitahaya es el nematodo lesionador Pratylenchus spp., (VARÓN, 2006), que es un endoparásito migratorio con todos sus estados encontrados en el córtex. Se alimenta principalmente sobre las células del córtex y forma cavidades que contienen nidos o colonias con todos sus estados. Producto del ataque del nematodo, se presenta decoloración del tejido afectado, que es usualmente pronunciada. Los síntomas en la parte aérea incluyen clorosis y enanismo. El ciclo de vida puede completarse en 4 semanas y puede sobrevivir en ausencia del hospedante por varios meses. Las especies más importantes son polífagas como P. brachyurus, P. coffeae, P. goodeyi, P. penetrans, y P. zeae (GOWEN et al., 2005; AGRIOS, 2005; LUC et al., 2005; CASTILLO & VOVLAS, 2007).
Debido al daño que ocasionan los nematodos fitoparásitos en el sistema radical de la pitahaya, se realizó este estudio cuyo objetivo fue caracterizar los nematodos fitoparásitos que afectan el sistema radical de la pitahaya amarilla en fincas afiliadas a la Asociación de Productores de Pitahaya Amarilla, ASOPPITAYA.
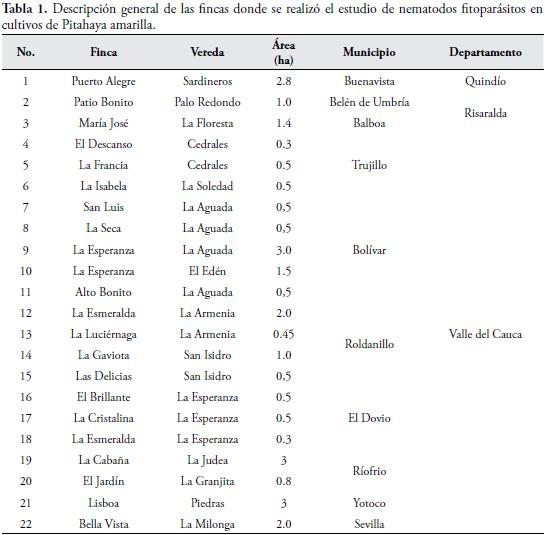
MATERIALES Y MÉTODOSEl estudio se realizó en 22 cultivos de pitahaya amarilla, abarcando un área cultivada de aproximadamente 26 ha, en los departamentos de Quindío, Risaralda y Valle del Cauca en predios afiliados a ASOPPITAYA, ubicada en Roldanillo, Valle del Cauca, Colombia (Tabla 1). La selección de las fincas, donde se recolectaron las muestras se efectuó con la ayuda de ASOPPITAYA, y el criterio de selección se basó en que ellas fueran representativas de cada municipio por su producción y prácticas de cultivo.
En el lote de cada finca, el recorrido para la recolección de las muestras se hizo de acuerdo a la topografía del terreno, en zig-zag (terreno ondulado) y en X (terreno plano), siempre garantizando que al recolectar las muestras se cubriera la mayor área posible y no se tomaran muestras de los bordes del lote. En el plato de 10 plantas de pitahaya se recolectó una muestra de 200 g de raíces y 200 g de suelo, en los cuatro puntos cardinales (oriente, occidente, norte y sur), las cuales se depositaron en un balde de 20 L de capacidad, para formar una muestra compuesta (unidad de muestreo) que posteriormente se mezcló, homogeneizó y empacó (2 kg) en una bolsa de plástico. Este procedimiento se realizó tres veces en cada lote a una distancia de 7 m entre cada planta. Las muestras se extrajeron con un palín de hoja rectangular (13 x 50 cm de ancho y largo, respectivamente) a una distancia de entre 5 y 20 cm del cuello de las plantas y una profundidad de 10 a 20 cm, en un hoyo de 13 cm de largo y ancho y 20 cm de profundidad. Posteriormente, se rotuló e identificó la información correspondiente al propietario, finca, vereda, municipio, departamento y área del lote (Tabla 1).
En los laboratorios de Fitopatología del departamento de Fitotecnia de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas y Diagnóstico Fitosanitario del ICA, Palmira, se realizó la extracción de nematodos basados en el principio de flotación de los nematodos en azúcar (MEREDITH, 1973; ARAYA et al., 1995). El procedimiento se realizó de la siguiente manera: las raíces se lavaron con agua corriente, después de dejarlas secar a temperatura ambiente, se pesaron 30 g de ellas en una balanza Analytical Plus, marca Ohaus, y con la ayuda de tijeras se cortaron transversalmente trozos de raíces de 1 cm, que luego se homogenizaron Reconocimiento de nematodos fitoparásitos en pitahaya amarilla 153 (ARAYA et al., 1995). Tales trozos se colocaron dentro del vaso de una licuadora Osterizer, modelo 565-15, con 500 mL de agua, luego se licuaron a alta velocidad por 30 seg. La solución del licuado fue depositada en un tamiz de 250 um el cual estaba colocado sobre un tamiz de 106 um, y éste sobre otro de 25 um. La muestra se lavó con agua a presión para que hubiera desprendimiento de los nematodos, y del material que quedaba en el tamiz de 25 um, luego se depositó todo su contenido en tubos de centrifugación de 30 mL de capacidad. Posteriormente, se centrifugó a 3.800 rpm durante 5 min. Como consecuencia de la centrifugación hubo sedimentación de las partículas pesadas en el fondo del tubo y se procedió a eliminar el sobrenadante. Seguidamente, los tubos fueron llenados nuevamente con solución de sacarosa al 50% y sometidos a centrifugación a 3.800 rpm durante 5 min con el propósito de que los nematodos quedaran flotando en la solución de sacarosa por densidad diferencial y fueran separados de las partículas más pesadas. Luego el sobrenadante se depositó en el tamiz de 25 um para lavar la sacarosa con agua corriente a presión baja y evitar que los nematodos fueran afectados por ésta. Finalmente se recogieron 20 mL de agua con nemáatodos en una caja de Petri. La extracción de nemtodos de suelo se realizó de similar manera, omitiendo el procedimiento de licuado.
En cada muestra se registró el número de nemáatodos fitoparásitos en 100 g de raíces y en 100 g de suelo. La identificación de fitonemátodos se realizó recolectando 30 nematodos de cada caja de Petri, los cuales se montaron en un porta-objetos con una gota de agua que se cubrió con un cubre-objetos y se observaron en el microscopio compuesto de luz marca Nikon a través del objetivo 40X.
Con los nematodos encontrados se obtuvieron promedios para la variable número de nematodos fitoparásitos; se estimó el número de éstos para cada especie de acuerdo con su identificación, y en cada especie se estableció en qué proporción de las muestras se encontraba. La identificaron de nematodos fitoparásitos se realizó con las claves taxonómicas de THORNE (1961), MAGGENTI et al., (1987), LUC et al. (1990), HUNT (1993); MAI et al. (1996), SIDDIQI (2000), CASTILLO & VOVLAS (2008) y PERRY et al. (2009).
RESULTADOS Y DISCUSIÓNEn las 22 fincas muestreadas se encontraron principalmente los géneros Helicotylenchus y Meloidogyne en una frecuencia del 100 y 50%, respectivamente (Tabla 2).
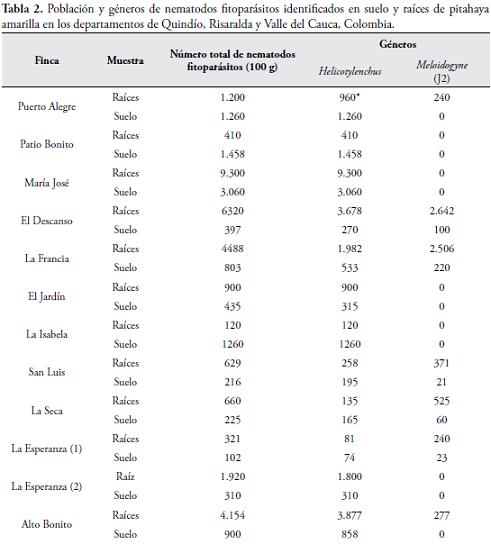
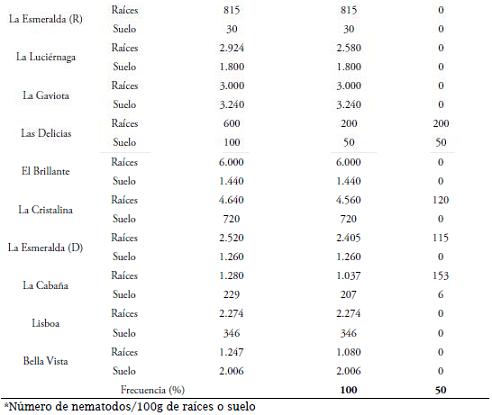
Con menor frecuencia se encontraron Dorylaimus spp., Tylenchus spp., Aphelenchus spp., y Pratylenchus spp., con una frecuencia de 27, 23, 14 y 5%, respectivamente (datos no mostrados). Estos resultados difieren ligeramente de los obtenidos por RINCÓN et al. (1989) en el Valle del Cauca, Cauca y Quindío, quienes obtuvieron para Meloidogyne spp., una frecuencia de 81 y 65% en suelo y raíces, respectivamente; además de una frecuencia de 86 y 29%, respectivamente para Helicotylenchus spp. La mayoría de los nematodos identificados en este estudio han sido reportados parasitando el sistema radical de la pitahaya (RINCÓN et al., 1989; VIDAL & NIETO, 1989; VARÓN, 2006; ROJAS et al., 2008), y otros cultivos de importancia económica como arroz, trigo, maíz, plátano, banano, maíz, yuca, sorgo, etc. (SIDDIQI, 2000; AGRIOS, 2005; CASTILLO & VOVLAS, 2008; y PERRY et al., 2009). Los géneros Helicotylenchus, Meloidogyne y Pratylenchus, también han sido encontrados por RINCÓN et al. (1989) y ARAUJO & MEDINA (2008), parasitando el sistema radical de la pitahaya.
Igualmente, los nematodos que se presentaron con mayor frecuencia, Helicotylenchus spp., y Meloidogyne spp., fueron los que tuvieron las mayores poblaciones, las cuales variaron de acuerdo al sitio de muestreo. En seis de las 22 fincas, es decir, en el 27%, las poblaciones de Helicotylechus spp., oscilaron entre 3.000 y 9.300 nematodos/100g de raíces (Tabla 2). Esta última población se halló en la finca María José, vereda La Floresta, municipio de Balboa, departamento de Risaralda. Altas poblaciones de Meloidogye spp., sólo se encontraron en las fincas El Descanso y La Francia, de la vereda Cedrales, municipio de Trujillo, departamento del Valle del Cauca, con valores de 2.642 y 2.506 estados juveniles (J2)/100g de raíces, respectivamente (Tabla 2). En general, en todas las fincas donde se realizó el estudio, Helicotylenchus spp., en relación con Meloidogyne spp., no sólo presentó mayor frecuencia, sino también mayores poblaciones. En las muestras de suelo, Helicotylenchus spp., asimismo presentó las poblaciones más altas en siete de las 22 fincas, es decir, en el 32%, con valores que oscilaron entre 1.260 y 3.240 nematodos/100g de suelo, correspondiendo esta última población a la finca La Gaviota, municipio de Roldanillo, departamento del Valle del Cauca (Tabla 2).
Las poblaciones anteriores fueron mayores y al contrario, a las obtenidas por RINCÓN et al. (1989), quienes encontraron poblaciones de Meloidogyne spp., con un promedio de 877 nematodos/g de raíces y 302 nematodos/100g de suelo, seguido por Helicotylenchus spp., con promedio de 42/g de raíces y 196 nematodos/100g de suelo. Los mayores valores obtenidos en este estudio en comparación a los obtenidos por RINCÓN et al. (1989), se debieron fundamentalmente a tres razones: primero; ellos recolectaron las muestras de raíces y suelo principalmente de plantas que mostraban síntomas de amarillamiento, flacidez y enanismo; mientras que en el presente estudio las plantas fueron recolectadas de todo el lote y sin tener selección especial por plantas; segundo, al método de extracción de Cobb modificado (1977) y BIRD (1971) que ellos utilizaron, pues en este trabajo fue el método de centrifugación y flotación en azúcar; y tercero, a que las mayores poblaciones de Meloidogyne spp., encontradas por RINCÓN et al. (1989), se obtuvieron en los municipios de Candelaria, Pradera, Corinto, Santander de Quilichao y Cerrito, municipios no considerados en el presente estudio. Asimismo, las poblaciones fueron mayores que las obtenidas por CASTAÑO & SALAZAR (1987), quienes encontraron poblaciones de Meloidogyne spp., y Helicotylenchus spp., de 376 y 79 nematodos/10g de raíces, respectivamente, en cultivos de pitahaya en buen estado agronómico; y poblaciones similares a las halladas en cultivos en mal estado agronómico cuyos valores fueron de 3.743 y 207 nematodos/10g, respectivamente.
De igual manera, los resultados obtenidos en este trabajo difieren de los obtenidos por ARAUJO & MEDINA (2008), quienes no encontraron Helicotylenchus spp., en el municipio de Riofrío, mientras que en este estudio si fue encontrado, diferencias atribuidas posiblemente a fincas distintas donde se recolectaron las muestras, al método de muestreo y al procedimiento de extracción de nematodos; siendo diferentes las fincas donde se recolectaron las muestras, ARAUJO & MEDINA (2008), encontraron Helicotylenchus spp., en muestras de suelo de los municipios de Bolívar, La Cumbre, El Dovio, Riofrío, Calima-Darién, Sevilla, Trujillo y Roldanillo, resultados que coinciden con los de este estudio donde se encontró Helicotylenchus spp., en todas las muestras de raíces y suelo (Tabla 2). Asimismo, CASTAÑO & SALAZAR (1987), encontraron a Helicotylenchus spp., como el nematodo con mayor frecuencia en muestras de suelo en los departamentos de Valle del Cauca, Cundinamarca, Quindío y Caldas, resultado que concuerda con los del presente trabajo.
La presencia de Helicotylenchus spp., con una frecuencia del 100%, al igual que sus altas poblaciones en raíces y suelo comparado con los demás géneros de fitonematodos antes mencionados, demuestran cómo dicho nematodo en el cultivo de pitahaya, tiene mayor aptitud biológica para sobrevivir así como mejores oportunidades de alimentación en comparación con otros fitonematodos habitantes del suelo. Características relacionadas con su hábito alimenticio de ectoparásito, semi-endoparásito o endoparásito de raíces (LUC et al., 2005). En pitahaya, Helicotylenchus spp., tiene al menos los hábitos alimenticios de ectoparásito y semi-endoparásito por haberse encontrado en raíces y suelo. Igualmente, producto del parasitismo, en la epidermis de las raíces produce lesiones pequeñas circulares de color café obscuras tornándose necróticas.
Hay que resaltar que Helicotylenchus spp., es un nematodo fitoparásito polífago y cosmopolita en áreas tropicales y sub-tropicales (SIDDIQI, 2000; LUC et al., 2005), corroborando sus características biológicas para sobrevivir y su potencial como nematodo fitoparásito en cultivos como plátano, banano, arroz, maíz, etc. Según WILLMONTT et al. (1975), H. dihystera puede sobrevivir 6 meses en suelo almacenado en sacos de plástico a temperaturas tan altas como 18-24°C en bodegas y tan bajas como 1.1-4.4°C en refrigeradores. Esta capacidad de sobrevivir en el suelo a diferentes temperaturas y por varios meses, permiten al nematodo parasitar e incrementar sus poblaciones en las raíces secundarias ramificadas y superficiales de la pitahaya (ESSO AGRÍCOLA, 1988).
A pesar de ser registrado Meloidogyne spp., como el fitonematodo de mayor importancia en el cultivo de la pitahaya amarilla en los departamentos del Cauca, Valle del Cauca, Caldas y Cundinamarca (RINCÓN et al., 1989; VIDAL & NIETO, 1989; PALACINO, 1990; VARÓN, 2006; ARAUJO & MEDINA, 2008; ROJAS et al., 2008), en este estudio se demuestra que el nematodo Espiral Helicotylenchus Reconocimiento de nematodos fitoparásitos en pitahaya amarilla 157 spp., actualmente es el más importante, causando daños severos manifestados a través del encrespamiento de las raíces con ápices hinchados y dañados, con y disminución de raíces laterales (Figura 1A), daños diferentes a los primarios producidos por Meloidogyne spp., que son principalmente agallas o nudosidades donde se encuentran las hembras del nematodo (Figura 1B); y, similares a los síntomas secundarios ocasionados por Meloidogyne spp., que consisten en amarillamiento de tallos, flacidez y raquitismo de pencas, tallos angostos, detención del crecimiento y menor producción (RINCÓN et al., 1989; VIDAL & NIETO, 1989; VARÓN, 2006; ROJAS et al., 2008).

Además, las altas poblaciones de Helicotylenchus spp., son una vía de entrada de otros microorganismos habitantes naturales del suelo como hongos y bacterias que al encontrar heridas o daños ocasionados por los nematodos fitoparásitos, pueden ingresar fácilmente al sistema radical y colonizar los haces vasculares, convirtiéndose en un factor predisponente de otros agentes causantes de enfermedades como Fusarium oxysporum agente causante de la pudrición basal y marchitez de la pitahaya, tal como lo demostraron ARAUJO & MEDINA (2008) en plantas de pitahaya; así como DUNCAN & MOENS (2006) en cultivos de banano, algodón, tabaco, papa, tomate y soya.
Según RINCÓN et al. (1989), CASTAÑO et al. (1989) y VIDAL & NIETO (1989), en el cultivo de pitahaya la mayor fuente de inóculo y diseminación de nematodos fitoparásitos son las plantas de almácigo, razón por la cual las medidas de manejo deben comenzar en este sitio. Como en el caso anterior y debido a las altas poblaciones de Helicotylenchus spp., y de Meloidogyne spp., encontradas en las fincas muestreadas, se deben realizar muestreos para determinar las poblaciones actuales que permitan tomar decisiones de manejo. Medidas preventivas como sembrar plantas en óptima calidad sanitaria además de la utilización de áreas libres de nematodos (VIDAL & NIETO, 1989); son estrategias que contribuyen en el manejo apropiado de éstos.
Otros géneros de nematodos fitoparásitos encontrados con menor frecuencia y población (datos no mostrados) fueron: Dorylaimus spp., con 240 nematodos en 100g de raíces y suelo, Tylenchus spp., con 344, Aphelenchus spp., con 277, y Pratylenchus spp., con 120, en las fincas La Cristalina, La Luciérnaga, Alto Bonito y El Jardín, respectivamente. CASTAÑO & SALAZAR (1987), también encontraron con menor frecuencia y población a estos nematodos fitoparásitos; que difieren de los hallados por RINCÓN et al. (1989), quienes registraron la presencia de los géneros Tylenchorhynchus, Trichodorus, Hoplotylus y Hemicycliophora, nematodos que no fueron encontrados en la presente investigación, ni tampoco en el trabajo que realizó ARAUJO & MEDINA (2008), atribuido posiblemente a que las muestras fueron recolectadas en sitios diferentes.
A pesar que la frecuencia y población de los anteriores géneros fueron menores, es muy importante continuar el monitoreo de dichos nematodos fitoparásitos para evitar que puedan llegar a causar daño económico en el cultivo de la pitahaya, ya que, por ejemplo Pratylenchus spp., es un nematodo cosmopolita con amplio rango de hospedantes (CASTILLO & VOVLAS, 2008), que puede llegar a ser limitante en el cultivo de la pitahaya en la finca El Jardín del municipio de Ríofrio, departamento del Valle del Cauca, donde fue registrado.
En las fincas estudiadas, se evidenció cómo la población total de Helicotylenchus spp. (Figura 4), presentó poblaciones superiores a 3.000 individuos/100g de raíces y suelo en nueve fincas, entre 1.000 y 3.000 individuos, en ocho fincas y el resto con menos de 1.000 individuos (Figura 2).
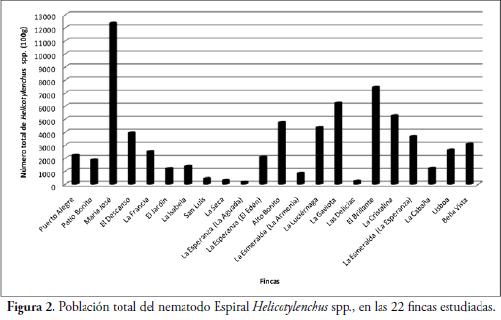
Resultados que demuestran cómo dicho nematodo fitoparásito es importante para el desarrollo vegetativo y productivo de la pitahaya amarilla en las áreas estudiadas. Asimismo, se resalta cómo muchas plantas no presentaban síntomas de nematosis en condiciones de campo, por lo cual se requiere realizar muestreos para conocer sus poblaciones y adoptar medidas de manejo apropiadas. Tales resultados coinciden con los obtenidos por RINCÓN et al. (1989), quienes demostraron que H. dihystera disminuye el sistema radical de la pitahaya cuando las poblaciones oscilan entre 5.000 y 10.000 individuos.
Debido a la importancia que está adquiriendo Helicotylenchus spp., en el área de estudio, se realizó la identificación de la especie, para lo cual se recurrió a caracteres morfológicos y morfo-métricos, utilizando las claves taxonómicas de WILLMONTT et al. (1975), FORTUNER (1987); MAI et al. (1996) y SIDDIQI (2000). Las características morfológicas de las hembras del nematodo fueron el cuerpo en espiral, estoma-estilete bien desarrollado, esófago dividido en tres partes con meta-corpus valvulado, desembocadura de glándula dorso-esofágica en precorpus, traslape dorsal del esófago con el intestino, región labial hemisférica, cola dorsalmente convexa-conoide con terminación estrecha y leve proyección, las cuales permitieron junto con la descripción morfo-métrica de la hembra (Tabla 3), identificar la especie Helicotylenchus dihystera (Figura 3). Esta especie, también fue registrada en el cultivo de la pitahaya por CASTAÑO et al. (1989), aunque tales autores no indican el procedimiento empleado para la identificación de la especie.

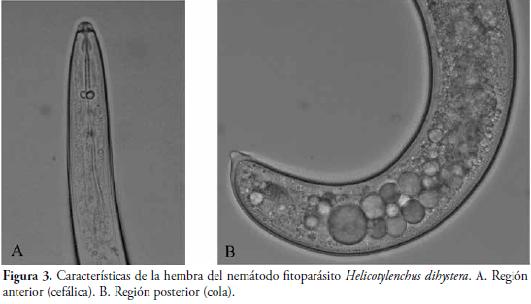
Queda demostrado que el nematodo fitoparásito más importante en el cultivo de pitahaya amarilla en el área de estudio es el nematodo espiral Helicotylenchus dihystera (WILLMONTT et al., 1975), debido a su distribución y población encontrada, seguido del nematodo del nudo radical Meloidogyne spp.
Debido a los daños que causan H. dihystera y Meloidogyne spp., en el sistema radical, tales nematodos también puede ser un factor predisponente para que se presenten otros microorganismos fitopatógenos como el hongo Fusarium oxysporum (ARAUJO & MEDINA, 2008), haciéndose necesario monitorear sus poblaciones y comenzar a realizar un manejo integrado del cultivo.
Finalmente, la decisión o recomendación de un programa de manejo integrado de nematodos fitoparásitos debe basarse en el conocimiento de las especies de nematodos fitoparásitos, sus densidades poblacionales, fuente de inóculo en condiciones de almácigo y campo, además de los mecanismos de diseminación, base para la selección e implementación de medidas de manejo.
AGRADECIMIENTOSLos autores del artículo agradecemos el valioso aporte científico del Dr. Jairo Castaño Zapata, profesor Titular de la Universidad de Caldas, por la revisión del documento; a la Dra. Sandra Milena García, gerente de ASOPPITAYA, por su contribución en la concepción y realización del presente estudio.
AGRIOS, G., 2005.- Plant pathology. 5ed. Nueva York: Elsevier Academic Press. p 922. [ Links ] [ Links ]
ARAUJO, L. & MEDINA, O., 2008.- Reconocimiento de patógenos asociados al cultivo de pitahaya amarilla (Selenicereus melaganthus Haw.) en el departamento de Valle del Cauca. Trabajo de grado presentado como requisito para optar al título de Microbiólogo. Universidad Popular del Cesar. [ Links ] [ Links ]
CASTAÑO, S.; RINCÓN, A. & VARÓN, F., 1989.- Observaciones preliminares sobre el manejo de nemátodos en pitahaya Acathocereus pitahaya. ASCOLFI Informa 15(5): 48-49. [ Links ] [ Links ]
DE WAELE, D. & DAVIDE, R., 1998.- Nematodos noduladores de las raíces del banano, Meloidogyne incognita (Kofoid y White, 1919) Chitwood, 1949 y Meloidogyne javanica (Treub, 1885) Chitwood, 1949. En: Plagas de Musa. Hoja divulgativa Número 3. [ Links ] [ Links ]
ESSO AGRÍCOLA, REVISTA., 1988.- El cultivo de la pitaya. No. 2 - Noviembre de 1988. p.12. [ Links ] [ Links ]
FORTUNER, R., 1987.- A reappraisal of Tylenchina (Nemata). 8. The family Hoplolaimidae Filip'ev, 1934(l). Revue Nematól. 10 (2): 219 -237. [ Links ] [ Links ]
HUNT, D.J., 1993.- Aphelenchida, Longidoridae and Trichodoridae: Their Systematics and Bionomics. CABI Bookshop. [ Links ] [ Links ]
MAI, W.; MULLIN, P.; LYON, H. & LOEFFLER, K., 1996.- Plant parasitic nematodes. A pictorical key to genera. Fifth edition. Comstock Publishing Associates A Division of Cornell University Press. p. 277 [ Links ] A.; LUC, M.; RASKI, D.; FORTUNER, R. & GERAERT, E., 1987.- A Reappraisal of Tylenchina (Nemata). 2. Classification of the suborder Tylenchina (Nemata: Diplogasteria). Revue Nématol. 10 (2): 135-142. [ Links ]
PALACINO, J.H., 1990.- Interacción entre Glomus manihotis y Meloidogyne incognita en pitaya amarilla y roja bajo condiciones de vivero. Cenicafé (Colombia) 41 (3): 80-90. [ Links ] [ Links ]
PERRY, R.; MOENS, M. & STARR, J., 2009.- Root knot nematodes. CAB International. London. p.480 [ Links ]N, A.; CASTAÑO, S. & VARÓN F., 1989.- Reconocimiento y evaluación del daño de nematodos asociados con Pitahaya Acanthocereus pitahaya. ASCOLFI Informa 15(5): 46- 48. [ Links ]
ROJAS, A.; REBOLLEDO, A.; KONDO, D.; TORO, J. & OROZCO, M., 2008.- Pitahaya Amarilla (Selenicereus megalanthus). Centro de Investigación Palmira, Plegable divulgativo. Noviembre de 2008. Palmira - Valle del Cauca. [ Links ] [ Links ]
THORNE, G., 1961.- Principles of nematology. New Cork, Mc Graw Hill, Book company. p. 553 [ Links ], 2008.- Universidad Nacional de Palmira tiene las mejores especies de pitahaya amarilla de Colombia. Obtenido en junio de 2009. Desde http://www.universia.net.co/noticias/. [ Links ]
VARÓN, F., 2006.- Enfermedades del cultivo de la pitahaya y su manejo. Revista ASIAVA. pp. 17-21. [ Links ] [ Links ]
WILLMONTT, S.; GOOCH, P.S. & SIDDIQI, M.R., 1975.- Helicotylenchus dihystera. C.I.H. Description of plantparasitic nematodes, Set 1, No. 9. CAB International, Wallingford, Oxon, UK. [ Links ]













