Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.17 no.2 Manizales July/Dec. 2013
DIVERSIDAD DE ESCARABAJOS CARABIDAE Y SCARABAEIDAE DE UN BOSQUE TROPICAL EN EL MAGDALENA MEDIO COLOMBIANO*
DIVERSITY OF CARABIDAE AND SCARABEIDAE BEETLES OF A TROPICAL FOREST IN THE MIDDLE MAGDALENA REGION IN COLOMBIA
Miguel Uribe L.1 y Luis Fernando Vallejo E.2
* FR: 27-III-2013. FA: 23-IX-2013.
1 Ingeniero Agrónomo, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Manizales, Colombia. E-mail: migueluribe40@gmail.com
2 Profesor Asociado, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Manizales, Colombia. A. A. 275. E-mail: luis.vallejo_e@ucaldas.edu.co
Resumen
La Reserva Natural Río Manso del municipio de Norcasia (Caldas), es un bosque seco tropical con transición a húmedo de excepcional valor ecológico. En este trabajo se resume su potencial para justificar su conservación y manejo, seleccionando dos grupos de insectos del orden Coleoptera de las familias Scarabaeidae (coprófagos de la subfamilia Scarabaeinae) y Carabidae como modelos para el diagnóstico de la calidad de este ecosistema. Los métodos empleados incluyeron trampas de caída (pitfall), trampas de luz negra, redes de intercepción, redes entomológicas y colecta manual. La recolección del material entomológico se inició en diciembre de 2010 y concluyó en diciembre de 2011. Los resultados permitieron comparar el bosque con un ecosistema intervenido antrópicamente (potrero) a través de índices de diversidad alfa y beta. En las muestras se encontraron doce especies de la subfamilia Scarabaeinae y cuatro morfoespecies; la tribu Dichotomiini representada por los géneros Ateuchus, Canthidium, Dichotomius y Ontherus fue la más diversa, mientras la tribu Eurysternini la contrastó con el género Eurysternus y una única especie: E. foedus. La familia Carabidae estuvo representada por diez géneros ubicados en ocho tribus, el género más abundante fue Calosoma a diferencia de Agra que presentó un único espécimen. La diversidad alfa (a) para el bosque fue de a = 16, mientras que para el potrero presentó un valor de a = 6. La diversidad beta para el potrero y para el bosque alcanzó un valor de 62,5%.
Palabras clave: Scarabaeinae, Carabidae, Reserva Río Manso.
Abstract
The Río Manso natural reserve in the municipality of Norcasia (Department of Caldas), is a tropical dry forest with transition to wet forest with exceptional ecological value. This paper summarizes the potential to justify their conservation and management selecting two groups of Coleoptera insects from the Scarabaeidae (dung beetles of the Scarabaeinae subfamily) and Carabidae families as models for the diagnosis of quality in this ecosystem. The methods used included pitfall traps, black light traps, interception nets, entomological nets and hand collection. The entomological material collection took place from December 2010 to December 2011. The results allowed comparing the forest with anthropically treated system (pasture) through alpha and beta. diversity indexes. In the samples there were twelve species of the Scarabaeinae subfamily and four morph species; the Dichotomiini tribe represented by the genus Ateuchus, Canthidium, Dichotomius and Ontherus was the most diverse, while the Eurysternini tribe contrasted with the Eurysternus genus and an only species: E. foedus. The Carabidae family was represented by ten genders located in eight tribes; the most abundant genus was Calosoma in contrast to Agra that presented an only specimen. Alpha diversity (a) for the forest was a = 16, while for the pasture presented a value of a = 6. Beta diversity for the pasture and forest was 62.5%
Key words: Scarabaeinae, Carabidae, Manso River reserve.
INTRODUCCIÓN
Una de las mayores amenazas para el futuro del planeta tierra es la deforestación de sus bosques que se encogen vertiginosamente. En el último siglo han desaparecido más de la mitad de estos como resultado del desarrollo de las tierras, la agricultura, la explotación de la madera, las quemas y los daños resultantes de las sequías (DE DUVE, 1999). El Bosque-Selva Tropical, el último refugio de la diversidad biológica, es a ciencia cierta el ecosistema más susceptible al daño originado por la actividad humana dada su compleja estructura y el fuerte endemismo de las especies vegetales y animales que lo habitan (MYERS, 1992; MENDOZA, 1999; MYERS et al., 2000).
Solo dos bosques con la características seco tropical con transición a húmedo, subsisten en el departamento de Caldas como reservas naturales, la Reserva Natural Río Manso (RNRM) y el Bosque Selva de Florencia, ambos conectados por corredores ecológicos con una excepcional riqueza biológica y aparentemente poca intervención antrópica; hacen parte del patrimonio viviente y consecuentemente científico del país.
A pesar de que en la RNRM se adelantan importantes proyectos ambientales, tales como protección, recuperación, y conservación de nacimientos de agua, ríos y quebradas, protección de especies de flora y fauna y consolidación de su potencial como banco genético, pocos estudios que relacionen su entomofauna se han llevado a cabo. Salvo algunos muestreos locales con escarabajos coprófagos (Coleoptera: Scarabaeinae) (ARANGO & MONTES, 2009) no existen registros para este lugar.
Las familias Carabidae (Coleoptera: Adephaga) y Sacarabaeidae, dos de los grupos entomológicos seleccionados en este estudio por sus cualidades ecológicas, reúnen varios de los requisitos como modelos para interpretar fenómenos de intervención antrópica (STRAHS, 1969; MARTÍNEZ, 2005b). Comúnmente los Carabidae son solitarios y de naturaleza depredadora con diversas especializaciones, algunas especies son parasitoides de pupas de escarabajos acuáticos (Gyrinidae, Dytiscidae e Hydrophilidae) como los del género Brachinus (MARTÍNEZ, 2005b; SASKA & HONEK, 2012), otras especies habitan en estructuras muy especializadas como cavernas o dentro de cortezas u oquedades formadas por raíces de árboles en el suelo (LIMA, 1952; PARDO-LOCARNO et al., 1991; CAMERO-RUBIO, 2003; LAROCHELLE & LARIVIÈRE, 2003; ESTRADA & SALAZAR, 2004; MARTÍNEZ, 2005b); igualmente los escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae), son reconocidos por su asociación con excremento y/o carroña de mamíferos y otros vertebrados, estrategias de aprovechamiento del sustrato como su recurso alimenticio y reproductivo (MEDINA et al., 2001; MURILLO et al., 2009; SCHOLTZ et al., 2009; CONCHA-LOZADA et al., 2010).
MATERIALES Y MÉTODOS
Características de la zona de estudio
La RNRM está ubicada a una altitud de 180-220 msnm, en las coordenadas 5°40'38,90"N - 70°46'28,65"W en el municipio de Norcasia al nororiente del departamento de Caldas en la vertiente oriental de la Cordillera Central (Figura 1). Limita al norte con el departamento de Antioquia de donde recibe la influencia del valle del río Magdalena, y la vertiente occidental de la Cordillera Central. Está bordeada al noroccidente por el río Manso, al oriente por el río Samaná y al sur por el río La Miel; abarca 481 ha constituidas en gran medida por grandes potreros arbolados, pastizales para el pastoreo, humedales y un remanente de bosque de 108 ha rodeado de parches de rastrojo en proceso de sucesión. Ecológicamente se ubica en una zona de transición hacia bosques secos, siendo este sector el más al sur del sistema Biogeográfico del Magdalena Medio y zona de hibridación con elementos del alto Magdalena y el Chocó Biogeográfico (HOLDRIDGE, 1982; CORPOCALDAS, 2012).

Captura de material entomológico
Para esta investigación se seleccionaron dos grandes grupos del Orden Coleoptera, la familia Scarabaeidae (Subfamilia Scarabaeinae) y la familia Carabidae. Se incluyeron arbitrariamente los sitios de muestreo, prefiriendo aquellos ambientes y zonas representativas de la Reserva (13 sitios), durante trece meses entre diciembre de 2010 hasta diciembre de 2011 cuando se realizó la recolección de las muestras entomológicas.
Se utilizaron varios métodos de captura: trampas de luz negra, trampas de caída (pitfall) trampas de intercepción y muestreo manual.
Las trampas de caída se instalaron en cada uno de los 13 sitios, en un cuadro constituido por cinco recipientes plásticos (como el número cinco del dado); cada sitio estuvo separado a 40 m de distancia de la siguiente manera: tres sitios se instalaron en el potrero, los restantes diez desde el perímetro del bosque hasta el centro de éste. Los recipientes se cebaron con excremento de porcino y humano, y pescado en descomposición dependiendo de la disponibilidad de cada uno.
Se instaló una trampa de intercepción dentro del bosque, esta se monitoreó cada mes durante la primera semana y a lo largo de los trece meses del trabajo de campo. Simultáneamente, se instalaron dos trampas de luz con dispositivo de encendido automático en la entrada del bosque, estas funcionaron desde las 18:00 h hasta las 06:00 h del día siguiente y se revisaron cada semana desde el comienzo hasta el final de la labor de campo.
ANÁLISIS DE LA INFORMACIÓN
Procesamiento e identificación del material entomológico
El material colectado se empacó en bolsas de polietileno (tipo ziploc), con su respectivo rótulo (fecha, sitio exacto, planta hospedante, altura sobre el nivel del mar, zona de vida, colector) y posteriormente se envió al Laboratorio de Entomología de la Universidad de Caldas (LEUC) donde los ejemplares se limpiaron, disecaron, rotularon y montaron en alfileres entomológicos. Finalmente se guardaron en gabinetes tipo Cornell, para conformar una colección de referencia.
Para la identificación de los ejemplares entomológicos se utilizaron los criterios de diferentes autores (MEDINA & LOPERA, 2000; MEDINA et al., 2001; ERWIN, 2002, 2004; CAMERO-RUBIO, 2003; ERWIN & MEDINA, 2003; LAROCHELLE & LARIVIÈRE, 2003; MARTÍNEZ, 2005a; 2005b; PARDO-LOCARNO, 2007; MURILLO et al., 2009; MEDINA & CULTID, 2010; VAZ-DE-MELLO et al., 2011; CULTID et al., 2012; NORIEGA, 2012; NORIEGA et al., 2012).
Análisis de los datos
Con el fin de evaluar la representatividad de la labor de campo y estimar el total de especies presentes (S = riqueza específica) en la zona vs el total esperado (N), el material entomológico se separó por fechas, se contó y se identificó para construir una matriz de datos (número total de especies, familia, subfamilia, tribu, género, especie, mes, año, cantidad total y cantidad para cada estación de muestreo, planta hospedante, método de colecta) en una hoja de cálculos Excel (®Microsoft).
Los datos acumulados se copiaron y se transcribieron en lenguaje de texto, luego con la ayuda del software EstimateS versión 7.5 (COLWELL, 1997) se aleatorizaron para construir curvas de acumulación de especies, basado en la proporción de unidades muestrales (en este caso cada uno de los 13 meses de muestreo) que contiene estimadores de riqueza observadas por especie (SOBS), estimadores de la riqueza esperada basado en la abundancia de cada especie en cada muestra (ACE, CHAO 1), además de los singletons (representantes únicos de las poblaciones) y los doubletons (representantes duplicados de las poblaciones) (JIMÉNEZ & HORTAL, 2000; VILLARREAL et al., 2006).
Por otro lado, la diversidad Beta (B) se determinó según el método de complementariedad propuesto por COLWELL & CODDINGTON (1994), según la fórmula:

Donde SA y SB representan la riqueza de especies del bosque y potrero respectivamente, y VAB el número de especies que comparten los dos ambientes. La complementariedad y la diversidad beta tienen un valor mínimo de cero cuando las dos comunidades poseen proporcionalmente poblaciones idénticas, y un valor máximo de 100 cuando las comunidades son completamente distintas.
RESULTADOS Y DISCUSIÓN
Desde que se concibió la idea de adelantar una investigación ecológica en la RNRM para estudiar la importancia de estos ecosistemas, se pensó en la selección de dos familias contrastantes cuyos integrantes comparten espacios semejantes pero no compiten por los mismos recursos. Sin competencias, las poblaciones de los dos grupos sumaron más eventos que se aprovecharon para enriquecer las fichas bioecológicas y la discusión que se presenta a continuación:
Representatividad del estudio
Las curvas de acumulación de especies de la familia Carabidae (Figure 3) y de la subfamilia Scarabaeinae (Figure 4) muestran que sus respectivas poblaciones están bien muestreadas en la RNRM, los diez géneros de Carabidae y los once de Scarabaeinae (riqueza específica) corresponden a más del 90% de los géneros esperados que predicen CHAO 1 y ACE Mean. Los valores de ambos estimadores indicaron un fuerte crecimiento en el inicio (asintótico) cuando las poblaciones comenzaron a aparecer y se comportaron de forma análoga en la medida del tiempo; las curvas de especies con un solo ejemplar (singletons) y con dos ejemplares (doubletons) se cruzaron desde el inicio (febrero-marzo de 2010) para estabilizarse rápidamente como una muestra de la dinámica de los ecosistemas señalados.
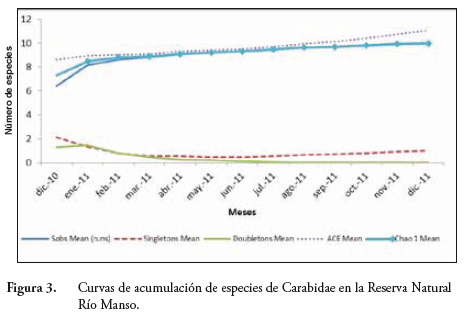
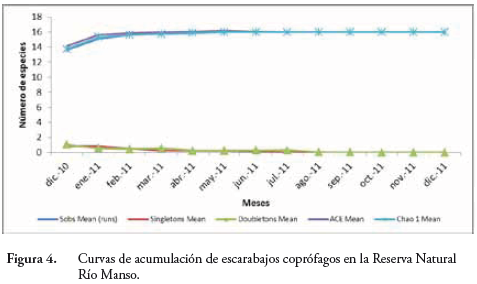
En ambos casos, se deduce una simetría entre el tiempo y la llegada de nuevas poblaciones; los estimadores de riqueza ACE Mean demuestran que las poblaciones crecen asintóticamente al comienzo del estudio, lo que significa que el esfuerzo de colecta y la posibilidad de encontrar registros nuevos es directamente proporcional, este evento refleja el significado de la diversidad alfa para la RNRM. En este caso, la diversidad de poblaciones de Carabidae y Scarabaeidae se puede explicar por la sumatoria de varios eventos relacionados con sus ciclos de vida, marcadamente afectados por la temperatura que optimiza la duración de las formas de desarrollo (embrión, estadios larvales, pupa) e incluso la actividad reproductiva de los adultos (WOLDA, 1988; CASTRO et al., 2012).
Las muestras únicas o singletons están influenciadas por representantes únicos como el caso del género Agra (Figura 6A); sugerimos que los ejemplares únicos se comportan como visitantes que provienen de sitios cercanos, entran al bosque en busca de recursos y regresan a sus sitios de origen donde prosperan y se establecen.
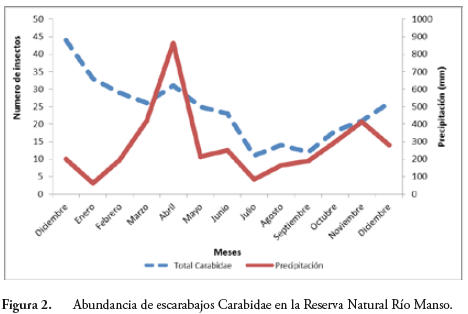
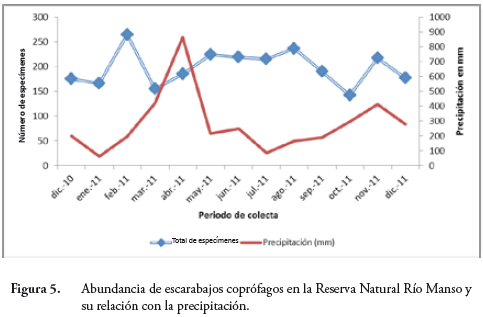
La Figura 5 muestra el comportamiento de las diferentes poblaciones de escarabajos coprófagos en el tiempo, se deduce una relación directa y proporcional entre la abundancia de estas y las lluvias que se hace manifiesta desde el mes de febrero, cuando se afecta la curva con un pico alto y con la mayor abundancia de las poblaciones, asimismo, se nota la tendencia al descenso en septiembre cuando disminuye la precipitación.
Diversidad Alfa y Beta
La diversidad alfa (a) para el bosque fue de a = 16, mientras que para el potrero presentó un valor de a = 6. La diversidad beta para el potrero y el bosque alcanzó un valor de 62,5% (HALFFTER et al., 2001; HALFFTER & MORENO, 2005).
RIQUEZA, ABUNDANCIA Y COMPOSICIÓN DE CARABIDAE
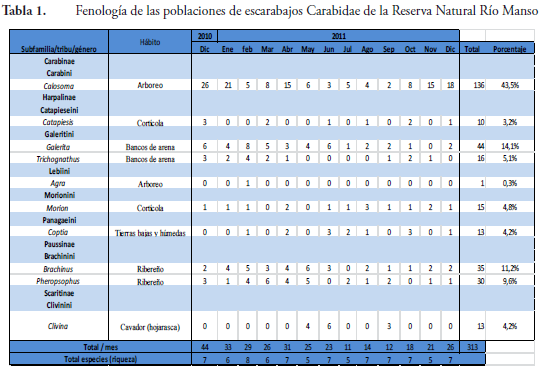
Se colectaron 313 ejemplares de la familia Carabidae representados por cuatro subfamilias, ocho tribus y diez géneros (Tabla 1). La subfamilia Carabinae se destacó como la de mayor abundancia con el 43,5% del total de los individuos recolectados, le siguen en orden de abundancia la subfamilia Harpalinae (31,6%), Paussinae (20,9%) y Scaritinae (4,6%). La Tabla 1 muestra la distribución de la abundancia de los Carabidae durante la fase de campo. De los anteriores datos se desprenden los siguientes comentarios:
Tribu Carabini, género Calosoma Weber (Figura 6A)
Como único género de la tribu Carabini (Tabla 1), se encontraron 136 individuos que representan el grueso de la abundancia de la familia en la RNRM. Las 170 especies de este género están organizadas en 22 subgéneros, la mayoría de los cuales están ampliamente distribuidos en las Américas. Después de analizar la morfología de las estructuras clave y de comparar nuestros ejemplares con otros de diferentes colecciones, se considera que los especímenes colectados en la RNRM están más cercanos a la especie Calosoma fulgens Chaudoir, registrada desde Cali (Colombia) hasta el oriente de Panamá en la Península de Azuero (ERWIN, 1991), que las tres especies registradas para Colombia (MARTÍNEZ, 2005b).

Subfamilia Carabinae:
Las especies del género Calosoma se caracterizan por sus proporciones corporales y por sus hábitos depredadores, se alimentan especialmente de moluscos, larvas y pupas de lepidópteros, dípteros, coleópteros y otros insectos, contribuyendo a eliminar una cantidad considerable de defoliadores (ARNETT & THOMAS, 2000). La literatura los registra como habitantes naturales del material orgánico del suelo y del dosel del bosque donde acechan a sus presas (BORROR & WHITE, 1998; PAIK et al., 2006). Los ejemplares encontrados fueron atraídos por la luz negra de las trampas instaladas en la entrada del bosque, especialmente en diciembre y enero. Para su recolección se han utilizado trampas de caída de manera tradicional (BAARS, 1979; HOLLAND & SMITH, 1999; RAWORTH & CHOI, 2001); en esta investigación comprobamos que trepan las ramas medias y altas de los árboles de porte medio, situación que se aprovechó para la instalación de trampas de luz negra, método de captura que arrojó muy buenos resultados.
Subfamilia Harpalinae:
Tribu Catapieseini, género Catapiesis Solier
Perteneciente a una de las subfamilias más diversas del grupo, algunos de los representantes de este género se caracterizan por sus llamativas formas, las cuales imitan el aspecto físico de hormigas con sus mandíbulas prominentes y sus élitros truncados y glabros. Viven en diversos hábitats, destacándose cuevas profundas, corteza de los árboles, el dosel y el piso del bosque donde se confunden dentro de la hojarasca. Emplean una considerable variedad de recursos para su alimentación y estilos de vida como la granivoría y la herbivoría (LINDROTH, 1968; FORSYTHE, 1982), mirmecofilia y termitofilia (ERWIN, 1981; BRANDMAYR et al., 1994), ovo-viviparidad (LIEBHERR & KAVANAUGH, 1985), ectoparasitismo de otros insectos (LINDROTH, 1954; JOLIVET, 1967), y la depredación de pequeños vertebrados como ranas (ELRON et al., 2007). Los diez ejemplares de este género (correspondiente al 3% del total recolectado) se encontraron sobre la corteza de los principales árboles de la RNRM (Bombacáceas, Cesalpináceas, Lecitidáceas), ente otros, situación que sugiere hábitos cortícolas. La Tabla 1) muestra el registro de las poblaciones de manera constante e intercalando los meses entre diciembre de 2010 y diciembre de 2011.
Tribu Galeritini, género Galerita Fabricius (Figura 6B)
Ampliamente distribuido, el género Galerita presenta 88 especies distribuidas en dos subgéneros, Progaleritina Jeannel 1949 y Galerita (sensu stricto) (ARNETT & THOMAS, 2000). Está distribuido en las principales regiones zoogeográficas excepto en la australiana. Más de la mitad de las especies se encuentran en el neotrópico y son fácilmente reconocibles por su cabeza estrecha en comparación con el pronoto que a su vez es más estrecho que el resto del cuerpo, exhibe mandíbulas contrastantes que emergen del rostrum, antenas filiformes de 11 segmentos, que se adelgazan a partir del quinto mientras que el escapo es amplio y largo. Su cuerpo es alargado y esbelto entre 15,5-23,5 mm de longitud, pubescente y de coloración oscura (ERWIN, 1991). Fue uno de los géneros más representativos en este estudio, y mostró una de las mayores abundancias registradas. Los 44 ejemplares se recolectaron sobre el piso, en taludes y barrancos, entre el material de litera (hojarasca) del bosque, utilizando trampas de caída y ocasionalmente trampas de luz negra. De manera interesante, el grupo se recolectó constantemente desde diciembre de 2010 hasta diciembre de 2011.
Género Trichognathus Fabricius (Figura 6C)
La población de Trichognathus, el otro representante de la tribu Galeritini, con 16 ejemplares (correspondiente al 5% del total), se recolectó revisando los taludes, barrancos, material de hojarasca obtenida del piso del bosque, emplazando trampas de caída y ocasionalmente trampas de luz; los individuos se observaron de manera constante durante la completa temporada de la fase de campo.
En una reciente publicación DOS SANTOS (2012) cita: "Trichognathus marginipennis Latreille, 1829 es la única especie del género monobásico. Reichardt (1964) consideró a T. cinctus Chaudoir, 1848 y a T. immarginipennis Steinheil, 1875 como variantes de T. marginipennis y sinonimizó los tres nombres". De distribución neotropical, se encuentra en localidades ubicadas en las tierras bajas de las estribaciones orientales de los Andes en los siguientes países: Venezuela, Brasil, Colombia, Perú, Bolivia, Paraguay y Argentina donde se le ve correr rápidamente persiguiendo a sus presas en las praderas de los bosques de galería (ARNDT & DRECHSEL, 1998), en la arena de los bordes de ríos y quebradas, y en galerías hechas en los taludes y barrancos.
Tribu Lebiini, género Agra Fabricius (Figura 6D)
Originalmente descrito por Fabricius en 1801, el género Agra incluye 602 especies, la mayoría de las cuales están ampliamente distribuidas en el neotrópico suramericano, su riqueza disminuye rápidamente hacia el norte, con no más de dos especies en el extremo norte neotropical (ERWIN, 2002). Se sabe muy poco sobre la forma de vida de las especies de Agra, excepto que los adultos son arborícolas, y que viven en alturas bajas y medias de los bosques tropicales, en tallos, hojas de palmas, bromelias (Bromeliaceae) y tallos de hierbas. Sus especies son depredadoras con actividad nocturna (LAROCHELLE & LARIVIÈRE; 2003; MARTÍNEZ, 2005a), la forma plana y alargada de sus cuerpos les facilita esconderse en la corteza y en las nervaduras de las palmas, situacion que puede explicar la presencia de las poblaciones dentro de las oquedades de la corteza de los árboles y en la parte media de los bosques; algunos individuos se sienten atraídos por las fuentes de luz. Los adultos son probablemente depredadores de otros insectos o se alimentan de exudados de hojas y tallos o de polen de las plantas de los bosques que habitan (ARNDT et al., 2001). Excepcionalmente se encontró en nuestro estudio un único representante durante el período de muestreo en el mes de febrero de 2011 en una de las trampas de luz negra. Este ejemplar constituye el más bajo porcentaje de los Carabidae recolectados en la RNRM.
Tribu Morionini, género Morion Latreille (Figura 6E)
Este género contiene 41 especies distribuidas especialmente en las regiones templadas-cálidas del planeta. Se reconocen fácilmente por sus antenas filiformes de 10 segmentos, los cinco últimos más estrechos que los precedentes y porque la margen del pronoto exhibe siete pares de sedas largas; el cuerpo es subpedunculado y las patas son muy largas (ERWIN, 1991). Las larvas y adultos viven bajo la corteza de diferentes especies de árboles y particularmente los adultos de M. aridus se han recolectado en los tallos de los cactus tipo saguaro (SCHWARZ, 1884). Este género representó el 5% del total de la población de Carabidae (Tabla 1) recolectándose 15 ejemplares a través de los trece meses de la fase de campo. Los individuos fueron atraídos por la luz negra de las trampas que estaban cerca de la corteza de los troncos de los árboles caídos donde ellos acechan a sus presas.
Tribu Panagaeini, género Coptia Brullé (Figura 6F)
Las 268 especies de esta tribu están divididas en 21 géneros presentes en la mayoría de las regiones zoogeográficas. El género Coptia está restringido de manera exclusiva al Neotrópico suramericano (ARNETT & THOMAS, 2000) donde sus individuos se encuentran asociados al piso del bosque (hojarasca) y la corteza de diferentes especies de árbolesy superficies lodosas de bosques de palmas y sitios con suelos similares (MARTÍNEZ, 2005a) donde acechan a sus presas que generalmente son larvas y adultos de otros insectos. En Colombia el género Coptia se ha registrado en el Parque Nacional Natural Tayrona, departamento de Magdalena (MARTÍNEZ, 2005a) y presenta una única especie aún no identificada. En este trabajo se hallaron 13 ejemplares que constituyen el 4% del total de la población (Tabla 1), los individuos fueron atraídos por la luz negra de las trampas instaladas cerca de la corteza de los árboles que constituyen sus sitios preferidos para capturar a presas.
Subfamilia Brachininae:
Tribu Brachinini, Género Brachinus Weber (Figura 6G)
Las 649 especies y 20 géneros de la tribu Brachinini se encuentran distribuidas en casi todas las regiones del mundo, especialmente en el neotrópico (ARNETT & THOMAS, 2000). Las 304 especies del cosmopolita género Brachinus, son conocidas por su carácter de bombarderos, ya que arrojan sustancias corrosivas como parte de su comportamiento de ataque y de defensa (STRAHS, 1969); Brachinus posee especies hidrófilas y mesófilas que generalmente viven en los bordes de ríos y quebradas y en bosques bajos, algunos son parasitoides de escarabajos acuáticos de las familias Gyrinidae, Dytiscidae e Hydrophilidae (LAROCHELLE & LARIVIÈRE, 2003; MARTÍNEZ, 2005a; SASKA & HONEK, 2012), se diferencian fácilmente de otros Carabidae por la forma de sus mandíbulas, cabeza y pronoto estrechos, élitros amplios, truncados apicalmente, dorso pubescente, color marrón-oscuro a negro, por lo general con brillo azulado. Los 35 individuos recolectados ocupan el 11% del total de las poblaciones registradas (Tabla 1), particularmente fueron atraídos por las fuentes de luz negra y esporádicamente por la carne de pescado descompuesta colocada en trampas de caída. Se observaron durante casi todos los meses de colecta.
Género Pheropsophus Solier (Figura 6H)
Los individuos de este género son escarabajos bombarderos exclusivamente neotropicales, son siete especies descritas (ERWIN, 1970), aunque otros autores están de acuerdo en que faltan muchas especies por describir y numerosos sinónimos necesitan ser revisados (FRANK et al., 2009). La especie más extendida y variable P. aequinoctialis (L.), ha sido registrada en Argentina (Catamarca, Jujuy), Bolivia, Brasil, Costa Rica, Ecuador, México (Yucatán), Nicaragua, Panamá, Paraguay, Perú, Uruguay y Venezuela (ERWIN, 2001). Los individuos son muy activos en la noche, cuando corren por senderos de arena o bordes de ríos y quebradas, se esconden durante el día debajo piedras y troncos donde se encuentran en grupos, son depredadores de otros insectos y también comen algunos materiales vegetales, como frutas maduras de palmas del género Astrocaryum (REICHARDT, 1971). En un estudio adelantado en la Universidad de Florida (FRANK et al., 2009), se describen los estados inmaduros y el comportamiento en condiciones de laboratorio de Pheropsophus aequinoctialis (L.) y Stenaptinus jessoensis, sus resultados incluyen análisis interesantes y proponen que estas especies pueden ser utilizadas en programas de control biológico de especies invasivas como grillos topo del género Scaptristicus. En nuestro estudio se encontraron 30 ejemplares de este género (probablemente la especie Pheropsophus aequinoctialis) que corresponden al 11% del total del ejercicio de recolección (Tabla 1) al igual que los representantes del género anterior, se utilizaron trampas de luz negra y de caída aprovechando las preferencias tróficas de los individuos durante casi todos los meses de colecta.
Subfamilia Scaritinae:
Tribu Clivinini, género Clivina Latreille (Figura 6I)
Clivina es un género cosmopolita, ampliamente distribuido con 389 especies y más de 100 en el hemisferio occidental (ARNETT & THOMAS, 200). Los individuos que representan las diferentes especies se reconocen fácilmente por la forma alargada de su cuerpo, tamaño pequeño de menos de cuatro mm, coloración marrón-rojiza y la fuerte constricción que separa el tórax del abdomen; se adicionan los élitros que presentan estrías e ínter-estrías, antenas moniliformes de 11 segmentos, fémures engrosados, tibias anteriores provistas de tres dientes en posición distal y un espolón en la base. Prefieren los sitios con alta humedad como los bordes de ríos y quebradas y el material de hojarasca del piso del bosque. Clivina representó el único género de esta subfamilia del cual se colectaron 13 ejemplares distribuidos principalmente entre mayo y junio, y estos a su vez constituyen el 4% del total de las poblaciones de Carabidae encontradas en este trabajo.
RIQUEZA, ABUNDANCIA Y COMPOSICIÓN DE SCARABAEINAE
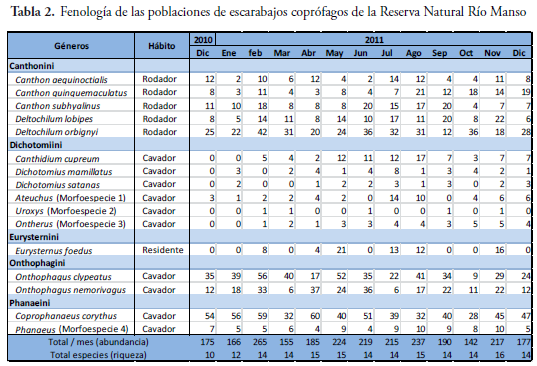
Se colectaron 2.567 individuos de la subfamilia Scarabaeinae. Se identificaron 12 especies y 4 morfoespecies, distribuidas en 6 tribus y 11 géneros (Tabla 2). La tribu que presentó el mayor número de géneros es Coprini, con Canthidium, Dichotomius y Ontherus; mientras que la tribu Oniticellini contrastó por ser la menos diversa con un único género, Eurysternus y una única especie: E. foedus (Tabla 2). De estos resultados se detallan a continuación los siguientes aspectos:
Tribu Canthonini, género Canthon Hoffmannsegg (Figura 7A, Figura 7B y Figura 7C)
La tribu Canthonini posee cerca de 340 especies ampliamente distribuidas en el mundo. El género Canthon es el más diverso con 150 especies que se encuentran desde el sur de Canadá hasta Argentina (ARNETT & THOMAS, 2000). Posee individuos de longitud variable 2-25 mm (pequeños a grandes), de forma ovalada, cabeza y pronoto carentes de cuernos ocarinas, antenas típicas lameladas de 9 segmentos, tibias media y posterior aplanadas, curvas, ligeramente ampliadas en el ápice y dimorfismo sexual mínimo (HOWDEN & YOUNG, 1981). Este género fue uno de los más abundantes en este estudio con 386 individuos (15,03% del total) repartidos en tres especies: C. quinquemaculatus (132 individuos, 5,14% del total) (Figura 7A), C. aequinoctialis (101 individuos, 3,4% del total) (Figura 7B) y C. subhyalinus (153 individuos, 5,96% del total) (Figura 7C, Tabla 2). Las diferentes poblaciones se encontraron principalmente restringidas al bosque y se recolectaron en trampas cebadas con excremento humano y porcino. Los datos anotados en la Tabla 2 permiten deducir que las tres especies aparecieron constantemente durante la etapa de campo.
Género Deltochilum Eschscholtz (Figura 7D)
Deltochilum es un género del Nuevo Mundo con 84 especies descritas, caracterizadas por su gran tamaño y porque son especialmente rodadores de estiércol y carroña (ARNETT & THOMAS, 2000; GÉNIER, 2012) y uno de los más abundantes registrados en este estudio (511 ejemplares, 19,9% del total) durante los trece meses de colecta. Se encontraron las especies D. lobipes (154 ejemplares, 6,0% del total colectado) y D. orbignyi (357 individuos, 13,9% del total colectado) (Figura 7D). Las poblaciones de las dos especies se encontraron proporcionalmente en trampas cebadas con pescado descompuesto, así como en excremento de humano y de porcino. Por otro lado, el hallazgo incluye individuos que mostraron actividad en el potrero y en el bosque.

Tribu Ateuchini, género Ateuchus Weber (Figura 7E)
El género Ateuchus está compuesto por 81 especies exclusivamente americanas, son valiosos recicladores de materia orgánica que se descompone en los bosques e igualmente sirven como controladores biológicos de moscas del estiércol y como indicadores biológicos de la calidad ambiental (KOHLMANN et al., 2007). Se hallaron 54 ejemplares (correspondientes al 2,1% del total capturado) en trampas de caída cebadas con excremento de porcino en los trece meses del trabajo de campo. Entre julio y agosto se registraron 24 individuos (0,93% del total general y 44,2% de la población) evidenciando una tendencia cíclica univoltina (Tabla 2). Se considera que las especies de este género poseen un espectro trófico exclusivamente coprófago. El género Ateuchus está ampliamente distribuido, se sabe que es muy rico en especies, pero paradójicamente éstas son pobremente conocidas en América del Sur, donde el nivel infragenérico de las poblaciones naturales no se ha resuelto a satisfacción.
Tribu Coprini, género Canthidium Erichson (Figura 7F)
Se sabe que hay 150 especies descritas del género Canthidium y otra gran cantidad espera ser descubierta (ARNETT & THOMAS, 2000). Es un grupo de distribución neotropical muy abundante en bosques tropicales de tierras bajas y actividad principalmente diurna, se reconocen porque el primer tarso de la pata posterior es alargado, aproximadamente dos veces el segundo y el mesoesterno es muy corto (CULTID et al., 2012). En este trabajo el género Canthidium estuvo representado por la especie C. cupreum (87 individuos que corresponden al 3,38% del total recolectado) que se encontró restringida al bosque, en trampas cebadas con pescado en descomposición, excremento de humano y excremento de porcino. Las poblaciones aparecieron especialmente entre junio y agosto cuando se registró su mayor abundancia. Infortunadamente falta mucho para resolver la caracterización taxonómica de las especies colombianas e incluir aspectos sobre su biología como ciclos de vida, patrones de nidificación y descripción de los estados inmaduros (CULTID et al., 2012).
Género Dichotomius Hope (Figura 7G)
Muy emparentado con el género anterior, las 150 especies descritas del género Dichotomius son exclusivas del Nuevo Mundo, se caracterizan por su marcado dimorfismo sexual que se acentúa en forma de cuernos y tubérculos cefálicos y pronotales en los machos, igualmente por su forma ovalada, mesoesterno amplio, su coloración oscura y por las estriaciones que exhiben en los élitros (CULTID et al., 2012). Se encontraron 52 ejemplares durante los trece meses de registro en campo. En este estudio, el género estuvo representado por las especies D. mamillatus (33 individuos, 1,28%) (Figura 7G) y D. satanas (19 individuos, 0,74%) recolectadas en trampas de caída cebadas con excremento de humano y de porcino instaladas dentro del bosque.
Género Ontherus Erichson
Es un género endémico de América Latina, especialmente distribuido en la Región Andina donde se han registrado 58 especies (GÉNIER, 1996). Se caracterizan por su cuerpo oscuro, de forma rectangular y por el clípeo rugoso en su porción dorsal y sin procesos dentiformes. Los machos presentan cuernos en la cabeza y protuberancias en el pronoto (CULTID et al., 2012). Los 35 ejemplares de este género (correspondiente al 1,4% del total), se encontraron permanentemente durante el periodo de colecta restringidos al bosque (Tabla 2). El grupo se capturó utilizando trampas de caída cebadas con excremento de humano y de porcino.
Género Uroxys Westwood
A la fecha se han descrito 65 especies de este género, la gran mayoría provenientes de Sur América, estando ausente el género en las Antillas Mayores y siendo el Estado mexicano de Tamaulipas el aparente límite máximo de su distribución septentrional (SOLÍS & KOHLMANN, 2013). Las especies se caracterizan por su tamaño pequeño (3-11 mm), dorso aplanado, coloración oscura, generalmente negros, cuerpo liso y lustroso; clípeo con dos o cuatro dentículos; tibias medias y posteriores con tubérculos, patas anteriores alargadas en los machos y cortas en las hembras (CULTID et al., 2012). Los cinco ejemplares de este género (correspondiente al 0,2% del total) se capturaron dentro del bosque en trampas de caída cebadas con excremento de humano y pescado en descomposición (Tabla 2). Particularmente los pocos representantes se recolectaron en épocas diferentes del trabajo de campo (febrero-marzo, junio, septiembre y noviembre).
Tribu Eurysternini, género Eurysternus Dalman (Figura 7H)
Eurysternus es el único género de la tribu Eurysternini y uno de los tres grupos de escarabajos estercoleros endémicos del neotrópico, junto a Eucraniini y Phanaeini (CAMBEFORT, 1991), se distribuye desde el centro de México hasta el sur de Brasil en diferentes tipos de bosques y consume una dieta variada de carroña, heces, e incluso hojas (CAMERO-RUBIO & LOBO, 2012). Las especies de este género se caracterizan por su tamaño pequeño a mediano (5-15 mm), forma rectangular y dorso aplanado. No presentan cuernos o protuberancias en la cabeza y el pronoto (CULTID et al., 2012). Las especies de Eurysternus hacen bolas de excremento pero no son rodadas, en su lugar son enterradas en nidos cavados por debajo de la fuente de excremento (HALFFTER & EDMONDS, 1982). Se encontraron 74 ejemplares de E. foedus (lo cual representa el 2,9% del total) (Tabla 2), restringidos exclusivamente al bosque. Llama la atención en este estudio que la tribu estuvo representada por una sola especie que fue atraída por el excremento de humano y de porcino, situación que se aprovechó para su captura con las trampas de caída.
Tribu Onthophagini, género Onthophagus Latreille
Onthophagus es un género de distribución mundial que incluye cerca de 2.000 especies descritas. La diversidad de este género se acentúa en la región oriental del planeta donde es muy rica, comparable solo con la diversidad de la región de África tropical. A pesar del creciente número de especies descritas se considera un grupo poco estudiado especialmente en el Nuevo Mundo (TARASOV & KABAKOV, 2010). De longitud variable (4 a 8 mm), es común que los machos presenten cuernos en la cabeza y una proyección en el clípeo hacia adelante en forma de punta no aguda. Las hembras no tienen el clípeo proyectado y no tienen cuernos y tienen dos carinas transversales en la cabeza, dando una apariencia bilobulada. El género Onthophagus se caracterizó como el segundo de mayor abundancia en este estudio con 689 ejemplares (26,9% del total), repartidos en las especies O. clypeatus (433 ejemplares, 16,9% del total) (Figura 7I) y O. nemorivagus (256 ejemplares, 10% del total), presentes tanto en el potrero como en el bosque. Las dos especies se encontraron en trampas de caída cebadas con excremento de humano y de porcino y particularmente con pescado en descomposición, situación que manifiesta un espectro trófico más amplio.
Tribu Phanaeini, género Coprophanaeus Olsoufieff
El género Coprophanaeus contiene cerca de 40 especies distribuidas desde el sur de los Estado Unidos hasta el centro de Argentina, la mayoría sus representantes se encuentran en el centro de Suramérica, especialmente en la región amazónica (EDMONDS, 2008). Son escarabajos de tamaño mediano y cuerpo robusto (14-28 mm), generalmente de coloración oscura con reflejos muy llamativos verde o púrpura metálicos, presentan el clípeo con dos dentículos agudos muy marcados y ojos prominentes. Las hembras presentan carina en la frente, algunas con tubérculos y los machos exhiben cuernos y tubérculos pronunciados en el pronoto. Son muy activos durante el crepúsculo y la noche y se encuentran especialmente en bosques de tierras bajas (CULTID et al., 2012). La especie C. corythus (Figura 7J) la más abundante en los ambientes estudiados (Tabla 2), se registró en el bosque y en el potrero. Los 583 ejemplares encontrados se repartieron proporcionalmente a lo largo de los trece meses que duró el trabajo de campo (22,7% del total colectado) y para su captura se utilizaron trampas de caída cebadas con excremento de humano y de porcino, y pescado en descomposición.
Género Phanaeus Macleay
Las 51 especies del género Phanaeus se distribuyen desde el sur de Estados Unidos hasta el norte de Argentina, el grupo incluye una parte importante de la fauna neotropical de escarabajos del estiércol preferencialmente coprófagos que usan excrementos húmedos de grandes herbívoros y omnívoros (PRICE & MAY, 2009). Son escarabajos de tamaño mediano (13-20 mm), color variable, de aspecto lustroso e iridiscente. Presentan clípeo con dos dentículos y margen anterior del pronoto interrumpido detrás de los ojos (CULTID et al., 2012). El comportamiento de nidificación de Phanaeus se caracteriza principalmente por la formación de galerías y más que rodaje, su comportamiento es de empujar. De este género exclusivamente neotropical se encontraron 91 ejemplares (3,5% del total recolectado) que aparecieron constantemente durante el periodo de colecta. La población se capturó dentro de trampas de caída cebadas con excremento de humano y de porcino, y pescado en descomposición, que se instalaron en el potrero y en el bosque. El género Phanaeus se ha destacado por su elaborado comportamiento, colores y cuernos que hacen que estos escarabajos sean objeto de numerosas publicaciones sobre la competencia entre machos, cooperación bisexual y nidificación (PRICE & MAY, 2009).
COMENTARIOS ADICIONALES
Familia Carabidae, nuevos registros
Se registran por primera vez los géneros Agra, Catapiesis, Clivina, Coptia, Morion y Trichognathus para el departamento de Caldas. Estos datos se suman a los registros de MARTÍNEZ (2005a) con el género Galerita en el municipio de Palestina (Caldas) para ampliar la lista original. Se considera que los eventos ecológicos encontrados en la RNRM favorecen la alta riqueza específica de poblaciones de Carabidae (diez géneros), esta situación está justificada por otros resultados obtenidos para tres departamentos de la zona cafetera de Colombia (Caldas, Quindío y Risaralda) (MARTÍNEZ, 2005b) y Sierra Nevada de Santa Marta (CAMERO-RUBIO, 2003) en cuyo caso la riqueza ecológica es comparable con la de los ecosistemas de transición de bosque seco a húmedo, propio de la región del Magdalena Medio colombiano. Igualmente, la diversidad de hábitos de los representantes de la familia Carabidae encontrados en la RNRM permite ubicarlos en diferentes estratos, desde el piso del bosque hasta aquellos que viven en la hojarasca o como cortícolas y arbóreos, parasitoides, carroñeros y depredadores, características de gran importancia en la estructura de los ecosistemas ya que son valiosos reguladores de poblaciones de otros organismos, especialmente especies plaga para cultivos o como modelos de interpretación del grado de perturbación (bioindicadores) de aguas (SASKA & HONEK, 2012), calidad del aire (AVGIN & LUFF, 2010), calidad del suelo (TYLER, 2008) y estructura de bosques (WERNER & RAFFA, 2000; ALLEGRO & SCIAKY, 2003). Nos parece adecuado mencionar el efecto positivo de la luz negra de las trampas instaladas como el método más efectivo de colecta de poblaciones de Carabidae, esto sugiere incluirlas dentro de los métodos tradicionales en investigaciones futuras.
Subfamilia Scarabaeinae
Al comparar la riqueza de esta subfamilia en la RNRM con la de un bosque seco tropical en el departamento de Tolima (Colombia) (ESCOBAR, 1997), hay 10 géneros que se traslapan excepto el género Malagoniella. En el bosque tolimense no se presentaron los géneros Ontherus y Coprophanaeus. Para estos dos ambientes existen especies comunes como C. aequinoctialis y C. subhyalinus.
FUENTES & CAMERO-RUBIO (2006) en un bosque húmedo tropical en el mismo departamento, encontraron 13 géneros de la subfamilia Scarabaeinae, los géneros que se traslapan con los encontrados en la RNRM son: Ateuchus, Canthidium, Canthon, Coprophanaeus, Deltochilum, Dichotomius, Eurysternus, Onthophagus, Phanaeus y Uroxys compartiendo especies como C. aequinoctialis, C. subhyalinus y E. foedus.
Las especies como C. aequinoctialis y C. subhyalinus se presentan en los tres tipos de bosque (bosque húmedo tropical y bosque seco tropical del departamento del Tolima y bosque de la Reserva Natural Río Manso del departamento de Caldas); teniendo en cuenta que los tres bosques se encuentran en ambientes bañados por el río Magdalena, los dos primeros se encuentran en diferentes sitios del departamento del Tolima y la RNRM se encuentra al norte del departamento de Caldas, la distribución de estas especies es amplia.
Hábitos de relocalización
Las especies telecópridas (rodadores) del género Deltochilum encontradas en la RNRM forman bolas de excremento y las ruedan para enterrarlas a cierta distancia del depósito original, este hábito permite la distribución de la materia orgánica dentro del bosque, quedando disponible para otros organismos incluyendo los degradadores. Los paracópridos (cavadores) en los que se encuentran las especies del género Onthophagus, se caracterizan porque los individuos cavan túneles debajo de la pila de excremento, allí entierran fragmentos de este para depositar sus huevos y continuar con su ciclo de vida; finalmente, las especies de hábito endocóprido (residentes) representado por individuos del género Eurysternus, se destacan porque separan una porción del excremento y construyen su nido dentro o inmediatamente debajo de la deyección. Se destacaron por su exclusividad dada la actividad dentro del bosque en parches muy centrados. Estos hábitos permiten que los residuos orgánicos como estiércol y carroña sean repartidos homogéneamente dentro del bosque, facilitan la aireación y la fertilidad del suelo y de manera positiva contribuyen al desarrollo de sus ciclos biológicos. Por otro lado, cuando los excrementos son desplazados permiten la redistribución de semillas dentro del bosque, evento importante en el proceso biológico de la sucesión (HOWDEN & YOUNG, 1981; CAMBEFORT, 1991; EDMONDS, 2008; CAMERO-RUBIO & LOBO, 2012).
Al comparar los resultados de las diversidades alfa y beta entre el bosque y el potrero de la RNRM, estas muestran un valor puntual de a = 16 para el bosque, en comparación con el potrero que presenta un valor de a = 6; el bosque es esencialmente más complejo, se encontraron especies con espectros tróficos específicos como aquellos del género Deltochilum con hábitos coprófagos y necrófagos, los del género Ontherus hallados en remanentes de bosque asociadas con excrementos de animales y los de los géneros Uroxys y Eurysternus en los sitios más internos asociados con excremento de animales. La diferencia de las comunidades en los dos ambientes, puede ser aprovechada para justificar el valor de estos géneros como indicadores de perturbación ambiental en ecosistemas parecidos que estén siendo afectados por las actividades humanas.
Las poblaciones de insectos en la RNRM mostraron una simetría proporcional con la presencia de las lluvias (Figura 5), estas aumentaron bien cuando aumentaron los registros de lluvias coincidiendo con los dos picos del régimen bimodal propio de nuestro país; en contraste, la riqueza de especies no se vio afectada por este fenómeno. A pesar de que al traslapar las líneas que se muestran en la Figura 5 hay coincidencias, no poseemos evidencias estadísticas que nos permitan concluir la existencia directa de esta relación.
AGRADECIMIENTOS
Agradecemos a la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas por el financiamiento de este proyecto; al Dr. Jorge Arí Noriega (Universidad de los Andes) por la revisión del manuscrito y la identificación de los escarabajos coprófagos; a la familia Jaramillo, especialmente a Ana María Jaramillo por facilitar el acceso a la RNRM; al señor Misael Salgado Morales por el apoyo logístico en el Laboratorio de Entomología de la Universidad de Caldas -(LEUC),y al Ingeniero Agrónomo Lucas Esteban Hincapié Usma por su valiosa colaboración en labor de campo dentro de la RNRM.
BIBLIOGRAFÍA
ALLEGRO, G. & SCIAKY, R., 2003.- Assessing the potential role of ground beetles (Coleoptera, Carabidae) as bioindicators in poplar stands, with a newly proposed ecological index (FAI). Forest Ecology and Management, 175: 275-284. [ Links ]
ARANGO, L. & MONTES, M., 2009.- Caracterización entomológica parcial de la cuenca del río La Miel en el departamento de Caldas (Colombia). Bol. Cient. Mus. Hist. Nat. U. de Caldas, 13 (2): 249-268. [ Links ]
ARNDT, E. & DRECHSEL, U. 1998.- Description of the larva of Trichognathus marginipennis Latreille, 1829 (Coleoptera, Carabidae). Mitteilungen der Münchner Entomologischen Gesellschaft, 88: 19-24. [ Links ]
ARNDT, E., KIMSE, S. & EWIN, T. L., 2001.- Arboreal beetles of neotropical forest: Agra Fabricius, larval descriptions with notes on natural history and behavior (Coleoptera, Carabidae, Lebiini, Agrina). The Coleopterists bulletin, 55 (3): 297-311. [ Links ]
ARNETT, R.H.JR. & THOMAS, M.C (eds.)., 2000.- American Beetles. Volume 1. Archostemata, Myxophaga, Adephaga, Polyphaga: Staphyliniformia. Boca Raton, FL: CRC Press. [ Links ]
AGIN, S. S. & LUFF, M.L., 2010.- Ground beetles (Coleoptera: Carabidae) as bioindicators of human impact. Munis Entomology & Zoology, 5: 209-215. [ Links ]
BAARS, M., 1979.- Catches in pitfall traps in relation to mean densities of carabid beetles. Oecologia, 41 (1): 25-46. [ Links ]
BRANDMAYR, T.Z., MARNO, I. &, PAARMANN, W., 1994.- Graphipterus serrator: a myrmecophagous carabid beetles with mandibular suctorial tube in the larva (Coleoptera: Carabidae: Graphipterini): 8-91 (in): DESENDER, K. et al. (eds.) Carabid Beetles: Ecology and Evolution. Dordrecht: Kluwer Academic Publishers. [ Links ]
CAMBEFORT, Y., 1991.- Biogeography and Evolution: 51-62 (in) HANSKI, I. & CAMBEFORT, Y. (Eds.) Dung Beetle Ecology. New Jersey: Princeton University Press. [ Links ]
CAMERO-RUBIO, E., 2003.- Caracterización de la fauna de carábidos (Coleoptera: Carabidae) en un perfil altitudinal de la Sierra Nevada de Santa Marta, Colombia. Revista Academia Colombiana de Ciencias, XXVII (105): 491-516. [ Links ]
CAMERO-RUBIO, E. LOBO, J. M., 2012.- The distribution of the species of Eurysternus Dalman, 1824 (Coleoptera: Scarabaeidae) in America: potential distributions and the locations of areas to be surveyed. Tropical Conservation Science, 5 (2): 225-244. [ Links ]
CASTRO, A.V., PORRINI, D.P. & CICCHINO, A.C., 2012.- Ensamble peridomiciliario de carábidos (Coleoptera: Carabidae) en un talar del sudeste bonaerense, Argentina. Revista de la Sociedad Entomológica Argentina, 71 (3-4): 231-247. [ Links ]
COLWELL, R. K. 1997.- EstimateS: Statistical estimation of species richness and shared species from samples. 7.5 ed. Disponible en http://purl.oclc.org/estimate [ Links ]
COLWELL, R.K. & CODINGTON, J. A., 1994.- Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 345: 101-118. [ Links ]
CONCHA-LOZADA, C.M., GALLEGO, M.C., PARDO-LOCARNO, L.C., 2010.- Fragmentación de ecosistemas montanos e impactos estructurales y poblacionales sobre la comunidad de escarabajos coprófagos (Col.: Scarabaeinae) en el alto río Cauca, Popayán, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 14 (1): 43-55. [ Links ]
CORPOCALDAS.,2012 http://www.corpocaldas.gov.co/publicaciones/772/revistacorpoaldas2.pdf. [ Links ]
CULTID, C.A., MEDINA, C.A., MARTÍNEZ, B.G., ESCOBAR, A.F., CONSTANTINO, L.M. & BETANCUR, N.J., 2012.- Escarabajos coprófagos (Scarabaeinae) del Eje Cafetero: guía para el estudio Ecológico. Colombia: WCS Books. [ Links ]
DE DUVE, C., 1999.- Polvo Vital. Primera edición en castellano. Santafé de Bogotá: Ed. Norma. [ Links ]
DOS SANTOS, G.I.M., 2012.- On immature and adult forms of Trichognathus marginipennis Latreille, 1829 (Coleoptera, Carabidae, Galeritini). ZooKeys, 212: 45-62. [ Links ]
EDMONDS, W.D., 2008.- A new species of Coprophanaeus Olsoufieff (Coleoptera: Scarabaeidae) from Bolivia. Zootaxa,1723: 42-46. [ Links ]
ELRON, E., SHLAGMAN, A. & GASITH, A., 2007.- First detailed report of predation on anuran metamorphs by terrestrial beetle larvae. Herpetological Review, 38: 30-33. [ Links ]
ESCOBAR, F., 1997.- Estudio de la comunidad de coleopteros coprófagos (Scarabaeidae) en un remanente de bosque seco al norte del Tolima, Colombia. Diversidad Biológica, 19: 419-430. [ Links ]
ESTRADA, E. & SALAZAR, J., 2004.- Coleoptera II: sobre algunas localidades colombianas para conocer y estudiar a Enceladus gigas Bonelli (Coleóptera: Carabidae, Siagoninae). Bol. Cient. Mus. Hist. Nat. U.de Caldas, 8:, 224. [ Links ]
ERWIN, T.L., (1970). A reclassification of bombardier beetles and a taxonomic revision of the North and Middle American species (Carabidae: Brachinida). Quaestiones Entomologicae, 6: 4-215. [ Links ]
________, 1981.- A synopsis of the immature stages of Pseudomorphini (Coleoptera: Carabidae) with notes on tribal affinities and behavior in relation to life with ants. The Coleopterists' Bulletin, 35 (1): 53-68. [ Links ]
________, 1991.- The ground-beetles of Central America (Carabidae), part II: Notiophilini, Loricerini, and Carabini. Smithsonian Contributions to Zoology, 501: 1-30. [ Links ]
________, 2001.- Checklist of the Western Hemisphere Caraboidea (Coleoptera). http://entomology.si.edu/Entomology/WstrnCarabids [ [ Links ]URL no longer active due to Smithsonian Firewall requirements; updated database available upon request].
________, 2002.- The Beetle Family Carabidae of Costa Rica: Twenty-nine new species of Agra Fabricius 1801 (Coleoptera: Carabidae, Lebiini, Agrina). Zootaxa, 119: 1-68. [ Links ]
________, 2004.- The Beetle Family Carabidae of Costa Rica: The genera of the Cryptobatida group of subtribe Agrina, tribe Lebiini, with new species and notes on their way of life (Insecta: Coleoptera). Zootaxa, 662: 1-54. [ Links ]
ERWIN, T.L. & MEDINA, R.F., 2003.- The neotropical species Askalaphium depressum (Bates): Larval description, first diagnosis and illustrations of immature Ctenodactylini, with natural history notes on the genus and tribe (Coleoptera: Carabidae). Zootaxa, 273: 1-15. [ Links ]
FORSYTHE, T.G., 1982.- Feeding mechanisms of certain ground beetles (Coleoptera: Carabidae). The Coleopterists Bulleti, 36: 26-73. [ Links ]
FRANK, J.H., ERWIN, T.L. & HEMENWAY, R.C., 2009.- Economically Beneficial Ground Beetles. The specialized predators Pheropsophus aequinoctialis (L.) and Stenaptinus jessoensis (Morawitz): Their laboratory behavior and descriptions of immature stages (Coleoptera, Carabidae, Brachininae). ZooKeys, 14: 1-36. [ Links ]
FUENTES, P.V. & CAMERO-RUBIO, E., 2006.- Estudio de la fauna de escarabajos coprófagos (Coleoptera: Scarabaeidae) en un Bosque Húmedo Tropical de Colombia. Entomotropica,26: 133-143. [ Links ]
GÉNIER, F., 1996.- A revision of the Neotropical genus Ontherus Erichson (Coleoptera: Scarabeidae, Scarabaeinae). Memoirs of the Entomological Society of Canada, 170: 1-169. [ Links ]
________, 2012.- A new species and notes on the subgenus Deltochilum (Deltochilum) Eschscholtz, 1822 (Coleoptera: Scarabaeidae: Scarabaeinae: Deltochilini). Zootaxa, 3357: 25-36. [ Links ]
HALFFTER, G. & EDMONDS, W., 1982.- The nesting behaviour of dung beetles (Scarabaeinae): An ecological and evolutive approach. Instituto de Ecología, Xalaa, México, D. F. [ Links ]
HALFFTER, G. & MORENO, C.E., 2005.- Significado biológico de las diversidades Alfa, Beta y Gamma (in) HALFFTER, SOBERÓN, KOLEFF & MELIC (eds.) Sobre Diversidad Biológica: El significado de las diverisdades alfa, beta y gamma. Zaragoza, España: m3m, Monografías Tercer Milenio. [ Links ]
HALFFTER,G., MORENO, C. E. & PINEDA, E.O., 2001.- Manual para evaluación de la biodiversidad en reservas de la biosfera. Zaragoza, España: GORFI, S.A [ Links ]
HOLDRIDGE, L. R., 1982.- Ecología basada en zonas de vida. Instituto Interamericano de Cooperación de la Agricultura. San José de Costa Rica. [ Links ]
HOLLAND, J. & SMITH, S., 1999.- Sampling epigeal arthropods: an evaluation of fenced pitfall taps usin mark- release- recapture and comparisons to unfenced pitfall traps in arable crops. Entomologia Experimentalis et Applicata, 91 (2): 347-357. [ Links ]
HOWDEN, H.F. & YOUNG, O.P., 1981.- Panamanian Scarabaeinae: Taxonomy, Distribution and Habits (Coleoptera, Scarabaeidae). Contributions of the American Entomological Institute 18 (1): 1-204. [ Links ]
JIMÉNEZ, A. & HORTAL, J., 2000.- Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventrios biológicos". Revista Ibérica de Aracnología. [on line]. Recuperado de http://entomologia.rediris.es/sea/publicaciones/ria/index.thm [ Links ]
JOLIVET, P., 1967.- Les Alticides vénéneux de l'Afrique du Sud. L'Entomologiste, 23: 100-111. [ Links ]
KOHLMANN, B., SOLÍS, A., ORTWIN, E., SOTO, X. & RUSSO, R., 2007.- Biodiversity, conservation, and hotspot atlas of Costa Rica: a dung beetle perspective (Coleoptera: Scarabaeidae: Scarabaeinae). Zootaxa, 1457: 1-34. [ Links ]
LAROCHELLE, A. & LARIVIÈRE, M.-C., 2003.- A natural history of the ground-beetles (Coleoptera: Carabidae) of America orth of Mexico., Auckland, New Zealand: PENSOFT Publishers. [ Links ]
LIEBHERR, J.K. & KAVANAUGH, D.H., 1985.- Ovoviparity in carabid beetles of the genus Pseudomorpha (Insecta: Coleoptera). Journal of Natural History, 19: 109-1086. [ Links ]
LIMA, D. C., 1952.- Insetos do Brasil. Escola Nacional Agronomia, VII. [ Links ]
LINDROTH, C.H., 1954.- Die larve von Lebia chlorocephala Hoffm. (Coleoptera: Carabidae). Opuscula Entomologica, 19: 29-33. [ Links ]
________, 1968.- The ground beetles (Carabidae excl. Cicindelinae) of Canada and Alaska. Part 5. Opuscula Entomologica, Supplementum, 33: 649-1192. [ Links ]
MARTÍNEZ, C., 2005a.- Informe de los Carabidos (Insecta: Coleoptea: Carabidae) en la cuenca media del cañon del río Barbas (Filandia, Quindío), cuenca media del río Chamnery (Aranzazu, Caldas), SFF Otún Quimbaya (Pereira, Risaralda) y cuenca del río chinchina (Manizales, Caldas). Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. [ Links ]
________, 2005b.- Introducción a los escarabajos Carabidae (Coleoptera) de Colombia. Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. [ Links ]
MEDINA, C.A. & CULTID, C., 2010.- Reconocimiento taxonómico de las especies de escarabajos coprófagos del Sistema Regional de Áreas Protegidas del Eje Cafetero (SIRAP-EC). Wildlife Conservation Society - Programa Colombia, Fundación para la Promoción de la Investigación y la Tecnología del Banco. Cali, Valle del Cauca, Colombia. (Informe técnico). [ Links ]
MEDINA, C.A. & LOPERA, A., 2000.- Clave ilustrada para la identificación de géneros de escarabajos coprófagos (Coleoptera: Scarabaeinae) de Colombia Escarabajos Coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) de Colombia. Caldasia, 22 (2): 299-315. [ Links ]
MEDINA, C.A., LOPERA, A., VÍTOLO, A. & GILL, B., 2001.- Escarabajos Coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) de Colombia. Biota Colombiana, II:, 31-144. [ Links ]
MENDOZA, C. H., 1999.- Estructura y riqueza florística del bosque seco tropical en la región Caribe y el Valle del río Magdalena, Colombia. Caldasia,. 21 (1): 89-97. [ Links ]
MURILLO, D.A., QUIROS, K. & RODRÍGUEZ, A., 2009.- Estudio preliminar de la composición de escarabajos copronecrófilos (Scarabaeidae), en la estación ambiental Tutunendo Quibdó, Chocó, Colombia. Zoología, 29: 102-9. [ Links ]
MYERS, N., 1992.- Tropical Deforestatión and Climatic Change: The conceptual Background: 1-3 (in) MYERS, N. (ed.) Tropical Forest and Climate. Library of Congress Cataloging. [ Links ]
MYERS, N., MITTERMEIER, R.A., MITTERMEIER, C.G.; DA FONSECA, G.A.B. & KENT, J., 2000.- Biodiversity hotspots for conservation priorities. Nature, 403 (6772): 853-858. [ Links ]
NORIEGA, J.A., 2012.- Dung Beetles (Coleoptera: Scarabaeinae) Attracted to Lagothrix lagotricha (Humboldt) and Alouatta seniculus (Linnaeus) (Primates: Atelidae) Dung in a Colombian Amazon Forest. Psyche: A Journal of Entomology, I. [ Links ]
NORIEGA, J.A., MORENO, J., OTAVO, S. & CASTAÑO, E., 2012.- New departmental records for Digitonthophagus gazella (Coleoptera: Scarabaeidae) in Colombia. Acta Biolgica Colombiana, 1:, 201-204. [ Links ]
AIK, J. K., TRAC, D. H. & WILL, K., 2006.- Carabidae from Vietnam (Coleoptera). Journal of Asia-acific Entomology, 9:, 85-105. [ Links ]
PARDO-LOCARNO, L.C. 2007.- Escarabajos coprófagos (Coleoptera-Scarabaeidae) de LLoró, departamento del Chocó, Colombia. Bol. Cient. Mus. Hist. Nat. U. deCaldas, 11: 377-388. [ Links ]
PARDO-LOCARNO, L.C., PUERTA-PAZ, M. & PULIDO, J.I., 1991.- Coleópteros de la zona plana del Valle de Cauca. Agricultura Tropical, 28 (3): 93-108. [ Links ]
PRICE, L. & MAY, M.L., 2009.- Behavioral ecology of Phanaeus dung beetles (Coleoptera: Scarabaeidae): review and new observations. Acta Zoológica Mexicana (nova series), 25 (1):211-238. [ Links ]
RAWORTH, D. &; CHOI, M.-Y., 2001.- Determining numbers of active carabid beetles per unit area from pitfall-trap data. Entomologia Experimentalis et Applicata, 98 (1): 95-108. [ Links ]
REICHARDT, H., 1971.- Notes on the bombarding behavior of three carabid beetles (Coleoptera, Carabidae). Revista Brasileira de Entomologia, 15: 31-34. [ Links ]
SASKA, P. & HONEK, A., 2012.- Efficiency of host utilisation by coleopteran parasitoid. Journal of Insect Physiology, 8:, 35-40. [ Links ]
SCHOLTZ, C. H., DAVIS, A. & KRYGER, U., 2009.- Evolutionary Biology and Conservation of Dung Beetles. Bulgaria: Pensoft ublishers. [ Links ]
SCHWARZ, E. A. 1884.- Carabidae confined to single plants. Bulletin of the Brooklyn Entomological Society, 6: 13 5-136. [ Links ]
SOLÍS, A. & KOHLMANN, B., 2013.- El género Uroxys (Coleoptera: Scarabaeidae) en Costa Rica. Giornale italiano di Entomologia, 13 (58): 289-340. [ Links ]
STRAHS, G., 1969.- Biochemistry at 100C: Explosive Secretory Discharge of Bombardier Beetles (Brachius). Science, Vol. 65:, 60-63. [ Links ]
TARASOV, I. S. & KABAKOV, O., 2010.- Two new species of Onthophagus (Coleoptera: Scarabaeidae) from Indochina, with a discussion of some problems with the classification of Serrophorus and similar subgenera. Zootaxa, 2344: 17-28. [ Links ]
TYLER, G., 2008.- Differences in abundance, species richness, and body size of ground beetles (Coleoptera: Carabidae) between beech (Fagus sylvatica L.) forests on Podzol and Cambisol. Forest Ecology and Man [ Links ]
VAZ-DE-MELLO, F.Z., EDMONDS, W.D., OCAMPO, F.C. & SCHOOLMEESTERS, P., 2011.- A multilingual key to the genera and subgenera of the subfamily Scarabaeinae of the New World (Coleoptera: Scarabaeidae). Zootaxa, 2854: 1-73. [ Links ]
VILLARREAL, H., ÁLVAREZ, M., ESCOBAR, F., FAGUA, G., GAST, F., MENDOZA, H., OSPINA, M. & UMAÑA, A M., 2006.- Manual de médodos para el desarrollo de inventarios de biodiversidad. Bogotá, Colombia, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. [ Links ]
WERNER, S M. & RAFFA, K F., 2000.- Effects of forest management practices on the diversity of ground-occurring beetles in mixed northern hardwood forests of the Great Lakes Region. Forest Ecology and Management, 139: 135-155. [ Links ]
WOLDA, H., 1988.- Insect seasonality: Why? 68. Annu. Rev. Ecol. Syst., 19: 1-18. agement, 256: 2154-2159. [ Links ]













