Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.17 no.2 Manizales July/Dec. 2013
APORTE AL CONOCIMIENTO PARA LA CONSERVACIÓN DE LAS MARIPOSAS (HESPERIOIDEA Y PAPILIONOIDEA) EN EL PÁRAMO DEL TABLAZO, CUNDINAMARCA (COLOMBIA)*
CONTRIBUTION TO THE KNOWLEDGE FOR THE CONSERVATION OF BUTERFLIES (HESPERIOIDEA Y PAPILIONOIDEA) IN EL TABLAZO MOOR, CUNDINAMARCA (COLOMBIA)
Fredy Montero-A.1 y Maira Ortiz-P.2
* FR: 3-XI-2012. FA: 8-VII-2013.
1 Investigador adscrito a la Asociación Colombiana de Lepidopterología, ACOLEP, Bogotá, Colombia. E-mail: eurimontero@yahoo.es
2 Bióloga. Universidad del Atlántico. Bogotá, Colombia. E-mail: biomayortiz@hotmail.com
Resumen
Buscando proporcionar información al conocimiento de la diversidad, ecología y biología de algunas de las mariposas diurnas (Hesperioidea y Papilionoidea) del Páramo del Tablazo, se realizaron colectas durante los meses de enero, febrero, marzo, agosto y septiembre de 2012, en un transecto dirigido altitudinalmente desde los 3000 hasta los 3500 msnm. Se reporta un total de 60 especies correspondientes a cuatro familias (Hesperiidae, Nymphalidae, Pieridae y Lycaenidae) y 32 géneros. La especie más abundante es Colias dimera (Pieridae: Coliadinae). Se reportan nuevos registros de distribución altitudinal para varias especies. Adicionalmente se aportan los ciclos de vida de seis especies de dos familias: Pieridae: (Pierini: Aporiina): Catasticta semiramis; Nymphalidae: pronophilina: Pedaliodes phaea, P. phaeinea, P. pollusca, P. phoenissa, P. empusa. Se estableció la asociación de estas con las plantas hospedero. Se comentan características morfológicas de cada uno de los instares preimaginales, al igual que aspectos etológicos. Todos los ciclos biológicos excepto P. phoenissa Hewitson son desconocidos hasta el momento de esta publicación.
Palabras clave: Colombia, Cundinamarca, páramo, diversidad, altitud, Satyrinae, Pronophilina, Catasticta, ciclos de vida, conservación.
Abstract
Searching to provide information and knowledge to the diversity, ecology and biology of some daytime butterflies (Hesperioidea and Papilionoidea) from El Tablazo moor, collections were carried out during the months of January, Februray, March, August and September 2012 within an area of 3,000 and 3,500 masl. A total of 60 species belonging to four families (Hesperiidae, Nymphalidae, Pieridae and Lycaenidae) and 32 genera were registered. The most abundant species was Colias dimera (Pieridae: Coliadinae). New altitudinal distribution records are reported for several species. Aditionally, the life cycles of six species from two families were provided: Pieridae: (Pierini: Aporiina): Catasticta semiramis; Nymphalidae: pronophilina: Pedaliodes phaea, P. phaeinea, P. pollusca, P. phoenissa, P. empusa. The association of these species with the host plant was established. Morphologic characcteristis of each one of the preimaging stances and ethology aspects are discussed. All biological cycles except P. phoenissa Hewitson are unknown until the moment this publication is issued.
Key words: Colombia, Cundinamarca, moor, diversity, altitude, Satyrinae, Pronophilina, Catasticta, life cycles, conservation.
INTRODUCCIÓN
Las mariposas han sido frecuentemente utilizadas como buenos indicadores debido al amplio conocimiento de su taxonomía, facilidad de observación y colecta en el campo, amplitud de ocupación de hábitats y rangos geográficos, especialización en nichos ecológicos de algunas especies y patrones biológicos correlacionados con otros taxa, además de otras características propias (BROWN, 1981; CAMBERFORT, 1991; HALFFTER, 1991; HOLLOWAY & STORK, 1991; KREMEN et al., 1993).
El reconocido papel de las mariposas como indicadores del estado de conservación, diversidad, endemismo y grado de intervención de una biota, se constituye en una herramienta importante en la conservación de hábitats (BROWN, 1981).
Algunas estrategias muy interesantes para favorecer el mantenimiento o aumento de la diversidad de los lepidópteros en zonas urbanas, podrían ser la utilización de plantas nutricias de especies autóctonas y la conservación o restauración del bosque en galería en las rondas de quebradas y ríos. El manejo racional y amable ecológicamente, de los suelos de uso agrícola y ganadero tradicionales, resultaría vital para evitar la desaparición de algunas especies, la recuperación de otras y el mantenimiento con poblaciones abundantes de las más resistentes (BAQUERO et al., 2011).
Tras los últimos años, diversos procesos de perturbación natural y antrópica en Colombia están ocasionado progresivamente una disminución de los hábitats naturales, lo cual tiene un gran impacto sobre las poblaciones animales y vegetales en los diferentes ecosistemas del país. Estos procesos conllevan a la fragmentación de las comunidades vegetales nativas de los ecosistemas montanos, resultando en un mosaico de remanentes de hábitats naturales y sinantrópicos a través de toda la región andina (CORTÉS & FAGUA, 2003).
Los individuos de diferentes especies, como los lepidópteros, no pueden cruzar de un fragmento a otro, debido a las diferentes características medioambientales hostiles que se generan en cada fragmento, como lo es la variabilidad en los microhábitats y la posible exposición a nuevos depredadores (LOVEJOY et al., 1986; ANDRADE, 1998). Esto genera la pérdida de la capacidad de mantener estable a la biota presente en estas zonas fragmentadas y en consecuencia la disminución de la diversidad genética y posibles extinciones locales. Además, se producen desplazamientos o reemplazamientos de las diferentes especies naturales por otras más adaptadas al tipo de ambiente generadas por la fragmentación (MAHECHA et al., 2011).
Este documento presenta una lista preliminar de las especies de Rhopalocera reportadas durante las pesquisas y los resultados obtenidos tras lograr criar algunas de las mismas en el área de estudio, convirtiéndose en información base relevante para la conservación de la lepidopterofauna en el Páramo del Tablazo y en general para la Sabana de Bogotá.
MATERIALES Y MÉTODOS
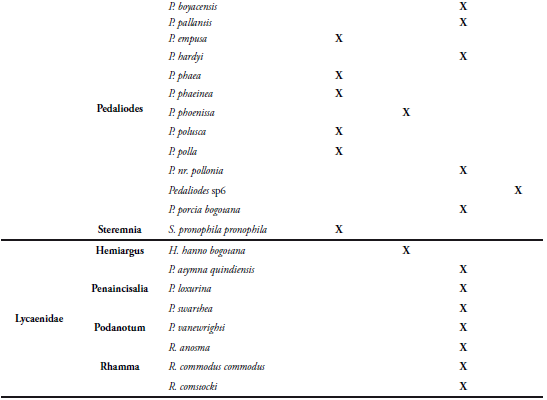
Los muestreos y el trabajo de campo se realizaron durante los meses de enero, febrero, marzo, agosto y septiembre de 2012, correspondientes a la época de verano, ya que en invierno no es posible la colecta de individuos por dificultades en el clima que presenta la zona. Se establecieron seis estaciones altitudinales cada 100 metros (Tabla 1), iniciando en 3000 hasta 3500 msnm, con caminatas lineales durante todo el transecto (Figura 1).
Se utilizaron redes entomológicas, con un esfuerzo de muestreo de ocho horas diarias ejecutadas por dos colectores, iniciando a las 8:00 horas y finalizando a las 16:00 horas, durante 63 días en total. El muestreo se complementó con 10 trampas Van Someren-Rydon (DEVRIES, 1987), cebadas con macerado de fruta fermentada (banano, mango) y excremento humano, ubicadas dos trampas equidistantes a cada estación altitudinal. Las trampas fueron revisadas 2 veces al día: a las 9:00 y a las 15:00.

Los ejemplares se sacrificaron por medio de presión digital en el tórax y se colocaron en sobres de papel mantequilla rotulados con los datos básicos de colecta; posteriormente fueron guardados en recipientes herméticos con pastillas de alcanfor hasta su preparación e identificación. La identificación taxonómica se realizó con el apoyo del taxónomo Jean François Le Crom, autor de la serie de libros Mariposas de Colombia. Los especímenes, fotografiados e identificados, fueron depositados en la colección del Museo Entomológico Francisco Luis Gallego, Medellín.
La metodología aplicada al muestreo en campo para la obtención de inmaduros, se realizó de dos formas: 1) La búsqueda de huevos y larvas en las plantas que se encuentran a lo largo de caminos y ecotonos de las localidades ya definidas; esto para las especies de las que se tenía conocimiento de su planta hospedante. 2) La captura de hembras en campo, llevándolas al laboratorio y colocándolas en bolsas ziplock para inducirlas a la ovoposición. Para las especies que se desconocía su planta hospedante, se monitorearon, contando determinar el momento de su postura, para definir la planta a la que se asocian.
Los huevos o larvas obtenidos, fueron llevados al laboratorio, ubicado en la misma zona de vida de las especies (3250 msnm), donde se criaron hasta la obtención de los adultos. Los huevos, se dispusieron en cajas de Petri, con papel secante húmedo en el fondo, hasta la eclosión de las larvas. Las larvas se mantuvieron en contenedores plásticos donde se agregan ramas de la planta hospedero, para su alimentación. Los recipientes fueron limpiados periódicamente con el fin de retirar excrementos y humedad residual, para evitar patógenos que puedan ser negativos en el desarrollo de las larvas. Las pupas se suspendieron en un recipiente pupario.
A cada una de las larvas le fue llevado un registro escrito, con datos de tamaño, tiempo de desarrollo, comportamiento, y un registro fotográfico, para hacer visual los detalles de cada especie en cada una de sus diferentes etapas.
Análisis de datos
Para el análisis de datos se realizaron gráficas para la riqueza y abundancia de las especies con respecto a las familias de mariposas encontradas en la zona de estudio y por las estaciones altitudinales establecidas.
Se calculó el índice de riqueza de Margalef (D) y el porcentaje de abundancia relativa. La diversidad total y por estaciones (altitud) se analizó a través del índice de Shannon (H'); y el coeficiente de similitud de Bray-Curtis, para establecer similaridad entre estaciones.
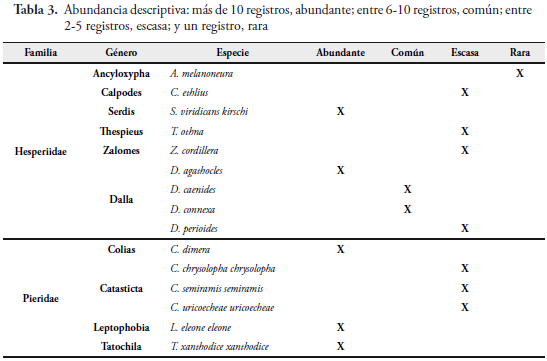
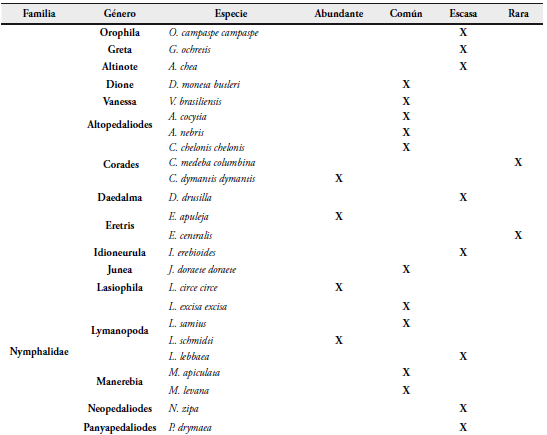
Para analizar la abundancia y riqueza de las mariposas en el área de estudio, se utilizó la metodología de FAGUA (1996) adaptada por HENAO (2006): se tomó la riqueza como el número de especies presentes en la zona de vida, y la abundancia se determinó como el número de registros de una especie dentro del muestreo.
La estimación de la abundancia fue descriptiva (Tabla 3), y se obtuvo según la frecuencia de las observaciones en todos los muestreos y se clasificaron así:
- Especies abundantes: más de 10 registros.
- Especies comunes: entre 6-10 registros.
- Especies escasas: de 2 a 5 registros.
- Especies raras: 1 solo registro.
Área de estudio
El municipio de Subachoque se encuentra ubicado en la vertiente occidental de la Cordillera Oriental de los Andes colombianos en el departamento de Cundinamarca (Colombia) y en su parte alta se localiza el Páramo del Tablazo. El clima de la región se caracteriza por sus fuertes lluvias la mayor parte del año con dos picos de precipitación en abril y octubre. Los bosques y ecosistemas del municipio han sido sometidos a una fuerte presión debido a la tala para cultivo o cría de ganado. Esto ha creado un diverso mosaico de vegetación que va desde potreros y cultivos hasta bosques secundarios en proceso de recuperación.
La Cuchilla (Páramo) del Tablazo está situada en la zona sur-occidental del Complejo Guerrero, sistema de páramos del noroeste de Cundinamarca que incluye localidades como cerros Socotá, Santuario y Colorado, páramos Napa, Alto, Guargua y laguna Verde, los altos de La Mina y El Muchacho (RANGEL, 2000). El complejo se ubica en las zonas altas de los municipios de Carmen de Carupa, Zipaquirá, Cogua, Pacho, San Cayetano, Supatá y Subachoque (Cuchilla del Tablazo). Ocupa unas 39.240 hectáreas (ha), entre los 3200 y los 3780 metros sobre el nivel del mar (Figura 2).
Las precipitaciones presentan un régimen bimodal, con dos periodos húmedos (abril-mayo; octubre-noviembre) y dos secos (diciembre-marzo; julio-septiembre). La temperatura promedio varía entre 7,2 y 11,1°C (MAHECHA, et al, 2004). Por encima de la cota 3200 msnm, la Corporación Autónoma Regional de Cundinamarca (CAR) y Conservación Internacional (CI) en el año 2004, identificaron para el Complejo Guerrero tres unidades de vegetación: páramo, bosques altoandinos y asociación de matorrales, rastrojos y vegetación de subpáramo (MAHECHA, et al, 2004). El páramo está dominado por comunidades vegetales de frailejones y gramíneas en macolla, donde se entremezclan matorrales y prados que incrementan la diversidad de flora del complejo. Se registra en alto porcentaje las familias Poaceae, Asteraceae, Ericaceae, Melastomataceae, Rosaceae y Rubiaceae, especialmente los géneros Espeletia, Calamagrostis, Puya, Hypericum, Valeriana y Miconia. De las especies de frailejón reportadas se destacan Espeletia chocontana, E. cayetana, E. barclayana y Espeletiopsis corymbosa por ser endémicas de la región (MAHECHA, et al, 2004).
Se identifican como especies arbóreas dominantes Cavendishia nitida, Clusia multiflora, Drimys granadensis, Macleania rupestris y Weinmannia microphylla, así como los conglomerados de Chusquea aff. scandens como la manifestación vegetal más importante en las zonas con cobertura dispersa (MAHECHA, et al, 2004).
Este estudio se realizó en la vereda Pantano de Arce, zona correspondiente a las estribaciones de la Cuchilla del Tablazo (Subachoque, Cundinamarca), en altitudes que van desde los 3000 hasta los 3500 msnm (Figura 1). Se evidencia un total de 60 especies y se encuentra que esta publicación es la primera lista publicada de Hesperioidea y Papilionoidea de la zona del Páramo del Tablazo.
RESULTADOS Y DISCUSIÓN
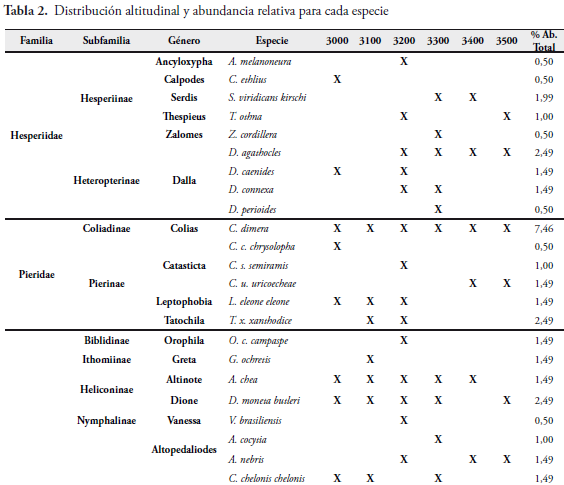
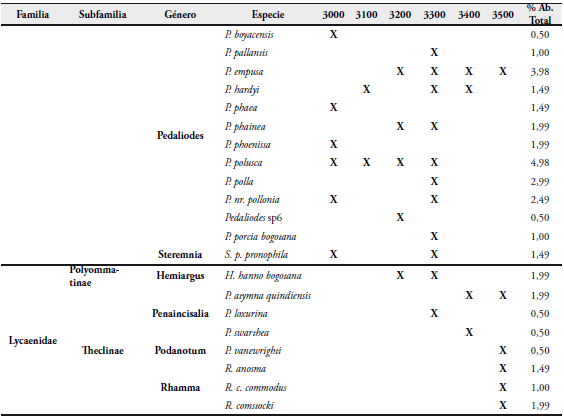
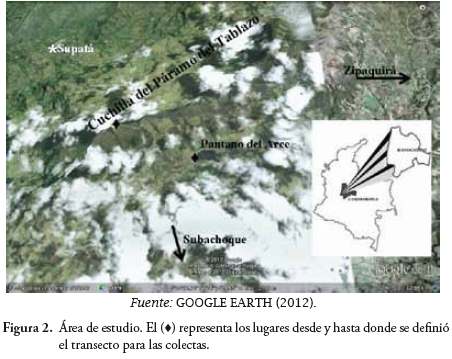
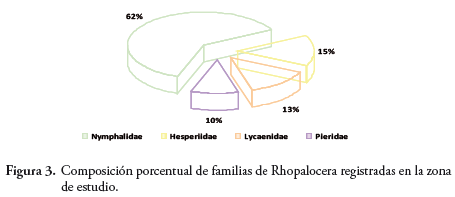
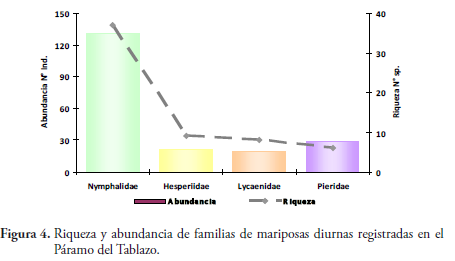
La comunidad de lepidópteros del área de estudio, presentó una composición total de cuatro familias, 11 subfamilias, 32 géneros y 60 especies (Tabla 2). La familia con mayor número de especies fue Nymphalidae con el 62% (37 especies) del total de las especies reportadas; seguida de Hesperiidae con 15% (9 especies), Lycaenidae con 13,3% (8 especies) y Pieridae con 10% (6 especies). (Figura 3).
Se registró un total de 201 individuos, siendo la familia más abundante Nymphalidae con 131 individuos del total registrado (Figura 4), equivalente al 65,17%; seguido por Pieridae con 29 individuos (14,43%), Hesperiidae con 21 (10,45%), y Lycaenidae con 20 (9,95%). Las especies más abundantes fueron Colias dimera con 7,46%, Pedaliodes polusca con 4,98%, Pedaliodes empusa con 3,98%, Eretris apuleja y Lasiophila circe con 3,48%, Manerebia apiculata y Pedaliodes polla con 2,99%. Las restantes especies se ubicaron por debajo del 2,50% (Tabla 2).
La familia de mayor riqueza fue Nymphalidae con 37 especies y 18 géneros; seguida de Hesperiidae con nueve especies, Lycaenidae con ocho especies y Pieridae con seis especies (Figura 4).
La colecta por trampas reportó un total de 36 individuos, lo que representó el 15,19% del total capturado, registrando a Corades dymantis como la más abundante con 25%; seguida de Pedaliodes polusca con 22,2%, Pedaliodes phaeinea, Lasiophila circe y Pedaliodes polla con 16,67%, y Pedaliodes empusa con 2,78%.
Para las diferentes estaciones altitudinales se reporta que la Estación 4, a 3300 msnm, fue la de mayor abundancia con 64 individuos que representa el 31,84%; seguida de la Estación 3 (3200 msnm) con 23,38% y 47 individuos; la Estación 1 (3000 msnm) con 16,42% y 33 individuos; la Estación 2 (3100 msnm) con 10,45% y 21 individuos; y las estaciones 5 (3400 msnm) y 6 (3500 msnm) con 8,96% y 18 individuos, respectivamente (Figura 5).
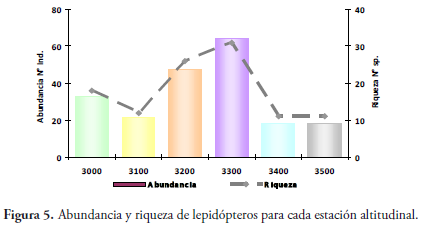
La familia Nymphalidae fue la más abundante en todas las estaciones altitudinales con 69,70%, 85,71%, 51,06%, 84,38% y 50,00% en las estaciones 1 (3000 msnm), 2 (3100 msnm), 3 (3200 msnm), 4 (3300 msnm) y 5 (3400 msnm), respectivamente; sin embargo en la Estación 6 (3500 msnm), la familia Lycaenidae reportó un valor de 61,11%, siendo el género Rhamma el más abundante (81,8%) con nueve individuos del total reportado (11 individuos).
La subfamilia Satyrinae registra el mayor número de especies en la Estación 1, Estación 2 y Estación 4 (61,1%, 58,3% y 74,2% respectivamente); pero también se incluyen altos porcentajes para las estaciones 1 y 5 (46,2% y 45,5%).
En la familia Nymphalidae, la especie Orophila campaspe se presentó con distribución restringida a 3200 msnm, en los árboles de mayor porte (ocho metros promedio); y la especie Greta ochretis es escasa y limitada entre 3100 y 3200 msnm. En la subfamilia Satyrinae las especies Pedaliodes phoenissa, P. phaea, P. boyacensis, Panyapedaliodes drymaea y Corades medeba solo se registran a una altitud de 3000 msnm, siendo comunes a esta altitud. La especie Pedaliodes pallantis, estuvo presente durante el tiempo de muestreo, pero se encuentra restringida a un pequeño fragmento de bosque a 3300 msnm. Las restantes especies de la subfamilia Satyrinae, presentan un rango altitudinal amplio, desde los 3000 hasta los 3500 msnm, siendo más comunes en su mayoría entre los 3200 y 3300 msnm.
La abundancia de la familias Pieridae, Hesperiidae y Lycaenidae, está representada por especies como Colias dimera, Tatochila xanthodice, especies del género Dalla y del género Rhamma respectivamente.
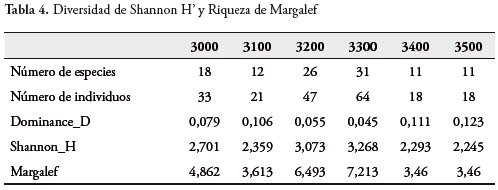
La diversidad total de Shannon registrada para el Páramo del Tablazo, en el transecto seleccionado fue de 3,879, señalando entonces que la diversidad es alta. Para cada estación, la diversidad de Shannon registró el valor más alto para la Estación 4 (3300 msnm) con 3,268; seguido de la Estación 3 (3200 msnm) con 3,073; y las restantes estaciones reportaron valores desde 2,245 hasta 2,701 (Tabla 4); estos valores señalan buena diversidad, lo que se corrobora con los bajos valores de dominancia registrados para cada estación. La riqueza total según Margalef, reportó un valor de 11,13, señalando nuevamente alta riqueza. La Estación 4 (3300 msnm) con 7,213 fue la más alta, seguida de la Estación 3 (3200 msnm) con 6,493 (Tabla 4). Las restantes estaciones registraron valores entre 3,46 y 4,862.
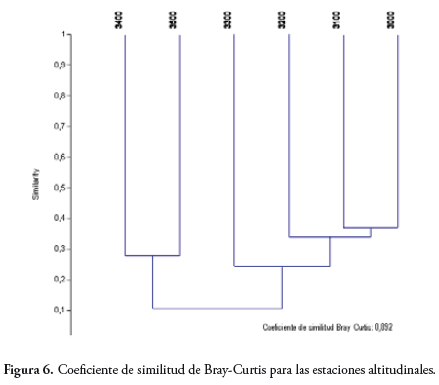
De acuerdo al índice de Bray-Curtis (método de Paired Group), se observa que las estaciones 1 (3000 msnm) y 2 (3100 msnm), son muy similares, y estas dos a la Estación 3 (3200 msnm); y estas a la Estación 4 (3300 msnm), conformando el primer grupo similar con las primeras cuatro estaciones. Las estaciones 5 (3400 msnm) y 6 (3500 msnm), conforman un segundo grupo similar entre ellos, pero distante a las restantes estaciones (Figura 6).
Se registran nuevos rangos de distribución altitudinal para las especies:
Catasticta uricoecheae hasta 3500 msnm.
Vanessa braziliensis hasta 3200 msnm.
Altinote chea hasta 3400 msnm.
Altopedaliodes cocytia hasta 3400 msnm.
DISCUSIÓN
La familia Pieridae registró la especie más abundante, Colias dimera, ya que estuvo presente en todas las estaciones de muestreo con elevada cantidad de representantes, su abundancia y frecuencia puede obedecer a la alta oferta de su planta hospedera, Trébol blanco (Trifolium repens: Fabaceae), debido a las condiciones que ofertan las grandes áreas intervenidas utilizadas como potreros para ganado en espacios abiertos, adicionalmente estas áreas facilitan el crecimiento de vegetación con flores [Taraxacum officinalis (Asteraceae), diente de león, fuente de su alimentación en estado imaginal]. Estas especies ruderales y arvenses son de las más frecuentes y comunes en zonas abiertas o de potreros (ANDRADE, 1998; ORELLANA, 2004) y se encuentran ampliamente distribuidas en zonas montanas de Venezuela, Colombia, Ecuador y Perú, entre otros países.
La subfamilia Satyrinae, con la tribu Pronophilini fue la más abundante y con mayor número de especies durante el muestreo, coincidiendo con ADAMS (1986) quien afirma que miembros de la tribu Pronophilini dominan en términos de número absoluto de rhopaloceros en bosques montanos (entre 2000 y 3000 msnm) y en zonas superiores a 2500 msnm donde hay bosque de niebla y páramo, estas son el grupo de mariposas más comunes. PYRCZ & RODRÍGUEZ (2007), mencionan que el 95% de las especies de Pronophilini se encuentran en los Andes, siendo este grupo de Satyrinae altamente diversificado en zonas montanas y de páramo.
En cuanto a la abundancia relativa, seis de las siete especies más abundantes pertenecen a la subfamilia Satyrinae, y tres al género Pedaliodes, que ha sido descrito como el más diverso de esta subfamilia (GARCÍA et al., 2002). Este género es propio de tierras altas o montanas (DEVRIES, 1987), donde se encuentran sus principales plantas hospederas, Poaceae y Cyperaceae (GARCÍA et al., 2002).
La familia Lycaenidae, fue la más abundante en la Estación 6, a 3500 msnm, reportando mayor número de especies del género Rhamma. Esta estación se caracterizó por ser la zona más alta donde se realizaron las colectas, correspondiendo al filo de la montaña. De acuerdo a esta cualidad se encontraron representantes de esta familia donde se reconoce el típico comportamiento de "hilltoping", además de que en su totalidad los especímenes colectados fueron machos. GARCÍA et al. (2002) afirman que en el caso de los Theclinae, algunos géneros son endémicos y propios de grandes alturas, encontrándose especies a más de 4000 msnm, en los páramos de las tres cordilleras del país.
Las familias Nymphalidae, Pieridae y Hesperiidae, registraron la mayor representatividad en rangos de distribución altitudinal (3000-3500 msnm) y la familia Lycaenidae la de mayor restricción (3400-3500 msnm).
El bajo número de individuos reportados de la familia Lycaenidae, puede ser debido a que las colectas que se realizaron no se enfocaron a lugares con bordes o filos de montañas o inflorescencias típicas, donde es común encontrarlos, ya que solamente un área presentó esta cualidad.
Los registros exhibidos por la subfamilia Satyrinae (Nymphalidae) que presentaron la mayor representatividad en rangos altitudinales, se podría explicar por estrategias biológicas propias del grupo, como melanismo alar (coloración oscura) y tallas corporales pequeñas junto con mecanismos complejos de termorregulación (CLENCH, 1966). Estas alternativas permiten una mayor flexibilidad y respuesta adaptativa frente a restricciones ambientales que aparecen a medida que incrementa la altitud como el aumento de precipitación, humedad, vientos y descenso de la temperatura (DENNIS, 1993). SINGER (1971), argumenta que la estrategia de adaptación ecológica en las mariposas, está moldeada por la distribución espacial y abundancia numérica de sus plantas hospederas, lo que entonces favorece la presencia de especies de esta subfamilia, ya que su planta huésped se encuentra de manera abundante en la zona.
VARGAS et al. (1994) citados por OSPINA et al., (2010), proponen que la distribución altitudinal que presenta la familia Pieridae, puede ser debida a que muchas especies son euriecas, es decir, que pueden ser encontradas desde zonas muy perturbadas hasta más o menos conservadas, y que además poseen mecanismos de termorregulación que les permite adaptarse a las restricciones ambientales de zonas de altura (CLENCH, 1966; DENNIS, 1993), en donde la posible alteración de los hábitats, estimula la aparición de especies del género Colias, consideradas como colonizadoras (ANDRADE & AMAT, 1996).
Estados inmaduros
Las mariposas son insectos holometábolos y fitófagos, es decir que la fase adulta y la fase larvaria ocupan nichos completamente distintos en el ecosistema, y que tanto su forma de alimentarse como el sustrato sobre el que lo hacen, son diferentes (FERNÁNDEZ & BAZ, 2006).
La estructura externa de las larvas de lepidoptera es muy diversa, dependiendo de la familia a la que pertenecen. De manera general, las larvas poseen una cabeza distinta, aparato bucal, un par de antenas cortas, seis stemmata (ojos simples), áreas adfrontales, una hilera de labios protuberantes, tres pares de patas torácicas, 10 segmentos abdominales con crochet formando patas falsas en A3, A4, A5, A6 y A10, y espiráculos en protórax (STHER, 1987; POWELL, 2009).
Las larvas son los insectos inmaduros, siendo presa fácil a otros insectos y expuestos a ser parasitados; como resultado a esto, desarrollaron muchas adaptaciones inusuales y hábitos evolucionados que van desde coloraciones crípticas que coinciden con el fondo, mimetismo de ramas, el color como señal de advertencia y diversos puntos, espinas, cuernos, y pelos o espinas urticantes; otras se dejan caer al suelo o giran hacia abajo en hilos de seda. En general la estructura y adaptaciones de comportamiento de las larvas son conocidas superficialmente, y aun relativamente conspicuos, abundantes e importantes grupos, quedan por descubrir (STHER, 1987; POWELL, 2009).
Los huevos de lepidoptera son diversos en forma y estructura (esféricos, aplanados, alargados, etc.), abundancia, y la forma en que son puestos (individuales y gregarios); considerablemente se sabe menos de los huevos de lepidoptera que de las larvas y aunque algunos huevos de grupos seleccionados son conocidos, el conocimiento general aún es simple (STHER, 1987; POWELL, 2009).
Catasticta semiramis semiramis (Lucas, 1852)
Planta hospedante
Gaiadendron punctatum (Ruiz & Pavón) Loranthaceae: Arbusto o árbol pequeño hemiparásito que puede crecer hasta los 8 m de altura. Las hojas son simples, opuestas y elípticas de 5 a 10 cm, con el haz lustroso de color verde oscuro, levemente rojizo o púrpura; el envés verde claro con puntos oscuros densos (Figura 7). La especie fructifica con un pico alrededor de marzo a julio (ALARCÓN & PARADA, 2010). Los frutos de G. punctatum son drupas que maduran de verde a crema, son dehiscentes, carnosas, con una semilla café rugosa. La especie es empleada en los programas de restauración de bosque altoandino AGUILAR & VANEGAS, (2009). Los frutos y semillas son consumidos y dispersados por aves frugívoras del área de estudio (ORTIZ & UMBA, 2010).

Ciclo de vida
Instar 1: Cápsula cefálica color negro, con abundantes y cortos pelos blancos en frontoclípeo y otros más largos en parte anterior y lateral. Cuerpo amarillo después de la eclosión, luego toman un tono amarillo más oscuro después de consumir alimentos; tiene numerosas, largas y finas setas primarias de color blanco en segmentos torácicos y abdominales; zona torácica negra con setas largas curvadas hacia delante, y el último segmento abdominal de color café. Instar 2: Cabeza color negro, conservando la posición de los pelos. El cuerpo es ahora amarillo oscuro y café; en dorso presenta una línea central café y dos laterales del mismo color; mantiene la zona torácica y el último segmento abdominal de color negro. Conserva la posición de las setas primarias blancas en todos los segmentos torácicos y abdominales. Instar 3: Cápsula cefálica negra con pequeñas protuberancias amarillas de las que salen las setas primarias muy largas y blancas. Cuerpo café con línea dorsal y lateral color café; cada segmento de la larva posee un par de largas setas primarias dorsales y laterales color blanco que salen de protuberancias amarillas (chalazas), y abundantes setas secundarias más cortas del mismo color; zona torácica negra con largas setas blancas curvadas hacia delante, que salen de las protuberancias amarillas.

Instar 4: La cabeza y cuerpo similar a instar 3, pero la tonalidad del cuerpo se oscurece; se mantiene y oscurece la línea dorsal central y las setas blancas largas sobre las protuberancias (chalazas) amarillas; la superficie se observa densamente cubierta de otras pequeñas protuberancias amarillas de donde salen las setas secundarias más cortas. Se hacen notorias las áreas intersegmentales de color café más claro que el resto del cuerpo formando una serie de bandas transversales. Instar 5: Cápsula cefálica y cuerpo similar a instar 4; el tono del cuerpo se oscurece aún más; se observa menos densa la superficie de setas secundarias, se mantienen las chalazas amarillas con las largas setas blancas (Figura 8). Pupa: De color blanco con muchas manchas negras y naranjas, simulando excremento de aves. Predominantemente de color marrón rojizo, pero con manchas de negro en el tórax y blanco en las zonas laterales de los segmentos abdominales 4-8, la cabeza con una proyección anterior de color amarillo crema apical, y una protuberancia redondeada subdorsal; protórax con una pronunciada cresta longitudinal dorsal; mesotórax con una cresta crema pronunciada longitudinal dorsal (que termina de color negro posteriormente), una protuberancia lateral doble redondeada en la base del ala anterior, y una cresta lateral crema y negro en la protuberancia lateral; segmento A2 con una protuberancia redondeada café oscuro dorsolateral; segmento A3 con una doble protuberancia redondeada dorsolateral negra; segmentos abdominales 3 a 7 cada uno con una cresta media dorsal, más pronunciada anteriormente, crestas laterales anterior y posteriormente blancas. Hasta el momento de la entrega del informe, aún se encontraban en fase de pupa.
Comportamiento: La postura y las larvas son gregarias, se alimentan en grupo, y producen cantidades considerables de seda, sobre todo en los últimos instares. Las larvas en instar 1 y 2, se alimentan en el día y se ubican en el envés de las hojas, a partir de instar 3, se alimentan en la noche, y durante el día se congregan en la base de los árboles, para protegerse; en la noche ascienden por el tronco de los árboles hasta las ramas donde se alimentan. Hacen su crisálida en la parte baja de los árboles; se sujetan al tronco o ramas de los árboles por el abdomen y por la región media pasa una fibra de seda alrededor de su cuerpo.
Género Pedaliodes sensu lato
Planta hospedante
Las especies del género Pedaliodes Butler (Pedaliodes phaea Hewitson, P. phaeinea Staudinger, P. polusca Hewitson, P. phoenissa Hewitson y P. empusa Felder & Felder) registradas en este estudio, se alimentan de Chusquea (Figura 9) en su estado larval. BECCALONI, et al, (2008) propone esta planta para diversas especies del Complejo Pedaliodes. Conocida popularmente como "chusque", Chusquea aff. scandens Kunth (Poaceae, Bambusoidea) se encuentra principalmente en Cundinamarca en el flanco occidental de la Cordillera Oriental, y en los cerros y páramos de la Sabana de Bogotá, entre otros lugares. Se registra entre los 1900 y los 3900 msnm, en el bosque muy húmedo montano bajo (bmh-MB), en el bosque húmedo montano bajo (bh-MB), en el bosque seco montano bajo (bs-MB), en el bosque muy húmedo montano (bmh-M) (MAHECHA et al., 2004) y generalmente asociado a corrientes de agua.
Es una planta de cañas amarillentas, delgadas, altas y arqueadas, ramificadas y enmarañantes o trepadoras (si hay árboles o peñas cerca). Presenta hojas simples alternas en ramilletes a intervalos sobre los nudos de las cañas. Trepadora facultativa y estrictamente heliófila, su floración es sincrónica a intervalos multianuales, frecuentemente acompañada de mortandad masiva (DAMA, 2011).
Huevos del género Pedaliodes: Debido a la similitud existente entre los huevos del género Pedaliodes Butler, se describen de manera general: Forma esférica no perfecta, color blanco luego de la postura, pero al transcurrir los días se torna amarillo claro; con variables estrías o hendiduras irregulares orientadas verticalmente. Antes de la emergencia de las larvas, el corion se hace transparente siendo visible la cápsula y epicráneo de color negro y pelos dorsales. Son depositados de forma individual.

Pedaliodes phaea (W.C. Hewitson, 1862)
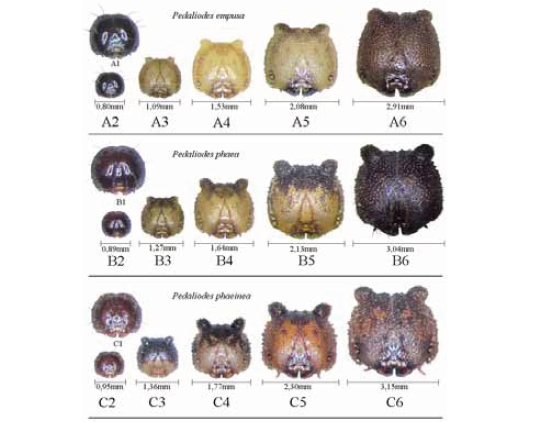
Instar 1: La larva presenta cápsula cefálica esférica, con dos pequeñas protuberancias en la parte superior, de color negro brillante y cubierta de cortas setas blancas. El cuerpo es tubular de color crema claro, con una línea ancha dorsal café y tres franjas longitudinales del mismo color. Presenta un par de pelos negros en dorso en cada segmento abdominal y torácico, y pelos en zona espiracular. El cuerpo termina en su último segmento con un par colas de escaso desarrollo, con mayor cantidad de pelos blancos más largos que el resto del cuerpo. Instar 2: La cabeza es color crema con manchas café oscuro en la parte superior y lateral, finamente reticulada con densos y cortos pelos pálidos; presenta dos cuernos pequeños y redondeados. El cuerpo es color crema oscuro con línea dorsal y varias líneas laterales e irregulares color café. Aparece una banda café dorsolateral en zona torácica y una leve mancha lateral en segmento abdominal A6 y A7. La característica principal de esta especie es la presencia de dos pares de puntos café en A1 y A2, y otros más pequeños en A6 y A7. Toda la larva tiene ahora pequeños puntos y granulaciones dispersas, cortas setas pálidas, y cola caudal más larga y más separada. Instar 3: La larva mantiene las condiciones y patrones de manchas, líneas y puntos de cabeza y cuerpo, pero se hacen más oscuras y notorias, especialmente las manchas laterales de A6 y A7. Instar 4: La cápsula cefálica tiene ahora las manchas café más amplias en la parte posterior de la cabeza, se oscurecen. El cuerpo ahora tiene una tonalidad base color café, se mantienen los cuatro puntos en A1 y A2, pero desaparecen en A6 y A7; la línea dorsal desaparece en zona torácica y se oscurece a partir de A1; las líneas laterales irregulares son menos notorias. Terminación caudal prominente. Instar 5: Cápsula cefálica similar a instar 4, pero menos manchas laterales, cuernos cortos y redondos. El color del cuerpo es ahora café oscuro; la línea central dorsal es incompleta; desaparecen líneas laterales y ahora son pequeñas manchas irregulares café; los cuatro puntos se mantienen pero no son tan notorios (Figura 10).

Pedaliodes phaeinea Staudinger, 1897
Instar 1: Las larvas en instar 1 de los Pedaliodes descritos hasta el momento, presentan una morfología y coloración muy parecida, siendo una forma de definir sus diferencias a través de mapas quetotáxicos; por tal motivo, la larva en instar 1 es muy similar a P. phaea, cápsula cefálica redonda, color negro, cubierta con pelos blancos y con dos pequeñas protuberancias en su parte superior. De igual forma, el cuerpo es de color crema claro, con una línea ancha dorsal café y tres líneas longitudinales del mismo color; dos series de pelos negros en dorso. Instar 2: Cabeza color crema con manchas café oscuro en la parte superior y lateral, y con dos pequeños cuernos redondos. El cuerpo es color crema, con una línea dorsal y varias líneas laterales curvadas de color café y blanco; banda café oscuro detrás de la cápsula cefálica en zona torácica y junto una línea ancha blanca que se angosta progresivamente en los siguientes segmentos. Presenta cuatro puntos café oscuro en A1 y A2. Instar 3: Cabeza igual que instar 2. El cuerpo color café claro; línea dorsal café clara; mantiene los cuatro puntos café oscuro en A1 y A2, aparecen ahora cuatro manchas en dorso en A7 y A8, y se hacen más oscuras las líneas laterales curvadas. Cola más desarrollada y separada. Instar 4: La cápsula cefálica conserva las manchas de instares anteriores, pero detrás de los cuernos redondos cambian a color blanco. El cuerpo ahora tiene una tonalidad base color café y amarillo; en dorso se mantienen los puntos en A1 y A2, pero aparecen pares de pequeños puntos negros y pequeñas manchas blancas; la línea dorsal no es notoria; el primer segmento torácico es color blanco. Las líneas laterales irregulares forman una mancha o franja ancha color café en dorsolateral, observándose de esta forma a la larva de un tono más claro en dorso y más oscuro en zona lateral. Instar 5: Cápsula cefálica color café oscuro manteniendo las manchas particulares. El color del cuerpo es ahora café oscuro, pero más claro en último segmento abdominal; en dorso desaparece la línea central; el primer segmento torácico aún es blanco; ahora se observan una serie de puntos y manchas más oscuras, pero se mantienen los puntos en A1 y A2. (Figura 11).

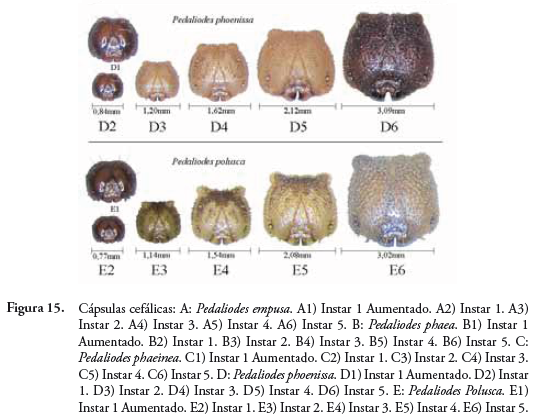
Pedaliodes polusca (W.C. Hewitson, 1862)
Instar 1: Cápsula cefálica redonda y de color negro, con cortas setas negras y otras largas laterales y superiores dirigidas hacia delante; dos protuberancias en epicráneo. El cuerpo es color verde claro, y presenta dorsalmente una gruesa línea central color café que inicia muy clara en A4 y A5 y se oscurece hasta A10, y paralelamente tres líneas longitudinales color blanco. Tiene cortas setas negras en dorso y otras blancas en zona subespiracular. Instar 2: La cabeza es color café claro y la sutura epicraneal es café oscuro y algunas manchas en la cara; está finamente reticulada y con muchos cortos pelos blancos; desarrolla dos pequeños cuernos redondos bien definidos. El cuerpo es ahora color crema oscuro, con una gruesa línea central café oscuro en dorso y aparecen algunos pares de manchas café, y delgadas líneas laterales irregulares; el cuerpo también se observa totalmente reticulado y con cortos pelos blancos. Instar 3: La cápsula cefálica conserva las manchas en la cara y el color café oscuro en la sutura epicraneal, se observa más reticulada y con más pelos. El cuerpo es ahora café claro, y el tono es más uniforme; en dorso se mantiene la línea central (siendo más oscura desde A5), y aparecen dos manchas en A4 y A6 sobre esa línea dorsal; las líneas laterales irregulares desaparecen formando pequeñas manchas y puntos.

Instar 4: Se oscurecen las manchas del frontoclípeo de la cápsula cefálica; el color café oscuro de la sutura epicraneal no es completo. El cuerpo mantiene la línea dorsal pero ahora es café clara; se oscurecen las manchas en A4 y A6. La larva presenta ahora más manchas y puntos pequeños de color oscuro por todo el cuerpo. Instar 5: La cápsula cefálica no tiene el color café oscuro en la sutura epicraneal, y ahora toda la cara es color café oscuro; se mantiene reticulada y con muchos y cortos pelos blancos. El cuerpo es color café; línea dorsal como en instar 4; se amplían y oscurecen las manchas en A4 y A6; desaparecen algunas manchas y puntos del instar 4. Ahora los pares de manchas en dorso, se unen formando figuras romboides en todo el dorso (Figura 12).
Pedaliodes phoenissa (W.C. Hewitson, 1862)
Instar 1: Cápsula cefálica redonda y de color negro, con cortos pelos blancos y otros un poco más largos en parte lateral y superior dirigidos hacia delante. El cuerpo es color verde claro con cortos pelos blancos, siendo más notorios en zona espiracular; dorsalmente presenta una línea central de color verde más oscura que el resto del cuerpo y que se torna color café desde el segmento A5 finalizando en A10 entre dos pequeñas y cortas colas; en zona dorsolateral y espiracular una delgada línea blanca y paralelamente presenta otras dos líneas irregulares del mismo color. Instar 2: La cabeza es color café claro, siendo la zona frontal media y superior un poco más oscura; la sutura epicraneal y parte lateral posterior tiene una mancha café oscuro; ahora desarrolla dos pequeños cuernos redondos bien definidos; finamente reticulada y con muchos cortos pelos blancos. El cuerpo es de color crema con una tonalidad verde; dorsalmente presenta dos delgadas líneas café que se oscurecen a partir de A5 y dos pequeñas manchas oscuras a cada lado de las líneas dorsales desde segmento A1 hasta A4; en la zona torácica, lateralmente, aparece una banda café oscura y desaparece entre los segmentos A1 y A2; en la parte de arriba y abajo de esta banda y en zona espiracular, presenta unas líneas irregulares color blanco y café que terminan en segmento A10. La larva presenta ahora pequeños puntos y granulaciones dispersas. Instar 3: La cápsula cefálica mantiene las manchas y coloración como instar 2. El cuerpo es ahora color café claro; en la zona dorsal se conservan las dos delgadas líneas café, pero ahora presenta manchas café desde segmento A4 hasta A10, tornándose las delgadas líneas centrales más oscuras en los últimos segmentos, y al finalizar los segmentos A1, A2 y A6, aparecen un par de puntos; en zona torácica y segmentos A1 y A2, lateralmente, se mantienen las bandas café oscura y ahora es muy notoria la línea blanca en zona espiracular. Instar 4: La cápsula cefálica es color crema, las manchas se mantienen pero son ahora más claras y es notorio un pequeño punto oscuro en la parte posterior de la cabeza; los cuernos redondos se mantienen. El cuerpo es color crema; dorsalmente se mantienen las líneas delgadas color café; desaparecen las manchas de los segmentos A4 hasta A10; se oscurecen los dos pares de puntos de A1 y A2, y aparecen cuatro pares de puntos desde el segmento A3 hasta A6; se mantiene la banda café en la zona lateral torácica, aunque ahora es más clara. Se conserva la línea blanca espiracular. Instar 5: La cápsula cefálica es color café claro, las manchas laterales se aclaran y ahora la zona frontal de la cabeza se torna de color café oscuro. El cuerpo es color crema; en dorso las líneas centrales se mantienen en zona torácica y últimos segmentos abdominales, y en los restantes segmentos desaparecen (A3 hasta A8), donde ahora se forman figuras romboides a partir de los pares de puntos. Se mantiene la banda café lateral en tórax; desaparece línea blanca espiracular (Figura 13).

Pedaliodes empusa empusa (Felder & Felder, 1867)
Instar 1: Cápsula cefálica esférica, color negro brillante, dos protuberancias craneales, y con pelos claros cortos, siendo más largos en zona lateral y anterior, donde se encuentran curvados hacia delante. Al emerger la larva es completamente de color verde, al avanzar el instar, presenta en dorso una gruesa línea color café que se oscurece progresivamente hasta A10, una línea blanca dorsolateral y una línea café lateralmente. Al igual que los otros Pedaliodes estudiados, presenta cortos pelos negros en todo el cuerpo. Instar 2: La cápsula cefálica es color crema, con algunas manchas café en frontoclípeo y zona lateral; pequeños cuernos redondos; se encuentra totalmente reticulada y con cortos pelos blancos. El cuerpo es color café con una gruesa línea dorsal café que se oscurece a partir de A5; en zona torácica, dorsolateralmente aparece una franja café oscuro seguida de una blanca. Toda la larva tiene ahora pequeñas granulaciones y muchos pelos cortos de color blanco. Instar 3: Cápsula cefálica similar a instar 2. El cuerpo es color café; la línea dorsal es menos notoria, se mantiene la franja dorsolateral en zona torácica; aparecen muchos puntos y pequeñas manchas color café oscuro dispersos en todo el cuerpo, siendo más notorios un par de puntos en dorso en A1 y A8 y una mancha central en A7. Instar 4: La cabeza es color crema y la mancha de frontoclípeo es ahora más oscura. El cuerpo es color café y mantiene la línea dorsal clara y las manchas y puntos dispuestos por todo el cuerpo. Aparecen siete puntos negros lateralmente a cada lado, desde A2 hasta A9, y se logra ver muy levemente figuras romboides en el dorso. Instar 5: Cápsula cefálica similar a instar 4. El cuerpo mantiene todos los patrones de figuras y manchas que instar 4, pero desaparece la franja dorsolateral café que se encontraba en zona torácica (Figura 14).

Pupa género Pedaliodes
Las pupas del género, son muy similares, pero presentan sus diferencias en la posición de las manchas. De forma alargada, más o menos cónica hacia el cremáster y los últimos segmentos abdominales (A6-A10), cilíndrico el resto del cuerpo, forjándose una curvatura dorsal hacia la cabeza, terminando en dos ligeras protuberancias unidas entre sí, en vista frontal; generalmente de color café o crema oscuro; en vista lateral son notorios unos puntos negros que corresponden a los espiráculos. Para Pedaliodes phaea, ventralmente, la región alar con manchas de color café y en la zona del primer par de patas; región costal un poco oscura, con puntos oscuros dispersos en el margen externo del ala. Pedaliodes phaeinea, es de color café claro y no presenta manchas en zona ventral, pero sí, algunas en zona alar. Pedaliodes polusca, es color crema oscuro, ventralmente con manchas claras por el borde de la región alar y en zona del primer par de patas al igual que un par de puntos; lateralmente una mancha oscura en parte costal del ala y a los lados del cremáster; en zona dorsal muchos puntos café dispersos y un par de pequeñas protuberancias en zona abdominal. Pedaliodes empusa, en zona ventral, presenta un par de manchas y puntos en el primer par de patas; región alar y costal de ala con muchas manchas y algunas otras en zona dorsal abdominal.
Comportamiento del género Pedaliodes: Las larvas consumen el corion del huevo tras emerger, pero en el caso de P. empusa, no es consumido en su totalidad; posteriormente a su emergencia buscan ubicarse en el envés de las hojas, generalmente por los bordes. Presentan hábitos de alimentación diurnos en los primeros instares (instar 1 y 2), y consumen los bordes de las láminas donde reposan; luego, en instares posteriores (instar 3-5) su actividad pasa a ser nocturna, saliendo a alimentarse a partir de las 6:00 p.m. Las larvas en general no consumen la exhubia después de la muda. En el caso de P. phaea, como medida de protección cuando perciben movimientos fuertes o bruscos en la planta, se dejan caer súbitamente al suelo y se enroscan, protegiendo la cabeza con el resto del cuerpo. Cuando se están preparando para pasar a la fase de pupa, se suspenden por los "crochets" el segmento abdominal 10, recogiéndose en forma de "J".
De acuerdo a esta información obtenida en campo, en laboratorio y bibliográfico, se asume que las larvas a partir de instar 3, permanecen en la parte baja de los chuscales buscando refugio, dentro de la hojarasca que se produce en la vegetación, y en horas de la noche salen a alimentarse, evitando así los predadores. Las larvas de Pedaliodes empusa, al percibir o sentirse perturbadas, realizaron movimientos laterales con la cabeza hacia atrás, de forma defensiva (GREENEY et al., 2012).
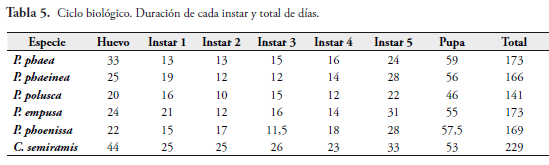
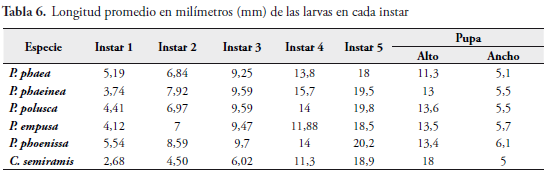
En las Tablas 5 y 6, se encuentran los datos comparativos del tiempo de desarrollo del ciclo biológico y las longitudes en cada instar de las especies estudiadas. La figura 15 muestra las diferencias fenotípicas de las cápsulas cefálicas de cada especie en cada instar.
AGRADECIMIENTOS
Los autores expresamos nuestros agradecimientos y admiración a personas e instituciones que aportaron en todas las diferentes etapas del desarrollo de este escrito: A la Marroquinera Mario Hernández, por su afortunado compromiso en la conservación de las mariposas colombianas al financiar la investigación a largo plazo. A Jean François Le Crom, Presidente de ACOLEP, gestor y coordinador del proyecto "Conservación de las Mariposas del Tablazo". Al "Proyecto Mariposa", que donaron un par de minibecas, como apoyo a la investigación. A Claudia Patricia Sañudo, Sandra Uribe Soto, Roger Vila, Diego Carrero y en general a todo el equipo de trabajo de este proyecto. A Luis Eduardo Motoa por su oportuna contribución a la difusión de los resultados. A nuestros buenos amigos y colaboradores para esta causa: Jorge Llorente Busquets, Gregory Nielsen, Walter Winhard, Luis Carlos Gutiérrez, Julián Adolfo Salazar, Hannier Pulido, Mateo Hernández Schmidt, María Dolores Heredia, Oscar Rojas Zamora, Periódico "Puertas 2000" al señor Héctor Cañón, Mauricio González, Samuel Rojas Pulido, David Reyes, Juan González y familia.

BIBLIOGRAFÍA
ADAMS, M.J., 1986.- Pronophiline butterflies (Satyridae) of the three Andean Cordilleras of Colombia. Zool. Journ. Linn. So., 87: 235-320. [ Links ]
AGUILAR, M. & VANEGAS, S.; 2009.- Viveros. Una experiencia comunitaria en el Páramo de Rabanal. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. [ Links ]
ALARCÓN, I.D. & PARADA, M., 2010.- Fenología reproductiva de especie ornitófilas y ornitócoras de los estratos bajos del Parque: 57-98 (en) ROSERO LASPRILLA, L. (ed.) Estudios ecológicos en el Parque Natural Municipal Ranchería, un aporte para su conservación. Tunja: Uptc. [ Links ]
ANDRADE, M.G., 1998.- Utilización de las mariposas como bioindicadoras del tipo de hábitat y su biodiversidad en Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 22 (84): 407-421. [ Links ]
ANDRADE, M.G. & AMAT, G.D., 1996.- Estudio regional de las mariposas altoandinas en la cordillera oriental de Colombia. Capítulo VII: 149-180 (en) G. ANDRADE, M. & FERNÁNDEZ, F. (eds.) Insectos de Colombia, Estudios escogidos. Colección Jorge Álvarez Lleras No. 10. Bogotá: Academia Colombiana de Ciencias Exactas, Físicas y Naturales. [ Links ]
BAQUERO, E., MORAZA, M.L., ARIÑO, A.H. & JORDANA, R., 2011.- Mariposas diurnas de Pamplona. Ayuntamiento de Pamplona: Gráficas Iratxe. 137p. [ Links ]
BECCALONI, G.W., VILORIA, A.L., HALL, S.K. & ROBINSON, G. S., 2008.- Catalogue of the hostplants of the Neotropical butterflies. (Catálogo de las plantas huésped de las mariposas neotropicales). Zaragoza: Sociedad Entomológica Aragonesa. (Monografías del Tercer Milenio, Vol. 8). 536p. [ Links ]
BROWN, K.S., 1981.- Contribución del conocimiento de los lepidópteros neotropicales a la Biogeografía. Simposia y Conferencias, IV Congreso latinoamericano de Entomología (Maracay). p. D70-D93. [ Links ]
CAMBERFORT, Y., 1991.- Biogeography and evolution: 51-68 (in) HANSKI. I. & CAMBEFORT, Y. (eds.). Dung Beetle Ecology. Princeton, New Jersey: Princeton University Press. [ Links ]
CLENCH, H.K., 1966.- Behavioral thermoregulation in butterflies. Ecology, 47 (6): 1021-1034. [ Links ]
CORTÉS, C. & FAGUA, G., 2003.- Diversidad de arañas de estrato rasante en transectos borde-interior de un bosque del piedemonte cordillerano (Medina, Cundinamarca). Rev. Col. Ent., 29 (2): 113-120. [ Links ]
DAMA.GOV.CO., 2011.- Especial: Fichas técnicas por especie. http://www.dama.gov.co. Chusquea scandens. [ Links ]
DENNIS, R., 1993.- Butterflies and climate change. Manchester University press. 276p. [ Links ]
DEVRIES, P.J., 1987.- The butterflies of Costa Rica and their natural history Papilionidae, Pieridae, Nymphalidae. Princeton University Press. 327p. [ Links ]
FAGUA, G., 1996.- Comunidad de mariposas y artropofauna asociada con el suelo de tres tipos de vegetación de la Serranía de Taraira (Vaupés, Colombia). Una prueba del uso de mariposas como Bioindicadores. Rev. Col. Ent., 22 (3): 143-151. [ Links ]
FERNÁNDEZ, M.J. & BAZ, A., 2006.- Mariposas del Campus. Naturaleza y Medio Ambiente N 3. EcoCampus Alcalá. Vicerrectorado de Campus y Calidad Ambiental. 56p. [ Links ]
GARCÍA, C.A., CONSTANTINO, L.M., HEREDIA, M.D. & KATTAN, G.H., 2002.- Mariposas comunes de la Cordillera Central de Colombia. Cali: Wildlife Conservation Society Programa de Colombia. 130p. [ Links ]
GOOGLE EARTH., 2012.- Área de estudio: Cuchilla del Tablazo – Cundinamarca – Colombia. kh.google.com [ Links ]
GREENEY, H.F., PYRCZ, T.W., DEVRIES, P.J. & DYER, L.A., 2009.- The early stages of Pedaliodes poesia (Hewitson, 1862) in eastern Ecuador (Lepidoptera: Satyrinae: Pronophilini). Journal of Insect Science, 9 (38): 1-8. [ Links ]
GREENEY, H.F., DYER, L.A. & SMILANICH, A.M., 2012.- Feeding by lepidopteran larvae is dangerous: A review of caterpillars' chemical, physiological, morphological, and behavioral defenses against natural enemies. Invertebrate Survival Journal, 9: 7-34. [ Links ]
HALFFTER, G., 1991.- Historical and ecological factors determining the geographical distribution of beetles (Coleoptera: Scarabaeidae: Scarabaeinae). Fol. Entomol. Mex., 82: 195:238. [ Links ]
HENAO, E.B., 2006.- Aproximación a la distribución de mariposas del departamento de Antioquia (Papilionidae, Pieridae y Nymphalidae: Lepidoptera, con base en zonas de vida. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 10: 279-312. [ Links ]
HEREDIA, M.D. & VILORIA, A.L., 2004.- Description and life history of Pedaliodes zingara, a new satyrine species from Colombia (Nymphalidae). Journal of the Lepidopterists' Society, 58 (2): 80-87. [ Links ]
HOLLOWAY, J.D. & STORK, N.E., 1991.- The dimensions of biodiversity: The use of the invertebrates as indicators of human impact: 3-62 (in) HAWKSWORTH, D.L. (ed.) The biodiversity of microorganisms and invertebrates; its role in sustainable agriculture. Washington: D. S. International. [ Links ]
KREMEN, C., COWELL, R.K., ERWIN, T.L., MURPHY, D.D., NOSS, R.F. & SANJKAYAN, M.A., 1993.- Terrestrial arthropod assemblages: Their use in Conservation planning. Conservation Biology, 7: 796-808. [ Links ]
LOVEJOY, T., BRERREGAARD, A., RYLANDS, J., MALCOM, C., QUINTELA, L., HARPER, K., BROWN Jr., A., POWELL, G., POWELL, R., SCHUBART, & HAYS, M., 1986.- Edge and other effects of isolation on Amazon forest fragments (in) SODLE, M.E. (ed.) Conservation Biology. The Science of scarcity and diversity. Sunderland, Massachusetts: Sinauer. 285p. [ Links ]
MAHECHA, G.E., OVALLE, E.A., CAMELO, S.D., ROZO, F.A., BARRERO, B.D. - CORPORACIÓN AUTÓNOMA REGIONAL DE CUNDINAMARCA., 2004.- Vegetación del territorio CAR: 450 especies de sus llanuras y montañas. Bogotá. D.C.: CAR. 861p. [ Links ]
MAHECHA, O.J., DUMAR, J.C. & PYRCZ, T.W., 2011.- Efecto de la fragmentación del hábitat sobre las comunidades de Lepidoptera de la tribu Pronophilini a lo largo de un gradiente altitudinal en un bosque andino en Bogotá (Colombia) (Lepidoptera: Nymphalidae, Satyrinae). Shilap, 39 (153): 117-126. [ Links ]
ORELLANA, A.M., 2004.- Mariposas de los páramos de la Sierra Nevada y Sierra de La Culata (Cordillera de Mérida, Venezuela): pp. 5/575/71 (in) ANDRESSEN, R. & MONASTERIO, M. (eds.) Los páramos andinos: Los desafíos en el siglo XXI. Memorias del IV Simposio Internacional de Desarrollo Sustentable en los Andes. Mérida, Universidad de los Andes. [ Links ]
ORTIZ, L. & UMBA, C., 2010.- Dinámica anual de un ensamble de aves frugívoras y su relación con la dispersión de semillas: 171-192 (en) ROSERO LASPRILLA, L. (ed.) Estudios ecológicos en el Parque Natural Municipal Ranchería, un aporte para su conservación. Tunja: Uptc. [ Links ]
OSPINA, L.A., GARCÍA. J.F., VILLA, F.A. & REINOSO, G., 2010.- Mariposas Pieridae (Lepidoptera: Papilionoidea) de la cuenca del Río Coello (Tolima), Colombia. Act. Biol., 32 (93): 173-188. [ Links ]
PELZ, V., 1997.- Life history of Pedaliodes parepa from Ecuador (Lepidoptera: Nymphalidae: Satyrinae). Tropical Lepidoptera, 8: 41-45. [ Links ]
POWELL, J.A., 2009.- Lepidoptera (Moths, Butterflies): 559-586 (in) RESH, V.H. & CARDÉ, R.T. (eds.). Encyclopedia of Insects. Second edition 2009. Elsevier's Science, Macmillan Publishing Solutions. 1093p. [ Links ]
PYRCZ, T. & RODRÍGUEZ, A., 2007.- Mariposas de la tribu Pronophilini en la Cordillera Occidental de los Andes de Colombia (Lepidoptera: Nymphalidae, Satyrinae). Shilap, 35 (140): 455-489. [ Links ]
RANGEL, C., 2000.- La región paramuna y franja aledaña en Colombia. Colombia Diversidad Biótica III. La región de vida paramuna. Bogotá: Universidad Nacional de Colombia – Instituto de Ciencias Naturales, Instituto de Investigación Recursos Biológicos Alexander von Humboldt. 902p. [ Links ]
SINGER, M.C., 1971.- Evolution of food – plant preferences in the butterfly Euphydrias editha. Evolution, 25: 383-389 (in) The ecology and ethology of the tropical butterfly Victoriana epaphus. I. Life cycle and natural history. J. Lepid. Soc., 26 (1972): 155-170. [ Links ]
STHER, F.W., 1987.- Order Lepidoptera: 288-305 (in) STEHR, F.W. (ed.) Immature Insects. Vol. 1. Dubuque, Kendall/ Hunt Publishing Company. 975p. [ Links ]
VARGAS, I., LLORENTE-BOUSQUETS, J. & LUIS, M.A., 1994.- Listado lepidopterofaunístico de la Sierra de Atoyac de Álvarez en el Estado de Guerrero: Notas acerca de su distribución local y estacional (Rhopalocera: Papilionoidea). Folia Entomol. Mex., 86: 41-178. [ Links ]