Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.18 no.1 Manizales Jan./June 2014
CARACTERES HEMATOLÓGICOS EN INDIVIDUOS DE TILAPIA NILÓTICA (Oreochromis niloticus, Trewavas 1983) CON PESOS ENTRE 50-150 g y 150-250 g, ESTACIÓN PISCÍCOLA, UNIVERSIDAD DE CALDAS, COLOMBIA*
HEMATOLOGICAL CHARACTERS IN NILE TILAPIA (Oreochromis niloticus, Trewavas 1983) INDIVIDUALS WEIGHING BETWEEN 50 AND 150 g AND 150 AND 250 g, FISH STATION, UNIVERSIDAD DE CALDAS, COLOMBIA
Christine M. Hahn-von-Hessberg1, Adriana Quiroz-Bucheli2, Alberto Grajales-Quintero1
* FR: 30-I-2014. FA: 3-III-2014.
1 Profesor, Departamento Producción Agropecuaria, Universidad de Caldas, Manizales, Caldas, Colombia.
2 Médico Veterinaria y Zootecnista, Universidad de Caldas, Manizales, Caldas, Colombia.
CÓMO CITAR: HAHN-VON-HESSBERG, C.M., QUIROZ-BUCHELI, A. & GRAJALES-QUINTERO, A., 2014.- Caracteres hematológicos en individuos de tilapia nilótica (Oreochromis niloticus, Trewavas 1983) con pesos entre 50-150 g y 150-250 g, Estación Piscícola, Universidad de Caldas, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 18 (1): 142-157.
Resumen
Se compararon parámetros hematológicos en O. niloticuscon pesos entre 50-150 g y 150-250 g, para obtener referentes de comparación, realizados en la Estación Piscícola, de la Universidad de Caldas, Colombia. Se utilizo un diseño completamente al azar con submuestreos; las pruebas hematológicas se depositaron en tubos de ensayo con EDTA, para su análisis en laboratorio. Se aplicó el software SPSS, la prueba Kolmogorow-Smirnow, la prueba T, de Levene, y de Kruskal Wallis, para las correlaciones entre los parámetros hematológicos evaluados. Al correlacionar los dos rangos de peso en O. niloticus no existen diferencias significativas en los valores hematológicos. Los análisis estadísticos encontrados fueron similares en los dos rangos de peso así: número de eritrocitos de 1,95±0,58 y 2,19±0,64 x106/mm3, hemoglobina 9,32±2,63 y 9,94±2,84 g/dL; hematocrito de 32,44±5,78 y 33,56±6,86%, proteínas plasmáticas 31,86±6,14 y 32,20±6,50 g/dL y una velocidad de segmentación eritrocitaria de 7,56±5,52 y 7,94±5,17 mm/h, un volumen corpuscular medio 183,43±75,44 y 165,76±60,80 u3, hemoglobina corpuscular media 50,56±22,39 y 49,19±21,27 uug y concentración de hemoglobina corpuscular media de 28,68±5,39 y 29,61±5,08%, respectivamente. El referente de leucocitos para el primer rango es de 2,11±1,03 y para el segundo rango es de 2,18±0,97 células x105 mm3, utilizado para evaluar la línea blanca como son: trombocitos, linfocitos, neutrófilos, monocitos, eosinófilos y basófilos. Para el grado de asociación entre cada una de las variables, existe una correlación positiva entre el peso, longitud y altura, así como entre la longitud y altura. Para el nivel de hemoglobina se obtuvo una correlación positiva con neutrófilos y CHCM, el índice eritrocitarios VCM se relacionó igualmente de manera positiva con HCM y de forma negativa con el número total de eritrocitos, el índice CHCM posee correlación positiva con neutrófilos, los leucocitos totales se correlacionaron con el recuento diferencial de trombocitos, linfocitos y neutrófilos, por último se observó una correlación positiva entre trombocitos y neutrófilos, siendo similares a estudios reportados en otras condiciones ambientales.
Palabras clave: Cichlidae,Oreochromis niloticus, eritrocito, hematocrito, leucocito, trombocito.
Abstract
Hematological parameters were compared in O. niloticus weighing between 50-150 g and 150-250 g, for comparison referents, carried out at the Fishing Station, Universidad de Caldas, Colombia. A completely randomized design was used with sub-sampling; the blood samples were placed in test tubes with EDTA for analysis in the laboratory. SPSS software, the Kolmogorow-Smirnov test, T test, Levene and the Kruskal Wallis tests were applied for correlations between hematologic parameters evaluated. When correlating the two weights ranges in Oreochromis niloticus no meaningful differences were found in the hematologic values. Statistical analyses found were similar in the two weight ranges as follows: erythrocyte count of 1.95±0.58 and 2.19±0.64 x106/mm3, hemoglobin 9.32±2.63 and 9.94±2.84 g/dL, hematocrit of 32.44±5.78 and 33.56 ± 6.86%, plasma protein 31.86±6.14 and 32.20±6.50 g/dL and a speed erythrocyte segmentation of 7.56±5.52 and 7.94±5.17 mm/h, a mean corpuscular volume of 183.43±75.44 and 165.76±60.80 u3, mean corpuscular hemoglobin of 50.56±22.39 and 49.19±21.27 uug and concentration mean corpuscular hemoglobin of 28.68±5.39 and 29.61±5.08%, respectively. The leukocytes referent for the first range is 2.11±1.03 and for the second range it is 2.18±0.97 cells x105mm3, used to evaluate the white line as: thrombocytes, lymphocytes, neutrophils, monocytes, eosinophil's and basophils. For the degree of association between each of the variables, there is a positive correlation between weight, length and height, as well as between length and height. For the hemoglobin level a positive correlation was obtained with neutrophils and CHCM, VCM erythrocyte index also related with HCM positively and negatively to the total number of erythrocytes, CHCM index has positive correlation with neutrophils, total leukocytes were correlated with differential count of thrombocytes, lymphocytes and neutrophils. Finally there was a positive correlation between thrombocytes and neutrophils, being similar to studies reported in other environmental conditions.
Key words: Cichlidae, Oreochromis niloticus, erythrocyte, hematocrit, leukocyte, thrombocyte.
INTRODUCCIÓN
La producción acuícola constituye una fuente alternativa de proteína importante para la seguridad alimentaria mundial a su vez una actividad generadora de empleo e ingresos, aumentó un promedio del 7% anual entre 1990 y 2010, constituyéndose la tilapia la segunda especie de importancia (DREZE & SEN, 2011; FAO, 2009, 2010, 2012; FAO, FIDA & PMA, 2012; THOMPSON & SUBASINGHE, 2011).En Colombia las principales especies cultivadas son el camarón marino, tilapia, trucha y cachama (INPA, 2001; FAO, 2005b, 2011; FAO & INCODER, 2011; MADR & IICA, 2012; PROCHILE, 2011). O. niloticus fue introducida a Colombia en 1979 (FAO & INCODER, 2011; GUTIÉRREZ-BONILLA & ÁLVAREZ-LEÓN, 2011), posee un rápido crecimiento, alta eficiencia reproductiva (GALVÁN-GUEVARA & DE LA OSSA, 2011; GRAJALES et al., 1996; GUTIÉRREZ-BONILLA & ÁLVAREZ-LEÓN, 2011; PEÑA-MENDOZA et al., 2011), excelente modelo experimental biológico porfacilidad de manejo,utilizada en la evaluación de ecosistemas acuáticos (HYLANDER et al., 2000; ALMEIDA et al., 2002; RANZANI-PAIVA et al., 2005; ISHIKAWA et al., 2007; KORKMAZ et al., 2009).
El aumento de la producción de la tilapia requiere herramientas precisas, eficaces y de bajo costo para detectar y monitorear los índices productivos; así los análisis de los parámetros químicos y hematológicos de la sangre en los animales llega a ser una herramienta importante (ALMEIDA et al., 2002; CHEN et al., 2003,2004), siendo indicadores del estado fisiológico de los peces, permitiendo monitorizar el progreso de la enfermedad o la respuesta a la terapia instaurada (TAVARES-DÍAS et al., 1999, 2004; HRUBEC et al., 2000; SILVEIRA-COFFIGNY et al., 2004; AZEVEDO et al., 2006a;CENTENO et al., 2007; CLAUSS et al., 2008;SILVA et al., 2009; CRIVELENTI et al., 2011; HAHN VONHESSBERGet al., 2011; JERÓNIMO et al., 2011; SEBASTIÃO et al., 2011;EL-HAWARRY, 2012), determinando si la enfermedad es de carácter bacteriano, parasitario, viral, por desequilibrio nutricional, condiciones anóxicas, efectos de estrés, productos químicos, intoxicación,variabilidad genéticay cambios medio ambientales (ALMEIDA et al., 2002; MARTINS et al., 2004b; COFFIGNY et al., 2004; RANZANI-PAIVA, et al., 2005; AZEVEDO et al., 2006b; GHIRALDELLI et al., 2006a, 2006b;CENTENO et al., 2007; ISHIKAWA et al., 2007;YUE & ZHOU, 2008; KORKMAZ et al., 2009; EL-KHALDI, 2010; HAHN VON-H et al., 2011; JERÓNIMO et al., 2011; SEBASTIÃO et al., 2011; SERIANI et al., 2012; SILVA et al., 2012; SILVEIRA-). Por otra, parte factoresmedioambientales (temperatura, fotoperiodo, densidad, salinidad), fisiológicas (especie, género, edad, sexo, ciclo reproductivo, nutrición) y manejo (captura, manipulación, anestésicos, muestras de sangre, reactivos puedencausar efectos en los parámetros sanguíneos de los peces(CHEN et al., 2003, 2004; GHIRALDELLI et al., 2006a; CLAUSS et al., 2008; CRIVELENTI et al., 2011; PHUMYU et al., 2012; QIANG et al., 2013).
El cultivo de poblaciones monosexuales de tilapia permite uniformidad de los lotes dando similitud de parámetros hematológicos y químicos (CHEN et al., 2003; EL-GREISY & EL-GAMAL, 2012; HAHN-VON-HESSBERG et al., 2012).Se requiere la disponibilidad de valores de referencia normales o estandarizadas de los componentes sanguíneos como indicadores del estado de salud de los peces, para poder establecer variaciones en los parámetros hematológicos en casos anormales (CHEN et al., 2003, 2004; SILVEIRA-COFFIGNY et al., 2004; CENTENO et al., 2007;). En O. niloticus se encontrado eritrocitos y varias líneas leucocitarias como linfocitos maduros y jóvenes, neutrófilos, monocitos, eosinófilos, basófilos y trombocitos (UEDA et al., 1997, 2001; MARTINS et al., 2004a, 2008b; SILVEIRA-COFFIGNY et al., 2005; RANZANI-PAIVA et al., 2005; SAYED et al., 2007; BAILONE et al., 2010; EL-BOSHY et al., 2010; HAHN-VON-HESSBERG et al., 2011; SERIANI et al., 2012; SILVA et al., 2012; MEHRIM, 2013); además se reportan la concentración de hemoglobina, porcentaje de hematocrito, cálculo de los índices eritrocitarios: Volumen Corpuscular Medio (VCM), Hemoglobina Corpuscular Media (HCM) y Concentración de Hemoglobina Corpuscular Medio (CHCM) y Velocidad de Segmentación Eritrocitaria (VSE) (BITTENCOURT et al., 2003; DUY et al., 2008; LIM et al., 2009; HAHN-VON-HESSBERGet al., 2011; MEHRIM, 2013; SEBASTIÃO et al., 2011; SERIANI et al., 2012; SILVA et al., 2012;YOUNG-MIN& KANG, 2008). Los eritrocitos mantienen el núcleoen los peces, anfibios, reptiles y aves(MORERA, 2011), sufren alteraciones como policitemia, anemia, morfología anormal, e inclusiones nucleares o citoplasmáticas. Un hematocrito del 45% o mayor se considera una policitemia y está acompañado de altos valores de hemoglobina causados por deshidratación, hipoxia, efectos de estrés único o consecutivo o en machos sexualmente maduros. En las reducciones del hematocritoindican estados anémicos causado posiblemente porenfermedades inflamatorias, renales o esplénicas, trastornos nutricionales, toxinas, traumatismos, ulceraciones cutáneas, parasitismos, septicemia bacteriana o viral (MARTINS et al., 2004b;TAVARES-DIAS &MORAES, 2004; GHIRALDELLI et al., 2006a, 2006b;CLAUSS et al., 2008; SEBASTIÃO et al., 2011).
El efecto de la temperatura del agua, en el recuento de glóbulos rojos, glóbulos blancos y concentraciones de hemoglobina en juveniles de O. niloticus es significativa; los valores hematológicos aumentan a medida que aumenta la temperatura del agua (QIANG et al., 2013).El hematocrito varía dentro y entre especies y se correlaciona con el nivel de actividad de los peces al igual quecon la edad, género, calidad del agua, fotoperiodo y dieta (CLAUSS et al., 2008).En cuanto a los índices de medición de sangre absoluta, se reporta un aumento de valores de HCM y CHCM en presencia de bacterias (SEBASTIÃO et al., 2011).La concentración de proteína total puede ser evidencia de una nutrición ineficiente por disminución de la albumina sérica, señal de infecciones sistémicas al haber un aumento de las globulinas circulantes (CRIVELENTI et al., 2011).Los leucocitos están relacionados directamente con la respuesta inmunológica específica e inespecífica (TAVARES-DIAS &MORAES, 2004; JERONIMO et al., 2011;).Varios tipos de leucocitos participan en la respuesta celular, incluyendo linfocitos, monocitos, granulocitos (neutrófilos, eosinófilos y basófilos). Los granulocitos se encuentran en pequeñas proporciones (TAVARES-DIAS &MORAES, 2004; SILVA et al., 2009). La leucopenia con linfopenia y un aumento de granulocitos es indicativo de una respuesta de estrés, parasitosis, septicemia bacteriana o sepsis; los linfocitos están presentes en las respuestas inmunológicas, proceso inflamatorio de los peces. La linfocitosis puede sugerir estimulación inmunogénica, debida a sistemas de producción con alta densidad, mala calidad de agua o elevada carga bacteriana, mientras que la linfopenia puede indicar condiciones de inmunosupresión (TAVARES-DIAS &MORAES, 2004; GHIRALDELLI et al., 2006a;CLAUSS et al., 2008; JERÓNIMO et al., 2011;SEBASTIÃO et al., 2011; SILVA et al., 2012).
Los monocitos actúan en el proceso de inflamación y respuesta inmune, tienen capacidad citotóxica no específica, dando un aumento de la actividad fagocítica de los antígenos bacterianos, y la liberación inducida de factores activadores de macrófagos por la inoculación de patógenos siendo las células más grandes dentro de la diferenciación celular (TAVARES-DIAS &MORAES, 2004; CLAUSS et al., 2008; SEBASTIÃO et al., 2011).Los granulocitosis se asocian con la inflamación,los neutrófilos son los más comunes, responsables de la fagocitosis y las respuestas no específicas por quimiotaxis (EL-BOSHY et al., 2010; GHIRALDELLI et al., 2006a; JERÓNIMO et al., 2011; TAVARES-DIAS &MORAES, 2004). La neutrofilia asociada con procesos inflamatorios, de estrés y bacterianos y una neutropenia aguda puede reflejar extravasación de neutrófilos en un sitio significativo (SILVEIRA-COFFIGNYet al., 2004; CLAUSS et al., 2008; SEBASTIÃO et al., 2011).En los peces no se conoce muy bien las funciones de los eosinófilos, poco frecuentes, una eosinofilia es indicativa de una respuesta inflamatoria asociada con la estimulación antigénica o infecciones parasitarias,los basófilos son escasos en el recuento diferencial, su función no es clara, tienen respuesta inmune alérgica (TAVARES-DIAS &MORAES, 2004; CLAUSS et al., 2008). Los trombocitos responsables de controlar la pérdida de fluidos de las heridas superficiales de los peces, interactúan en el sistema de defensa por medio de la actividad fagocítica y bacterial, por tanto diversos autores incluyen los trombocitos en el recuento diferencial de leucocitos, y otros lo contabilizan como serie independiente (TAVARES-DIAS &MORAES, 2004; AZEVEDO et al., 2006a; GHIRALDELLI et al., 2006a;CLAUSS et al., 2008; SILVA et al., 2009; JERÓNIMO et al., 2011; SEBASTIÃO et al., 2011). Los altos niveles de glucocorticoides causan una trobocitopenia y ladeficiencia de vitamina K aumentanlos tiempos de coagulación(CLAUSS et al., 2008), se ha registrado una disminución de trombocitos en presencia de parásitos, la trombocitosis se ha reportado en peces infectados con bacterias y en medios eutrofizados (GHIRALDELLI et al., 2006a, 2006b; SEBASTIÃO et al., 2011).
Este trabajo se orientó a comparar parámetros hematológicos en O. niloticus con pesos entre 50-150 g y 150-250 g, en la Estación Piscícola. Se realizaronanálisis de laboratorioobteniendo parámetros como: recuento de eritrocitos y leucocitos en cámara de Neubauer, recuento diferencial de leucocitos en frotis sanguíneos con tinción de Wright, velocidad de segmentación eritrocitaria, proteína plasmática, valor del hematocrito en microhematocrito e índices eritrocitarios:VCM,HCM y CHCM.
MATERIALES Y MÉTODOS
El estudio se realizó en la Estación Piscícola, Granja Montelindo,Universidad de Caldas, departamento de Caldas- Colombia, municipio de Palestina, Vereda Santágueda, una altura de 1010 msnm, humedad relativa de 76%y precipitación de 2200 mm/año, temperatura media de 22,8°C,temperatura promedio del agua de 27°C, oxígeno 5 ppm y pH 5,5-7,9. A los 05° 04' N y75°45' W.
Los peces se distribuyeron en un diseño completamente al azar con submuestreo, compuesto por dos tratamientos (T1: animales entre 50-150 g; T2: animales entre 150-250 g), y diez (10) repeticiones por tratamiento, con cinco (5) peces por repetición. Se seleccionaron 50 machos de O. niloticus obtenidos por reversión sexual, de apariencia sana,para cada tratamiento, tomándose variables de peso (balanza electrónica), longitud total y altura (distancia entre la línea dorsal y la línea ventral del pez).
Se utilizó la técnica descrita por CARVALHO (2006) y YANAR & KUMLU (2001) y para tranquilizar los peces consulfato de Quinaldina. Las muestras de sangre se tomaron por punción directa en el seno venoso. En la extracción de sangre se utilizaron jeringas desechables de 1 cc, conagujas hipodérmicas,que se depositaron en tubos de ensayo de 4,5 cc, impregnados con EDTA, trasportadasen nevera de icopor para su análisis en el laboratorio clínico del Hospital Veterinario "Diego Villegas Toro".Los frotis sanguíneos se tiñeron con coloración Wright para el recuento diferencial de leucocitos (trombocitos, linfocitos, monocitos, neutrófilos, eosinófilosy basófilos) sobre 100 células en forma lineal(UNIVERSIDAD DE CALDAS, 2005). Los parámetros se evaluaron según CONROY (1998) para la Velocidad de Segmentación Eritrocitaria (VSE) dandose en valores en milímetros/hora (mm/h), el Hematocrito en porcentaje (%), la Hemoglobina en gramos/decilitros (g/dL), la Proteína plasmática se procedió a su lectura en gramos/litros (g/L), los eritrocitos y leucocitos diluidos en reactivo de "Natt y Herrick" y en cámara de Neubauer, dando como resultado: eritrocitos totales x 106 milímetro cúbico (mm3). El procedimiento utilizado fue el mismo para los leucocitos, expresándose como número de leucocitos totales por 105mm3.Para los índices eritrocitarios se aplicaron las formulas descritas por CONROY & CONROY (1987), para el Volumen Corpuscular Medio (VCM): VCM= (Hematocrito (%) x 10)/Recuento eritrocitario (x106/mm3), expresado en micrones cúbicos (u3).Hemoglobina Corpuscular Media (HCM): enHCM= (Hemoglobina (g/dL) x 10)/Recuento eritrocitario (x106/mm3),dando su resultado en micromicrogramos (uug). Concentración de Hemoglobina Corpuscular Media (CHCM): CHCM= Hemoglobina (g/dL) x 100/ Hematocrito (%), dado en porcentaje (%). Se utilizó el software SPSS para el análisis de los datos, la prueba Kolmogorow-Smirnow para la normalidad,para las variables con distribución paramétrica se uso la prueba T para igualdad de medias y la prueba de Levene para la homogeneidad de varianzas; mientras que para las variables no paramétricas la prueba Kruskal Walis, esto con una comparación estadística P≤0,05. Se realizaron correlaciones entre los parámetros hematológicos evaluados.
RESULTADOS Y DISCUSIÓN
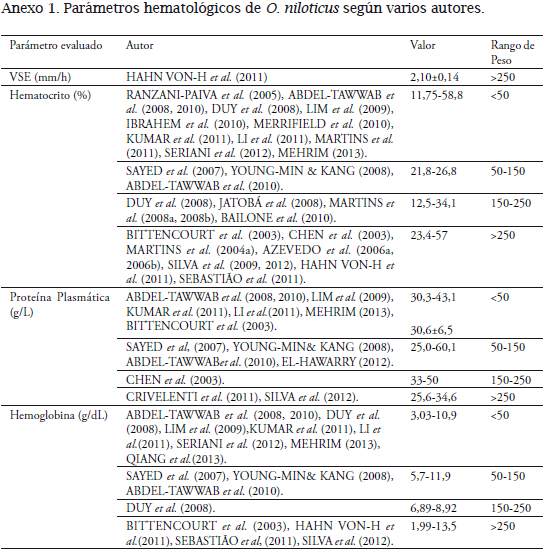
Los parámetros hematológicos en O. niloticus entre pesos de 50-150 g, con un promedio de 101,78±22,72 g, fueron similares a los valores obtenidos entre pesos de 150-250 g, cuyo promedio fue 196,94±32,52 g, cultivada en condiciones medioambientales en la Estación Piscícola, coincidiendo con valores registrados por diferentes autores (UEDA et al., 1997; DUY et al., 2008;YOUNG-MIN& KANG, 2008; LIM et al., 2009;HAHN VON-H et al., 2011; KUMAR et al., 2011;SEBASTIÃO et al., 2011; SERIANI et al., 2012; SILVA et al., 2012; MEHRIM, 2013; QIANG et al., 2013).
La longitud total promedio para el tratamiento uno fue 17,32±1,71 cmy para el tratamiento dos de 21,13±3,01cm; y una altura promedio para el primer y segundo grupo de 5,80±0,58 cm y 7,24±0,55 cm respectivamente.Siendo altamente significativala diferencia (P<0,001) en el peso, longitud y altura entre los tratamientos, las demás variables se conservan iguales, sugiriendo que el cambio de estos valores no fue significativo para encontrar diferencias en los parámetros hematológicos de esta especie, debido a la pureza y homogeneidadde la especie (TENORIO-COLÍN, 2003).Se podría sugerir que por su rápido desarrollo y rusticidad quelos parámetros hematológicos son similares en la mayoría de las etapas de vida (RANZANI-PAIVA, et al., 2005), coincidiendo con PÉREZ et al. (2004), EL-GREISY & EL-GAMAL (2012),y HAHN-VON-HESSBERGet al.(2012). Esta especie aparentemente no realiza ajustes hematológicos porefectos de estrés (bajas concentraciones de oxigeno), debido al gran numero y longitud de los filamentos branquiales y a la alta presencia de laminillas secundarias que permite el eficiente intercambio de gases, junto con una alta afinidad de la hemoglobina al oxígeno (DUY et al., 2008).
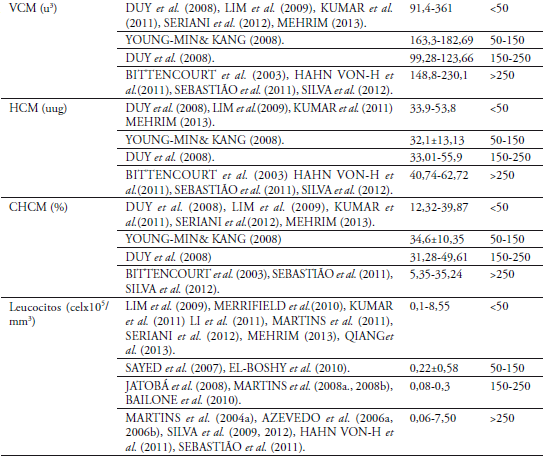
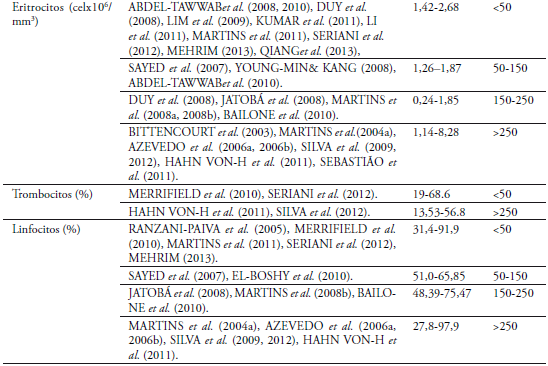
El número de eritrocitos entre pesos 50-150 g (1,952 x106células/mm3) y 150-250 g de O. niloticus (2,193 x106células/mm3) no mostró diferencia estadística, coincidiendo con DUY et al. (2008) y MARTINS et al. (2008b)igualmente a HRUBEC et al. (2000) en híbridos de tilapia, coincidiendo con diferentes autores(Anexo1).No coincide con MARTINS et al. (2008a) que encontró que los resultados difieren por valores más altos de los eritrocitos según la variable peso evaluado en condiciones normales y BITTENCOURT et al. (2003) observado en condiciones de cultivo semi-intensivo.PHUMYU et al. (2012) registra valores más altos en machos que en hembra.JERÓNIMOet al. (2011) afirma que está relacionado con el mecanismo de compensación respiratoria". El recuento total de leucocitos encontrados en O.niloticus no presentó diferencia estadística significativa entre pesos 50-150 g y 150-250 g (P>0,05) con 2,11 y 2,18 x105células/mm3 respectivamente, valores iguales registrados se encuentran en el rango de este parámetro (MARTINS et al., 2004a; LIM et al., 2009; HAHN-VON-HESSBERGet al., 2011; KUMAR et al., 2011; LI et al., 2011; SERIANI et al., 2012; QIANGet al., 2013), utilizando directamente la cámara de Neubauer y por el método indirecto realizado con frotis de sangre (ISHIKAWA et al., 2008);otros autores como AZEVEDO et al.(2006a, 2006b), JATOBÁ et al. (2008), MARTINS et al. (2008a, 2008b, 2011), BAILONE et al. (2010),EL-BOSHY et al. (2010), MERRIFIELD et al. (2010) SAYED et al.(2007), SEBASTIÃO et al. (2011) y SILVA et al.(2009, 2012) encontraron valores más bajos de leucocitos. La presencia de un mayor número de leucocitos en sangre puede indicar una mejor respuesta de defensa del cuerpo (TAVARES-DIAS &MORAES, 2004; AZEVEDO et al., 2006a; MEHRIM, 2013;), ya que posiblemente en los sistemas de producción de alta densidad están expuestos constantemente a altas cargas bacterianas y menor calidad del agua (MARTINS et al., 2004b; HRUBEC et al., 2000; JERONIMO et al., 2011), las células blancas poseen un papel importante en la función inmune (SAYED et al., 2007; QIANG et al., 2013).En el conteo diferencial de leucocitos fueron observados trombocitos, linfocitos, neutrófilos, monocitos, basófilos y eosinófilos, determinados por el predominio de linfocitos circulantes (53-54%) encontrados en los frotis de O. niloticus (MARTINS et al., 2004a, 2008a); AZEVEDO et al., 2006a, 2006b; HAHN-VON-HESSBERGet al., 2011. En situaciones de estrés, el número de linfocitos circulantes disminuye (AZEVEDO et al., 2006a), teniendo en cuenta las condiciones medio ambientales y de manejo de la especie los valores de los linfocitos son semejantes a los registrados por MARTINS et al. (2004a, 2008b, 2011), RANZANI-PAIVA et al. (2005),SAYED et al. (2007), JATOBÁ et al. (2008),SILVA et al. (2009, 2012), BAILONE et al. (2010), EL-BOSHY et al. (2010),MERRIFIELD et al. (2010), HAHN VONHESSBERGet al. (2011),SEBASTIÃO et al. (2011),y SERIANI et al. (2012), pudiéndose inferir que los peces utilizados no mostraron respuestas al estrés, por tanto son valores obtenidos propios de la especie. No concuerdan con AZEVEDO et al. (2006a; 2006b) y MEHRIM (2013), donde los valores obtenidos superan el promedio de este estudio.Los trombocitos se incluyeron en el recuento diferencial de glóbulos blancos, el porcentaje encontrado (26,06±0,48 y 26,14±0,44 respectivamente en cada tratamientofue similar al reportado por HAHN-VON-HESSBERGet al. (2011), MERRIFIELD et al. (2010), SERIANI et al. (2012) y SILVA et al. (2012), que incluyen los trombocitos en el recuento diferencial. En O. aureus se registran valores de 66,5 ± 10,2%, valor dentro del rango de la especie estudiada (SILVEIRA-COFFIGNY et al., 2004).
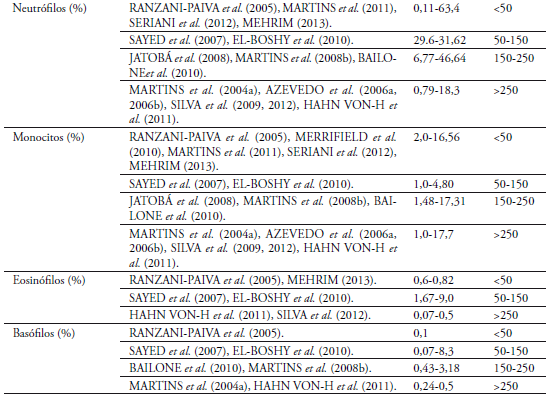
Los valores mínimos y máximos encontrados para los neutrófilos en los dos tratamientos se encuentra entre 0 y 29%, con un promedio para el tratamiento uno de 9% y para el dos de 10%, encontrándose reportes similares para esteparámetro (MARTINS et al., 2004a, 2008b, 2011; RANZANI-PAIVA et al., 2005;AZEVEDO et al., 2006a, 2006b; SAYED et al., 2007;HAHN VONHESSBERGet al., 2011;SERIANI et al., 2012; SILVA et al., 2012; MEHRIM, 2013) y valores mayores (JATOBÁ et al., 2008; SILVA et al., 2009; BAILONE et al., 2010; EL-BOSHY et al., 2010;) pero no incluyen en su conteo el valor de trombocitos. El mayor número de neutrófilos puede deberse a unabaja calidad del agua y alto contenido de materia orgánica circulante, como sugiere AZEVEDOet al. (2006a), bajo condiciones de estrés (MARTINSet al, 2004b)o en respuesta a parasitismo e infección (GHIRALDELLI et al., 2006a; JERÓNIMO et al., 2011).Para los parámetros de monocitos, eosinófilos y basófilos, que se encuentran en menor cantidad en el recuento diferencial, los referentes encontrados son similares (MARTINS et al., 2004a, 2008b; RANZANI-PAIVA et al., 2005; SAYED et al., 2007;BAILONE et al., 2010; EL-BOSHY et al., 2010; HAHN-VON-HESSBERG et al., 2011;MEHRIM, 2013; SILVA et al., 2012).
No se encontró diferencia estadística para el hematocrito de O. niloticus para los pesos entre 50 y 150 gde 32,44±5,78 y para 150 y 250 g de 33,56±6,86% (Tabla 1), siendo muy similares a los datos obtenidos por BITTENCOURT et al. (2003), CHEN et al. (2003), MARTINS et al. (2004a, 2008b, 2011), RANZANI-PAIVA et al. (2005); AZEVEDO et al. (2006a, 2006b), SAYED et al. (2007), JATOBÁ et al. (2008), YOUNG-MIN& KANG (2008), LIM et al. (2009), SILVA et al. (2009, 2012), BAILONE et al. (2010), IBRAHEM et al. (2010), MERRIFIELD et al. (2010), HAHN-VON-HESSBERG et al.(2011),ABDEL-TAWWAB et al. (2010), KUMAR et al. (2011), LI et al. (2011),SEBASTIÃO et al. (2011), y SERIANI et al. (2012), valor superior a los registrados para la especie evaluada en condiciones de laboratorio (ABDEL-TAWWABet al.,2008; MARTINS et al., 2008a; MEHRIM, 2013), coincidiendo con DUY et al. (2008) que evaluaron machos de O.niloticus, en un sistema de recirculación.
Existe una correlación entre la hemoglobina y el hematocrito puesto que sus valores están relacionados con la actividad y el hábitat de los peces. La hemoglobina encontrada fue similar ala registradapor BITTENCOURT et al.(2003),SAYED et al. (2007), ABDEL-TAWWAB et al.(2008, 2010), DUY et al. (2008),YOUNG-MIN & KANG (2008), LIM et al. (2009), HAHN VON- HESSBERG et al.(2011), KUMAR et al. (2011), LI et al.(2011), SERIANI et al. (2012), SILVA et al. (2012) y QIANG et al. (2013), no coincidiendo con SEBASTIÃO (2011) ni MEHRIM (2013) y que registran referencias menores al límite inferior de este parámetro.
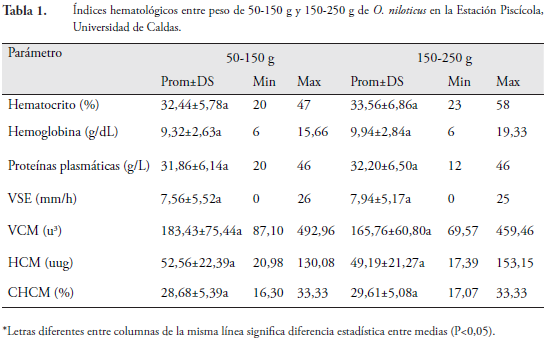
La concentración de proteína está altamente relacionada con el estado nutricional y la calidad del alimento (CRIVELENTI et al., 2011). El valor de proteína plasmática para la especie en estudio fue de 31,86±6,14 y 32,20±6,50 g/L en cada tratamiento, sin encontrarse diferencias significativas, coincidiendo con lo reportadopor ABDEL-TAWWAB et al.(2008, 2010),BITTENCOURT et al. (2003), LIM et al. (2009),CRIVELENTI et al.(2011),EL-HAWARRY (2012); KUMAR et al.(2011), LI et al.(2011), ySILVA et al.(2012), SAYED et al.(2007) y YOUNG-MIN & KANG (2008)reportan valores mayores , así mismo para el hibrido O. niloticus x O. mossambicus x O. aureus (HRUBEC et al., 2000) se reportó una concentración de 48-78 g/L en alta densidad. El rango de VSE está entre 0 y 26 mm/h, con un promedio de 7,75mm/h para los dos tratamientos, sin embargo HAHN-VON-HESSBERG et al.(2011) reporta para O. niloticus un valor de 2,10±0,14 mm/h, con un máximo de 5 mm/h, utilizando la misma técnica de este trabajo.
En los índices eritrocitarios (VCM, HCM y CCMH) no se encontró diferencia estadística, semejantes a los registrados por BITTENCOURT et al. (2003), DUY et al. (2008), YOUNG-MIN& KANG (2008), HAHN-VON-HESSBERGet al.(2011), KUMAR et al. (2011), LIM et al. (2009), SEBASTIÃO et al. (2011), SERIANI et al. (2012), y SILVA et al. (2012) inclusive para híbrido de Oreochromis (HRUBEC et al. 2000), y para O. aureus(SILVEIRA-COFFIGNY et al. 2004).
Al realizar la correlación entre variables (peso, longitud, altura, VSE, hematocrito, proteína plasmática, hemoglobina, VCM, HCM, CHCM, leucocitos, eritrocitos, trombocitos, linfocitos, neutrófilos, monocitos, eosinófilos y basófilos)hay una correlación positiva entre peso y longitud-altura, así como entre longitud y altura. El nivel de hemoglobina en sangre fue positivamente correlacionado con CHCM y neutrófilos, el índice eritrocitarios VCM se relacionó positivamente con HCM y negativamente con el número total de eritrocitos, y el índice CHCM tienen una correlación positiva con neutrófilos, los leucocitos totales se correlacionaron el recuento diferencial de trombocitos, linfocitos y neutrófilos, por último se observó una correlación positiva entre trombocitos y neutrófilos.
Un indicador de la variación de crecimiento es el cambio en el peso, longitud y altura del animal en un tiempo determinado, pueden estar influenciados por actividad, alimento, fotoperiodo, salinidad y temperatura (GÓMEZ-PONCE et al., 2011; MENA-HERRERA, 2001), encontrándose así una relación entre estas variables de tasa de crecimiento. Peso y longitud con un coeficiente de 0,93, peso y altura con 0,92 y longitud y altura con significancia de 0,81, coincidiendo con BITTENCOURTet al. (2003) y HAHN-VON-HESSBERGet al. (2011). La correlación entre las variables: peso, longitud y altura y los diferentes parámetros hematológicos, se puede llegar a la conclusión que estos valores morfométricos no afectan de manera significativa a los parámetros evaluados, la variable peso tiene una significancia de correlación de 0,103, -0,015, -0,022, 0,052, -0,087, -0,060, 0,056, -0,094, 0,086, -0,106, -0,054, -0,088, -0,064, -0,186 y -0,101 sobre VSE, hematocrito, proteína plasmática, hemoglobina, VCM, HCM, CHCM, leucocitos, eritrocitos, trombocitos, linfocitos, neutrófilos, monocitos, eosinófilos y basófilos respectivamente.Las principales causas de estrésen peces se relacionan con transporte, calidad del agua, deficiencia nutricional, hacinamiento, temperatura y profilaxis, cambios que afectan el sistema inmunológico, eritrocitos,leucocitos, recuento diferencial de leucocitos y hemoglobina(MARTINS et al., 2004a, 2004b; SERIANI et al., 2012; SILVA et al., 2012; QIANG et al., 2013),explicaría la correlación positiva encontrada entre neutrófilos y hemoglobina, y entre leucocitos y las diferentes líneas leucocitarias.
Según MARTINS et al. (2004a), los peces expuestos a estrés muestran aumento en el número de leucocitos y hematocrito después de 50, un estrés continuo provoca la reducción en el número de leucocitos y posterior aumento de hematocrito, yen ambos casos se relacionan con neutrofília y linfopenia. RANZANI-PAIVA et al. (2005) describe un aumento en el número de leucocitos y eosinófilosen la presencia de enfermedades inducidas por parásitos. CHEN et al. (2003) registra que no hay correlación entre hematocrito, proteína plasmática y la variable peso.
La correlación entre VCM y HCM registrada por BITTENCOURT et al. (2003), coincide con la encontrada en este estudio, por tanto están ligados al valor toral de eritrocitos, hemoglobina y hematocrito, al igual que con el índice CHCM, por lo que al modificarse uno de estos valores los demás también se modificarán, coincidiendo con SERIANI et al. (2012), dada probablemente que el aumento de VCM sea debido a la liberación de eritroblastos y no de eritrocitos por un efecto hemolítico y una compensación por liberación de células inmaduras.
CONCLUSIONES
A medida que la industria de la acuicultura se expande, son necesariasherramientas eficaces y eficientes para supervisar el estado de salud,enfermedad o respuesta a tratamientos. Los parámetros hematológicos encontrados para O. niloticus,en las condiciones de cultivo llevados a cabo en la Estación Piscícola de la Universidad de Caldas,siendo el peso la variable dependiente para estudiar los índices hematológicos.Suvariación no fue determinante en el valor de los diferentes parámetros hematológicos, a su vez estos valores son similares alos registrados por otros autores, indicando normalidad. Las diferencias encontradas en algunos parámetros sanguíneos sugieren, probablemente, cambios del medio ambiente, fisiológicas o de manejo.
BIBLIOGRAFÍA
ABDEL-TAWWAB, M., ABDEL-RAHMAN, A.M. & ISMAEL, N.E.M., 2008.-Evaluation of commercial live bakers' yeast, Saccharomyces cerevisiae as a growth and immunity promoter for Fry Nile tilapia, Oreochromis niloticus (L.) challenged in situ with Aeromonas hydrophila. Acuicultura, 280: 185-189. [ Links ]
ABDEL-TAWWAB, M., AHMAD, M.H., KHATTAB, Y.A.E. & SHALABY, A.M.E., 2010.- Effect of dietary protein level, initial body weight, and their interaction on the growth, feed utilization, and physiological alterations of Nile tilapia, Oreochromis niloticus (L.). Acuicultura, 298: 267-274. [ Links ]
ALMEIDA, J.A., DINIZ, Y.S., MARQUES, S.F.G., FAINE, L.A., RIBAS, B.O., BURNEIKO, R.C. & NOVELLI, E.L.B., 2002.- The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination. Environment International, 27: 673-679. [ Links ]
AZEVEDO, T.M., MARTINS, M.L., YAMASHITA, M.M. & FRANCISCO, C.J., 2006a.- Hematología de Oreochromis niloticus: comparação entre peixes mantidos em piscicultura consorciada com suínos e empesque-pague no vale do Rio Tijucas, Santa Catarina, Brasil. B. Inst. Pesca, São Paulo, 32(1): 41-49. [ Links ]
AZEVEDO, T.M.P., MARTINS, M.L., BOZZO, F.R. & MORAES, F.R., 2006b.- Respuestas hematológicas y de enmalle en tilapia parasitados de Valle de Río Tijucas, SC, Brasil. Scientia Agricola, 63 (2): 115-120. [ Links ]
BAILONE, R.L., MARTINS, M.L., MOURIÑO, J.L.P., VIEIRA, F.N., PEDROTTI, F.S., NUNES, G.C. & SILVA, B.C., 2010.- Hematology and agglutination titer after polyvalent immunization and subsequent challenge with Aeromonas hydrophila in Nile tilapia(Oreochromis niloticus). Arch. Med. Vet. Valdivia,42 (3): 221-227. [ Links ]
BITTENCOURT, N.L., MOLINARI, L.M., SCOARIS, D.O., PEDROSO, R.B., NAKAMURA, C.V., UEDA-NAKAMURA, T., ABREU-FILHO B.A. & DIAS-FILHOV, P., 2003.- Haematological and biochemical values for Nile tilapia Oerochromis niloticus cultured in semi-intensive system. Biological sciences, 25 (2): 385-389. [ Links ]
CASTAÑEDA, M.B., CABRERA, A.F., NAVARRO, Y. & VRIES, W., 2010.-Procesamiento de datos y análisis estadísticos utilizando SPSS. Porto Alegra,Brazil, Edipucrs. pág. 164. [ Links ]
CARVALHO, D.M., 2006.- Ação da Benzocaina e do Óleo de Cravo sobre parámetros fisiológicos de Tilapia, Oreochromis niloticus: Tesis, Centro de Aqüicultura da Uneps, Campus Jaboticabal, São Paulo Brasil. [ Links ]
CENTENO, L., SILVA-ACUÑA, R., BARRIOS, R., SALAZAR-LUGO, R., MATUTE, C. & PÉREZ, J.L., 2007.- Características hematológicas de la cachama (Colossoma macropomum) en tres etapas de crecimiento cultivadas en el estado Delta Amacuro, Venezuela. Revista Zootecnia Tropical. Venezuela, 25 (4): 237-243. [ Links ]
CHEN, C.Y., WOOSTER, G.A., GETCHELL, R.G., BOWSER, P.R. & TIMMONS, M.B., 2003.- Blood chemistry of healthy, nephrocalcinosis-affected and ozone-treated tilapia in a recirculation system, with application of discriminant analysis. Aquaculture, 218: 89-102. [ Links ]
CHEN, C.Y., WOOSTER, G.A. & BOWSER, P.R., 2004.- Comparative blood chemistry and histopathology of tilapia infected with Vibrio vulnificus or Streptococcus iniae or exposed to carbon tetrachloride, gentamicin, or copper sulphate. Aquaculture, 239: 421-443. [ Links ]
CLAUSS, T.M., DOVE, A.D.M. & ARNOLD, J.E., 2008.- Hematologic Disorders of Fish. Vet. Clin. Exot. Anim., 11: 445-462. [ Links ]
CONROY, D.A., 1998.- Manual de métodos y técnicas de laboratorio de uso común en la hematología pisciaria. Maracay, Venezuela: Pharmafish. págs.1-22. [ Links ]
CONROY, D.A. & CONROY, G., 1987.- Manual de métodos de diagnóstico en ictiopatología, con especial referencia a los salmónidos. FAO, Documento de campo 4. Brasilia, Brasil. [ Links ]
CRIVELENTI, L.Z., BORÍN, S., SOCHA, J.J. & MUNDIM, A.V., 2011.- Valores bioquímicos séricos de tilapia del Nilo (Oreochromis niloticus) en cultivo intensivo. Revista de Investigaciones Veterinarias del Perú, 22(4): 318-323. [ Links ]
DREZE, J. & SEN, A., 2011.- Putting growth in its place. Outlook, 14 de noviembre de 2011. Disponible en: http://www.outlookindia.com/article.aspx?278843 Accesado en: 15/04/2013. [ Links ]
DUY, U.T., SCHRAMA, J.W., VAN DAM, A.A. & VERRETH, J.A.J., 2008.- Effects of oxygen concentration and body weight on maximum feed intake, growth and hematological parameters of Nile tilapia, Oreochromis niloticus. Acuicultura, 275: 152-162. [ Links ]
EL-BOSHY, M.E., EL-ASHRAM, A.M., ABDELHAMID, F.M. & GADALLA, H.A., 2010.- Immunomodulatory effect of dietary Saccharomyces cerevisiae, B-glucan and laminaran in mercuric chloride treated Nile tilapia (Oreochromis niloticus) and experimentally infected with Aeromonas hydrophila. Fish & Shellfish Immunology, 28: 802-808. [ Links ]
EL-GREISY, Z.A & EL-GAMAL, A.E., 2012.- Monosex production of tilapia, Oreochromis niloticus using di?erent doses of 17a-methyltestosterone with respect to the degree of sex stability after one year of treatment. Egyptian Journal of Aquatic Research, 38: 59-66. [ Links ]
EL-HAWARRY, W.N., 2012.- Biochemical and non-specific immune parameters of healthy Nile tilapia (Oreochromis niloticus), blue tilapia (Oreochromis aureus) and their interspecific hybrid (male O. aureus × female O. niloticus) maintained in semi-intensive culture system. Online Journal of Animal and Feed Research, 2 (1): 84-88. [ Links ]
EL-KHALDI, A.T.F., 2010.- Effect of different stress factors on some physiological parameters of Nile tilapia (Oreochromis niloticus). Saudi Journal of Biological Sciences, 17 (3): 241-246. [ Links ]
GALVÁN-GUEVARA, S. & DE LA OSSA, V.J., 2011.- Fauna exótica y fauna trasplantada con mayor representatividad en Colombia. Revista Colombiana Ciencia Animal, 3 (1): 167-179. [ Links ]
GHIRALDELLI, L., MARTINS, M.L., YAMASHITA, M.M. & JERONIMO, G.T., 2006a.- Hematología de Oreochromis niloticus (Cichlidae) e Cyprinus carpio (Cyprinidae) mantidos em diferentes condições de manejo e alimentação no Estado de Santa Catarina, Brasil. Acta Scientiarum Biological Sciences, 28(4): 319-325. [ Links ]
GÓMEZ-PONCE, M.A., GRANADOS-FLORES, K., PADILLA, C., LÓPEZ-HERNÁNDEZ, M. & NÚÑEZ-NOGUEIRA, G., 2011.- Edad y crecimiento del híbrido de tilapia Oreochromis niloticus x Oreochromis aureus (Perciformes: Cichlidae) en la represa "Zimapán" Hidalgo, México. Revista de Biolgía Tropical, San José, 59 (2). [ Links ]
GHIRALDELLI, L., MARTINS, M.L., YAMASHITA, M.M. & JERONIMO, G.T., 2006b.- Ectoparasites influence on the haematological parameters of Nile tilapia and carp cultured in the State of Santa Catarina, South Brazil. Journal of Fisheries and Aquatic Science, 1 (3): 270-276. [ Links ]
GRAJALES, Q.A., HAHN VON-H., C. &OSPINA, H.O., 1996.- La piscicultura como alternativa de desarrollo campesino. Rev. U. de Caldas, 1 (1): 1-4. [ Links ]
GUTIÉRREZ-BONILLA, F.P. & ÁLVAREZ-LEÓN, R., 2011.- Los Cíclidos (Pisces: Cichlidae) en Colombia: introducciones, trasplantes y repoblaciones. Revista luna azúl, 33: 154-177. [ Links ]
HAHN-VON-HESSBERG, C., GRAJALES-QUINTERO, A. & GUTIÉRREZ, A.V., 2011.- Parámetros hematológicos de tilapia nilótica (Oreochromis niloticus, Linneaus 1757) con peso entre 250 g y 350 g, en el Centro Experimental Piscícola de la Universidad de Caldas, Vet. Zootec., 5(1): 47-61. [ Links ]
HAHN-VON-HESSBERG, C.M., GRAJALES-QUINTERO, A. & RESTREPO-MURILLO, M.A., 2012.- Monografía de protocolos para obtener poblaciones monosexo de tilapia nilótica (Oreochromis niloticus; TREW. 1983). Boletin Científico de Museo de Historia Natural,16 (1): 156-172. [ Links ]
HRUBEC, T.C., CARDINALE, J.L. & SMITH, S.A., 2000.- Hematology and plasma chemistry reference intervals for cultured tilapia (Oreochromis Hybrid). Veterinary Clinical Pathology, 29 (1). [ Links ]
HYLANDER, L.D., PINTO, F.N., GUIMARAES, J.R.D., MEILI, M., OLIVEIRA, L.J. & CASTRO, E., 2000.- Fish mercury concentration in the Alto Pantanal, Brazil: in?uence of season and water parameters. The Science of the Total Environment, 261: 9-20. [ Links ]
IBRAHEM, M.D., FATHI, M., MESALHY, S. & EL-ATY, A.M.A., 2010.- Effect of dietary supplementation of inulin and vitamin C on the growth, hematology, innate immunity, and resistance of Nile tilapia (Oreochromis niloticus). Fish & Shellfish Immunology, 29 (2): 241-246. [ Links ]
INSTITUTO NACIONAL DE PESCA Y ACUICULTURA, INPA, 2001.- Fundamentos de acuicultura continental. Segunda edición. Grafimpresos Quintero. Bogotá D. C., págs.2-18 y 283-298. [ Links ]
ISHIKAWA, N.M., RANZANI-PAIVA, M.J.T., LOMBARDI, J.V. & FERREIRA, C.M., 2007.- Hematological parameters in Niletilapia, Oreochromis niloticus exposed to sub-letal concentrations of mercury. Brazilian Archives of Biology and Technology. Curitiba,50 (4): 619-626. [ Links ]
ISHIKAWA, N.M., RANZANI-PAIVA, M.J.T. & LOMBARDI, J.V., 2008.- Metodologia para quantificação de leucócitos totais em peixe, Oreochromis niloticus. Archives of Veterinary Science, 13 (1): 54-63. [ Links ]
JATOBÁ, A., VIEIRA, F.N., NETO, C.B., SILVA, B.C., MOURIÑO, J.L.P., JERÔNIMO, G.T., DOTTA, G. & MARTINS, M.L., 2008.- Utilização de bactérias ácido-lácticas isoladas do trato intestinal de tilápia-do-nilo como probiótico. Pesquisa Agropecuaria Brasileira., Brasilia, 43 (9): 1201-1207. [ Links ]
JERÓNIMO, G.T., LAFFITTE, L.V., MOTA, G.M. & MARTINS, M.L., 2011.- Seasonal influence on the hematological parameters in cultured Nile tilapia from southern Brazil. Braz. J. Biol. São Carlos, 71 (3). [ Links ]
KORKMAZ, N., CENGIZ, E.I., UNLU, E., UYSAL, E. & YANAR, M., 2009.- Cypermethrin-induced histopathological and biochemical changes in Nile tilapia (Oreochromis niloticus), and the protective and recuperative effect of ascorbic acid. Environmental Toxicology and Pharmacology, 28: 198-205 [ Links ]
KUMAR, V., MAKKAR, H.P.S., DEVAPPA, R.K. & BECKER, K., 2011.- Isolation of phytate from Jatropha curcas kernel meal and effects of isolated phytate on growth, digestive physiology and metabolic changes in Nile tilapia (Oreochromis niloticus L.). Food and Chemical Toxicology, 49: 2144-2156. [ Links ]
LI, E., LIM, C., CAI, C. & KLESIUS, P.H., 2011.- Growth response and resistance to Streptococcus iniae of Nile tilapia, Oreochromis niloticus, fed diets containing different levels of wheat distiller's dried grains with solubles with or without lysine supplementation. Animal Feed Science and Technology, 170: 246-255. [ Links ]
LIM, C., YILDIRIM-AKSOY, M., LI, M.H., WELKER, T.L. & KLESIUS, P.H., 2009.- Influence of dietary levels of lipid and vitamin E on growth and resistance of Nile tilapia to Streptococcus iniae challenge. Aquaculture, 298: 76-82. [ Links ]
MARTINS, M.L., NOMURA, D.T., YAMAGUCHI-MYIAZAKI, D.M., PILARSKY, F., RIBEIRO, K., DE CASTRO, D.P & MELDAU DE CAMPOS, C.F.,2004a.- Physiological and haematological response of Oreochromis niloticus (Osteichthyes: Cichlidae) exposed to single and consecutive stress of capture. Animal Sciences, Acta Scientiarum, 26 (4): 449-456. [ Links ]
MARTINS, M.L., PILARSKY, F., ONAKA, E.M., NOMURA, D.T., FENERICK, J., RIBEIRO, K., MYIAZAKI, D.M.Y., CASTRO, M.P. & MALHEIROS, E.B., 2004b.- Hematologia e resposta inflamatória aguda em Oreochromis niloticus (Osteichthyes: Cichlidae) submetida aos estímulos único e consecutivo de estresse de captura. Boletim do Instituto da Pesca, São Paulo, 30 (1): 71-80. [ Links ]
MARTINS, M.L., MOURIÑO, J.L.P., AMARAL, G.V., VIEIRA, F.N., DOTTA, G., JATOBÁ, A.M.B., PEDROTTI, F.S., JERÔNIMO, G.T., BUGLIONE-NETO, C.C. & PEREIRA, G., 2008a.- Haematological changes in Nile tilapia experimentally infected with Enterococcus sp. Brazilian Journal of Biology, 68 (3): 657-661. [ Links ]
MARTINS, M.L., YAMAGUCHI-MIYAZAKI, D.M., MORAES, F.R., GHIRALDELLI, L., ADAMANTE, W.B. & PEDREIRA-MOURIÑO, J.L., 2008b.- Ração suplementada com vitaminas C e E influencia a resposta inflamatória aguda em tilápia do Nilo. Ciência Rural, Santa María, 38 (1): 213-218. [ Links ]
MARTINS, M.L., SHOEMAKER, C.A., XU, D. & KLESIUS, P.H., 2011.- Effect of parasitism on vaccine efficacy against Streptococcus iniae in Nile tilapia. Aquaculture, 314: 18-23. [ Links ]
MEHRIM, A.I., 2013,- Physiological, biochemical and histometric responses of Nile tilapia (Oreochromis niloticus L.) by dietary organic chromium (chromium picolinate) supplementation. Revista de Investigación Avanzada. Manuscrito aceptado. Disponible en: http://www.sciencedirect.com/science/article/pii/S209012321300060X [consultado el: 13 de abril de 2013] [ Links ]
MENA-HERRERA, A., 2001.- Relación entre la gasometría y las variables productivas de la tilapia roja (híbrida) Oreochromis niloticus (Linnaeus) x Oreochromis mossambicus (Peters), durante la adaptación y cultivo a diferentes salinidades, México: Tesis, Universidad de Colima, Colima. [ Links ]
MERRIFIELD, D.L., GÜROY, D., GÜROY, B., EMERY, M.J., LLEWELLYN, C.A., SKILL, S. & DAVIES, S.J., 2010.- Assessment of Chlorogloeopsis as a novel microbial dietary supplement for red tilapia (Oreochromis niloticus). Aquaculture, 299: 128-133. [ Links ]
MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL, MADR & Instituto Interamericano de Cooperación para la Agricultura, IICA, 2012.- Agenda nacional de investigación en pesca y acuicultura. MADR & IICA.Disponible en: http://www.minagricultura.gov.co/[Consultado el 17 de abril de 2013] [ Links ].
MORERA, D., 2011.- Los eritrocitos nucleados podrían jugar un papel en la respuesta inmunitaria. Universidad Autónoma de Barcelona, Instituto de Biotecnología y de Biomedicina "Vicent Villar Palasí".Disponible en: http://www.uab.es/PDF/PDF_1326439980461_es.pdf [Consultado el 15 de abril de 2013] [ Links ]
ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA AGRICULTURA Y LA ALIMENTACIÓN, FAO, 2005a.- Programa de información de especies acuáticas Oreochromis niloticus (Linnaeus, 1758).Departamento de Pesca y Acuicultura, FAO.Disponible en: http://www.fao.org/fishery/culturedspecies/Oreochromis_niloticus/es[Consultado el 15 de abril de 2013] [ Links ].
-----------------, 2005b.- Visión general del sector acuícola nacional, Colombia.FAO. Disponible en: http://www.fao.org/fishery/countrysector/naso_colombia/es [Consultado el 15 de abril de 2013] [ Links ]
-----------------, 2009.- El estado mundial de la pesca y la acuicultura 2008. Roma, FAO. [ Links ]
-----------------, 2010.- Perfiles sobre la pesca y la acuicultura por países, Colombia. FAO. [ Links ]
-----------------, 2011.- Revisión regional sobre la situación y tendencias en el desarrollo de la Acuicultura en América Latina y el Caribe – 2010. Roma, FAO,Circular No. 1061/3. [ Links ]
-----------------, 2012.- El estado mundial de la pesca y la acuicultura 2012.Roma, FAO. [ Links ]
FAO & INCODER, 2011.- Diagnóstico del Estado de la Acuicultura en Colombia. FAO – INCODER, Disponible en: http://www.ceniacua.org/archivos/Diagnostico_para_revision_Dic_5_2011_v1.pdf [Consultado el 17 de abril de 2013] [ Links ].
FAO, FIDA & PMA, 2012.- El estado de la inseguridad alimentaria en el mundo 2012. El crecimiento económico es necesario pero no suficiente para acelerar la reducción del hambre y la malnutrición. Roma, FAO. [ Links ]
PEÑA-MENDOZA, B., GÓMEZ-MÁRQUEZ, J.L. & GARCÍA-ALBERTO, G., 2011.- Ciclo reproductor e histología de las gónadas de tilapia Oreochromis niloticus (Perciformes: Cichlidae).Ciencia Pesquera, 19(2): 23-36. [ Links ]
PHUMYU, N., BOONANUNTANASARN, S., JANGPRAI, A., YOSHIZAKI, G. & NA-NAKORN, U., 2012.- Pubertal effects of 17a-methyltestosterone on GH–IGF-related genes of the hypothalamic–pituitary–liver–gonadal axis and other biological parameters in male, female and sex-reversed Nile tilapia. General and Comparative Endocrinology, 177: 278-292. [ Links ]
PROCHILE, 2011.- Estudio de Mercado Servicio Biotecnología para el sector Acuícola en Colombia. Bogotá, Disponible en: http://www.prochile.gob.cl/wp-content/blogs.dir/1/files_mf/documento_08_16_11164828.pdf[Consultado el 09 de abril de 2013] [ Links ].
QIANG, J., YANG, H., WANG, H., KPUNDEH, M.D. & XU, P., 2013.- Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia ,Oreochromis niloticus (L.) and mortality under Streptococcus iniae infection. Fish & Shellfish Immunology,34: 8-16. [ Links ]
QUIROZ-BUCHELI, A., 200-Caracteres hematológicos en individuos de tilapia nilótica (Oreochromis niloticus, Trewavas 1983) con pesos entre 50-150g y 150-250g, Estación Piscícola, Universidad de Caldas, Colombia.Tesis Universidad de Caldas. Programa de Medicina Veterinaria y Zootecnia. [ Links ]
RANZANI-PAIVA, M.J., FELIZARDO, N.N. & LUQUE, J.L., 2005.- Parasitological and hematological analysis of Nile Parasitological and hematological analysis of Nile tilapia Oreochromis niloticus Linnaeus, 1757 Linnaeus, 1757 from Guarapiranga reservoir, from Guarapiranga reservoir, São Paulo State, Brazil. Acta Scientiarum Biological Sciences, 27 (3): 231-237. [ Links ]
SAYED, Y.S., SAAD, T.T., EL-BAHR, S.M., 2007.- Acute intoxication of deltamethrin in monosex Nile tilapia, Oreochromis niloticus with special reference to the clinical, biochemical and haematological effects Environmental. Toxicology and Pharmacology, 24(1): 212-217. [ Links ]
SEBASTIÃO, F.A., NOMURA, D., SAKABE, R. & PILARSKI, F., 2011.- Hematology and productive performance of Nile tilapia (Oreochromis niloticus) naturally infected with Flavobacterium columnare. Brazilian Journal of Microbiology. 42: 282-289. [ Links ]
SERIANI, R., RANZANI-PAIVA, M.J.T., GONçALVES, A., SIQUEIRA, S.R. & LOMBARDI, J.V., 2012.- Determination of selenium toxicity to Oreochromis niloticus based on hematological parameters. Biological Sciences, Maringá, 34 (2): 125-131. [ Links ]
SILVA, B.C., MARTINS, M.L., JATOBÁ, A., NETO, C.C.B., VIEIRA, F.N., PEREIRA, G.V., JERÔNIMO, G.T., SEIFFERT, W.Q. & MOURIÑO, J.L.P., 2009.- Hematological and immunological responses of Nile tilapia after polyvalent vaccine administration by different routes. Pesquisa Veteinaria Brasileira, 29 (11): 874-880. [ Links ]
SILVA, R.D., ROCHA, L.O., ALVES-FORTES, B.D., VIEIRA, D. & SOARES-FIORAVANTI, M.C., 2012.- Parâmetros hematológicos e bioquímicos da tilápia-do-Nilo (Oreochromis niloticus L.) sob estresse por exposição ao ar. Pesquisa Veteinaria Brasileira. Rio de Janeiro, 32 (1): 99-107. [ Links ]
SILVEIRA-COFFIGNY, R., PRIETO-TRUJILLO, A. & ASCENCIO-VALLE, F., 2004.-Effects of different stressors in haematological variables in cultured Oreochromis aureus S. Comparative Biochemistry and Physiology, Part C 139: 245-250. [ Links ]
SILVEIRA-COFFIGNY, R., MARTINEZ-PEREZ, M., ASCENSIO-VALLE, F., 2005.- Características morfológicas y citoquímicas de las células de la sangre periférica de Oreochromis aureus S.Cichlidae. REDVET. Revista Electronica de Veterinaria, 6 (10). [ Links ]
TAVARES-DIAS, M. & MORAES, F.R., 2004.- Hematologia de peixes teleósteos. Ribeirão Preto: Villimpress. pág. 144. [ Links ]
TAVARES-DIAS, M., SCHALCH, H.C., MARTINS, M.L., SILVA, E.D., MORAES, F.R. & PERECIN, D., 1999.- Hematologia de teleósteos brasileiros com infecção parasitária. I. Variáveis do Leporinus macrocephalus Garavelo e Britski, 1988 (Anostomidae) e Piaractus mesopotamicus Holmberg, 1887 (Characidae). Acta Scientiarum, 21 (2): 337-342. [ Links ]
TENORIO-COLÍN, G., 2003.- Caracterización isoenzimática de Oreochromis niloticus y O. mossambicu introducidas en México. Ciencia y mar,7 (19):3-9. [ Links ]
THOMPSON, B. &SUBASINGHE, R., 2011.- Aquaculture's role in improving food and nutrition security: pp.150-162 In: THOMPSON, B. & AMOROSO, L. (ed.) Combating micronutrient deficiencies: food-based approaches. FAO & CABI, Roma. [ Links ]
UEDA, I.K., EGAMI, M.I., SASSO, W.S. & MATUSHIMA, E.R., 1997.- Estudo hematológico do sangue periférico de Oreochromis niloticus (Linnaeus, 1758) (Cichlidae, Teleostei)Parte I. Brazilian Journalof Veterinary Research and Animal Science, 34 (5): 270-275. [ Links ]
-----------------, 2001.- Cytochemical aspects of peripheral blood cells of Oreochromis (Tilapia) niloticus. (Linnaeus, 1758) (Cichilidae, Teleostei) –Part II. Brazilian Journalof Veterinary Research and Animal Science, 38 (6): 273-277. [ Links ]
UNIVERSIDAD DE CALDAS, 2005.- Manual de procedimientos en hematología y coagulación laboratorio de microbiología. Manizales: Centro Editorial Universidad de Caldas, págs.20-29. [ Links ]
YANAR, M. & KUMLU, M., 2001.- The Anaesthetics efects of quinaldine sulphate and/ or diazepam on sea bass (Dicentrarchus labras) JuveNiles. Journal Veterinary Animal Science, 25 (1): 185-189. [ Links ]
YOUNG-MIN, E. & KANG, J.C, 2008.- Effect of waterborne benomyl on the hematological and antioxidant parameters of the Nile tilapia,Oreochromis niloticus. Pesticide Biochemistry and Physiology, 92 (3): 138-143. [ Links ]
YUE, Y.R. & ZHOU, Q.C., 2008.- Effect of replacing soybean meal with cottonseed meal on growth, feed utilization, and hematological indexes for juveNile hybrid tilapia, Oreochromis niloticus × O. aureus. Aquaculture, 284: 185-189. [ Links ]