Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.18 no.1 Manizales Jan./June 2014
EFECTO DE Beauveria bassiana y DEL ENTOMONEMATODO Steinernema sp. SOBRE LARVAS DE Galleria mellonella*
EFFECT OF Beauveria bassiana and ENTOMOPATHOGENIC NEMATODE Steinernema sp. ON Galleria mellonella LARVAE
Tito Bacca1, Tulio César Lagos B.2
* FR: 19-II-2014. FA: 25-III-2014.
1 Profesor Asociado. Facultad de Ciencias Agrícolas, Programa de Ingeniería Agronómica, Universidad de Nariño, Torobajo, Pasto, Colombia. E-mail: titobacca@gmail.com
2 Profesor Asociado. Facultad de Ciencias Agrícolas, Programa de Ingeniería Agroforestal, Universidad de Nariño, Torobajo, Pasto, Colombia. E-mail: tclagosb@udenar.edu.co
CÓMO CITAR: BACCA, T. & LAGOS B., T.C., 2014.- Efecto de Beauveria bassiana y del entomonematodo Steinernema sp. sobre larvas de Galleria mellonella. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 18 (1): 247-258.
Resumen
En el manejo integrado de plagas, es común la utilización de varios agentes de control biológico, tales como los hongos entomopatógenos (HE) y nematodos parásitos de insectos (NE). Estos dos patógenos pueden tener el mismo hospedero y hábitat, conllevando a que se presenten relaciones de sinergismo o antagonismo al colonizar el mismo huésped. Con base en lo anterior, este trabajo tuvo como objetivo estudiar la interacción que puede presentarse entre Beauveria bassiana (Bb) y Steinernema sp. (Ss) en larvas del lepidótero Galleria mellonella (Gm) de manera individual y en conjunto. La unidad experimental estuvo conformada por seis larvas de Gm colocadas en cajas de cultivo de tejidos de 24 pozos, con papel filtro. Bb se utilizó en una concentración por larva de 1 x 103 (n=9) esporas/ ml y de Ss una concentración de 100 Juveniles infectivos (JI) por larva. Como testigo se utilizó agua estéril. En general, se pudo encontrar que el porcentaje de mortalidad a las 48 horas para el tratamiento donde se realizó aplicación simultánea fue superior y estadísticamente diferente al de los tratamientos individuales. En relación con el desarrollo de Ss, aunque no se observó diferencias significativas en cuanto a la diferenciación de sexos, sí se presentó disminución en la producción de juveniles infectivos e índice de penetración (variables evaluadas para establecer el efecto del hongo sobre el nematodo). En el caso del hongo, su esporulación se redujo significativamente. Finalmente, aunque se presenta una mayor eficacia para el control de la plaga cuando se utilizan los patógenos juntos, el desarrollo de cada uno de los organismos se ve afectado posiblemente por la competencia por el hospedero, en donde domina el agente que primero logre colonizar. En términos generales la comprensión de estas interacciones sobre un insecto blanco específico, permitirá determinar la compatibilidad de los componentes del control biológico que se utilicen y ayudará a incrementar la eficacia en la reducción de la plaga.
Palabras clave: entomopatógeno, nematodo, hongos, control biológico, sinergismo, antagonismo.
Abstract
In the integrated pest management the use of several biological control agents is common such as the entomopathogenic fungi (EF) and nematode parasites of insects (NE). These two pathogens may have the same host and habitat, leading to the appearance of synergism or antagonism relations when colonizing the same host. Based on the foregoing, this work had as main objective to study the interaction that can occur between Beauveria bassiana (Bb) and Steinernema sp. (Ss) in the lepidopteron Galleria mellonella (GM) larvae individually and as a group. The experimental unit was composed of six GM larvae from 24 wells placed in tissue culture dishes, with filter paper. Bb was used in a concentration of 1 x 103 (n= 9) spores/ml per larvae and Ss was used in a concentration of 100 infective juvenile (IJ) per larva. Sterile water was used as control. In general, it could be found that the percentage of mortality at 48 hours, for the treatment in which simultaneous application was performed, was higher and statistically different from that of individual treatments. In relation to the development of Ss, although there were no significant differences concerning the differentiation of sexes, there was decreased production of infective juveniles and penetration rate (variables evaluated to establish the effect of the fungus on the nematode). In the case of fungus, its sporulation was significantly reduced. Finally, although there is an increased effectiveness in pest control when pathogens are used together, the development of each of the organisms is affected possibly by competition for the host in which case, the agent that colonizes first dominates. In general terms the understanding of these interactions on a specific target insect will make it possible to determine the compatibility of the components of biological control to be used and will help increase the efficiency in the reduction of the pest.
Key words: enthomopathogenic, nematodes, fungi, biological control, synergism, antagonism.
INTRODUCCIÓN
En el manejo integrado de plagas (MIP) los nematodos entomopatógenos (NE) y hongos entomopatogenos (HE), se utilizan como agentes de control de gran eficacia y selectividad, especialmente para un amplio espectro de plagas. Estos agentes de control biológico se pueden utilizar en forma inundativa como insecticidas biológicos o en aplicaciones inoculativas. Tales formas de aplicación pueden asegurar el establecimiento de estos organismos, reduciendo así las poblaciones de plaga (KAYA y GAUGLER. 1993).
Tanto NE y HE pueden ocupar el mismo hospedero y hábitat, conllevando a diferentes tipos de relaciones sinergistas o antagonistas, que pueden ir en detrimento o favorecimiento en el control de plagas. Este tipo de relaciones aún no están bien entendidas; el sinergismo se puede aprovechar para aumentar los niveles de control de plagas, se propone que uno de los agentes de control puede estresar o alterar el comportamiento (alimentación o movimiento) de insecto plaga, creando una oportunidad de mayor susceptibilidad para el ataque del otro agente de control (ANSARI et al., 2008). Este tipo de sinergismo entre NE y HE ha sido demostrado por ANSARI et al., (2004) y ANSARI et al., (2006) para el control de una plaga de céspedes en Europa, Hoplia philanthus Füessly. Dichas sinergias pueden ser aprovechas en control biológico, debido a que se pueden disminuir los costos por que se bajan las dosis de aplicación. Sin embargo, también puede ocurrir antagonismo entre estos organismos, pues el hongo puede ser patogénico para el NE o el entomopatógeno puede ser afectado por las toxinas emitidas por el NE en la etapa inicial del hospedero (SHAPIRO et al., 2004).
El sinergismo u otra relación ecológica dependerán de la relación patógeno - huésped de la interacción, de los factores bióticos (concentración de patógeno, flora y fauna natural y población del hospedante) y abióticos (tipo de suelo, pH, temperatura y humedad del suelo) factores que influyen en el resultado de esta relación (KAYA & THURSTON, 1993; SHAPIRO-ILAN et al., 2012).
Teniendo en cuenta los anteriores antecedentes, el objetivo de esta investigación fue estudiar la interacción que entre Beauveria bassiana (Bb) y Steinernema sp. (Sr) en la infección de larvas del lepidótero Galleria mellonella (Gm) de forma individual y en conjunto.
MATERIALES Y MÉTODOS
La investigación se realizó en el laboratorio de Entomología del Centro Nacional de Investigaciones de Café CENICAFÉ, en Chinchiná (Caldas) a 1410 msnm. Se utilizó el insecto Galleria mellonella debido a que es un blanco de fácil observación y manipulación, también porque un insecto hospedante de entomonematodos ampliamente estudiado y es hospedero del hongos entomopatógenos. Para los bioensayos se utilizaron larvas de séptimo instar de G. mellonella con peso promedio de 0,2 ± 0,004 g (c ± S2), que se obtuvieron una cría mantenida en CENICAFÉ. El hongo Beauveria bassiana (B.b 9205) fue suministrado en la planta piloto de control biológico de CENICAFÉ, con una viabilidad del 92% y la patogencidad sobre broca Hypothenemus hampei del 97%, antes de la reactivación en G. mellonella. El entomonematodo utilizado fue Steinernema sp., fue suministrado de la colección de aislamientos de la disciplina de Entomología de CENICAFÉ, mantenido a una temperatura promedio de 12 °C.
Reactivación y multiplicación del hongo entomopatógeno
Para la reactivación de Beauveria bassiana, se tomó larvas de Galleria mellonella, las cuales se infectaron en una suspensión concentrada de esporas (108 esporas / ml), para garantizar la infección del entomopatógeno. Las larvas posteriormente, se colocaron en una caja petrí con papel toalla estéril humedecida con agua destilada estéril, a manera de cámara húmeda; finalmente, la caja se llevó a incubación a 24 ± 2°C durante cinco días, en oscuridad constante. Las anteriores condiciones garantizan la infección del hongo y la evidencia de síntomas y signos de las larvas afectadas por el entomopatógeno, como son pérdida de movimiento, coloración rojiza, presencia de máculas a la altura de espiráculos y en región intersegmental, rigidez completa del cuerpo de la larva y aparición de micelio blanco algodonoso en espiráculos boca y ano. Las larvas con la sintomatología descrita, se sometieron a un proceso de desinfección, consistente en la inmersión en una solución de hipoclorito de sodio al 1 % de la concentración comercial, durante dos minutos. Posteriormente, se eliminó el exceso de hipoclorito enjuagando con agua destilada estéril (tres veces) y secando cada larva con papel toalla estéril. Finalmente, cada larva se colocó en caja petrí con 15 ml de Agar Sabouraud Dextrosa (ASD), para permitir el crecimiento y multiplicación del hongo en el medio. Las cajas petrí se mantuvieron en condiciones de 24 ± 2°C con 12 horas de luz y 12 de oscuridad diaria durante 48 días, tiempo aproximado en el cual se realizó la recolección de las esporas para el montaje del experimento.
A las esporas colectadas, se les realizó prueba de viabilidad (24 y 48 horas), en Agar agua con el fin de conocer dicha característica antes del montaje del experimento.
Obtención de la concentración del hongo
Las cajas petrí en donde se evidenció esporulación del hongo, se lavaron con 10 ml de una solución de agua destilada estéril y Tween 80 (0,1%) (ADET). Los recuentos de esporas se realizaron en cámara de Neubauer, ajustando la concentración de esporas por medio de diluciones seriadas a 107 esporas/ml.
El sistema utilizado para infectar las larvas, fue el de inmersión durante 30 segundos en 100 ml de la suspensión de esporas (1x 109 esporas/ml). Para determinar la concentración por larva, se utilizaron 10 larvas infectadas mediante el mismo sistema. Se colocaron en tubos con 9 ml de ADET, y posteriormente, se procedió a realizar el recuento de esporas en cámara de recuento. El número de esporas por larva encontrado para la realización de este experimento fue de 7,8 ± 2,8 x 105 (c± D.E).
Multiplicación de entomonematodos
Para la multiplicación de Steinernema sp., a una caja petrí con papel filtro estéril, se adicionó un volumen de 1 ml con una concentración de 1000 juveniles infectivos, colocando finalmente 10 larvas de último instar de G. mellonella; las cajas se sellaron con vinilpel, para evitar la desecación y se llevaron a una temperatura de incubación de 24 ± 2°C en completa oscuridad, por un tiempo de 48 horas. Al final de este tiempo, las larvas muertas y con evidencia de síntomas de infección por el nematodo (consistencia blanda sin descomposición y coloración desde habana a tabaco), se pasaron a caja petrí con papel filtro a una temperatura de 24 ± 2 °C y oscuridad constante, durante 144 ± 24 h. Las condiciones descritas permiten desde la infección de los nematodos hasta su desarrollo en el interior de las larvas. Finalizado este tiempo, las larvas se colocaron en cámaras de recuperación de Juveniles Infectivos (JI), cámaras White, para estimular la emergencia de los nuevos JI. Con el fin de eliminar residuos del insecto, los JI se lavaron con agua estéril y se precipitaron por gravedad, almacenándolos a 12 ± 3°C. Lo anterior se realizó diariamente hasta los 10 días posteriores al inicio de la emergencia.
Ajuste de la concentración de JI de entomonematodos
Para determinar la concentración de nematodos se utilizó una cámara de recuento utilizada en nematología. El número de nematodos utilizado por larva, fue de 109 ± 4,41) (c± D.E) nematodos/ 300 ml.
Unidad experimental (U.E)
La U.E estuvo conformada por seis larvas de G. mellonella colocadas en cajas de cultivo de tejidos (Falcon) de 12,5 X 8,5 cm, con 24 pozos. En cada pozo (1,75 cm de diámetro X 1,75 cm de largo), se colocó una rodaja de papel filtro y una larva de G. mellonella.
Tratamientos
Los tratamientos evaluados fueron los siguientes:
1. Ssp. Infección con Steinernema sp.
2. B.b. Infección con B. bassiana
3. Ssp.+Bb0d. Infección simultánea con Steinernema sp. y B. bassiana.
4. B.b.+ 3d.Ssp. Infección con B. bassiana y 3 días después infección con Steinernema sp.
5. Ssp. +3d.B.b. SInfección con Steinernema sp. y 3 días después infección con B. bassiana
6. T. Testigo. Larvas de G. mellonella, inmersas en ADET y con aplicación de 300 ml de agua libre de nematodos por pozo.
Para los tratamientos 2 y 6 se utilizaron cinco repeticiones (U.E), para un total de 30 larvas por tratamiento. Los otros tratamientos contaron con siete repeticiones, para un total de 42 larvas.
Variables analizadas
Mortalidad de G. mellonela: Esta variable se estimó para todos los tratamientos descritos. La mortalidad fue registrada cada 24 horas después de la infección, hasta que se presentó 100% de mortalidad en cada tratamiento.
Producción de nematodos por larva de G. mellonella
Una vez se produjo la muerte de cada larva (entre 2 a 5 días dependiendo del tratamiento) éstas se llevaron a cámara seca. Cuando se observó síntomas de la infección del nematodo, entre 7 y 10 días después de la muerte de las larvas, éstas se individualizaron en cámara White para promover la emergencia de nematodos, la cantidad total de nematodos emergidos se estimó utilizando la cámara de recuento de nematodos. Además, se registró las características cualitativas de los síntomas y signos de las larvas atacadas ya fuera por el hongo o por el nematodo. Para la medición de esta variable, de manera aleatoria se seleccionaron 15 larvas por tratamiento.
Índice de penetración de los nematodos (IP)
Esta variable fue estimada como la relación entre el número de NE JI colocados y los que alcanzaron completo desarrollo dentro de la larva de G. mellonella. A las 48 horas después de la infección con el nematodo se tomaron tres larvas por unidad experimental, para un total de 15 larvas por tratamiento. Éstas se disecaron para determinar el IP y establecer la proporción de sexos del nematodo. Para calcular este índice, se utilizó la siguiente ecuación:

Para la estimación de esta variable, de manera aleatoria se seleccionaron 15 larvas por tratamiento.
Desarrollo del B. bassiana y producción de esporas por larva
Para los tratamientos en los cuales se aplicó B. bassiana, se determinaron signos y síntomas descritos anteriormente para cada larva. Además, se estableció el número de esporas producidas por larva en los tratamientos que presentaron esporulación sobre el cadáver del insecto, utilizando la metodología descrita anteriormente para el ajuste de la concentración de esporas del hongo. Para la medición de esta variable, se tomaron 12 larvas por tratamiento; para el tratamiento b, esta variable se midió con el total de las larvas de todas las repeticiones (30 larvas).
Diseño experimental y análisis estadístico
Se utilizó un diseño completamente aleatorizado y la variables fueron sometidas a un análisis de varianza (p<0,05). Para comparar los promedios se utilizó la prueba de Duncan (p<0,05). Las mortalidades de cada tratamiento en el tiempo, se ajustaron a modelos polinómicos, y las pendientes de cada ecuación fueron comparadas con la prueba de T (p<0,05).
RESULTADOS Y DISCUSIÓN
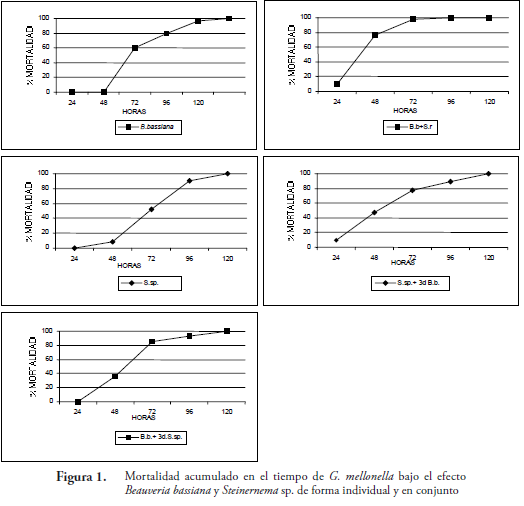
Mortalidad de G. mellonella
Las mortalidades más rápidas se consiguieron con los tratamientos de aplicación simultanea de NE y B. bassiana (Ssp.+B.b0d.) y de hongo más NE después de tres días; esto posiblemente, se debe a la movilidad del nematodo y a la asociación con su simbionte bacteriano, lo cual le permite infectar más rápido. Dichos tratamientos a las 48 horas, alcanzaron en promedio una mortalidad del 53,55%, en contraste con los tratamientos donde se aplicó B. bassiana, cuyo promedio de mortalidad para este tiempo fue de 6,05%. Las mortalidades para los demás tratamientos a las 72 horas ocurrieron en tiempos similares, con excepción del tratamiento del hongo donde se produjo la mortalidad más lenta (Fig.1). Lo anterior se ve reflejado al comparar los componentes lineales para cada ecuación, donde los tratamientos Ssp.+B.b0d., presentan las mayores pendientes, lo que se traduce como una mortalidad más rápida, en contraste con lo sucedido para el tratamiento B.b. (solo hongo) (Tabla 1).

Ecuaciones seguidas por la misma letra no presentan diferencias significativas en el componente lineal de cada ecuación (P<0,05 Prueba de T)
Los resultados de la aplicación simultanea del nematodo y hongo, donde se consiguió una mortalidad más rápida concuerdan con los obtenidos por KAYA & THURSTON (1993), quienes estudiaron la interacción Steinernema carpocapsae y B. bassiana sobre G. mellonela en suelo, encontrando que existe una aceleración y aumento en la mortalidad del lepidóptero. En el caso de la interacción entre B. bassiana y los nematodos Steinernema feltiae y Heterorhabditis bacteriophora sobre G. mellonela, se produjo una acción antagonista entre la aplicación de los nematodos y el hongo y también se disminuyó el tiempo de mortalidad (BARBERCHECK & KAYA, 1990). Similarmente, también se conoce el caso de Spodoptera exigua que al ponerlo en contacto H. bacteriophora y conidias B. bassiana en el suelo, se produce una mayor mortalidad que la acción del hongo solo (BARBERCHECK, & KAYA, 1991). Esto muestra que en algunos casos, la mezcla de dos patógenos diferentes puede producir un efecto positivo en la aceleración en el tiempo de mortalidad (KAYA & THURSTON, 1993; FINNEY, 1981; MOLINA et al., (2006)).
Producción acumulada de JI por larva de G. mellonella
La producción en el tratamiento de solo nematodos, fue estadísticamente igual al tratamiento de aplicación de nematodos más hongo tres días después. Estos tratamientos a su vez fueron mayores y estadísticamente diferentes a los tratamientos de aplicación de hongo más tres días después nematodos y la aplicación de los dos organismos en forma simultánea (Tabla 2). Es importante destacar que el porcentaje de larvas que produjeron JI para los dos últimos tratamientos correspondieron al 6 y 12%, respectivamente de las larvas evaluadas. MOLINA et al., (2006) encontraron un efecto parecido al encontrar que el hongo Metarhizium anisopliae disminuye considerablemente la producción de JI de Heterorhabditis bacteriophora aplicados sobre Diatraea saccharalis.
La presencia del hongo sobre el nematodo, reduce la producción de juveniles (Tabla 2). Esto se atribuye principalmente a la producción de toxinas o metabolitos secundarios del hongo, que inhiben el desarrollo y producción de nematodos, siendo ésta una competencia interespecífica entre la bacteria simbionte del nematodo y las toxinas (HU & WEBSTER, 2000, ISAACSON & WEBSTER, 2002; SHAPIRO et al., 2004).

Promedios seguidos con la misma letra no presentan diferencias significativas (p<0,05 Prueba de Duncan).
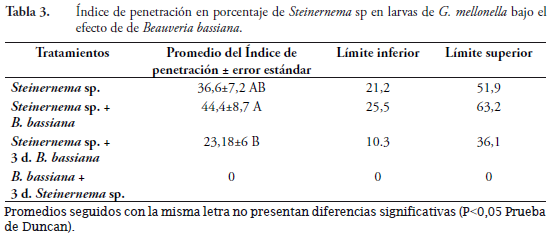
Índice de penetración
Para esta variable, el tratamiento aplicación del nematodo solo, fue estadísticamente igual a los demás tratamientos donde se aplicó el nematodo, excepto para el tratamiento hongo más tres días nematodo, donde no hubo penetración de Steinernema sp. El tratamiento aplicación simultanea de nematodo más hongo fue mayor y diferente al tratamiento nematodo más tres días después hongo (Tabla 3).
Cuando se aplican los dos organismos sobre G. mellonella se presenta penetración de los nematodos; sin embargo, el desarrollo de los adultos dentro del insecto se ve afectada por el hongo, lo que se traduce en la disminución de nuevos JI producidos por larva. Una vez se establece el nematodo en G. mellonella, este no es tan susceptible de ser afectado con posteriores aplicaciones de hongo. El nematodo es afectado por B. bassiana en el proceso de colonización del hospedante y también se ve afectado en su proceso reproductivo. Cuando el hongo está establecido no es posible o es muy difícil la penetración y reproducción del nematodo; por lo tanto, parece que el Steinernema sp. tiene cierta preferencia a penetrar y reproducirse en hospedantes sanos.
Promedios seguidos con la misma letra no presentan diferencias significativas (P<0,05 Prueba de Duncan).
Diferenciación de sexos de los nematodos juveniles
El porcentaje de machos y hembras producidas por cada larva de G. mellonella fue estadísticamente igual para todos los tratamientos (Tabla 4). El efecto de la aplicación del hongo sobre Steinernema sp. no afectó la diferenciación de sexos. La proporción se sexos registrada en todos los tratamientos fue cercana a la relación de 1 : 1, que es la relación normal para nematodos entomopatógenos.

Promedios seguidos con la misma letra no presentan diferencias significativas (P<0,05 Prueba de Duncan) EE= error estándar.
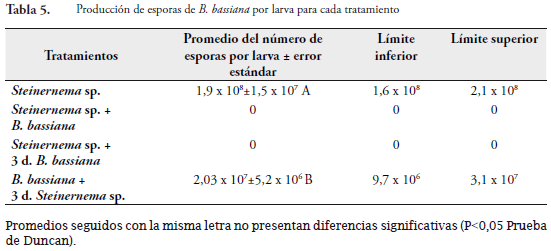
Desarrollo del hongo
La geminación de esporas, utilizadas en la inoculación de las larvas, en los diferentes tratamientos fue de 83,5% (S=13) y 86,1% (S=11,2) para las 24 horas y 48 horas, respectivamente. Estas condiciones garantizaron una buena viabilidad del hongo. Los tratamientos donde se desarrolló el hongo y hubo producción de esporas fueron: el tratamiento dcon solo B. bassiana y el de aplicación de hongo y después de tres días nematodo. Estos tratamientos fueron estadísticamente diferentes. En el primer tratamiento se presentó un 100% de esporulación de las larvas analizadas mientras que en el segundo el 58% de las larvas presentaban signos del hongo. En los demás tratamientos donde se aplicó B. bassiana no hubo producción de esporas sobre el cadáver de las larvas (Tabla 5). Esto nos muestra las limitaciones de la reproducción del hongo en presencia del nematodo. Cuando el hongo ya se ha establecido en G. mellonella existe desarrollo del hongo pero la esporulación es más baja en comparación cuando se aplica solo hongo. Con esta variable se evidencia claramente que existe efecto de competencia intraespecífica del nematodo o de su bacteria simbionte sobre el desarrollo del Steinernema sp. ya que no existe esporulación del hongo.
Este efecto de competencia del desarrollo del hongo sobre el del nematodo en su mismo hospedero, fue encontrado por MOLINA et al. (2006), quien explica que estos dos entomopatógenos se encuentran en una competencia para obtener nutrientes y reproducirse con éxito. El nematodo se considera el más virulento de los agentes. Este coloniza rápidamente su hospedero y suprime el desarrollo del hongo.
La combinación de dos patógenos diferentes puede afectar la producción de la progenie. Generalmente, solo un patógeno se desarrollará en el hospedante excluyendo al otro o la producción de su progenie. La producción de progenie ya sea del nematodo o B. bassiana es adversamente afectada cuando ambos tipos de patógenos se colocan en un insecto hospedante. Los nematodos producen juveniles infectivos mientras previenen la producción del hongo. El mecanismo de exclusión del hongo es basado en los compuestos antibióticos o fungistáticos producidos por el mutualista Xenorhabdus, para que se produzca el hongo se requiere de uno o varios días para infectar al hospedante antes de la aplicación del nematodo (ISAACSON & WEBSTER, 2002).
Promedios seguidos con la misma letra no presentan diferencias significativas (P<0,05 Prueba de Duncan).
CONCLUSIONES
El efecto de la aplicación simultanea de Steinernema sp. y B. bassiana producen una muerte más rápida en G. mellonella que el efecto de la aplicación del hongo o nematodo por separado.
La producción de juveniles de Steinernema sp. e índice de penetración de Steinernema sp. en G. mellonella se disminuyen por la presencia del B. bassiana. La relación en la diferenciación de sexos de Steinernema sp. no se ve afectada por B. bassiana. El crecimiento B. bassiana, con la interacción de Steinernema sp., se inhibe o reduce en la producción de esporas.
Cuando se requiera integrar las aplicaciones de Steinernema sp. y B. bassiana para manejar un insecto plaga, se debe tener en cuenta que existe una competencia intraespecifica de los organismos involucrados en esta relación. Por lo tanto, para efectos de conseguir una mortalidad rápida se puede utilizar la mezcla. Pero si lo que se busca es inocular el patógeno en el medio, no se deben integrar, lo mejor es utilizar el organismo que más ventajas presente controlando insecto plaga.
AGRADECIMIENTOS
A Juan Carlos López Núñez por el apoyo técnico y científico en el planeamiento y realización del experimento. Al Centro Nacional de Investigaciones de Café, CENICAFÉ, por facilitar toda la logística para el desarrollo de esta investigación.
BIBLIOGRAFÍA
ANSARI, M.A.; SHAH, F.A. & BUTT, T.M. 2008.- Combined use of entomopathogenic nematodes and Metarhizium anisopliae as a new approach for black vine weevil, Otiorhynchus sulcatus, control. Entomol. Exp. Appl., 129: 340-347. [ Links ]
ANSARI, M.A; SHAH, F.A; TIRRY, L. & MOENS, M. 2006.- Field trials against Hoplia philanthus (Coleoptera: Scarabaeidae) with a combination of an entomopathogenic nematode and the fungus Metarhizium anisopliae CLO 53. Biol. Control., 39: 453-459. [ Links ]
ANSARI, M.A; TIRRY, L. & MOENS, M. 2004.- Interaction between Metarhizium anisopliae CLO 53 and entomopathogenic nematodes for control of Hoplia philanthus. Biol. Control 31: 172-180. [ Links ]
BARBERCHECK, M.E. & KAYA, H.K. 1990.- Interactions between Beauveria bassiana and the entomogenous nematodes, Steinernema feltiae and Heterorhabditis heliothidis. J. Invertebr. Pathol., 55, 225–234. [ Links ]
BARBERCHECK, M.E. & KAYA, H.K. 1991.- Competitive interactions between entomopathogenic nematodes and Beauveria bassiana (Deuteromycotina: Hypomycetes) in soilborne larvae of Spodoptera exigua (Lepidoptera: Noctuidae). Environ. Entomol., 20, 707–712. [ Links ]
FINNEY, J.R. 1981.- Potential of nematodes for pest control. (en) BURGES, H.D. Microbial Control of pest and plant diseases 1970 – 1980. Academia Press, London, Inglaterra. [ Links ]
HU, K. & WEBSTER, J.M. 2000.- Antibiotic production in relation to bacterial growth and nematode development in Photorhabdus-Heterorhabditis infected Galleria mellonella larvae. Microb. Lett., 189, 219– 223. [ Links ]
ISAACSON, P.J. & WEBSTER, J.M. 2002.- Antimicrobial activity of Xenorhabdus sp. RIO (Enterobacteriaceae), symbiont of the entomopathogenic nematode, Steinernema riobrave (Rhabditida: Steinernematidae). J. Invertebr. Pathol., 79, 146–153. [ Links ]
KAYA, H. K.; THURSTON, G.S. 1993.- Soil microorganism affecting entomopathogenic nematodes. (en): BEDDING, R,A.; AKHURST, R.J. & KAYA, H.K (eds). Nematodes and the biological control of insect pest. CSIRO Information Service, East Melbourne, Australia. [ Links ]
KAYA, H. K. & GAUGLER, R. 1993.- Entomopathogenic nematodes. Annu. Rev. Entomol. 38: 181 - 206. [ Links ] .
MOLINA, A. J.P.; SAMUELS, R.I.; MACHADO I.R. & DOLINSKI, C. 2007.- Interactions between isolates of the entomopathogenic fungus Metarhizium anisopliae and the entomopathogenic nematode Heterorhabditis bacteriophora JPM4 during infection of the sugar cane borer Diatraea saccharalis (Lepidoptera: Pyralidae). J Invertebr Pathol 96:87-192 [ Links ]
SHAPIRO-ILAN, D.I; BRUCK, D. & LACEY, L.A. 2012.- Principles of Epizootiology and Microbial Control. (en) VEGA, F.; KAYA, H. (eds) Insect Pathology. Academic Press, San Diego. [ Links ]
SHAPIRO, D.I.; JACKSON, M.; REILLY, C.C. & HOTCHKISS, M.W. 2004. Effects of combining an entomopathogenic fungi or bacterium with entomopathogenic nematodes on mortality of Curculio caryae (Coleoptera:Curculionidae). Biol. Control., 30: 119-126. [ Links ]













