Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.18 no.2 Manizales jul./dic. 2014
BIOLOGÍA REPRODUCTIVA DEL BALSO BLANCO (Heliocarpus americanus L.)
REPRODUCTIVE BIOLOGY OF White Balsa Wood (Heliocarpus americanus L.)
Tulio César Lagos Burbano1, Karen Evelin Benavides Arteaga2
* FR: 17-VII-2014. FA: 14-XI-2014.
1 Profesor Asociado, I.A. Ph.D. Universidad de Nariño. Facultad de Ciencias Agrícolas. Pasto, Colombia. tclagosb@yahoo.com
2 Ingeniera Agrónoma. karenbenavides9118@hotmail.com
CÓMO CITAR: LAGOS BURBANO, T.C. & BENAVIDES ARTEAGA, K.E., 2014.- Biología reproductiva del balso blanco (Heliocarpus americanus L.). Bol. Cient. Mus. Hist. Nat. U. de Caldas, 18 (2): 28-44.
Resumen
Los estudios de biología floral son la base para adelantar procesos de conservación y uso de los recursos genéticos. Con el propósito de estudiar algunos aspectos de la biología floral y describir morfológicamente el fruto y la semilla del Heliocarpus americanus, se marcaron 1000 botones florales de 2 mm de longitud (estado cero). Las variables evaluadas fueron longitud del botón floral, longitud y ancho de cáliz, longitud y ancho de corola, longitud y diámetro del ovario, longitud y ancho de la antera, longitud del filamento, longitud del estilo y longitud del pedicelo. Estas evaluaciones se realizaron cada tres hasta los 33 días, momento en el cual se dio la fecundación. Para el fruto se estudió el eje polar, diámetro ecuatorial, longitud y grosor del pedúnculo. Se hicieron mediciones cada seis días hasta los 111, cuando el fruto alcanzó la maduración. Igualmente, se evaluó la viabilidad y maduración de los órganos reproductivos de la flor y la germinación de la semilla. El crecimiento de los verticilos y fruto se ajustó al modelo cuadrático de la forma y = B0+B1X+B2X2. El polen inicia su maduración a los nueve días, con un 54,34 % de viabilidad. La receptividad del pistilo se dio a los 15 días, coincidiendo con la apertura floral. El fruto tiene de uno a tres semillas y la germinación fue del 64 % a los 21 días. Con este estudio se sientan las bases de la biología reproductiva de H. americanus que servirán para estudios de propagación y mejoramiento genético de esta especie.
Palabras clave: crecimiento, desarrollo, viabilidad, receptividad, polen, ovario.
Abstract
Studies of floral biology are the basis to advance in conservation and use of genetic resources processes. In order to study some aspects of floral biology and morphologically describe the fruit and seed of Heliocarpus americanus, 1,000 two mm long flower buds (zero state) were labeled. The variables evaluated were length of flower bud, length and width of calyx, length and width of corolla, length and diameter of the ovary, length and width of the anther, filament length, style, length and pedicel length. These assessments were carried out every three to 33 days, when fertilization occurred. For the fruit, the polar axis, equatorial diameter, length and thickness of the peduncle was studied. Measurements were made every six days for 111 days when the fruit reached maturity. Similarly, the viability and maturation of the reproductive organs of the flower and seed germination were evaluated. The growth of whorls and fruit were adjusted to the quadratic model of the form y = B0+B1X+B2X2. Pollen begins maturation nine days after with a 54.34% viability. The pistil receptivity occurred at 15 days, coinciding with anthesis. The fruit has from one to three seeds and the germination percentage was 64% at 21 days. With this study, the bases for reproductive biology of H. americanus are set which will serve for propagation studies and genetic improvement of this species.
Key words: growth, development, viability, receptivity, pollen, ovary.
INTRODUCCIÓN
H. americanus L. syn. H. popayanensis H.B.K conocido con el nombre vernáculo de "balso blanco", es una especie que pertenece a la familia Malvaceae. Se encuentra en bosques secundarios, en altitudes que oscilan entre 500 y 2500 msnm, desde el norte de Argentina hasta el sur de México (ROBYNS, 1964). En Colombia se encuentra desde los 0 a 2600 msnm, en un rango de precipitación que va desde los 1500 hasta los 2500 mm/año y una temperatura que varía entre 18,5 y 21 ºC (MAHECHA et al., 2004; VÁSQUEZ et al., 2006). En el departamento de Nariño se distribuye en 15 municipios localizados a lo largo de las vertientes que forman la parte media de los ríos Guáitara, Juanambú y Mayo, en altitudes que van desde 1181 y 2670 msnm. En esta zona, la especie se ha establecido por regeneración natural en un 93,10 % (LAGOS et al., 2013). Sin embargo, en algunos municipios como Sandoná y Ancuya, su presencia ha sido afectada, negativamente, por la cosecha desmedida de su corteza, lo cual ha conducido a una elevada erosión de sus recursos genéticos.
H. americanus alcanza alturas entre 10 y 25 m, con un fuste de 15 m, así como de 20 a 80 cm de diámetro a la altura del pecho (DAP); con copa en forma de paraguas, tronco recto y cilíndrico, ramificado a baja altura; corteza blanco-grisáceo; hojas simples, alternas, con tres lóbulos acuminados, con bordes serrados y base cordada, pecíolo largo, pubescente (VARGAS, 2002).
Las flores del balso blanco se disponen en inflorescencias tipo panículas de cimas de 18 a 20 flores; flor hermafrodita con corola tetrámera con sépalos y pétalos, lineares a estipulados; estambres de 16 a 20, ovario ovoide ubicado sobre un androginóforo; fruto ovoide, de tipo aquenio múltiple (esquizocarpo), indehiscente, glabrescente. La flor es de color amarillo claro, con simetría actinomorfa. El cáliz es gamosépalo, tetrámero de color verde claro. El pistilo tiene longitud de 1 mm, de color verde blanquecino y ovario de color verde claro. El estilo es bifurcado y brevistilo. El ovario es supero, de forma ovoide ubicado sobre un androginóforo corto. Cuando la flor ha sido fecundada se torna de un color café oscuro. La flor presenta entre 15 a 18 anteras biloculares de color amarillo que se encuentran unidas al filamento (PÉREZ, 2009; RAMÍREZ et al., 2011).
Desde el estado cero en adelante, hasta los 27 días, los sépalos, los pétalos, las anteras y el estilo presentan un desarrollo progresivo hasta la polinización y formación del fruto tal como lo reporta WOLPERT et al. (2010), posterior a ese periodo las partes de la flor empiezan a marchitarse hasta que finalmente se desprenden. Este proceso ocurre después de presentarse los procesos de polinización, fecundación y estados iniciales de formación del fruto. En algunos municipios del departamento del Cauca la formación de los brotes florales se presenta entre los meses de marzo y abril (SILVA & RESTREPO, 2012), mientras que la floración ocurre entre los meses de mayo y julio. LÁREZ et al. (2005) indican que con base en las variaciones observadas y la duración de la floración de H. americanus L., esta especie se cataloga como una especie semiestacional debido a que florece de tres a cinco meses, durante el periodo más seco, época en la cual produce grandes cantidades de flores y frutos durante cortos periodos de tiempo (RIAÑO, 2005).
WILLIAMS & MEAVE (2002) afirman que existe una variación del comportamiento fenológico entre y dentro de diferentes sitios y especies, por lo que es importante considerar cada planta en una unidad eco-morfofisiológica independiente y expuesta a todos los factores ambientales.
La formación del fruto en el balso blanco comienza desde los 39 hasta los 111 días, momento en el cual el fruto alcanza la madurez fisiológica. La maduración de los frutos se da entre los meses de agosto y septiembre, y no ocurre uniformemente dentro del mismo árbol, observándose en un mismo racimo diferentes grados de madurez (RODRÍGUEZ et al., 2009).
Los trabajos orientados a establecer la biología floral y las características morfológicas del fruto y la semilla de esta especie son muy escasos. Estos estudios son la base inicial para poder conocer la especie y poder utilizarla en programas de mejoramiento genético, propagación y conservación de recursos genéticos. El desarrollo actual de la investigación en silvicultura apunta hacia el mejoramiento genético con el fin de lograr mayor rendimiento, mejorar la calidad de la madera, obtener resistencia a plagas, enfermedades y adaptabilidad al ambiente (VÁSQUEZ, 2001). El mejoramiento genético, el manejo y la mitigación de los efectos de la fragmentación forestal, sobre la diversidad y la variabilidad genética, requieren de un profundo conocimiento de la biología reproductiva de la especie (DIEZ, 2002).
Con base en lo anterior, los objetivos de esta investigación se orientaron hacia el estudio de algunos aspectos de la biología floral y describir las características morfológicas del fruto y la semilla de H. americanus L.
MATERIALES Y MÉTODOS
Localización
El presente trabajo se realizó en dos fases. La primera se llevó a cabo en el municipio de Chachagüí, departamento de Nariño, ubicado a 1950 msnm, 1º21'22.9"LN, 77º16'40.8"LO, con temperatura máxima de 28 °C y mínima de 10 °C y humedad relativa del 76 % (GELT, 2010). La segunda fase se realizó en el laboratorio de Cultivo de Tejidos Vegetales de la Universidad de Nariño, el cual se encuentra a una altitud de 2488 msnm, con temperatura de 19 °C, sede Torobajo, municipio de Pasto, Nariño, Colombia.
Biología floral
El material vegetal utilizado en esta investigación correspondió a flores y frutos de cinco árboles tomados al azar de un relicto de bosque ubicado en la cabecera municipal de Chachagüí. Las flores y frutos se tomaron de la periferia de cada uno de los arboles escogidos.
Siguiendo la metodología de HERRERA et al. (2010) se evaluó el crecimiento de los verticilos de la flor de balso blanco. Se marcaron 1000 botones florales menores a 2 mm de longitud (estado inicial o cero). Cada tres días, y a partir del estado cero, se hicieron mediciones en mm de 10 botones florales de la longitud y diámetro de cáliz (LS y DS), longitud y ancho de corola (LGP y AP), longitud y diámetro del ovario (LO y DO), longitud y ancho de la antera (LA y AA), longitud del filamento (LF), longitud del estilo (LES) y longitud del pedicelo (LP). Con base en lo anterior, los periodos de medición correspondieron a: 3, 6, 9, 12, 15, 18, 21, 24, 27, 30 y 33 días después del estado cero.
En cada una de las mediciones se fijaron 10 botones florales o flores en solución Farmer (3 etanol: 1 ácido acético glacial) por 24 horas a temperatura ambiente (TA). Posteriormente, se cambió en Farmer fresco y se almacenó a 4 ºC hasta su utilización (DAVID et al., 2010).
Viabilidad polínica
La viabilidad del polen se evaluó en los 11 periodos antemencionados. Se tomaron 10 anteras de 10 flores de cada uno de los cinco árboles ya mencionados. Cada antera se colocó en una placa. Se agregaron dos gotas de Acetocarmin al 1 % y con la ayuda de agujas de disección se liberaron los granos de polen. Luego, se desecharon los residuos de la antera y se procedió a observar en 10 campos con el objetivo 40X, de un microscopio Nikon Eclipse E200. Se determinó el porcentaje de granos de polen viables, que son aquellos que se tiñen de color rojo (HERRERA et al., 2010).
Receptividad del pistilo
Se aplicaron dos gotas de peróxido de hidrogeno al 3 % sobre el estigma del pistilo en 10 primordios florales tomados al azar de cada uno de los cinco árboles muestreados. Cuando el peróxido forma burbujas sobre el estigma, se considera que el pistilo se encuentra receptivo (DAVID et al., 2010).
Crecimiento del fruto
El crecimiento y la descripción morfológica del fruto se realizaron cada seis días a partir de su formación (33 días después del estado cero), en 10 frutos por cada árbol estudiado. Se hicieron 20 mediciones en mm de eje polar y ecuatorial del fruto (EPF y DEF) y peso del fruto (PF) a los 39, 45, 51, 57, 63, 69, 75, 81, 87, 93, 99, 105 y 111 días después del estado cero cuando el fruto tomo un color marrón, el cual es indicativo de madurez.
Análisis de la información
Las variables del crecimiento de la flor y del fruto se analizaron teniendo en cuenta los estadígrafos de dispersión y de tendencia central. Igualmente, se realizó un análisis de correlación simple de Pearson y se evaluaron los modelos de crecimiento lineal y cuadrático.
Características morfofisiológicas de la semilla
Siguiendo las normas ISTA (1996) se evaluaron la pureza, la humedad, el peso de 100 semillas, la curva de imbibición, el vaneamiento, la viabilidad de la semilla y la germinación.
Pureza (P): se dividió la muestra de trabajo (2500 semillas) entre semilla pura, otra semilla y materia inerte; posteriormente, se determinó el peso de las semillas (gramos). El porcentaje de la pureza se calculó mediante la siguiente fórmula:
Donde: PSP = peso de semilla pura, PM = peso de muestra.
Humedad de semilla (H): esta prueba se realizó en dos réplicas de un gramo (PH). Las muestras se secaron en un horno a una temperatura de 103 °C durante 17 horas, para luego determinar el peso seco (PS). La humedad se expresó en porcentaje, según la siguiente ecuación:
Donde: H = contenido de humedad (%), PH = peso húmedo, PS = peso seco.
Peso de 1000 semillas (P1000): se realizó el pesaje de ocho muestras de 1000 semillas cada una, con un porcentaje de humedad del 14 %.
Curva de imbibición (CI): con el fin de determinar el tiempo apropiado de imbibición de la semilla en agua se realizó una curva de imbibición. Para ello se tomaron tres muestras de 100 semillas, en las cuales se determinó el peso inicial. Posteriormente, cada muestra se colocó en un recipiente con agua destilada. Estas se sometieron a diferentes periodos de imbibición (2, 4, 6, 8, 10, 12 y 16 horas). La absorción de agua se calculó mediante la fórmula:
Donde: PF = peso final, PI = peso inicial.
Vaneamiento (V): se tomaron cinco repeticiones de 300 semillas, las cuales se sumergieron en un beaker con agua durante una hora. Posteriormente, se realizó el conteo de semillas flotantes, las que se consideraron como vanas. Esta variable se determinó en porcentaje, de acuerdo con la ecuación:
Donde: V = vaneamiento (%), NSF = número de semillas flotantes, NST = número se semillas totales.
Germinación: el porcentaje de germinación se evaluó en cuatro muestras de 100 semillas colocadas en cajas Petri, con papel absorbente. Se tomaron lecturas diarias de germinación, considerando germinación como la emergencia de radícula, hasta los 21 días de evolución.
Viabilidad de la semilla: el porcentaje de viabilidad de las semillas de balso blanco se determinó, utilizando la técnica topográfica con Tetrazolio (2, 3, 5-cloruro de trifenil tetrazolio), en cuatro réplicas de 100 semillas. Las semillas se colocaron en imbibición en agua durante 24 horas, luego se extrajeron los embriones. Una vez embebidos en agua se introdujeron en una solución de Tetrazolio al 1 %. Se mantuvieron en un lugar oscuro durante dos horas, tiempo en el cual se examinaron los embriones, teniendo en cuenta las categorías descritas en la Tabla 1.

RESULTADOS Y DISCUSIÓN
Biología floral
Las flores de H. americanus se disponen en inflorescencias (Figura 1A) tipo panículas tal como lo menciona RAMÍREZ et al. (2011). La corola es tetrámera de color amarillo claro, con simetría actinomorfa. Los pétalos se ensanchan hacia el extremo en una terminación redondeada. El cáliz es gamosépalo, tetrámero de color verde claro, el cual permanece adherido a la flor después de la fecundación (Figura 1B), observaciones que concuerdan con el trabajo de PÉREZ (2009). El pistilo maduro tiene longitud de 1 mm, de color verde blanquecino y ovario de color verde claro (Figura 1C). El estilo es bifurcado y brevistilo, es decir, que está por debajo de los estambres. El ovario es supero, de forma ovoide ubicado sobre un androginóforo corto, tal como lo reporta LAY (1949) (Figura 1D). Cuando la flor ha sido fecundada se torna de un color café oscuro. La flor presenta entre 15 a 18 anteras biloculares de color amarillo que se encuentran unidas al filamento (Figura 1E y 1F).

Crecimiento de verticilos florales
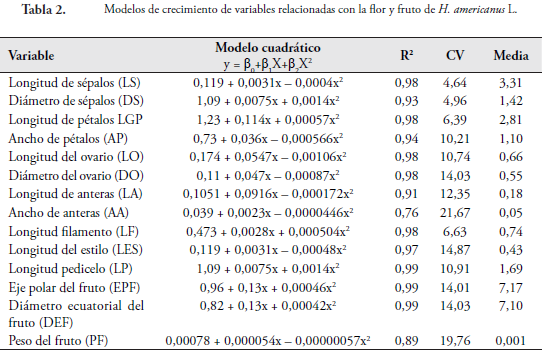
En la Tabla 2 se muestran los modelos de crecimiento de la flor y el fruto de H. americanus para longitud y diámetro de cáliz (LS y DS), longitud y ancho de corola (LGP y AP), longitud y diámetro del ovario (LO y DO), longitud y ancho de la antera (LA y AA), longitud del filamento (LF), Longitud del estilo (LES) y longitud del pedicelo (LP), eje polar (EP), diámetro ecuatorial (DE) y peso del fruto (PF).
Se encontró que el modelo cuadrático de la forma y = B0+B1X+B2X2 es el que mejor explica el crecimiento de cada uno de los verticilos de la flor y el fruto, con coeficientes de determinación (R2) que varían entre el 0,76 a 0,99 % (Tabla 2). El LS, el DS, la LGP y el AP alcanzaron el máximo crecimiento a los 30 días con valores de 0 a 4,24 mm. A partir de este momento se presenta un crecimiento decreciente hasta los 33 días de evaluación, disminuyendo entre 0,06 a 0,12 mm/día. Las variables DO, LO, LA, LF y LES alcanzaron su máximo crecimiento (0,1 a 0,86 mm) a los 27 días. Posteriormente, se observa una disminución en la velocidad de crecimiento hasta los 33 días, momento en el cual el ovario da lugar al fruto. El AA crece lentamente y desde el estado inicial (0,04 mm) no hay un incremento significativo, manteniendo su tamaño constante hasta alcanzar un tamaño de 0,07 mm a los 33 días.
La longitud del pedicelo (LP) crece durante todo el ciclo de evaluación. Desde el estado inicial (1,42 mm) hasta el final alcanzan 4,23 mm de largo, con una velocidad de crecimiento que varía entre 0,06 a 0,14 mm/día.
Todas las variables evaluadas alcanzaron su mayor velocidad de crecimiento a los 27 días, con promedios que oscilan entre 0,01 a 0,1 mm/día. A partir de este periodo, la LA, LF y LES disminuyen su velocidad de crecimiento debido a su senescencia, que conlleva a la separación de los mismos. Mientras que el DO y LO, detienen su crecimiento para luego dar paso a la formación del fruto. Después de los 30 días hasta el final de la evaluación se presenta una disminución de la velocidad de crecimiento de las variables LS, LGP, DS, AP, ya que se da la formación del fruto, mientras que el LP va aumentando su velocidad de crecimiento hasta los 33 días donde alcanza la máxima velocidad (0,05 mm/día) (Figura 2). Desde el estado cero, en adelante, algunas variables crecen constantemente hasta los 27 días momento en el cual los sépalos, los pétalos, las anteras y el estilo empiezan a marchitarse hasta que, finalmente, se desprenden cuando se han presentado los procesos de polinización, fecundación y formación del fruto.
Al respecto, TORREY (1969) indica que desde el momento de la iniciación floral existe un desarrollo progresivo de las partes que componen la flor hasta la polinización y formación del fruto. De igual manera, ROJAS & ROVALO (1985) mencionan que el crecimiento en diámetro y largo se presenta en algunos modelos de crecimiento de plantas donde se pueden distinguir tres etapas: crecimiento lento en los primeros estados de formación, rápido crecimiento con mayor elongación y en las últimas etapas un crecimiento lento.
La formación de los botones florales se presentó entre marzo y abril, y la floración entre mayo y junio. De acuerdo con RAMÍREZ (1997) y RIAÑO (2005), las variaciones observadas en la duración de la floración de H. americanus permiten catalogarla como una especie semiestacional debido a que florece de tres a cinco meses, durante el periodo más seco, época en la cual produce grandes cantidades de flores y frutos durante cortos periodos de tiempo.
La maduración de los frutos se da entre los meses de agosto y septiembre, y no ocurre uniformemente dentro del mismo árbol, observándose en un mismo racimo diferentes grados de madurez. Los frutos permanecieron en el árbol de 90 a 105 días.
Se determinó que el ciclo reproductivo de H. americanus dura, aproximadamente, 135 días. A partir del estado cero, la apertura floral se da entre los 12 a 15 días y la formación del fruto comienza desde los 39 hasta los 111 días, momento en el cual el fruto alcanza la madurez y se suelta de la planta. WILLIAMS & MEAVE (2002) afirman que existe una variación del comportamiento fenológico entre y dentro de diferentes sitios y especies, por lo que es importante considerar cada planta en una unidad eco-morfofisiológica independiente y expuesta a todos los factores ambientales.
Las características florales han sido comúnmente asociadas con el tipo de polinización. De acuerdo con WEBERLING (1989) todas las adaptaciones florales, los métodos de polinización particular desarrolladas por insectos polinizadores, así como también el establecimiento de métodos especiales de dispersión de frutos y semillas no están confinadas usualmente a caracteres individuales, sino que conciernen a la totalidad de los órganos florales.
En este sentido, se observó que H. americanus presenta una serie de atributos florales que favorecen la polinización por insectos entre los cuales se destacan el tamaño reducido de las flores, el color amarillo atractivo para los insectos, el aroma y la presencia de abundante polen como recompensa floral tal como lo encontró CORONADO (2010) en su investigación sobre biología reproductiva de Herissantia crispa (L.) Briz y Bastardia viscosa (L.) H.B.K. (Malvaceae).
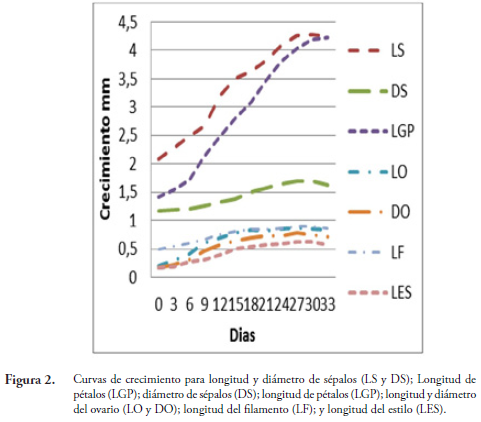
De acuerdo con el análisis de correlación (Tabla 3) la LS está asociada con DS (r =0,93*), LGP (r =0,97*), LO (r =0,91*), DO (r =0,93*), LF (r =0,94*) y LES (r =0,92*). En la misma forma que aumenta la LS, también aumenta de tamaño el DS, LGP, LO, DO, LF y LES. El crecimiento de las variables LO, DO, LF y LES es muy similar alcanzando su máximo crecimiento a los 30 días, momento en el cual las estructuras de reproducción se preparan para la fecundación y así formar el nuevo fruto. Asimismo, la LS, el DS y la LGP incrementan su tamaño hasta los 30 días, cayendo cuando han cumplido su función de protección hacia las demás partes de la flor después de la floración (Figura 2).
El DS se incrementa proporcionalmente con la LGP (r =0,95*) alcanzando su máximo crecimiento a los 30 días, el cual amplía su tamaño para dar lugar al desarrollo de estructuras del gineceo. La LGP está correlacionado con el DO (r =0,90*), LF (r =0,89*) y LES (r =0,90*). Esto indica que los pétalos, al incrementar su tamaño, generan espacio para permitir el correcto desarrollo de las estructuras comprometidas con la reproducción (Figura 2, Tabla 3).
El LF está correlacionado con la LES (r =0,90*), alcanzando su máximo crecimiento a los 27 días. El DO esta correlacionado con el LF (r =0,89*). La LO está correlacionada con el DO (r =0,97*) y LF (r =0,90*), es decir, que tienen la misma forma de comportamiento y variación en cuanto al crecimiento (Figura 2). En ninguna de las variables relacionadas con la flor de la especie se observaron correlaciones negativas dado que todas las estructuras florales aumentan de tamaño en igual proporción.
Viabilidad polínica (VP)
Los granos de polen comienzan a ser viables a los nueve días de evaluación cuando muestran un 54,34 % de VP. Los estados con mayor VP (100 %) ocurren a los 24 días de evaluación. Similares resultados menciona ALCORCÉS (2009) en Hibiscus sabdariffa, encontrando que la viabilidad del polen fue mayor al 93 %. Esto indica que no existen barreras fisiológicas o genéticas que limiten la organogénesis de los gametos masculinos bajo las condiciones donde se realizó el estudio.
Receptividad del pistilo
El 80 % de las flores evaluadas fueron receptivas desde los 15 días. A los 27 días, ya se encuentran receptivos el 100 % de los pistilos, verificándose un mecanismo de protandria donde la maduración del polen ocurre antes que el pistilo esté receptivo (BERTIN & NEWMAN, 1993), que en H. americanus se observa al final de la etapa de la antesis. La protandria evita la autofecundación por el hecho de que los tubos polínicos del polen crecen relativamente más rápido y hacen obligatoria la polinización cruzada o alogamia. Igualmente, en estudios realizados sobre la biología reproductiva de la familia Malvaceae con el género Hibiscus se han encontrado especies totalmente autoincompatibles, con una baja producción de polen y granos de tamaño reducido (KLIPS & SNOW, 1997).
Morfología del fruto de H. americanus
El fruto es un aquenio múltiple (esquizocarpo), indehiscente, de forma ovoide con abundantes cerdas plumosas que miden entre 0,89-16,16 mm de largo cubiertas de pelos hirsutos, son de color café y se asemejan a un Sol, de ahí que su nombre genérico se forma de la palabra griega Helio, que significa Sol (Figura 3A). Los frutos maduros son diseminados por el viento. Similares observaciones encontraron MAHECHA et al. (2004). Es de color rojizo en estados iníciales y conforme madura es de color café (Figura 3B), contiene de dos a tres semillas, dichas observaciones coinciden con ESPINAL (1982).
Los incrementos y la velocidad de crecimiento de las variables evaluadas en frutos, indican un crecimiento gradual desde el estado inicial de formación del fruto (6 días) hasta su maduración (84 días). El DEF y el EPF alcanzan su máximo crecimiento a los 84 días de evaluación con valores de 14,7 y 15,13 mm, respectivamente, época en la cual están totalmente maduros (Figura 4). El peso del fruto (PF) alcanza las variaciones más significativas a partir de los 36 hasta los 66 días, con un peso máximo de 0,0023 g, disminuyendo hasta el final de la evaluación (84 días) donde presenta un peso de 0,0013 g.

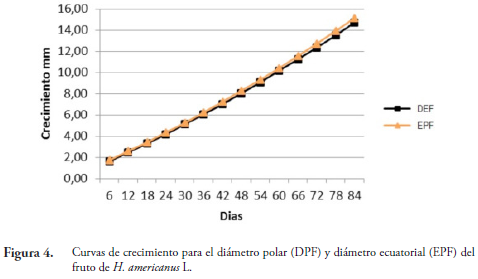
El crecimiento y desarrollo del fruto comienza a los 6 días. Durante el desarrollo, las capsulas son esféricas a oviforme. DIEZ (2002) menciona que los frutos se desarrollan en dos o tres meses en promedio, lo cual coincide con los resultados encontrados en esta investigación, donde la duración desde el estado inicial hasta la maduración de los frutos es de 90 a 105 días.
Morfología de la semilla de H. americanus L.
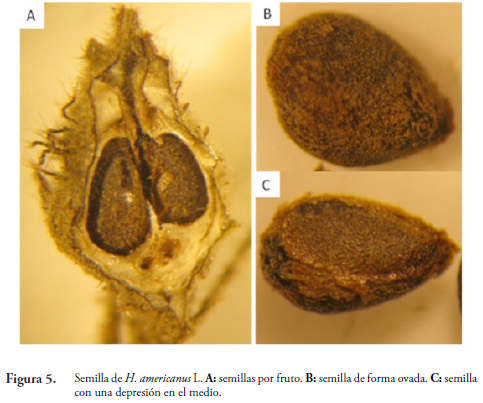
El fruto presenta de una a tres semillas (Figura 5A), de forma ovada (Figura 5B), con una depresión en el medio, color marrón, de consistencia dura y textura pilosa (Figura 5C) tal como la describe HERNÁNDEZ (1989) en su estudio sobre tamaño de la semilla y efecto de la temperatura en la germinación de Heliocarpus popayanensis H.B.K.
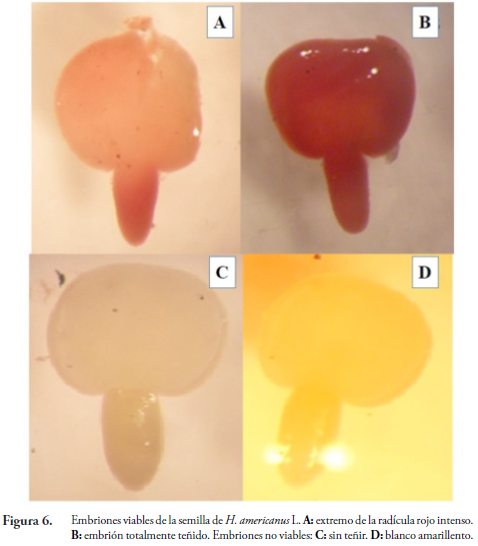
El contenido de humedad fue de 13,64 %. De igual forma, HERNÁNDEZ (1989) observó que la humedad de H. popayanensis H.B.K. se encuentra en el rango de 5 a 20 %, lo cual coincide con lo reportado por LANG (1965). El peso de 1000 semillas fue de 0,92 g y la pureza del 88 %. De acuerdo con la categorización de la tinción con Tetrazolio se encontró que la viabilidad de la semilla fue del 56,5 % (Figura 6), lo que indica que hubo la existencia de semillas con tejidos muertos o deterioro de la misma tal como lo menciona PÉREZ & PITA (2001). De la misma forma, las condiciones ambientales como cambios de temperatura y humedad hacen que la viabilidad de la semilla se vea afectada durante el almacenamiento. En general, la viabilidad de la semilla se reduce cuando la temperatura y el contenido de humedad se incrementen (CORDERO & OLIVEROS, 1983).
Asimismo, se encontró que el porcentaje de vaneamiento de la semilla fue del 57,39 %´como una consecuencia de una baja fertilidad que dependería de factores genéticos, así como también de predación y aborto de las semillas (GARCÍA et al., 2001). El porcentaje de germinación fue del 64 % a los 21 días a una temperatura de laboratorio de 19 °C, considerado bajo, debido a mecanismos de latencia. Similares resultados encontraron VÁSQUEZ & OROZCO (1996) en semilla de H. appendiculatus Turcz. Según estos autores, esta especie posee una semilla termoblástica dado que la temperatura es el factor más influyente en su germinación, siendo mejor en ambientes con temperaturas altas (26 a 36 °C).
De igual manera, en un estudio realizado con la especie H. donnell-smithii por VÁSQUEZ & OROZCO (1982), se encontró que la germinación requiere de un cambio fuerte de temperatura, preferiblemente, con temperaturas por encima de 31 °C; asimismo, HERNÁNDEZ (1989) encontró que la germinación de H. popayanensis H.B.K. necesita de una temperatura mínima entre 15 a 18 °C y máxima entre 38 a 40 °C, con una germinación bastante homogénea entre 18 y 34 °C.
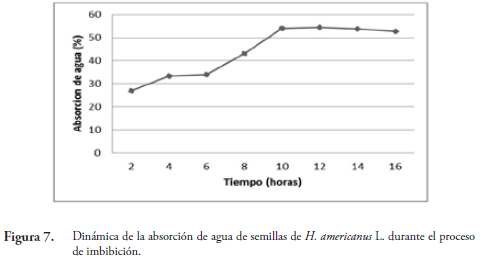
La imbibición es el proceso de absorción de agua por la semilla. Este se da por las diferencias de potencial hídrico (mátrico) entre la semilla y la solución de imbibición (SUÁREZ & MELGAREJO, 2010). Como se observa en la Figura 7, este proceso se presentó en tres fases. La fase I (2 a 6 horas) se caracterizó por un incremento rápido de la absorción de agua que corresponde a la imbibición. La fase II (6 a 9 horas) está asociada a una absorción lenta de agua tal como lo plantean BEWLEY & BLACK (1982) y corresponde a una etapa de activación del metabolismo y movilización de nutrientes. En la fase III (10 a 12 horas) la semilla ya ha absorbido la mayor cantidad de agua (54,6 % de absorción). A partir de las 12 hasta las 16 horas, se observa una disminución lenta de la capacidad de absorción de agua, mostrando rompimiento longitudinal de la cara cóncava de la cubierta de la semilla debido a la turgencia. Esta fase coincide con el inicio del proceso de germinación. El periodo de imbibición de la semilla depende del contenido inicial de humedad, en este caso el lote tuvo 14 % (base peso seco) y se determinó un tiempo de imbibición de 12 horas (Figura 7).
CONCLUSIONES
El crecimiento de las estructuras florales y del fruto de Heliocarpus americanus L., se ajustó al modelo cuadrático de la forma y = B0+B1X+B2X2. El ciclo reproductivo es de 135 días. La apertura floral se da entre los 12 a 15 días y la formación del fruto comienza desde los 6 días hasta los 90 días.
Los granos de polen comienzan a ser viables desde los 9 días y están completamente maduros a los 27 días después del estado cero (2 mm). La especie es protandra. El pistilo comienza a ser receptivo desde los 15 días hasta los 27 días, tiempo en el cual se encuentran totalmente receptivos.
Se presentó un alto porcentaje de vaneamiento y bajos porcentajes de germinación y viabilidad de la semilla de H. americanus L., siendo limitantes para tener en cuenta en el manejo y el almacenamiento por periodos muy largos de tiempo.
AGRADECIMIENTOS
A la Facultad de Ciencias Agrícolas de la Universidad de Nariño y en especial al Grupo de Investigación en Producción de Frutales Andinos (GPFA), por dar el aval para llevar a cabo esta investigación. Al fondo Caldas de COLCIENCIAS por la financiación de este trabajo. A Tito Bacca Ibarra por la corrección preliminar de este manuscrito.
BIBLIOGRAFÍA
ALCORCÉS, N., 2009.- Estudios citogenéticos de Hibiscus sabdariffa L. (Malvaceae). Revista Científica UDO Agrícola, 9 (3): 595-598. [ Links ]
BERTIN, R. & NEWMAN, C., 1993.- Dichogamy in the angiosperms. Botanical Review, 59: 112-152. [ Links ]
BEWLEY, J. & BLACK, M., 1982.- Physiology and biochemistry of seeds in relation to germination, Viability, dormancy and environmental control. Springer-Verlag, Berlin. [ Links ]
CORDERO, M. & OLIVEROS, M., 1983.- Efecto de varias condiciones de almacenamiento sobre la germinación de semillas de Androogon gayanus. Agronomía Tropical, 33 (6): 177-189. [ Links ]
CORONADO, R., 2010.- Biología reproductiva de Herissantia crispa (L.) BRIZ y Bastardia viscosa (L.) H.B.K. (Malvaceae): Tesis, Universidad de Oriente, Escuela de Ciencias, Cumaná, Venezuela. [ Links ]
DAVID, S., OSORIO, K. & LAGOS, T.C., 2010.- Evaluación del crecimiento, la morfología floral y el fruto de chilacuán (Vasconcellea cundinamarcensis B.). Revista de Ciencias Agrícolas, 28 (1): 9-23. [ Links ]
DIEZ, C., 2002.- Notas de ecología forestal: biología reproductiva de las plantas de los bosques tropicales. Universidad Nacional de Colombia, Sede Medellín. [ Links ]
ESPINAL, L., 1982.- Apuntes sobre flora de la región central del Cauca. Centro de publicaciones, Universidad del Valle, Cali. [ Links ]
GARCÍA, P., GULIAS, J., MARTÍNEZ, J., MARZO, A., MELERO, J., TRAVESET, A., VEINTIMILLA, P., VERDÚ, M., CERDÁN, V., GASQUE, M. & MEDRANO, H., 2001.- Bases ecológicas para la recolección, almacenamiento y germinación de semillas de especies de uso forestal de la Comunidad Valenciana. Edit. Banc de Llavors Forestals, Valencia, España. [ Links ]
GELT. GOBIERNO EN LÍNEA DEL ORDEN TERRITORIAL., 2010.- Municipio de Chachagüí (N). Recuperado de http://www.chachagui-narino.gov.co/nuestromunicipio.shtml?apc=mIxx-1-&m=f. [ Links ]
HERNÁNDEZ, R., 1989.- Tamaño de la semilla y efecto de la temperatura en la germinación de Heliocarpus popayanensis H.B.K. Revista Forestal Venezolana, 23 (33): 21-42. [ Links ]
HERRERA, D., DELGADO, J. & LAGOS, T.C., 2010.- Algunos aspectos de la biología floral, horarios y métodos de polinización artificial en Tomate de árbol (Cyphomandra betacea (Cav.) Send.): Tesis, Universidad de Nariño, Facultad de Ciencias Agrícolas, Pasto, Colombia. [ Links ]
ISTA. INTERNATIONAL SEED TESTING ASSOCIATION, 1996.- International rules for seed testing. Seed Science & Technology. [ Links ]
KLIPS, R. & SNOW, A., 1997.- Delayed autonomous self-pollination in Hibiscus laevis (Malvaceae). American Journal of Botany, 84: 48-53. [ Links ]
LAGOS, T.C., ORDOÑEZ, H., CASTILLO, A., NAVIA, J., LAGOS, L., BENAVIDES, C., ANDRADE, D., DUARTE, D. & LÓPEZ, D., 2013.- Distribución geográfica actual y potencial de Balso blanco (Heliocarpus americanus L.) en el departamento de Nariño. Revista de Ciencias Agrícolas, 30 (2): 45-59. [ Links ]
LANG, A., 1965.- Effects of some internal and external conditions on seed germination: 848-187 (en) RUHLAND, W. (ed). Encyclopedia of plant physiology, 15 (2). Springer Verlag, New York. [ Links ]
LAREZ, A., MAYZ, J. & ALCORCÉS, N., 2005.- Fenología reproductiva de árboles y otros biotipos en el municipio de Caripe del Estado de Monagas. Revista Ernstia, 15 (1-4): 107-128. [ Links ]
LAY, K.K., 1949.- A revision of the genus Heliocarpus L. Annals of the Missouri Botanical Garden, 36: 507-541. [ Links ]
MAHECHA, G., OVALLE, A., CAMELO, D., ROZO, A. & BARRERO, D., 2004.- Vegetación del territorio CAR. 450 especies de sus llanuras y montañas. Bogotá. Colombia. [ Links ]
PÉREZ, E., 2009.- Flora del bajío y regiones adyacentes: Tiliaceae. Instituto de Ecología, A.C. Centro regional del Bajío, Pátzcuaro, Michoacán. [ Links ]
PÉREZ, F. & PITA, J., 2001.- Viabilidad, vigor, longevidad y conservación de semillas. Departamento de Biología Vegetal, Universidad Politécnica de Madrid, España. [ Links ]
RAMÍREZ, N., 1997.- Biología reproductiva y selección de especies nativas para la recuperación de aéreas degradadas: métodos y significados. Acta botánica, 20 (1): 43-63. [ Links ]
RAMÍREZ, L., SUÁREZ, J. & RAMÍREZ, J., 2011.- Evaluación de las propiedades oculantes de Malvaviscus arboreus, Heliocarpus popayanensis e Hylocereus undatus para clarificación de aguas. Servicio Nacional de Aprendizaje SENA, Caldas, Antioquia. [ Links ]
RIAÑO, K., 2005.- Aspectos ecológicos de diez especies pioneras arbóreas en corredores de conexión Barbas-Bremen. Universidad del Quindío, Facultad de Educación, Armenia. [ Links ]
ROBYNS, A., 1964.- Flora of Panama: Part IV, family 114. Tiliaceae. Annals of the Missouri Botanical Garden, 51: 3-35. [ Links ]
RODRÍGUEZ, J., SINACA, P. & JAMANGAPÉ, G., 2009.- Frutos y semillas de árboles tropicales de México. Instituto Nacional de Ecología, Secretaría de Medio Ambiente y Recursos Naturales, México. [ Links ]
ROJAS, M. & ROVALO, M., 1985.- Fisiología Vegetal aplicada. McGraw-Hill, México. [ Links ]
SILVA, L. & RESTREPO, S., 2012.- Compendio de calendarios apícolas de Cauca, Huila y Bolívar. Instituto Humboldt, Bogotá [ Links ].
SUÁREZ, D. & MELGAREJO, L.M., 2010.- Biología y germinación de semillas: 13-24 (en) MELGAREJO, L.M. (ed) Experimentos en Fisiología Vegetal. Universidad Nacional, Colombia. [ Links ]
TORREY, J., 1969.- Development in flowering plants. Fourth printing, Macmillan. [ Links ]
VARGAS, W., 2002.- Guía ilustrada de las plantas de las montañas del Quindío y los Andes Centrales. Universidad de Caldas, Manizales, Colombia. [ Links ]
VÁSQUEZ, A., 2001.- Silvicultura de Plantaciones Forestales en Colombia. Universidad del Tolima, Colombia. [ Links ]
VÁSQUEZ, C. & OROZCO, A., 1982.- Seed germination of a tropical rain forest pioneer tree (Heliocarpus donnell-smithii) in response to diurnal fluctuation of temperature. Physiol. Plant., 56: 295-298. [ Links ]
VÁSQUEZ, C. & OROZCO, A., 1996.- Physiological ecology of seed dormancy and longevity: 535-558 (en) MULKEY, S., CHAZDON, R. & SMITH, A.P. (eds.) Tropical Forest Plant Ecophysiology. New York. [ Links ]
VÁSQUEZ, C., URIBE, A. & ÁLVAREZ, J., 2006.- Propagación por estacas juveniles de Balso Blanco (Heliocarpus americanus L. Sin. H. popayanensis) utilizando propagadores de sub-irrigación. Rev. Fac. Nal. Agr., 59 (2): 3479-3498. [ Links ]
WEBERLING, F., 1989.- Morpholgy of flowers and inflorescences. Cambridge University Press, New York. [ Links ]
WILLIAMS, G. & MEAVE, J., 2002.- Patrones fenológicos: 407-431 (en) GUARIGUATA, M. & KATTAN, G. (eds.). Ecología y conservación de bosques neotropicales. Ediciones LUR, Costa Rica. [ Links ]
WOLPERT, L., JESSEL, T., LAWRENCE, E., MEYEROWITS, E., ROBERTSON, E. & SMITH, J., 2010.- Principles of development. Third edition. University of Oxford. [ Links ]













