Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.19 no.2 Manizales July/Dec. 2015
https://doi.org/10.17151/bccm.2015.19.2.3
DOI: 10.17151/bccm.2015.19.2.3
BIOLOGÍA REPRODUCTIVA Y POLINIZACIÓN ARTIFICIAL DEL TOMATE DE ÁRBOL (Cyphomandra betacea (Cav.) Sendt)*
REPRODUCTIVE BIOLOGY AND ARTIFICIAL POLLINATION OF THE TAMARILLO (Cyphomandra betacea (Cav.) Sendt)
Tulio César Lagos B.1, Tito Bacca2, Diana Milena Herrera P.3 Jenny Laura Delgado T.4
* FR: 23-V-2014 . FA: 23-VII-2015.
1 Ingeniero Agrónomo, Doctor en Ciencias Agrarias con énfasis en Fitomejoramiento, Facultad de Ciencias Agrícolas, Universidad de Nariño. Pasto, Colombia. Autor para correspondencia. E-mail: tclagosb@udenar.edu.co.
2 Ingeniero Agrónomo, Profesor Titular, Facultad de Ingeniería Agronómica, Universidad del Tolima, Ibague, Colombia,. E-mail: titobacca@gmail.com.
3 Ingeniero Agrónomo, Facultad de Ciencias Agrícolas, Universidad de Nariño. Pasto, Colombia. E-mail: dianahe1217@hotmail.com.
4 Ingeniero Agrónomo, Facultad de Ciencias Agrícolas, Universidad de Nariño. Pasto, Colombia. E-mail: lacors24@hotmail.com.
CÓMO CITAR:
LAGOS B., T.C., BACCA, T., HERRERA P., D.M. & DELGADO T., J.L., 2015.- Biología reproductiva y polinización artificial del tomate de árbol (Cyphomandra betacea (Cav.) Sendt). Bol. Cient. Mus. Hist. Nat. U. de Caldas, 19 (1): 60-73. DOI: 10.17151/bccm.2015.19.2.3
El propósito de este trabajo fue estudiar la biología reproductiva, horarios y métodos de polinización artificial en tomate de árbol Cyphomandra betacea, cultivar Manzano en una localidad del departamento de Nariño (Colombia), ubicado a 2100 msnm, con temperatura de 13°C. Se marcaron 1000 botones florales de 0,5 cm de largo. Cada ocho y hasta 40 días, cuando se dio la fecundación, se hicieron mediciones en mm de la longitud del botón floral, largo y diámetro de la corola, diámetro ecuatorial del cáliz, largo y diámetro del ovario, largo del filamento, largo del estilo, largo y ancho de anteras, viabilidad del polen y receptividad del pistilo. El crecimiento de los verticilos se ajustó al modelo y = Bd. El polen inicia su maduración a los 24 días, con un 61,48% de viabilidad. La receptividad del pistilo se da a los 16 días, 13 días antes de la antesis. Igualmente, se evaluaron horarios de polinización con y sin hormona. Las polinizaciones realizadas entre 8 a.m. y 4 p.m. con y sin hormona, no presentaron diferencias significativas para eficiencia de hibridación (EH), número de semillas por fruto (SPF) y porcentaje de germinación (PG). La EH osciló entre el 36 y el 68%. El número de SPF osciló entre 240 y 361 y el PG presentó un rango de 56 a 66%. Entre las 2 y 4 p.m. y sin hormona, se obtuvo el mayor peso por fruto (121,97 g) y la mayor velocidad de germinación (1,87).
Palabras clave: solanáceas, fecundación, hibridación, receptividad del pistilo, viabilidad polínica.
AbstractThe purpose of this work was to study the reproductive biology, schedules and methods of artificial pollination in tamarillo Cyphomandra betacea, Manzano cultivar growing in a town in the department of Nariño (Colombia), located at 2,100 m.a.s.l. with a temperature of 13°C. One thousand (1,000) flower buds of 0.5 cm in length were marked. Every eight days and during 40 days when fertilization occurred, measurements in mm of the flower bud length and diameter of the corolla, equatorial diameter of the calyx, length and diameter of the ovary, length of the filament, length of the style, length and width of the anther, pollen viability and pistil receptivity, were made. The growth of the whorls was adjusted to the model y = Bd. The pollen starts ripening at 24 days, with 61.48% viability. The responsiveness of the pistil is given at 16 days, 13 days before anthesis. Similarly, pollination times with and without hormone were evaluated. Pollinations carried out from 8 AM to 4 PM, with and without hormone, did not show significant differences for hybridization efficiency (HE), number of seeds per fruit (SPF) and germination percentage (GP). The HE, ranged between 36 and 68%. The number of SPF ranged between 240 and 361 and GP presented a range of 56-66%. Between 2 and 4 PM and without hormone, the largest fruit weight (121.97 g) and higher germination rate (1.87) were obtained.
Key words: Solanaceae, fertilization, hybridization, pistil receptivity, pollen viability.
El tomate de árbol es un frutal de la familia Solanaceae, que tiene un alto potencial para desarrollar alternativas productivas comerciales en la región natural andina de Colombia, con miras a la exportación y a la creación de empresas agropecuarias que exploten las bondades agroindustriales de esta especie. Su centro de origen está ubicado entre el sur de Bolivia y norte de Argentina. Se han encontrado especies silvestres también en Perú, Chile, Ecuador y Colombia (BOHS, 1989). En América Latina es cultivado en Colombia y Ecuador y de manera marginal en Perú, Chile, Bolivia, Argentina, Brasil, Venezuela, Costa Rica, Guatemala, Jamaica, Puerto Rico y Haití. Los principales productores de esta fruta son Nueva Zelanda, Kenia, Sri Lanka, India, Colombia, Zambia y Zimbabwe (GARCÍA, 2008; LAGOS et al., 2011).
En el sur de Colombia este cultivo representa una gran oportunidad para llevar a cabo proyectos productivos; sin embargo, su progreso no ha sido óptimo debido a la limitada atención que ha recibido por parte de los programas de investigación. Pese a su demanda creciente, no ha logrado desarrollarse. Una de las causas, es la escasa oferta de cultivares mejorados para la siembra (TAFUR, 2006).
Desde sus inicios, el cultivo de tomate de árbol se ha llevado a cabo con genotipos seleccionados por los propios productores, los cuales son heterogéneos y de base genética estrecha (LOBO, 2004). En el sur de Colombia no existe un programa de mejoramiento de la especie, el cual es necesario para desarrollar a nivel tecnológico el cultivo y contribuir al incremento de los ingresos de los agricultores, quienes no cuentan con cultivares mejorados, adaptados a sus condiciones ambientales y socioeconómicas.
Entender los sistemas de polinización y mejora, los cuales regulan la estructura genética de las poblaciones, es importante para determinar las limitaciones reproductivas para la conservación y manejo de una especie (KOUL & BHATNAGAR, 2007).
El conocimiento de la estructura floral y de la biología reproductiva de una especie, es básico para el mejorador de plantas, con el fin de desarrollar las técnicas de emasculación e hibridación como estrategia de control de la polinización, las cuales han contribuido al rápido progreso logrado en el mejoramiento genético de plantas (ARAMÉNDIZ et al., 2009).
La biología reproductiva de una especie vegetal tiene implicaciones sobre la supervivencia de la especie, con consecuencias importantes para la viabilidad de las poblaciones. Por lo tanto, el conocimiento de los procesos reproductivos, ofrece importantes aportes para el diseño de programas de conservación de recursos genéticos, especialmente de plantas en peligro de extinción (CARRIÓ et al., 2009).
La producción de semilla híbrida de Solanáceas involucra el mantenimiento de dos líneas parentales separadas (masculina y femenina). La masculina actúa como dador de polen y la femenina como receptor de polen. Las flores del progenitor femenino son emasculadas durante el estadio del botón floral óptimo para la polinización manual, cuyas anteras son removidas por medio de pinzas, que son polinizadas manualmente y, consecuentemente, forman frutos que contienen las semillas híbridas (GEORGE, 1999).
El uso de híbridos F1 de Solanáceas viene ocurriendo desde hace muchos años en la agricultura de esta hortaliza, en razón a sus ventajas de mayor vigor de la planta, más resistencia a plagas y enfermedades, maduración precoz, homeostasis, mejor calidad y rendimiento de fruto (ANTONINI et al., 2002; BLAT et al., 2007) y además mayor uniformidad de fruto. Estudios comparativos entre cultivares híbridos y variedades realizados por SOUSA et al. (1997) y ANTONINI et al. (2002), evaluaron el rendimiento total y calidad de frutos y evidenciaron mayor rendimiento en los híbridos a causa de la heterosis y mayor cantidad de frutos de primera categoría. Aspectos relacionados con los horarios y métodos de polinización artificial son de gran importancia para el establecimiento de las bases genéticas para programas de hibridación, que busquen la recombinación genética de diferentes formas para la producción de variedades o híbridos mejorados. Hasta el momento, las investigaciones realizadas con respecto a métodos y horarios de polinización artificial en tomate de árbol son muy limitadas. Un estudio desarrollado por OSORIO & MADRID (1978) en la Universidad Nacional de Colombia sede Medellín, indica que el conocimiento de la biología floral es fundamental para la obtención de variedades mejoradas. El tipo de polinización artificial y la época indicada para hacer la emasculación definen los métodos de cruzamiento.
Trabajos similares en uchuva (Physalis peruviana L.) fueron realizados por ORDOÑEZ & RUANO (2002) y LAGOS et al. (2008). En esta especie, el 85% de las flores abrieron a los 37 días, entre las 7 y 10 a.m. La primera antera fue dehiscente al día siguiente de la apertura floral. Los granos de polen alcanzaron una viabilidad del 97%, a los 35 días. El polen maduró antes de la antesis y el estigma se muestra receptivo antes de la apertura de la flor. Tanto el polen como el pistilo maduro a los 35 días de desarrollo, dos días antes de la apertura floral. La receptividad del pistilo se presentó dos días antes de la antesis, fenómeno que restringe la autopolinización. Aunque se tienen muchos trabajos de biología floral en otras especies como Psidium guajava (CARABALLO, 2001), Carica papaya (PARES et al., 2004), Passiflora foetida (GARCÍA & HOC, 1998) y la chirimoya (GONZÁLEZ et al., 2007), entre otros, se observa una deficiencia notable en trabajos de biología y genética básica para el fitomejoramiento de los frutales andinos como el tomate de árbol, por lo tanto, es necesario orientar los esfuerzos para la investigación, producción y promoción de este frutal como un cultivo alternativo para la diversificación de la producción de los cultivos andinos.
Acorde con lo anterior, los objetivos de este trabajo se orientaron hacia el estudio de algunos aspectos de la biología floral, establecer horarios y técnicas de polinización artificial en tomate de árbol cultivar Manzano, bajo condiciones de la región andina del departamento de Nariño.
MATERIALES Y MÉTODOSLocalización. El presente trabajo se realizó en dos fases. Una de campo y una de laboratorio. La primera, se llevó a cabo en el municipio de Nariño a una altura de 2100 msnm en las coordenadas 01º17'49,6" LN y 77º20'52,6" LO, con temperatura promedio de 16ºC (GELT, 2009). La segunda fase se cumplió en el laboratorio de cultivo de tejidos vegetales de la Universidad de Nariño, ubicado a una altura de 2488 msnm, sede Torobajo.
Algunos aspectos de la biología floral. Siguiendo la metodología utilizada por PAREDES et al. (2005) se evaluó el crecimiento de los diferentes verticilos de la flor de C. betacea. Se marcaron 500 botones florales de 0,5 cm de longitud (estado cero). Cada ocho días y a partir del estado cero, se tomaron cinco botones florales, en los cuales se realizaron las medidas de los diferentes verticilos y se estableció el crecimiento en 10 fases de evaluación que correspondieron a 0, 8, 16, 24, 30, 32, 34, 36, 38 y 40 días después del estado cero (ddec).
Con base en las medidas de crecimiento, se evaluaron las siguientes variables: la longitud botón floral (LB), el diámetro ecuatorial del cáliz (DEC), el largo de la corola (LC), el diámetro base de la corola (DBC), el diámetro medio de la corola (DMC), el largo de la antera (LA), el ancho de la antera (AA), el largo del filamento (LF), el largo del estilo (LE), el diámetro del ovario (DO) y el largo del ovario (LO). Estas variables, se sometieron al análisis de correlación simple de Pearson y se evaluaron los modelos de crecimiento lineal sin intercepto y cuadrático.
Viabilidad polínica. La viabilidad del polen se evaluó en cada uno de los 10 periodos anteriormente mencionados, tomando anteras, las cuales se maceraron sobre un portaobjetos utilizando tres gotas de Acetocarmín al 1%. Luego se eliminaron los residuos, se cubrió con una laminilla y se observó bajo un microscopio de luz Nikon SMZ800 con el objetivo 40x. En 10 campos tomados al azar, se hizo el conteo de granos de polen viable (teñidos de rojo) y no viable (blanquecinos), para finalmente establecer el porcentaje de viabilidad polínica (BARRIOS et al., 2005).
Receptividad del pistilo. La receptividad del pistilo se evaluó en cada uno de los periodos correspondientes a 0, 8, 16, 24, 30, 32, 34, 36, 38 y 40 ddec (0,5 cm). Se utilizó como indicador de receptividad, la formación de burbujas, dada por la adición de una gota de peróxido de hidrógeno en los estigmas de los pistilos de las diferentes edades (LAGOS et al., 2008).
Antesis. Antes de que ocurriera la apertura floral (28 ddec), se marcaron 100 botones florales, para realizar observaciones del proceso de apertura floral y antesis desde las 6:30 a.m. hasta las 6:30 p.m. Se registró el inicio de la apertura floral, la duración de la misma hasta la máxima apertura, la hora de la antesis, el inicio de la antesis a partir de la apertura floral y el fin de la antesis.
Polinización artificial. Para el estudio de la polinización artificial, se evaluaron los siguientes tratamientos: polinización en el horario de 8 a 10 a.m. con hormona (8-10 a.m.), polinización entre 8 a 10 a.m. sin hormona (8-10 a.m. sh), polinización entre 10 a.m. y 12 m. con hormona (10-12 a.m.), polinización entre 10 a.m. y 12 m. sin hormona (10-12 a.m. sh), polinización entre 12 m. y 2 p.m. con hormona (12-2 p.m.), polinización entre 12 m. y 2 p.m. sin hormona (12-2 p.m. sh), polinización entre 2 y 4 p.m. con hormona (2-4 p.m.), polinización en entre 2 y 4 p.m. sin hormona (2-4 p.m. sh).
Los horarios y métodos de polinización artificial se analizaron bajo el modelo de Bloques Completos al Azar con dos factores. En el primer factor se estudiaron cuatro horarios de polinización artificial y en el segundo se evaluó la aplicación o no de ácido giberélico a una concentración de 1000 ppm, para un total de ocho tratamientos (8-10 a.m., 8-10 a.m. sh, 10-12 a.m., 10-12 a.m. sh, 12-2 p.m., 12-2 p.m. sh, 2-4 p.m. y 2-4 p.m. sh) y cinco repeticiones. El bloque correspondió a un árbol y dentro de cada árbol, los tratamientos se distribuyeron al azar.
Se calculó la eficiencia de la hibridación (EH) en porcentaje, con base en la siguiente relación:
donde:
EH: Eficiencia de la hibridación.
CE: Números de cruzamientos efectivos (correspondió al número de frutos cuajados).
TC: Total de cruzamientos.
En cinco frutos tomados al azar de la unidad experimental se determinó el número de semillas por fruto maduro (NSF), el peso de fruto maduro (PPF), la velocidad de germinación (VG) y el porcentaje de germinación de 50 semillas (PG).
La polinización artificial se realizó con polen colectado de flores recién abiertas, las cuales tenían entre 26 y 29 ddec (Figura 1A). Los botones florales a emascular tenían una edad 28 ddec (Figura 1B y 1c). Estos botones, presentaban un diámetro en la base de la corola de 0,42 cm y un eje polar de 0,90 cm. La tonalidad del color rosado de los pétalos de estos botones florales es más fuerte. Una vez emasculados los botones florales, en los tratamientos que llevaban hormona, se hizo la aplicación de 1000 ppm de ácido giberélico. Luego, se realizó la polinización de los estigmas (Figura 1D y Figura 1E) y se procedió a proteger estos botones con bolsas de papel glassine para evitar la contaminación con polen extraño (Figura 1F).

RESULTADOS Y DISCUSION
Morfología de las flores de C. betacea. La Figura 2A muestra la estructura de una flor típica de tomate de árbol. La corola (Figura 2B) es pentámera de color blanco o rosado, con simetría actinomorfa (CRONQUIST, 1986). Los pétalos son puntiagudos hacia el extremo, unidos entre sí por la base. Contrario a lo que sucede con los sépalos estos se caen con la fecundación del ovario (BERNAL et al., 2003). El cáliz (Figura 2C) es gamosépalo, pentámero de color verde claro y permanece adherido a la flor después de la fecundación (MORA, 2004). El pistilo tiene una longitud de 1 cm, formado por estigma y estilo, de color blanquecino y ovario de color amarillo pálido. El estilo es longistilo, es decir que sobresale por encima de los estambres. Cuando la flor ha sido fecundada se torna de color café oscuro. El androceo (Figura 2D) está formado por los estambres que se constituyen por las anteras y el filamento.
La flor presenta cinco anteras biloculares (ANGULO, 2003) de color amarillo que se encuentran unidas a la base mediante un filamento de color blanco. Cada una posee dos sacos polínicos color crema y su dehiscencia es foraminal o poricida (OSORIO & MADRID, 1978).

Crecimiento de los verticilos florales de C. betacea. La Figura 3 muestra las curvas de crecimiento de los verticilos florales de C. betacea bajo las condiciones del municipio de Nariño. A partir del día cero (0,5 cm) el LA, el LF y el LE (Figura 3A) alcanzaron el máximo crecimiento a los 30 días. A partir de esta fase, estos entran en un proceso de senescencia dado por la pérdida de turgencia, lo que conlleva a un estado de flacidez y finalmente a la abscisión de los mismos, tal como lo observó PAREDES et al. (2005) en Physalis peruviana. El DO y el LO tienen su máximo crecimiento entre los 35 y 40 días, momento en el cual el ovario da lugar al fruto. El AA crece lentamente y desde el tamaño inicial no hay un crecimiento significativo manteniendo su tamaño constante.
El LB y el LC (Figura 3B) tienen un crecimiento máximo en los 30 días y el DBC y el DMC no presentan un crecimiento tan marcado, pero al igual que el LB y el LC son estructuras que durante esta fase presentan una considerable disminución de la tasa de crecimiento y una importante canalización de los recursos hacia la formación de estructuras reproductivas y la acumulación de reservas en las semillas (MARTÍNEZ & PÉREZ, 1994). El DEC tiene un crecimiento constante durante los primeros 40 días de evaluación.
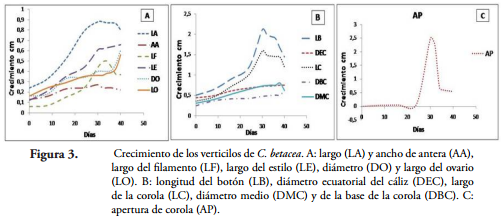
Los sépalos son verticilos persistentes por su función protectora de las demás partes de la flor durante el estado juvenil y hasta la formación del fruto. La AP (Figura 3C) se da a los 29 días, época que coincide con el máximo valor de DMC (0,53 cm). Generalmente, la apertura floral antecede a la liberación del polen en la antesis. En esta especie, ocurre el máximo crecimiento de la corola a lo ancho. Se presenta la apertura floral, exponiendo el pistilo y después de media hora se da la dehiscencia de las anteras, tal como lo encontraron LAGOS et al. (2008).
El crecimiento de los verticilos florales de esta especie, se ajustó al modelo lineal y = Bd, donde: y = variable dependiente, B = coeficiente de regresión y d = número de días transcurridos en cada evaluación. Los coeficientes de determinación (R2) en este modelo, oscilaron entre 89 y el 98%, los cuales superaron a los del modelo cuadrático que tienen R2 de 28 y 86%. En la Figura 4A se presenta el crecimiento desde el estado cero hasta los 40 días para las variables LB (Y = 0,052d, R2 = 0,95), DEC (Y = 0,022d, R2 = 0,92), LC (Y = 0,041d, R2 = 0,97), DBC (Y = 0,015d, R2 = 0,93), DMC (Y = 0,022d, R2 = 0,94), AP (Y = 0,030d, R2 = 0,54).
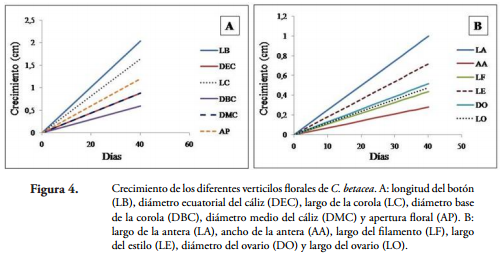
Al igual que en la Figura 4A, la Figura 4B describe el crecimiento para LA (Y = 0,025d, R2 = 0,97), AA (Y = 0,007d, R2 = 0,90), LF (Y = 0,011d, R2 = 0,96), LE (Y = 0,018d, R2 = 0,99), DO (Y = 0,013d, R2 = 0,96) y LO (Y = 0,012d, R2 = 0,94). Teniendo en cuenta el coeficiente de regresión (B), la velocidad de crecimiento de los órganos florales de tomate de árbol en promedio fue de 0,022 cm/día. La LB (Figura 4A) creció más rápido que los demás órganos florales, a razón de 0,052 cm/día. Este crecimiento rápido responde a que el botón floral alberga órganos de reproducción como el androceo, el gineceo y estructuras como el ovario que más adelante darán origen a la formación del fruto. Este presenta un crecimiento lineal hasta los 40 días, de ahí en adelante detiene su crecimiento debido a que la planta utiliza sus reservas hacia la formación de frutos y semillas.
Desde el estado cero en adelante algunas variables crecen constantemente hasta los 40 días, momento en el cual ya se ha dado la apertura floral y las estructuras como los pétalos, las anteras y el estilo empiezan a marchitarse hasta que finalmente se desprenden y se han presentado procesos como la polinización, la fecundación y la formación del fruto. Los sépalos permanecen en el ovario hasta la maduración. Estas observaciones coinciden con lo expresado por TORREY (1969), quien indica que desde el momento de la iniciación floral existe un desarrollo progresivo de las partes que componen la flor hasta la polinización y formación del fruto. En este proceso existe un complejo de interacciones que involucran no solamente los componentes nutricionales sino también un sistema hormonal diferente que incluye giberelinas, citoquininas y auxinas.
Maduración del polen y viabilidad polínica (VP) en C. betacea. Los granos de polen comienzan a ser viables desde los 24 días, cuando muestran un 61,48% de VP. Los estados con mayor VP (100%) ocurren a los 34 y 36 días, luego a los 40 días se observa una disminución en la VP del 37,04%.
Madurez del pistilo. Desde los 16 días, el 80% de las flores evaluadas reaccionó positivamente a la prueba del peróxido de oxígeno. A los 24 días ya se encuentran receptivos el 100% de los pistilos, verificándose un mecanismo de protoginia debido a que la antesis ocurre a los 29 días. La protoginia se da en el caso de que los óvulos y el estigma estén receptivos, mucho antes de que estén maduros los granos de polen y los estambres de la misma planta o flor. En las plantas que son autoincompatibles este fenómeno evita la autofecundación y, por lo tanto, favorece la diversidad genética a través de la fecundación cruzada o alogamia (VALLEJO & ESTRADA, 2002).
Apertura floral (AF). La apertura floral en C. betacea, en un 75% ocurre entre las 6:30 a.m. y las 6:30 p.m. en el día 29 después del estado cero (0,5 cm). El 25% de las flores restantes presentan su apertura al día siguiente. En el día 28, antes de que ocurra la apertura floral, se observó que los botones florales se encontraban hidratados, suaves y con la punta estrellada. Los picos de apertura floral se presentaron entre las 9:30 a.m. y las 12:30 p.m. Un 31% de las flores abrieron a las 10:30 a.m., debido a que en estas horas la temperatura se incrementó en un rango de 2 a 11°C.
Al día 30, todas las flores se encontraban abiertas y se dio la dehiscencia de las anteras. Dos días después, estas sufren un proceso de oxidación. En este periodo, el estigma presenta una coloración normal y aún no se ha desprendido. En el día 34 los estigmas se deshidratan, y en el día 36 las anteras y los pétalos empiezan a presentar pérdida de turgencia, tienen una coloración marrón y el estilo se desprende con facilidad. Finalmente, al día 40, todas las estructuras del androceo y el estilo se necrosan totalmente y se desprenden junto con la corola, quedando únicamente el cáliz y el ovario que se transforma en fruto, tal como lo describe CUTTER (1971).
Antesis. La liberación de los granos de polen se localizó en la parte superior de la antera. Esta apertura es de tipo foraminal (BERNAL et al., 2003). En el 61% de las flores evaluadas la antesis ocurrió entre las 10:00 a.m. y 12:30 p.m. En las primeras horas de la mañana (6:30 a 9:30 a.m.) se registró el menor porcentaje de flores en antesis (15%). Después de las 1:30 p.m. se observó una disminución de la misma (20%). Estos registros son similares a los encontrados por ORDÓÑEZ & RUANO (2002), en otra solanácea como Physalis peruviana L.
Media hora después de presentarse la apertura floral, la antesis ocurrió en una sola antera y al transcurrir el día se dio en el resto. En el día 30 se encontraron dehiscentes todas las anteras. MOSQUERA (2002) en un estudio realizado en P. peruviana, encontró que la antesis efectiva se presenta en el primer día de la apertura floral cuando la temperatura está cerca a los 16°C. Por debajo de los 15°C, esta se limita. Por lo tanto, el inicio de la antesis está influenciado por el ambiente, en especial por la temperatura y la humedad relativa.
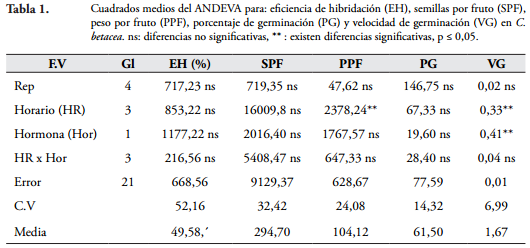
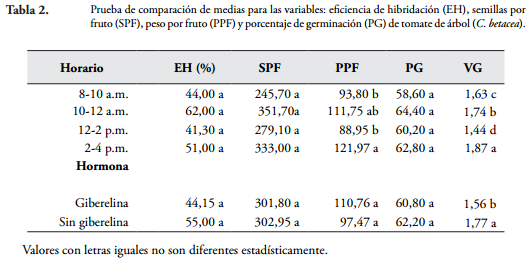
Polinización artificial. Los cuadrados medios del ANDEVA (Tabla 1) indican que no se presentaron diferencias significativas entre horarios y hormonas en las variables eficiencia de hibridación (EH), semillas por fruto (SPF) y porcentaje de germinación (PG). En PPF se presentaron diferencias entre horarios y en VG entre horarios y hormona. La interacción horario por hormona no fue significativa para todas las variables.
El hecho de que no existan diferencias significativas entre EH, SPF y PG, significa que independientemente de la hora en la que se realice la polinización y de la utilización o no de hormona, se puede obtener semilla híbrida para los procesos de mejoramiento. La EH oscila entre el 36 y 68%, lo cual es suficiente para obtener semilla, debido a que el número de SPF obtenido va desde 240 hasta 361. El PG presentó un rango que va desde el 56 hasta el 66%, el cual puede considerarse adecuado para obtener suficientes plantas híbridas.
El PPF presentó diferencias entre horarios determinando que en 2-4 p.m. se presenta el mayor valor con un promedio de121,97 g similar al horario de 10-12 a.m. con 111,75 g, a diferencia de los horarios de 8-10 a.m. y entre 12-2 p.m. que presentan promedios de 93,80 y 88,95 g respectivamente. El mayor PPF coincidió con el más alto valor en la VG con 1,87 en el horario de 2-4 p.m., que presentó diferencias significativas con los demás horarios (Tabla 2). Teniendo en cuenta que de todos los factores climáticos, la temperatura es el más incidente en los procesos fisiológicos, cabe destacar que en el horario de 2-4 p.m., la temperatura osciló entre 19 a 25°C, favoreciendo la germinación de los granos de polen y la maduración de los óvulos, posibilitando una buena fecundación, dado que el intervalo normal de temperaturas en que estos procesos tienen lugar va entre 10 a 30°C, siendo los valores óptimos entre los 18 y 25°C (ALBERT, 1991).
Según lo mencionado anteriormente, este comportamiento diferencial obtenido en los valores de PPF y VG, es producto de la polinización en diferentes horas del día, causando variables contenidos de glucosa e hidratos de carbono los cuales constituyen la principal fuente de energía, hecho que puede afectar inicialmente la VG en las semillas producidas (CUTTER, 1971). Además, las mayores velocidades de germinación se dan en horas de la tarde, debido a una alta acumulación de reservas y energía, la cual es favorecida por el incremento de la temperatura que, a su vez, estimula el desarrollo inicial del eje embrionario dando origen a semillas completas con un normal desarrollo que obtienen un buen vigor.
Los PG obtenidos por hibridación artificial no mostraron diferencias estadísticas significativas entre los tratamientos. Estos valores se encuentran en un rango del 56 al 66%, siendo similares con los PG de la semilla comercial o registrada, que tienen promedios del 50%. Un menor número de granos de polen sobre el estigma origina frutos pequeños y un menor número de semillas, tal como lo indica el coeficiente se correlación entre SPF y PPF que fue de 0,79. Además, la deficiencia en la polinización produce un bajo contenido de auxinas que inducen un desbalance hormonal especialmente en el contenido de giberelinas, etileno y ácido abscísico que juegan un papel importante en la maduración de la semilla.
CONCLUSIONESEl modelo de crecimiento de los diferentes verticilos florales de C. betaceae, se ajustó a la regresión lineal sin intercepto y = Bd. En el cultivar Manzano de C. betacea la apertura floral se dio a los 29 días después del estado cero y ocurrió entre las 06:30 a.m. y las 06:30 p.m. con un pico a las 10:30 a.m. Los granos de polen alcanzaron la madurez a los 24 días y la receptividad del estigma a los 16 días. La receptividad del pistilo se presentó ocho días antes de la viabilidad polínica.
Para las variables eficiencia de hibridación, semillas por fruto y porcentaje de germinación, no se encontraron diferencias significativas. En peso promedio de fruto se presentaron diferencias entre horarios. El horario de 2-4 p.m. presenta el mayor peso de fruto maduro. En la velocidad de germinación se presentaron diferencias entre horarios y hormona obteniéndo la mayor velocidad de germinación el horario de 2-4 p.m., sin la utilización de hormona.
ALBERT, F., 1991.- Tratado de arboricultura frutal. Vol. 1. Morfología y fisiología del árbol frutal. 4ta Edición. Ediciones Mundi prensa España, Madrid. [ Links ]
ANGULO, R., 2003.- Frutales exóticos de clima frío. Bayer CropScience. [ Links ]
ANTONINI, A.C., ROBLES, W.G., TESSARIOLI, J.N. & KLUGE, R., 2002.- Capacidade produtiva de cultivares de berinjela. Hortic. Bras., 20 (4): 646-648. [ Links ]
ARAMÉNDIZ, H., CARDONA, C. & ESPITIA, M., 2009.- Caracterización de la morfología floral de dos cultivares de berenjena (Solanum melongena L.) (Solanaceae). Rev. Fac. Nal. Agr., 62 (2): 5125-5134. [ Links ]
BARRIOS, L., CAETANO, M., CARDOSO, C., COPPENS, G., ARROYABE, A. & OLAYA, C., 2005.- Caracterización del polen de especies de los géneros Passiflora y Dilkea. Acta Agron., 54 (3): 19-23. [ Links ]
BERNAL, J., DÍAZ, C., AMAYA, A. & VANEGAS, F., 2003.- Generalidades del cultivo. Tecnología para el cultivo del tomate de árbol. Rionegro, Antioquia, CORPOICA - La Selva. Manual técnico 3. [ Links ]
BLAT, S.F., BRAZ, L.T. & ARRUDA, A.S., 2007.- Avaliação de híbridos duplos de pimentão. Hortic. Bras., 25 (3): 350-354. [ Links ]
BOHS, L., 1989.- Ethnobotany of the genus Cyphomandra (Solanaceae). Econ. Bot., 43 (2): 143-163. [ Links ]
CARABALLO, B.M., 2001.- Biología floral del guayabo (Psidium guajava L.) en la Planicie de Maracaibo, Zulia, Venezuela. Rev. Fac. Agron., 18: 41-55. [ Links ]
CARRIÓ, E., JIMÉNEZ, J.F., SÁNCHEZ, P. & GUEMES, J., 2009.- Reproductive biology and conservation implications of three endangered snapdragon species (Antirrhinum, Plantaginaceae). Biol. Cons., 142: 1854-1863. [ Links ]
CRONQUIST, A., 1986.- Introducción a la Botánica. 2° ed. México. [ Links ]
CUTTER, E., 1971.- Plant anatomy: experiment and interpretation. Addison-Wesley, London. [ Links ]
GARCÍA, M.C., 2008.- Manual de manejo cosecha y postcosecha del tomate de árbol. Bogotá, Corpoica. [ Links ]
GARCÍA, M.T. & HOC, P., 1998.- Biología floral de Passiflora foetida (Passifloraceae). Rev. Biol. Trop., 46 (2): 191-202. [ Links ]
GELT., 2009.- Gobierno en línea del Orden. Disponible en: http://www.narino-narino.gov.co [ Links ]
GEORGE, R.A., 1999.- Vegetable seed production. 2. ed. CABI Publishing, London. [ Links ]
GONZÁLEZ, M., HUESO, J.J., ALONSO, F. & CUEVAS, J., 2007.- Mejora de la productividad y calidad del fruto mediante el control de la polinización en Chirimoyo. Documentos Técnicos. Almería, Fundación Cajamar. [ Links ]
KOUL, M.M. & BHATNAGAR, A.K., 2007.- Plant reproductive biology studies crucial for conservation. Curr. Sci., 92 (9): 1207. [ Links ]
LAGOS, T.C., BENAVIDES, C.A., PAREDES, R. & LAGOS, L.K., 2011. Distribución de tomate de árbol Cyphomandra betacea (Cav.) Sendt. y caracterización eco-climática en las zonas del cultivo de Nariño. Rev. Colomb. Cienc. Hortic, 5 (1): 11-19. [ Links ]
LAGOS, T.C., VALLEJO, F.A., CRIOLLO, H. & MUÑOZ, J.E., 2008.- Biología reproductiva de la Uchuva (Physalis peruviana L.). Acta Agron., 57 (2): 81-88. [ Links ]
LOBO, M., 2004.- Informe técnico: Tomate de árbol frutal promisorio para la diversificación del agro andino. FONTAGRO. [ Links ]
MARTÍNEZ, J. & PÉREZ, F., 1994.- Introducción a la fisiología vegetal. Ediciones Mundi prensa, Bilbao, españa. [ Links ]
MORA, L., 2004.- Morfología sistemática y evolución de las angiospermas. Universidad Nacional de Colombia. Capítulo VI. ISBN: 958-701-475-8. [ Links ]
MOSQUERA, C., 2002.- Polinización entomófila de la uvilla (Physalis peruviana L.). Rev. Cienc. Agríc., 19 (1-2): 140-156. [ Links ]
ORDOÑEZ, M. & RUANO, L., 2002.- Evaluación de diferentes horarios de polinización artificial en Uvilla (Physalis peruviana L.) bajo condiciones de campo de la granja de Botana, municipio de Pasto: Trabajo de grado, Universidad de Nariño, Facultad de Ciencias Agrícolas, Pasto. [ Links ]
OSORIO, E. & MADRID, C., 1978.- Biología floral del tomate de árbol (Cyphomandra betacea (Cav.) Sendt.) y Lulo (Solanum quitoense L.): Trabajo de grado, Universidad Nacional de Colombia, Medellín. [ Links ]
PAREDES, O. MORA, A. LAGOS, T.C., CRIOLLO, H. & VALLEJO, F., 2005.- Estudio de la biología floral de la Uchuva (Physalis peruviana L.). Rev. Cienc. Agríc., 22 (I y II): 34-49. [ Links ]
PARES, J., LINÁREZ, R., ARIZALETA, M. & MELÉNDEZ, L., 2004.- Aspectos de la biología floral en lechosa (Carica papaya L.) cv. "Cartagena roja", en el estado Lara, Venezuela. Rev. Fac. Agron., 21 (2): 116-125. [ Links ]
SOUSA, J.A., MALUF, W.R. & GOMES, L.A., 1997.- Produtividade e qualidade de frutos de cultivares de polinização aberta e híbrida F1 de berinjela (Solanum melongena L.). Ciênc. Agrotec., 21 (2): 334-342. [ Links ]
TAFUR, R., 2006.- Propuesta frutícola para Colombia y su impacto en la actividad económica, nacional, regional y departamental. Memorias: Primer Congreso Colombiano de Horticultura. Sociedad Colombiana de Ciencias Hortícolas, Bogotá [ Links ].
TORREY, J.G., 1969.- Development in flowering plants. Macmillan, London. [ Links ]
VALLEJO, F. & ESTRADA, E., 2002.- Mejoramiento genético de plantas. Universidad Nacional de Colombia, Palmira. [ Links ]














