Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.19 no.2 Manizales July/Dec. 2015
https://doi.org/10.17151/bccm.2015.19.2.7
DOI: 10.17151/bccm.2015.19.2.7
MANEJO INTEGRADO DEL NEMATODO DEL NUDO RADICAL [Meloidogyne incognita (Kofoid & White) Chitwood Y Meloidogyne mayaguensis Rammh & Hirschmann] EN ALMÁCIGOS DE GUAYABO (Psidium guajava Linneo), VARIEDAD PALMIRA ICA-1*
INTEGRATED MANAGEMENT OF ROOT-KNOT NEMATODES [Meloidogyne incognita (Kofoid & White) Chitwood AND Meloidogyne mayaguensis Rammh & Hirschmann] IN SEEDLING NURSERIES OF GUAVA (Psidium guajava Linneo), PALMIRA ICA-1 VARIETY
* FR: 25-II-2015, FA: 30-X-2015
1 Magíster en Fitopatología, Universidad de Caldas. Manizales, Colombia. E-mail: roalorpaz@hotmail.com
2 Profesor Asistente, programa de Maestría en Fitopatología, Universidad de Caldas. Manizales, Colombia. E-mail: oscar.guzman@ucaldas.edu.co
3 Ph. D., en Fitopatología. E-mail: jleg@une.net.co
CÓMO CITAR:
ORTIZ, R.A., GUZMÁN, Ó.A. & LEGUIZAMÓN, J., 2015.- Manejo integrado del nematodo del nudo radical [Meloidogyne incognita (Kofoid & White) Chitwood y Meloidogyne mayaguensis Rammh & Hirschmann] en almácigos de guayabo (Psidium guajava Linneo), variedad Palmira ICA-1. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 19 (2): 104-138. DOI: 10.17151/bccm.2015.19.2.7
Los hongos Purpureocillium lilacinum, cepa Pl-11 y Pochonia chlamydosporia, cepa Jl-1, son antagonistas de los nematodos fitoparásitos. El objetivo de esta investigación fue conocer el efecto de los hongos P. lilacinum, cepa Pl-11 y Pochonia chlamydosporia var. catenulata, cepa Jl-1, sobre Meloidogyne incognita y Meloidogyne mayaguensis en raíces de guayabo, variedad Palmira ICA-1 y su relación con el crecimiento de plántulas. En un almácigo, ubicado en la Granja Montelindo de la Universidad de Caldas, bajo un diseño completamente aleatorio, se establecieron 12 grupos de 18 plántulas de guayabo, variedad Palmira ICA-1, de 30 días de edad. Las raíces de 18 plántulas se inocularon con 5.000 huevos y juveniles (J2) de M. incognita y M. mayaguensis/plántula. Ocho días antes y después de la inoculación de ambas especies de Meloidogyne, y a los 30 y 60 días, se adicionaron 111 ml de P. lilacinum (1 x 109 esporas/ml)/plántula. Este mismo procedimiento se realizó con P. chlamydosporia (1 x 109 esporas/ml), la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) y Carbofuran (500 ppm). Se tuvo un testigo nematodo y un testigo agua. Se comprobó que la plántulas tratadas con las mezclas de P. lilacinum y P. chlamydosporia (1 x 106 esporas/L) en combinación con Carbofuran (125 ppm), y la mezcla de P. lilacinum yP. chlamydosporia (1 x 108 esporas/ml), aplicadas 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicadas a los 30 y 60 días, obtuvieron mayor crecimiento con una altura de 62,8 y 59,8 cm; un peso seco de hojas de 24,6 y 21,1 g; y un peso seco de raíces de 12 y 11 g, respectivamente, en comparación con los testigos que tuvieron los menores valores con 41,27; 9,93 y 4,58 g, respectivamente. Con las mismas mezclas, las plántulas disminuyeron el índice de nudos radicales en 6 grados y 4 grados, respectivamente, en relación con el testigo nematodo, quien tuvo un índice de 9. Los hongos P. lilacinum, cepa Pl-11, y P. chlamydosporia var. canetulata, cepa Jl-1, solos o en mezcla, confirmaron su excelente potencial infectivo en el control de M. incognita y M. mayaguensis, pudiéndose usar en condiciones de almácigo dentro de un programa de manejo integrado de Meloidogyne spp.
Palabras clave: control biológico, guayabo, infección, Meloidogyne, Pochonia chlamydosporia, Purpureocillium lilacinum.
AbstractPurpureocillium lilacinum strain PL-11 and Pochonia chlamydosporia strain JL-1 fungi are opponent to plant parasitic nematodes. The objective of this research was to know the effect of P. lilacinum, strain Pl-11 and P. chlamydosporia var. catenulata, strain Jl-1, on Meloidogyne incognita and Meloidogyne mayaguensis in guava roots from the Palmira ICA-1 variety and their relationship with plant growth. In a seedling nursery, located in the Montelindo farm of Universidad de Caldas, 12 groups of 18 thirty (30) days old seedlings of guava, Pamira ICA-1 variety, were stablished under a completely randomized design. Roots of 18 seedlings were inoculated with 5,000 eggs and second (J2) stage juveniles of M. incognita and M. mayaguensis/seedling. Eight days before and after inoculation of both Meloidogyne species and 30 and 60 days later, 111 mL of P. lilacinum (1 x 109 espores/mL)/seedling was added. The same process was made with P. chlamydosporia (1 x 109 esporas/mL), the mixture of P. lilacinum and P. chlamydosporia (1 x 108 espores/mL), the mixture of P. lilacinum and P. chlamydosporia (1 x 106 espores/mL) in combination with Carbofuran (125 ppm and 500 ppm). There was both nematode and water control. It was demostrated that seedlings treated with the mixture of P. lilacinum and P. chlamydosporia (1 x 106 esporas/L) in combination with Carbofuran (125 ppm), and the mixture of P. lilacinum and P. chlamydosporia (1 x 108 esporas/mL), 8 days before and after inoculation of M. incognita and M. mayaguensis and newly treated 30 and 60 days after inoculation of nematodes, obtained a better growth with a height of 62.8 and 59.8 cm, a dry weight of leaves of 24.6 and 21.1 g, and a dry weight of roots of 12 and 11 g, respectively, in comparison to the controls that had lower values with 41.27, 9.93 and 4.58 g, respectively. With the same mixtures, seedlings decreased root knot index in 6 and 4 degrees, respectively, in relation to the nematode controls, which obtained an index of 9. P. lilacinum strain PL-11 and Pochonia chlamydosporia strain JL-1 fungal strains, alone or in mixture, confirmed their excellent infective potential in the control of M. incognita and M. mayaguensis, being possible to use them in nursery conditions as a part of an integrated pest management program of Melodogyne spp.
Key words: biological control, guava, infection, Meloidogyne, Pochonia chlamydosporia, Purpureocillium lilacinum.
El guayabo (Psidium guajava L.), nativo de América tropical y subtropical, produce la guayaba conocida como la "fruta reina" por tener 16 vitaminas, de las cuales se destaca la vitamina C, que puede alcanzar 300 mg/100 g de peso fresco, cuando la naranja solo alcanza 54 mg/100 g de peso fresco. La fruta es apreciada por su sabor y aroma, por reducir las lipoproteínas de alta densidad de la sangre, actuar como neutralizante de hidratos de carbono y por contener aminoácidos como el triptófano, la lisina y la metiotina, esenciales para el crecimiento normal del cerebro (LEE et al., 1998; LOZANO et al., 2002).
Colombia es el cuarto productor mundial de guayaba, con el 5% de la producción (1,2 millones de t), después de la India y Pakistán que aportan 50% y México que contribuye con 25% (UDEA, 2012). La fruta es fundamental en la economía colombiana ya que el 30% de la producción se utiliza para la elaboración de bocadillos y el 70% para el procesamiento de jaleas, néctares, pulpas y consumo fresco (FAO, 2008; TAFUR, 2012). Debido a esto, las actividades comerciales con el cultivo sustentan 9.000 familias y representan $ 40.000 millones de pesos anuales. En Colombia hay sembradas 15.000 ha, con una producción de 145.000 t y un rendimiento de 9,7 t/ha establecidas en 22 departamentos; de los cuales se destacan Valle del Cauca con 17.926 t, Meta con 12.988 t, Caldas con 6.756 t, Risaralda con 6.577 t, Santander con 6.147 t y Quindío con 4.839 t (DANE, 2011; TAFUR, 2012; UDEA, 2012).
A través de su ciclo de desarrollo, el guayabo es susceptible a plagas como la mosca de la fruta (Anastrepha spp. Schinner y Ceratitis capitata Wied.) y enfermedades ocasionadas por hongos fitopatógenos como la antracnosis (Colletotrichum gloeosporioides Penz.), la roña (Pestalotia versicolor Speg.) y la roya (Produccióninia psidii Wint.); y nematodos fitoparásitos de los géneros, Pratylenchus, Tylenchorhynchus, Helicotylenchus, Rotylenchulus, Hoplolaimus y Meloidogyne (AGRIOS, 2005; PERRY et al., 2009; GUZMÁN & CASTAÑO, 2010).
El nematodo de mayor importancia económica en el mundo es Meloidogyne spp. Goeldi, debido a que es cosmopolita, polífago y posee alta capacidad de multiplicación y de supervivencia (PERRY et al., 2009). Meloidogyne spp. parasita más de 2.000 especies vegetales afectando su rendimiento, causando pérdidas del 60% en berenjena (Solanum melongena L.), 33% en melón (Cucumis melo L.) y tomate (Solanum lycopersicum L.) (SIKORA & FERNÁNDEZ, 2005), 87% en yuca (Manihot sculenta Crantz) (COYNE & TALWANA, 2000), 45% en café (Coffea arabica L.) (LORDELLO et al., 1990; BARBOSA et al., 2004), 50% en lulo (Solanum quitoense L.) (GELPUD et al., 2011), 31% en banano (de Musa paradisiaca L.) (DE WAELE & DAVIDE, 1998; JONATHAN & RAJENDRAN, 2001) y pérdidas superiores al 60% en guayabo (Psidium guajava L.) (VILLOTA & VARÓN, 1997; BOLAÑOS et al., 2007). Meloidogyne spp. produce síntomas primarios conocidos como nudos o agallas en el sistema radical, después de la hipertrofia e hiperplasia de los tejidos parenquimáticos ubicados alrededor de zona de alimentación del nematodo (AGRIOS, 2005; BOLAÑOS et al., 2007; PERRY et al., 2009; GUZMÁN & CASTAÑO, 2010). Posteriormente, se manifiestan síntomas secundarios como clorosis y marchitamiento de las hojas, reducción del crecimiento, abortos florales, baja calidad y cantidad de frutos, disminución del peso de los frutos y cuando el ataque del nematodo es muy severo la planta muere (AGRIOS, 2005; GUZMÁN & CASTAÑO, 2010).
El manejo para disminuir la población de Meloidogyne spp. se basa en la prevención, las prácticas de cultivo, el uso de variedades resistentes, el manejo biológico y el manejo químico; este último, es el más utilizado, quizás porque permite un control rápido y eficaz (ARAYA et al., 1995). Sin embargo, se han reportado efectos negativos sobre el uso de nematicidas que van desde cáncer y envenenamiento en humanos; toxicidad en agua, insectos benéficos, aves, anfibios y peces, hasta la modificación de la microflora y microfauna de los suelos, que han dado paso a la restricción de los nematicidas y, a veces, su retiro del mercado (MENDES et al., 2005; WADA & TOYOTA, 2008; ARUMUGAM et al., 2013). Este impacto negativo de los nematicidas ha impulsado, en muchos países, la búsqueda de alternativas de manejo dirigidas a evitar el uso de productos químicos o sustituirlos por métodos más amigables con el agroecosistema (GÓMEZ, 2007).
Se ha reconocido el manejo biológico como una alternativa compatible con el agroecosistema, que puede reducir los nematodos fitoparásitos, a través de un amplio rango de organismos antagonistas que incluyen hongos, plantas, bacterias, protozoarios, ácaros y nematodos depredadores (DÁVILA et al., 1999). En el grupo de los hongos antagonistas de Meloidogyne spp. se encuentran: Purpureocillium lilacinum (Thom) Luangsa-Ard, Houbraken, Hywel-Jones & Samson y Pochonia chlamydosporia var. catenulata (Kamyschko ex G.L. Barron & Onions) Zare & W. Gams (CARDONA & LEGUIZAMÓN, 1997; PIEDRA, 2008).
El hongo P. lilacinum, en tomate (Solanum lycopersicum L.), infecta el 40% de las hembras y el 70% de huevos y juveniles de Meloidogyne spp. (KHAN & SAXENA, 1997; ESFAHANI & POUR, 2006). En okra americana (Abelmoschus esculentus) P. lilacinum reduce el 78% de huevos y el 81% de los estados juveniles (J2) de Meloidogyne spp. (CRUZ, 2007; DHAWAN & SINGH, 2009). En lima ácida (Citrus aurantifolia Christm. et Panz.) P. lilacinum en mezcla con P. chlamydosporia infecta el 49% de estados juveniles (J2) de M. javanica y el 54% de los huevos del nematodo (RAO, 2005). MONTES DE OCA et al. (2005), PETEIRA et al. (2005) y PUERTAS et al. (2006) demostraron que el hongo P. chlamydosporia var. catenulata es un agente potencial de control biológico de nematodos del nudo radical en cultivos de habichuela [Vigna unguiculata (L.) Walp.], al infectar el 80% de los huevos de Meloidogyne spp. En tomate (Solanum lycopersicum L.) el hongo P. chlamydosporia reduce el 72,83% de los huevos de M. javanica (DALLEMOLE-GIARETTA et al., 2014). Asimismo, P. chlamydosporia tiene amplio potencial como controlador de Meloidogyne spp. por la producción de dictioclamidosporas, las cuales son estructuras de resistencia que le permiten sobrevivir, emitir micelio, colonizar la rizósfera y proliferar en el suelo (GIRALDO & LEGUIZAMÓN, 1997; FLORES et al., 2008; HERNÁNDEZ & DÍAZ, 2008).
Teniendo en cuenta lo mencionado anteriormente, el objetivo de esta investigación fue determinar el efecto de los hongos Purpureocillium lilacinum, cepa Pl-11, y Pochonia chlamydosporia var. catenulata, cepa Jl-1, sobre el parasitismo de Meloidogyne incognita y Meloidogyne mayaguensis en raíces de guayabo, variedad Palmira ICA-1 y su relación con el crecimiento de plántulas, en condiciones de almácigo.
MATERIALES Y MÉTODOSLocalización. La investigación se realizó en la Granja Montelindo, de la Universidad de Caldas, localizada en la vereda Santágueda, municipio de Palestina, departamento de Caldas, Colombia, a una altitud de 1010 msnm, con temperatura promedio anual de 23ºC, precipitación de 2100 mm, humedad relativa del 76% y brillo solar de 2010 h.
Material vegetal. Se utilizaron 216 plántulas de guayabo de la variedad Palmira ICA-1, provenientes de semilla, que se pusieron a germinar en camas con sustrato cascarilla de arroz y con nutrientes suministrados por fertirrigación en el invernadero del Jardín Botánico de la Universidad de Caldas. Las plántulas se colectaron en un recipiente de plástico, 61 días después de la germinación, para proceder a sembrarlas en condiciones de almácigo.
Sustrato. El sustrato utilizado para el llenado de las bolsas y posterior siembra de las plántulas de guayabo fue una mezcla de suelo y cascarilla de arroz en proporción 3:1, preparada sobre un plástico negro, la cual se esterilizó con Dazomet (Basamid®) en dosis de 40 g/m2 y se tapó con plástico por 12 días.
Llenado de las bolsas y ahoyado. Se utilizaron 216 bolsas negras de polietileno, perforadas, con dimensiones 17 cm de ancho x 43 cm de largo, se llenaron con el sustrato esterilizado, empleando una paleta de plástico. Posteriormente, en el centro del sustrato contenido en la bolsa, se realizó un orificio de 8 cm de profundidad x 3,5 cm de diámetro, empleando un palo de madera de molde redondo, y en cada orificio se aplicaron 3 g de Fosforitahuila®.
Adecuación de las plántulas en condiciones de almácigo. En las 216 bolsas negras de polietileno que se ubicaron sobre una mesa de guadua de 4 x 2 x 1 m de largo, ancho y alto, respectivamente, se sembraron las plántulas de guayabo. Posteriormente, del total de las plántulas y de manera aleatoria se hicieron 12 grupos de 18 plántulas de guayabo. Las plántulas de cada grupo se etiquetaron con paletas de madera que contenían las letras iniciales del tratamiento y su repetición, por ejemplo: la etiqueta T1R1 hizo referencia al tratamiento 1 y a la repetición 1. Finalmente, a una altura de 1,80 m, en la parte superior del almácigo, se colocó una malla de color negro que produjo 60% de sombra.
Insumos biológicos y químicos utilizados para el manejo de Meloidogyne spp. Para el experimento, se utilizaron dos insumos biológicos formulados por la Corporación Laverlam International (Butte, Montana, Estados Unidos). El primero fue Purpureocillium lilacinum, cepa Pl-11, en concentración 4 x 109 esporas/g, con nombre comercial Biostat® y registro ICA No. 3855, presentado como polvo humectable (ICA, 2014) y el segundo fue Pochonia chlamydosporia var. catenulata, cepa Jl-1 (suministrado por el Centro Nacional de Investigaciones de Café (Cenicafé), cepa Cenicafé Jl-1), en concentración de 1,58 x 108 esporas/g y 2 x 106 clamidosporas/g y presentado como polvo humectable, con categoría toxicológica III.
El insumo químico utilizado fue Carbofuran, en concentración de 330 g/L, con nombre comercial Furadan® 3 SC. Este insumo viene como solución concentrada y categoría toxicológica I. Registro ICA No. 1461 (ICA, 2014).
Preparación de las concentraciones de los insumos biológicos y químicos. Las concentraciones de 1 x 109, 1 x 108 y 1 x 106 esporas/ml de P. lilacinum y P. chlamydosporia se prepararon pesando por separado 5, 0,5 y 0,0050 g y 4, 0,4 y 0,0040 g del envase plástico que contenía el insumo, respectivamente, empleando una balanza Analytical Plus marca Shimadzu®, posteriormente cada una se depositó en recipientes de plástico.
Para los tratamientos individuales, las cantidades de P. chlamydosporia o P. lilacinum se diluyeron por separado en 2 L de agua, y para los tratamientos combinados los bioinsumos se mezclaron en un recipiente que contenía 2 L de agua. Para homogenizar las diluciones de los insumos en agua se utilizó una varilla de vidrio.
Las concentraciones de 125 y 500 ppm de Carbofuran se obtuvieron extrayendo del envase de Furadan® 3 SC cantidades de 777,56 y 2.272 ul, con una micropipeta marca Biohit de 1.000 ul de capacidad, que se adicionaron de forma independiente en 2 L de agua corriente contenidos en recipientes de plástico.
Fuente de inóculo de Meloidogyne spp. Como fuente de inóculo se utilizaron raíces de plántulas de guayabo infestadas con Meloidogyne spp., localizadas en el Vivero Jaibana Frutales, ubicado en la vereda Cerritos, municipio de Pereira.
La extracción del nematodo de las raíces de guayabo se realizó en el Laboratorio de Fitopatología de la Universidad de Caldas, con base en el principio de flotación de los nematodos en azúcar realizado por JENKINS (1964) y MEREDITH (1973).
Posteriormente, con una cámara de conteo de 36 celdas (cada celda de 1 cm2) bajo un estereoscopio marca Leica® a 30X, se contaron 900.000 huevos y estados juveniles (J2) de Meloidogyne spp. en 360 ml de agua. Luego, los huevos y estados juveniles (J2) se depositaron en un frasco de vidrio, el cual se aforó a 500 ml de agua corriente para obtener un inóculo de 5.000 huevos y J2 de Meloidogyne spp. por cada 2 ml de solución. El inóculo se extrajo con ayuda de una micropipeta marca Biohit® de 1 ml de capacidad y se depositó en un beaker de 400 ml de capacidad que contenía 100 ml de agua corriente; para facilitar su aplicación en el plato de las plántulas.
Adicionalmente, se identificaron las especies M. incognita y M. mayaguensis, a través de la caracterización morfológica de patrones perineales de hembras adultas y de pruebas morfométricas de estados juveniles (J2) del fitonematodo, siguiendo las claves taxonómicas de TAYLOR & SASSER (1983), EISENBACK (1985), JEPSON (1987) y PERRY et al. (2009).
Aplicación de los tratamientos. En condiciones de almácigo, se tomaron 18 plántulas de guayabo (unidades experimentales) de 30 días de edad, a las cuales se les removió superficialmente el sustrato del plato, con la ayuda de una paleta de madera, para que el sistema radical quedara expuesto. Posteriormente en el plato de cada plántula se adicionó el inóculo de 5.000 huevos y estados juveniles (J2) de M. incognita y M. mayaguensis, que estaba contenido en 100 ml de agua corriente. Finalmente, la zona radical de cada una de las plántulas se cubrió con el sustrato utilizando la misma paleta de madera.
A los 8, 30 y 60 días antes y después de la inoculación de M. incognita y M. mayaguensis, en la zona radical de cada una de las 18 plántulas se adicionaron 111 ml de P. lilacinum (1 x 109 esporas/ml), utilizando un recipiente plástico de 400 ml de capacidad.
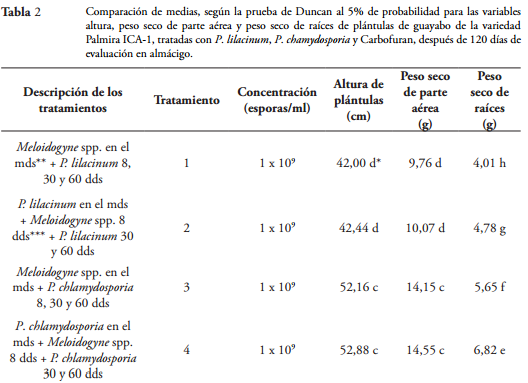
El procedimiento descrito anteriormente, también se realizó con P. chlamydosporia, la mezcla P. lilacinum y P. chlamydosporia, la mezcla P. lilacinum y P. chlamydosporia en combinación con Carbofuran y Carbofuran solo en las concentraciones correspondientes (Tabla 2). Se incluyó un testigo nematodo y un testigo agua. Se tuvieron 12 tratamientos, los cuales se describen en la Tabla 2.
Prácticas de cultivo de guayabo. La primera fertilización de las plántulas se realizó 20 días después de la siembra de ellas, incorporando 3 g de fertilizante (15-15-15) en el plato de las plántulas, el cual se tapó con el sustrato, utilizando una paleta de madera. Posteriormente, se fertilizó de forma similar cada 30 días. El riego se realizó diariamente en horas de la tarde, de forma manual aplicando 100 ml de agua corriente en cada una de las bolsas. Además, en cada bolsa, se realizó control de arvenses de forma manual y semanalmente, evitando competencia por nutrientes entre la plántula de guayabo y las arvenses.
Diseño experimental. Se utilizó un diseño experimental completamente al azar (DCA) con 12 tratamientos y 18 plántulas por tratamiento. Los datos obtenidos de las variables evaluadas se sometieron a análisis de varianza y, debido a que hubo diferencias estadísticas entre tratamientos, posteriormente se realizó la prueba de Duncan al 5% para establecer la diferencia entre los promedios de los tratamientos. El análisis estadístico se realizó mediante el programa Statistical Analysis System (SAS, 2009).
Variables evaluadasAltura de las plántulas (cm). Definida como la distancia entre el nivel del suelo y el nivel superior de las hojas. Se midió utilizando una cinta métrica y se registró cada 15 días.
Peso seco de raíces y peso seco de la parte aérea (g). Definido como el peso de las raíces y de la parte aérea (ramas, hojas y tallo), después de su desecación en el horno a una temperatura de 80°C y durante 24 h. Se calculó a los 120 días, para ello nueve plantas de cada tratamiento se lavaron y se secaron al ambiente y, posteriormente, se separaron las raíces y la parte aérea con ayuda de tijeras. Cada raíz y parte aérea de la plántula, se introdujeron de forma independiente en una bolsa de papel y luego se colocaron en una estufa a 80°C por 24 h. Después del secado, las bolsas se sacaron de la estufa y el contenido de las raíces y parte aérea se pesó individualmente en una balanza analítica marca Shimadzu®.
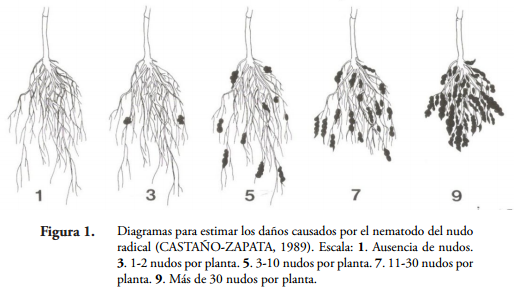
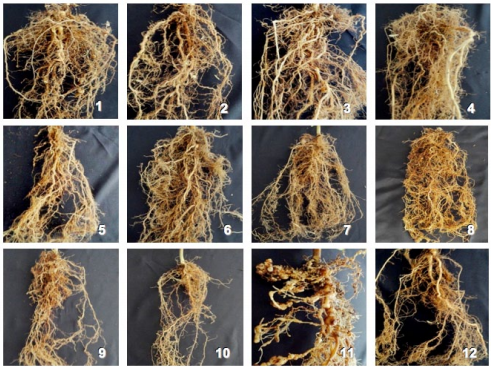
Índice de nudos radicales. Definido como el índice determinado por la cantidad de nudos radicales que ocasiona Meloidogyne spp. en las raíces de las plántulas. Antes de que las raíces se llevaran al horno, se evaluó visualmente el número de nudos radicales y se determinó el índice de nudos radicales, empleando para ello la escala de 1 a 9 propuesta por CASTAÑO-ZAPATA (1989) para estimar los daños causados por el nematodo del nudo radical (Figura 1).
Población de M. incognita y M. mayaguensis. Definida como el número de huevos o de estados juveniles (J2) de las especies de Meloidogyne encontradas en 100 g de raíces o en 100 g de suelo. Nueve muestras de raíces y suelo de cada tratamiento fueron utilizadas para la extracción de huevos, juveniles y adultos (hembras y machos) de M. incognita y M. mayaguensis con base en el principio de flotación de nematodos en azúcar realizado por JENKINS (1964) y MEDERITH (1973). La cantidad de huevos y estados juveniles (J2) de las especies mencionadas se determinó como el número de individuos en 100 g de suelo o de raíces de cada tratamiento, utilizando una caja de conteo de 36 celdas (cada celda de 1 cm2) y un estereoscopio a 30X.
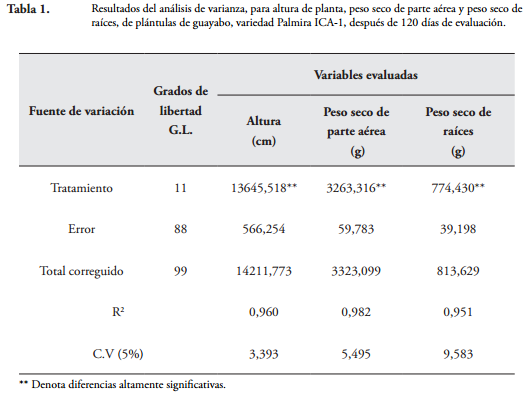
RESULTADOS Y DISCUSIÓNEfecto de los tratamientos en altura, peso seco de parte aérea y peso seco de raíces de las plántulas de guayabo. El análisis de varianza para las variables altura (cm), peso seco de parte aérea (g) y peso seco de raíces (g), mostró diferencias altamente significativas entre los tratamientos evaluados a los 120 días después de la siembra. Los altos coeficientes de determinación con R2 = 0,96, 0,98 y 0,95, respectivamente, y los bajos coeficientes de variación con C.V = 3,39, 5,49 y 9,58, respectivamente, demostraron la confiabilidad de los resultados obtenidos (Tabla 1).
Altura de las plántulas. Después de 120 días de evaluación, las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron la mayor altura con 62,8 cm, cuyo valor fue significativamente mayor (p = 0,05) en 4 cm a la alcanzada con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), en 12 cm a la obtenida tanto con P. chlamydosporia solo (1 x 109 esporas/ml) como con Carbofuran solo (500 ppm), en 21 cm a la producida con P. lilacinum solo (1 x 109 esporas/ml) y en 41 cm con el testigo nematodo (Tabla 2 y Figura 2). Del mismo modo, ZAKI & MAWBOOL (1998) reportaron que, después de 120 días de evaluación, plántulas de okra (Abelmoschus esculentus L.) que fueron inoculadas con 3.000 huevos y estados juveniles (J2) de M. javanica y tratadas con P. lilacinum (2 x 106 UFC/ml) en combinación con Carbofuran (11 mg de i.a./kg) en el momento de siembra, aumentaron su altura en 4 cm en comparación con el testigo nematodo, el cual obtuvo una altura de 29 cm. De estas evidencias, se deduce que algunas especies vegetales tales como el guayabo, variedad Palmira ICA-1 y la okra, las cuales son parasitadas por Meloidogyne spp., pueden alcanzar mayor altura si los hongos P. lilacinum, P. chlamydosporia y el nematicida Carbofuran se aplican de manera integrada que si se aplican por separado.
No obstante, las plántulas tratadas con la mezcla de P. lilacinum y P. chlamydosporia (1 x 108 esporas), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron la segunda mejor altura con 59,8 cm, la cual fue significativamente mayor (p = 0,05) en 7 cm a la conseguida tanto con P. chlamydosporia solo (1 x 109 esporas/ml) como con Carbofuran solo (500 ppm), y además fue significativamente mayor en 18 cm a la altura producida tanto con P. lilacinum solo (1 x 109 esporas/ml) como en el testigo nematodo el cual obtuvo una altura de 41 cm (Tabla 2 y Figura 2). De manera similar, RAO (2005) demostró que, luego de 150 días de evaluación, plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.) que fueron inoculadas con M. javanica y tratadas con la mezcla de P. lilacinum y P. chlamydosporia (2 x 106 UFC/ml) en el momento de siembra, aumentaron su altura en 9 cm en relación con el testigo nematodo, el cual tuvo una altura de 28,2 cm. El mismo autor también señaló que, cuando los hongos mencionados se aplicaron solos, las plántulas de lima ácida obtuvieron un aumento en la altura de 5 cm en comparación con el testigo nematodo. Estos resultados demostraron nuevamente que algunas especies vegetales como el guayabo Palmira ICA-1 y la lima ácida, las cuales son parasitadas por Meloidogyne spp., pueden obtener mayor altura cuando los hongos P. lilacinum y P. chlamydosporia son aplicados en mezcla, que cuando se aplican de manera individual.
Los resultados mencionados anteriormente, prueban que los tratamientos en los cuales P. lilacinum y P. chlamydosporia, se aplicaron en mezcla, causaron mayor altura en las plántulas; superando al testigo agua. Este resultado, se atribuye a la compatibilidad existente entre los hongos y las plantas, la cual aumentó la capacidad que tiene cada hongo para inducir la producción de ácido indolacético, una fitohormona (auxina) que contribuye en el crecimiento de los tejidos meristemáticos de la planta, como también incrementó su habilidad para solubilizar los fosfatos de calcio, el cual contribuye en la absorción de fósforo por las raíces en el suelo; siendo este último indispensable para la constitución celular y las reacciones bioquímicas de las plantas (VERA et al., 2002; CORREA, 2011; HERNÁNDEZ-LEAL et al., 2011).
En esta investigación, la estimulación del crecimiento en altura de las plántulas se manifestó inicialmente 30 días después de la primera aplicación de los tratamientos en mezcla, cuando las plántulas obtuvieron una altura de 19,5 cm, mayor en 4 cm al testigo agua y al testigo nematodo, y fue más evidente a partir de los 60 días (30 días después de la segunda aplicación) con la mezcla P. lilacinum y P. chlamydosporia combinada con Carbofuran, ya que las plántulas mostraron una altura mayor que las demás, con 42,8 cm (Tabla 2 y Figura 2).
Por otro lado, con P. chlamydosporia solo (1 x 109 esporas/ml), aplicado 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, las plántulas tuvieron una altura de 52,8 cm, la cual fue estadísticamente igual (p = 0,05) a la obtenida con Carbofuran solo (500 ppm), pero significativamente mayor (p = 0,05) en 10 cm a la alcanzada con P. lilacinum solo (1 x 109 esporas/ml) y en 11 cm al testigo nematodo (Tabla 2 y Figura 2). Un resultado similar fue obtenido por MUTHULAKSHMI et al. (2012), en plántulas de papa (Solanum tuberosum L.), las cuales fueron tratadas con P. chlamydosporia (10 kg/ha) después de ser inoculadas con G. rostochiensis en el momento de siembra. Los autores mencionan que, plántulas de papa tratadas con el hongo, aumentaron su altura en 7 cm en comparación con el testigo nematodo, el cual tuvo una altura de 25 cm. Estos resultados, prueban que P. chlamydosporia aplicado de manera individual puede aumentar la altura de algunas especies vegetales tales como la papa y el guayabo, variedad Palmira ICA-1, las cuales son generalmente afectadas por nematodos. Igualmente, los resultados de esta investigación demostraron que plántulas de guayabo, variedad Palmira ICA-1, afectadas por M. incognita y M. mayaguensis, pueden obtener la misma altura tanto con el hongo P. chlamydosporia como con el nematicida Carbofuran; sin embargo, el hongo, además de proporcionarle mayor altura a las plántulas, no causa efectos nocivos contra la salud humana, animal y ecosistemas (ATKINS et al., 2003; GARCÍA et al., 2004; MUTHULAKSHMI et al., 2012).
También, se encontró que las plántulas tratadas con P. lilacinum solo (1 x 109 esporas/ml), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días obtuvieron una altura de 42,4 cm, siendo de igual valor estadístico al testigo agua y al testigo nematodo (Tabla 1 y Figura 2). En consecuencia, se deduce que la concentración 1 x 109 esporas de P. lilacinum no produjo cambios en la altura de las plántulas de guayabo, variedad Palmira ICA-1, en presencia de las dos especies de Meloidogyne. Sin embargo, MUTKHTAR et al. (2013) demostraron que un aumento en la concentración de P. lilacinum, de 1 x 103 a 1 x 104 esporas/ml, fue suficiente para que plántulas de okra (Abelmoschus esculentus L.), que fueron inoculadas con 2.000 estados juveniles (J2) de M. incognita, obtuvieran un incremento en la altura de 13 cm, luego de 50 días de evaluación. Asimismo, KERRY (2000), RAO (2005), MUTKHTAR et al. (2013) y DALLEMOLE-GIARETTA et al. (2014) reportaron que la eficiencia del hongo P. lilacinum depende de la concentración aplicada. Por lo tanto, es probable que plántulas de guayabo, variedad Palmira ICA-1, establecidas en condiciones de almácigo, tengan un aumento en la altura si el hongo P. lilacinum se aplica a una concentración mayor que 1 x 109 esporas/ml.
De igual manera, en esta investigación se encontró que el testigo nematodo obtuvo una altura de 41,2 cm, cuyo valor no presentó diferencia estadística con el testigo agua (Tabla 2 y Figura 2) a los 120 días. Un resultado similar al encontrado aquí, fue reportado por ROSALES & SÚAREZ (2001) en plántulas de papaya (Carica papaya L.) inoculadas con M. incognita en condiciones de almácigo, las cuales después de 120 días tuvieron 34,2 cm de altura, sin diferencia estadística con la altura obtenida en el testigo agua. Lo mencionado anteriormente, permite deducir que Meloidogyne spp. no causa efecto en la variable altura de algunas especies vegetales tales como el guayabo, variedad Palmira ICA-1, y la papaya, bajo condiciones de almácigo, durante 120 días; sin embargo, lo más probable es que luego de este tiempo las diferencias en altura sean visibles, como lo encontraron DUQUE & GUZMÁN (2013) en plántulas de guayabo, variedad Palmira ICA-1, inoculadas con 10.000 huevos y estados juveniles (J2) de Meloidogyne spp., las cuales, después de 150 días, mostraron una altura inferior en 10 cm en comparación al testigo sin inocular, que obtuvo 56,8 cm. Asimismo, NIÑO et al. (2008) describen que plántulas de uchuva (Physalis peruviana L.), las cuales se inocularon con 1.000 estados juveniles (J2) de M. hapla/cm3 de suelo, únicamente manifestaron diferencias en altura en relación con el testigo absoluto, después de 250 días de inoculación con 1.000 J2 de M. hapla/cm3 de suelo.
Peso seco de parte aérea. Luego de 120 días de evaluación, se comprobó que las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron el mayor peso seco de parte aérea con 24,6 g, siendo significativamente mayor (p = 0,05) en 4 g al conseguido con la mezcla P. lilacinum y P. chlamydosporia (1 x 10 8 esporas/ml), en 10 g al obtenido con P. chlamydosporia (1 x 109 esporas/ml) o con Carbofuran (500 ppm), en 15 g al producido con P. lilacinum (1 x 109 esporas/ml) y en 15 g al testigo nematodo, el cual obtuvo un peso seco de parte aérea de 9,63 g (Tabla 2). Asimismo, ZAKI & MAWBOOL (1998) reportan que, luego de 120 días de evaluación, plántulas de okra (Abelmoschus esculentus L.), que fueron tratadas con P. lilacinum (2 x 106 UFC/g) en combinación con Carbofuran (11 mg de i.a./kg) después de ser inoculadas con M. javanica, obtuvieron un aumento en el peso seco de parte aérea de 4,2 g en comparación al testigo nematodo, el cual obtuvo un peso seco de parte aérea de 3,8 g. Los resultados anteriores, demostraron que la mezcla de P. lilacinum, P. chlamydosporia y Carbofuran son compatibles, y que su aplicación integrada en las raíces de plántulas de guayabo, variedad Palmira ICA-1, antes o después de la presencia de Meloidogyne spp., permitieron obtener mayores aumentos en el peso seco de parte aérea que cuando estos insumos se aplicaron de manera individual.
Por otro lado, las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml) 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis, y nuevamente tratadas a los 30 y 60 días, tuvieron un peso seco de parte aérea de 21,1 g, siendo significativamente mayor (p = 0,05) en 11 g del producido con P. lilacinum solo (1 x 109 esporas/ml), en 7 g del obtenido con P. chlamydosporia solo (1 x 109 esporas/ml) o con Carbofuran solo (500 ppm) y en 11 g al testigo nematodo, el cual obtuvo un peso seco de parte aérea de 9,63 g (Tabla 2). Del mismo modo, RAO (2005) encontró que, luego de 150 días de evaluación, plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.) inoculadas con M. javanica y tratadas con la mezcla de P. lilacinum y P. chlamydosporia (2 x 106 UFC/ml) en el momento de siembra, aumentaron el peso seco de parte aérea en 2,2 g en comparación al testigo nematodo, el cual tuvo 5,8 g. De esta manera, se demuestra que la aplicación en mezcla de los hongos P. lilacinum y P. chlamydosporia causa mayores aumentos en el peso seco de la parte aérea de algunas especies vegetales tales como el guayabo Palmira ICA-1 y la lima ácida, que cuando estos se aplican de manera individual.
En cuanto a las plántulas tratadas con P. chlamydosporia solo (1 x 109 esporas/ml), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, tuvieron un peso seco de la parte aérea de 15,5 g, siendo estadísticamente igual al conseguido con Carbofuran (500 ppm); y además, superior en 5 g al obtenido con P. lilacinum solo (1 x 109 esporas/ml) y al testigo nematodo, el cual obtuvo un peso seco de parte aérea de 9,63 g (Tabla 2). De igual manera, KHAN et al. (2012) reportaron que, luego de 120 días de evaluación, plántulas de berenjena (Solanum melongena L.) que fueron inoculadas con 1.500 estados juveniles (J2) de Meloidogyne spp., y tratadas con P. chlamydosporia (1 x 105 UFC/ml), obtuvieron un aumento en el peso seco de parte aérea de 4 g en relación con el testigo nematodo, el cual obtuvo un peso seco de parte aérea de 53,5 g. Estos resultados demostraron que, en condiciones de almácigo, la aplicación individual de P. chlamydosporia (1 x 109 esporas/ml) en raíces de plántulas de guayabo, variedad Palmira ICA-1, para el manejo de Meloidogyne spp., permite obtener mayor peso de parte aérea que la aplicación individual de P. lilacinum en la misma concentración. Asimismo, la aplicación del hongo mencionado, permitió obtener un peso seco aéreo estadísticamente igual al obtenido con Carbofuran en la concentración mayor (500 ppm).
Por el contrario, las plántulas de guayabo tratadas con P. lilacinum solo (1 x 109 esporas/ml), 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron un peso seco de parte aérea de 10,07 g, comportándose estadísticamente igual que el testigo nematodo y el testigo agua (Tabla 2); lo anterior, indica que P. lilacinum en la concentración de 1 x 109 esporas/ml no produjo cambios en el peso seco de la parte aérea de plántulas de guayabo, variedad Palmira ICA-1, como sí lo hizo P. chlamydosporia en la misma concentración; así, se demostró que para el peso seco de la parte aérea, P. chlamydosporia solo, en concentración 1 x 109 esporas/ml fue más efectivo que P. lilacinum solo, en la misma concentración. Sin embargo, MUTKHTAR et al. (2013) demostraron que en plántulas de okra (Abelmoschus esculentus L.) inoculadas con 2.000 estados juveniles (J2) de Meloidogyne incognita, un aumento en la concentración de P. lilacinum de 1 x 103 esporas a 1 x 104 esporas/ml, duplicó el peso seco de parte aérea a 8 g. Estos resultados, permiten deducir que P. lilacinum, aplicado en concentraciones mayores a 1 x 109 esporas/ml, podría aumentar el peso seco de la parte aérea de plántulas de guayabo, variedad Palmira ICA-1, que están parasitadas por M. incognita y M. mayaguensis.
Los resultados anteriores demostraron que, después de 120 días de evaluación, las mezclas P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) o P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), aplicadas en el plato de las plántulas de guayabo de la variedad Palmira ICA-1, 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicadas a los 30 y 60 días, proporcionaron mayores aumentos en el peso seco de la parte aérea que P. lilacinum solo (1 x 109 esporas/ml), P. chlamydosporia solo (1 x 109 esporas/ml) y Carbofuran (500 ppm) (Tabla 2). El efecto de aumento de peso seco de parte aérea causado por P. lilacinum y P. chlamydosporia en mezcla o en combinación con Carbofuran también ha sido reportado en plántulas de okra (Abelmoschus esculentus L.) y lima ácida (Citrus aurantifolia Christm. et Panz.) afectadas por Meloidogyne spp. (ZAKI & MAWBOOL, 1998; RAO, 2005).
Peso seco de raíces. Similar a lo ocurrido con los resultados de las variables altura de plántulas y peso seco de parte aérea y de raíces, se encontró que después de 120 días de evaluación, las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron el mayor peso seco de raíces con 12 g, cuyo valor fue significativamente mayor (p = 0,05) en 2 g al conseguido con la mezcla de P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), en 5 g al obtenido con P. chlamydosporia (1 x 109 esporas/ml) o con Carbofuran (500 ppm), en 7 g al obtenido con P. lilacinum (1 x 109 esporas/ml) y en 9 g en comparación con el testigo nematodo, el cual obtuvo un peso seco de 3,3 g (Tabla 2). Resultados similares fueron encontrados por REDDY & KHAN (1989) en plántulas de berenjena (Solanum melongena L.) tratadas con P. lilacinum (1 x 106 UFC/ml) en combinación con Carbofuran (1 kg de i.a./ha) 10 días antes de la siembra e inoculadas con 1.000 estados juveniles (J2) de Rotylenchulus reniformis. Estos autores mencionan que, luego de 120 días de evaluación, dichas plántulas tuvieron un aumento en el peso seco de raíces de 4 g en comparación con el testigo nematodo. Asimismo, REDDY & KHAN (1988) reportaron que plántulas de tomate (Solanum lycopersicum L.), que fueron tratadas antes de la siembra con P. lilacinum (1,2 x 108 esporas/g) en combinación con Carbofuran (2 kg de i.a./ha), y posteriormente inoculadas con 1.000 estados juveniles (J2) de Rotylenchulus reniformis, tuvieron un aumento en el peso seco de raíces de 1,2 g en comparación con el testigo nematodo, el cual obtuvo un peso seco de raíces de 1,3 g, después de 60 días de evaluación. Los anteriores resultados demostraron que los hongos P. lilacinum y P. chlamydosporia son compatibles con Carbofuran y que, aplicados de manera preventiva, aumentan el peso seco de raíces de especies vegetales tales como guayabo, variedad Palmira ICA-1, berenjena y tomate, las cuales son generalmente afectadas por nematodos.
Por otro lado, las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron un peso seco de raíces de 11 g, siendo significativamente menor (p = 0,05) en 1 g en comparación con el obtenido cuando la mezcla anterior se aplicó 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente se aplicó a los 30 y 60 días (Tabla 2). Estos resultados, demostraron que el peso seco de las raíces de guayabo, variedad Palmira ICA-1, estuvo influenciado por el tiempo de aplicación del tratamiento; por ello, hubo mayor peso seco de raíces de plántulas de guayabo, variedad Palmira ICA-1, cuando la mezcla de los dos hongos en combinación con Carbofuran se aplicó antes de la presencia de ambas especies de Meloidogyne, que cuando se aplicó después (Tabla 2). No obstante, es de resaltar que con la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), aplicada 8 días después de la inoculación de Meloidogyne spp. y nuevamente aplicada a los 30 y 60 días, se consiguió un peso seco de raíces mayor en 8 g al testigo nematodo, el cual obtuvo 3,3 g (Tabla 2). De igual manera, con el tratamiento antes mencionado, el peso seco de raíces de las plántulas de guayabo, variedad Palmira ICA-1, excedió en 1 g al producido con la mezcla de P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), en 4 g al obtenido con P. chlamydosporia (1 x 109 esporas/ml) o con Carbofuran (500 ppm), y en 6 g al logrado con P. lilacinum (1 x 109 esporas/ml), aplicados 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicados a los 30 y 60 días (Tabla 2). Los anteriores resultados demostraron que las raíces de guayabo, variedad Palmira ICA-1, pueden tener mayor peso seco con la aplicación preventiva de la mezcla de los hongos biocontroladores en combinación con Carbofuran, que cuando se aplican de manera individual.
En cuanto a las plántulas tratadas con la mezcla de P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml) 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron 10,0 g de peso seco de raíces; siendo significativamente mayor (p = 0,05) en 6,7 g al testigo nematodo que tuvo un peso seco de raíces de 3,3 g (Tabla 2). Asimismo, RAO (2005) señala que plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.) tratadas previamente con la mezcla de P. lilacinum y P. chlamydosporia (2 x 106 UFC/ml), e inoculadas en el momento de siembra con M. javanica, obtuvieron un aumento en el peso seco de raíces de 2,1 g en comparación con el testigo nematodo que tuvo 5,8 g, después de 150 días de evaluación. Estos resultados confirmaron lo propuesto por SOBITA & AVINASH (2010), quienes mencionan que los hongos P. lilacinum y P. chamydosporia aumentan el peso de las raíces de las plántulas cuando se aplican en mezcla, de manera preventiva. Cabe destacar que, en esta investigación, el peso seco de raíces logrado con dicha mezcla fue significativamente mayor (p = 0,05) que el alcanzado con los tratamientos individuales, excediendo en 3 g al obtenido con P. chlamydosporia (1 x 109 esporas) o con Carbofuran (500 ppm) y en 5 g al logrado con P. lilacinum (1 x 109 esporas) aplicados 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicados a los 30 y 60 días (Tabla 2).
También, se encontró que las plántulas tratadas con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron un peso seco de raíces de 8,0 g; siendo significativamente menor (p = 0,05) en 2 g al alcanzado con la misma mezcla de los hongos aplicada 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente aplicada a los 30 y 60 días (Tabla 2). Sin embargo, es de resaltar que con la mezcla mencionada, el peso seco de raíces de las plántulas de guayabo, variedad Palmira ICA-1, fue superior en 5 g al testigo nematodo y, además, excedió en 1 g al conseguido con P. chlamydosporia (1 x 109 esporas) o con Carbofuran (500 ppm), y en 3 g al obtenido con P. lilacinum (1 x 109 esporas) cuando se aplicaron 8 días antes de la inoculación de ambas especies de Meloidogyne y nuevamente se aplicaron a los 30 y 60 días (Tabla 2). Lo mencionado anteriormente, permite definir que después de la mezcla de P. lilacinum y P. chlamydosporia en combinación con Carbofuran, la mezcla de los hongos, sin el nematicida Carbofuran, también favoreció el peso seco de raíces de las plántulas de guayabo, variedad Palmira ICA-1, en comparación con los tratamientos en donde los hongos se aplicaron de manera individual. Asimismo, con los resultados antes mencionados, se encontró que cuando la mezcla P. lilacinum y P. chlamydosporia, se aplica antes de la presencia de M. incognita y M. mayaguensis, se obtiene mayor aumento en el peso seco de raíces de plántulas de guayabo variedad Palmira ICA-1, que cuando la misma mezcla se aplica después de la presencia de M. incognita y M. mayaguensis; en consecuencia, la aplicación preventiva de los hongos nematopatógenos P. lilacinum y P. chlamydosporia debe considerarse importante a la hora de realizar un plan de manejo de Meloidogyne spp.
Lo mencionado anteriormente, prueba que las plántulas tratadas de manera preventiva con P. lilacinum y P. chlamydosporia, solos, en mezcla o en combinación con Carbofuran, tuvieron mayor peso seco de raíces que las demás, incluyendo al testigo agua; esto se debe a que la estimulación en el crecimiento de las plantas, ocasionada por hongos P. chlamydosporia y P. lilacinum, debida a la producción de ácido indolacético, que contribuye en el crecimiento de los tejidos meristemáticos, no solo es en la variable altura, sino que también ha sido reportada para la variable peso seco de raíces de diferentes especies vegetales, como lo describen REDDY & KHAN (1989), RAO (2005), MACIÁ-VICENTE et al. (2009) y CORREA (2011) para cultivos de papa (Solanum tuberosum L.), cebada (Hordeum vulgare L.), berenjena (Solanum melongena L.), aguacate (Persea americana Mill.), tomate (Solanum lycopersicum L.) y lima acida (Citrus aurantifolia Christm. & Panzer.).
Por otra parte, las plántulas tratadas con P. chlamydosporia (1 x 109 esporas/ml) 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, tuvieron un peso seco de raíces de 6,8 g, el cual fue superior en 3,5 g al testigo nematodo (Tabla 2). Del mismo modo, KHAN et al. (2012) reportaron que plántulas de berenjena (Solanum melongena L.) tratadas con P. chlamydosporia (1 x 105 UFC/ml), 10 días antes de la siembra e inoculadas con 1.500 estados juveniles (J2) de Meloidogyne spp. en el momento de siembra, obtuvieron un aumento en el peso seco de raíces de 1 g, en relación con el testigo nematodo que tuvo 12,2 g. Asimismo, DHAWAN & SINGH (2009) mencionan que el hongo P. chlamydosporia (2,3 x 108 esporas/ml), aplicado como tratamiento preventivo en semillas de okra (Abelmoschus esculentus L.), fue suficiente para que después de 45 días las plántulas de okra, inoculadas con 2.250 huevos de M. incognita en el momento de siembra, obtuvieran un aumento en el peso seco de raíces de 0,6 g, el cual fue superior al testigo nematodo que obtuvo un peso seco de raíces de 2,1 g. Los resultados descritos anteriormente, demostraron que el hongo P. chlamydosporia, aplicado de manera individual y preventiva, es efectivo para aumentar el peso seco de las raíces de guayabo, variedad Palmira ICA-1, berenjena y okra parasitadas por Meloidogyne spp.
En la presente investigación, también se determinó que con P. chlamydosporia solo (1 x 109 esporas/ml), aplicado 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, el peso seco de las plántulas de guayabo, variedad Palmira ICA-1, superó en 2 g al conseguido con P. lilacinum (1 x 109 esporas/ml) y fue estadísticamente igual al conseguido con Carbofuran (500 ppm) (Tabla 2). Este resultado aclara que para la variable peso seco de raíces de guayabo, variedad Palmira ICA-1, el hongo P. chlamydosporia aplicado de manera preventiva, en la concentración de 1 x 109 esporas/ml, es mejor que P. lilacinum, aplicado en la misma concentración.
Adicionalmente, las plántulas en las que se aplicó P. chlamydosporia solo (1 x 109 esporas/ml), 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, tuvieron un peso seco de raíces de 5,6 g, el cual fue superior en 2,3 g al testigo nematodo. Si bien, el peso seco de raíces obtenido con dicho tratamiento fue significativamente menor (p = 0,05) en 1,2 g al alcanzado cuando el hongo fue aplicado 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente a los 30 y 60 días, este fue significativamente mayor (p = 0,05) en 1 g al conseguido con P. lilacinum (1 x 109 esporas/ml) (Tabla 2).
Del mismo modo, las plántulas tratadas con P. lilacinum solo (1 x 109 esporas/ml), 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días obtuvieron un peso seco de raíces de 4,78 g, cuyo valor excedió en 1,4 g al testigo nematodo (Tabla 2). Dicho aumento fue similar al encontrado por MOHAMEND (2013) en plántulas de tomate (Solanum lycopersicum L.) que fueron tratadas previamente con P. lilacinum (1 x 108 UFC/g), y posteriormente inoculadas con 5.000 huevos de Meloidogyne spp./planta. El autor menciona que las plántulas de tomate tuvieron un aumento en el peso seco de raíces de 1 g en relación con el testigo nematodo que obtuvo un peso seco de raíces de 3,60 g.
En cuanto a las plántulas tratadas con P. lilacinum solo (1 x 109 esporas/ml), 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente tratadas a los 30 y 60 días, obtuvieron un peso seco de raíces de 4,0 g, el cual fue superior en 0,7 g al testigo nematodo (Tabla 2). Sin embargo, este aumento fue significativamente menor (p = 0,05) en 0,7 g en relación con el logrado cuando P. lilacinum solo (1 x 109 esporas/ml) se aplicó 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente se aplicó a los 30 y 60 días (Tabla 2). Los resultados antes mencionados, demostraron que la aplicación de P. lilacinum de manera preventiva en la zona radical de las plántulas de guayabo variedad Palmira ICA-1, permitió obtener mayor peso seco de raíces que cuando el mismo hongo se aplicó luego de la presencia de ambas especies de Meloidogyne. Asimismo, se probó que la aplicación de P. lilacinum, antes de la presencia de los fitonematodos, ayudó a que las plántulas de guayabo, variedad Palmira ICA-1 en almácigo, obtuvieran un peso seco de raíces estadísticamente igual (p = 0,05) al obtenido en plántulas en las cuales los fitonematodos no estuvieron presentes (testigo agua) (Tabla 2).


Se demostró que los tratamientos con P. lilacinum y P. chlamydosporia aplicados en la zona radical de las plántulas de guayabo, variedad Palmira ICA-1, 8 días antes de la inoculación de M. incognita y M. mayaguensis, aumentaron en mayor medida el peso seco de las raíces que cuando estos se aplicaron 8 días después de la inoculación de los fitonematodos y nuevamente se aplicaron a los 30 y 60 días (Tabla 2). En consecuencia, la acción preventiva de los hongos P. lilacinum y P. chlamydosporia resultó favorable para el peso seco de las raíces de guayabo, variedad Palmira ICA-1, hecho que también ha sido demostrado con otras especies vegetales tales como berenjena (Solanum melongena L.), tomate (Solanum lycopersicum L.), lima ácida (Citrus aurantifolia Christm. et Panz.), okra (Abelmoschus esculentus L.) y tomate (Solanum lycopersicum L.) (REDDY & KHAN, 1988, 1989; RAO, 2005; DHAWAN & SINGH, 2009; KHAN et al., 2012; MOHAMEND, 2013).
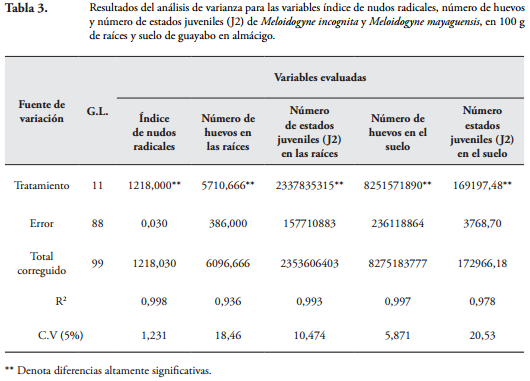
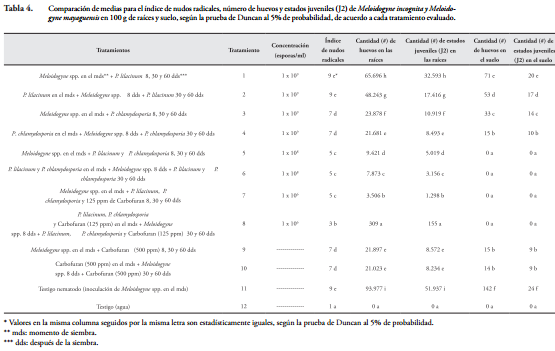
Efecto de los tratamientos sobre la población y el daño ocasionado por M. incognita y M. mayaguensis. El análisis de varianza realizado a las variables índice de nudos radicales, número de huevos y número de estados juveniles (J2) de M. incognita y M. mayaguensis, en 100 g de raíces y suelo de guayabo en almácigo, mostró diferencias estadísticas altamente significativas entre los tratamientos. Los altos coeficientes de determinación con R2 = 0,99, 0,93, 0,99, 0,99 y 0,97, respectivamente y los bajos coeficientes de variación con C.V = 1,2, 18,4, 10,4, 5,8 y 20,5%, respectivamente, mostraron la confiabilidad de los resultados obtenidos (Tabla 3).
Índice de nudos radicales. En las raíces de las plántulas de guayabo a los 120 días de evaluación, se comprobó que la mezcla P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), aplicada 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días, redujo significativamente el índice de nudos radicales a 3, en comparación con el testigo nematodo que alcanzó un índice de 9, cuyo valor es el más alto en la escala de evaluación de daños causados por el nematodo del nudo radical, propuesta por CASTAÑO-ZAPATA (1989) (Tabla 4 y Figura 3). Una reducción similar, a la encontrada aquí, fue reportada por RAMAKRISHNAN & PANDURANGA (2013), con la combinación de P. lilacinum (30 g/m2) y Carbofuran (10 g/m2), aplicada en plántulas de tabaco (Nicotiana tabacum L.), 5 días antes de la inoculación de M. incognita, bajo invernadero. Los autores mencionan que dicha combinación redujo el índice de nudos radicales a 1,81, en comparación con el testigo nematodo que obtuvo un índice de nudos radicales de 3,86. Asimismo, ZAKI & MAWBOOL (1998) reportan que la combinación de P. chlamydosporia (2 x 106 UFC/g) y Carbofuran (11 mg de i.a./kg), aplicada preventivamente en plántulas de okra (Abelmoschus esculentus L.), las cuales fueron inoculadas con M. javanica, redujo el índice de nudos radicales a 2,8, en relación con el testigo nematodo que tuvo un índice de nudos radicales de 4,5, luego de 120 días de evaluación. Estos resultados comprueban que la aplicación preventiva de los hongos P. lilacinum y P. chlamydosporia en combinación con Carbofuran reducen el daño ocasionado por Meloidogyne spp. en las raíces de especies vegetales tales como guayabo variedad Palmira ICA-1, tabaco y okra, lo cual permite que el sistema radical de dichas especies tenga una mejor absorción de agua y nutrientes, importantes para su desarrollo y producción.
De manera similar, cuando la mezcla de P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) se aplicó en las plántulas de guayabo, a los 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente se aplicó a los 30 y 60 días, se obtuvo un índice de nudos radicales de 5, cuyo valor fue significativamente mayor (p = 0,05) en 2 grados al obtenido con la aplicación de estos mismos insumos 8 días antes de la inoculación de Meloidogyne (Tabla 4 y Figura 3). Estos resultados demostraron que la aplicación preventiva de la mezcla de P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) disminuyó el daño ocasionado por M. incognita y M. mayaguensis, que la aplicación de la mezcla después de la presencia de los fitonematodos. No obstante, es de resaltar que la mezcla de P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) aplicada 8 días después de la inoculación de las especies de Meloidogyne y nuevamente aplicada a los 30 y 60 días, proporcionó un índice de nudos radicales de 5, el cual fue significativamente menor en cuatro grados al obtenido en el testigo nematodo, siendo además estadísticamente igual al índice alcanzado con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml) aplicada antes o después de la presencia de ambas especies de Meloidogyne (Tabla 4 y Figura 3).
Por otra parte, con P. chlamydosporia (1 x 109 esporas/ml), aplicado en las plántulas de guayabo a los 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, se obtuvo un índice de nudos radicales de 7, el cual fue significativamente menor (p = 0,05) en 2 grados al encontrado en el testigo nematodo (Tabla 4 y Figura 3). De modo similar, RAO (2005) demostró que luego de 150 días de evaluación, P. chlamydosporia (2 x 106 UFC/ml) aplicado en plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.) que fueron inoculadas con M. javanica en el momento de la siembra, redujo el índice de nudos radicales a 5, en comparación con testigo nematodo que obtuvo un índice de 8. Por consiguiente, el hongo P. chlamydosporia, aplicado de manera individual, antes o después de la presencia de las dos especies de Meloidogyne, disminuye los nudos radicales de plántulas de guayabo, variedad Palmira ICA-1 y de lima ácida, ocasionados por M. incognita y M. mayaguensis. En esta investigación tanto con P. chlamydosporia (1 x 109 esporas/ml) como con Carbofuran (500 ppm), aplicados en las plántulas de guayabo a los 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicados a los 30 y 60 días, se obtuvo un índice de nudos radicales de 7, con una reducción de 2 grados en comparación con el testigo nematodo (Tabla 4 y Figura 3); sin embargo, P. chlamydosporia, además de disminuir el índice de daño ocasionado por Meloidogyne spp., es capaz de colonizar la rizosfera de las plántulas infestadas y de persistir en el suelo por más de dos meses luego de ser aplicado (ARÉVALO et al., 2012).
Aunque con P. lilacinum (1 x 109 esporas/ml), aplicado en las plántulas de guayabo a los 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, se obtuvo un índice de nudos radicales de 9, que fue igual al que se produjo en el testigo nematodo, generalmente las raíces de las plántulas tratadas con el hongo tenían entre 40 y 60 nudos, mientras que las raíces del testigo nematodo entre 100 y 200 nudos (Tabla 4 y Figura 2). En contraste, el testigo agua, que presentó un índice de 1, demostró que no hubo nudos radicales, puesto que las especies de Meloidogyne no estuvieron presentes (Tabla 4 y Figura 3).


Se comprobó que, a excepción de P. lilacinum solo (1 x 109 esporas) aplicado 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, todos los tratamientos disminuyeron el índice de nudos radicales, no obstante, la mayor reducción se obtuvo con la mezcla de P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm) aplicada 8 días antes de la inoculación de ambas especies de Meloidogyne y nuevamente aplicada a los 30 y 60 días (Tabla 4 y Figura 3). Asimismo, reducciones del daño ocasionado por Meloidogyne spp., conseguidas con la aplicación preventiva de los hongos P. lilacinum y P. chlamydosporia, en mezcla y en combinación con Carbofuran, también han sido demostradas en otras especies vegetales tales como tabaco (Nicotiana tabacum L.), okra (Abelmoschus esculentus L.) y lima ácida (Citrus aurantifolia Christm. et Panz.) (ZAKI & MAWBOOL, 1998; RAO, 2005; RAMAKRISHNAN & PANDURANGA, 2013).

Población de M. incognita y M. mayaguensis en las raíces. Luego de 120 días de evaluación, se comprobó que la mezcla P. lilacinum y P. chlamydosporia, (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), aplicada 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días en las plántulas de guayabo, fue el mejor tratamiento para disminuir su población, ya que se obtuvieron 309 huevos y 155 estados juveniles (J2) de las dos especies de Meloidogyne en 100 g de raíces de guayabo variedad Palmira ICA-1, cuyos valores fueron significativamente menores en 25 y 20 veces que los obtenidas con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), 70 y 54 veces que las conseguidas con P. chlamydosporia solo (1 x 109 esporas/ml) o con Carbofuran solo (500 ppm) y 156 y 112 veces que las alcanzadas con P. lilacinum (1 x 109 esporas/ml), respectivamente; siendo, además, estadísticamente iguales al testigo agua, en donde las especies de Meloidogyne no estuvieron presentes (Tabla 4). Es de resaltar que con la mezcla P. lilacinum y P. chlamydosporia, (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), aplicada 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días en las plántulas de guayabo, se obtuvieron las mayores reducciones de huevos y de estados juveniles (J2) de los fitonematodos con 99,6% y 99,7%, respectivamente, en comparación con el testigo nematodo que obtuvo 93.977 huevos y 51.937 estados juveniles (J2) de las dos especies de Meloidogyne. Una reducción similar a la encontrada aquí para los estados juveniles (J2) de M. incognita y M. mayaguensis fue reportada por DHAWAN & SINGH (2009), quienes mencionan que P. chamydosporia (5 kg/ha) en combinación con Carbofuran (2 kg de i.a./ha), aplicados de manera preventiva en raíces de okra (Abelmoschus esculentus L.), que fueron inoculadas con M. incognita en el momento de siembra, redujeron el 81% de estados juveniles (J2) del fitonematodo, luego de 90 días de evaluación.
Por otro lado, cuando la mezcla P. lilacinum y P. chlamydosporia, (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), se aplicó 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente se aplicó a los 30 y 60 días en las plántulas de guayabo, redujo en las raíces el 96,2% de los huevos y el 97,5% de los estados juveniles (J2) de ambas especies de Meloidogyne en comparación con el testigo nematodo que obtuvo 93.977 huevos y 51.937 estados juveniles (J2)/100 g de raíces de las dos especies mencionadas (Tabla 4). Los resultados anteriores demostraron que los hongos P. lilacinum y P. chlamydosporia son compatibles con Carbofuran y que su aplicación preventiva en raíces de guayabo, variedad Palmira ICA-1, causó la mayor reducción poblacional de M. incognita y M. mayaguensis que su aplicación después de la presencia de ambas especies de Meloidogyne.
Se encontró que la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), aplicada 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días en las plántulas de guayabo, redujo considerablemente la población de las dos especies de Meloidogyne, disminuyendo el 91,6% de sus huevos y el 93,9% de sus estados juveniles (J2), en comparación con el testigo nematodo que obtuvo 93.977 huevos y 51.937 estados juveniles (J2)/100 g de raíces de ambas especies de Meloidogyne (Tabla 4). La reducción de los estados juveniles (J2) de M. incognita y M. mayaguensis, encontrada aquí, fue más alta que la reportada por RAO (2005) en plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.) con la mezcla P. lilacinum y P. chlamydosporia (2 x 106 UFC/ml), aplicada 10 días antes de la inoculación con M. javanica. El autor menciona que, después de 150 días de evaluación, la mezcla de los dos hongos redujo en las raíces el 49% de sus estados juveniles (J2), en comparación con el testigo nematodo que obtuvo 960 estados juveniles (J2) de M. javanica/100 g de raíces.
También, se encontró que las reducciones de 91,6% de huevos y 93,9% de los estados juveniles (J2) de M. incognita y M. mayaguensis, obtenidas con la mezcla P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), cuando esta se aplicó 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente se aplicó a los 30 y 60 días en las plántulas de guayabo, fueron estadísticamente mayores (p = 0,05) que cuando se aplicaron de manera individual, disminuyendo el número de huevos y de estados juveniles (J2) de las dos especies de nematodos de la siguiente manera: 3 y 2 veces más que P. chlamydosporia (1 x 109 esporas/ml) o que Carbofuran (500 ppm), y 6 y 5 veces más que P. lilacinum (1 x 109 esporas/ml).
Asimismo, las reducciones mencionadas, fueron mayores que las encontradas con la misma mezcla pero aplicada 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días, la cual redujo el 89,9% de sus huevos, y el 90,3% de sus estados juveniles (J2) en las raíces, en relación con el testigo nematodo que presentó 93.977 huevos y 51.937 estados juveniles (J2)/100 g de raíces de ambas especies de Meloidogyne (Tabla 4).
Por otro lado, la aplicación de P. chlamydosporia (1 x 109 esporas), 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicada a los 30 y 60 días en las plántulas de guayabo, redujo en las raíces el 76,9% de los huevos, y el 83,6% de los estados juveniles (J2) de ambas especies de Meloidogyne en comparación con el testigo nematodo que presentó 93.977 huevos y 51.937 estados juveniles (J2)/100 g de raíces de las dos especies de Meloidogyne. Es de destacar que las reducciones, mencionadas aquí, fueron estadísticamente iguales a las obtenidas con el agroquímico (Carbofuran) (Tabla 4). De manera similar, la reducción en los huevos de las especies de Meloidogyne, encontrada en esta investigación con P. chlamydosporia, fue similar a la reportada por DALLEMOLE-GIARETTA et al. (2014), quien señaló que la incorporación preventiva de 3 g de sustrato de arroz colonizado por P. chlamydosporia/kg de suelo, en plántulas de tomate (Solanum lycopersicum L.) inoculadas con M. javanica, redujo el 72,83% de los huevos, en comparación con el testigo nematodo que obtuvo 89.039 huevos de M. javanica/100 g de raíces.
Se comprobó que las reducciones de huevos y estados juveniles (J2) de M. incognita y M. mayaguensis en 76,9% y 83,6%, respectivamente obtenidas con P. chlamydosporia (1 x 109 esporas) aplicado 8 días antes de la inoculación de las dos especies de Meloidogyne y nuevamente aplicado a los 30 y 60 días en las plántulas de guayabo, fueron estadísticamente mayores (p = 0,05) que las conseguidas con P. lilacinum (1 x 109 esporas/ ml), ya que redujo 2 veces más el número de huevos y estados juveniles (J2) de las dos especies mencionadas. Además, dichas reducciones también fueron mayores que las alcanzadas con P. chlamydosporia (1 x 109 esporas) aplicado 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, que redujo el 74,5% de los huevos, y el 78,9% de los estados juveniles (J2) de las dos especies de nematodos (Tabla 4). Este resultado comprobó que la aplicación preventiva del hongo P. chlamydosporia (1 x 109 esporas/ ml) tuvo mayor efecto biocontrolador de M. incognita y M. mayaguensis que cuando se aplicó después de la presencia de ambas especies. Estos resultados, también, permiten aclarar que cuando los hongos P. lilacinum y P. chlamydosporia se aplicaron solos, en la misma concentración (1 x 109 esporas/ ml), P. chlamydosporia proporcionó mejores reducciones en la población de M. incognita y M. mayaguensis que P. lilacinum. Es probable que este resultado sea consecuencia del potencial que tiene P. chlamydosporia para producir dictioclamidosporas, las cuales son estructuras de resistencia del hongo que le permiten sobrevivir, emitir micelio, colonizar la rizosfera y proliferar en el suelo (LEGUIZAMÓN, 1994; FLORES et al., 2008; HERNÁNDEZ & DÍAZ, 2008).
De esta manera, P. lilacinum (1 x 109 esporas/ml), aplicado 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días en las plántulas de guayabo, redujo el 48,67% de los huevos y el 66,47% de los estados juveniles (J2) de ambas especies de Meloidogyne en comparación con el testigo nematodo, que obtuvo 93.977 huevos y 51.937 estados juveniles (J2)/100 g de raíces de las dos especies de nematodos. Las reducciones encontradas con este bioinsumo fueron mayores a las alcanzadas con P. lilacinum (1 x 109 esporas/ml), aplicado 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días, el cual redujo el 30,0% de los huevos, y el 37,2% de los estados juveniles (J2) de ambas especies de Meloidogyne (Tabla 4).
Después de 120 días de evaluación, se comprobó que cuando los hongos P. lilacinum y P. chlamydosporia, se aplicaron, en mezcla o en combinación con Carbofuran, en la zona radical de las plántulas de guayabo, variedad Palmira ICA-1, 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente se aplicaron a los 30 y 60 días, fueron más efectivos para reducir las dos especies de nematodos que cuando los mismos hongos se aplicaron a los 8 días después de la inoculación de ambas especies de Meloidogyne y nuevamente se aplicaron a los 30 y 60 días. Estos resultados positivos de la aplicación de los hongos de manera preventiva, también se han reportado en especies vegetales tales como okra (Abelmoschus esculentus L.), lima ácida (Citrus aurantifolia Christm. et Panz.), café (Coffea arabica L.) y tomate (Solanum lycopersicum L.), causando reducciones entre 49 % y 81% de la población de Meloidogyne spp. (RAO, 2005; DHAWAN & SINGH, 2009; CASTRO & RIVILLAS, 2011; DALLEMOLE-GIARETTA et al., 2014).
Población de M. incognita y M. mayaguensis en el suelo. Se probó que las mezclas P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), y P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), aplicadas 8 días antes u 8 días después de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicadas en las plántulas de guayabo a los 30 y 60 días tuvieron mayor efecto que los demás tratamientos, debido a que redujeron 100% la población de las dos especies de nematodos en el suelo en comparación con el testigo nematodo que obtuvo 142 huevos y 24 estados juveniles (J2) de M. incognita y M. mayaguensis/100 g de suelo. Por este motivo, luego de 120 días de evaluación, en las muestras de suelo donde se aplicaron dichas mezclas, no se encontraron huevos o estados juveniles (J2) de las dos especies de Meloidogyne, de igual manera a como ocurrió en el testigo agua (Tabla 4).
La reducción obtenida con las mezclas mencionadas anteriormente, fue mayor que la encontrada por MUTHULAKSHMI et al. (2012), quienes demostraron que el tratamiento de P. chlamydosporia (10 kg/ha) combinado con Carbofuran (2 kg de i.a./ha) y en mezcla con la bacteria Pseudomonas fluorescens Migula (10 kg/ha) y el hongo Trichoderma viride Pers. (10 kg/ha), disminuyó el 63,7% de los huevos y 75,8% de los quistes de Globodera rostochiensis, en el suelo de plántulas de papa (Solanum tuberosum L.), en comparación con el testigo nematodo que obtuvo 10.600 huevos y 179 quistes de G. rostochiensis/100 g de suelo (Tabla 4). La reducción de 100% de las dos especies de Meloidogyne encontrada con las mezclas mencionadas, también fue mayor que la reportada por RAO (2005), quien menciona que luego de 150 días de evaluación, la mezcla de P. lilacinum y P. chlamydosporia (2 x 106 UFC/ml) aplicada en plántulas de lima ácida (Citrus aurantifolia Christm. et Panz.), inoculadas con M. javanica, disminuyó el 62% de los estados juveniles (J2) en el suelo, en comparación al testigo nematodo que obtuvo 459 huevos y 134 estados juveniles (J2) de M. javanica/100 g de suelo.
El hongo P. chlamydosporia (1 x 109 esporas/ml), aplicado 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado a los 30 y 60 días en las plántulas de guayabo, redujo el 89,4% de los huevos y el 58,3% de los estados juveniles (J2) de ambas especies de Meloidogyne en comparación con el testigo nematodo. En cambio, cuando el mismo hongo se aplicó 8 días después de la inoculación de las dos especies de Meloidogyne y nuevamente se aplicó a los 30 y 60 días, se obtuvieron reducciones de 76,7% y 41,6%, respectivamente, en comparación al testigo nematodo; sin embargo, es de destacar que sus valores fueron estadísticamente iguales a los producidos con Carbofuran (500 ppm) (Tabla 4). Una reducción similar en los huevos de M. incognita y M. mayaguensis, encontrada con este tratamiento, fue reportada por CRUZ (2007), quien menciona que, bajo condiciones de campo, la aplicación de P. chamydoporia (3 x 109 esporas/ml) en el momento de siembra de okra (Abelmoschus esculentus L.), disminuyó el 76% los huevos de Meloidogyne spp. en el suelo (Tabla 4).
Por otro lado, P. lilacinum (1 x 109 esporas/ml), aplicado 8 días antes de la inoculación de M. incognita y M. mayaguensis y nuevamente aplicado en el plato de las plántulas de guayabo a los 30 y 60 días, redujo el 62,68% de los huevos y el 29,17% de estados juveniles (J2) de las dos especies de nematodos, con valores estadísticamente mayores (p = 0,05) que los obtenidos con P. lilacinum aplicado en la misma concentración 8 días después la inoculación de las dos especies de Meloidogyne y nuevamente aplicado a los 30 y 60 días, que redujo 50,0% de los huevos y 16,6% de sus estados juveniles (J2) en comparación con el testigo nematodo (Tabla 4). En contraste, en el testigo nematodo se obtuvo el mayor número de huevos con 142/100 g de suelo y el mayor número de estados juveniles (J2) de M. incognita y M. mayaguensis con 24/100 g de suelo y en el testigo agua no estuvieron presentes (Tabla 4). Las menores cantidades de ambas especies de Meloidogyne en el suelo, también pueden explicarse debido al hábito alimenticio de estos nematodos fitoparásitos, los cuales se caracterizan por ser endoparásitos sedentarios; por consiguiente, una vez ha alcanzado un sitio de alimentación fijo en las raíces, se tornan inmóviles y adquieren una forma abultada para formar y depositar los huevos en su interior (JEPSON, 1987; CROW & DUNN, 2005; PERRY et al., 2009; GUZMÁN et al., 2012).
Los resultados mencionados anteriormente, permitieron comprobar que los tratamientos con P. lilacinum y P. chlamydosporia, aplicados en la zona radical de las plántulas de guayabo, variedad Palmira ICA-1, contribuyeron en la reducción de M. incognita y M. mayaguensis en el suelo. Siendo las mezclas P. lilacinum y P. chlamydosporia (1 x 106 esporas/ml) en combinación con Carbofuran (125 ppm), y P. lilacinum y P. chlamydosporia (1 x 108 esporas/ml), las que mantuvieron el suelo libre de los fitonematodos.
CONCLUSIONESEl sistema radical de guayabo, variedad Palmira ICA1, inoculado tres veces con los hongos Purpureocillium lilacinum, cepa Jl-1, y Pochonia chlamydosporia, cepa Jl-1, en mezcla o en combinación con Carbofuran, antes y después de la presencia de Meloidogyne incognita y Meloidogyne mayaguensis, redujeron el 96% de estos nematodos y disminuyeron el índice de nudos radicales, constituyendose en una alternativa de manejo integrado del nematodo del nudo radical, basada en el uso racional de los insumos biológicos y químicos.
La inoculación de los hongos Purpureocillium lilacinum, cepa Jl-1, y Pochonia chlamydosporia, cepa Jl-1, en mezcla o en combinación con Carbofuran, en el sistema radical de guayabo, variedad Palmira ICA-1, antes o después de la presencia de Meloidogyne incognita y Meloidogyne mayaguensis, estimuló el crecimiento de las plántulas, ocasionando aumentos hasta del doble en altura y peso seco de la parte aérea; y cuando esta inoculación se realizó antes de la presencia de las dos especies de nematodos, el peso seco de raíces se incrementó tres veces en comparación con el testigo nematodo.
Los hongos Purpureocillium lilacinum, cepa Pl-11, y Pochonia chlamydosporia var. canetulata, cepa Jl-1, solos o en mezcla, en condiciones de almácigo, confirmaron su alto potencial infectivo en el control de M. incognita y M. mayaguensis, por lo cual se promueve su uso en condiciones de almácigo y de campo dentro de un programa de manejo integrado de Meloidogyne spp. como una alternativa ambientalmente segura, económica, accesible y de fácil aplicación.
AGRADECIMIENTOSA la Corporación Laverlam International, por el aporte de las formulaciones de los hongos controladores de fitonematodos y por el apoyo económico para poder realizar esta investigación. Igualmente, a la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas, por la co-financiación de esta investigación. A Jorge Elías Toro Alzate, por su colaboración en la propagación de guayabo, variedad Palmira ICA-1, en el invernadero del Jardín Botánico de la Universidad de Caldas.
AGRIOS, G.N., 2005.- Plant pathology. 5 ed. Elsevier Academic Press, Nueva York. [ Links ]
ARAYA, M., CENTENO, M. & CARRILLO, W., 1995.- Densidad poblacional y frecuencia de los nematodos parásitos de banano (Musa AAA) en nueve cantones de Costa Rica. Corbana, 20 (43): 6-11. [ Links ]
ARÉVALO, J., SILVA, S.D., CARNEIRO, M., LOPES, R.B., CARNEIRO, R., TIGANO, M.S. & HIDALGO-DÍAZ, L., 2012.- Pochonia chlamydosporia (Goddard) Zare y Gams como potencial agente de control biológico de Meloidogyne enterolobii (Yang y Eisenback) en cultivos hortícolas. Rev. Protección Veg., 27 (2). Recuperado de http://scielo.sld.cu/scielo.php?script [ Links ]
ARUMUGAM, K., RAMALINGAM, P. & APPU, M., 2013.- Isolation of Trichoderma Viride and Pseudomonas Fluorescens organism from soil and their treatment against rice pathogens. Journal of Microbiology and Biotechnology Research, 3 (6): 77-81. Recuperado de http://scholarsresearchlibrary.com [ Links ]
ATKINS, S.D., HIDALGO, L., KALISZ, H., MUCHLINE, T.H., HIRSCH, P.R. & KERRY, B.R., 2003.- Development of a new management strategy for the control of root-knot nematodes (Meloidogyne spp.) in organic vegetable production. Pest Manag. Sci., 59: 183-189. [ Links ]
BARBOSA, D.H., VIERA, H.D., SOUZA, R.M., VIANA, A.P. & SILVA, C.P., 2004.- Field estimates of coffe yield losses and damage threshold by Meloidogyne exigua. Nematologia Brasileira, 28 (1): 49-54. [ Links ]
BOLAÑOS, M., GÓMEZ, J.M., MELO, J.P. & CAMPO, E.J., 2007.- Evaluación de prácticas de manejo de nematodos parásitos en cultivos de guayabo en el Valle del Cauca. Plegable divulgativo, noviembre de 2007. [ Links ]
CARDONA, N.L. & LEGUIZAMÓN, J.E., 1997.- Aislamiento y patogenicidad de hongos y bacterias al nematodo del nudo radical del café Meloidogyne spp. Goeldi. Fitopatología Colombiana, 21 (1): 39-52. [ Links ]
CASTAÑO-ZAPATA, J., 1989.- Estandarización de la estimación de daños causados por hongos, bacterias y nematodos en fríjol (Phaseolus vulgaris L.). Fitopatología Colombiana, 13 (1): 9-19. [ Links ]
CASTRO, A.M. & RIVILLAS, C.A., 2011.- Protección biológica de raíces de café contra el complejo de nematodo nodulador M. incognita + M. javanica en condiciones de almácigo. Fitopatología Colombiana, 35 (1). [ Links ]
CORREA, G.P., 2011.- Evaluación de la capacidad promotora del crecimiento de microorganismos extraidos de suelos supresivos sobre plántulas de tomate (Solanum lycopersicum) y su influencia en la calidad de plántula: Trabajo monográfico, Escuela Superior de Ingeniería, Almería. [ Links ]
COYNE, D.L. & TALWANA, L.A.H., 2000.- Reaction of cassava cultivars to root-knot nematodes (Meloidogyne spp.) in pot experiment and farmer-managed field trials in Uganda. International Journal of Nematology, 10: 153-158. [ Links ]
CROW, W. & DUNN, R., 2005.- Introduction to plant nematology. Plant Parasitic Nematodes. Department of Entomology and Nematology, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. http://edis.ifas.ufl.edu [ Links ]
CRUZ, S.A., 2007.- Control del nematodo nodulador de raíz (Meloidogyne spp.) en el cultivo de okra americana (Abelmoschus esculentus) con Micorriza Vesiculo Arbuscular (VAM), Trichoderma harzianum, Paecilomyces lilacinus, Pochonia chlamydosporia y Marigold (Tagetes erecta). Proyecto especial presentado como requisito parcial para optar el título de Ingeniero Agrónomo en el grado Académico de Licenciatura, Zamorano-Honduras. [ Links ]
DALLEMOLE-GIARETTA, R., GRASSI, L., DEBORAH, M.X., FALCÃO, Z.R., FERRAZ, S. & LOPES, E.A., 2014.- Incorporação ao solo de substrato contendo micélio e conídios de Pochonia chlamydosporia para o manejo de Meloidogyne javanica. Cienc. Rural, 44 (4). Recuperado de http://www.scielo.br/scielo.php?pid [ Links ]
DANE (DEPARTAMENTO ADMINISTRATIVO NACIONAL DE ESTADÍSTICA), 2011.- Resultados Encuesta Nacional Agropecuaria ENA. Bogotá [ Links ].
DÁVILA, M., ACOSTA, N., BETANCOURT, C. & NEGRÓN, J., 1999.- Capacidad quitinolítica de hongos aislados de suelos agrícolas infestados con el nematodo nodulador (Meloidogyne spp.) en Puerto Rico. J. Agric. Univ. P.R., 83 (3-4): 189-199. [ Links ]
DE WAELE, D.D. & DAVIDE, R.G., 1998.- Nematodos noduladores de las raíces del banano. Plagas de Musa. Hoja divulgativa No. 3. Inibap, Colombia. [ Links ]
DHAWAN, S.C. & SINGH, S., 2009.- Compatibility of Pochonia chlamydosporia with nematicide and neem cake against root knot nematode, Meloidogyne incognita infesting okra. Indian Journal of Nematology, 39: 85-89. [ Links ]
DUQUE, A. & GUZMÁN, O.A., 2013.- Comportamiento de materiales de guayabo (Psidium guajava Linneo) al parasitismo del nematodo formador de agallas [Meloidogyne incognita (Kofoid & White) Chitwood y Meloidogyne javanica (Treub) Chitwood]. Revita Luna Azul, 37: 130-154. [ Links ]
EISENBACK, J.D., 1985.- Detailed morphology and anatomy of second-stage juveniles, males, and females of the genus Meloidogyne (root-knot nematodes) (en) SASSER, J.N. & CARTER, C.C. (eds.) An Advanced Treatise on Meloidogyne. Volume I. Biology and Control. A cooperative publication of the Department of Plant Pathology and the United States Agency for International Development, North Carolina State University Graphics, Raleigh, North Carolina. [ Links ]
ESFAHANI, N.M. & POUR, A.B., 2006.- The effects of Paecilomyces lilacinus on the Pathogenesis of Meloidogyne javanica and Tomato Plant Growth parameters. Iran Agricultural Research, 24 (2): 67-76. [ Links ]
FAO (ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA ALIMENTACIÓN Y LA AGRICULTURA), 2008.- Guayaba. Características generales. http://www.fao.org/ [ Links ]
FLORES, C.R., ATKINS, S.D., MANZANILLA-LÓPEZ, R. & PRADO-VERA, I.C., 2008.- Caracterización de aislamientos mexicanos de Pochonia chlamydosporia (Goddard) Gams y Zare para el control biológico de Nacobbus aberrans (Thorne) Thorne y Allen. Revista Mexicana de Fitopatología, 26 (2): 93-104. [ Links ]
GARCÍA, L., BULNES, C., MELCHOR, G., VEGA, E., MONTES DE OCA, N., HIDALGO, L. & MARRERO, E., 2004.- Safety of Pochonia chlamydosporia var. catenulata on acute oral and dermal Toxicity/ Pathogenicity evaluations in rats and rabbits. Vet. And Human Toxicology, 46 (5): 248-250. [ Links ]
GELPUD, C.C., MORA, M.E., SALAZAR, G.,C. & BETANCOURTH, G.C., 2011.- Susceptibilidad de genotipos de Solanum spp. al nematodo causante del nudo radical Meloidogyne spp. (chitwood). Acta Agronómica, Colombia, 60 (1): 50-67. [ Links ]
GIRALDO, F.M. & LEGUIZAMÓN, C.J., 1997.- Aislamiento y evaluación in vitro de hongos a partir de estados de Meloidogyne spp. infectados naturalmente. Cenicafé, 48 (3): 195: 203. [ Links ]
GÓMEZ, L., 2007.- Diagnóstico de nematodos agalleros y prácticas agronómicas para el manejo de Meloidogyne incognita en la producción protegida de hortalizas: Tesis, UNAH - CENSA, Cuba. [ Links ]
GUZMÁN, P.O. & CASTAÑO, Z.J., 2010.- Identificación de nematodos fitoparásitos en guayabo (Psidium guajava L.), en el municipio de Manizales (Caldas), Colombia. Rev. Acad. Colomb. Cienc., 34 (130): 117-125. [ Links ]
GUZMÁN, P.O., CASTAÑO, Z.J. & VILLEGAS, E.B., 2012.- Principales nematodos fitoparásitos y síntomas ocasionados en cultivos de importancia económica. Agronomía, 20 (1): 38-50. [ Links ]
HERNÁNDEZ-LEAL, T.I., CARRIÓN, G. & HEREDIA, G., 2011.- Solubilización in vitro de fosfatos por una cepa de Paecilomyces lilacinus (Thom) Samson. Agrociencia, 45 (8): 881-892. [ Links ]
HERNÁNDEZ, M.A. & DÍAZ, L.H., 2008.- KlamiC®: Bionematicida agrícola producido a partir del hongo Pochonia chlamydosporium var. catenulata. Revista Protección Vegetal, 23 (2): 131-134. [ Links ]
ICA (INSTITUTO COLOMBIANO AGROPECUARIO), 2014.- Área de protección vegetal: Listado de Registro de Venta de plaguicidas químicos de uso agrícola. http://www.ica.gov.co [ Links ]
JENKINS, W.R., 1964.- A rapid centrifugal flotation technique for separating nematodes from soil. Plant Disease Reporter, 48 (9): 692. [ Links ]
JEPSON, S., 1987.- Identification of root-knot nematodes (Meloidogyne species). CAB International, United Kingdom. [ Links ]
JONATHAN, E.I. & RAJENDRAN, G., 2001.- Assessment of avoidable yield loss in banana due to root-knot nematode Meloidogyne incognita. Indian Journal of Nematology, 30 (2): 162-164. [ Links ]
KERRY, B.R., 2000.- Rhizosphere interactions and the exploitation of microbial agents for the biological control of plant parasitic nematodes. Annual Review of Phytopathology, 38 (1): 423-442. [ Links ]
KHAN, T.A. & SAXENA, S.K., 1997.- Integrated management of root-knot nematode Meloidogyne javanica infected tomato using organic materials and Paecilomyces lilacinus. Bioresourse Technology, 61: 247-250. [ Links ]
KHAN, M.R., MOHIDDIN, F.A., EJAZ, M.N. & KHAN, M.M., 2012.- Management of root-knot disease in eggplant through the application of biocontrol fungi and dry neem leaves. Turk J Biol, 36: 161-169. [ Links ]
LEE, M.D., CHEN, C.H., TSAY, T.T. & LIN, Y.Y., 1998.- Survey and control of guava nematode diseases. Plant Protection Bulletin Taipei, 40: 265-276. [ Links ]
LEGUIZAMÓN, J.E., 1994.- Efecto de Meloidogyne spp. en plántulas de Coffea arabica L. variedad Caturra en etapa de vivero: 5 (en) XV Congreso de la Asociación Colombiana de Fitopatología y Ciencias Afines. Santafé de Bogotá [ Links ].
LORDELLO, R.R.A, LORDELLO, A.L.L. & MARTINS, A.L.M., 1990.- Plantio de cafezal em área infestada por Meloidogyne exigua. Nematologia Brasileira, 14: 18-19. [ Links ]
LOZANO, J.C., TORO, J.C., GARCÍA, R. & TAFUR, R., 2002.- Manual sobre el cultivo de la guayaba en Colombia. Fruticultura colombiana, Cali. [ Links ]
MACIÁ-VICENTE, J.G., ROSSO, L.C., CIANCIO, A., JANSSON, H.B. & LÓPEZ-LLORCA, L.V., 2009.- Colonisation of barley roots by endophytic Fusarium equiseti and Pochonia chlamydosporia: effects on plant growth and disease. Annals of Applied Biology, Warwickshire, 155 (3): 391-401. [ Links ]
MEREDITH, J., 1973.- Algunos métodos de campo y laboratorio para trabajar con nematodos. Maracaibo, Venezuela. [ Links ]
MENDES, C.A.C., MENDES, G.E., CIPULLO, J.P. & BURDMANN, E.A., 2005.- Acute intoxication due to ingestion of vegetables contaminated with aldicarb. Clinical Toxicology, 43: 117-118. [ Links ]
MOHAMED, S.K., 2013.- The potential of five eco-biorational products on the reproduction of root-knot nematode and plant growth. ESci J. Plant Pathol, 2 (02): 84-91. Recuperado de http://www.escijournals.net [ Links ]
MONTES DE OCA, N., ARÉVALO, J., ACOSTA, N., PETEIRA, B., HIDALGO-DÍAZ, L. & KERRY, B.R., 2005.- Estabilidad de la cepa IMI SD 187 de P. chlamydosporia var. catenulata. Parte I. Indicadores morfológicos, productivos y patogénicos. Rev. Protección Veg., 20 (2): 93-100. [ Links ]
MUTHULAKSHMI, M., KUMAR, S., SUBRAMANIAN, S. & ANITA, B., 2012.- Compatibility of Pochonia chlamydosporia with other biocontrol agents and carbofuran. J Biopest., 5: 243-245. Recuperado de http://www.jbiopest.com [ Links ]
MUTKHTAR, T., ARSHAD, H.M. & ZAMEER, K.M., 2013.- Biocontrol potential of Pasteuria penetrans, Pochonia chlamydosporia, Paecilomyces lilacinus and Trichoderma harzianum against Meloidogyne incognita in okra. Phytopathologia Mediterranea, 52 (1): 66-76. [ Links ]
NIÑO, N.E., ARBELÁEZ, G. & NAVARRO, R., 2008.- Efecto de diferentes densidades poblacionales de Meloidogyne hapla sobre uchuva (Physalis peruviana L.) en invernadero. Agronomía Colombiana, 26 (1): 58-56. [ Links ]
PERRY, R., MOENS, M. & STARR, J., 2009.- Root knot nematodes. CAB International, London. [ Links ]
PETEIRA, B., PUERTAS, A., HIDALGO-DÍAZ, L., HIRSCH, P.R., KERRY, B.R. & ATKINS, S.D., 2005.- Real-time PCR to monitor and asses the efficacy of the nematophagous fungus Pochonia chlamydosporia var. catenulata against root-knot nematode populations in the field. Biotecnología Aplicada, 22 (4): 261-266. [ Links ]
PIEDRA, N.R., 2008.- Manejo biológico de nematodos fitoparásitos con hongos y bacterias. Tecnología en Marcha, 21 (1): 123-132. [ Links ]
PUERTAS, A., DE LA NOVAL, B., MARTÍNEZ, B., MIRANDA, I., FERNÁNDEZ, F. & HIDALGO, L., 2006.- Interacción de Pochonia chlamydosporia var. catenulata con Rhizobium sp., Trichoderma harzianum y Glomus clarum en el control de Meloidogyne incognita. Rev. Protección Veg., 21 (2): 80-89. [ Links ]
RAMAKRISHNAN, S. & PANDURANGA, R., 2013.- Evaluation of Paecilomyces lilacinus for the Management of Root-Knot Nematode, Meloidogyne incognita in Flue Cured Virginia (FCV) Tobacco Nursery. Indian Journal of Nematology, 43 (1): 65- 69. [ Links ]
RAO, M.S., 2005. Management of Meloidogyne javanica on acid lime nursey seedlings by using formulations of Pochonia chlamydosporia and Paecilomyces lilacinus. Nematol medit., 33: 145-148. [ Links ]
REDDY, P.P. & KHAN, R.M., 1988.- Evaluation of Paecilomyces lilacinus for the biological control of Rotylenchulus reniformis infecting tomato as compared with carbofuran. Nematologia Mediterranea, 16 (1): 113-116. [ Links ]
________, R.M., 1989.- Evaluation of biocontrol agent Paecilomyces lilacinus and Carbofuran for the management agent Paecilomyces lilacinus and Carbofuran for the management of Rotylenchulus reniformis infecting brinjal. Pak. J. Nematol., 7 (1): 55-59. [ Links ]
ROSALES, L. C. & SÚAREZ, Z. H. 2001.- Reacción de cinco materiales de caricáceas, al ataque del nematodo Meloidogyne incognita. Nematología mediterránea. Vol. 29: 177-180. [ Links ]
SAS (Statistical Analysis System (SAS® 9.2). 2009. https://support.sas.com [ Links ]
SIKORA, R.A. & FERNÁNDEZ, E., 2005.- Nematode Parasites of Vegetables: 319-392 (en) LUC, M., SIKORA, R.A. & BRIDGE, J. (eds.) Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. CAB International, Wallingford, UK. [ Links ]
SOBITA, S. & AVINASH, P., 2010.- Antagonistic efficacy of Paecilomyces lilacinus and Verticillium chlamydosporiun against Meloidogyne incognita infecting okra. Indian Journal of Nematology, 40: 113p. [ Links ]
TAFUR, J.E., 2012.- Emprendimiento empresarial en tierras con vocación forestal: Evaluación financiera de la producción de guayaba en la Hacienda La María: Tesis, Universidad Nacional de Colombia. Palmira. [ Links ]
TAYLOR, A.L. & SASSER, J., 1983.- Biología, identificación y control de nemátodos del nódulo de la raíz. Universidad del Estado de Carolina del Norte (ed.), Carolina del Norte, U.S.A. [ Links ]
UDEA (Universidad de Antioquia). 2012. Producción, transformación y comercialización de frutas tropicales. http://huitoto.udea.edu.co [ Links ]
VERA, D.F.; PÉREZ, H. & VALENCIA, H., 2002.- Aislamiento de hongos solubilizadores de fosfatos de la rizófera de arazá (Eugenia stipitata, Myrtaceae). Acta Biol. Colom., 7: 33-40. [ Links ]
VILLOTA, F. & VARÓN, F., 1997.- Evaluación de materiales de guayaba (Psidium guajava L.) por su comportamiento al ataque de Meloidogyne incognita Raza 2. Fitopatología Colombiana, 21 (2): 31-37. [ Links ]
WADA, S. & TOYOTA, K., 2008.- Effect of three organophosphorous nematicides on non-target nematodes and soil microbial community. Microbes and Environments, 23 (4): 332-336. [ Links ]
ZAKI, M.J. & MAWBOOL, M.A., 1998.- Use of Biocontrol Fungi with Carbofuran in the Control of Root-Knot Nematodes in Okra. Pakistan Journal of Biological Sciences, 1: 27-28. [ Links ]














