Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.19 no.2 Manizales jul./dic. 2015
https://doi.org/10.17151/bccm.2015.19.2.16
DOI: 10.17151/bccm.2015.19.2.16
EFECTO DE LA ESTRUCTURA DE LA VEGETACIÓN SOBRE LA DISTRIBUCIÓN Y RIQUEZA DE MACROHONGOS EN ISLA PALMA, PACÍFICO COLOMBIANO*
EFFECTS OF THE STRUCTURE OF VEGETATION ON MACROFUNGI RICHNESS AND DISTRIBUTION IN ISLA PALMA, COLOMBIAN PACIFIC REGION
Igor Peña Avendaño 1, Edier Soto Medina2.
* FR: 10-IV-2015- FA: 2-VIII-2015
1 Candidato a Doctor, Grupo de Ecología y Diversidad Vegetal, Universidad del Valle, Facultad de Ciencias Naturales, Departamento de Biología. Cali, Colombia. E-mail: ediersot@gmail.com
2 Estudiante de Maestría, Grupo de Biología de Plantas y Microorganismos, Universidad del Valle, Facultad de Ciencias Naturales, Departamento de Biología. Cali, Colombia. E-mail: ediersot@gmail.com
CÓMO CITAR:
PEÑA, I. & SOTO, E., 2015.- Efecto de la estructura de la vegetación sobre la distribución y riqueza de macrohongos en Isla Palma, Pacífico colombiano. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 19 (2): 251-262. DOI: 10.17151/bccm.2015.19.2.16
Resumen
El objetivo de este trabajo fue estudiar la riqueza de hongos macromicetos y relacionar su variación con las variables ambientales y la estructura vegetal en Isla Palma, Pacífico colombiano. Para esto, se establecieron nueve parcelas fijas de 10x10 m, distribuidas en tres trayectos de 90 m de largo, perpendiculares a la costa oriental de la isla, con inicio a 20 m de la línea de marea, y separados entre sí por 60 m. Se colectaron los macrohongos en cada parcela en visitas mensuales durante seis meses. También se midieron parámetros de la vegetación y la intensidad de luz. Se encontraron 107 morfoespecies de macromicetos, siendo los géneros Marasmius y Mycena los dominantes. La riqueza de macromicetos no estuvo relacionada con los parámetros de vegetación ni con la intensidad de luz; sin embargo, estos parámetros sí estuvieron relacionados con la composición de macromicetos en el bosque.
Palabras clave: macromicetos, vegetación, diversidad, riqueza.
Abstract
The aim of this work was to study the macrofungal richness and relate its variation with environmental variables and vegetation structure in Isla Palma, Colombian Pacific region. For this, nine fixed 10x10 m plots were established, distributed in three 90 m long paths, perpendicular to the Eastern coast of the island, starting 20 m away from the tide line, and separated 60 m from each other. Macrofungi were collected in each plot monthly for six months. Vegetation parameters and light intensity were also measured. One hundred-seven (107) macrofungal morphospecies were found, being Marasmius and Mycena the dominant genera. Macrofungi richness was not related to vegetation parameters or with the light intensity; however, these parameters were related to the composition of macrofungi in the forest.
Key words: macrofungi, vegetation, diversity, richness.
INTRODUCCIÓN
Los integrantes del reino Fungi son organismos muy importantes; cumplen relevantes funciones ecosistémicas como la descomposición y el reciclaje de nutrientes y sostienen con las plantas formadoras de micorrizas el mutualismo más prevalente en nuestro planeta (KIERS et al., 2011). Su riqueza de especies fue estimada en 1,5 millones (HAWKSWORTH, 1991), de las cuales solo se han descrito alrededor de 80.000 a 120.000 (WEBSTER & WEBER, 2007). A esta rata, la descripción de la diversidad del reino podría tardar aproximadamente mil años, y es posible que su desaparición esté avanzando más rápido que su descripción taxonómica. No se cuenta con estimativos precisos de extinción (HAWKSWORTH, 1991). En la actualidad es prioritario desarrollar técnicas para la evaluación rápida de la diversidad fúngica, que permitan tomar decisiones sobre su futuro en hábitats amenazados (CANNON, 1997).
Existe un grupo de hongos que se caracterizan por la producción de cuerpos fructíferos visibles a simple vista, y son llamados macromicetes o macrohongos. Estos se agrupan en los filum Basidiomycota y Ascomycota y se calcula que existen por lo menos 49.500 especies sobre el planeta (SCHMIT & MULLER, 2006). En este grupo la toma de datos se hace sobre los cuerpos fructíferos, que son una estructura de reproducción que se expresa bajo una precisa combinación de características, incluyendo localización geográfica, elevación, temperatura, humedad, luz y flora circundante (WILKINS & SHEILA, 1940; ARNOLDS, 1981; SWAPNA et al., 2008). La naturaleza conspicua de los macromicetes permite evaluar relativamente rápido la diversidad fúngica de un sitio (BALMFORD et al., 2000).
Aunque los hongos macromicetes tienen un mayor registro de estudios que cualquier otro grupo de hongos, sobre todo en Europa y Estados Unidos, el conocimiento de su diversidad es incompleto, inclusive en esas regiones (MUELLER et al., 2006). Algunas dificultades para estimar la diversidad de macromicetes son el gran número de especies, incluso en pequeños lugares, y la carencia de los manuales de identificación apropiados y de personal entrenado. Dichas dificultades se ven multiplicadas en los trópicos (CANNON, 1997). Debido a estos inconvenientes, no se han podido contestar preguntas tan básicas como cuál es el número de especies de una localidad específica, o si la diversidad es mayor en un tipo de bosque que en otro (MUELLER et al., 2006).
Además de realizar inventarios de especies fúngicas para distintas zonas, y comprender qué variables condicionan su presencia en un hábitat determinado, existe un creciente interés por investigar la influencia de los macromicetes en la supervivencia de otros organismos, en relacionar su diversidad y abundancia con las especies vegetales, y en estudiar sus patrones de distribución en diferentes microambientes para incluirlos posteriormente en decisiones de conservación de áreas prioritarias de bosque (BROWN et al., 2006). En Colombia, en los últimos cincuenta años, se ha incrementado el interés por el estudio de la diversidad de macrohongos. Actualmente se encuentran registradas en la literatura un total de 605 especies. La mayoría de registros corresponden a la región Andina (aproximadamente 83%). Las regiones de la Amazonia, Caribe y Chocó biogeográfico con 13, 6 y 7% de las especies respectivamente, son zonas caracterizadas por la alta diversidad de flora y fauna y han sido muy pobremente exploradas desde el punto de vista micológico (FRANCO-MOLANO et al., 2010). De esta forma, el objetivo de este estudio fue estimar la diversidad de macrohongos en Isla Palma, Pacífico colombiano, y relacionar su variación con la estructura de la vegetación y la intensidad de luz, durante el periodo noviembre de 2011 a junio de 2012.
MATERIALES Y MÉTODOS
Área de estudio
Isla Palma se encuentra ubicada en la bahía de Málaga (3º53' N; 77º21' W), al norte del Puerto de Buenaventura, Colombia (Figura 1). En esta región el patrón anual de pluviosidad es bimodal, con un pico principal entre los meses de septiembre-noviembre y un pico secundario entre los meses de abril-mayo; el promedio de precipitación anual es de 6000 mm y la humedad relativa es del 90% (CANTERA et al., 1998). La isla se encuentra rodeada de acantilados rocosos distribuidos uniformemente con alturas entre 6 y 15 m, y playas arenosas que quedan descubiertas en bajamar. La vegetación es típica de la selva neotropical, predominando árboles entre 10 y 50 m de altura, arbustos de tallas pequeñas, helechos y diversidad de gramíneas (GÓMEZ-HERNÁNDEZ & WILLIAMS-LINERA, 2011).
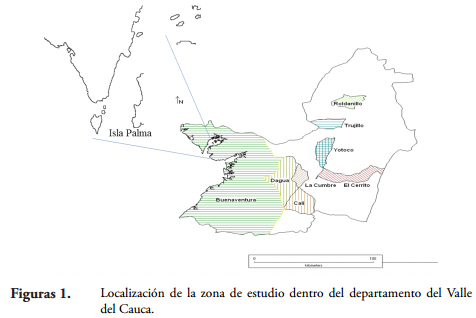
Establecimiento de las parcelas
Se establecieron nueve parcelas fijas distribuidas en tres trayectos de 90 m de largo, perpendiculares a la costa oriental de la isla, con inicio a 20 m de la línea de marea, y separados entre sí por 60 m (Figura 2). Para cada trayecto se distinguieron tres zonas, separadas 30 m una de la otra, siendo la zona 1 la más cercana a la línea de marea. En cada una de las zonas de los distintos trayectos se estableció una parcela fija de 10x10 m y una subparcela de 5x5 m (Figura 2) (FIDALGO & BONONI, 1989). Cada parcela fue muestreada una vez en el mes, durante un período de seis meses.
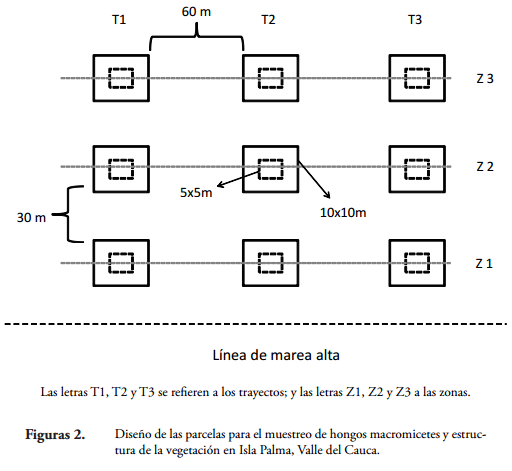
Estructura de la vegetación y muestreo de macromicetes
En cada parcela de 10x10 m se determinó la estructura de la vegetación para árboles = 5 cm DAP (diámetro a la altura del pecho, 1,3 m). Todos los individuos fueron contados e identificados, se les midió la altura y DAP. En las subparcelas de 5x5 m se midieron los mismos parámetros anteriores para plantas leñosas con DAP < 5 cm y una altura = 2 m. Se registraron datos de luminosidad para cada parcela de 10x10 m (luxómetro marca Extech, referencia Light Meter 401025) en cada muestreo.
Dentro de cada parcela se realizó una búsqueda minuciosa de macromicetos. Se recolectaron individuos presentes en la hojarasca, el suelo y la vegetación, que estuvieran en buen estado y de ser posible en diferentes etapas de desarrollo. La recolección se hizo desenterrando los individuos con crecimiento en tierra y hojarasca, y desprendiendo con una porción de sustrato a los individuos que se desarrollaban sobre madera. Las muestras fueron almacenadas en bolsas de papel parafinado, indicando el trayecto, número de la parcela, número del espécimen, fecha de recolección y sustrato. Se tomaron datos sobre características que cambian rápidamente después de ser colectados como color, forma, tamaño, consistencia y carácter higrófano (MUELLER et al., 2004).
Los macromicetos fueron deshidratados a una temperatura de 60°C, por un tiempo de 6 a 12 horas dependiendo del estado del espécimen, una vez secos fueron introducidos al congelador por 12 horas, con el fin de eliminar de la muestra cualquier organismo o huevos que hubiesen sobrevivido al proceso de deshidratación. La determinación del material fúngico se realizó con base en algunas características bioquímicas (como la respuesta de los tejidos y esporas a reactivos y colorantes como el Melzer y el KOH) y sus características macro (descripción de estructuras como píleo, estípite e himenóforo) y micromorfológicas (descripción de hifas y esporas) (DENNIS, 1956). Las muestras fueron identificadas hasta nivel de familia, género o especie por medio de diferentes claves taxonómicas (SINGER, 1986; RYVARDEN, 1991; MCCUNE et al., 2002). Todas las muestras fueron guardadas en bolsas de polipropileno y depositadas en el Herbario CUVC de la Universidad del Valle.
Análisis de datos
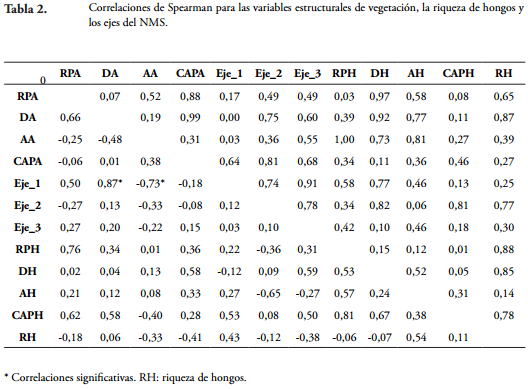
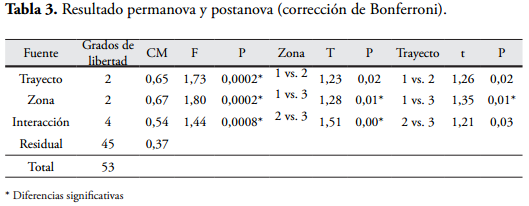
La riqueza se estimó como el número de especies de macromicetes registradas en cada parcela. Las variables estructurales y la riqueza de hongos fueron comparadas mediante pruebas ANOVA de dos vías (zonas y trayectos). También se efectuó una permanova de dos vías para comparar la composición de macromicetes entre trayectos y zonas (índice de Jaccard) y postanova con corrección de Bonferroni. Para explorar la relación entre las variables de estructura vegetal y la riqueza de hongos, se realizó un análisis de correlación de Spearman.
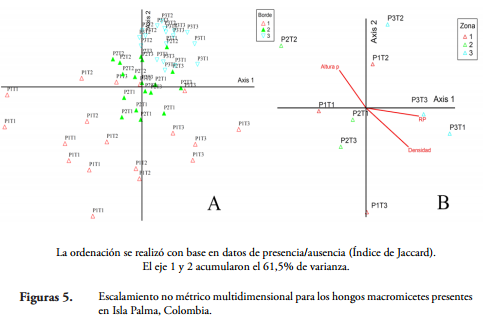
Con el fin de evaluar el efecto de la estructura vegetal sobre el ensamblaje de macromicetes, se realizó un escalamiento no métrico multidimensional (NMS) usando el índice de Jaccard. Este análisis se efectuó para todos los muestreos y para los datos acumulados por parcela. También se hicieron correlaciones de Spearman entre los ejes del NMS y las variables intensidad de luz y estructura de la vegetación. Todos los análisis fueron efectuados con los programas PC-ORD 5.0 (MCCUNE et al., 2002) y Statistica 7.0 (STATSOFT, 2004).
RESULTADOS Y DISCUSIÓN
Se encontró un total de 107 morfoespecies de hongos, la moda fue de seis especies y la riqueza tuvo poca variación entre unidades de muestreo, no exhibió patrones en los trayectos ni con respecto al borde y se distribuyó uniformemente en el bosque, con un pico en el quinto muestreo (Figura 3). Por otro lado, 63 especies (59%) fueron raras (infrecuentes) (11) a muy raras (52). Las especies más frecuentes fueron Mycena sp. (frecuencia 28), Marasmius cf. ruforotula y Trametes versicolor (21 cada una). Lo anterior, sugiere que hay un alto aporte de diversidad beta a la diversidad total, que es un patrón común en los hongos (OHENOJA, 1993; CARRIER, 2003). Esto se debe a la naturaleza efímera de los cuerpos fructíferos y el efecto del clima sobre la producción de carpóforos (FIDALGO & BONONI, 1989; KREBS et al., 2008; O'HANLON & HARRINGTON, 2012), que aumenta la heterogeneidad entre muestras.
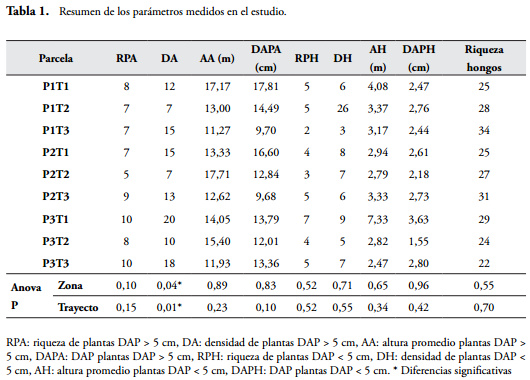
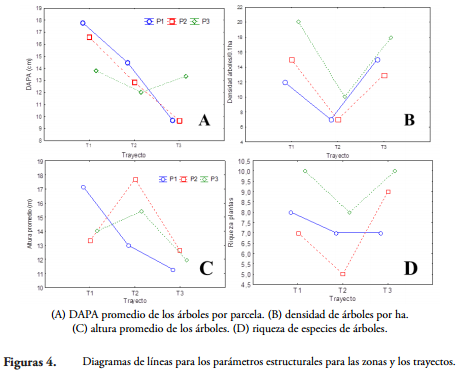
Por otro lado, se encontraron 39 especies de plantas con DAP = 5 cm y 20 con DAP < 5 cm. El número de especies osciló entre 5-10 entre parcelas para plantas con DAP = 5 cm y tendió a ser más alto en la zona más alejada del borde, y más bajo en el trayecto 2 (Figura 3). La densidad de árboles varío de 7 a 20 árboles por parcela y presentó un patrón similar a la riqueza de plantas (Tabla 1). El DAP y la altura promedio fueron similares entre las tres zonas, pero fueron más altos en el trayecto 1. Estos resultados sugieren que la riqueza de árboles se distribuye homogéneamente en el bosque, pero la fisonomía (principalmente la densidad de árboles y el DAP) presenta diferencias entre trayectos y con respecto al borde de la isla. Las variables estructurales de la vegetación y la intensidad de luz no presentaron correlaciones significativas con la riqueza de macromicetes (Tabla 2). Este resultado puede deberse a que la vegetación (número de especies y estructura), que ha sido sugerida como una variable relacionada positivamente con la riqueza de hongos (OHENOJA, 1993; SCHMIT & MULLER, 2006), no presentó una fuerte variación en el sitio de estudio.
El resultado del NMS mostró que las parcelas de cada zona se agruparon claramente: la zona 3 presentó un agrupamiento más compacto, mientras que las muestras de la zona 1 estuvieron más dispersas (Figura 5). Esto indica que la diversidad beta fue más alta en la zona 1, mientras que en la zona 3 fue más baja. Estos agrupamientos no estuvieron relacionados con la intensidad de luz (p < 0,05). Además, la permanova sugiere que estas zonas presentan una composición de macromicetes distinta, al igual que los trayectos (p < 0,05) (Tabla 3); sin embargo, las zonas 1 y 2 no mostraron diferencias significativas, y solo los trayectos 1 y 3 presentaron diferencias significativas en la composición de hongos. Así entonces, la zona cercana al mar presentó un ensamblaje de macromicetes más heterogéneo, lo cual se puede deber a que presenta distintas condiciones de luz, humedad y el efecto de la salinidad a las zonas internas (parámetros no medidos en este estudio).
Aunque las variables estructurales no estuvieron relacionadas con la riqueza de macromicetes, estas sí presentaron correlaciones significativas con los ejes del NMS, lo cual indica que los agrupamientos basados en la composición de macromicetos están relacionados con la estructura de la vegetación (árboles DAP = 5 cm). De esta forma, todos resultados sugieren que la riqueza de hongos presenta un patrón distribución espacial homogéneo, pero la composición es probablemente determinada por la estructura de la vegetación y otros parámetros no medidos en este estudio. Se ha propuesto que la diversidad de árboles no está relacionada positivamente con la riqueza de hongos en las zonas tropicales, debido a que a medida que aumenta el número de huéspedes (árboles) para los hongos, las oportunidades para la especialización disminuyen, dado que la probabilidad de colonización exitosa se reduce mientras los huéspedes se vuelven más raros (LODGE, 1997; OHENOJA, 1993; FERRER & GILBERT, 2003). También, se ha encontrado que la cantidad de madera gruesa disponible (abundancia de recurso) y la heterogeneidad de hábitat están enlazadas con la riqueza y distribución de los macrohongos (LODGE et al., 1995; LODGE, 1997; HENKEL et al., 2002; FERRER & GILBERT, 2003). Por otro lado, en las regiones tropicales se ha observado que la estructura de la vegetación de sotobosque es más importante que la de los árboles en la determinación de la diversidad de hongos (KREBS et al., 2008; KUJAWA & KUJAWA, 2008; LODGE et al., 2008). Sin embargo, el bosque presentó un patrón homogéneo en la estructura de sotobosque, por lo cual la riqueza de macromicetos no varió entre zonas.
Varios autores han reportado que la composición de macromicetes cambia marcadamente entre bosques con composición de especies de árboles similar (KUJAWA & KUJAWA, 2008). Se ha encontrado que la composición de macrohongos generalistas de huésped difiere entre comunidades de hospederos (FERRER & GILBERT, 2003), y la composición de hongos especialistas cambia a través de la distribución de los árboles hospedadores (BROWN et al., 2006), aunque gremios de macrohongos pueden estar restringidos a demarcados grupos de árboles huésped (HENKEL et al., 2002).
CONCLUSIONES
Los inventarios de macromicetes no pueden completarse en un periodo corto de tiempo. En general, la riqueza observada a través de muestreos es una subestimación de la riqueza verdadera debido a las especies que no se registran en los inventarios. En el presente estudio se encontró un total de 107 morfoespecies, y se recomienda realizar estudios posteriores durante periodos más prolongados de tiempo.
La utilización de morfoespecies como unidades taxonómicas para los análisis permitió una evaluación parcial, pero rápida, de la diversidad fúngica de Isla Palma, y podría ser una herramienta muy útil a la hora de tomar decisiones sobre la inclusión de sitios para la protección de los hongos, en regiones tan poco exploradas a nivel micológico, como la Amazonia, el Caribe y el Chocó biogeográfico.
Los resultados muestran que la vegetación (riqueza y estructura) no presentó una fuerte variación en el sitio de estudio, sin embargo esta área de bosque alberga una diversidad fúngica con un alto recambio de especies (diversidad beta) entre parcelas de muestreo, de manera que los esfuerzos de conservación en Isla Palma deberán considerar la conservación de la mayor área boscosa posible.
AGRADECIMIENTOS
A la Universidad del Valle por el apoyo logístico en el préstamo de las instalaciones y equipos de laboratorio. Al programa de Jóvenes Investigadores de Colciencias por la financiación. Al profesor Alan Giraldo por facilitar las salidas de campo.
REFERENCIAS
ARNOLDS, E., 1981.- Ecology and coenology of macrofungi in grasslands and moist heatlands in Drenthe, the Netherlands. Vol. 1. Bibliotheca mycological. J. Cramer, Vaduz. [ Links ]
BALMFORD, A., LYON, A.J. & LANG, R., 2000.- Testing the Higher taxon approach to conservation planning in a megadiverse group: the macrofungi. Biological Conservation, 93: 209-217. [ Links ]
BROWN, N., BHAGWAT, S. & WATKINSON, S., 2006.- Macrofungal diversity in fragmented and disturbed forests of the western Ghats of India. Journal of Applied Ecology, 43:11-17. [ Links ]
CANNON, P.F., 1997.- Strategies for rapid assessment of fungal diversity. Biodiversity and Conservation, 6: 669-680. [ Links ]
CANTERA, J., NEIRA, R. & RICAURTE, C., 1998.- Bioerosión en la costa Pacífica colombiana: un estudio de la biodiversidad, la ecología y el impacto de los animales destructores de acantilados rocosos sobre el hombre. Fondo FEN Colombia, Colombia. [ Links ]
CARRIER, P., 2003.- Effects of water addition on biotic and abiotic components of a dry boreal forest in the Yukon: Unpublished Ph.D. Thesis, Department of Zoology, University of British Columbia, Vancouver, B.C. [ Links ]
DENNIS, R.W.G., 1956.- Some Xylarias of Tropical America. Kew Bull., 3: 401- 444. [ Links ]
FERRER, A. & GILBERT, G.S., 2003.- Effect of tree host species on fungal community composition in a tropical rain forest in Panama. Divers. Distrib., 9 (6): 455-468. [ Links ]
FIDALGO, O. & BONONI, V.L., 1989.- Fungos e liquens macroscópicos: 24-26 (en) FIDALGO, O. & BONONI, V.L.R. (coords.) Técnicas de coleta, preservação e herborização de material botânico. Instituto de Botânica, São Paulo. [ Links ]
FRANCO-MOLANO, A.E., CORRALES, A. & VASCO, A., 2010.- Macrohongos de Colombia II. Listado de especies de los órdenes Agaricales. Boletales. Cantharellales y Russulales (Agaricomicetes - Basidiomycota). Actual Biol., 32 (92): 89-114. [ Links ]
GÓMEZ-HERNÁNDEZ, M.A. & WILLIAMS-LINERA, G., 2011.- Diversity of macromicetos determined by tree species, vegetation structure and micro-environment in tropical cloud forests in Veracruz, Mexico. Botany, 89 (3): 203-216. [ Links ]
HAWKSWORTH, D., 1991.- The fungal dimension of biodiversity: magnitude, Significance, and conservation. Mycological Research, 95: 641-655. [ Links ]
HENKEL, T.W., TERBORGH, J. & VILGALYS, R., 2002.- Ectomycorrhizal fungi and their leguminous hosts in the Pakaraima Mountains of Guyana. Mycol. Res., 106 (5): 515-531. [ Links ]
KIERS, E.T., DUHAMEL, M., BEESETTY, Y., MENSAH, J.A., VERBRUGGEN, E., FELLBAUM, C.R., . BÜCKING, H., 2011.- Reciprocal Rewards Stabilize Cooperation in the Mycorrhizal Symbiosis. Science, 333 (6044): 880-882. [ Links ]
KREBS, C., CARRIER, P., BOUTIN, S., BOONSTRA, R. & HOFER, E., 2008.- Mushroom crops in relation to the weather in southwestern Yukon. Botany, 86: 1497-1502. [ Links ]
KUJAWA, A. & KUJAWA, K., 2008.- Effect of young midfield shelterbelts development on richness of macrofungi communities and their functional structure. Pol. J. Ecol., 56: 45-56. [ Links ]
LODGE, D., 1997.- Factors related to diversity of decomposer fungi in tropical forests. Biodivers. Conserv., 6(5): 681-688. [ Links ]
LODGE, D., CHAPELA, I., SAMUELS, G., UECKER, F.A., DESJARDIN, D., HORAK, E., WHALLEY, A.J.S., 1995.- A survey of patterns in fungal diversity: 157-173 (en) SCHELDEGGER, C. & WOLSELEY, P. (eds.) Lichen conservation. Proceedings of the Symposium Lichens - a Strategy for Conservation. Mitteilungen der Eidgenossischen Forschungsanstalt fur Wald, Schnee und Landschaft, Vancouver. [ Links ]
LODGE, D., LASSØE, T., AIME, M.C. & HENKEL, T.W., 2008.- Montane and cloud forest specialists among neotropical Xylaria species. North Am. Fungi, 3: 193-213. [ Links ]
MCCUNE, B., GRACE, J.B. & URBAN, D.L., 2002.- Analysis of ecological communities. MjM Software. Gleneden Beach. Oregon. [ Links ]
MUELLER, G., BILLS, F. & FOSTER, S., 2004.- Biodiversity of Fungi Inventory and Monitoring methods. First edition. Elsevier Academic Press. [ Links ]
MUELLER, G., SCHMIT, J., LEACOCK, P., BUYCK, B., CIFUENTES, J., DESJARDIN, D., WU, Q., 2006.- Global diversity and distribution of macrofungi. Biodiversity and Conservation. On line: Springer Science + Business Media B.V. [ Links ]
OHENOJA, E., 1993.- Effect of weather conditions on the larger fungi at different forest sites in northern Finland in 1976-1988. Unpublished Ph.D. thesis, Department of Botany, Oulu University, Oulu, Finland. [ Links ]
O'HANLON, R. & HARRINGTON, T.J., 2012.- Macrofungal diversity and ecology in four Irish forest types. Fungal Ecology, 5: 499-508. [ Links ]
RYVARDEN, L., 1991.- Genera of Polypores nomenclature and taxonomy. Synopsis Fungorum 5. Norway. [ Links ]
SCHMIT, J.P. & MULLER, J.M., 2006.- An estimate of the lower limit of global fungal diversity. Biodiversity and conservation. On line: Springer Science + Business Media B.V. [ Links ]
SINGER, R., 1986.- The Agaricales in modern taxonomy. Fourth edition. Koeltz Scientific Books, Chicago. [ Links ]
STATSOFT, 2004.- Statistica 7.0. Recuperado de http://www.statsoft.com.au/v7.htm [ Links ]
SWAPNA, S., AKBER S. AND KRISHNAPPA M., 2008. Diversity of macrofungi in semi-evergreen and moist deciduous forest of Shimoga District-Karnataka,India. J. Mycol. Pl. Pathol., 38(1): 21-26. [ Links ]
WEBSTER, J. & WEBER, R., 2007.- Introduction to Fungi. Third edition. Cambridge University Press. [ Links ]
WILKINS, W.H & SHEILA, H.M., 1940.- The ecology of the larger fungi. Annals of Applied Biology, 27 (1): 17-34. [ Links ]














