Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.19 no.2 Manizales July/Dec. 2015
https://doi.org/10.17151/bccm.2015.19.2.24
DOI: 10.17151/bccm.2015.19.2.24
VARIACIÓN TEMPORAL DE LA ARANEOFAUNA (ARACHNIDA: ARANEAE) EN UN FRAGMENTO DE BOSQUE SECO TROPICAL (BST), EN EL DEPARTAMENTO DEL ATLÁNTICO, COLOMBIA*
TEMPORARY VARIATION OF ARACHNOFAUNA (ARACHNIDA: ARANEAE) IN A FRAGMENT OF DRY TROPICAL FOREST (DTF) IN THE DEPARTMENT OF ATLÁNTICO, COLOMBIA
Luis Quijano C.1, Neis Martínez H.2, 3
* FR: 1-IV-2015- FA: 16-VIII-2015
1 Estudiante de Biología. Semillero de investigación Artrópodos e Insectos NEOPTERA del Caribe colombiano. Facultad de Ciencias Básicas, Universidad del Atlántico. Barranquilla, Colombia. E-mail: luisquijanocuervo@gmail.com
2 Grupo Biodiversidad del Caribe colombiano. - Programa de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico. Barranquilla, Colombia.
3 Estudiante de Doctorado en Ciencias – Biología, Universidad Nacional - Sede Bogotá. E-mail: neysjosemartinez@gmail.com.
CÓMO CITAR:
QUIJANO C., L. & MARTÍNEZ H., N., 2015.- Variación temporal de la araneofauna (Arachnida: Araneae) en un fragmento de Bosque Seco Tropical (BST), en el departamento del Atlántico, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 19 (2): 381-396. 10.17151/bccm.2015.19.2.24
Resumen
Se analizó la variación temporal de la composición y estructura de la araneofauna en la Reserva Campesina La Montaña (RCM), departamento del Atlántico, Colombia. Se realizaron 10 muestreos entre noviembre de 2012 y agosto del 2013, con el fin de abarcar las épocas seca y de lluvias. Se delimitó un transecto lineal de 500 m de largo por 20 m de ancho, donde se marcaron 10 puntos de muestreo distanciados 50 m. En cada uno las arañas fueron capturadas empleando los métodos de captura manual (CM), agitación del follaje (AF), cernido de hojarasca (CH) y trampa de caída (TC). Se capturaron 1.866 individuos distribuidos en 32 familias, destacándose Araneidae como la más abundante con 525 individuos (28,1%), seguida por Salticidae y Lycosidae con 407 (21,8%) y 173 individuos (9,27%) respectivamente. La primera familia presentó su mayor abundancia en mayo (108), mientras que Salticidae presentó el mayor valor en enero (69) y Lycosidae en febrero con 33 individuos. Con respecto a la riqueza, los mayores valores se presentaron en junio (25) y diciembre con 22 familias. Adicionalmente, se registraron ocho gremios, de los cuales el más abundante (567 individuos) fue las constructoras de telas orbiculares (CTO), presentándose el mayor valor en mayo; mientras que las cursoriales del suelo (CS) fueron las más diversas (10 familias), siendo enero, febrero y junio los meses con mayor (8) número de familias. Estos resultados demuestran que las comunidades de arañas en la zona presentan un patrón temporal que depende de los cambios estacionales que se dan en el Bosque Seco Tropical.
Palabras clave: variación temporal, época, Araneidae, Salticidae, gremios, constructoras de telas orbiculares.
Abstract
The temporary variation of the composition and structure of arachnofauna in the Reserva Campesina La Montaña (RCM), department of Atlántico, Colombia was analyzed. Ten samples were taken between November 2012 and August 2013 in order to cover the dry and rainy seasons. A 500 m long, 20 m wide linear transect was delimited, where 10 sampling points spaced 50 m from each other were marked. In each sampling point, spiders were collected using manual capture methods (MC), agitation foliage (AF), litter sifting (LS) and pitfall trap (PT). A total of 1,866 individuals distributed in 32 families were captured. The family Araneidae was the most abundant with 525 individuals (28.1%), followed by Salticidae and Lycosidae with 407 (21.8%) and 173 individuals (9.27%) respectively. The first family showed its greater abundance in May (108), while Salticidae showed the highest value in January (69) and Lycosidae in February with 33 individuals. With regard to the family richness, the highest values occurred in June (25) and December with 22 families recorded. Additionally eight guilds were observed from which the most abundant (567 individuals) were the orb weaving (OW) constructors, with the highest value in May while cursorial soil spiders (CS) were the most diverse (10 families), being January, February and June the months with the greatest number of families (8). These results demonstrate that the spider communities in the area present a temporal pattern that depends on seasonal changes that occur in the Dry Tropical Forest.
Key words: temporal variation, season, Araneidae, Salticidae, guilds, orb weaving constrctors.
INTRODUCCIÓN
El Bosque Seco Tropical (BST) comprende bosques caducifolios y semicaducifolios que se encuentran en la zona tropical, los cuales se caracterizan porque durante el año atraviesan una severa estacionalidad climática (PIZANO & GARCÍA, 2014). La mayor cantidad de precipitación regularmente se da durante cuatro meses del año, donde la media no sobrepasa los 200 mm por mes (ESPINOSA et al., 2012). El periodo de sequía en estos bosques es muy prolongado, oscilando entre los 5 y 6 meses, donde se registran valores de precipitación que no superan los 10 mm mensuales (MAASS & BURGOS, 2011). Esta condición es causante de un estrés hídrico (LIMA & RODAL, 2010), que incide en el cambio de fenología de la vegetación presente, producto de la caída de sus hojas durante la ausencia de lluvias y la presencia de un bosque siempre verde durante la época de precipitaciones (ESPINOSA et al., 2012). Producto de estos cambios es posible que se presente disminución en la disponibilidad de refugio y recursos del medio, esto último debido a que la mayoría de la fauna del BST tienen su periodo de actividad sincronizado con la presencia o ausencia de lluvias en este bioma (BARRAZA et al., 2010).
La estacionalidad es un factor que se debe tener en cuenta cuando se realizan estudios de tipo ecológico (WOLDA, 1988), debido a que los cambios en flora y fauna pueden estar influenciados por cambios en las condiciones medioambientales (FARCIC et al., 2010). Para evaluar el efecto de esta estacionalidad en la biota, se hace necesaria la utilización de grupos taxonómicos de gran importancia ecológica como los invertebrados terrestres. Estos se destacan por ser los componentes principales de las cadenas tróficas y por jugar un papel importante en el reciclaje de nutrientes y en el mantenimiento de la estructura y fertilidad del suelo (WELLS et al., 1983). Dentro de estos invertebrados se encuentran las arañas, las cuales ocupan una gran cantidad de nichos espaciales y temporales, se caracterizan por presentar una elevada diversidad taxonómica al interior de cada hábitat y además por exhibir grandes respuestas taxón y gremio-específicas a las variaciones ambientales (TOTI et al., 2000), lo que las hace un excelente grupo para estudios ecológicos en fragmentos de BST.
A pesar de la importancia de las arañas, en Colombia la mayoría de estudios se han restringido a las regiones Andina y Pacífica, evaluando solo aspectos fundamentales de tipo ecológico (VALDERRAMA, 1996; FLÓREZ, 1998; BLANCO et al., 2003; FLÓREZ et al., 2004; RICO et al., 2005; CEPEDA & FLÓREZ, 2007; ROMO & FLÓREZ, 2008; CABRA-GARCÍA et al., 2010; CABRA-GARCÍA et al., 2010a, 2010b; BETANCUR et al., 2011; SABOGAL, 2011; CABRA-GARCÍA et al., 2012; VANEGAS et al., 2012). Por su parte, en la región Caribe colombiana, aunque alberga una alta diversidad de arañas (RANGEL et al., 1995), el conocimiento que se tiene acerca de este grupo es aún incipiente. Entre los pocos estudios, se destacan los realizados por OW (2001), MORÓN (2004), FERREIRA-OJEDA et al. (2009), ESCORCIA et al. (2012) y PEÑALOZA-VILLADIEGO et al. (2013), quienes determinaron la diversidad y abundancia de la araneofauna presente en la región. Sin embargo, en estos estudios no se han documentado las variaciones temporales de las comunidades de arañas en el BST.
Teniendo en cuenta lo anterior, se analizó la variación temporal de la composición y estructura de la araneofauna en la Reserva Campesina La Montaña (RCM). De esta forma, se busca ampliar el conocimiento sobre el comportamiento de las comunidades de arañas en función de los cambios que ocurren en los fragmentos de BST en el Caribe colombiano.
METODOLOGÍA
Área de estudio
La RCM se encuentra entre las inmediaciones de los municipios de Juan de Acosta y Usiacurí, departamento del Atlántico, Colombia (Figura 1). Está localizada a 10º46'02,6" N y 75º02'34" O, a una altitud que oscila entre 160 y 250 m y con una extensión aproximada de 47 ha. La temperatura promedio es de 28oC y la precipitación media anual presenta valores cercanos a los 179 mm (MARTÍNEZ et al., 2012).
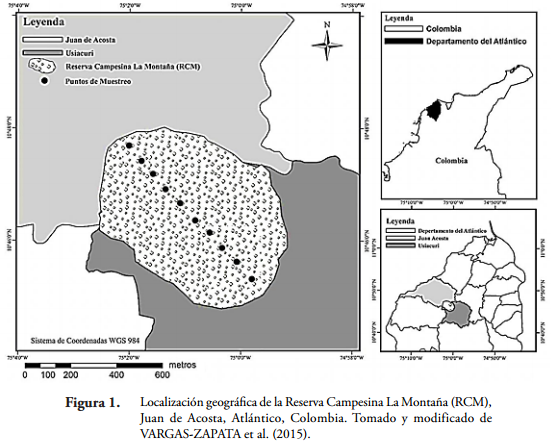
La vegetación predominante del lugar es la típica de BST, descrita por PIZANO & GARCÍA (2014), predominando tres estratos vegetativos: sotobosque, arbustivo y dosel. En esta zona las especies arbóreas más abundantes son la ceiba blanca (Hura crepitans L), camajón (Sterculia apetala Jacq.), jobo (Spondias mombin L.), majagua (Pseudobombax septenatum Jacq.), indio en cuero (Bursera simaruba L), carito (Enterolobium cyclocarpum Jacq.), macondo (Cavanillesia platanifolia Bonpl), balso (Ochroma pyramidale Cav. ex Lam) y carreto (Aspidosperma polineuron Müll. Arg) (VARGAS-ZAPATA et al., 2015). Además, este fragmento de bosque se encuentra rodeado de tierras que son usadas para la ganadería extensiva y la agricultura, donde predomina la siembra de yuca (Manihot esculenta) y millo (Sorghum bicolor) (MARTÍNEZ et al., 2012).
Diseño de muestreo
Se realizaron 10 muestreos entre noviembre de 2012 y agosto de 2013, con salidas mensuales de dos días. Los muestreos fueron realizados entre las 8:00 a.m. y las 6:00 p.m. En el interior del fragmento de bosque de la RCM se delimitó un transecto lineal de 500 m de largo por 20 m de ancho, donde se marcaron 10 puntos de muestreo distanciados 50 m. En cada uno se emplearon cuatro técnicas de muestreo: captura manual (CM), agitación del follaje (AF), cernido de hojarasca (CH) y trampas de caída (TC). La CM consistió en la búsqueda intensiva de los individuos durante 30 min por punto, para un total de 300 min por muestreo. Esta técnica se utilizó en todos los lugares posibles de inventariar (suelo, troncos caídos, hojarasca, telarañas, etc.), siguiendo los lineamientos propuestos por CODDINGTON et al. (1991). La AF se realizó con un esfuerzo muestral de 60 agitaciones por punto, en todos los niveles de estratificación posible, exceptuando el dosel del bosque. Para esto, se utilizó una jama (60 cm de diámetro; 50 cm de profundidad) y un madero. Para la recolección de los individuos se utilizaron aspiradores bucales. En el caso de CH, luego de identificar un lugar con la presencia de hojarasca en cada uno de los puntos, se cernían alrededor de 10 L de hojarasca con la ayuda de un cernidor Winkler. Posteriormente, el material cernido era revisado en campo en bandejas blancas para la captura de las arañas. Por último, la técnica de TC consistió en la instalación de vasos de plástico de 0.5 L al ras del suelo, los cuales contenían una solución letal compuesta por detergente, agua y alcohol al 70%. Esta trampa fue dejada por un tiempo aproximado de 24 h. Adicionalmente, en cada punto se midieron variables ambientales in situ como humedad relativa (H.R) y temperatura ambiental (T.A) con un termohigrómetro (Marca Extech RHT). También, se midió la precipitación (Prec) con la ayuda de un pluviómetro (marca Hellmam) localizado en los alrededores de la Reserva. Con base en los valores de precipitación y en su continuidad se determinaron dos épocas: lluvias (noviembre, diciembre, abril, mayo, junio, julio, agosto) y seca (enero, febrero, marzo). Lo anterior, con el fin de determinar la posible influencia de la estacionalidad en la comunidad de arañas de la RCM.
Los individuos recolectados se preservaron en alcohol etílico al 70%. Posteriormente fueron transportados hasta las instalaciones de la Universidad del Atlántico, para su identificación taxonómica hasta el nivel de familia, con ayuda de las claves de FLÓREZ (1996), RAMÍREZ (1999) y JÓQUE & DIPPENAAR-SCHOEMAN (2007). Posteriormente fueron confirmadas con la colección de Arañas del Instituto de Ciencias Naturales (ICN) de la Universidad Nacional-Sede Bogotá. Una vez confirmados los especímenes, se incorporaron a la colección de arañas en húmedo del Museo de la Universidad del Atlántico (UARC).
Análisis de datos
Se estimó la riqueza como el número de familias y la abundancia como el número de individuos por meses y épocas de muestreo. Los valores de abundancia de las familias por meses fueron transformados a ln (x+1) y con estos valores se construyó una matriz de similitud, basado en el índice de Bray Curtis. Teniendo en cuanta lo anterior, con el fin de observar patrones de agrupación entre épocas, se realizó un análisis de escalamiento multidimensional no métrico (nMDS) y para establecer diferencias significativas entre dichos patrones, se ejecutó una prueba ANOSIM (análisis de similaridad) a posteriori. Para observar las familias que tipificaban a cada época, se realizó un análisis SIMPER, todo lo anterior con la ayuda del programa PRIMER 6.0 (CLARKE & WARWICK, 2001). Por último, para determinar la posible influencia de las variables ambientales medidas sobre la estructura de la comunidad de arañas, se efectuó un análisis de correspondencia canónica (ACC) (Programa Past 2.17, HAMMER et al., 2001). Las familias de arañas fueron separadas en gremios tróficos siguiendo lo descrito por UETZ et al. (1999) y LILJESTHRÖM et al. (2002). Esto, con el fin de observar la variación temporal de este grupo en el área de estudio.
RESULTADOS
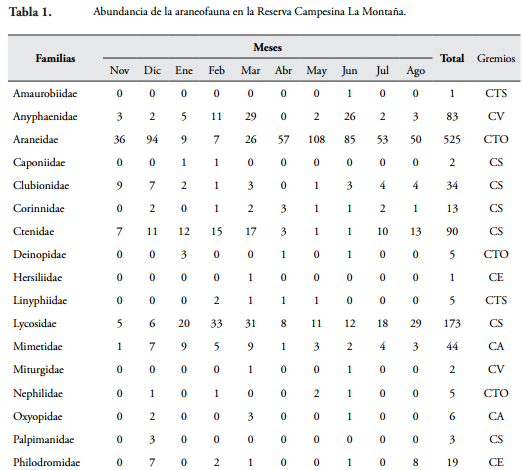
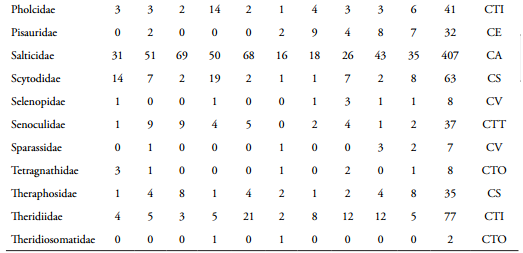
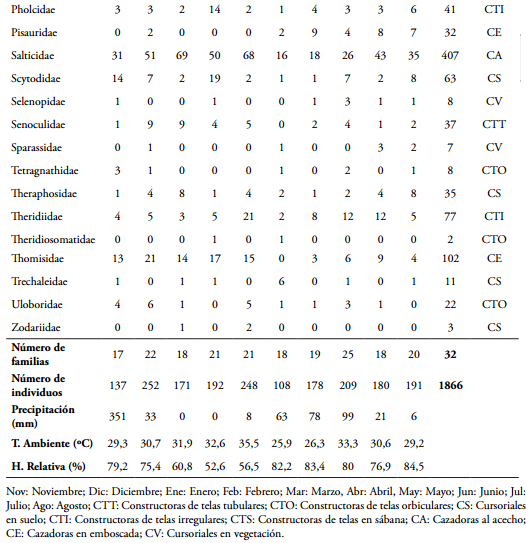
Se capturaron 1.866 individuos distribuidos en 32 familias, destacándose Araneidae como la más abundante con 525 individuos (28,1%), seguida por Salticidae y Lycosidae con 407 (21,8%) y 173 individuos (9,27%) respectivamente (Tabla 1). Araneidae presentó su mayor abundancia en mayo (108), mientras que Salticidae presentó el mayor valor en enero (69) y Lycosidae en febrero con 33 individuos. Amaurobiidae y Hersiliidae con un individuo cada una, fueron las familias menos abundantes (Tabla 1).
Teniendo en cuenta los muestreos, junio fue el mes con mayor número de familias (25), coincidiendo con los mayores registros de precipitación (99 mm) de la segunda época de lluvias (Tabla 1). Noviembre presentó la menor riqueza de familias (17), cuando los valores de precipitación fueron de 351 mm, con valores de temperatura de 29,3ºC y humedad ambiental de 79,2% en el área de estudio (Tabla 1). Por otro lado, teniendo en cuenta los valores de abundancia, diciembre presentó el mayor número de individuos (252), cuando los valores de precipitación registrados fueron de 33 mm, con una temperatura de 30,7ºC y humedad ambiente de 75,4%. En abril se observó el menor valor (108 individuos), coincidiendo con una precipitación de 63 mm y temperatura y humedad ambiente de 25,9ºC y 82,2% respectivamente (Tabla 1).
Las familias que aportaron un porcentaje mayor al 70% de la abundancia total fueron Araneidae, Salticidae, Lycosidae, Thomisidae, Ctenidae y Anyphaenidae. La abundancia de estas familias presentó una fuerte variación durante los meses de muestreo (Figura 2). Familias que utilizan la construcción de telas como estrategias para forrajear, como es el caso de Araneidae, mostraron una mayor frecuencia durante las épocas con altas precipitaciones en la Reserva; mientras que aquellas arañas errantes y buscadoras activas (Lycosidae, Ctenidae y Salticidae) fueron más frecuentes durante las épocas seca y bajas lluvias. Por otro lado, las familias habitantes de la vegetación, como Thomisidae y Anyphaenidae, no exhibieron un claro patrón relacionado con los regímenes pluviométricos de la RCM (Figura 2).
Con el nMDS se logró evidenciar la presencia de dos grupos muy marcados con un stress de 0,09 (Figura 3). El primero de ellos, conformado por los meses que hacen parte de la época seca (febrero, enero, marzo) y el segundo por aquellos con presencia de lluvias (noviembre, diciembre, agosto, julio, junio y mayo) (Tabla 1). Por otro lado, abril a pesar de ser un mes con valores altos de precipitación, se presenta como un mes atípico al modelo (Figura 3).
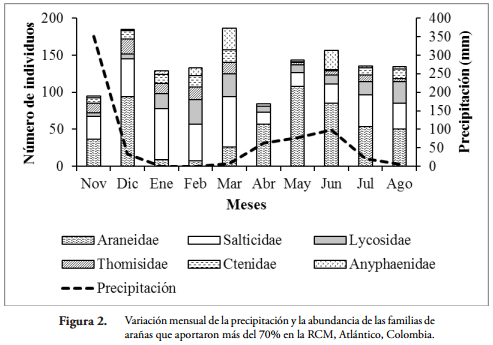
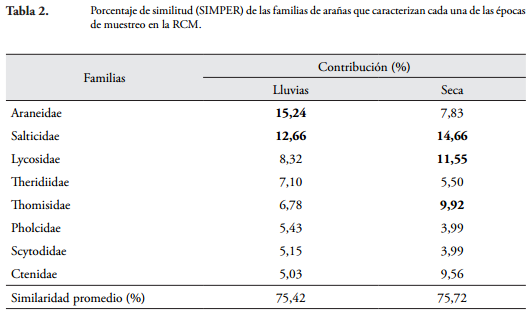
Con el test ANOSIM se logró determinar que la estructura de la comunidad de arañas entre las epocas evaluadas presentó diferencias significativas (R = 0,66; p = 0,012). Teniendo en cuenta la rutina SIMPER, se determinó que el periodo de lluvias estuvo caracterizado por las familias Araneidae y Salticidae; mientras que Salticidae, Lycosidae y Thomisidae caracterizaron la época seca (Tabla 2).
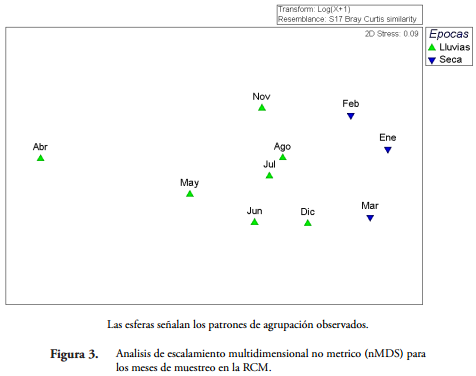
Las esferas señalan los patrones de agrupación observados.
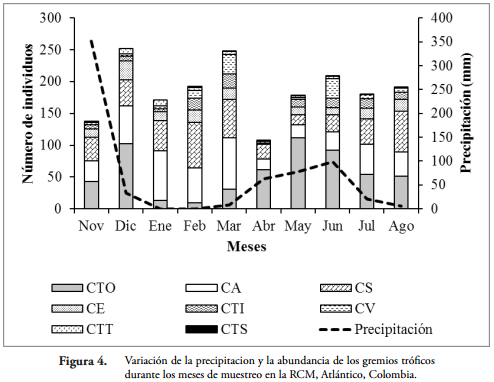
En el fragmento de BST de la RCM se observó una alta riqueza de gremios tróficos (Tabla 1). El gremio que presentó el mayor número de familias (8) fue las cursoriales del suelo (CS) y las constructoras de telas tubulares (CTT) la menos diversa con una sola familia. Las constructoras de telas orbiculares (CTO) con 567 individuos fue el gremio con la mayor abundancia, mientras que las constructoras de telas en sabana (CTS) presentaron el menor número con seis individuos (Tabla 1 y Figura 4). Teniendo en cuenta las épocas de muestreo, las CTO fueron las más abundantes durante las altas precipitaciones (124,80 mm); mientras las CS y CA fueron más frecuentes durante la época seca (entre 0 y 8,0 mm) (Figura 4).
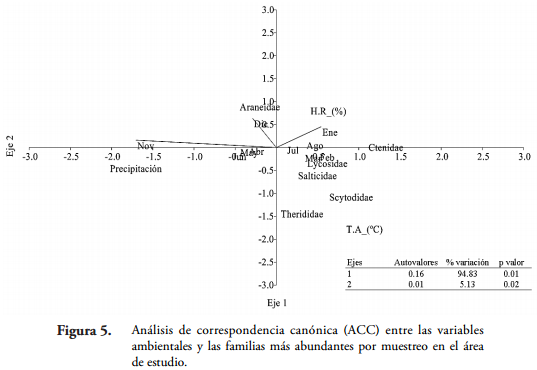
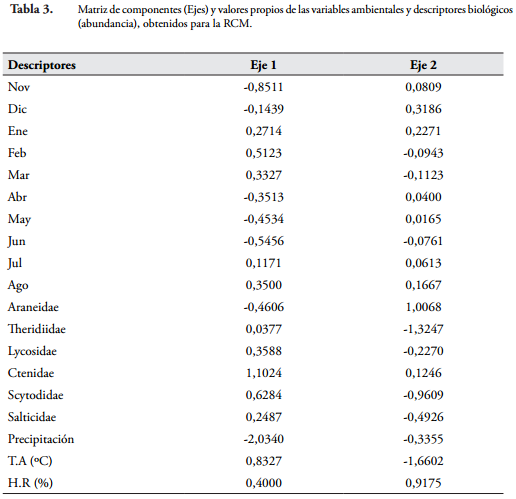
Por último, con el análisis de correspondencia canónica (ACC) entre las variables ambientales y los descriptores biológicos (abundancia de las familias) por muestreo, se determinó que los dos primeros ejes canónicos explicaban un 99,96% de la variabilidad de los datos (Figura 5). El primer eje presentó el mayor porcentaje de variación (94,83%) explicando en mayor proporción la variación de los mismos (Figura 5). Con este modelo se logra evidenciar una alta influencia de la precipitación, sobre los parámetros ecológicos evaluados en el estudio, presentando el mayor autovalor de las variables ambientales en el primer eje (Tabla 3). Sin embargo, al observar el comportamiento de la abundancia de las familias, se logra evidenciar que la mayoría de ellas están influenciadas por las otras dos variables tenidas en cuenta para el análisis (Temperatura ambiente y Humedad relativa) (Tabla 3 y Figura 5).
DISCUSIÓN
Con este estudio se demuestra que la RCM presenta una alta riqueza de familias (47,76 %), respecto a las reportadas para el país por PERAFAN et al. (2013). El número de familias de arañas sobrepasa al registrado por FLÓREZ & SÁNCHEZ (1995), ESCORCIA et al. (2012) y PEÑALOZA-VILLADIEGO et al. (2013) en la región Caribe colombiana; lo cual demuestra la importancia de este tipo de estudios en fragmentos de bosque seco tropical, ya que permiten identificar sitios capaces de albergar una alta biodiversidad.
La mayor abundancia de Araneidae y Salticidae en la RCM concuerda con algunos trabajos realizados para el orden por FLÓREZ (1998), RICO et al. (2005), ÁVALOS et al. (2007), CABRA et al. (2010b), ESCORCIA et al. (2012), GÓMEZ-RODRÍGUEZ & SALAZAR (2012) y PEÑALOZA-VILLADIEGO et al. (2013). La alta abundancia de Araneidae se debe posiblemente a su amplia distribución cosmopolita y alta riqueza a nivel mundial (WORLD SPIDER CATALOG, 2014) y por ser excepcionalmente exitosa colonizando cualquier nicho, siendo reportada en todos los estratos vegetales (ESCORCIA et al., 2012). El mayor pico de actividad de Araneidae en mayo se puede atribuir a que durante este mes se presenta una alta humedad ambiental, la cual beneficia la asequibilidad al recurso agua, que es de suma importancia para la producción de la seda. Adicionalmente, el aumento de la cobertura y los cambios en la estructura vegetal en la RCM, puede tener influencia en la implantación de sus telas durante este mes (GIRALDO et al., 2004; AMBALAPARAMBIL et al., 2005). Otro factor que pudo tener influencia en la alta proporción de individuos de esta familia durante mayo, fue la alta disponibilidad de presas (observación personal), la cual es una de las variables que influye en mayor proporción al patrón temporal exhibido por las comunidades de arañas (CARVALHO et al., 2015). Por otro lado, la alta abundancia de Salticidae se puede atribuir a sus hábitos cursoriales, principalmente diurnos y excelente capacidad visual (BLEST et al., 1990), lo cual le permite explotar una gran cantidad de nichos y ser excepcionalmente exitosa a la hora de conseguir su alimento (JACKSON & POLLARD, 1996). Estas características las hace habitantes comunes de la mayoría de microhábitats existentes en el BST. La mayor abundancia de Lycosidae (familia netamente cursorial) en febrero (época seca), se puede atribuir a la mayor acumulación de hojarasca en el suelo; lo cual influye en el aumento de las presas potenciales para esta familia, como algunos artrópodos detritófagos. Además, con la pérdida del follaje aumentan los espacios abiertos y libres de vegetación en el área de estudio, sitios preferenciales para el desplazamiento de esta familia (BUDDLE et al., 2000; GIRALDO et al., 2004). Los hábitos ecológicos y comportamentales de las familias Amaurobiidae y Hersiliidae pueden estar explicando su baja abundancia en la zona. En el caso de Hersiliidae es una familia que se hace poco evidente, debido a sus patrones de coloración y forma del cuerpo, lo que le permite mimetizarse sobre sus sustratos de posamiento en la RCM. En el caso de Amaurobiidae, debido a su pequeño tamaño y ocurrencia en lugares oscuros (JÓQUE & DIPPENAAR-SCHOEMAN, 2007), puede reducir su visualización, disminuyendo así sus probabilidades de ser capturadas.
Por otro lado, las familias Thomisidae y Anyphaenidae, presentaron un patrón aleatorio y no relacionado con el régimen pluviométrico de la zona; debido probablemente a que son otras variables medioambientales, las que influyen en el comportamiento de estas familias. Por ejemplo, en el caso de Thomisidae es probable que el desarrollo de flores en la vegetación sea el factor limitante que influya en su comportamiento temporal, como consecuencia de la pérdida o ganancia de sus sustratos de posamiento y lugares para cazar (GIRALDO et al., 2004).
La mayor abundancia de las CTO está directamente relacionada con el alto número de individuos presentado por Araneidae. Sin embargo, la mayor frecuencia de este gremio en la RCM, posiblemente está influenciada por el grado de conservación que se presenta en el fragmento de BST; lo cual permite una mayor proporción de sustratos vegetales para implantar sus telas, así como una mayor cantidad de artrópodos (insectos), la principal presa del orden Araneae. La mayor abundancia de este gremio en mayo se debe a que durante este mes, se presentan las variables medioambientales adecuadas (alta humedad ambiental, disponibilidad de presas y sustratos de andamiaje), que permiten que este grupo predomine en la Reserva. Para el caso de la mayor abundancia de las CA y CS, en meses secos y bajas lluvias, se puede atribuir al aumento de zonas de refugio y lugares abiertos, que inciden en la búsqueda de alimento de estos gremios en el fragmento de bosque. Los otros gremios encontrados, debido a sus valores bajos de abundancia, no fue posible descifrar un claro patrón de variación. La mayor abundancia exhibida por estos grupos funcionales concuerda con lo reportado por ÁVALOS et al. (2007) para un bosque higrófilo y pastizal de la provincia de Corrientes, Argentina.
Al observar la variación mensual de la araneofauna presente en la Reserva, se logra evidenciar lo planteado por diferentes autores (SPILLER & SCHOENER, 1995; ARANGO et al., 2000; CARVALHO et al., 2015) sobre el efecto tardío que causan algunas variables medioambientales y bióticas, sobre la composición y estructura de las comunidades de arañas. Lo anterior se evidencia durante los meses de diciembre (época lluvias) y marzo (época seca), donde se presentan picos de abundancia similares, producto de la influencia de las condiciones bióticas y abióticas en los meses precedentes a estos muestreos. Por último, cabe resaltar el comportamiento atípico presentado en abril durante este estudio (baja abundancia), debido a que este mes presentó características adecuadas (alta precipitación, alta humedad) para la comunidad de arañas. Lo anterior, se puede atribuir al efecto que tienen las escorrentías por las aguas lluvias en el fragmento. La geomorfología de la RCM presenta pendientes pronunciadas (entre 12 y 25%), lo cual influye en la velocidad y fuerza con que las escorrentías pueden arrastrar muchos sustratos en el suelo (trocos caídos, hojarasca y vegetación rasante) que son utilizados por grupos de arañas pertenecientes a gremios que colonizan estratos bajos, afectando de esta forma la abundancia de este grupo de arañas y sus respectivas presas.
AGRADECIMIENTOS
A Luz Marina Cuervo Sepúlveda [madre de uno de los autores del presente trabajo] por su apoyo económico para la realización de las fases de campo. A toda la comunidad de la Reserva Campesina La Montaña (RCM), por su colaboración con la fase de campo; en especial a Santiago Conrado "Chago" y Rafael Conrado "El Mono". A los integrantes del semillero artrópodos e insectos NEOPTERA del Caribe colombiano de la Universidad del Atlántico por su ayuda. Al profesor Eduardo Flórez Daza, por su colaboración en la identificación de los especímenes. A la Vicerrectoría de Investigación y Proyección Social y a la Facultad de Ciencias Básicas de la Universidad del Atlántico, por facilitar los permisos de recolecta y el uso del Laboratorio de Zoología para la determinación taxonómica de las arañas. A COLCIENCIAS por el apoyo financiero recibido a través de la convocatoria No. 617 de 2013 (Convocatoria para formación de alto nivel para la ciencia, la tecnología y la innovación).
REFERENCIAS
AMBALAPARAMBIL, V., MUNDACKATHARAPPEL, J., ENATHAYIL, S. & POTHALIL, A., 2005.- Seasonal variation in spider abundance in Kuttanad rice agroecosystem, Kerala, India (Araneae). Acta zoologica bulgarica, 1: 181-190. [ Links ]
ARANGO, A.M., RICO-GRAY, V. & PARRA-TABLA, V., 2000.- Population structure, seasonality, and habitat use by the green lynx spider Peucetia viridans (Oxiopidae) inhabiting Cnidoscolus aconitifolius (Euphorbiaceae). Journal of Arachnology, 28: 185-194. [ Links ]
ÁVALOS, G., RUBIO, G., BAR, M. & GONZÁLEZ, A., 2007.- Arañas (Arachnida: Araneae) asociadas a dos bosques degradados del Chaco húmedo en Corrientes, Argentina. Revista de Biología Tropical, 55 (3-4): 899-909. [ Links ]
BARRAZA, J., MONTES, J., MARTÍNEZ, N. & DELOYA, C., 2010.- Ensamblaje de escarabajos coprófagos (Scarabaeidae: Scarabaeinae) del Bosque Tropical Seco, Bahía Concha, Santa Marta, Colombia. Revista Colombia de Entomología, 36 (2): 285-291. [ Links ]
BETANCUR, N., CABRA, J. & ARMBRECHT, I., 2011.- Arañas asociadas a redes de Cyrtophora citricola (Forsskål, 1775) (Araneae: Araneidae) en zonas urbanas y rurales del valle alto del río Cauca, Colombia. Revista Ibérica de Aracnología, 19: 15-21. [ Links ]
BLANCO, E., AMAT, G. & FLÓREZ, E., 2003.- Araneofauna orbitelar (Araneae: Orbiculariae) de los Andes de Colombia: comunidades en hábitats bajo regeneración. Revista Ibérica de Aracnología, 7: 189-203. [ Links ]
BLEST, A.D., O'CARROLL, D.C. & Carter, M., 1990.- Comparative ultrastructure of layer I receptor mosaics in principal eyes of jumping spiders: the evolution of regular arrays of light guides. Cell and Tissue Research, 262: 445-460. [ Links ]
BUDDLE, C.M., SPENCE, J.R. & LANGOR, D.W., 2000.- Sucession of boreal forest spider assemblages following wildfire and harvesting. Ecography, 23: 424-436. [ Links ]
CABRA-GARCÍA, J., BERMÚDEZ, C., OSORIO, A. & CHACÓN, P., 2012.- Cross-taxon congruence of a and B diversity among five leaf litter arthropod groups in Colombia. Biodiversity and Conservation, 21: 1493-1508. [ Links ]
CABRA-GARCÍA, J., CHACÓN, P. & VALDERRAMA C., 2010a.- Additive partitioning of spider diversity in a fragmented tropical dry forest (Valle del Cauca, Colombia). The Journal of Arachnology, 38 (2): 192-205b. [ Links ]
________, 2010b.- Riqueza y composición de arañas en diferentes coberturas vegetales del Parque Natural Regional EL Vínculo (Valle del Cauca, Colombia). Cespedesia, 32: 90-91c. [ Links ]
CABRA-GARCÍA, J., MONTEALEGRE L. & ARCE M., 2010.- Evaluación rápida de la riqueza de arañas en un Bosque Húmedo Tropical del departamento del Cauca (Colombia). Boletín del Museo de Entomología de la Universidad del Valle, 11 (1): 1-9a. [ Links ]
CARVALHO, L., SEBASTIAN, N., ARAÚJO, H., DIAS, S., VENTICINQUE, E., BRESCOVIT, A. & VASCONCELLOS, A., 2015.- Climatic Variables Do Not Directly Predict Spider Richness and Abundance in Semiarid Caatinga Vegetation, Brazil. Environmental Entomology. doi: http://dx.doi.org/10.1093/ee/nvu003 [ Links ]
CEPEDA, J. & FLÓREZ E., 2007.- Arañas tejedoras: uso de diferentes microhábitats en un bosque andino de Colombia. Revista Ibérica de Aracnología, 14: 39-48. [ Links ]
CLARKE, K.R. & WARWICK, R.M., 2001.- Change in Marine Communities: an Approach to Statistical Analysis and Interpretation. 2nd. ed. Primer-E Ltd, Plymouth, UK. [ Links ]
CODDINGTON, J., GRISWOLD, C., DÁVILA, D., PEÑARANDA, E. & LARCHER, S., 1991.- Designing and testing sampling protocols to estimate biodiversity in tropical ecosystems: 40-60 (en) DUDLEY, E.C. The Unity of evolutionary biology: Proceedings of the fourth international congress of systematic and evolutionary biology. Dioscorides Press, Portland, Oregon. [ Links ]
ESCORCIA, R., MARTÍNEZ, N. & SILVA, J., 2012.- Estudio de la diversidad de arañas de un Bosque Seco Tropical (Bs-T) en Sabanalarga, Atlántico, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 16 (1): 247-260. [ Links ]
ESPINOSA, C.I., DE LA CRUZ, M., LUZURIAGA, A.L. & ESCUDERO, A., 2012.- Bosques tropicales secos de la región Pacífico Ecuatorial: diversidad, estructura, funcionamiento e implicaciones para la conservación. Ecosistemas, 21 (1-2): 167-179. [ Links ]
FARCIC, M., DEL-CLARO, K. & DOMINGOS, A., 2010.- Seasonal variation of ground spiders in a Brazilian Savanna. Zoologia, 27 (3): 353-362. [ Links ]
FERREIRA-OJEDA, L., FLÓREZ-D., E. & SABOGAL-GONZÁLEZ, A., 2009.- Arañas orbitelares de un bosque húmedo subtropical de la Sierra Nevada de Santa Marta (Magdalena, Colombia). Caldasia, 31(2): 381-391. [ Links ]
FLÓREZ, E., 1996.- Las arañas del departamento del Valle del Cauca. Un manual introductorio a su diversidad y clasificación. INCIVA-COLCIENCIAS, Cali. [ Links ]
FLÓREZ, E., 1998.- Estructura de comunidades de arañas (Araneae) en el departamento del Valle, suroccidente de Colombia. Caldasia, 20 (2): 173-192. [ Links ]
FLÓREZ, E., PINZÓN, J., SABOGAL, A. & BARRETO, N., 2004.- Selección de presas y composición de la dieta de la araña Alpaida variabilis (Araneae: Araneidae) en pastizales de la sabana de Bogotá, Colombia. Revista Ibérica de Aracnología, 9: 241-248. [ Links ]
FLÓREZ, E. & SÁNCHEZ, H., 1995.- La diversidad de los arácnidos en Colombia. Aproximación inicial: 327-372 (en) RANGEL, O. (ed.) Colombia Biótica I. Universidad Nacional de Colombia, INDERENA. [ Links ]
FOELIX, R.F., 2011.- Biology of spiders. 3rd ed. Oxford University Press, New York, USA. [ Links ]
GIRALDO, A., PÉREZ, D. & ARELLANO, G., 2004.- Respuesta de la comunidad de arañas epígeas (Araneae) en las lomas de Lachay, Perú, ante la ocurrencia del evento El Niño 1997-98. Ecología Aplicada, 3 (1-2): 45-58. [ Links ]
GÓMEZ-RODRÍGUEZ, J. & SALAZAR, C., 2012.- Arañas de la región montañosa de Miquihuana, Tamaulipas: listado faunístico y registros nuevos. Dugesiana, 19 (1): 1-7. [ Links ]
HAMMER, Ø., HARPER, D.A.T. & RYAN, P.D., 2001.- PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontología Electrónica, 4 (1). [ Links ]
JACKSON, R.R. & POLLARD, S.D., 1996.- Predatory behavior of jumping spiders. Annual Review of Entomology, 41: 287-308. [ Links ]
JÓQUE, R. & DIPPENAAR-SCHOEMAN, A.S., 2007.- Spider families of the world. Royal Museum for Central Africa. [ Links ]
LILJESTHRÖM, G., MINERVINO, E., CASTRO, D. & GONZÁLEZ, A., 2002.- La Comunidad de Arañas del Cultivo de Soja en la Provincia de Buenos Aires, Argentina. Neotropical Entomology, 31 (2): 197-210. [ Links ]
LIMA, A.L.A. & RODAL, M.J.N., 2010.- Phenology and wood density of plants growing in the semi-arid region of northeastern Brazil. Journal of Arid Environments, 74: 1363-1373. [ Links ]
MAASS, M. & BURGOS, A., 2011.- Water Dynamics at the Ecosystem Level in Seasonally Dry Tropical Forests: 141-156 (en) DIRZO, R., MOONEY, H., CEBALLOS, G. & YOUNG, H. (eds.) Seasonally Dry Tropical Forests: Ecology and Conservation. Island Press, Washington. [ Links ]
MARTÍNEZ, N., SALCEDO, G., SIERRA, K. & BARRAZA, J., 2012.- Escarabajos coprófagos (Coleoptera: Scarabaeinae) asociados a excrementos de mamíferos en un fragmento de bosque seco tropical en el departamento del Atlántico, Colombia. Ecología Austral, 22: 203-210. [ Links ]
MORÓN, E., 2004.- Descripción de las familias de arañas (Arácnida: Aranae) en un paleocauce del río Palomino, Dibulla-Guajira: Tesis, Universidad del Magdalena, Santa Marta. [ Links ]
OW, Y., 2001.- Influencia de las actividades agropecuarias en la diversidad y abundancia de arañas tejedoras en un bosque seco tropical en la Serranía de Pajuancho, municipio de Juan de Acosta, Atlántico: Tesis, Universidad del Atlántico, Barranquilla. [ Links ]
PEÑALOZA-VILLADIEGO, A., GARCÍA-GARRIDO, J., FLÓREZ-DAZA, E. & SAMPEDRO-MARÍN, A., 2013.- Araneofauna de la Reserva Forestal Protectora Serranía de Coraza. Sucre-Colombia. Revista Colombiana de Ciencia Animal, 5 (1): 36-47. [ Links ]
PERAFÁN, C., SABOGAL, A., MORENO-GONZÁLEZ, J., GARCÍA-RINCÓN, A., LUNA-SARMIENTO, D., ROMERO-ORTÍZ, C. & FLÓREZ, E., 2013.- Diagnóstico del estado actual de la fauna de arácnidos y de su gestión en Colombia (en) RUEDA-RAMÍREZ, D., TORRADO-LEÓN, E. & BECERRA, E. H. (comps.) Memorias Congreso Colombiano de Entomología. 40 Congreso Socolen. Bogotá, D.C., 10, 11 y 12 de julio de 2013. DVD. Sociedad Colombiana de Entomología – Socolen, Bogotá [ Links ].
PIZANO, C. & GARCÍA, H. (eds.), 2014.- El Bosque Seco Tropical en Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá [ Links ].
RAMÍREZ, M., 1999.- Orden Araneae (en) CRESPO, F., IGLESIAS, M. & VALVERDE, A. El ABC en la D terminación de artrópodos I. Ciudad universitaria pabellón II (1428) Capital federal, Argentina. [ Links ]
RANGEL-CH., J.O., LOWY, P. & SÁNCHEZ, H., 1995.- Región Caribe: 217-232 (en) RANGEL, J.O. Colombia Diversidad Biótica I. Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Bogotá [ Links ].
RICO, A., BELTRÁN, J., ÁLVAREZ A. & FLÓREZ, E., 2005.- Diversidad de arañas (Arachnida: Araneae) en el Parque Nacional Natural isla Gorgona, Pacífico colombiano. Biota Neotropica, 5 (1): 1-12. [ Links ]
ROMO, M. & FLÓREZ, E., 2008.- Comunidad de arañas orbitelares (Araneae: Orbiculariae) asociada al bosque altoandino del Santuario Flora y Fauna Galeras, Nariño, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 13 (1): 114 – 126. [ Links ]
SABOGAL, A., 2011.- Estudio comparativo de las comunidades de arañas asociadas a bosques conservados y áreas intervenidas en el Santuario de Flora y Fauna Otún Quimbaya (Risaralda, Colombia): Tesis, Universidad Nacional de Colombia, Bogotá [ Links ].
SEÑA, L. & ECHEVERRY, A., 2013.- Mariposas de la subfamilia Biblidinae (Lepidóptera: Nymphalidae) en un fragmento de Bosque Seco Tropical (Bs-T) en el departamento del Atlántico, Colombia: Tesis, Universidad del Atlántico, Barranquilla. [ Links ]
SPILLER, D.A. & SCHOENER, T.W., 1995.- Long-term variation in the effect of lizards on spider density is linked to rainfall. Oecologia, 103: 133-139. [ Links ]
TOTI, D.S., COYLE, F.A. & MILLER, J.A., 2000.- A structured inventory of Appalachian grass bald and heath bald spider assemblages and a test of species richness estimator performance. Journal of Arachnology, 28: 329-345. [ Links ]
UETZ, G., HALAJ, J. & CADY, A.B., 1999.- Guild structure of spiders in Makor Crops. Journal of Arachnology, 27: 270-280. [ Links ]
VALDERRAMA, C.A., 1996.- Comparación de la distribución vertical de arañas constructoras de telas orbiculares en tres zonas de un bosque nublado: Tesis, Universidad de los Andes, Bogotá [ Links ].
VANEGAS, S., FAGUA, G. & FLÓREZ, E., 2012.- Distribución vertical de arañas asociadas a Quercus humboldtii y Clusia spp. en el santuario de fauna y flora Iguaque, Colombia. Acta biol. Colomb., 17: 635 – 656. [ Links ]
VARGAS-ZAPATA, M.A., BOOM-URUETA, C.J., SEÑA-RAMOS, L.I., ECHEVERRY-IGLESIAS, A.L., MARTÍNEZ-HERNÁNDEZ N.J., 2015.- Composición vegetal, preferencias alimenticias y abundancia de Biblidinae (Lepidoptera: Nymphalidae) en un fragmento de bosque seco tropical en el departamento del Atlántico, Colombia. Acta biol. Colomb. 20(3):79-92. [ Links ]
WELLS, S.M., PYLE, R.M. & COLLINS, N.M., 1983.- The UICN invertebrate red. UICN, Gland, Switzerland. [ Links ]
WOLDA, H., 1988.- Insect seasonality: why? Annual Review of Ecology and Systematics, 19: 1-18. [ Links ]
WORLD SPIDER CATALOG, 2014.- World Spider Catalog. Natural History Museum Bern, online at http://wsc.nmbe.ch [ Links ]














