Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.20 no.1 Manizales Jan./June 2016
https://doi.org/10.17151/bccm.2016.20.1.6
DOI: 10.17151/bccm.2016.20.1.6
MANEJO DE MACRÓFITAS ACUÁTICAS EN LA ACUMULACIÓN Y TRANSFORMACIÓN DE CIANURO PRODUCTO DEL BENEFICIO DEL ORO EN LA MINA LA COQUETA*
MANAGEMENT OF AQUATIC MACROPHYTE IN ACCUMULATION AND TRANSFORMATION OF CYANIDE RESULTING FROM GOLD PROCESING IN THE MINE LA COQUETA
* FR: 15-II-2016. FA: 30-IX-2016.
1 Departamento de Química. Grupo de Investigación Estudios Ambientales en Agua y Suelo (GEAAS). Facultad de Ciencias Exactas y Naturales. Universidad de Caldas. A. A. 275.Calle 65 No 26 – 10, Manizales, Colombia.
2 Bióloga. Departamento de Ciencias Biológicas. Grupo de Investigación Estudios Ambientales en Agua y Suelo (GEAAS). Facultad de Ciencias Exactas y Naturales. Universidad de Caldas. A. A. 275.Calle 65 No 26 – 10, Manizales, Colombia.
**Autor correspondencia: jhon.galvis@ucaldas.edu.co; Teléfono: (576) 8781500 ext. 12426.Calle 65 No 26 – 10. Caldas, Colombia.
CÓMO CITAR:
JARAMILLO-SALAZAR, M.T., BUITRAGO-ESCOBAR, D.P., HENAO-VASCO, S.M. & GALVIS-GARCIA, J.H., 2016.- Manejo de macrófitas acuáticas en la acumulación y transformación de cianuro producto del beneficio del oro en la kmna La Coqueta. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 20 (1): 63-77. DOI : 10.17151/bccm.2016.20.1.6
Resumen
Las macrófitas acuáticas han sido utilizadas en procesos de biorremediación, ya que pueden absorber algunas sustancias disueltas y producir oxígeno mediante fotosíntesis. Con base en los estudios de remoción de compuestos tóxicos por parte de plantas acuáticas que permitan la depuración de aguas residuales, la presente investigación tuvo como propósito principal buscar la disminución de la contaminación por cianuro y la toxicidad de las aguas residuales del lavado de arena del proceso de cianuración de oro de la mina La Coqueta, mediante la utilización de macrófitas acuáticas flotantes (Eichhornia crassipes, Pistia stratiotes Salvinia auriculata); además, de acuerdo con los resultados de pruebas cualitativas, encontrar el destino final del cianuro en las plantas al ser absorbidos por éstas. El tratamiento de agua cianurada se realizó mediante un sistema de acuarios, los cuales contenían el agua proveniente de la mina, en ellos se depositaron las plantas para el tratamiento, se tomaron parámetros fisicoquímicos de control (pH, porcentaje de saturación de oxígeno y conductividad), además de la determinación de cianuro y toxicidad en el agua, pruebas cualitativas de compuestos nitrogenados en las plantas y bioensayos con Daphnia pulex en las plantas y en el agua tratada. Con base en los resultados de las pruebas cualitativas, se evidenció que las macrófitas pueden cambiar su metabolismo en condiciones de estrés y este cambio de metabolismo induce también a que se produzcan otro tipo de metabolitos secundarios no presentes naturalmente (e. g. glicósidos cianogénicos y alcaloides) en las plantas sometidas al tratamiento.La remoción de cianuro por parte de estas especies fue hasta del 86% al final del tratamiento, demostrando gran eficiencia para remover compuestos tóxicos del agua cianurada proveniente de la mina La Coqueta, ya que en los bioensayos realizados con Daphnia pulex indicaron que estos organismos podían resistir a las características del agua después del tratamiento con las plantas. Señalando que se puede realizar un tratamiento natural, ambientalmente seguro y económicamente viable que permita descontaminar el agua cianurada proveniente del lavado de las arenas del beneficio del oro a través del proceso de cianuración.
Palabras clave Cianuro, Eichhornia crassipes, fitorremediación, Salvinia auriculata, Pistia stratiotes.
Abstract
Aquatic macrophytes have been used in bioremediation processes, as they can absorb some dissolved substances and produce oxygen through photosynthesis. Based on the studies of toxic compounds removal by aquatic plants that allow wastewater treatment, this research had as main purpose to search the reduction of cyanide contamination and toxicity of waste water from sand washing in the cyanidation process in La Coqueta gold mine by means of the use of floating aquatic macrophytes (Eichhornia crassipes, Salvinia auriculata, Pistiastratiotes). Similarly, according to the results of qualitative tests, a goal was to find the final destiny of cyanide afterplants had absorbed it. Treatment of cyanide water was conducted through a system of tanks containing water from the mine in which plants for treatment were included and physicochemical control parameters (pH, oxygen saturation percentage and conductivity) were taken. Besides determination of cyanide and water toxicity, qualitative testsof nitrogenous compounds in plants and bioassays with Daphnia pulex in plants and in the treated water were determined. Based on the results of qualitative tests ti was evidenced that macrophytes can change their metabolism under stress conditions and this change in metabolism also induces the production of other types of secondary metabolites not present naturally (e.g. cyanogenic glycosides and alkaloids) in plants subjected to treatment. The removal of cyanide by these species was up to 86% at end of treatment, showing high efficiency for removal of toxic compounds of cyanide water from La Coqueta mine, as bioassays conducted using Daphnia pulex indicated that these organism could resist water characteristics after treatment with plants, noting that natural treatmentenvironmentally safe and economically feasible can be made to decontaminate cyanide water from the washing of sands resulting from cyanide gold processing.
Key words: Bioremediation, cyanide, La Coqueta mine, macrophytes, Daphnia pulex.
INTRODUCCIÓN
El hombre puede estar expuesto a cianuro a través de una gran variedad de compuestos, los cuales pueden ser de origen natural y antropogénico. Las plantas son los principales productores de cianuro en la naturaleza, ya que aproximadamente 2600 especies de plantas producen compuestos como los glicósidos cianogénicos (LUQUE, 2005); la biosíntesis de cianuro tiene lugar también en algunos animales y en microorganismos como bacterias, hongos y algas. Las principales fuentes de contaminación de origen antropogénico son los desechos de las industrias mineras de extracción de metales preciosos, industrias metalúrgicas del hierro y el acero y de las industrias químicas que producen distintos compuestos de cianuro, ya que tienen una gran afinidad con el oro y la plata (QUIROGA & OLMOS, 2009).
Los diferentes organismos cianogénicos poseen distintas rutas de producción de cianuro, las cuales pueden ser: 1.Síntesis directa como ocurre en bacterias, algas y hongos, y 2.Producción de intermediarios cianurados estables como son glicósidos cianogénicos y posterior degradación de éstos para producir cianuro, lo que ocurre en plantas y artrópodos (LUQUE, 2005). Entre los mecanismos de resistencia más importantes desarrollados por algunos seres vivos frente a la toxicidad del cianuro se encuentran dos: 1. La existencia de rutas de degradación de cianuro, y 2. La presencia de una cadena de transporte de electrones insensible a cianuro. La primera observación de la existencia de una respiración resistente a cianuro tuvo lugar en plantas (GENEVOIS, 1929).
Los mecanismos de resistencia a cianuro adoptados por las plantas cianogénicas incluyen la detoxificación de cianuro mediante la formación de B-cianoalanina, la inducción de una oxidasa alternativa insensible a cianuro y la compartimentación de los glicósidos cianogénicos y de las enzimas responsables de su degradación, evitando de esta forma la producción de cianuro en condiciones normales (POULTON, 1988; VANLERBERGHE & McINTOSH, 1997). Los glicósidos cianogénicos son compuestos nitrogenados no tóxicos en sí mismos, pero se degradan cuando la planta sufre daño mecánico y libera sustancias volátiles tóxicas como el cianuro de hidrógeno, el cual es una toxina de acción rápida que inhibe metaloproteínas como la citocromo oxidasa, enzima clave en la respiración mitocondrial (ÁVALOS & PÉREZ, 2009).
Una de las principales causas de la contaminación del agua son productos de las crecientes prácticas mineras, que presentan altos contenidos de cianuro, mercurio, arsénico y otros residuos derivados de estos procesos. El cianuro es utilizado ampliamente en la minería para la recuperación del oro, como consecuencia de esto el agua utilizada en este proceso estará contaminada y con un alto grado de toxicidad. Con base en los estudios de remoción de compuestos tóxicos por parte de plantas acuáticas que permitan la depuración de agua cianurada, la presente investigación tuvo el propósito de buscar la disminución en el laboratorio, de la contaminación y la toxicidad de las aguas residuales del proceso de cianuración de oro de la mina La Coqueta mediante la utilización de macrófitas acuáticas flotantes (Eichhornia crassipes, Pistia stratiotes y Salvinia auriculata), planteando alternativas económicamente viables y ambientalmente seguras con tratamientos biológicos, o sea sin generar o añadir químicos al medio para evitar que estos residuos sean dispuestos directamente a los afluentes cercanos y resulte perjudicial para la biota.
MATERIALES Y MÉTODOS
Las macrófitas escogidas para este estudio (Eichhornia crassipes, Pistia stratiotes y Salvinia auriculata), se recolectaron de un pequeño lago ubicado en el Centro Nacional de Investigaciones del Café (CENICAFÉ), La Granja, Chinchiná, Colombia. Las plantas fueron aclimatadas a las condiciones ambientales de Manizales en un estanque en el Jardín Botánico de la Universidad de Caldas, este tiempo de aclimatación consistió en proveer a la planta de los nutrientes necesarios para su establecimiento (Fósforo y Nitrógeno), durante un periodo de 60 días; posteriormente se realizaron los ensayos en el Laboratorio de Ecotoxicología de la Universidad de Caldas.
La parte experimental del proyecto se realizó durante 30 días, con renovación de las plantas cada 10 días, se evaluaron 5 tratamientos, cada uno con tres réplicas; los tres primeros correspondientes a cada una de las especies de las macrófitas acuáticas (E. crassipes, S. auriculata y P. stratiotes); el cuarto a un policultivo de las 3 especies, el quinto contenía agua cianurada (sin plantas) proveniente del beneficio del oro de la mina La Coqueta (Manizales, Caldas) y el blanco fue el estanque de aclimatación ubicado en el Jardín Botánico de la Universidad de Caldas que contenía un policultivo de las macrófitas acuáticas seleccionadas y marcadas. Cada 12 horas se registraron valores de los parámetros conductividad, pH, porcentaje de saturación de oxígeno y temperatura del agua; cada 24 horas en la salida de los reactores se determinó la concentración de cianuro, plomo, hierro, arsénico, zinc y sulfuros.
Determinación cualitativa de glicósidos cianogénicos
Para determinar la presencia cualitativa de glicósidos cianogénicos en las plantas se siguió la metodología propuesta por HARBONE (1972), la cual consiste en tomar 1 g/planta, cortarla finamente y ponerla en un tubo de ensayo con papel indicador de picrato sódico, añadirle 6 gotas de cloroformo y 1.5 mL de agua destilada. Un cambio de color de amarillo a un naranja o rojo ladrillo indica liberación de HCN por la planta, si este no cambia de color en dos horas el tubo se deja de 24 a 48 horas más, un cambio de coloración a las dos horas indica presencia de glicósidos cianogénicos y de enzimas hidrolíticas respectivas, si el cambio de coloración aparece a las 48 horas indica que los glicósidos cianogénicos se liberaron espontáneamente sin la acción de una enzima y, si no cambia de color, indica que la planta no posee glicósidos cianogénicos.
Determinación cualitativa de presencia de alcaloides
Se obtuvieron extractos de las plantas con el fin de identificar presencia de alcaloides, esto se realizó por medio de cromatografía de capa fina (TLC). Los extractos crudos fueron monitoreados empleando diferentes sistemas de elusión y revelando con lámpara de luz ultravioleta (UVGL-58) a 254 y 366 nm, solución al 50% de ácido sulfúrico en etanol y reactivo de Dragendorff (MALDONI, 1991).
Respiración resistente al cianuro
Se determinó la respiración resistente al cianuro por medio del Termómetro FlashLink®70613310 (Modelo 20901). La respuesta por la planta a la existencia a este mecanismo de defensa, se determina mediante un aumento de la temperatura ambiente hasta 14° C (GONZÁLEZ, 2008).
Incremento de la biomasa
Se calculó el aumento de biomasa por medio del crecimiento y reproducción de las macrófitas acuáticas.
La concentración de cianuro en el agua se determinó con el método colorimétrico 4500-CN (APHA, 2005). El porcentaje de remoción de cianuro se calculó con la siguiente fórmula:

Pruebas de toxicidad
Para determinar la toxicidad se realizaron bioensayos con Daphnia pulex (APHA, 2005). Este bioensayo es de tipo estático (sin renovación de la solución de prueba), con una duración 96 horas (prueba tipo aguda) para determinar el CL50-96, para cada prueba se realizaron observaciones a las 4, 6, 8, 12, 24, 48 y 96 horas de inicio de ésta. Como agua de dilución se empleó agua reconstituida de tipo semidura (80 a 100 mg/L como CaCO3). La evaluación toxicológica se realizó con los neonatos de la especie (< 24 h). Durante los bioensayos no se suministró alimento a los organismos de prueba.
ANÁLISIS ESTADÍSTICO
Se realizó un ANOVA con el programa Statgraphics Plus para Windows versión 5.1 DEMO, con el fin de evaluar si existen diferencias significativas entre las variables fisicoquímicas tomadas para los tratamientos y el control, entre el día y la noche, todo para cada fase del tratamiento. El análisis de los bioensayos realizados con Daphnia pulex se efectuó con el programa estadístico Probit versión 1.5, con el fin de hallar la concentración letal media (CL50) a las 96 horas de iniciada la prueba aguda.
RESULTADOS Y DISCUSIÓN
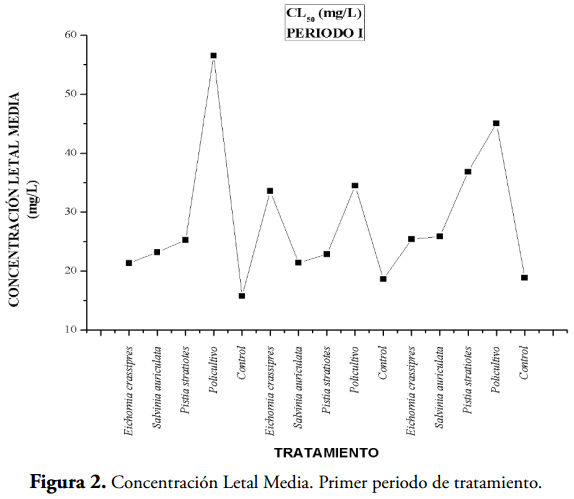
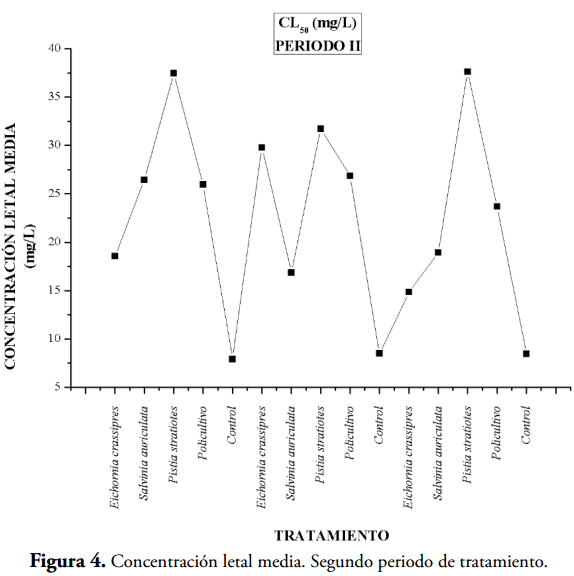
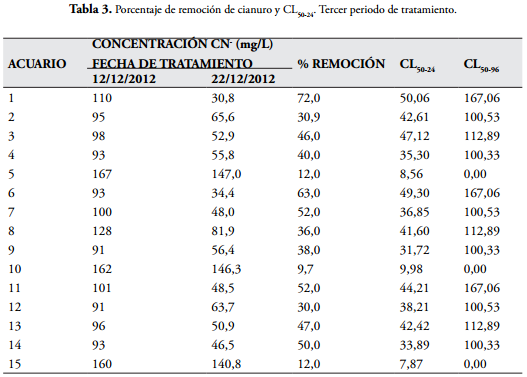
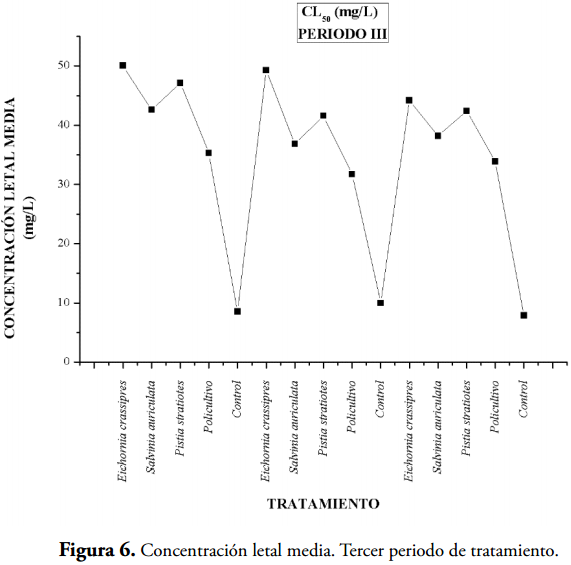
Los valores más bajos de concentración letal media, que implica una alta toxicidad, se presentaron en los controles (acuarios sin macrófitas 5, 10 y 15) y en los demás acuarios se observan valores mayores de CL50 indicando que las macrófitas acuáticas contribuyen a la detoxificación del agua residual (tablas 2 y 3), (Figuras 2,4 y 6). En la tabla 3 se evidencian valores de CL50-96 para las aguas residuales tratadas con las tres especies de macrófitas acuáticas y el policultivo, indicando esto un gran efecto detoxificador (Figuras 7).
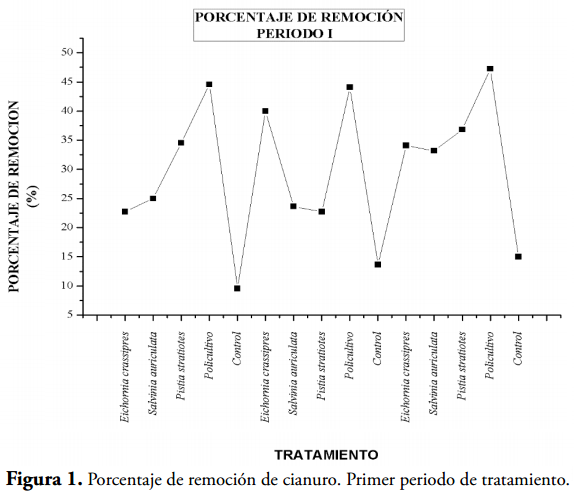
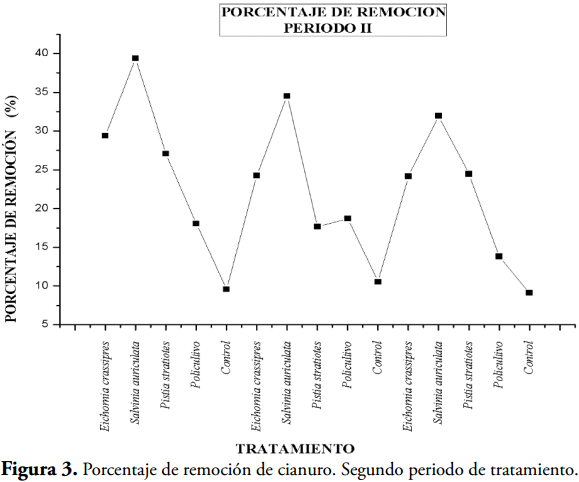
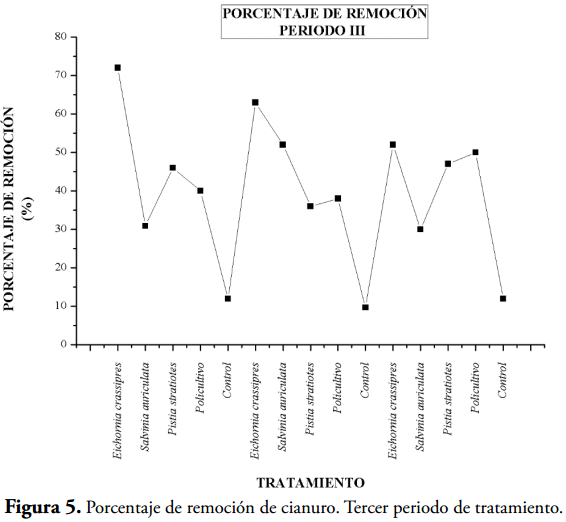
En las tablas 1, 2 y 3 y en las figuras 1, 3 y 5 se muestran los valores de concentración de cianuro al inicio y al final de cada jornada de tratamiento, junto al porcentaje de remoción, permitiéndonos deducir que las macrófitas acuáticas retiran cianuro del agua residual, siendo la más eficiente en la primera jornada el policultivo con valores de 44,55, 44,09, y 47,27% (Tabla 1, Figura 1); en la jornada del tratamiento II (Tabla 2, Figura 3), la planta más eficiente fue la Salvinia auriculata con porcentajes de remoción de 39,39, 34,53 y 31,97%.


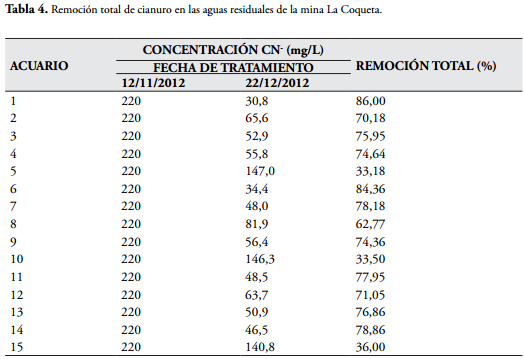
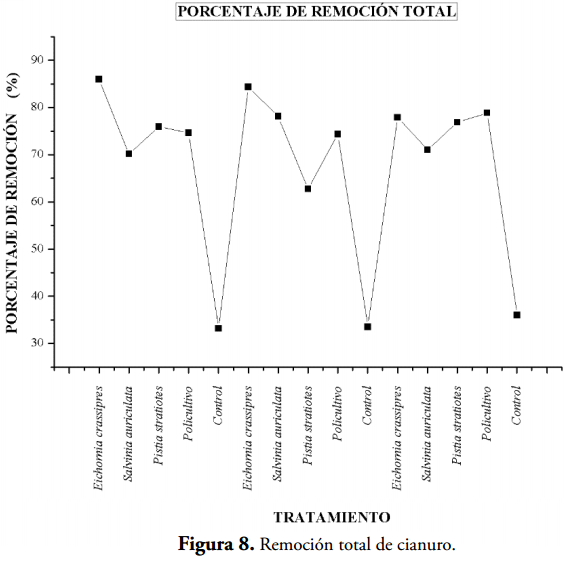
En la tercera jornada de tratamiento (Tabla 3 y Figura 5) la planta más eficiente en remoción del cianuro fue la Eichhornia crassipes con valores del 72, 63 y 52% Basándose en los resultados, se estableció que las macrófitas son fitorremediadoras para las aguas residuales procedentes de producto de lavado de arena de la cianuración, siendo E. crassipes la macrófita con el mejor comportamiento, debido a que presenta el mejor porcentaje de remoción total de CN- (86, 84,36 y 77,95%) (Tabla 4, Figura 8), además de presentar menor CL50.
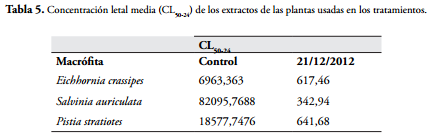
En la Tabla 5 se muestran resultados de los CL50 para los extractos de hojas de las plantas acuáticas. indicando de acuerdo con la disminución de los valores que la toxicidad se incrementa en las macrófitas debido a la absorción del cianuro entre otros contaminantes, siendo la menos tóxica la E. crassipes.
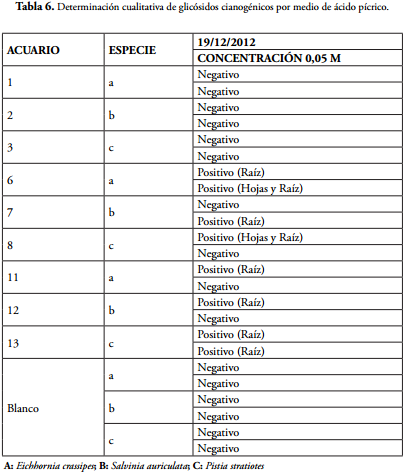
Las plantas en el control no mostraron la presencia de glicósidos cianogénicos, sin embargo, en las plantas expuestas al tratamiento, se evidenció cambio de color de amarillo a rojo ladrillo en el papel indicador picrato de sodio, en muestras de raíces y hojas de las tres especies (E. crassipes, P. stratiotes y S. auriculata), indicando la posible presencia de glicósidos cianogénicos y las respectivas enzimas hidrolíticas (Tabla 6).
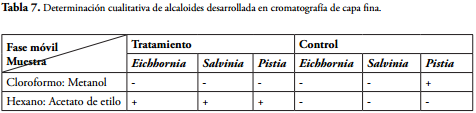
Respecto a la presencia de alcaloides, se observa en la tabla 7 que en el control sólo da positiva la prueba cualitativa que indica presencia de alcaloides polares en la Pistia stratiotes y negativa para las tres especies respecto a alcaloides no polares. Para las plantas después del tratamiento se observó que dio positiva la prueba para la presencia de alcaloides no polares en las tres especies.

Los glicósidos cianogénicos se presentan como defensa ante la herbivoría en las plantas que los poseen naturalmente (MALAGÓN & GARRIDO, 1990) y por ello, son liberados cuando la planta sufre un daño mecánico o es atacada, pero en las macrófitas acuáticas solo se presentaron cuando fueron sometidas al tratamiento con agua cianurada, lo que nos induce a pensar que no solo los glicósidos cianogénicos se encuentran de manera natural en las plantas, sino que también se pueden formar ante la presencia de nitrógeno en forma de cianuro, o ante el estrés producido por este compuesto. Esta información será corroborada a través de la cuantificación de los glicósidos cianogénicos, debido a que no se encuentra reportada en la literatura la presencia de glicósidos cianogénicos en las especies utilizadas en este estudio.
DISCUSIÓN
De acuerdo con los resultados experimentales respecto a la presencia de glicósidos cianogénicos y alcaloides (pruebas cualitativas), se sugiere que E. crassipes, S. auriculata y P. stratiotes tienen dos vías metabólicas para asimilar cianuro: la acumulación de glicósidos cianogénicos y la formación de alcaloides.
Los alcaloides relacionados con fases polares (cloroformo, metanol) están naturalmente presentes sólo en P. stratiotes, mientras que en las macrófitas acuáticas sometidas a tratamiento aparentemente no presentan alcaloides de esta naturaleza. Los alcaloides de tipo no polares se presentan (acetato de etilo, hexano) en las macrófitas sometidos a tratamiento con agua cianurada, pero no en el estado natural. En síntesis, los metabolitos secundarios de tipo alcaloidal presentan modificaciones respecto a las que se encuentran de forma natural debido al cambio de polaridad.
Se evidenció un aumento en la toxicidad de las macrófitas acuáticas al final del tratamiento con agua residual cianurada, lo que implica la necesidad de realizar un seguimiento a las macrófitas para su disposición final.
Los ensayos de toxicidad in vivo realizados con Daphnia pulex, demostraron que las macrófitas acuáticas presentaron una detoxificación del agua cianurada después de 30 días de tratamiento, ya que algunos organismos sobrevivieron hasta las 96 horas donde se terminó el bioensayo propuesto.
AGRADECIMIENTOS
A la Universidad de Caldas por permitirnos realizar esta investigación, por el apoyo económico y logístico brindado; al Ingeniero Alfredo Díaz Durán (QEPD) dueño de la mina La Coqueta por el apoyo financiero y el interés real y efectivo para proteger el medio ambiente. A José Humberto Gallego, Director del Jardín Botánico de la Universidad de Caldas, por su cooperación logística para el desarrollo de la investigación y el funcionamiento provisional del laboratorio de Ecotoxicología. A los integrantes del Semillero GEAAS por su dedicación y aportes.
REFERENCIAS
APHA, AWWA & WEF, 2005.- Standard Methods for the Examination of Water and Wastewater. Ed. 21. American Public Health Association, Washington, DC. [ Links ]
FINNEY, D. L., 1978.- Statistical Method in Biological Assay. London: High Wycombe. [ Links ]
HARBORNE, J. B., 1972.- Cyanogenic glucosides and their function. Phytochemicalecology. Academic Press, London: 104-123. [ Links ]
LUQUE, V. M., 2005.- Metabolismo del cianuro y del cianato en Pseudomonas pseudoalcaligenes CECT5344. Aplicaciones biotecnológicas. Pp. 23-57. [ Links ]
MALAGÓN, J. & A. GARRIDO.- 1990. Relación entre el contenido en glicósidos cianogenéticos y la resistencia a Capnodistene brionis (L.) en frutales de hueso. Bol. San. Veg. Plagas, 2: 499-503. [ Links ]
MALDONI, B., 1991.- Alkaloids: Isolation and Purification. Journal of Chemical Education. Universidad Nacional del Sur. Bahía Blanca, Argentina. 68: 700 - 703. [ Links ]
NOVOTNY, V. & H. OLEM, 1994.- Water Quality. Prevention, Identification and Management of Diffuse Pollution. New York: Van Nostrand Reinhold. [ Links ]
POULTON, J., 1990. Cyanogenesis in plants. Plant Physiology 94: 401 – 405. [ Links ]
QUIROGA P. N & V. OLMOS, 2009.- Revisión de la toxicocinética y la toxicodinamia del ácido cianhídrico y los cianuros. Acta Toxicológica de Argentina 17: 20-32. [ Links ]
VANLERBERGHE G. C. & L. McINTOSH, 1997.- Alternative oxidase: From Gene to Function. Annual Review of Plant Physiology and Plant Molecular Biology 48: 703–734. [ Links ]














