Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.20 no.2 Manizales jul./dic. 2016
https://doi.org/10.17151/bccm.2016.20.2.8
DOI: 10.17151/bccm.2016.20.2.8
ISOLATION OF ENTOMOPATHOGENIC NEMATODES NATIVE IN RAW CANE SUGAR CROPS AND PATHOGENICITY TESTS ON Diatraea saccharalis (LEPIDOPTERA: CRAMBIDAE)
* FR: 23-IX-16. FA: 18-X-16.
1 Estudiante Ingeniería Agronómica. Universidad de Caldas, Manizales, Colombia. E-mail: rubian069@hotmail.com. ORCID: 0000-0002-2321-0049
2 I.A., M.Sc., Ph.D. Departamento de Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia. E-mail: alberto.soto@ucaldas.edu.co. ORCID: 0000-0002-9727-8919
Los nematodos entomopatógenos son organismos habitantes del suelo que interactúan como importantes reguladores de su ecosistema, los cuales son utilizados como controladores de plagas en cultivos de importancia comercial. En este estudio se determinó la presencia de nematodos nativos en suelos provenientes de cultivos de caña panelera de los municipios de Supía, Riosucio y Filadelfia del departamento de Caldas. Se evaluó igualmente la mortalidad que causan dichos organismos sobre larvas de Diatraea saccharalis. Se encontraron 15 aislamientos pertenecientes al género Steinernema y 6 al género Heterorhabditis. Se seleccionaron 10 de los aislamientos de nematodos más virulentos sobre Galleria mellonella (nueve de Steinernema y uno de Heterorhabditis) para inoculación in vitro sobre larvas de último instar de D. saccharalis, empleando el método de inmersión, mostrando mortalidades entre el 10% y el 52%, 72 horas después de la infestación. Estos resultados contribuyen al conocimiento de la diversidad de nematodos entomopatógenos en el departamento de Caldas y dan una perspectiva del posible empleo de estos organismos como un componente importante del manejo integrado de Diatraea en caña panelera.
Palabras clave: control biológico, manejo integrado de plagas, Steinernema, Heterorhabditis.
AbstractEntomopathogenic nematodes are soil-dwelling organisms acting as important regulators of their ecosystem which are currently used as controllers of pests in commercially important crops. In this study, the presence of native nematode in soils from raw cane sugar crops located at the municipalities of Supía, Riosucio and Filadelfia of the Department of Caldas, was determined. The mortality caused by these organisms on larvae of Diatraea saccharalis was also evaluated. Fifteen isolates belonging to the genus Steinernema and 6 to the genus Heterorhabditis were found. Ten of the most virulent nematodes on Galleria mellonella (nine Steinernema and one Heterorhabditis) were selected for in vitro inoculation on last instar larvae of D. saccharalis using the immersion method, showing insect mortalities ranging from 10% and 52%, 72 hours after infestation. These results contribute to the knowledge of the diversity of entomopathogenic nematodes in the department of Caldas and give a perspective on the possible use of these organisms as an important component in the integrated management of Diatraea in raw cane sugar.
Key words: biological control, integrated pest management, Steinernema, Heterorhabditis.
El barrenador Diatraea spp. (Lepidoptera: Crambidae) es considerado la plaga más nociva para las plantaciones de caña de azúcar, de la cual se extraen azúcar, panela y biocombustibles (GALLO et al., 2002; BADILLA & GÓMEZ, 2003; VARGAS et al., 2013). Este insecto presenta amplia distribución y su presencia ocurre durante todo el ciclo del cultivo (GÓMEZ & LASTRA, 1995; PÉREZ & MARTÍNEZ, 2011). El hábitat críptico que presentan las larvas hace que el control químico sea poco eficaz como medida de control. Debido a esto, organismos entomopatógenos que habitan el suelo como hongos (ARCAS et al., 1999; GONGORA, 2008), bacterias (RAMOS et al., 2004) y nematodos entomopatógenos (NEP) (KAYA & GAUGLER, 1993; SÁNCHEZ & RODRÍGUEZ, 2007; CAMPOS et al., 2008; BATALLA-CARRERA et al., 2010), son objeto de estudio sobre el barrenador con el fin de incorporarlos en programas de manejo integrado de la plaga en cultivos de caña de azúcar, reduciendo el impacto ambiental y contribuyendo a la preservación de la diversidad a través de una menor presión sobre las especies (GÓMEZ, 1995).
Los NEP (Rhabditida: Steinernematidae y Heterorhabditidae) son habitantes del suelo que parasitan artrópodos, principalmente insectos en estados inmaduros, gracias a que poseen una relación simbiótica con bacterias gram-negativas de los géneros Xenorhabdus (THOMAS & POINAR, 1979) y Photorhabdus (BOEMARE et al., 1993). Esta simbiosis es altamente eficaz y tiene la capacidad de matar a su hospedante entre 24 y 72 h después del ingreso del nematodo en estado infectivo (J3 ó JI) a la cavidad hemocélica, principalmente a través de las aberturas naturales. Los heterorhabditidos poseen una estructura quitinizada (diente) capaz de perforar la cutícula (BEDDING & MOLYNEUX, 1982). En el hemocele, el nematodo libera una colonia de bacterias entomopatógenas cuya función es degradar los tejidos hasta ocasionar la muerte del hospedante por septicemia (BURNELL & STOCK, 2000), propiciando a la vez un medio de alimentación para el nematodo. Las bacterias asociadas a los NEP presentan un cuadro típico de infección en el que la coloración del cadáver permite identificar el género de NEP involucrado (POINAR, 1979). Los NEP's presentan buen potencial en el control de plagas en cultivos de caña de azúcar (BELLINI & DOLINSKI, 2012), estando asociados actualmente a investigaciones (FERRER et al., 2004; TAVARES et al., 2007) que buscan su incorporación en el MIP del sistema productivo. Los aislamientos e investigaciones de NEP en predios destinados al cultivo poseen gran potencial, debido a que estos organismos son atraídos por compuestos radiculares exudados por la caña de azúcar (TONELLI, 2014).
El objetivo del presente trabajo fue aislar NEP nativos en suelos provenientes de cultivos de caña panelera de los municipios de Supía, Riosucio y Filadelfia del departamento de Caldas y evaluar la patogenicidad que presentan dichos organismos a larvas de D. saccharalis.
MATERIALES Y MÉTODOSEl estudio se realizó en el Laboratorio de Control Biológico y en el Centro de Investigación y Cría de Enemigos Naturales de la Universidad de Caldas, ubicado en Manizales (Coordenadas 5°05'N y 75°40' W), y se dividió en dos fases:
1. Fase de búsqueda y aislamiento: se seleccionaron 17 predios sembrados en caña panelera que presentaran alta infestación de Diatraea spp. en Supía, Riosucio y Filadelfia de Caldas. En cada predio se tomaron cinco muestras de suelo de 500 g y se depositaron en bolsas plásticas previamente rotuladas, las cuales se llevaron al Laboratorio de Control Biológico de la Universidad de Caldas para su análisis. Los sitios de muestreo se georreferenciaron.
Para determinar la presencia de NEP nativos se utilizó la técnica conocida como "insecto trampa" descrita por BEDDING & AKHURST (1975), la cual consistió en depositar 500 g de suelo en un recipiente plástico y 10 larvas de último instar de Galleria mellonella (Lepidoptera: Pyralidae), conocida por su alta susceptibilidad a dichos organismos (SHAPIRO et al., 2002; ARANDA & BUSTILLO, 2007). Las muestras permanecieron en la oscuridad y a temperatura ambiente durante 10 días; a partir del quinto día se inició la extracción de larvas de G. mellonella muertas, se ubicaron en cajas Petri y se sometieron a un periodo de incubación de 72 h a 250C. Las larvas que presentaron síntomas por ataque de nematodos (POINAR, 1979) fueron aisladas y se ubicaron posteriormente en trampas ':White' modificadas por KAYA & STOCK (1997), con el fin de aislar NEP. Las larvas infectadas permanecieron durante 9 días en las respectivas trampas, mientras se realizaron cosecha de NEP a los 5, 7 y 9 días. Finalmente, se observó la actividad de los NEP al contar el número de juveniles infectivos observados en 10 alícuotas (10 ul), con ayuda de un estereomicroscopio marca Olympus. Después de decantar tres veces cada muestra de NEP, se almacenaron en tubos Falcon® de 50 mL en solución de hipoclorito de sodio [0,05%] + bicarbonato de sodio [0,5%], con concentraciones de NEP /mL no superiores a 5.000 individuos y se ubicaron en refrigerador a temperatura promedio de 160C durante 15 días para analizar la supervivencia y garantizar la virulencia de los juveniles infectivos al momento de realizar las inoculaciones (MOLINA et al., 2006; ANDALO et al., 2011).
2. Pruebas de patogenicidad (in vitro) sobre D. saccharalis: se seleccionaron los 10 aislamientos de NEP que presentaron mayor virulencia sobre G. mellonella, basados en los criterios de porcentaje de mortalidad de larvas (mayor o igual al 70%), reproducción (número de juveniles infectivos emergentes con promedio superior a 70.000 NEP/larva) y porcentaje de supervivencia (superior a 80% después de 15 días de almacenamiento) (Tabla 1). Se evaluó la mortalidad de las larvas a las 24, 48 y 72 h después de las inoculaciones llevadas a cabo por el método de inmersión, en las que se utilizaron soluciones de 100 mL con 400.000 NEP de cada aislamiento (4.000 JI/mL), de acuerdo con la metodología propuesta por SHAPIRO et al. (2002). Se utilizó el diseño completamente al azar con 10 repeticiones por tratamiento, cada unidad experimental estuvo conformada por una caja Petri de 9,0 cm de diámetro y 10 larvas de último instar de D. saccharalis con dieta suministrada por el laboratorio Bioagro para la alimentación de las larvas, en ausencia de luz y a temperatura ambiente. Se realizaron evaluaciones de mortalidad a las 24 h, 48 h y 72 h después de la infestación, sometiendo las larvas muertas al mismo proceso de aislamiento de NEP descrito para G. mellonella. El tratamiento testigo consistió en larvas de D. saccharalis inmersas en agua destilada.
RESULTADOS Y DISCUSIÓNLos resultados muestran una alta presencia de NEP en la zona de estudio, ya que el porcentaje de aislamientos positivos alcanzó el 88,2%, valor probablemente relacionado con las prácticas de agricultura de baja intensidad (CAMPOS et al., 2008) que se desarrollan en torno al cultivo de la caña panelera en los municipios de estudio. Se presentó mortalidad de larvas de G. mellonella entre el 8% y el 92% (Tabla 1), existiendo una relación directa entre el porcentaje de larvas muertas y el número de JIs. emergentes por larva (Figura 1), debido probablemente al número de JIs. que ingresaron a la cavidad hemocélica de cada larva y se reprodujeron exitosamente.

En el 100% de los aislamientos positivos se observó la presencia de nematodos del género Steinernemay 40% de ellos adicionalmente el género Heterorhabditis.
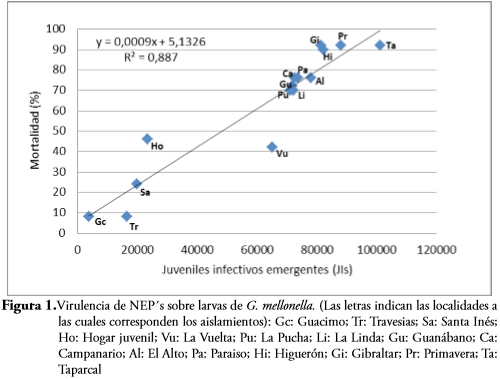
El promedio de JIs. emergentes por larva muestra una alta capacidad de reproducción de los NEP nativos en larvas de G. mellonella. Diez aislamientos, entre ellos nueve del género Steinernemaspp. y uno de Heterorhabditis spp., superaron el promedio de JIs./larva de 70.000 y muestran a la vez un porcentaje de supervivencia al almacenamiento superior a 80%. Estos aislamientos fueron seleccionados para realizar las respectivas inoculaciones sobre D. saccharalis, cuya mortalidad después de 72 h se presenta en la Tabla 2.
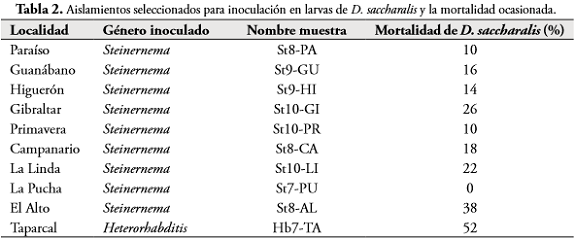
La mortalidad presentada por D. saccharalis evidencia la capacidad de los NEP's nativos de ingresar al cuerpo de las larvas del barrenador y cumplir su función como parásito. El género Heterorhabditis spp. (Hb7-TA) mostró un mejor comportamiento durante el ensayo, tal como se ha evidenciado en otras investigaciones (BELLINI & DOLINSKI, 2012), alcanzando una mortalidad de 52%, seguido por el aislamiento de Steinernemaspp. (St8-AL) con 38%. El aislamiento La Pucha no presentó ningún grado de virulencia sobre D. saccharalis, mientras que el resto de aislamientos virulentos de Steinernemaspp. ocasionaron mortalidad entre el 10% y 38% (Tabla 2). El tratamiento testigo no registró mortalidad de larvas de D. saccharalis.
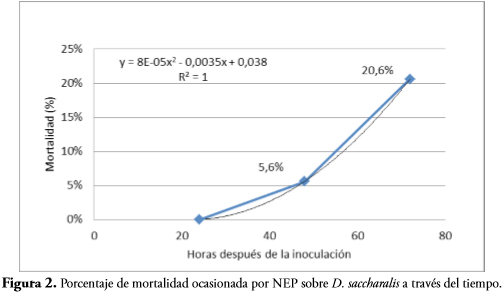
Los resultados evidencian que la mortalidad de larvas se inició entre las 24 y 48 h después de la inoculación, alcanzando un valor promedio de 20,6% a las 72 h (Figura 2)
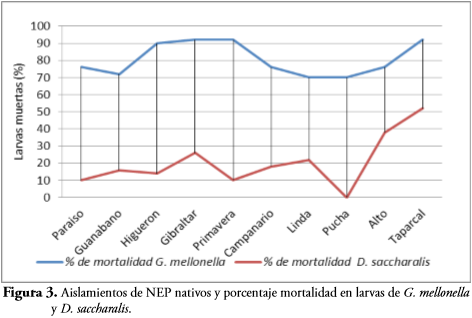
En la Figura 3 se relaciona el comportamiento de los nematodos nativos sobre G. mellonella y D. saccharalis en estado larval. Taparcal (Hb7-TA) evidencia los mayores porcentajes de mortalidad en los dos artrópodos, presentando un efecto de virulencia alto sobre G. mellonella (92%) y superando el 50% sobre D. saccharalis. El Alto (St8-AL), presentó el comportamiento con menor heterogeneidad en la mortalidad ocasionada con 75% sobre G. mellonella y 38% sobre D. saccharalis, los demás tratamientos presentaron un comportamiento variable en relación al grado de virulencia ocasionado sobre ambas especies. El aislamiento La Pucha (St7-PU) no presentó ningún efecto de mortalidad sobre D. saccharalis, por lo cual se infiere que en total el 90% de los aislamientos seleccionados para inoculaciones son virulentos sobre larvas de D. saccharalis.
La integración de NEP en el manejo de plagas de la caña de azúcar es una propuesta interesante analizada con anterioridad por varios autores, donde indiscutiblemente se presentan diferentes retos en torno a su uso como controladores biológicos debido a sus dificultades cuando se exponen a condiciones extremas; sin embargo, gracias al conocimiento que se ha alcanzado en la nematología entomológica, se sabe que es posible combinar el efecto letal de los NEP con efectos sinérgicos propiciados por la interacción con organismos como Bacillus thuringiensis(KOPPENHOFER & KAYA, 1997; POLANCZIK & ALVES, 2005) y Metarhizium anisopliae (ANSARI et al., 2004), entre otros, y que además este efecto puede ser potencializado con productos que reducen la susceptibilidad a los ambientes externos como inhibidores de luz UV y humectantes que reducen la desecación en el exterior (SMITS, 1996; ANSARI et al. 2004; SCHROER et al., 2005; JUNG & KIM, 2006; DELGADO & APONTE, 2012).
El alto porcentaje de aislamientos positivos de NEP encontrado (88,2%), demuestra una alta presencia de dichos organismos asociados al cultivo de caña panelera y sugiere que la zona de estudio posee ecosistemas edáficos con amplia diversidad por explorar, teoría reforzada por el hallazgo de múltiples larvas de G. mellonella afectadas por hongos entomopatógenos durante las evaluaciones. Su estudio y aplicación pueden contribuir con la reducción de la aplicación de agroquímicos en este y otros sistemas productivos agrícolas, apoyados en las cualidades que tienen estos organismos como lo son: su amplia distribución, elevada tasa reproductiva, ciclo de vida corto, capacidad de búsqueda y otras ventajas que los definen como excelentes controladores biológicos.
Los aislamientos de Heterorhabditis Hb7-TA y de Steinernema St8-AL, evidenciaron características propias de JIs. deseables en un programa de manejo de plagas, hecho que debe ser verificado en campo por investigaciones futuras, complementándolas con la especialización de NEP en plagas de interés a través de la inoculación de múltiples generaciones de JIs. sobre la misma especie.
AGRADECIMIENTOSA la Vicerrectoría de Proyección de la Universidad de Caldas, y al Proyecto "Implementación del Centro de Investigación, Innovación y Tecnología al sector Panelero del departamento de Caldas-Centro BEKDAU" por el financiamiento de la investigación.
ANDALÓ, V., MOINO Jr, A., MAXIMINIANO, C., CAMPOS, V.P. & MENDONÇA, L., 2011.- Influence of temperature and duration of storage on the lipid reserves of entomopathogenic nematodes. Revista Colombiana de Entomología, 37(2): 203-209. [ Links ]
ANSARI, M.A., TIRRY, L. & MOENS, M., 2004.- Interaction between Metarhizium anisopliae CLO 53 and entomopathogenic nematodes for the control of Hoplia philanthus. Biological Control, 31(2): 172-180. [ Links ]
ARANDA, R. & BUSTILLO, A.E., 2007.- Optimización de la cría de Galleria mellonella (L.) para la producción de nematodos entomopatógenos parásitos de la broca del café. Cenicafé. Colombia, 58(2): 142–157. [ Links ]
ARCAS, J.A., DÍAZ, B.M. & LECUONA, R.E., 1999.- Bioinsecticidal activity of conidia and dry mycelium preparations of two isolates of Beauveria bassiana against the sugarcane borer Diatraea saccharalis. Journal of Biotechnology, 67(2-3): 151-158. [ Links ]
BADILLA, F. & GÓMEZ, J., 2003.- Pérdidas de azúcar causadas por Diatraea spp. en Nueva Concepción, Guatemala. Manejo Integrado de Plagas Y Agroecología (Costa Rica), 67: 18–22. [ Links ]
BATALLA-CARRERA, L., MORTON, A. & GARCÍA-DELPINO, F., 2010.- Efficacy of entomopathogenic nematodes against the tomato leafminer Tuta absoluta in laboratory and greenhouse conditions. BioControl, 55(4): 523-530. [ Links ]
BEDDING, R.A. & AKHURST, R.J., 1975.- A simple technique for Soil, the detection of insect parasitic rhabditid nematodes in soil. Nematologica, 21: 109-110. [ Links ]
BEDDING, R.A. & MOLYNEUX, A.S., 1982.- Penetration of insect cuticle by infective juveniles of Heterorhabditis spp. (Heterorhabditidae: Nematoda). Nematologica, 28(3): 354-359. [ Links ]
BELLINI, L. & DOLINSKI, C., 2012.- Foliar application of entomopathogenic nematodes (Rhabditida: Steinernematidae and Heterorhabditidae) for the control of Diatraea saccharalis in greenhouse. Semina: Ciências Agrárias, 33(3): 997-1004. [ Links ]
BOEMARE, N.E., AKHURST, R.J. & MOURANT, R.G., 1993.- DNA relatedness between Xenorhabdus spp. (Enterobacteriaceae), Symbiotic Bacteria of Entomopathogenic Nematodes, and a Proposal to Transfer Xenorhabdus luminescens to a new genus, Photorhabdus gen. nov. International Journal of Systematic and Evolutionary Microbiology, (18): 249-255. [ Links ]
BURNELL, A.M. & STOCK, S.P., 2000.- Heterorhabditis, Steinernema and their bacterial symbionts - lethal pathogens of insects. Nematology, 2(1): 31-42. [ Links ]
[ Links ]
DELGADO, Y. & APONTE, A.S., 2012.- Virulencia, producción y desplazamiento de nematodos entomopatógenos sobre larvas del picudo de la guayaba Conotrachelus psidii Marshall (Coleoptera: Curculionidae) en laboratorio. Universitas Scientiarum, 17(3): 283-290. [ Links ]
FERRER, F., ARIAS, M., TRELLES, A., PALENCIA, G., NAVARRO, J.M. & COLMENAREZ, R., 2004.- Posibilidades del uso de nematodos entomopatógenos para el control de Aeneolamia varia en caña de azúcar. Manejo Integrado de Plagas Y Agroecología (Costa Rica), (72): 39-43. [ Links ]
GALLO, D., NAKANO, O., SILVEIRA NETO, S., CARVALHO, R.P.L., BATISTA, G.C., BERTI FILHO, E. & VENDRAMIM, J.D., 2002.- Entomologia Agrícola. São Paulo, Ceres. [ Links ]
GÓMEZ, L.A., 1995.- Manipulación y aumento de enemigos naturales en el MIP. Bases Tecnológicas del MIP, p. 93-100. [ Links ]
GÓMEZ, L.A. & LASTRA, L.A., 1995.- Insectos asociados con la caña de azúcar en Colombia. Cenicaña. Cali, 249-253. [ Links ]
GÓNGORA, C.E., 2008.- Los hongos entomopatógenos en el control de insectos: 133-149 (en) BUSTILLO, A.E. Los insectos y sumanejo en la caficultura colombiana. FNC, Cenicafe, Chinchiná [ Links ].
JUNG, S. & KIM, Y., 2006.- Synergistic effect of Xenorhabdus nematophila K1 and Bacillus thuringiensis subsp. aizawai against Spodoptera exigua (Lepidoptera: Noctuidae). Biological Control, 39(2): 201-209. [ Links ]
KAYA, H.K. & GAUGLER, R., 1993.- Entomopathogenic Nematodes. Annual review of Entomology, 38(1): 181-206. [ Links ]
KAYA, H.K. & STOCK, S.P., 1997.- Techniques in insect nematology. Manual of Techniques in Insect Pathology, 1: 281-324. [ Links ]
KOPPENHÖFER, A.M. & KAYA, H.K., 1997.- Additive and Synergistic Interaction between Entomopathogenic Nematodes and Bacillus thuringiensis for Scarab Grub Control. Biological Control, 8(2): 131-137. [ Links ]
MOLINA, J.P., MOINO Jr, A., SOUSA, R., ANDALÓ, V. & APARECIDA, L., 2006.- Effect of temperature, concentration and storage time on the survival of entomopathogenic nematodes. Revista Colombiana de Entomología, 32(1): 24-30. [ Links ]
PÉREZ, E. & MARTÍNEZ, K., 2011.- Distribución espacial y ciclo de vida de Diatraea spp. en plantaciones de Saccharum officinarum (Caquetá, Colombia). Ingenierías & Amazonia, 4(2): 122-130. [ Links ]
POINAR, G.O., 1979.- Nematodes for biological control of insects. Boca Raton, Florida. 227 p. [ Links ]
POLANCZYK, R.A., ALVES, S.B., 2005.- Interação entre Bacillus thuringiensis e outros entomopatógenos no controle de Spodoptera frugiperda. Manejo Integrado de Plagas y Agroecología (Costa Rica), 74(1): 24-33 [ Links ]
RAMOS, F., CARMONA, A. & BERES, M., 2004.- Evaluación de aislamientos de Bacillus thuringiensistóxicos a Diatraea saccharalis (Lepidoptera: Pyralidae). Bioagro, 16(3): 183-188. [ Links ]
SÁNCHEZ, L. & RODRÍGUEZ, M.G., 2007.- Potencialidades de Heterorhabditis bacteriophora Poinar cepa HC1 para el manejo de Hypothenemus hampei Ferr. Parasitismo y capacidad de búsqueda. Revista de Protección Vegetal, 22 (2): 80-84. [ Links ]
SHAPIRO, D.I., GAUGLER, R., TEDDERS, W.L., BROWN, I. & LEWIS, E.E., 2002.- Optimization of inoculation for in vivo production of entomopathogenic nematodes. Journal of Nematology, 34(4): 343-350. [ Links ]
SMITS, P.H., 1996.- Post-application Persistence of Entomopathogenic Nematodes. Biocontrol Science and Technology, 6(3): 379-388. [ Links ]
SCHROER, S., YI, X. & EHLERS, R.U., 2005.- Evaluation of adjuvants for foliar application of Steinernema carpocapsae against larvae of the diamondback moth (Plutella xylostella), Nematology, 7(1): 37-44. [ Links ]
TAVARES, F.M., FILHO, A., LEITE, L.G., ALMEIDA, L.C., SILVA, A.C. & AMBRÓS, C.M., 2007.- Efeito de Heterorhabditis indica e Steinernemasp.(Nemata: Rhabditida) sobre larvas do bicudo da cana-de-açúcar, Sphenophorus levis (Coleoptera: Curculionidae), em laboratório e casa-de-vegetação. Nematologia Brasileira, 31(1): 12-19. [ Links ]
THOMAS, G.M., & POINAR, G.O., 1979.- Xenorhabdus gen. nov., a genus of entomopathogenic, nematophilic bacteria of the family Enterobacteriaceae. International Journal of Systematic and Evolutionary Microbiology, 29(4): 352-360. [ Links ]
TONELLI, M., 2014.- Resposta de nematoides entomopatogênicos aos voláteis radiculares de cana-de-açúcar (Saccharum officinarum L.) sob herbivoria de ninfas de Mahanarva fimbriolata (Stal) (Hemiptera: Cercopidae) (Mestrado dissertação, Escola Superior de Agricultura "Luiz de Queiroz"). 49 p. [ Links ]
VARGAS, G., LASTRA, L.A., VILLEGAS, A. & BARCO, L.E., 2013.- Diatraea tabernella: Nueva especie de barrenador del tallo en el valle del río Cauca. Importancia y perspectivas de manejo. Serie divulgativa N° 16. Cali. Cenicaña, Cali. [ Links ]














