Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.20 no.2 Manizales July/Dec. 2016
https://doi.org/10.17151/bccm.2016.20.2.14
DOI: 10.17151/bccm.2016.20.2.14
USE OF MICROHABIT BY ANURANS IN AN INTERVENED DRY FOREST FRAGMENT OF THE MAGDALENA MEDIO AREA IN GUARINOCITO, CALDAS
1 Universidad del Valle, Departamento de Biología. Programa Académico de Biología. Cali, Colombia. Email: cromanpa94@gmail.com, sarachan801@gmail.com, mon9212@gmail.com, jun.ishida@correounivalle.edu.co, jenny.gallo@correounivalle.edu.co
2 Universidad del Valle. Departamento de Biología, Grupo de Investigación en Ecología Animal. Cali, Colombia. Email: wilmar.bolivar@correounivalle.edu.co, alan.giraldo@correounivalle.edu.co, ecología.animal@correounivalle.edu.co
Se compararon los ensamblajes de anuros de tres hábitats (bosque, lago y cantera) con diferente grado de perturbación antrópica presentes en un fragmento de bosque seco en la hacienda La Española, corregimiento de Guarinocito, Caldas. Se realizaron muestreos de recorridos extensivos usando el método de registro por relevamiento por encuentros visuales (REV), a partir de los cuales se registró la abundancia y uso del microhábitat para cada una de las especies dentro de los diferentes hábitats, y se realizó el registro de variables ambientales descriptoras del sitio de muestreo, tales como temperatura, humedad relativa y perímetro de espejos de agua. Se encontraron 13 especies de anuros, entre las cuales Engystomops pustulosus registró la mayor abundancia relativa, con una tasa de captura de 5,16 individuos por hora. Se registraron diferencias significativas en la diversidad entre los hábitats de estudio, siendo menor en el bosque, en donde hubo menor riqueza, pero mayor dominancia. La tasa de recambio de especies entre hábitats fue del 71%, exhibiendo Lago y Cantera la mayor similitud en composición de la anurofauna. El uso de sustrato por parte de cada especie en los diferentes hábitats registró diferencias significativas (X², p<0,05) y solo dos especies (Leptodactylus fragilis y L. colombiensis) presentaron alta variabilidad en los sustratos usados.
Palabras clave: Anuros, ensamblaje, bosque seco tropical, bosque en regeneración, factores bióticos, hábitats modificados.
AbstractThe anuran assemblages in three habitats (forest, lake and quarry) with different degrees of human disturbance present in a dry forest fragment in the Farm La Española, Guarinocito, Caldas, were compared. Extensive routes samplings were conducted using visual encounter surveys (VES), from which abundance and microhabitat use were recorded for each one of the species within the different habitats, and the record of environmental variables describing the sampling area such as temperature, relative humidity, and water ponds perimeter, was carried out. A total of 13 anurans species were found, among which Engystomops pustulosus recorded the most relative abundance with a catch rate of 5.16 individuals per hour. Significant differences were found in diversity between the studied habitats being lower in the forest where there were lower richness but better dominance. The rate of replacement of species between habitats was 71%, showing pond and quarry the greater similarity in anurofauna composition. The use of substrate by each species was different between habitats (X², p<0.05) and only two species (Leptodactylus fragilis and L. colombiensis) showed high variability in the modified habitats.
Key words: Anurans, assemblages, tropical dry forest, regenerating forest, biotic variables, modified habitats.
Los anuros son un grupo de tetrápodos considerados de gran importancia ecológica por ser ectotérmicos, presentar una particular diversidad en sus ciclos de vida y además tener piel permeable, lo que los convierte en organismos sensibles a las incidencias del ambiente y por tanto en indicadores de la degradación en ecosistemas (DUELLMAN & TRUEB, 1994; DI TADA et al., 1996; WAKE & VREDENBURG, 2008). A pesar de estas singularidades y de poseer una riqueza similar a la de otros grupos taxonómicos (e.g. mamíferos), son organismos que se encuentran altamente amenazados dentro del trópico, en parte por la alta degradación de sus hábitats (HOFFMANN et al., 2010), lo que hace indispensables promover investigaciones acerca de su riqueza y diversidad en los diferentes ecosistemas para poder fortalecer las estrategias y planes de conservación.
Los esfuerzos de investigación para conocer el estado de las poblaciones de anuros, aunque necesarios, son insuficientes, e incluso los estudios sobre la composición de los ensamblajes, o las características de selección y preferencias de hábitat son limitados (YOUNG et al., 2004; BLAUSTEIN et al., 2011; PITTMAN et al., 2014). De acuerdo con las propiedades físicas se reconocen dos niveles del hábitat: macrohábitat y microhábitat. El primero comprende características ambientales generales como temperatura, humedad, precipitación, entre otras, y el segundo, en el caso de anfibios, hace referencia a la cobertura vegetal, los sitios de percha y sustratos disponibles. A partir de estos descriptores espaciales se pueden identificar variaciones ecológicas importantes entre las especies que coexisten en los diferentes ensamblajes de anuros, las cuales estarían relacionadas con características del micro y macro-hábitat definidas por limitaciones tanto ecológicas como evolutivas (CABRAL & SAZIMA, 2000; VIGNOLI, 2007; SCHEFFERS et al., 2014).
En este sentido, algunos factores ambientales pueden ser determinantes en el establecimiento de fronteras en las distribuciones ecológicas y geográficas de poblaciones de anuros, lo cual afecta también la capacidad de alimentación y dinámica reproductiva que influye directamente la dinámica poblacional (RUSTIGIAN et al., 2003; NASSAUER et al., 2007). Por ejemplo, es conocido que anuros de tierras bajas y ambientes secos se enfrentan al reto de encontrar humedad adecuada, dado que los niveles de esta pueden fluctuar dramáticamente durante el día o por variaciones estacionales, comprometiendo así el desarrollo tanto de estadios larvales como el éxito reproductivo de los adultos (WELLS, 2007; HILLMAN et al., 2009). Además, la fragmentación de los relictos boscosos también puede afectar las poblaciones de anuros de manera directa o indirecta, como consecuencia de los cambios en la calidad del hábitat y la proporción de microhabitats disponibles para reproducción, forrajeo y oviposición (URBINA-CARDONA et al., 2006, CÁCERES-ANDRADE & URBINA-CARDONA, 2009).
Es ampliamente reconocida la existencia de una asociación entre la diversidad de anuros y las variables bióticas (eg. estructura vegetal) y abióticas (eg. temperatura y humedad relativa) que definen un hábitat. Esta asociación modula los requerimientos fisiológicos que enfrentan los organismos a partir de la disposición de recursos y las características físicas del entorno (URBINA-CARDONA et al., 2006; VITT & CALDWELL, 2013). Este tipo de información es relevante en los procesos de conservación local de anuros y son un aspecto crítico para entender la dinámica de estas poblaciones en ambientes altamente vulnerables y diversos como los bosques secos tropicales, hábitat en donde los esfuerzos de investigación principalmente se han centrado en la generación de listados taxonómicos (BLANCO-TORRES & BONILLA-GÓMEZ, 2010).
En el presente trabajo, además de describir la riqueza y composición del ensamblaje de anuros que habitan en tres tipos de hábitat asociados a un fragmento de bosque seco en el Magdalena medio del departamento de Caldas, se evalúo la relación de las diferentes especies de anuros con las características ambientales (bióticas y abióticas) y el uso de microhábitat, considerando una escala geográfica local.
MATERIALES Y MÉTODOSÁrea de estudio
El estudio se desarrolló en la hacienda La Española (5°51,9' N – 74°45,7' W), ubicada en el corregimiento de Guarinocito, municipio de La Dorada, en el departamento de Caldas, Colombia, entre los 240 y 280 msnm (Figura 1). La zona corresponde al bioma de bosque seco tropical (bs-T) y pertenece a la provincia biogeográfica Chocó-Magdalena (HERNÁNDEZ-CAMACHO et al., 1992). Presenta un patrón de lluvias de tipo bimodal tetraestacional, con dos periodos lluviosos (mayo-junio y septiembre-noviembre) y dos periodos secos (enero-abril y julio-agosto), siendo la precipitación y temperatura anual promedio de 1590 mm y 28°C respectivamente (STILES & BOHÓRQUEZ, 2000).
Método de muestreo
El muestreo fue realizado durante la temporada seca entre los días 10 al 13 de abril del año 2013, durante tres noches consecutivas por seis personas. Se delimitó en la zona de estudio tres categorías de hábitat: bosque, cantera y lago. En cada categoría se establecieron tres parcelas de 15 x 20 m, las cuales eran similares en su estructura física y composición florística. La cobertura vegetal de cada hábitat fue establecida. Con el propósito de garantizar la independencia entre cada unidad de muestreo, la distancia mínima entre parcelas fue mayor a 130 m. Cada noche se realizaron tres jornadas de registro entre las 18:00 h y 00:00 h, con una intensidad de tiempo de 2 h en cada uno de los hábitats establecidos. Para evitar el sesgo relacionado con los máximos de actividad de las especies, se varió el orden de muestreos entre días sucesivos.
El censo de anuros fue realizado por medio de la técnica de relevamiento por encuentro visual (REV) (HEYER et al., 1994), identificando cada individuo hasta el nivel de específico. Al momento de la captura se registraron la temperatura y humedad relativa. Se infirió el uso de microhábitat con base en la altura de percha y tipo sustrato en el cual se observó el organismo por primera vez.
Análisis de datosLos patrones de abundancia interespecífica de las especies encontradas fueron identificados siguiendo las propuestas de GREIG-SMITH (1983) y O'CONNOR & AARSSEN (1987). Los valores de abundancia estandarizados (y'= log [x+1]) fueron empleados para realizar una matriz gráfica de dispersión. Esta matriz indica las relaciones funcionales (lineales o no) entre la abundancia y su respectivo valor de correlación entre pares de especies.
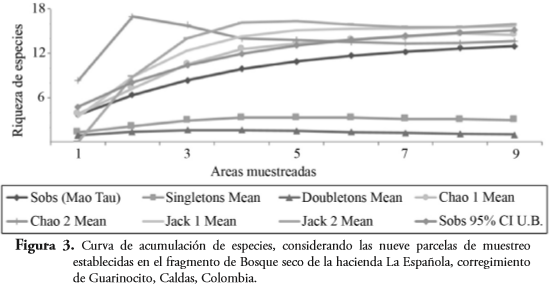
Se construyó una curva de acumulación de especies como un estimador de diversidad. Esta técnica evalúa el esfuerzo de muestreo y el número de especies observadas con respecto a las especies esperadas. Se utilizaron los estimadores de riqueza específica y estructura del ensamblaje (especies con relación a su abundancia) de Sobs, Singletones, Dobletones, Chao I y II, además de Jackknife 1 y 2. Además, se elaboró una curva de aparición de especies para cada uno de los hábitats, con base en el índice de presencia-ausencia, con el cual se establece la probabilidad de hallar nuevos taxones con el aumento del número de individuos encontrados (HAMMER et al., 2001).
Se utilizaron los descriptores univariados de Shannon (H') y Simpson (S) para cuantificar la diversidad y dominancia en el ensamblaje de anuros presente en cada hábitat. Se utilizó el índice de equidad de Pielou [ln (H')] para establecer el grado de incertidumbre en predecir a cuál especie pertenecerá un individuo de una comunidad, debido a que considera el efecto de las especies raras en la muestra (PIELOU, 1975; MAGURRAN, 2004) y se cuantificó el número de especies abundantes (N1) y el número de especies muy abundantes (N2) en cada tipo de hábitat, con base en los números de la serie de Hill (HILL, 1973). Se realizó una comparación estadística de la diversidad entre las unidades de hábitat utilizando la prueba de t-Student para el índice de Shannon.
Para establecer el grado de reemplazo en la composición de anuros entre los hábitats se calculó el índice de diversidad beta de comunidad de Whittaker (DUELLMAN, 1978), el cual considera la diversidad beta (B) como una relación entre el número de especies en la unidad de estudio (Sy) y la diversidad en las localidades que forman la unidad de estudio (Sa), donde B = Sy/Sa. De acuerdo con este índice, bajas similitudes ecológicas (recambio) generan altas diversidades entre hábitats (heterogeneidad) (MAGURRAN, 2004).
Se utilizó como estimador de la abundancia relativa la tasa de encuentro de cada especie, definida en función del tiempo invertido en cada muestreo (6 h/hábitat) y el número de individuos de cada especie detectada en cada hábitat. Esta tasa se empleó para realizar una clasificación ordinal de especies como raras, no comunes, frecuentes, comunes, y abundantes, utilizando los intervalos propuestos por PEDROZA-BANDA & ANGARITA-SIERRA (2011). Para establecer el uso del microhábitat se definieron siete tipos de sustratos: tierra (tr), roca (rc), fango (fg), hojarasca (hjs), hoja (hj), rama (ra) y agua (ag); evaluando con tablas de contingencia las diferencias en el uso y disponibilidad de sustrato para cada especie (X² Peterson, a= 0,05) (BROWN & ROTHERY, 1993). Para evaluar la distribución vertical de cada especie, se definieron cinco intervalos de altura de percha como I=0-50 cm, II=50-100 cm, III=100-150 cm, IV=150-200 cm y V > 200 cm, siendo establecida la altura de percha para cada especie como la moda de la distribución. Todos los análisis numéricos se realizaron utilizando los programas estadísticos Estimates v9.0, Past v2.17 y el R software (HAMMER et al., 2001; TEAM, 2010; COLWELL et al., 2012).
RESULTADOSEl área de estudio se caracterizó por presentar una humedad relativa promedio de 78,57 %, y una temperatura de 29,37°C durante el periodo de muestreo, siendo la relación entre estas dos variables de tipo inversa y no significativa (r=-0,67, p=0,051). Los hábitats considerados para este trabajo se caracterizaron por presentar rasgos específicos de composición vegetal, disponibilidad de recursos hídricos y topografía, entre otros. La cobertura vegetal fue menor en la zona de cantera (<10%) que en la zona de bosque (cobertura entre 70-90%). En la zona de cantera los sustratos predominantes fueron fango, agua, roca y tierra; mientras que en el bosque fueron hojarasca y ramas. En la cantera la familia vegetal más abundante fue Euphorbiaceae con ejemplares que no superaron 1,5m de altura, mientras que en el bosque las familias más abundantes fueron plantas leñosas de Photbiaceae, Fabaceae, Rubiaceae y Meliaceae con ejemplares entre 2 a 25 m de altura.
En la zona de cantera las fuentes de agua fueron pequeños pozos artificiales formados a partir del proceso de extracción de piedras, mientras que en la zona de bosque la fuente directa de agua fue el río Purnio, el cual se encontraba entre 140 m y 390 m de las parcelas de estudio. En la zona de lagunas, el espejo de agua ocupó el 80% del área de muestreo siendo los sustratos predominantes agua, hojarasca y hojas, y estando cubiertas las orillas por poaceas y pontederiáceas.
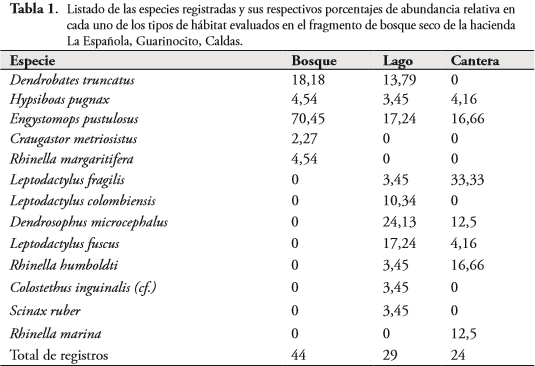
En total, se registraron 13 especies de anuros, siendo mayor la abundancia en bosque, seguido por lago y cantera (Tabla 1). No se observaron diferencias significativas para la abundancia de anuros entre los hábitats considerados (KW p>0,05) ni en sus réplicas (KW p>0,05). En la zona de bosque la especie dominante en abundancia fue E. pustulosus, mientras que en el lago fue Dendropsophus microcephalus y en la cantera estuvieron igualmente representadas Rhinella humboldti y E. pustulosus (Tabla 1).
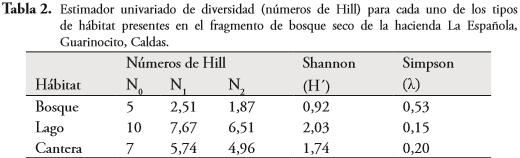
El esfuerzo de muestreo fue significativo para toda el área de estudio (Figura 3). Sin embargo, el número de especies que conforma el ensamblaje de anuros no fue muestreado en su totalidad (Sobs=13, Chao I= 14,5, Chao II= 13,62, Jack 1= 15,67 y Jack 2= 15,96). El lago fue el hábitat con mayor número de especies registradas (10 especies), seguida por cantera (7 especies) y bosque (5 especies). Respecto a las abundancias equitativas relativas (N1) por hábitat, en bosque se presentaron un 40% de estas, mientras que el 80% y 86% se registraron en lago y cantera respectivamente (Tabla 2). En cuanto a las especies muy abundantes (N2) se registraron en un 40%, 70% y 71% de forma respectiva en bosque, lago y cantera (Tabla 2).
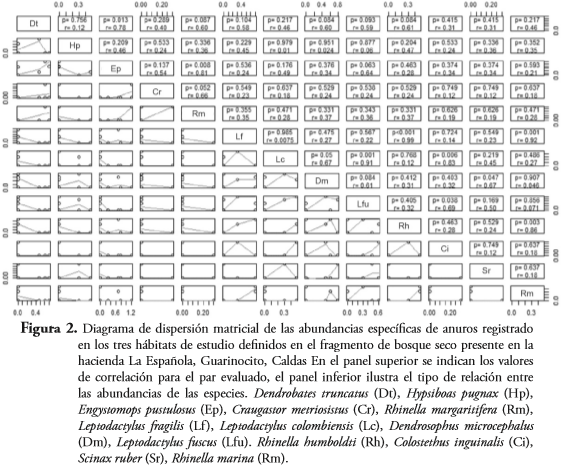
Se establecieron diferencias significativas para la diversidad entre los hábitats estudiados (bosque-lago: t= -4,85, p<:0,05; bosque-cantera: t= 3,63, p<0,05; lago-cantera: t= 1,31, p>0,05), siendo en el bosque significativamente menor la diversidad y mayor la dominancia que en la zona de cantera o en la zona de lago (Tabla 2). También se encontraron correlaciones significativas entre las abundancias específicas de D. truncatus, E. pustulosus, E. pustulosus, R. margaritifera, L. fragilis, R. humboldti, L. fuscus, C. panamensis, L. colombiensis, C. panamensis, S. ruber, D. microcephalus, L. fragilis, R. marina y R. humboldti - R. marina, siendo E. pustulosus, R. humboldti, R. marina y L. fragilis las especies que presentaron un mayor número de asociaciones con otras especies (Figura 2).
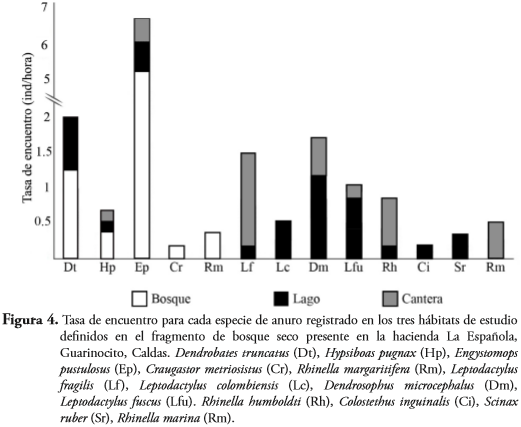
La tasa de recambio de especies total en la zona de estudio fue del 71% (Bw= 0,71), siendo menor la tasa de cambio entre lago y cantera (B=0,36), que entre bosque y lago (B= 0,40) y bosque y cantera (B= 0,75). De las cinco especies capturadas en el bosque, E. pustulosus presentó la mayor tasa de captura (5,2 ind/hora); mientras que de las seis especies capturadas en la cantera, L. fragilis fue la especie con la tasa de captura más alta (1,33 ind/hora); y de las 10 especies capturadas en el lago, D. microcephalus fue la especie que presentó una mayor tasa de captura (1,16 ind/hora) (Figura 4).
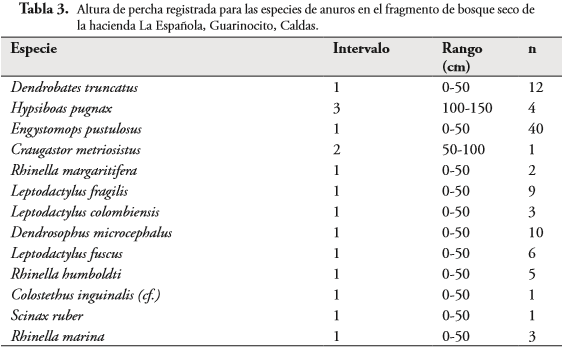
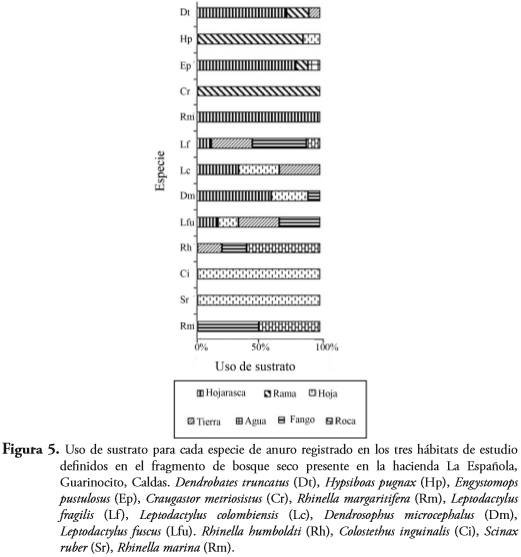
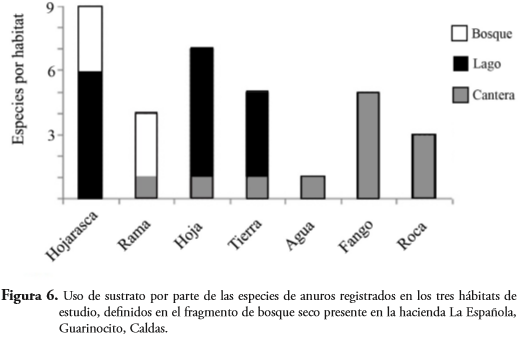
Se encontraron diferencias significativas para el uso del sustrato por las especies encontradas en la zona de estudio. (X², P>0,05). Sin embargo, C. metriosistus, R. margaritifera, C. inguinalis y S. ruber estuvieron representadas por menos de tres ejemplares, lo que podría estar sesgando este resultado hacia el uso de un único sustrato. En contraste, L. fragilis y L. colombianus fueron las especies que utilizaron un mayor número de sustratos (Figura 5). La hojarasca fue el sustrato más usado por las especies, seguido de hoja. Cabe resaltar que todas las especies que se encontraron sobre roca también se encontraron asociadas al fango. También se detectaron diferencias significativas en el uso de sustrato entre hábitat (X², p>0,05), siendo el hábitat cantera el que presentó una mayor heterogeneidad en el uso de sustratos por parte de las especies de anuros, seguida del lago y bosque respectivamente (Figura 6). La especie que presentó la mayor altura de percha fue H. pugnax (50-200 cm), mientras que las otras especies presentaron alturas de percha medias (50-100 cm) o bajas (0-50 cm) (Tabla 3). C. inguinalis, D. truncatus, D. microcephalus y E. pustulosus fueron registradas asociadas al suelo (0-50 cm).
DISCUSIÓN
Cada especie experimenta y responde de manera particular y única a las condiciones ecológicas de su hábitat. Por lo tanto, para poder comprender las interacciones que ocurren entre las especies y su entorno se necesita definir adecuadamente la escala espacio temporal de la investigación y describir detalladamente las condiciones ambientales (AFONSO & ETEROVICK, 2007). La repartición de los recursos se convierte entonces en un aspecto crucial para explicar la riqueza de especies en una localidad y por otro lado, cobra relevancia el concepto de microhábitat como un elemento ambiental que permite mantener una alta densidad poblacional y facilitar la explotación óptima de los recursos disponibles en el ecosistema (HILL & HILL, 2001; CYNTHIA et al., 2005; CUNNINGHAM et al., 2015). En ecosistemas tropicales fragmentados, los anfibios responden a cambios en los gradientes ambientales y estructurales de distintas maneras, ajuste que se refleja en la abundancia o riqueza de especies y en la composición del ensamblaje (CARVAJAL-COGOLLO & URBINA-CARDONA, 2008). Como resultado de esto, la preferencia de cada especie de acuerdo con los microhábitats disponible será el reflejo de un rango eco-fisiológico de tolerancia dentro del ensamblaje (URBINA-CARDONA & LONDOÑO, 2003; URBINA-CARDONA et al., 2006).
La diferenciación del uso de los recursos puede ocurrir principalmente en tres dimensiones del nicho: hábitat, dieta y hora de actividad entre las especies (SKELLY et al., 2002, SCHIESARI, 2004, 2006; SCHIESARI et al. 2009). Bajo los preceptos de la ecología clásica, se esperaría la mayor riqueza y abundancia de especies este restringida a bosques, pero debido a que las áreas intervenidas proveen un mayor número de microhábitats para la anurofauna, los valores de los estimadores de diversidad serían menores en zonas boscosas con respecto a áreas bajo presión antrópica, tal como fue establecido en el presente trabajo. De acuerdo con VASCONCELOS & ROSSA-FERES (2008), la mayor heterogeneidad espacial y ambientes con mayor humedad permite que aumenten los valores de riqueza y abundancia de los anuros. Sin embargo, los bosques secos, aunque tienen una alta complejidad estructural, tienen poca disponibilidad de microhábitats para los anuros en comparación con las áreas intervenidas, que, aunque son menos complejas en cuanto a estructura, son significativamente más heterogéneas (BLANCO-TORRES & BONILLA-GÓMEZ, 2010).
Cuando dos o más especies ocurren en el mismo espacio, más frecuentemente de lo esperado debido a que presentan algún tipo de relación ecológica o por simple casualidad, se generan las asociaciones interespecíficas (BINI et al., 2003; GROSBOIS et al., 2009). Estas asociaciones pueden ser positivas cuando ambas especies presentan los mismos (o similares) requerimientos ambientales o cuando la presencia de alguna influye directa o indirectamente sobre la presencia de la otra. En contraste, las asociaciones negativas se generan si las especies presentan requerimientos ecológicos diferentes o presentan relaciones ecológicas negativas como exclusión por competencia, territorialidad, depredación, entre otras (CROSSLAND, 2000; GUREVITCH et al., 2000; WERNER & PEACOR, 2003). En la zona de estudio E. pustulosus, R. humboldti, R. marina y L. fragilis fueron las especies que presentaron un mayor número de interacciones, lo que hace suponer que la amplitud de su nicho es mayor que el de las otras especies de anuros registrados en esta localidad.
A diferencia de lo reportado por ACOSTA-GALVIS et al. (2006), durante el desarrollo de la presente investigación individuos de D. truncatus fueron registrados activos durante la noche, sin embargo, podría ser consecuencia de la perturbación que generó el muestreo. Las dos especies de hílidos registradas en la zona (H. pugnax y D. microcephalus) estuvieron activas durante la noche, asociadas únicamente a la vegetación que rodeaba los cuerpos de agua, nunca sobre el suelo o la hojarasca. Estas características son particulares de los hílidos con respecto a ranas de otras familias que componen los ensambles neotropicales de bajas altitudes como leptodactílidos, bufónidos o dendrobátidos que son propios de microhábitats terrestres ocupando principalmente el suelo del bosque (BERNARDI, 1999; MUÑOZ-GUERRERO et al., 2007).
Dos especies del género Leptodactylus (L. fragilis y L. colombiensis) fueron las especies que presentaron una mayor heterogeneidad en el uso de sustratos. Posiblemente los hábitos reproductivos asociados a pequeñas charcas o pozas de estas especies (PONSSA, 2008) les brinda una mayor independencia a fuentes de agua permanente y de esta manera puede explotar un mayor número de hábitats y sustratos. Por otro lado, los individuos que componen este género presentan el segundo mayor tamaño corporal entre las especies evaluadas. Por lo tanto, de acuerdo con la regla de Cope (HONE & BENTON, 2005), un mayor tamaño permitiría que las especies exploten un nicho de mayor área. La hojarasca fue el sustrato más usado por las especies del área de estudio, sin embargo, esto probablemente se encuentre relacionado con que este sustrato fue el más abundante y no porque realmente haya una preferencia de las especies. Se encontraron también diferencias significativas en el uso del sustrato entre hábitats, probablemente asociado a las características intrínsecas a cada hábitat.
AGRADECIMIENTOSA Mario Francisco Velasco, propietario de la hacienda La Española, por permitir el ingreso a esta localidad. A la Coorporación Autónoma Regional de Caldas (Corpocaldas) por proporcionar el permiso de investigación. Al Departamento de Biología de la Universidad del Valle por su apoyo para el desplazamiento a la zona de estudio.
AFONSO, L.G. & ETEROVICK, P.C., 2007.- Microhabitat choice and differential use by anurans in forest streams in southeastern Brazil. Journal of Natural History, 41: 937-948. [ Links ]
ACOSTA-GALVIS, A.; HUERTAS-SALGADO, C. & RADA, M., 2006.- Aproximación al conocimiento de los anfibios en una localidad del magdalena medio (Departamento de Caldas, Colombia). Revista de la Academia Colombiana de Ciencias, 30(115): 291-303. [ Links ]
BERNARDI, J.A.R., 1999.- Composição e diversidade de espécies da anurofauna da Estação Científica Ferreira Penna, Floresta Nacional de Caxiuanã, Pará, Brasil. Master Thesis. Editorial: Universidade Federal do Pará, Centro de Ciências Biológicas. [ Links ]
BINI, L.M.; DINIZ-FILHO, J.A.F.; BASTOS, R.P.; SOUZA, M.C.; PEIXOTO, J.C. & RANGEL, T.F.L., 2003.- Interspecific synchrony in a local assemblage of anurans in Central Brazil: effects of phylogeny and reproductive patterns. Acta Scientiarum, 25: 131-135. [ Links ]
BLANCO-TORRES, A. & BONILLA-GOMEZ, M.A., 2010.- Microhábitat partitioning between Leiuperidae and Bufonidae species (Amphibia: Anura) in tropical dry forest areas in Colombian Caribbean. Acta Biológica Colombiana, 15(3): 47-60. [ Links ]
BLAUSTEIN, A.R.; HAN, B.A.; RELYEA, R.A.; JOHNSON, P.T.; BUCK, J.C.; GERVASI, S.S. & KATS, L.B., 2011.- The complexity of amphibian population declines: understanding the role of cofactors in driving amphibian losses. Annals of the New York Academy of Sciences, 1223(1): 108-119. [ Links ]
BROWN, D. & ROTHERY, P., 1993.- Models in biology: mathematics, statistics and computing. John Wiley & Sons. Chichester, UK. [ Links ]
CABRAL, P. & SAZIMA, I., 2000.- Structure of an anuran community in a montane meadow in southeastern Brazil: effects of seasonality, habitat, and predation. Amphibia-Reptilia, 21: 439-461. [ Links ]
CÁCERES-ANDRADE, S. & URBINA-CARDONA, J.N., 2009.- Ensamblajes de anuros de sistemas productivos y bosques en el piedemonte llanero, Departamento del Meta, Colombia. Caldasia, 31:175-194. [ Links ]
CARVAJAL-COGOLLO, J.E. & URBINA-CARDONA, J.N., 2008.- Patrones de diversidad y composición de reptiles en fragmentos de bosque seco tropical en Córdoba, Colombia. Tropical Conservation Science, 1(4): 397-416. [ Links ]
COLWELL, R.K.; CHAO, A.; GOTELLI, N.J.; LIN, S.; MAO, C.X.; CHAZDON, R.L. & LONGINO, J.T., 2012.- Models and estimators linking individual-based and sample-based rarefaction, extrapolation, and comparison of assemblages. Journal of Plant Ecology, 5: 3-21. [ Links ]
CROBLAND, M.R., 2000.- Direct and indirect effects of the introduced toad Bufo marinus (Anura: Bufonidae) on populations of native anuran larvae in Australia. Ecography, 23(3): 283-290. [ Links ]
CUNNINGHAM, H.R.; RISSLER, L.J.; BUCKLEY, L.B. & URBAN, M.C., 2015.- Abiotic and biotic constraints across reptile and amphibian ranges. Ecography. 39(1): 1-8. [ Links ]
CYNTHIA, P.D.A.; UETANABARO, M. & HADDAD, C.F., 2005.- Breeding activity patterns, reproductive modes, and habitat use by anurans (Amphibia) in a seasonal environment in the Pantanal, Brazil. Amphibia-Reptilia, 26(2): 211-221. [ Links ]
DI TADA, I.E.; ZABATTIERI, M.V.; BRIDAROLLI, M.E.; SALAS, N.E. & MARTINO, A.L., 1996.- Anfibios Anuros de la provincia de Córdoba. En: Di Tada, I. E. & E. H. Bucher. (eds). Biodiversidad de la provincia de Córdoba. Universidad Nacional de Río Cuarto. Río Cuarto, Argentina. [ Links ]
DUELLMAN, W.E., 1978.- The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneus Publication. University of Kansas, Museum of Natural History. No. 65. [ Links ]
DUELLMAN, W.E. & TRUEB, L., 1994.- Biology of amphibians. The John Hopkins University Press Ltd. London. [ Links ]
GREIG-SMITH, P., 1983.- Quantitative Plant Ecology. University of California Press. [ Links ]
GROSBOIS, V.; HARRIS, M.P.; ANKER-NILSSEN, T.; McCLEERY, R.H.; SHAW, D.N.; MORGAN, B.J. & GIMENEZ, O., 2009.- Modeling survival at multi-population scales using mark-recapture data. Ecology. 90: 2922-2932. [ Links ]
GUREVITCH, J.; MORRISON, J.A. & HEDGES, L.V., 2000.- The interaction between competition and predation: a meta-analysis of field experiments. American Naturalist, 155(4): 435-453. [ Links ]
HAMMER, O.; HARPER, D. & RYAN, P., 2001.- PAST: paleontological statistics software for education and data analysis. Paleontología Electrónica, 4: 1-9. [ Links ]
HERNÁNDEZ-CAMACHO, J.; GUERRA, A.H.; QUIJANO, R.O. & WALSCHBURGER, T., 1992.- Unidades biogeográficas de Colombia. En: Halffter, G. (Ed.). La diversidad biológica de Iberoamérica I. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, Instituto de Ecología. Xalapa, México. [ Links ]
HEYER, W.R.; DONNELLY, M.A.; McDIARMID, R.W.; HAYEK, A.C. & FOSTER, M.S., 1994.- Medición y monitoreo de la diversidad biológica. Métodos estandarizados para anfibios. Smithsonian Institution Press, Washington y Londres, Editorial Universitaria de la Patagonia. [ Links ]
HILL, M., 1973.- Diversity and evenness: A unifying notation and its consequences. Ecology, 54: 27-432 [ Links ]
HILL, J.L. & HILL, R.A., 2001.- Why are tropical rain forests so species rich? Classifying, reviewing and evaluating theories. Progress in Physcal Geography, 25(3): 326-354. [ Links ]
HILLMAN, S.S.; WITHERS, P.C.; DREWES, R.C. & HILLYARD, S.D., (2009)- Ecological and Environmental Physiology of Amphibians. Oxford University Press, Oxford, UK. [ Links ]
HOFFMANN, M.; HILTON-TAYLOR, C.; ANGULO, A.; BÖHM, M.; BROOKS, T.M.; BUTCHART, S.H.M.; et al., 2010.- The impact of conservation on the status of the world's vertebrates. Science, 330: 1503-1509. [ Links ]
HONE, D.W. & BENTON, M.J., 2005.- The evolution of large size: how does Cope's Rule work? Trends in Ecology and Evolution, 20(1): 4-6. [ Links ]
MAGURRAN, A.E., 2004.- Measuring biological diversity. Blackwell Publishing. Malden, MA. USA. [ Links ]
MUÑOZ-GUERRERO, J.; SERRANO, V & RAMÍREZ-PINILLA, M.P., 2007.- Uso de microhábitat, dieta y tiempo de actividad en cuatro especies simpátricas de ranas hílidas neotropicales (Anura: Hylidae). Caldasia, 29(2): 413-425. [ Links ]
NASSAUER, J.I.; SANTELMANN, M.V. & SCAVIA, D., 2007.- From the corn belt to the Gulf societal and environmental implications of alternative agricultural futures. Editorial: Resources for the Future, Washington, DC. [ Links ]
O'CONNOR, I. & AARSSEN, L.W., 1987.- Species association patterns in abandoned sand quarries. Vegetatio, 73(2): 101-109. [ Links ]
PEDROZA-BANDA, R. & ANGARITA-SIERRA, T., 2011.- Herpetofauna de los humedales La Bolsa y Charco de Oro, Andalucía, Valle del Cauca, Colombia. Revista de la Academia Colombiana de Ciencias, 35(135): 243-260. [ Links ]
PIELOU, E., 1975.- Ecological divesity. John Wiley & Sons, New York. [ Links ]
PITTMAN, S.E.; OSBOURN, M.S. & SEMLITSCH, R.D., 2014.- Movement ecology of amphibians: a missing component for understanding population declines. Biological Conservation, 169: 44-53. [ Links ]
PONSSA, M.L., 2008.- Cladistic analysis and osteological descriptions of the frog species in the Leptodactylus fuscus species group (Anura, Leptodactylidae). Journal of Zoological Systematics and Evolutionary Research, 46: 249-266. [ Links ]
RUSTIGIAN, H.; SANTELMANN, M. & SCHUMAKER, N., 2003.- Assessing the potential impacts of alternative landscape designs on amphibian population dynamics. Landscape Ecology, 18: 65-81. [ Links ]
SCHEFFERS, B.R.; EDWARDS, D.P.; DIESMOS, A.; WILLIAMS, S.E. & EVANS, T.A., 2014.- Microhabitats reduce animal's exposure to climate extremes. Global change biology, 20(2): 495-503. [ Links ]
SCHIESARI, L.C., 2004.- Performance Tradeoffs across Resource Gradients in Anuran Larvae. PhD Dissertation, The University of Michigan, Ann Arbor, MI. [ Links ]
SCHIESARI, L., 2006.- Pond canopy cover: a resource gradient for anuran larvae. Freshwater Biology, 51: 412-423. [ Links ]
SCHIESARI, L.; WERNER, L. & GEORGE, W. (2009).- Carnivory and resource-based niche differentiation in anuran larvae: implications for food web and experimental ecology. Freshwater Biology, 54: 572-586. [ Links ]
SKELLY, D.K.; FREIDENBURG, L.K. & KIESECKER, J.M., 2002.- Forest canopy and the performance of larval amphibians. Ecology, 83(4): 983-992 [ Links ]
STILES, F.G. & BOHÓRQUEZ, C.I., 2000.- Evaluando el estado de la biodiversidad: el caso de la avifauna de la serranía de las quinchas, Boyacá, Colombia. Caldasia, 22: 61-92. [ Links ]
TEAM, R.D.C., 2010.- R: A language and enviroment for statistical computing. Viena, Austria: R foundation for statistical computing. Retrieved from http://www.R-project.org. [ Links ]
URBINA-CARDONA, J.N. & LONDOÑO, M.C., 2003.- Distribución de la comunidad de herpetofauna en áreas con diferente grado de perturbación antrópica en la Isla Gorgona, pacífico colombiano. Revista de la Academia Colombiana de Ciencias, 27(102): 105-113. [ Links ]
URBINA-CARDONA, J.N.; OLIVARES-PÉREZ, M. & REYNOSO, V.H., 2006.- Herpetofauna diversity and microenvironment correlates across the pasture-edge-interior gradient in tropical rainforest fragments in the region of Los Tuxtlas, Veracruz. Biological Conservation, 132: 61-75. [ Links ]
VASCONCELOS, T. & ROSSA-FERES, D., 2008.- Habitat heterogeneity and use of physical and acoustic space in anuran communities in southeastern Brazil. Phyllomedusa, 7(2):127-142. [ Links ]
VIGNOLI, L.; BOLOGNA, M.A. & LUISELLI, L., (2007).- Spatio-Temporal Resource Use at a Micro-Habitat Scale in an Amphibian Community of a Pond in mediterranean Central I Ta Ly. Vie Et Milieu - Life and Environment, 57(3): 159-164. [ Links ]
VITT, L.J. & CALDWELL, J.P., 2013.- Herpetology: an introductory biology of amphibians and reptiles. 4th ed. Academic press. California. [ Links ]
WAKE, D. & VREDENBURG, V., 2008.- Are we in the midst of the sixth mass extinction? A view from the world of amphibians. Proceedings of the National Academy of Sciences of the USA, 105: 11466-11473 [ Links ]
WELLS, K.D., 2007.- The Ecology and Behaviour of Amphibians. University of Chicago Press, Chicago, IL. [ Links ]
WERNER, E.E. & PEACOR, S.D., 2003.- A review of trait-mediated indirect interactions in ecological communities. Ecology, 84(5): 1083-1100. [ Links ]
YOUNG, B.E.; STUART, S.N.; CHANSON, J.S.; COX, N.A. & BOUCHER, T.M., 2004.- Joyas que están desapareciendo: el estado de los anfibios en el nuevo mundo. Nature Serve, Arlington, Virginia. [ Links ]














