Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín Científico. Centro de Museos. Museo de Historia Natural
versión impresa ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.21 no.1 Manizales ene./jun. 2017
https://doi.org/10.17151/bccm.2017.21.1.9
DOI: 10.17151/ bccm.2017.21.1.9
CYTOGENETIC AND MOLECULAR SEXING OF PSITTACIDES
* FR: 19-X-16. FA: 24-IV-16.
Trabajo financiado por la Vicerrectoría de Investigaciones y Posgrados, Universidad de Caldas.
1 Bióloga. Egresada Programa de Biología Universidad de Caldas, Manizales, Colombia.
2 Lic. Biología y Química, M.Sc. Profesora Departamento Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia.
3 Ingeniero Agrónomo, Ph.D. Profesor Facultad de Ciencias Agrarias, Universidad Nacional de Colombia Sede Medellín, Colombia.
4 Médico Veterinario Zootecnista, Ph.D. Profesor Departamento Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia. henry.mesa@ucaldas.edu.co
La familia Psittacidae es uno de los grupos con mayor declive poblacional a causa de la cacería, fragmentación y degradación de hábitat. Los programas de conservación y de reintroducción requieren la identificación del sexo en todos los individuos para realizar análisis de parentesco, estimar parámetros demográficos y lograr que las liberaciones o reintroducciones de individuos tengan mayor probabilidad de éxito al liberar grupos conformados por machos y hembras en edad reproductiva o de parejas ya establecidas. En los psitácidos la discriminación sexual presenta dificultades debido a la ausencia de dimorfismo sexual y a que los métodos tradicionales de sexaje son traumáticos o requieren protocolos extensos que no funcionan en individuos juveniles. En este sentido, las herramientas moleculares y algunas citogenéticas resultan efectivas por ser poco invasivas y tener una mayor sensibilidad. Tanto las herramientas moleculares como las citogenéticas empleadas en este estudio permitieron la diferenciación entre machos y hembras de ocho especies de psitácidos (Amazona amazónica, Amazona festiva, Amazona ochrocephala, Ara ararauna, Ara macao, Ara severa, Aratinga wagleri y Pionus menstruus). En términos generales, la eficiencia de la reacción de PCR para amplificar los genes CHD-Z y CHD-W para los individuos muestreados fue del 83 % (34 de 41 individuos amplificados). En un total de 32 individuos de seis especies de psitácidos (A. ararauna, A. macao, A. festiva, A. ochrocephala, P. menstruus) se hizo posible la diferenciación por cariotipo en 25 de ellas, lo que representa una sensibilidad del 78 % para la prueba citogenética de sexaje. No fue posible obtener un número suficiente de metafases con el fin de establecer el patrón de cariotipo de A. wagleri y A. severa por el bajo número de individuos. El sexaje de psitácidos puede realizarse a través de cualquiera de estos dos métodos, aunque el sexaje citogenético resulta inconveniente para las especies que no tienen cariotipo definido tal como es el caso de A. severa y A. wagleri. El sexaje molecular proporciona una técnica poco invasiva, eficaz y rápida para obtener el sexo de individuos mediante la utilización de los iniciadores P2 y P8.
Palabras clave: dimorfismo, cariotipo, PCR, psitácidos.
AbstractThe Psittacidae family is one of the groups with the highest population decline due to hunting, habitat fragmentation and degradation. Conservation and reintroduction programs require the identification of gender in all individuals to perform kinship analysis, to estimate demographic parameters and to ensure that releases or reintroduction programs of individuals are more likely to succeed when releasing groups formed by males and females of reproductive age or established couples. Sex differentiation in psittacides presents difficulties due to the absence of sexual dimorphism and because sexing traditional methods are traumatic or require extensive protocols that do not work on juvenile individuals. In this sense, molecular and some cytogenetic tools are effective because they are not invasive and have a greater sensitivity. Both molecular and cytogenetic tools used in this study allowed differentiating between males and females of eight species of psittacines (Amazona amazonica, Amazona festiva, Amazona ochrocephala, Ara ararauna, Ara macao, Ara severa, Aratinga waglerii and Pionus menstruus). Generally speaking, efficiency of the PCR reaction to amplify genes CHD - Z and CHD - W for sampled individuals was 83% (34 of 41 individuals amplified). In a total of 32 individuals of six species of psittacines (Ara ararauna, Ara macao, Amazona festiva, Amazona ochrocephala, Pionus mentruus) the karyotype differentiation was possible in 25 of them representing a sensitivity of 78% for the cytogenetic sexing test. It was not possible to obtain a sufficient number of metaphases to establish the pattern of karyotype for Aratinga wagleri and Ara severa due to the low number of individuals. Psittacides sexing can be done by either of these two methods, although cytogenetic sexing is inconvenient for species that do not have a defined karyotype, as in the case of Ara severa and Aratinga wagleri. Molecular sexing provides a minimally invasive, effective and rapid technique to determine the sex of individuals using primers P2 and P8.
Key words: dimorphism, karyotype, PCR, Psittacines.
Hoy existen más de 9198 especies de aves silvestres, conformando el grupo de animales con mayor biodiversidad mundial. Colombia ocupa el primer lugar en diversidad de aves, destacando la familia Psittacidae por ser uno de los grupos con mayor presión a causa de la cacería, fragmentación y degradación de hábitat (RODRÍGUEZ et al., 2002; JUNIPER et al., 1998). La identificación del sexo en aves es importante para establecer la filopatría entre sexos, análisis de parentesco y parámetros demográficos. Igualmente el número de parejas reproductivas en una población puede ser mejor estudiado si se conoce la proporción de sexos. Esta información es vital en especies en peligro de extinción (la gran mayoría monógamos) debido a que determina el tamaño de la siguiente generación. Por otro lado, las liberaciones o reintroducciones de individuos tendrán mayor probabilidad de éxito si se liberan grupos conformados por machos y hembras en edad reproductiva o si se liberan parejas ya establecidas (WHITINGHAMM et al., 2000; JONES et al., 2003; KOCIJAN et al., 2011; MIYAKI et al., 1998).
En los psitácidos, como en la mayoría de las aves, la discriminación sexual presenta dificultades debido a la ausencia de dimorfismo sexual y a que los métodos tradicionales de sexaje tales como la endoscopia, medición de niveles hormonales, observación del comportamiento, e incluso el cariotipo, presentan desventajas por ser traumáticas o requerir protocolos extensos que no funcionan en individuos juveniles. En este sentido, las herramientas moleculares resultan efectivas. Según GRIFFITHS et al. (1998) y FRIDOLFSSON et al. (1999), el descubrimiento del gen CHD-W en aves hembras y del gen CHD-Z en ambos sexos (hembras ZW, machos ZZ) permitió el desarrollo de un método de sexaje que consiste en localizar los dos genes conservados CHD (chromo-helicase-DNA-binding) ubicados en los cromosomas sexuales. Esta técnica ha sido ampliamente documentada por GRIFFITHS et al. (1995), PAUTRAT et al. (2002), DUBIEC et al. (2006) y HENAO et al. (2010), entre otros. Por otra parte, la discriminación sexual por medio de cariotipo no es muy utilizada debido a que los distintos órdenes de aves poseen un cariotipo extenso y complejo: entre 36 y 126 cromosomas, muchos de ellos del mismo tamaño y disposición del centrómero; algunas especies presentan microcromosomas y otras no tienen dimorfismo sexual cromosómico, haciendo difícil su inspección y correcta identificación. Sin embargo, en Psittaciformes, la determinación del sexo mediante la técnica citogenética es fácilmente obtenida dado que los cromosomas Z y W en la familia Psittacidae son claramente visualizados. Una ventaja de este método es que tiene la posibilidad de identificar defectos cromosómicos como inversiones, translocaciones y triploidias, las cuales producen mala actividad reproductiva (GRIFFITHS et al., 2000; CAMACHO et al., 2009; GOLDSMIDT et al., 1997; BONAGURA et al., 1997).
Es así que, en esta investigación, se recurre a la amplificación por PCR de los genes CHD-W y CHD-Z como herramienta molecular y al idiograma del cariotipo como herramienta citogenética con fines de determinar el sexo en aves de la familia Psittacidae a partir del cálamo de plumas en crecimiento.
MATERIALES Y MÉTODOSLa fase de campo se realizó en el Centro de Atención, Valoración y Rehabilitación de Fauna Silvestre (CAVR Montelindo) de CORPOCALDAS, ubicado en la granja Montelindo de la Universidad de Caldas. Se colectaron plumones en crecimiento de 41 individuos sanos de ocho especies de la familia Psittacidae (A. amazónica, A. festiva, A. ochrocephala, A. ararauna, A. macao, A. severa, A. wagleri y P. menstruus) identificados con un chip electrónico, las muestras fueron transportadas en nevera de polietileno y posteriormente refrigeradas a -20 °C hasta su análisis.
El ADN fue extraído del cálamo de plumas con el método fenol-cloroformoalcohol isoamílico, de acuerdo a la metodología propuesta por la NIH (2005) con algunas modificaciones. La cantidad y calidad del ADN se evaluó en geles de agarosa al 1,5 %, la amplificación de los genes CHD-W y CHD-Z se realizó mediante PCR con los iniciadores P2 (5'TCTGCATCG-CTAAATCCTTT3') y P8 (5'-CTCCCAAGGATGAGRAAYTG-3') descritos por GRIFFITHS et al. (1998). Las condiciones de amplificación se realizaron según lo establecido por CERIT et al. (2007) y los productos de amplificación se visualizaron en geles de poliacrilamida al 8 % teñidos con nitrato de plata.
Para el cultivo celular se utilizaron muestras extraídas del cálamo de plumas transportadas a temperatura ambiente y procesadas inmediatamente después de llegar al laboratorio con base al protocolo propuesto por el Instituto de Genética del Eje Cafetero (IGEC), la técnica de tinción utilizada fue la técnica secuencial y los criterios para la selección de metafases son los propuestos por DESCAILLEAUX et al. (1979).
RESULTADOSTanto las herramientas moleculares como las citogenéticas empleadas en este estudio permitieron la diferenciación entre machos y hembras de ocho especies de psitácidos (A. amazónica, A. festiva, A. ochrocephala, A. ararauna, A. macao, A. severa, A. wagleri y P. menstruus). El material genético fue obtenido en una concentración entre 50 y 100 ng cuantificados mediante la utilización de un marcador de peso molecular HyperLadder III (Bioline); la visualización de los productos de PCR llevada a cabo en geles de poliacrilamida al 8 %, utilizando los iniciadores P2 y P8, mostraron dos fragmentos para los individuos hembras provenientes de la amplificación de los cromosomas Z y W y una única banda para los machos producto de la amplificación de cromosomas Z (Figura 1).
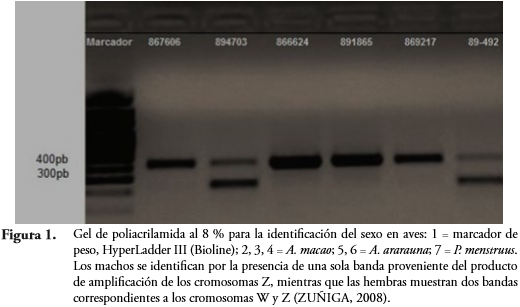
En términos generales, la eficiencia de la reacción de la PCR para amplificar los genes CHD-Z y CHD-W para el total de individuos muestreados fue del 83 % (34 de 41 individuos amplificados). En un total de 32 individuos de seis especies de psitácidos (A. ararauna, A. macao, A. festiva, A. ochrocephala y P. menstruus) se hizo posible la diferenciación por cariotipo en 25 de ellos, lo que representa una sensibilidad del 78 % para el sexaje citogenético.
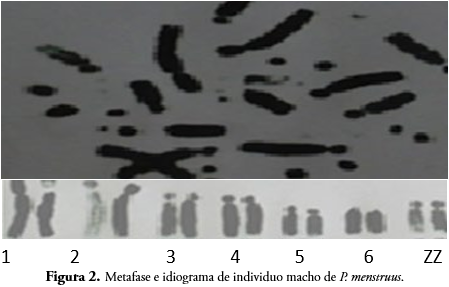
P. menstruus posee un cariotipo conformado por 72 pares de cromosomas, según lo reportado por LUCCA et al. (1991), de los cuales las parejas uno a cinco son subtelocéntricas, seis a 15 telocéntricas y el par sexual ZZ subtelocéntricos (Figura 2).
Los individuos de la especie A. ochrocephala poseen las parejas uno a ocho subtelocéntricos, nueve a 18 telocéntricas y el par sexual los cromosomas Z y W metacéntricos (Figura 3).

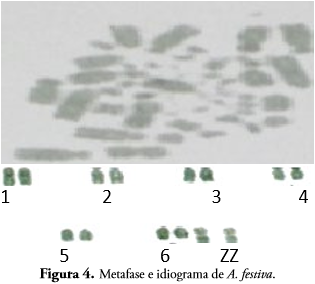
A. festiva posee el primer par de cromosomas metacéntricos, dos a cuatro subtelocéntricos, cinco a siete telocéntricos, ocho metacéntricos, nueve y diez telocéntricos y el par sexual metacéntrico (Figura 4).
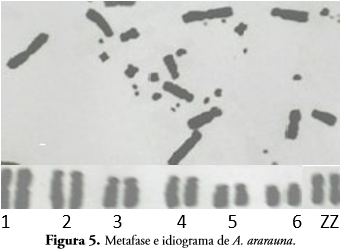
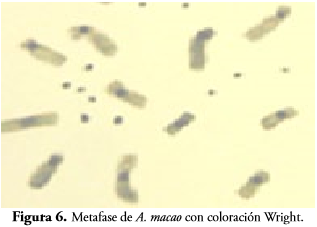
A. ararauna y A. macao presentan un número diploide de cromosomas 2n = 70, al igual que otras especies del género Ara; A. ararauna se caracteriza por el primer par de cromosomas metacéntrico, dos a seis submetacéntricos, siete a nueve metacéntricos y el par de cromosomas ZZ metacéntricos (Figuras 5-6).
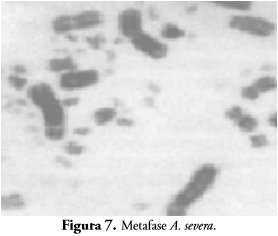
En las especies A. wagleri y A. severa (Figura 7) no fue posible obtener un número suficiente de metafases, por lo que no se pudo establecer el patrón del cariotipo debido al bajo número de individuos.
DISCUSIÓN
El uso de los cebadores denominados P2 y P8 permite amplificar dos regiones del gen CHD presentes en los cromosomas sexuales de las aves. Uno amplifica regiones altamente conservadas (exones) y el otro no conservadas (intrones), permitiendo la amplificación de hasta dos segmentos en individuos hembras y solo un fragmento en machos (GRIFFITHS et al., 1998). En este estudio, se pudo contar con individuos de sexo conocido para estandarizar la prueba en una primera etapa. Asimismo, se observa concordancia del 100 % entre los resultados del sexaje por métodos moleculares y citogenéticos.
El empleo de metodologías basadas en la PCR y en la amplificación del gen CHD permite llevar a cabo un sexado molecular fiable, efectivo y rápido en la mayoría de las aves tanto en aquellas especies caracterizadas por presentar un marcado dimorfismo sexual como en otras en las que este es escaso o nulo (CAEIRO, 2015). Además, es un método no invasivo que permite preservar la ética y responsabilidad en la manipulación y trabajo con animales vivos (GONZÁLEZ, 2014).
El sexaje molecular ha contribuido a la conservación de especies amenazadas tal como es el caso del guacamayo de Spix (Cyanopsitta spixii); para el cual GRIFFITHS et al. (1998) determinaron el sexo del último ejemplar de vida libre, que resultó ser un macho, y a partir de ello se logró la reintroducción de la especie (LIZA, 2006). Para el caso de la presente investigación, se determinó el sexo de ejemplares de ocho especies de psitácidos dentro de los cuales A. macao se encuentra incluida en el apéndice I del CITES (en peligro de extinción); mientras que A. amazónica, A. ochrocephala, P. menstruus, A. wagleri, A. ararauna y A. severa se encuentran en el apéndice II (como especies vulnerables); lo anterior, apoya la validez de esta técnica como herramienta para programas de conservación debido a que son especies muy comprometidas por la problemática del comercio ilegal.
En Psittaciformes, el número diploide de cromosomas varía de 62 en Melopsittacus undulatus a 86 en Forpus xanthopterygius; los géneros Ara, Amazona, Aratinga y Pionus posen cariotipos casi idénticos (LUCCA et al., 1991). Según FRANCISCO et al. (2001), los géneros Ara, Cyanopsitta, Propyrrhura, Aratinga, Pionittes, Pionopsitta, Nandayus y Guaruba son caracterizados por poseer la pareja uno de su respectivo cariotipo metacéntrica conservativa; las parejas dos, tres, cuatro, cinco y seis varían desde submetacéntricos hasta subtelocéntricos; las parejas siete y ocho varían desde metacéntricos hasta subtelocéntricos y las parejas nueve, diez y once varían desde metacéntricos hasta telocéntricos; esto fue corroborado en la presente investigación con las especies A. macao y A. ararauna.
Para DUARTE et al. (1995) existe un segundo grupo que es observado principalmente en especies del género Amazona y Brotogeris, caracterizado por un importante número de macrocromosomas telocéntricos. En la presente investigación los cariotipos de las especies A. amazónica, A. ochrocephala, A. macao, A. ararauna, P. menstruus, A. festiva, corresponden a los reportados por DUARTE et al. (1995), LUCCA et al. (1991) y AQUINO (1990).
Los cariotipos de A. severa y A. wagleri no se reportan debido a que el número de individuos muestreados de estas especies fue insuficiente para realizar un registro del nuevo cariotipo. Adicionalmente las muestras de algunos individuos no fueron adecuadas por no ser plumas en crecimiento o por estar contaminadas, por lo que se sexaron citogenéticamente tan solo 33 individuos significando que el 19,5 % de ellos no obtuvo registro de cariotipo. Aunque AQUINO (1990), LUCCA et al. (1991), DUARTE et al. (1995), GOLDSMIDT et al. (1997), LEDESMA et al. (2003), OLIVEIRA et al. (2003) y CAPARROZ et al. (2001) han publicado gran cantidad de cariotipos de aves reportando una sensibilidad de más del 90 % para la prueba, en su mayoría Psittáciformes, la técnica no es muy utilizada para sexaje en aves; específicamente, ya que poseen un gran número de microcromosomas que hace difícil su identificación (GRIFFITHS, 2000; CAMACHO et al., 2009). Por otra parte el sexaje con otras técnicas como las moleculares, a pesar de que podría llegar a ser más fácil, rápida y precisa, suelen generar más costos.
En este estudio se ha reflejado una concordancia del 100 % entre la técnica citogenética y la técnica molecular; lo cual demuestra que el sexaje de psitácidos puede realizarse por cualquiera de estos dos métodos. A pesar de que con el sexaje citogenético se logra diferenciar fácilmente los cromosomas Z y W, resulta inconveniente para las especies que no tienen cariotipo definido tal como es el caso de A. severa y A. wagleri. Además, aunque varias especies de los géneros Ara y Aratinga si poseen cariotipo, aún existen imprecisiones que disminuyen la certeza de la técnica. Finalmente el sexaje molecular proporciona una técnica poco invasiva, eficaz y rápida para obtener el sexo de individuos mediante la utilización de los iniciadores P2 y P8.
AGRADECIMIENTOSA la doctora Ana Lorenza Valencia del Instituto de Genética del Eje Cafetero por todo el tiempo dedicado y sus valiosos aportes para la realización del protocolo citogenético y a Óscar Ospina, director del Centro de Rehabilitación de Fauna Silvestre de CORPOCALDAS.
AQUINO, H. & FERRARI, I., 1990.- Chromosome study of Amazona amazónica and A. aestiva (Aves: Psittaciformes): Determination of chromosome number and identification of sex chromosomes by C banding methods. Genética, 81: 1-3. [ Links ]
BONAGURA, J. & KIRK, R., 1997.- Terapéutica veterinaria de pequeños animales. McGraw-Hill Interamericana. [ Links ]
CAMACHO, M.N., MARTÍN, N.R., DÍAZ, B.Z. & VERA, V., 2009.- Determinación del sexo en aves mediante herramientas moleculares. Actualidades Biológicas Colombianas, 14 (1): 25-38. [ Links ]
CAEIRO, A.M., 2015.- Sexado molecular en aves rapaces: Tesis, Facultad de Ciencias, Universidad de la Coruña, España. [ Links ]
CAPARROZ, R., ROBADO, N., BIANCHI, C. & WAYNTAL, A., 2001.- Analysis of the genetic variability and breeding behaviour of wild populations of two macaw species (Psittaciformes, Aves) by DNA fingerprinting. Ararajuba, 9 (1): 43-49. [ Links ]
CERIT, H.K., 2007.- Sex identification in avian species using DNA typing methods. World's Poultry Science Journal, 63: 91-99. [ Links ]
DUARTE, J.M.B. & CAPARROZ, R., 1995.- Cytotaxonomic analysis of Brazilian species of the genus Amazona (Psittacidae: Aves) and confirmation of the genus Salvatoria (Ribeiro, 1920). Rev. Bras. Genet., 18: 623-628. [ Links ]
DUBIEC, A. & ZAGALSKA, M., 2006.- Molecular techniques for sex identification in birds. Biological lett., 43 (1): 3-12. [ Links ]
DESCAILLEAUX, J., DESCAILLEAUX, L., ESTRADA, R., ESPINOZA, M., VELÁSQUEZ, M., VALENCIA, D., OLIVEIROS, N. & CORDOVA, J., 1979.- Manual de técnicas citogenética humana y de mamíferos. Universidad Nacional Mayor de San Marcos. [ Links ]
FRANCISCO, M.R. & GALETTI, J.R., 2001.- Citotaxonomic considerations on Neotropical Psittacidae birds and description of three new karyotipes. Hereditas, 134: 225-228. [ Links ]
FRIDOLFSSON, A.K. & ELLEGREN, H., 1999.- A simple and universal method for molecular sexing of nonratite birds. Journal of Avian Biology, 30: 116-121. [ Links ]
GOLDSCHMIDTT, B.M., DENISE, L. & SOUZA, M., 1997.- Chromosome study in two Aratinga species (A. guarouba and A. acuticaudata) (Psittaciformes). Brazilian Journal of Genetics, 20 (4). [ Links ]
GONZÁLEZ, S., 2014.- Determinación del sexo en aves: Tesis, Facultad de Ciencias, Universidad de la Coruña, España. [ Links ]
GRIFFITHS, R., 2000.- Sex identification of birds. Seminar in Avian an exotic Pet Medicine, 9 (1): 1-49. [ Links ]
GRIFFITHS, R. & TIWAR, B., 1995.- Sex identification of the last wild Spix's macaw. Nature, 375: 454-455. [ Links ]
GRIFFITHS, R., DOUBLE, M., ORR, K. & DAWSON, R., 1998.- A DNA test to sex most birds. Molecular ecology, 7: 1071-1075. [ Links ]
GRIFFITHS, R. & KORN, R., 1997.- A CHD1 gene Z chromosome linked in the chicken (Gallus domesticus). Gene, 197: 225-229. [ Links ]
HENAO, B.E. & MORENO, D., 2010.- Determinación molecular del sexo en siete especies de la familia Furnariidae - Aves: Tesis, Facultad de Ciencias Exactas, Universidad de Caldas, Manizales, Colombia. [ Links ]
JONES, A.G. & ANDREN, W.R., 2003.- Methods of parentage analysis in natural populations. Molecular ecology, 12: 2511-2523. [ Links ]
JUNIPER, T. & PARR, M., 1998.- Parrots: A guide to the parrots of the world. Pica Press. [ Links ]
LEDESMA, A.M., FREITAS, T.R., DA SILVA, J., DA SILVA, F. & GUNSKY, R.J., 2003.- Descripción Cariotípica de Spheniscus magellanicus (Spheniscidae). Hornero, 18 (1): 61-64. [ Links ]
LIZA, R.J., 2006.- Determinación del sexo en guacamayos de las especies Ara ararauna, Ara macao, Ara chroropthera, Ara militaris, Propyrrhura couloni mediante el uso de ADN: Tesis, Universidad de Quito, Ecuador. [ Links ]
LUCCA, E.J., SHIRLEY, L.R. & LAINER, C., 1991.- Karyotipe studies in twenty - two species of parrots (Psittaciformes: Aves). Rev. Brasil. Genetics, 14: 73-98. [ Links ]
MIYAKI, Y.M., GRIFFITHS, R., ORR, K., NAHUM, L.A., PEREIRA, S.L. & WAJNTAL, A., 1998.- Sex Identification of Parrots, Toucans and Curassows by PCR: Perspectives for Wild and Captive Population Studies. Zoo Biology, 17: 415-423. [ Links ]
OLIVEIRA, L.V., MERCIVAL, R.F., GUARACY, T., GOLDSCHMIDT, B. & GALETTI, P., 2003.- Karyotype description of two Neotropical Psittacidae species: The endangered Hyacinth macaw, Anodorhynchus hyacinthinus, and the Hawk-headed Parrot, Deroptyus accipitrinus (Psittaciformes: Aves), and its significance for conservation plans. Genetics and Molecular Biology, 26 (3): 283-287. [ Links ]
PAUTRAT, L., ANGULO, I., GERMANÁ, C., UCHIME, C., CASTILLO, R. & CANDELA, M., 2002.- Manual de identificación de especies peruanas de flora y fauna silvestres susceptibles al comercio ilegal. INRENA. [ Links ]
RODRÍGUEZ, J. & HERNÁNDEZ, J., 2002.- Loros de Colombia. Serie de Guías de Campo. Editorial Conservación Internacional Colombia. [ Links ]
WHITINGHAM, L.A. & DUNN, P.O., 2000.- Offspring sex ratios in tree swallows: Females in better condition produce more sons. Molecular Ecology, 9: 1123-1129. [ Links ]
ZÚÑIGA, C., RAMÍREZ, N., 2008.- Identificación del sexo en aves mediante la amplificación del gen CHD-1 por reacción en cadena de la polimerasa (PCR): Tesis, Facultad de Ciencias de la Salud, Universidad Colegio Mayor de Cundinamarca, Colombia. [ Links ]
CÓMO CITAR:
BETANCUR, C.L., AGUILAR, S.B., MESA-ECHEVERRI, H. & BARRERA, C.F., 2017.- Sexaje citogenético y molecular de psitácidos. Bol. Cient. Mus. Hist. Nat. Univ. Caldas, 21 (1): 112-121. DOI: 10.17151/ bccm.2017.21.1.9














