Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín Científico. Centro de Museos. Museo de Historia Natural
Print version ISSN 0123-3068
Bol. Cient. Mus. Hist. Nat. Univ. Caldas vol.21 no.1 Manizales Jan./June 2017
https://doi.org/10.17151/bccm.2017.21.1.10
DOI: 10.17151/bccm.2017.21.1.10
AGE STRUCTURE AND POPULATION MORPHOMETRY IN THE SOUTH AMERICAN SNAPPING TURTLE (Chelydra acutirostris, PETERS 1862) (CHELYDRIDAE) IN THREE AFFLUENTS OF LA VIEJA RIVER, DEPARTMENT OF QUINDÍO, COLOMBIA
* FR: 21-VI-16. FA: 31-VII-16
1 Programa de Biología, Universidad del Quindío, Armenia, Colombia. E-mail: arangolozanoj1@gmail.com.
2 Grupo de Investigación en Ecología Animal, Departamento de Biología, Universidad del Valle, Cali, Colombia. E-mail: katherineyoungv@gmail.com.
3 Grupo de Investigación en Ecología Animal, Departamento de Biología, Universidad del Valle, Cali, Colombia. E-mail: ecologia.animal@correounivalle.edu.com.
4 Grupo de Investigación Biodiversidad y Educación Ambiental –BIOEDUQ–, Universidad del Quindío; Fundación Neotrópica, Armenia, Colombia. E-mail: abotero@uniquindio.edu.co.
Se analizó la estructura etaria y morfométrica de las poblaciones de tortuga pímpano, en tres afluentes del río La Vieja (departamento del Quindío): quebrada Cajones (municipio de Montenegro), quebrada Cristales (municipio La Tebaida) y río Espejo (municipio de Armenia, sector Pantanillo). Se realizaron 18 jornadas de muestreo entre agosto de 2015 y enero de 2016, en las localidades de estudio. En cada afluente se establecieron cuatro trayectos lineales, de acuerdo a la topología del terreno, con una longitud total de 400 m a lo largo del curso del agua. Cada individuo capturado fue medido, pesado y sexado en el sitio. En total se capturaron 55 tortugas: 23 en la quebrada Cajones, 16 en la quebrada Cristales y 16 en el río Espejo. Tanto en el río Espejo como en la quebrada Cajones la población estuvo dominada por individuos adultos, no siendo diferente la proporción macho-hembra a la esperada 1:1. Se encontró diferencias significativas en la longitud preanal de machos y hembras, siendo mayor en machos; al igual que la relación de la longitud del plastrón y la longitud preanal, la cual incremento en mayor proporción para machos. En general, la población de tortugas para los tres afluentes se encontró en equilibrio en términos de proporción de machos y hembras. Además, al realizar el análisis de proporción de sexos entre los tres afluentes no se encontraron diferencias significativas entre estos.
Palabras clave: autoecología, ecología de poblaciones, ecosistemas acuáticos, proporción sexual, Chelydra acutirostris.
AbstractThe age structure and morphometry of the South American snapping turtle in populations in three tributaries of La Vieja River in the Department of Quindío, Cajones creek (Municipality of Montenegro), Cristales creek (Municipality of La Tebaida) and Espejo River (Municipality of Armenia, Pantanillo sector) were analyzed. Eighteen sampling sessions were performed between August 2015 and January 2016 in the places selected for the study. Four lineal paths, according to the topology of the ground with a total length of 400 meters along the watercourse, were established in each tributary. Each captured individual was measured, weighed and selected by sex on site. In total 55 turtles were captured, 23 in the Cajones creek, 16 in the Cristales creek and 16 in the Espejo River. Both in the Espejo River and in the Cajones creek the population was dominated by adults, the male-female ratio not being different than expected, 1:1. Highly significant differences were found in the preanal length of males and females, being higher in males, as well as in the relation between plastron length and the preanal length, which increased in greater proportion for males. In general, turtle population for the three tributaries were found in equilibrium in terms of male and female ratio. Also, after having performed the analysis of gender ratio among the three tributaries, significative difference among these were not found.
Key words: autoecology, population ecology, aquatic ecosystems, gender ratio, Chelydra acutirostris.
Colombia es el séptimo país del mundo con mayor riqueza de especies de tortugas y el segundo para el neotrópico después de Brasil. De las más de 30 especies de tortugas colombianas, 25 son de hábitos dulceacuícolas (PÁEZ et al., 2012; TURTLE TAXONOMY WORKING GROUP, 2014; FORERO-MEDINA et al., 2016). Sin embargo, la mayoría de las poblaciones de tortugas en el país se encuentran amenazadas por factores tales como la perdida, degradación y destrucción de su hábitat, el tráfico y comercialización para consumo humano (PÁEZ et al., 2012). Además, ha sido reconocido que los tensores ambientales pueden alterar la estructura etaria, e incluso provocar la reducción del tamaño de las poblaciones de tortugas, hasta su extirpación local (DODD, 1990; GIBBONS et al., 2000; RUEDA-ALMONACID et al., 2007; MORALES-BETANCOURT et al., 2012). En el caso de la especie objeto de estudio, Chelydra acutirostris (Peters 1862), los tensores que afectan su supervivencia están dados por la destrucción de madres viejas y humedales hábitat típico de esta tortuga; su comercialización, principalmente en las regiones Pacífico y Andina, la cacería, el uso como mascotas y uso mágico-religioso (HENAO & RUIZ-PALMA, 1996; CUESTA-RÍOS et al., 2007).
En Colombia, los estudios sobre C. acutirostris se han centrado en identificar la distribución de sus poblaciones, el tamaño de las mismas y caracterizar su hábitat (MEDEM, 1977; HENAO & RUIZ-PALMA, 1996; MOSQUERA & MURILLO, 2003; MÚNERA & REGALADO 2009; YOUNG-VALENCIA et al., 2014; YOUNG-VALENCIA et al., 2017). Sin embargo, estos son estudios puntuales y aún son deficientes para poder realizar una adecuada valoración del estado de conservación de esta tortuga tanto a nivel global como en localidades especificas (CASTAÑOMORA, 2002).
La tortuga Pímpano, ampliamente distribuida en Colombia, se puede encontrar en las cuencas del Magdalena, Caribe y Pacífico (MEDEM, 1977; REGALADO-TABARES et al., 2012); aunque en todos los casos es dependiente de ecosistemas acuáticos, lo cual restringe su área de ocupación. En la cuenca del río La Vieja su presencia se ha reportado para las quebradas Cristales (MOSQUERA & MURILLO, 2003), La Jaramilla, Cajones, Los Coclí (YOUNG-VALENCIA et al., 2014; YOUNG-VALENCIA et al., 2017) y los ríos Roble, Espejo, Quindío y La Vieja (MEDEM, 1977; MÚNERA & REGALADO, 2009). Todos estos afluentes presentan una alta degradación por vertimientos agropecuarios, industriales y domésticos (BOTERO-BOTERO et al., 2011; BOTERO-BOTERO et al., 2016).
La morfología es indudablemente uno de los aspectos más relevantes del fenotipo de los animales. Asimismo, el estudio de aspectos morfométricos entre poblaciones permite generar agrupaciones etarias y diferenciar entre sexos. Esta herramienta ha sido ampliamente empleada en tortugas (CLAUDE et al., 2003; LOPEZ & SCHOPPE, 2004; DAZA & PÁEZ, 2007; CEBALLOS & VALENZUELA, 2011; GIRALDO et al., 2012). De la morfología de C. acutirostris se conocen algunos aspectos generales: puede llegar a crecer hasta unos 49 cm de longitud del caparazón y alcanzar 34 kg de peso en cautiverio (RUEDA-ALMONACID et al., 2007). Los machos son más grandes que las hembras, la cola en ambos sexos es tan larga o un poco más larga que el caparazón (STEYERMARK et al., 2008). A pesar de que el aspecto externo de hembras y machos es similar, también se ha sugerido que los sexos pueden diferenciarse por la longitud preanal en relación a su grosor; siendo mayor esta relación en los machos debido a la presencia del pene (MEDEM, 1977).
Con el propósito de generar información sobre la biología y ecología poblacional de C. acutirostris, que permita fortalecer acciones de conservación para esta especie en el país, se analizó la estructura etaria y morfométrica de tres poblaciones asociadas a la cuenca hidrográfica del río La Vieja (departamento del Quindío, Colombia).
METODOLOGÍAEl área de estudio se circunscribió a la cuenca hidrográfica del río La Vieja. Este es uno de los principales tributarios del río Cauca y su cuenca ocupa todo el Quindío, así como parcialmente los departamentos de Risaralda y Valle del Cauca en el Centro Occidente de Colombia (Figura 1).
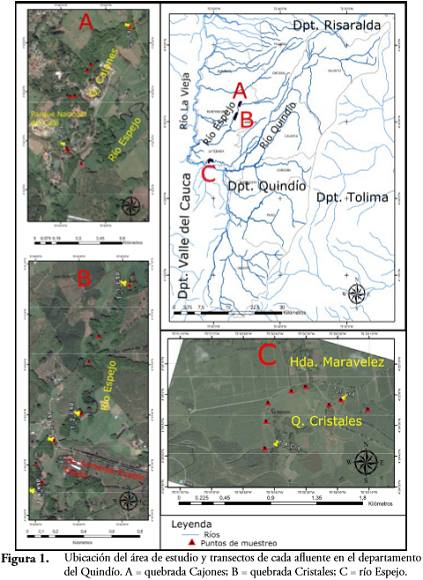
Esta cuenca sufre la degradación de las condiciones físicas, químicas y biológicas del agua ocasionada por vertimientos agropecuarios, industriales y domésticos, alteración de la geomorfología del cauce por erosión especialmente en zonas deforestadas, aprovechamiento forestal y fragmentación de los bosques ribereños, explotación de minería aurífera y de material destinado a la construcción (BOTERO-BOTERO et al., 2011; BOTERO-BOTERO et al., 2016). El paisaje a escala de la cuenca es dominado por una matriz agropecuaria (ganadería y cultivos); asociados a los cauces se encuentran pequeñas áreas de vegetación nativa, principalmente bosque de Guadua angustifolia (BOTERO et al., 2011; BOTERO-BOTERO et al., 2016). La región presenta dos temporadas de bajas precipitaciones (junio-septiembre y enero-marzo) y dos de altas precipitaciones (octubre-diciembre y abril-mayo) (ROMÁN-VALENCIA, 1993).
Se seleccionaron tres afluentes del río La Vieja en el departamento del Quindiío, en los que previamente han sido registrados individuos de C. acutirostris (MOSQUERA & MURILLO, 2003; MÚNERA & REGALADO 2009; YOUNG-VALENCIA et al., 2014): la quebrada Cajones (N 04° 32' 22.08" W 075° 46' 6.28"; 970-1250 m s. n. m.) con un recorrido aproximado de 3000 m desde el casco urbano del municipio de Montenegro hasta el Parque Nacional de la Cultura Cafetera, en donde desemboca al río Espejo. La quebrada Cristales (N 04° 30' 41" W 075° 42' 32"; 1475 m s. n. m.) tiene un recorrido aproximado de 33 km desde el sur de la ciudad de Armenia hasta el río La Vieja, en el sector del Valle de Pisamal. El río Espejo (N 04°30'34,94" W 075°46'44,85"; 1216 m s. n. m.) tiene una longitud aproximada de 155 km (Figura 1). Todos estos afluentes, reciben vertimientos de aguas residuales de los municipios donde nacen (CRQ, 2005).
Desde agosto de 2015 hasta enero de 2016, se realizaron muestreos mensuales en cada uno de los afluentes seleccionados. En cada uno se establecieron cuatro trayectos de 400 m de longitud, separados entre sí por 200 m; es decir, se definieron cuatro unidades de muestreo por afluente. Para la captura de las tortugas se realizó una revisión visual y manual en el borde del curso de agua, en contra de la corriente, buscando exhaustivamente sitios preferidos por la especie tales como palizadas, abundante vegetación marginal y zonas de inundación poco profundas y pantanosas. A la vez dos personas, una a lado y lado del cauce, palparon la pared del mismo y las cavidades formadas hasta tocar los bordes aserrados de la parte trasera del caparazón de la tortuga; una vez es detectada, se procede a sacarla del agua sujetando al individuo por la cola. Todos los especímenes capturados, fueron marcados en los escudos marginales; siguiendo la metodología de CAGLE (1939) y modificada para C. acutirostris con el propósito de generar un código numérico único.
A cada individuo se le registró la longitud recta del caparazón (LRC), longitud recta del plastrón (LRP), longitud preanal (LPR), longitud postanal (LP) y el peso; además, se determinó el sexo considerando el grosor y la LPR de la cola. Los individuos adultos se discriminaron como aquellos especímenes cuya longitud total del caparazón fuera mayor a 20 cm, ya que a este tamaño pueden ser considerados como maduros sexualmente (MEDEM, 1977; CORREDOR et al., 2001; YOUNG-VALENCIA et al., 2014).
Con base en los registros de captura se estableció la estructura etaria y sexual de las poblaciones en cada afluente muestreado, al igual que se evaluaron posibles diferencias entre adultos y juveniles entre las poblaciones utilizando una tabla de contingencia (RODRÍGUEZ-MURCIA, 2015). Se estableció la relación tamaño-peso para las poblaciones y se evaluaron posibles diferencias entre estas. Utilizando los registros de los individuos adultos se establecieron las medidas morfométricas promedio. De igual manera se utilizó un análisis de comparación por rangos de Mann-Whitney, para evaluar si existen diferencias en las variables anteriormente mencionadas entre machos y hembras (GIRALDO et al., 2012). Además, se compararon las medidas morfométricas de machos y hembras entre afluentes utilizando una prueba de comparación múltiple no paramétrica de Kruskal-Wallis y un posterior estadístico de Dunn (GIRALDO et al., 2012). Por último, se evaluó la relación de las variables LPR y LRP entre adultos de C. acutirostris con un análisis de covarianza (WHITE & MURPHY, 1973). Los análisis estadísticos se realizaron utilizando el software R versión 3.3.1.
RESULTADOSDurante el esfuerzo de muestreo equivalente a 252 horas/hombre, fueron capturados 55 individuos: 23 en la quebrada Cajones, 16 en la quebrada Cristales y 16 en el río Espejo (Figura 2).
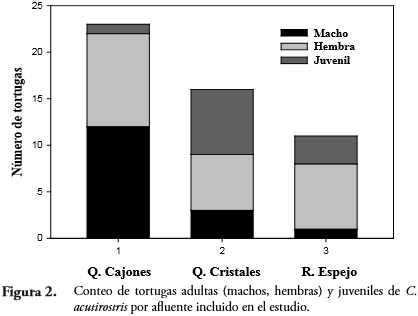
No se detectaron diferencias significativas en la proporción macho-hembra entre los afluentes de estudio (Chi2 = 1,79; P = 0,41), ajustándose la proporción machohembra en cada afluente a la proporción 1:1 (Chi2 = 4,8; P = 0,40). Sin embargo, se encontraron diferencias significativas en la proporción adultos-juveniles entre los afluentes incluidos en el estudio (Chi² = 9,18; P = 0,01); siendo la población de C. acutirostris dominada por adultos en la quebrada Cajones y en el río Espejo (Tabla 1).
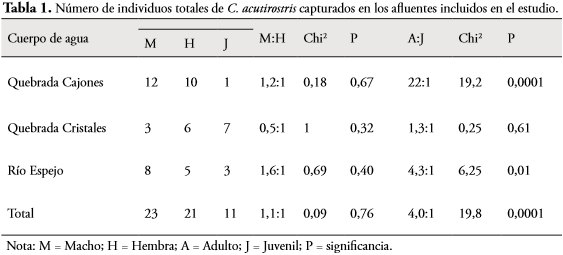
El crecimiento de C. acutirostris, en la zona de estudio, con base en la relación tamañopeso, fue de tipo alométrico (R2 = 0,986; P = 0,001; n = 55) (Figura 3).
El mayor registro de LRC, fue de un macho en río Espejo (40,01 cm); mientras la menor talla de LRC, fue en un juvenil en la quebrada Cristales (3,77 cm). En términos generales, las mayores tallas de LPR y los mayores registros de peso fueron en machos del río Espejo con un registro máximo de 17 cm de LPR y un peso máximo registrado de 13,8 kg (Tabla 2).
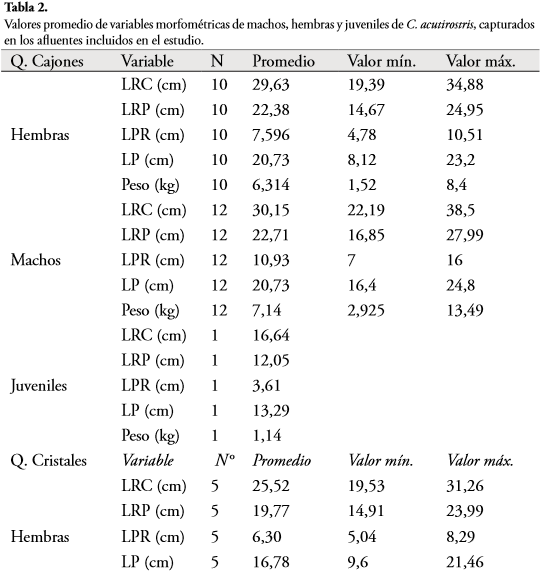
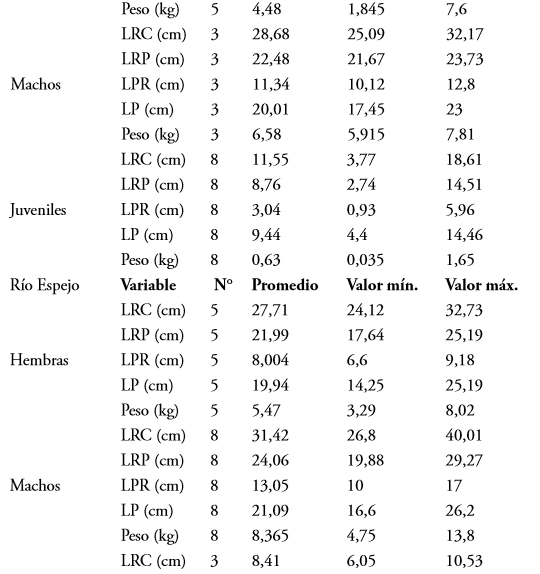

En las variables morfométricas entre machos y hembras se encontró que únicamente la variable LPR presentó diferencias significativas (U = 37; P = 0,001) (Tabla 3).
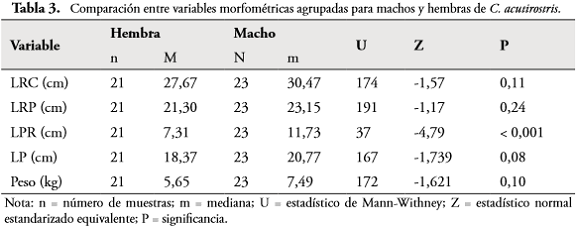
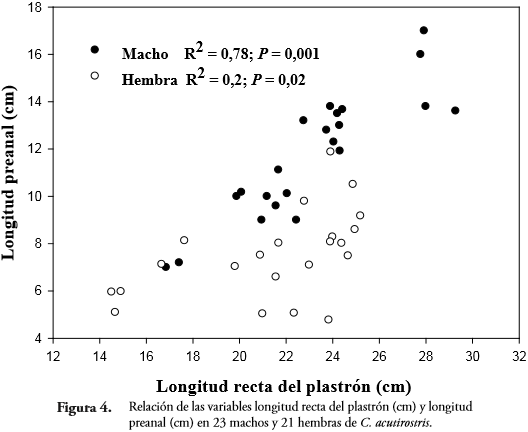
La región preanal tendió a ser mayor en machos que en hembras del mismo tamaño. Al comparar la relación de las variables LRP y LPR, en adultos, se encontró que existen diferencias significativas en la interacción de las variables sexo y LRP (F = 17,04; P = 0,001); al igual que la región preanal aumenta en una proporción más rápida en machos (R² = 0,788; P = 0,001; n = 23) que en hembras (R² = 0,207; P = 0,02; n = 21) (Figura 4).
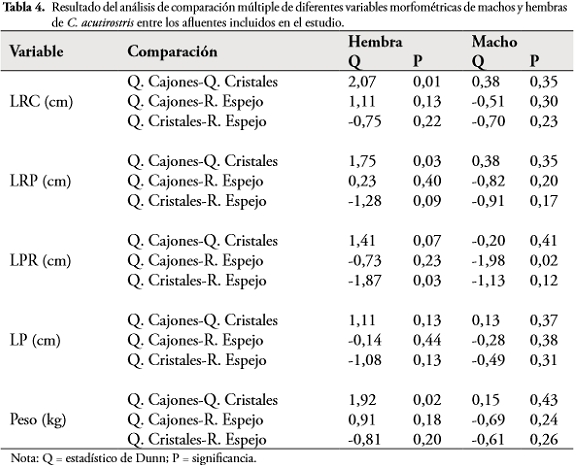
Al comparar las variables morfométricas de machos y hembras, entre afluentes, se encontró que las hembras de la quebrada Cajones fueron significativamente más grandes y pesadas que las hembras de la quebrada Cristales. Por otro lado, las hembras del río Espejo presentaron medidas mayores de LPR que hembras de la quebrada Cajones (Tabla 4). En machos únicamente se encontraron diferencias significativas en la variable LPR, siendo esta medida mayor para machos del río Espejo. La variable LP no presentó diferencias significativas para machos, ni hembras en ningún afluente (Tabla 4).
DISCUSIÓN
La quebrada Cajones es un afluente con una longitud menor a 4 km, que presenta altos índices de contaminación debido a que recibe más del 75 % de las aguas de vertientes del municipio de Montenegro (CRQ, 2005). Sin embargo, fue en esta quebrada donde se presentó el mayor número de capturas. A menudo existe una asociación positiva entre la condición y la calidad del hábitat, pero algunas especies alcanzan su máxima abundancia en áreas degradadas o fragmentadas. Por tal motivo la abundancia de una especie puede estar determinada por las condiciones microclimáticas, el alimento disponible y otros rasgos elusivos para el observador (CEBALLOS & MIRANDA, 1986; GALBRAITH et al., 1988). Es posible que la mayor densidad de tortugas en la quebrada Cajones sea producto del control que ejercen los propietarios de predios cercanos, así como el Parque Nacional del Café, al restringir la entrada a pescadores y cazadores a la zona baja de la quebrada. Además, la presencia de la tortuga en este afluente podría sugerir cierto grado de tolerancia a este tipo contaminación; similar a lo reportado por JOHNSTON et al. (2012) para C. serpentina osceola en el río Santa Fe (Norte de Florida), en donde la mayor densidad se encontró asociada a un pequeño sector del río que recibía agua de 9 quebradas con alta descarga orgánica.
La mayor incidencia de individuos adultos capturados con respecto a los juveniles probablemente se deba a que los últimos suelen permanecer ocultos bajo el lodo, lo que hace más difícil su detección. Este comportamiento ha sido descrito para otras especies del género Chelydra (JOHNSTON et al., 2012; LESCHER et al., 2013; ROSE & SMALL, 2014) y puede favorecer un mayor registro de adultos respecto a juveniles (BROOKS et al., 1991). Sin embargo, el mayor registro de juveniles en la quebrada Cristales podría indicar que esta localidad está funcionando como zona de anidación efectiva para esta especie; información similar a la reportada por YOUNGVALENCIA et al. (2014) para la quebrada Los Coclí, en el Quindío.
La población de tortuga Pímpano, para los tres afluentes, se encontró en equilibrio en términos de proporción macho-hembra; lo cual indica que por cada hembra hubo un macho en promedio. Al realizar el análisis de proporción de sexos entre afluentes, tampoco se encontraron diferencias significativas en cuanto a la proporción de hembras y machos; resultado que fue consistente con lo reportado por MOSQUERA & MURILLO (2003) y MÚNERA & REGALADO (2009) para la misma zona de estudio. Aunque no se ha evaluado el efecto de la temperatura sobre el sexo de los neonatos en C. acutirostris, es posible que la temperatura de incubación sea determinante en la proporción macho-hembra de estas poblaciones; ya que para la congénere C. serpentina la temperatura de incubación determina el sexo, siguiendo un patrón TSD-II donde neonatos hembras se relacionan con temperaturas de incubación bajas y altas y los machos con temperaturas intermedias (YNTEMA, 1979; STEYERMARK et al., 2008). Considerando que los resultados sugieren un equilibrio en la proporción macho-hembra en las poblaciones estudiadas, y asumiendo que la temperatura tiene un efecto sobre el sexo de los neonatos de C. acutirostris igual al reportado para C. serpentina, es de esperar que la temperatura de incubación en la zona de estudio haya sido lo suficientemente variable para no sesgar el sexo de los neonatos; y hasta cierto punto, verse reflejado en los adultos de C. acutirostris. Por otro lado, también es posible que tanto machos como hembras presenten una misma tasa de mortalidad (PÁEZ et al., 2012; EWERT & NELSON, 1991; GIRALDO et al., 2012; YOUNG-VALENCIA et al., 2014).
En general, las tortugas capturadas fueron grandes. Los registros de LRC realizados, fueron mayores a los reportados previamente por YOUNG-VALENCIA et al. (2014). El individuo con la menor talla de LRC fue registrado en la quebrada Cristales (3,8 cm), este registro es similar al reportado por MOSQUERA & MURILLO (2003) (LRC=3,7 cm); aunque fue mayor al reportado por MÚNERA & REGALADO (2009) (LRC=3,4 cm).
Al comparar la medida de LRC de los machos y las hembras fue evidente que los machos predominaron con la mayor talla de LRC; lo que es congruente con lo registrado por MOSQUERA & MURILLO (2003), quienes describieron una mayor talla para machos. Por su parte, YOUNG-VALENCIA et al. (2014) reportaron una mayor talla de LRC en hembras; lo anterior se debe a que encontraron un mayor registro de hembras respecto a machos, las cuales tenían una mayor LRC; igualmente tan solo tenían como referencia a 7 machos, mientras que en total para este estudio se capturaron 23. Otra posibilidad, es que la metodología empleada haya permitido capturar machos de mayor tamaño con respecto a las hembras.
Cuando se comparó la LRC, con el peso de los 55 individuos capturados, se estableció que el crecimiento de C. acutirostris es alométrico. Esto sugiere que, al alcanzar la etapa de madurez sexual, disminuye su tasa de crecimiento (YOUNG-VALENCIA et al., 2014). En el caso de los juveniles, estos invierten mayor energía en crecimiento que los adultos en reproducción (CONGDON & GIBBONS, 1990).
Las diferencias significativas registradas para la LPR, entre machos y hembras de C. acutirostris, confirman la validez de su uso como herramienta para determinar el sexo en esta especie cuando se presenta alometría positiva (REGALADO-TABARES et al., 2012; FAIRBAIRN, 1997). Así, la región preanal con respecto a LRP incrementa en proporción de forma más rápida para machos que hembras; resultados similares son reportados en C. serpentina (MOSIMAN & BIDER, 1960; WHITE & MURPHY, 1973) y recientemente en C. acutirostris (MOSQUERA & MURILLO 2003; RUEDA-ALMONACID et al., 2007; MÚNERA & REGALADO, 2009; YOUNG-VALENCIA et al., 2014). Una región preanal de mayor tamaño en los machos probablemente esté asociada con la ubicación del pene, característica distintiva de todos los Testudines (MEDEM, 1977; MILLER & DINKELACKER, 2007).
De acuerdo con los estudios realizados de C. acutirostris, en el departamento del Quindío, se tiene que las tortugas de mayor tamaño están registradas para las quebradas y que los individuos de menor tamaño se encuentran en los ríos. Sin embargo, en la presente investigación, el individuo de mayor tamaño fue registrado en el río Espejo. Teniendo en cuenta que esta especie se caracteriza por realizar amplios desplazamientos (REGALADO-TABARES et al., 2012) es probable que las tortugas de mayor tamaño no se vean limitadas a las quebradas, ya que una vez alcanzan la madurez sexual más fácilmente tienden a aventurarse en aguas abiertas como es el caso de los ríos (CONGDON & GIBBONS, 1990; CONGDON et al., 1994).
En este estudio, la presencia de dos neonatos en el mes de enero (bajas lluvias) podría sugerir posturas de huevos en altas lluvias. Así, y teniendo en cuenta el período de incubación de 94 a 106 días calculado en cautiverio para la especie por CORREDOR et al. (2001), da como resultado posturas de huevos en octubre (altas lluvias). Esto, para que la eclosión de los individuos se realice al final de las lluvias. Igualmente MOSQUERA & MURILLO (2003), para la quebrada Cristales, reportaron posturas en el mes de junio (final de la temporada de lluvias); mientras que YOUNG-VALENCIA et al. (2014), reportaron huevos en la quebrada Cajones en el mes de octubre (altas lluvias). También, en el presente estudio, se registró en la quebrada Cajones una copula en el mes de agosto (bajas lluvias). Por tanto, se puede plantear que C. acutirostris estaría realizando actividad reproductiva entre agosto y octubre en la zona de estudio.
CONCLUSIÓNLa población de C. acutirostris estuvo dominada por individuos adultos, estando en equilibrio la proporción macho-hembra. La mayor cantidad de capturas se registró en la quebrada Cajones y se estableció un crecimiento de tipo alométrico, a la vez que se identificó la LPR como una variable informativa para establecer el sexo en esta especie. Se registraron individuos adultos y de gran tamaño tanto en las quebradas como en el río Espejo; se propone como potencial época de reproducción para C. acutirostris, en el departamento del Quindío, el período de agosto-octubre. Se hace necesario continuar los esfuerzos de investigación para establecer tendencias de preferencia de hábitat, definir rangos de hogar y establecer patrones de movilidad de los individuos de esta especie. Lo que permitiría tener una mejor información técnica para proponer acciones de manejo y conservación de la especie, por lo menos, a nivel local.
AGRADECIMIENTOSA Dahian Lizeth Patiño Siro, Juan Manuel Botero-Valencia, Santiago Styles, Lorena Benítez Cubillos, Andrés Camilo Montes, por su apoyo durante las jornadas de muestreo. El Grupo de Investigación en Ecología Animal del Departamento de Biología de la Universidad del Valle, Cali, Colombia, financió el proyecto y facilitó los equipos de campo. El Parque Nacional de la Cultura Cafetera facilitó el acceso a las instalaciones para la realización de este estudio. El programa de Biología de la Universidad del Quindío facilitó el uso de equipos de campo para el desarrollo del muestreo.
REGALADO-TABARES, A.C., BOTERO-BOTERO, Á., MÚNERA-ISAZA, C., ORTEGA-GUIO, A.F. & RESTREPO-ISAZA, A., 2012.- Chelydra acutirostris: 275-278 (en) PÁEZ, V.P., MORALES-BETANCOURT, M.A., LASSO, C.A., CASTAÑOMORA, O.V. & BOCK, B.C (ed.) Biología y conservación de las tortugas continentales de Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá [ Links ].
BOTERO-BOTERO, A., SÁNCHEZ-PACHÓN, J.A., CARDONA-CLAROS, C.N. & CÁRDENAS, G.A., 2011.- Distribución de una población introducida de chigüiro Hydrochoerus hydrochaeris en el departamento del Quindío. Rev. Invest. Univ. Quindío, 21: 29:35. [ Links ]
BOTERO-BOTERO, A., CORREA-VIANA, M., TORRES-MEJÍA, A.M., UTRERA, A. & KATTAN, G., 2016.- Extensión de presencia y área de ocupación de la nutria neotropical (lontra longicaudis) en la cuenca del río La Vieja, Alto Cauca, Colombia. Bol. Cient. Mus. Hist. Nat. U. de Caldas, 20 (1): 101-115. [ Links ]
BROOKS, R.J., BROWN, G.P. & GALBRAITH, D.A., 1991.- Effects of a sudden increase in natural mortality of adults on a population of the common snapping turtle (Chelydra acutirostris). Can. J. Zool., 69: 1314-1320. [ Links ]
CAGLE, F.R., 1939.- A system of marking turtles for future recognition. Copeia, 3: 170-173. [ Links ]
CASTAÑO-MORA, O.V., 2002.- Libro rojo de reptiles de Colombia. Universidad Nacional de Colombia, Ministerio de Medio Ambiente, Conservación Internacional Colombia. [ Links ]
CEBALLOS, G. & MIRANDA, A., 1986.- Los Mamíferos de Chamela, Jalisco: manual de campo. Universidad Nacional Autónoma de México. [ Links ]
CEBALLOS, C.P. & VALENZUELA, N., 2011.- The role of sex-specific plasticity in shaping sexual dimorphism in a long-lived vertebrate, the snapping turtle Chelydra serpentina. Evolutionary Biology, 38 (2): 163-181. [ Links ]
CLAUDE, J., PARADIS, E., TONG, H. & AUFFRAY, J.C., 2003.- A geometric morphometric assessment of the effects of environment and cladogenesis on the evolution of the turtle shell. Biological Journal of the Linnean Society, 79 (3): 485-501. [ Links ]
CONGDON, J.D. & GIBBONS, J.W., 1990.- The evolution of turtle life histories: 45-54 (en) GIBBONS, J.W (ed.) Life history and ecology of the slider turtle: Smithsonian Institution Press, Washington. [ Links ]
CONGDON, J.D., DUNHAM, A.E. & VAN LOBEN-S, R.C., 1994.- Demographics of common snapping turtles (Chelydra serpentina): Implications for conservation and management of longlived organisms. Am Zool., 34: 397-408. [ Links ]
CRQ., 2005.- Plan de ordenamiento y manejo de la cuenca del río la Vieja, diagnóstico julio de 2005. Disponible en: www.crq.gov.co. [ Links ]
CORREDOR, G.A., ESPONOZA, D.A. & GALVIS C.A., 2001.- Crianza en cautiverio de la tortuga bache (Chelydra acutirostris) en el zoológico de Cali, Colombia. V Congreso Internacional de Manejo de Fauna Silvestre en Amazonía y Latinoamérica. [ Links ]
CUESTA-RÍOS, E.Y., VALENCIA-MAZO, J.D. & JIMÉNEZ-ORTEGA, A.M., 2007.- Aprovechamiento de los vertebrados terrestres por una comunidad humana en bosques tropicales (Tutunendo, Chocó, Colombia). Revista Institucional Universidad Tecnológica del Chocó, 26 (2): 37-43. [ Links ]
DAZA, J.M. & PÁEZ, V.P., 2007.- Morphometric variation and its effect on reproductive potential in female Colombian slider turtles (Trachemys callirostris callirostris). Herpetologica, 63 (2): 125-134. [ Links ]
DODD, C.K., 1990.- Effects of habitat fragmentation on a stream-dwelling species, the flattened musk turtle Sternotherus depressus. Biological Conservation, 54 (1): 33-45. [ Links ]
EWERT, M.A. & NELSON, C.E., 1991.- Sex determination in turtles: Diverse patterns and some possible adaptive values. Copeia, 1: 50-69. [ Links ]
FAIRBAIRN, D.J., 1997.- Allometry for sexual size dimorphism: Pattern and process in the coevolution of body size in males and females. Annual Review of ecology and Systematics, 28 (1): 659-687. [ Links ]
FORERO-MEDINA, G., PÁEZ, V.P., GARCÉS-RESTREPO, M.F., CARR, J.L., GIRALDO, A. & VARGAS-RAMÍREZ, M., 2016.- Research and conservation priorities for tortoises and freshwater turtles of Colombia. Tropical Conservation Science, 9 (4): 1-14. [ Links ]
GALBRAITH, D.A., BISHOP, C.A., BROOKS, R.J., SIMSER, W.L. & LAMPMAN, K.P., 1988.- Factors affecting the density of populations of common snapping turtles (Chelydra serpentina serpentina). Canadian Journal of Zoology, 66 (5): 1233-1240. [ Links ]
GIBBONS, J.W., SCOTT, D.E., RYAN, T.J., BUHLMANN, K.A., TUBERVILLE, T.D., METTS, B.S. & WINNE, C.T., 2000.- The Global Decline of Reptiles, Déjà Vu Amphibians Reptile species are declining on a global scale. Six significant threats to reptile populations are habitat loss and degradation, introduced invasive species, environmental pollution, disease, unsustainable use, and global climate change. BioScience, 50 (8): 653-666. [ Links ]
GIRALDO, A., GARCÉS-RESTREPO, M.F., CARR, J.L. & LOAIZA, J., 2012.- Tamaño y estructura poblacional de la tortuga sabaletera (Rhinoclemmys nasuta, testudines: Geoemydidae) en un ambiente insular del Pacífico Colombiano. Caldasia, 34 (1): 109-125. [ Links ]
HENAO, L.D. & RUIZ-PALMA, J., 1996.- Estado actual de la tortuga bache (Chelydra serpentina acutirostris) en el Valle del Cauca: cacería y cautiverio en la comunidad de San Cipriano, Buenaventura: 157-160 (en) OSORIO DE LA CRUZ, H (ed.). Seminario sobre Investigación y Manejo de Fauna para la Construcción de Sistemas Sostenibles: CIPAV, Cali. [ Links ]
MILLER, J.D. & DINKELACKER, S.A., 2007.- Reproductive Structures and Strategies of Turtles: 225-278 (en) WYNEKEN, J., GODFREY, M.H., & BELS, V (ed.) Biology of Turtles: From Structures to Strategies of life: CRC Press. [ Links ]
JOHNSTON, G.R., SUÁREZ, E., MITCHELL, J.C., SHEMITZ, G.A., BUTT, P.L. & KAUNERT, M., 2012.- Population ecology of the snapping turtle (Chelydra serpentina osceola) in a northern Florida river. Bulletin of the Florida Museum of Natural History, 51: 243-256. [ Links ]
KALIONTZOPOULOU, A., 2011.- Geometric morphometrics in herpetology: Modern tools for enhancing the study of morphological variation in amphibians and reptiles. Basic and Applied Herpetology, 25: 5-32. [ Links ]
LESCHER, T.C., TANG-MARTÍNEZ, Z., & BRIGGLER, J.T., 2013-. Habitat Use by the Alligator Snapping Turtle (Macrochelys temminckii) and Eastern Snapping Turtle (Chelydra serpentina) in Southeastern Missouri. The American Midland Naturalist Journal, 169 (1): 86-96. [ Links ]
LOPEZ, M.F. & SCHOPPE, S., 2004.- Morphometry of four species of non-marine turtles from Palawan, Philippines with special referece to sexual dimorphism. Agham Mindanaw, 2: 43-54. [ Links ]
MEDEM, F., 1977.- Contribución al conocimiento sobre la taxonomía, distribución geográfica y ecológica de la tortuga "Bache" (Chelydra acutirostris). Caldasia, 12: 41-101. [ Links ]
MOSQUERA, S. & MURILLO, S., 2003.- Estado actual de la población de tortuga Pímpano Chelydra serpentina acutirostris en la quebrada Cristales del departamento del Quindío: Tesis, Universidad del Quindío, Facultad de Educación, Armenia. [ Links ]
MOSIMAN, J.E. & BIDER, J.R., 1960.- Variation, sexual dimorphism and maturity in a Quebec population of the common snapping turtle, Chelydra serpentina. Canadian Journal of Zoology, 38: 19-38. [ Links ]
MORALES-BETANCOURT, M.A., LASSO, C.A., TRUJILLO, F. & DE LA OSSA, J., 2012.- Amenazas a las poblaciones de tortugas continentales de Colombia: 452-492 (en) PÁEZ, V.P., MORALES-BETANCOURT, M.A., LASSO, C.A.; CASTAÑO-MORA, O.V. & BOCK, B.C (ed.) Biología y conservación de las tortugas continentales de Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá [ Links ].
MÚNERA, C. & REGALADO, A.C., 2009.- Distribucion y abundancia relativa actual de la tortuga Pímpano (Chelydra acutirostris Peters 1862) Phillips et al., 1996 en los ríos Roble y Espejo, sistema rio La vieja, departamento del Quindío, Colombia: Tesis, Universidad del Quindío, Facultad de Educación, Armenia. [ Links ]
PÁEZ, V.P., MORALES, M.A., LASSO, C.A., CASTAÑO, O.V. & BOCK, B.C., 2012.- Biología y conservación de las tortugas continentales de Colombia. Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt. [ Links ]
TURTLE TAXONOMY WORKING GROUP., 2014.- Turtles of the World. Annotated Checklist of Taxonomy, Synonymy, Distribution with Maps, and Conservation Status (en) RHODIN, A.G.J., PRITCHARD, P.C.H., VAN DIJK, P.P., SAUMURE, R.A., BUHLMANN, K.A., IVERSON, J.B., MITTERMEIER, R.A (ed.) Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group: Chelonian Research Monographs. [ Links ]
RODRÍGUEZ-MURCIA, J.D., 2014.- Estructura poblacional y dimorfismo sexual de Kinosternon leucostomum (Testudines: Kinosternidae) en un sistema de charcas asociadas al río Purnió (Caldas, Colombia): Tesis, Universidad Militar Nueva Granada, Cajicá [ Links ].
ROMÁN-VALENCIA, C., 1993.- Composición y estructura de las comunidades de peces en la cuenca del río La Vieja, alto Cauca, Colombia. Biol. y edu., 3 (5): 8-19. [ Links ]
ROSE, F.L. & SMALL, M.F., 2014.- Population size, survivorship, density, and capture probability of Chelydra serpentina inhabiting an urban environment. The Southwestern Naturalist, 59 (3): 331-336. [ Links ]
RUEDA-ALMONACID, J.V., CARR, J.L., MITTERMEIER, R.A., RODRÍGUEZ-MAHECHA, J.V., MAST, R.B., VOGT, R.C., RHODIN, A.G.J., DE LA OSSA-VELÁSQUEZ, J., RUEDA J.N. & MITTERMEIER, C.G., 2007.- Las tortugas y los cocodrilianos de los países andinos del trópico. Editorial Panamericana, Formas e Impresos. [ Links ]
STEYERMARK, A.C., FINKLERY, M.S. & BROOKS, R.J., 2008.- Biology of the Snapping Turtle (Chelydra serpentina). Johns Hopkins University Press. [ Links ]
YNTEMA, C.L., 1979.- Temperature levels and periods of sex determination during incubation of eggs of Chelydra serpentina. Journal of Morphology, 159 (1): 17-27. [ Links ]
YOUNG-VALENCIA, K., ORTEGA, A.F. & BOTERO-BOTERO, Á., 2014.- Densidad y estructura de las poblaciones de tortuga Pímpano (Chelydra acutirostris, Peters 1862) (Chelydridae) en las quebradas Cajones y Los Coclí, departamento del Quindío, Colombia. Revista Biodiversidad Neotropical, 4: 149-161. [ Links ]
YOUNG-VALENCIA, K., ORTEGA-GUIO, A. & BOTERO-BOTERO, Á. 2017.- Influencia de las variables de hábitat sobre la presencia de la tortuga Pímpano (Chelydra acutirostris, Peters 1862) (Chelydridae) en las quebradas Cajones y los Coclí, Quindío, Colombia. Revista Colombiana de Ciencia Animal-ReCIA, 9 (1): 6-13. [ Links ]
WHITE, J.B. & MURPHY, G.G., 1973.- The reproductive cycle and sexual dimorphism of the common snapping turtle, Chelydra serpentina. Herpetological, 29: 240-246. [ Links ]
CÓMO CITAR:
ARANGO-LOZANO, J., YOUNG-VALENCIA, K., GIRALDO, A. & BOTERO-BOTERO, A., 2017.- Estructura etaria y mormometría poblacional de la tortuga pímpano (Chelydra acutirostris, Peters 1862) (Chelydridae) en tres afluentes del río La Vieja, departamento del Quindío, Colombia. Bol. Cient. Mus. Hist. Nat. Univ. Caldas, 21 (1): 122-137. DOI: 10.17151/bccm.2017.21.1.10














