INTRODUCCIÓN
El Sicalis Coronado (Sicalis flaveola) es una especie principalmente granívora de la familia Thraupidae (KLICKA et al., 2007). Se distribuye en Suramérica, y se reconocen cinco subespecies: S. f. pelzeni (Argentina, Bolivia, Brasil, Paraguay, Uruguay y Chile), S. f. brasiliensis (Brasil), S. f. flaveola (Colombia y Venezuela), S. f. valida (Ecuador y Perú) y S. f. koenigi (Argentina) (RISING et al., 2011). En Colombia, su distribución inicial, se reporta en la región Caribe, oriente de los Andes desde Arauca hasta Meta y oriente del Vichada; pero luego fue reportada en el Valle del Cauca, como aves que escaparon de jaulas o expansión de su rango geográfico y los primeros registros datan de 1971 (HILTY, 1985).
Esta especie, común en áreas abiertas y semiabiertas con intervención humana, como parques y cultivos (MARCONDES-MACHADO, 1988), presenta una dieta principalmente granívora aunque incluye también frutos e insectos que obtiene en el suelo, estrato herbáceo, ramas y follaje hasta los 5 m de altura (ZOTTA, 1940; DE LA PEÑA & PENSEIRO, 2003; DE LA PEÑA, 2011). Se alimenta en grupos donde la mayoría de los miembros son juveniles (MARCONDES-MACHADO, 1997).
Los primeros aportes sobre biología reproductiva de la especie provienen de Brasil, a partir de cinco nidos en cautiverio con los cuales se determinó época reproductiva y tamaño de postura (BUSCHINELLI, 1971). Posterior a ésto, se encuentran trabajos sobre la biología reproductiva de la especie pero sólo en zonas templadas del sur como en Argentina, Chile y en áreas subtropicales de Brasil (MANSON, 1985; QUIROGA et al., 2006; PALMERIO & MASSONI, 2009). Es considerada una especie socialmente monógama, aunque se han reportado dos casos de poligínia en Brasil (MARCONDES-MACHADO, 1982). Construye su nido en forma de taza al interior de cavidades en árboles seniles, en estructuras antrópicas como lámparas, al interior de nidos abandonados de otras especies (ejemplo: nidos de horneros) y en cajas nido (MANSON, 1985; MARCONDES-MACHADO, 1988; PALMERIO & MASSONI, 2009). El tamaño de la nidada en Argentina y Chile puede variar entre 2 y 6 huevos (MANSON, 1985; DE LA PEÑA, 1995; QUIROGA et al., 2003; PALMERIO, 2012; OROZCO et al., 2016) y la época reproductiva en la zona templada del sur es entre octubre y marzo (PALMERIO, 2012).
A pesar de su amplia distribución en Suramérica y de la existencia de información sobre la reproducción de la especie en algunos países, aún se presentan vacíos sobre la biología y el comportamiento reproductivo en el extremo norte de Suramérica. En Colombia, por ejemplo, existen sólo algunas observaciones de nidos, avistamientos esporádicos y reporte de época reproductiva con tres nidos (HILTY & BROWN, 2001). En Venezuela sólo existe información sobre tamaño de la postura y huevos (RAMO & BUSTO, 1984; CRUZ & ANDREWS, 1989). Así, llenar los vacíos de información planteados permite contribuir a esclarecer conceptos sobre las estrategias de vida y presiones selectivas a las cuales se ven sometidas algunas de las especies en la región tropical. Trabajos sobre la historia natural de las especies son fundamentales para el entendimiento de su ecología conductual y ocupan, cada vez, un mayor posicionamiento en el campo de la ornitología debido a la implicación que tienen sus aportes en la conservación (STUTCHBURY & MORTON, 2001). A pesar de su importancia, aún es precario el conocimiento sobre algunas especies, en especial, aquellas más comunes que ocupan ambientes urbanos (MURGUI & HEDBLOM, 2017), como es el caso del Sicalis Coronado. El objetivo de este estudio es, por lo tanto, describir por primera vez los principales aspectos de la biología reproductiva de S. f. flaveola, en Cali, Colombia, con énfasis en estacionalidad de la época reproductiva, tamaño de postura, periodo de incubación, cuidado paternal y desarrollo de polluelos.
MÉTODOS
Área de estudio
La investigación se llevó a cabo entre enero de 2013 y mayo de 2015 en el campus Meléndez de la Universidad del Valle (3°38’25,6’’ N, 76°19’13,6’’ W, 990 msnm), municipio de Santiago de Cali, departamento del Valle del Cauca, Colombia. De acuerdo con las características climáticas, la región se clasifica como Bosque Seco Tropical (bs-T), según el sistema de Holdridge (ESPINAL, 1967); con una temperatura promedio de 24,1°C y una humedad relativa promedio de 73%. La precipitación promedio anual es de 1471 mm, con dos picos de lluvia, entre marzo y mayo y de septiembre a noviembre (RIVERA, 2006). El campus tiene un área aproximada de 100 ha, de las cuales 9,5 ha están ocupadas por edificaciones, 44 ha por árboles, 45,5 ha por prados y pastizales y 1 ha por dos lagos (ARDILA-TÉLLEZ & CRUZBERNATE, 2014).
Métodos de campo
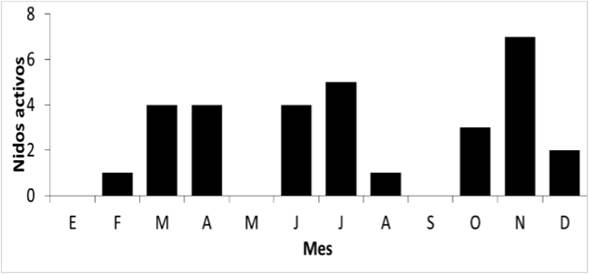
Época reproductiva. Se instalaron 94 cajas nido (dimensiones: 25 cm de alto, 13 cm de ancho y 10 cm de profundidad) con un orificio de entrada de 4 cm de diámetro y techo móvil para facilitar su revisión. Se ubicaron en toda el área de estudio, en árboles a 2 m de altura sobre el suelo, con una distancia mínima de separación entre ellas de 30 m y se revisaron cada tres días. El área de estudio se recorrió dos veces por semana, para un total de 232 recorridos adicionales, con el objeto de encontrar nidos silvestres. A estos nidos se les determinó la altura sobre el suelo y el volumen de la cavidad, teniendo en cuenta que correspondieron a nidos en lámparas o cercos con formas ortoédricas y cilíndricas. Se determinó el número de nidos activos (con huevos o polluelos) por mes, y se estableció la época reproductiva para la especie.
Postura, incubación y permanencia de los polluelos en el nido. Los nidos activos tuvieron seguimiento y observación diaria de dos a tres horas continuas a una distancia de 20 m entre las 8:00 y 18:00 h. Se registró la actividad que realizó cada miembro de la pareja durante dichos periodos de observación. De cada nido se registraron las variables: tamaño y medidas de la postura, duración del período de incubación, y permanencia de los polluelos en el nido (desde la eclosión del primer huevo hasta el abandono del nido por el último volantón). El período de incubación se estimó como el tiempo transcurrido desde que la hembra comienza a incubar hasta la eclosión del último huevo. Los huevos fueron medidos y pesados el mismo día en que fueron puestos. Se determinó el tipo de eclosión que presentaron los nidos; considerándose sincrónica aquella postura donde todos los huevos eclosionaron el mismo día y asincrónica cuando tomó varios días.
Desarrollo de polluelos. Se registró la tasa de crecimiento de los polluelos, con base en la medición diaria de cuatro caracteres morfológicos desde el momento del nacimiento hasta el abandono del nido. Los caracteres morfológicos fueron: masa corporal medida con una balanza digital (± 0,01 g), largo del pico, tarso-metatarso y ala medidos con un calibrador digital (± 0,01 mm). La longitud del ala se tomó desde la articulación hasta el extremo de la novena pluma primaria.
Anillamiento y éxito reproductivo. Para el reconocimiento individual, los adultos reproductivamente activos y los polluelos fueron marcados mediante anillos tarsales de colores dispuestos en combinaciones únicas. Los adultos se capturaron con redes de niebla instaladas en la vecindad inmediata de los nidos y con el uso de una puerta móvil instalada en la entrada de las cajas nido. El éxito reproductivo se midió como el número de polluelos que llegaron al momento de emplumar en relación con el total de polluelos nacidos, y el éxito de anidamiento se midió como el número de nidos en que al menos un polluelo alcanzó la edad de emplumar.
Determinación molecular del sexo. La proporción secundaria de sexos de los polluelos producidos por la especie se determinó mediante el método molecular propuesto por ELLEGREN (1996). Para este análisis se tomaron muestras de sangre (10 µl) en polluelos y adultos de la vena braquial y se conservaron en “Tarjetas FTA” Whatman. Se empleó el lisado celular con la resina de intercambio iónico “Chelex 100” para liberar el ADN y se cuantificó con Thermo ScientificTM NanoDrop 2000. La PCR se realizó con base en lo descrito por FRIDOLFSSON & ELLEGREN (1999) utilizando los iniciadores 2550F - 2718R. Los productos amplificados fueron separados en geles de agarosa al 1% y coloreados con bromuro de etidio (SAMBROOK & RUSSELL, 2001).
Análisis de datos. Para determinar si existían diferencias significativas en el número de nidos activos entre las temporadas reproductivas anuales se empleó una prueba de Bondad de ajuste (ZAR, 2010). El volumen de la cavidad donde fueron construidos los nidos silvestres se calculó con base en la fórmula matemática establecida para el cilindro y el ortoedro. Se calculó la ganancia de masa y talla diaria de los polluelos con la resta de las medidas tomadas entre días consecutivos. Se utilizó un modelo lineal generalizado mixto para analizar si el tiempo diario dedicado por las hembras al cubrimiento de los polluelos variaba significativamente con el transcurrir de los días. Las variables “día” (discreta) y “tiempo de permanencia en el nido” (continua) fueron consideradas factores fijos, mientras que la variable “nido” (discreta) fue aleatoria. Se consideró como “día 1” el día que comenzó la eclosión. Para el análisis de los datos se usó el programa estadístico R (R CORE TEAM, 2017).
RESULTADOS
Nido
Se registraron en total 18 nidos (nueve en cajas nido y nueve en lámparas y cercos). La época reproductiva para la especie es continua durante el año, no se encontraron diferencias significativas en el número de nidos activos entre los meses de mayor reproducción (χ2 = 0,875 gl = 2, p = 0,001) y se observaron volantones vocalizando y solicitando alimento a lo largo del año (Fig. 1). El volumen de los nidos en lámparas y cercos varió de 654,23 cm3 a 14064,91 cm3 (media = 2790,15, DE = 4258,22, n = 9) y la altura sobre el suelo en que se hallaron fue de 1,63-2,94 m (media = 2,4 m, DE = 0,50, n = 9).
Postura
Los huevos fueron de color crema con vetas marrones, con un peso de 1,6-2,5 g (media = 2,1 g, DE = 0,23, n = 52), largo de 19,26-22,8 mm (media = 20,08 mm, DE = 1, n = 52) y ancho de 13-15,46 mm (media = 14,55 mm, DE = 0,63, n = 52). El tamaño de la postura fue de 3-4 huevos (media = 3,46, DE = 0,51, n = 15) (Fig. 2). La postura fue seriada, es decir que ponen un huevo por día.
Incubación
Según la eclosión, los huevos no se incuban siempre desde el primer día y la incubación puede comenzar cualquier día hasta que se pone el último huevo. Se observaron cinco nidos con eclosión sincrónica y seis con eclosión asincrónica. La duración del período de incubación fue de 14-19 días (media = 16, DE = 1, n = 6) y la hembra es la única encargada de esta actividad. Del tiempo de observación, la hembra dedicó el 53,1% a la incubación y el resto del tiempo el nido permaneció solo (Fig. 3a). El macho acompañó a la hembra durante la incubación, vocalizando cerca al nido, y también durante los vuelos que ella ejecutaba al llegar o salir del mismo.
Permanencia de polluelos en el nido
El cuidado de los polluelos (cubrimiento y alimentación) fue compartido parcialmente por los miembros de la pareja, ya que la hembra es la única que cubre los polluelos. Ambos miembros de la pareja alimentaron los polluelos, pero presentaron diferencias en sus patrones de inversión paternal. El tiempo que las hembras dedicaron a los polluelos en el interior del nido disminuyó significativamente a medida que avanzó el desarrollo de los polluelos (Tabla 1 y Fig. 3a). El número promedio de visitas al nido efectuadas por las hembras fue de 1,62±0,68 visitas/h, con duración de 1-68 min (media = 5, DE = 7), mientras que para los machos fue de 0,89±0,42 visitas/h (Fig. 3b), con una duración menor a un minuto. La permanencia de los polluelos en el nido fue de 15-19 días (media = 18,25, DE = 1, n = 8).
Tabla 1 Resultado del Modelo lineal generalizado mixto usado para evaluar variación del tiempo de permanencia en el nido que efectuó la hembra durante el cuidado de los polluelos de Sicalis Coronado (Sicalis faveola flaveola) en el campus de la Universidad del Valle, Cali, suroccidente de Colombia.
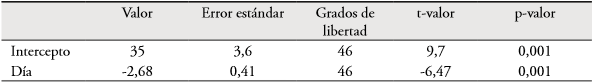
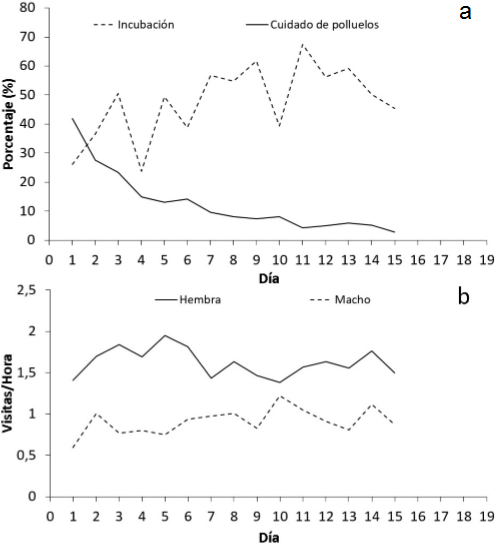
Figura 3 Incubación y cuidado de polluelos del Sicalis Coronado (Sicalis faveola flaveola) en el campus de la Universidad del Valle, Cali, suroccidente de Colombia. a) Porcentaje de tiempo diario dedicado por la hembra a incubación y cuidado de polluelos. b) Promedio de visitas diarias por ambos miembros de la pareja durante la permanencia de polluelos en el nido.
Desarrollo de polluelos
Los polluelos nacieron ciegos, con un fino plumón gris en las regiones lumbar, cefálica y humeral. En el cuarto día salieron los cañones de las primarias, el día siguiente abrieron los ojos y al séptimo día se observaron los cañones largos de las plumas de las alas (Fig. 4). El peso de los polluelos presentó un incremento de 1,37±0,19 g (n = 35) hasta el octavo día, después fue de 0,36±0,28 g/día. Los polluelos fueron capaces de volar fuera del nido desde el decimocuarto día de edad, cuando el largo de la novena primaria alcanzó 41,91±3,7 mm, y el peso fue de 15,04±1,25 g, que correspondieron al 62,14% y 69,18% de las medidas del adulto, respectivamente. El crecimiento del tarso fue de 1,38±0,38 mm/día hasta el noveno día, después fue de 0,16±0,19 mm/día y al momento de abandonar el nido el tarso midió 20,52±1,33 mm. El crecimiento del pico fue constante con una tasa de 0,35±0,15 mm durante todo el desarrollo; al momento de abandonar el nido el pico alcanzó 8,85±0,53 mm de largo (Fig. 5).

Figura 4 Progresos morfológicos durante el crecimiento de los polluelos del Sicalis Coronado (Sicalis faveola flaveola) en el campus de la Universidad del Valle, Cali, suroccidente de Colombia. a) Polluelo de un día de edad. b) Siete días. c) 10 días. d) 12 días. e) 15 días. f) Adulto.
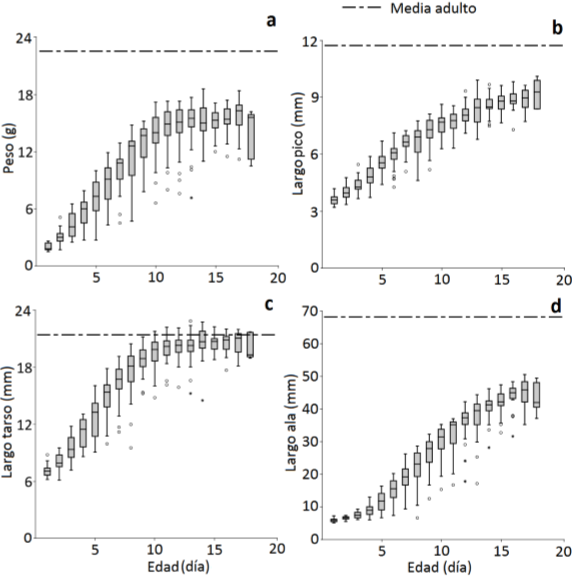
Figura 5 Tasa de crecimiento de los polluelos del Sicalis Coronado (Sicalis faveola flaveola) (n = 35) en el campus de la Universidad del Valle, Cali, suroccidente de Colombia. Peso corporal (a), largo del pico (b), largo del tarso-metatarso (c) y largo del ala (d). Diagrama de caja: línea horizontal = mediana, caja = Q1-Q3, círculos y asteriscos = valores atípicos.
Éxito reproductivo y determinación molecular del sexo
En 18 nidos se encontraron 56 huevos, de los cuales 43 (76,7%) llegaron hasta el momento de la eclosión y 38 (67,8%) eclosionaron exitosamente. De los 18 nidos, cuatro (22,2%) no pasaron del periodo de incubación y en 11 nidos al menos un polluelo alcanzó la edad del primer vuelo, dando un éxito de anidamiento de 61,1%. El éxito reproductivo, medido como el número de polluelos que llegaron al momento del éxodo (25) en relación con el total de polluelos nacidos (38), fue del 65,8%.
Se determinó el sexo con métodos moleculares en la totalidad de los polluelos que llegaron a la edad de volantón (n = 16). Los fragmentos amplificados del intrón del gen CHD1 estaban dentro del rango de valores reportados en la literatura (CHD1Z = 600-650 pb y CHD1W = 400-450 pb) (Fig. 6). Se encontró que no existe una diferencia significativa en el número de polluelos que llegan a la edad del éxodo según el sexo (siete machos vs. nueve hembras); la proporción secundaria de sexos fue de 1:1 (χ2 = 0,25 gl = 1, p = 0,001).

Figura 6 Gel de agarosa al 1% con los productos de amplificación del intrón comprendido entre el nucléotido 2550 y 2718 del gen CHD1 del Sicalis Coronado (Sicalis flaveola flaveola) en el campus de la Universidad del Valle, Cali, suroccidente de Colombia. De izquierda a derecha: marcador de peso molecular de 100 pb. H = hembras con dos bandas: CHD1Z y CHD1W. M = machos con una banda: CHD1Z.
DISCUSIÓN
En el caso del Sicalis Coronado, el tamaño de la nidada hallado en este estudio para la subespecie S. f. flaveola (3,46 huevos) es similar al reportado para la misma subespecie en Venezuela, en donde se halló un promedio de huevos por postura de 3,6 (CRUZ & ANDREWS, 1989) y 3,75 huevos (RAMO & BUSTO, 1984), con un rango de 3 a 5 huevos. Estos resultados difieren ligeramente de la subespecie S. f. pelzeni, para la cual se registró un tamaño de postura de 4,0 (QUIROGA et al., 2003), 5,0 (DE LA PEÑA, 1995), 3,87 (PALMERIO, 2012), 4,22 (MANSON, 1985) y 4,1 huevos (OROZCO et al., 2016), con rangos de 2 a 6 huevos. Los datos encontrados en este trabajo apoyan lo reportado en paserinos, donde el tamaño de las nidadas es menor en los trópicos que en zonas templadas (MARTIN et al., 2006), con posturas de 2-3 huevos en el neotrópico vs. 4-5 huevos en la zona templada del hemisferio norte (MARTIN, 1996). Diferencias en tamaños de nidada pueden reflejar variaciones en presiones selectivas que tienen las especies, además de poder influir en rasgos demográficos y de vulnerabilidad de las poblaciones (SAETHER et al., 1996; SAETHER & BAKKE, 2000).
Una explicación a la diferencia en el tamaño y el rango de las posturas, puede ser la duración de las estaciones en el hemisferio sur (WINKLER et al., 2014). Se conoce que, al inicio de la temporada reproductiva, existen mejores condiciones ambientales y se incrementan las probabilidades de encontrar parejas disponibles de mejor calidad (YOUNG, 1994; HANSSON et al., 2000; WINKLER et al., 2014). El tamaño de las posturas tiende a variar a lo largo de la temporada reproductiva en las zonas templadas, donde el número de huevos por postura disminuye a medida que avanza la época reproductiva (WINKLER et al., 2014). En las especies del trópico las posturas no varían en gran medida, ya que las condiciones ambientales son relativamente estables. En S. f. flaveola se encontró que las posturas fueron de tres huevos entre enero y septiembre, y entre octubre y diciembre -la época de mayor pluviosidad donde las condiciones ambientales son las más favorables- las posturas fueron en su mayoría de cuatro huevos, evidenciando un esfuerzo reproductivo regulado a lo largo del año con una variación mínima.
El 28% de los nidos en S. f. flaveola (información de este estudio más datos no publicados) no pasaron el periodo de incubación debido a depredación, mientras que en S. f. pelzeni el porcentaje fue de 35% (PALMERIO, 2012). Estos valores, sugieren que las presiones sobre el nido, durante los períodos de postura e incubación en el Sicalis Coronado, se encuentran en un rango cercano entre el hemisferio sur y el trópico; lo que concuerda con lo reportado por MARTIN et al. (2006), quienes no encontraron diferencias significativas en la depredación de nidos entre el trópico, hemisferio sur y el hemisferio norte.
Los cuidados de los padres, en el periodo de incubación y de polluelos, traen un riesgo alto; generan un mayor gasto energético y exposición a los depredadores que comprometen la supervivencia de la pareja (GHALAMBOR & MARTIN, 2001; MARTIN, 2002). El período de incubación en S. flaveola para Colombia fue de 16 días, mientras que lo reportado para Argentina fue de 12,95 (n = 104) (PALMERIO & MASSONI, 2009, 2011), 13,3 (n = 34) (MANSON, 1985) y 16 días (n = 5) (QUIROGA et al., 2003), y en Chile de 11,1 días (n = 7) (OROZCO et al., 2016). Excepto por lo mencionado por QUIROGA et al. (2003), el período de incubación es más largo en el trópico y concuerda con lo encontrado en otras especies de paserinos (MARTIN, 2002). Esta diferencia se podría explicar por el menor tiempo dedicado a la incubación por parte de las hembras en el trópico (MARTIN, 2002). Se considera que existe una relación inversa entre el porcentaje diario de atención al nido por parte de los adultos y la duración total del periodo de incubación (GHALAMBOR & MARTIN, 2001; MARTIN, 2002). Aunque el riesgo sobre la nidada aumenta con periodos de incubación más largos en el trópico, se compensaría por la posibilidad de futuras reproducciones de los adultos (MARTIN, 2002), ya que las especies del trópico tienen una mayor esperanza de vida.
La duración del período de cuidado de los polluelos difiere entre las subespecies, en S. f. flaveola fue de 18,25 días mientras que en S. f. pelzeni fue de 14 (MANSON, 1985; PALMERIO & MASSONI, 2009; OROZCO et al., 2016). Esto apoyaría la hipótesis que algunas especies del trópico presentan períodos de cuidado de polluelos más largos que en las zonas templadas (STUTCHBURY & MORTON, 2001). Aparentemente, un período más largo de permanencia de los polluelos en el nido les confiere ventajas en términos de mayor tiempo para el crecimiento en la longitud del ala, que a su vez contribuirá con un mejor desempeño durante el vuelo después de emplumar (MARTIN, 2015). Aún con las diferencias encontradas entre el Sicalis Coronado de Argentina y Colombia, estas no se reflejan en el éxito de anidamiento; en S. f. pelzeni fue del 55% (PALMERIO, 2012) y para S. f. flaveola fue del 61,1%.
Las teorías clásicas consideran aspectos como: limitación de alimentos, depredación de nidos y la mortalidad de adultos, para explicar la variación en la biología reproductiva de las aves en diferentes latitudes (MARTIN, 2004). Sin embargo, la limitación de alimentos y la depredación no han explicado el tamaño de la postura de muchas especies tropicales (MARTIN, 1996, 2004; MARTIN et al., 2000). Los trabajos de historia natural se han centrado en las diferencias en el tamaño de la postura. Pero otros aspectos, como los aquí descritos, también deben continuarse en investigación para conocer los mecanismos que subyacen en estos procesos diferenciadores entre especies.
Se ha planteado que las especies del trópico son similares a las del hemisferio sur y difieren en las estrategias de vida de las especies del hemisferio norte. En el caso del Sicalis Coronado (S. f. flaveola) la incubación está a cargo de la hembra, y el cuidado de los polluelos antes del abandono del nido es efectuado por la pareja; similar a lo que ocurre con S. f. pelzeni. Pero también existen diferencias: la subespecie en el Valle del Cauca presenta un rango de postura menor, y períodos más largos de incubación y permanencia de polluelos en el nido.