INTRODUCCIÓN
La comunicación acústica es una característica sobresaliente en los saltamontes. Se produce por la interacción mecánica entre las alas anteriores, también llamadas tegminas. Una de las tegminas posee un raspador que frota la tegmina opuesta, en su lado interno sobre una fila de pequeños dientes, y produce una vibración en una zona membranosa, conocida como espejo, que cumple la función de irradiación del sonido (BAILEY, 1970; MORRIS & PIPHER, 1972; MONTEALEGRE-Z, 2005; MONTEALEGRE-Z & MASON, 2005). Todas las estructuras involucradas en la estridulación se encuentran en la región anal de la tegmina. La fila de dientes (= fila estridulatoria) está ubicada en la porción ventral de la vena cubital posterior (CuP), el raspador es una porción engrosada en la base de la CuP, y el área de vibración (= espejos y arpa) está delimitada por las venas anales (A1, A1+2) y las cubitales (CuA’s, CuP’s) (BÉTHOUX, 2012).
El mecanismo de producción del sonido es generalizado en el suborden Ensifera, no obstante, la posición, funcionamiento y variación de los componentes morfológicos entre la tegmina izquierda y la derecha difieren ampliamente entre las superfamilias y familias (GU et al., 2012; CHAMORRO-RENGIFO et al., 2014). En Tettigoniidae, la tegmina izquierda presenta la fila de dientes y se superpone sobre la tegmina derecha (MONTEALEGRE-Z., 2009; MONTEALEGRE-Z. & MANSON, 2005; MORRIS & PIPHER, 1972; WALKER, 1974). A pesar del alto grado de similitud morfológica entre los grupos, existe un alto grado de especialización funcional de cada tegmina, lo cual repercute en las diferencias morfológicas y morfométricas (MONTEALEGRE-Z. & MANSON, 2005; CHIVERS et al., 2014. Debido a la especialización funcional, las tegminas son asimétricas y existe una variación en el nivel de asimetría (CHAMORRO-RENGIFO et al., 2014).
Sin embargo, a pesar de que esa variación morfológica es reconocida, no existe ningún estudio que determine ni describa en detalle la variación de la simetría. El objetivo de este estudio es determinar a través de la herramienta de morfología geométrica, el grado de variación de la tegmina izquierda en relación a la tegmina derecha, y cómo esa variación se comporta dentro y entre taxones de Tettigoniidae.
MÉTODOS
Especímenes y disección
Se utilizaron 192 especímenes, 145 depositados en la colección de Tettigoniidae del Laboratorio de Sistemática e Biología de Coleoptera (LabCol) del Departamento de Biología Animal de la Universidade Federal de Viçosa (MG), en Brasil; 31 especímenes provinieron de la colección de insectos de la Universidad del Quindío-Armenia, Colombia (CIUQ) y 13 de la colección entomológica del programa de Biología de la Universidad de Caldas-Manizales, Colombia (CEBUC), recolectados en la región central andina, el Pacífico y la Amazonia colombiana.
Se retiró la tegmina izquierda y derecha de cada espécimen. Las tegminas fueron extendidas y cubiertas con láminas de vidrio para microscopía y se secaron durante 48 horas. Los especímenes fueron identificados a la menor categoría taxonómica posible usando descripciones originales, claves taxonómicas y la comparación de las fotografías de los tipos nomenclaturales disponibles en Orthoptera Species File (OSF) (CIGLIANO et al., 2016). Para especies sin identificar en un determinado género, se le asignó la abreviación “sp.”, seguida de un numero consecutivo (v.g. Conocephalus sp.1, Conocephalus sp.2). Los géneros sin describir fueron identificados con la abreviación “Gen.” seguida de números consecutivos (v.g. Gen.1 sp., Gen.2 sp.). Las especies examinadas pertenecen a las seis subfamilias de Tettigoniidae a seguir: Pterochrozinae, Conocephalinae, Listroscelidinae, Meconematinae, Phaneropterinae y Pseudophyllinae.
Elaboración de las imágenes
Las tegminas fueron fotografiadas en un estereomicroscopio Carl Zeiss® discovery V20 con una cámara AxioCam® 506. Para cada par de tegminas se realizaron dos fotografías, una visión general en vista ventral utilizando una configuración de aumentos de acuerdo al tamaño de la tegmina, y una fotografía del aparato estridulatorio utilizando un lente objetivo Plan-Apo de 1.0x y objetivo de 7.5X para un campo focal de 31 mm. Estas fotografías se hicieron independientes del tamaño de la tegmina para estandarizar la escala de medida y reducir el error por diferencias en los aumentos. Las imágenes fueron procesadas con el software Adobe Photoshop cs6® y los esquemas ilustrados con CorelDraw X7®.
Morfometría geométrica
Para cada aparato estridulatorio se sobrepusieron seis puntos homólogos “Landmarks” (= LM’s) sobre cada tegmina, estos puntos fueron seleccionados de acuerdo con la propuesta de BÉTHOUX, (2012), adicionalmente se realizó un estudio previo comparativo de la morfología de la tegmina de Megatympanon speculatum (Listroscelidinae), Iaratrox maculata (Conocephalinae), Typophyllum sp.1 (Pterochrozinae), Plagiopleura nigro marginata (Phaneropterinae) y Pristonotus colombiae (Pseudophyllinae) (Figura 1) para examinar los puntos “Landmarks”.

Figura 1 Configuración de los seis LM’s seleccionados para análisis sobre las áreas estridulatorias: 1). Origen de la CuPb (= ramificación con la M+CuA); 2) intersección de la vena C con la CuPb; 3) Ápice de la CuPb en el borde de la tegmina; 4) Ápice distal de la CuPaα2; 5) Intersección de la CuPaα2 con la vena h, 6) Intersección de la h con la CuPa. Interpretación modificada de Béthoux, (2012): página 67, Figura 6B. Localización del área de vibración: espejo (verde) y arpa (marrón).
Los LM’s fueron digitalizados en los programas TPS-util y TPS-dig2 (ROHLF, 2015) y se obtuvieron dos archivos de extensión .TPS con las coordenadas crudas, uno de la tegmina del lado derecho y otro del lado izquierdo. Los archivos TPS se procesaron en el software MorphoJ 1.06 (KLINGENBERG, 2011), y fueron convertidos en una matriz que representó las coordenadas de LM’s de ambos lados. Las matrices de coordenadas fueron superpuestas y se realizó un ajuste Procrustes mediante traslación, rotación y reflexiones iterativas del lado izquierdo sobre el derecho, minimizando las desviaciones entre los LM’s correspondientes. Se obtuvo información de una configuración de referencia de la forma promedio entre ambos lados y los grupos evaluados, para ser utilizada en análisis posteriores (BENÍTEZ & PÜSCHE, 2014; ROHLF, 1998).
Diferenciación simétrica del aparato estridulatorio en ambas tegminas
Asimetría direccional (D.A.)
Las estimaciones asimétricas lineales y geométricas se realizaron a través de la diferencia entre dos medidas o formas geométricas especulares en dos estructuras separadas anatómicamente (Matching simmetry: MS) (KLINGENBERG, 2015). Para este estudio era de interés establecer un patrón de asimetrías direccionales (AD), por lo cual, los análisis se combinaron en las diferentes jerarquías taxonómicas abarcadas: para la jerarquía familia las diferencias entre subfamilias, y para subfamilia las diferencias entre tribus.
La estimación de la asimetría lineal se estimó a partir de pruebas de hipótesis para dos medias (U Mann whitney o T-student) entre las medidas de la tegmina izquierda y derecha; posteriormente con la diferencia resultante de la sustracción de las medidas de la tegmina izquierda menos la tegmina derecha se aplicaron pruebas de diseño de una vía no paramétrica (H- Krukall-Wallis) entre las subfamilias Phaneropterinae, Pseudophyllinae y Conocephalinae (Listroscelidinae, Meconematinae y Pterochrozinae fueron descartadas por no contar con un número de especies y géneros representativos de las tribus). Para todas las pruebas realizadas se asumió un valor de significancia α= 0,05, y se realizaron previa comprobación de los supuestos relativos a la normalidad (Shapiro-Wilk) y la homogeneidad de las varianzas (Prueba F o Levene) (ZAR, 2010). Este análisis fue acompañado del cálculo de la magnitud de la asimetría de cada medida, como el porcentaje de la diferencia que resulta de la razón entre la diferencia promedio de las medidas de la tegmina izquierda menos las medidas de la tegmina derecha sobre el valor promedio de la tegmina izquierda (Prom(izq-der)/(Prom(izq))*100. Esta es una medida independiente de la escala que permite comparaciones con otros estudios.
Para estimar la variación asimétrica de la forma se construyó una matriz con los LM’s de ambas regiones estridulatorias (derecha e izquierda) por ajuste Procrustes (Figura 1). Posteriormente se ejecutó un análisis ANOVA Procrustes adaptado para estudios de MS, asumiendo variación isotrópica entre los LM’s correspondientes en cada tegmina (KLINGENBERG et al., 1998; KLINGENBERG, 2015). De esta manera se estimó la significancia estadística de los efectos: por grupos taxonómicos, lado, grupos*lado y error. La prueba fue ejecutada basada en el estadístico F con (n - 1) x (2k - 4) para el efecto por grupos taxonómicos, 2k - 4 grados de libertad para el efecto lado; (n - 1) x (2k - 4) para el efecto de la interacción lado * grupo, y (r - 1) x n x 2 x (2k - 4) para el efecto del error, donde n = grupos en cada categoría taxonómica, r = réplicas por categoría taxonómica (individuos), y k = números pares de LM’s. No obstante, el supuesto de variación isotrópica es poco realista en la mayoría de datos biológicos, por lo cual el procedimiento se complementó con un análisis multivariado de la varianza (MANOVA), que permite evitar dicho supuesto (KLINGENBERG & MONTEIRO, 2005). Este último análisis se hizo siguiendo una distribución F y calculando el estadístico de trazo Pillai con su respectivo P-valor. Para visualizar los efectos en el análisis, patrones y variaciones de la forma se realizó un APC obtenido de las matrices de las covarianzas del efecto simétrico y asimétrico de la suma de cuadrados (KLINGENBERG et al., 1998; KLINGENBERG et al., 2002; KLINGENBERG, 2015).
RESULTADOS
Variación asimétrica de la forma
La superposición Procrustes de toda la configuración original y reflejada, produjo una configuración consenso simétrica (Figura 2). La descomposición de la forma alrededor de esta configuración consenso a partir de un análisis ANOVA Procrustes, indica diferencias de la asimetría entre subfamilias y tribus (Tabla 1). La variación entre lados por grupos solo fue significativa a nivel de familia; mientras que la asimetría encontrada entre lados fue altamente significativa en todas de subfamilias (P-valor <0,0001). Al nivel de Tettigoniidae, la significancia de la asimetría es sutil (P-valor= 0,0976), sin embargo, este valor puede ser asumido como una ligera diferenciación si se considera una significancia del 10% y no una convencional del 5% como se tomó para este estudio. Un valor más significativo de las diferencias se puede encontrar enmascarado por la alta variación que se presentó entre las especies que pertenecen a cada subfamilia.
Tabla 1 Resumen análisis ANOVA procrustes de los factores de la forma: Simetría coincidente: Modelo isotrópico, región estridulatoria de la tegmina derecha e izquierda (SS= suma de cuadrados, MS= Cuadrados medios, g.l= grados de libertad).

El supuesto de variación isotrópica de cada LM causa controversia, por lo tanto, la prueba MANOVA (Tabla 2) es más apropiada que el ANOVA Procrustes. Los métodos paramétricos estimados indican que la asimetría es altamente significativa tanto a nivel de la superfamilia como en las subfamilias. Sin embargo, la diferenciación de grupo por lado fue muy significativa para la familia y en las subfamilias con excepción de Pseudophyllinae.
Tabla 2 Análisis multivariado de la varianza MANOVA, Simetría coincidente: Modelo no isotrópico, área estridulatoria de la tegmina derecha e izquierda.

La Figura 2 representa los patrones de la asimetría promedio de la forma (como las diferencias entre los lados derecho menos izquierdo), ilustrando los resultados del análisis del MANOVA (Tabla 2). Estos resultados indican que a nivel de familia (Figura 2A) los puntos anatómicos de mayor asimetría son el 2 y el 3, ambos relacionados a la forma que puede presentar la vena CuPb; por consiguiente, en promedio no existe diferencia en el origen de esta vena, pero sí en la intersección de la vena C con la CuPb y en el sitio donde finaliza. En Conocephalinae, los principales desplazamientos asociados con la asimetría de la forma involucran principalmente los LM’s 2, 3 y 4. En Phaneropterinae se presentan disparidades asociadas a los puntos anatómico 3 y 4, que inducen que en promedio, el espejo tenga un alto grado de contracción hacia la zona anal y que el recorrido de la vena CuPaα2 cambie considerablemente entre los lados. Estas modificaciones permiten evidenciar que la asimetría está orientada a una fuerte reducción del espejo de la tegmina izquierda. En el caso de Pseudophyllinae, las asimetrías encontradas se deben a desplazamiento sutiles del punto tres (3) y cuatro (4) principalmente y el más significativo está relacionado con el punto anatómico uno (1), origen de la CuPb (Figura 2).
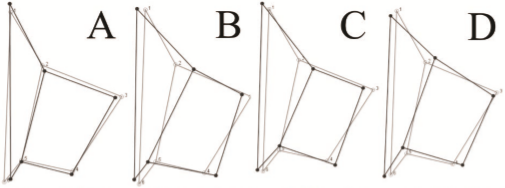
Figura 2 Variaciones parciales representadas en las cuatro primeras componentes, explicando el 86,34% de la varianza. Línea gris: descomposición consenso de la forma. Línea negra: disparidades de la forma representadas en cada componente.
Sobre la asimetría de la forma en Conocephalinae, existen diferencias entre las tribus, evidenciada en la disparidad de todos los puntos anatómicos del complejo estridulatorio. Cada tribu presenta un patrón asimétrico particular, en el caso de Agraeciini, el recorrido de la vena CuPaα2 es más extendido que en las otras tribus (Figura 3), contrario a lo que se observa entre los puntos 2 y tres 3 que hacen que la asimetría de la CuPb esté asociada a una fuerte reducción. Copiphorini presenta un patrón asimétrico semejante al de Agraeciini (Figura 3), con la diferencia que la intersección de la CuPaα2 y la vena transversal h solo presenta un desplazamiento sutil. Por último, Conocephalini se diferencia de las otras dos tribus porque la asimetría más significativa está asociada a la forma del recorrido de la CuPb (Figura 3), punto anatómico 2 en la intersección de la CuPb con la vena c, que se encuentra desplazada por encima del consenso simétrico.
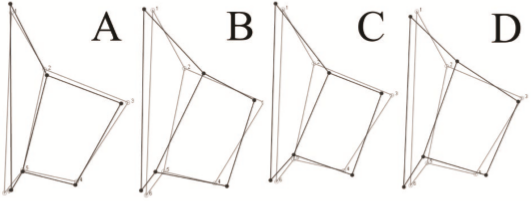
Figura 3 Patrones de la asimetría promedio de la forma (representada como la tegmina derecha menos izquierda) para las tribus de Conocephalinae, A) Conocephalinae; B) Agraeciini; C) Copiphorini; D) Conocephalini. Línea gris: consenso simétrico de la forma en Conocephalinae, línea negra: disparidad de la forma con respecto a la simetría promedio.
En Phaneropterinae hay un patrón constante entre los puntos anatómicos asociados al recorrido de la CuPaα2, con diferencias en las tribus Phaneropterini y Scudderini en donde se observaron asimetrías en el LM’s 4 y el ápice de la CuPaα2, sin que esto interfiera significativamente en la forma (Figura 4). En Steirodontini la disparidad de la forma del complejo estridulatorio está asociada al desplazamiento de la intersección de la vena CuPaα2 con la transversal h, que se presenta por debajo del promedio simétrico (Figura 4). Por otro lado, las principales asimetrías en las que difieren las tribus están asociadas al recorrido de la CuPb en el punto anatómico 3 y cuatro 4, que provocan cambios en la infl exión de la vena y en punto donde esta termina (Figura 4).
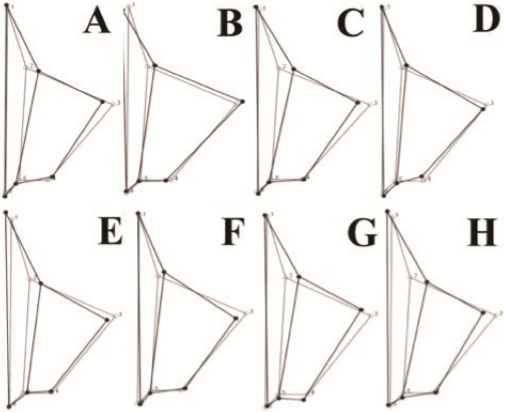
Figura 4 Patrones de la asimetría promedio de la forma (representada como la tegmina derecha menos izquierda) en las tribus de Phaneropterinae, A) Phaneropterinae; B) Dysoniini; C) Microcentrini; D) Phaneropterini; E) Phyllophorini, F) Pycnopalpini, G) Scudderini; H) Steirodontini. Línea gris: consenso simétrico de la forma en Phaneropterinae, línea negra: disparidad de la forma con respecto a la simetría promedio.
En Pseudophyllinae los LM’s asociados al recorrido de la CuPb presentan asimetrías en el punto de origen de la vena CuPb (LM 1) y al final (LM 3). El punto de la intersección CuPb con la transversal (2) se mantuvo simétrico y homogéneo entre las tribus, con excepción de Eucocconotini que presentó solo una sutil asimetría en este punto (Figura 5). La mayor disparidad de la simetría se presenta en los puntos que delimitan la forma del arpa, correspondientes al punto cinco (5), intersección de la CuPaα2 con la transversal h, el de mayor disparidad con respecto al consenso simétrico. Este desplazamiento produce una fuerte reducción de este componente estructural, particularmente, en el caso de Teleutiini (Figura 5G).

Figura 5 Patrones de la asimetría promedio de la forma (representada como la tegmina derecha menos izquierda) en las tribus de Pseudophyllinae, A) Pseudophyllinae; B) Cocconotiini; C) Eucocconotiini; D) Leptotettigini; E) Platyphyllini, F) Pleminiini, G) Teleutiini. Línea gris: consenso simétrico de la forma en Pseudophyllinae, Línea negra: disparidad de la forma con respecto a la simetría promedio.
DISCUSIÓN
El modelo no isotrópico de la MANOVA Procrustes para la forma permite explicar que el patrón asimétrico (diferencia de la forma entre tegminas derecha e izquierda) del complejo estridulatorio sucede a diferentes tasas de disparidad entre los puntos anatómicos entre subfamilias, por ejemplo el asociado a los LM’s ubicados sobre la vena CuPb y en algunos casos a la parte inferior de los espejos, lo que demuestra que la disparidad de la forma frecuentemente se presenta por las modificaciones de las venas que participan directamente en la estridulación (v.g. la vena CuPb que contiene la fila de dientes y de la que también se proyecta en el raspador). Por esa misma razón, el espejo derecho está mejor delimitado que el del lado izquierdo, debido a que en la tegmina derecha se encuentra la principal área de vibración de la producción de sonido (Montealegre-Z et al., 2009; Chivers et al., 2014; Sarria-S et al., 2014 y Sarria-S et al., 2016).
Los cambios de los puntos anatómicos son particulares en cada grupo taxonómico considerados en este trabajo. Cada subfamilia y la mayoría de las tribus estudiadas presentan cambios morfológicos específicos que podrían ser incluso utilizados como caracteres taxonómicos. Pseudophyllinae es el agrupamiento que presenta mayor simetría, ya que los desplazamientos de los puntos anatómicos con respecto al consenso simétrico son menores que en las otras subfamilias. Se concluye que las variaciones morfológicas en relación a la simetría no son aleatorias, sino que se relacionan con los Taxones estudiados, por lo cual, deben tener una relación específica a las características particulares de cada grupo.














