INTRODUCCIÓN
Mecistogaster ornata es una especie de zygóptero neotropical con abdomen largo perteneciente a la familia Pseudostigmatidae, los cuales habitan en bosques maduros desde México hasta Brasil y Argentina (CALVERT, 1908; FINCKE, 1984). Este grupo altamente especializado de odonatos deposita sus huevos exclusivamente en contenedores de agua de origen natural mejor conocidas como fitotelmas formadas en las hendiduras de los árboles por procesos de autopoda de algunas especies vegetales; así como en la cáscara de frutos y troncos de árboles caídos (CORBET, 1999; FINCKE, 2006). Con la acumulación de las precipitaciones, proporcionan un importante microhábitat acuático en los bosques tropicales para el establecimiento de sus larvas (LOUNIBOS, 1980; FRANK & LOUNIBOS, 1983; KITCHING, 2000; GREENEY, 2001), el cual ha sido documentado para casi todas las especies de pseudostigmatidos (FINCKE, 2006) y ampliamente estudiado para un pequeño número de especies como M. ornata (MACHADO & MARTÍNEZ, 1982; RAMÍREZ 1995; FINCKE, 2006). Sin embargo, la relación adulto-fitotelma en M. ornata no está del todo clara, sobre todo como la disponibilidad espacial de este hábitat podría estar influyendo en la abundancia poblacional de este pseudostigmatido.
En los fragmentos de bosque seco tropical (BST) del departamento del Atlántico, M. ornata es el único representante de la familia Pseudostigmatidae en este ecosistema y por lo tanto, su estrecho vínculo con la vegetación en cuanto a la utilización de microhábitats como las fitotelmas los hace vulnerables a la extracción selectiva de madera; debido a la reducción del área de los fragmentos y la alteración de su composición vegetal, así como la expansión progresiva de las fronteras agrícolas y ganaderas (MILES et al., 2006; PORTILLO-QUINTERO & SÁNCHEZ-AZOFEIFA, 2010). De esta manera, las actividades antrópicas estarían alterando la dinámica en las poblaciones de este zigóptero, así como la disposición y calidad de su microhábitat en el BST. Por otro lado, la estrecha relación entre este insecto y las especies vegetales en las que se da la formación de fitotelmas jugaría un papel como indicador del estado de conservación de los bosques o el cambio climático (FINCKE, 2006).
La mayoría de los esfuerzos científicos para el estudio de este grupo de odonatos se han centrado en los bosques húmedos tropicales de Centroamérica (FINCKE, 1984; 1992a; 1992b; 1992c, 1998, 1999, 2006; FINCKE et al., 1997; FINCKE & HEDSTRÖM, 2008); mientras que el BST ha recibido poca atención aún con su gran relevancia en cuanto a su riqueza y endemismo de especies y la problemática que presenta por su intensa transformación y destrucción por la fertilidad de sus suelos (JANZEN, 1988; CHÁVEZ & ARANGO, 1998; MILES et al., 2006). En Colombia aún existe un vacío en cuanto a los estudios de la dinámica de las poblaciones de odonatos en las distintas zonas biogeográficas (SÁNCHEZ & REALPE, 2010; ALTAMIRANDA & ORTEGA, 2012; PALACINO et al., 2012; ALTAMIRANDA et al., 2014), debido a que la mayoría de trabajos apuntan a guías y listados de la odonatofauna en nuestro país (URRUTIA, 2005; DE MARMELS, 2006; PÉREZ et al., 2011; PÉREZ & PALACINO, 2011). Sin embargo, es necesario establecer, fomentar y consolidar otras líneas de investigación como la ecología de poblaciones, considerando así lo necesario e imprescindible que es para la conservación este grupo de insectos y su hábitat. Teniendo en cuenta lo anterior, en el presente estudio se evaluó la estructura poblacional de M. ornata, la disposición espacial y algunas características de su microhábitat y parámetros ambientales en dos fragmentos de BST en el departamento de Atlántico, Colombia.
MATERIALES Y MÉTODOS
Área de estudio: Se seleccionaron dos fragmentos de BST (La Montaña= F1 y Sarmiento= F2) en la Reserva Campesina La Montaña (RCM), ubicada en el municipio de Juan de Acosta, departamento del Atlántico, Colombia; a una altitud de aproximadamente 177 a 250 m (fig. 1). Puesto que los nombres de los dos lugares aparecen reiteradamente en el texto, a partir de acá se propone la distinción entre ambos fragmentos (F1 y F2) para identificarlos y propiciar una lectura más ágil. La localización geográfica del F1 es 10°46’48.3’’ N y 75°02’51.2’’ O y tiene una extensión de 47 ha aproximadamente; mientras que F2 está localizado a 10°46’ 25.5’’ N y 75°02’57,8’’ O, con aproximadamente 19 ha de extensión. En este último fragmento, se observó el pastoreo de ganado vacuno en el interior del bosque, tala de árboles e intensas quemas en sus alrededores. La distancia mínima entre los bordes de los dos fragmentos es de 400 m aproximadamente. La ganadería y agricultura en las zonas aledañas de la RCM se caracterizan por ser de tipo extensiva, con cultivos permanentes de yuca (Manihot esculenta Crantz), millo (Sorghum bicolor (L.) Moench) y maíz (Zea mays L.). Los meses de mayor precipitación histórica corresponden a agosto y septiembre, con promedios que van desde 100 mm/mes hasta 580 mm/mes, mientras que enero, febrero y marzo corresponden a los meses con menores precipitaciones; que van desde 0 hasta 30 mm/mes. La temperatura alcanza valores mínimos de 25°C y máximos de 33°C durante todo el año (MARTÍNEZ et al., 2012; GARCÍA-ATENCIA et al., 2015). El tipo de suelo es arcilloso-arenoso, con un relieve ondulado y hace parte de los ecosistemas de serranías, con pendientes entre 12 y 25%, con un grado de erosión moderado (PANZA et al., 2001).
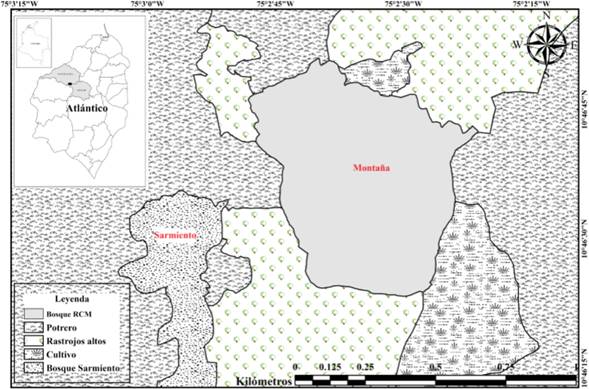
Figura 1 Localización de los fragmentos de BST de la Montaña (F1) y Sarmiento (F2), Atlántico, Colombia.
Entre las especies vegetales más representativas en el fragmento de BST F1 se encontraron a Hura crepitans L. (Ceiba), Calycophyllum candidissimum (Vahl) DC. (Guayabo), Spondias mombin L. (Jobo), Cavanillesia platanifolia (Humb. y Bonpl.) Kunth (Macondo), Bursera simaruba (L.) Sarg. (Indio encuero), Lecythis minor Jacq. (Olla de mono), Astronium graveolens Jacq. (Quebracho), Enterolobium cyclocarpum (Jacq.) Griseb. (Carito) y Aspidosperma polyneuron Müll. Arg. (Carreto). En F2 predominaron H. crepitans L. (Ceiba), L. minor Jacq. (Olla de mono), C. candidissimum (Vahl) DC. (Guayabo), A. graveolens (Quebracho), S. mombim L. (Jobo), G. ulmifolia Lam. (Guasimo), Pterocarpus acapulcensis Rose (Sangregado) y Albizia niopoides (Benth.) Burkart (Guacamayo). Cada fragmento es atravesado por un arroyo temporal y en su borde se presentan unos pocos musgos y helechos, así como aráceas de los géneros Anthurium (Schott) y Philodendron (Schott), característico de los arroyos en bosques secos.
Abundancia poblacional y porcentaje de recapturas: Para la estimación de la abundancia, en cada fragmento de bosque se estableció un área de 600 m de largo por 30 m de ancho, donde se marcaron 10 puntos distanciados 50 m uno del otro, para un total de 10 tramos con igual longitud. Las capturas y recapturas de M. ornata se llevaron a cabo con la ayuda de redes entomológicas, durante un periodo continuo entre las 8:00 hasta las 17:00 horas (9 horas/hombre/día/fragmento); con el fin de abarcar las horas de actividad de los pseudostigmatidos adultos (FINCKE, 1992a). La técnica utilizada fue búsqueda activa por captura-marca y recaptura, la cual ha sido considerada importante para los aportes al conocimiento de la autoecología y comportamiento de los odonatos (CORDERO & STOKS, 2008). Se realizaron 26 muestreos (13 por fragmento) cada 8 días entre finales de marzo y principio de junio de 2013. Con los datos de captura-recaptura, se estimó la abundancia total por punto, muestreo y fragmento y posteriormente se determinaron las diferencias estadísticas con una prueba no paramétrica (Kruskal-Wallis), con una a posteriori de Mann-Whitney para determinar diferencias. Estos análisis se realizaron con el programa PAST ver 3.0 (HAMMER et al., 2001).
Proporción sexual, estructura de edades y desplazamiento: Los imagos de M. ornata capturados se marcaron con un Sharpie® de tinta indeleble en la parte distal de las alas, con dos colores distintos: negro para F1 y azul para F2; con una letra y un número de acuerdo al muestreo y el número de captura (Fig. 2A, B). Una vez capturado, se georreferenció su posición utilizando un GPS (Etrex 30x Garmin® ±3m) para posteriormente determinar su desplazamiento estableciéndose un máximo, un mínimo y un promedio para las distancias recorridas por esta especie, cada vez que fuese recapturado. Adicionalmente para cada evento de captura, se tuvo en cuenta el sexo del individuo, debido a que estos presentan dimorfismo sexual. Al mismo tiempo, se tomaron apuntes de la hora de captura, actividad comportamental (Fig. 2C, D) y el punto en el que se encontraba. Con el fin de observar diferencias en la proporción de sexo observada y esperada se utilizó la prueba de contingencia Chi-Cuadrado con la ayuda del programa PAST ver 3.0 (HAMMER et al., 2001). Por otro lado, en los individuos capturados se consideraron tres edades: tenerales (individuos recién emergidos), jóvenes y adultos maduros, donde la coloración del pseudostigma y el estado del ala se usaron como criterio de separación, para posteriormente estimar la estructura de edades a partir de estas dos variables.
Disponibilidad de hábitat y variables ambientales: Con el fin de medir la disponibilidad de hábitat, en cada tramo se marcaron las fitotelmas encontradas con una placa de acrílico cada una con un número asignado. Para estimar los volúmenes de las fitotelmas asumimos su forma cilíndrica para utilizar la fórmula del volumen de cilindro: V = π R2 h. A cada fitotelma se le tomaron medidas de diámetro a la circunferencia de apertura, altura desde el suelo (m) y profundidad de la fitotelma (m), así como la especie vegetal en la que se encontró este microhábitat (Fig. 2E). En este caso solo se tuvieron en cuenta fitotelmas con altura menor o igual a 2 m, debido a que en el bosque seco este tipo de microhábitat se calientan y secan más rápidamente a una mayor altura (FINCKE, 1992b).

Figura 2 Adultos de M. ornata capturados y recapturados en los fragmentos de BST: A) Hembra madura; B) macho maduro; C) copula, D) ovipositando y E) fitotelma en C. candidissimum.
Por otro lado, en cada punto y hora se midió la temperatura ambiente y humedad relativa con un termohigrómetro (Data Logger Extech®) y la intensidad lumínica con un luxómetro (EasyView Light Meter Extech®). Esta última variable también fue medida cada vez que se capturó o recapturó un espécimen, así como cualquier patrón de comportamiento que se pudo observar. También se tuvieron en cuenta los datos de precipitación diarios en el área de estudio con la ayuda de un pluviómetro (Marca Hellman®). Para determinar qué tanto influyen estas variables ambientales en la variación del número de individuos capturados y recapturados de M. ornata por muestreo en cada fragmento, se realizó el índice de correlación de Spearman, utilizando el programa PAST ver 3.0 (HAMMER et al., 2001).
Densidad, cobertura, área basal y altura promedio de árboles: Por cada tramo donde se capturaron las libélulas, se llevó a cabo el levantamiento de un transecto lineal de 2 x 50 m, para un total de 10 en cada fragmento de bosque; obteniéndose un área total de 1000 m2 para cada uno. Se censaron todas aquellas plantas con diámetro altura pecho (DAP) superior a 10 cm, tomándose medidas de altura total, radios de la copa y DAP a 1,3 m (GENTRY, 1982). De esta manera, se determinó la riqueza de plantas (S) por tramo y fragmento y la densidad se calculó siguiendo lo propuesto por MOSTACEDO & FREDERICKSEN (2000), donde densidad (D = N/A) es un parámetro que permite conocer la abundancia de una especie o una clase de plantas, donde N es el número de individuos en un área (A) determinada. El área basal (AB) en m2 se calculó utilizando la fórmula propuesta por NEWTON (2007) (AB=0,00008754(DAP)2). El AB de todos los individuos que cumplieron con las condiciones de censo fueron sumados para obtener el AB total. La cobertura (Cob) de cada individuo se calculó a partir de los radios de la copa del dosel con la ecuación expuesta por LEMA (1995) (Cob=π (radio mayor2 + radio menor2)/2). Todos los cálculos se llevaron a cabo tanto para cada parcela levantada, como para los 1000 m2 como unidad muestral. La altura de los individuos censados fue calculada haciendo uso de un hipsómetro de Merrit (LEMA, 1995).
Con el fin de determinar si las variables de la vegetación (densidad, cobertura vegetal, área basal, riqueza de plantas y altura de la vegetación) y fitotelmas (número, altura y profundidad) explican la variación del número de individuos capturados-recapturados (Cap+Rec) por tramo y fragmento, se realizó un ACP (Programa PAST 3.0; HAMMER et al., 2001).
RESULTADOS
Abundancia y porcentaje de recapturas: En F1 (La Montaña) fueron capturados y liberados 90 individuos (35 ♂; 55 ♀), de los cuales 40 fueron recapturados (15 ♂; 25 ♀) una o más veces. El mayor número de capturas (19) se presentó en el muestreo 2 realizado en marzo (7 ♂; 12 ♀), cuando los valores de intensidad lumínica fueron de 314,216 Lumen (valor más alto de luz entre todos los muestreos), temperatura de 34,15°C, humedad relativa de 50,27% y una precipitación de 0,0 mm (Tabla 1). En cambio, los valores menores se presentaron durante los muestreos 11, 12 y 13 (mayo-junio) cuando las variables ambientales fueron 28,72 Lumen para la intensidad lumínica, 30,74°C y 72,26% la temperatura y humedad relativa respectivamente y una precipitación de 22 mm (Tabla 1). A partir de los datos anteriores, con el test de Kruskal-Wallis se demostró que el número de individuos capturados y recapturados (Cap+Rec) entre los muestreos en F1 presentaron diferencias significativas (N=13; H=34,67; Hc= 40,76; p= 0,00005379) (Tabla 1).
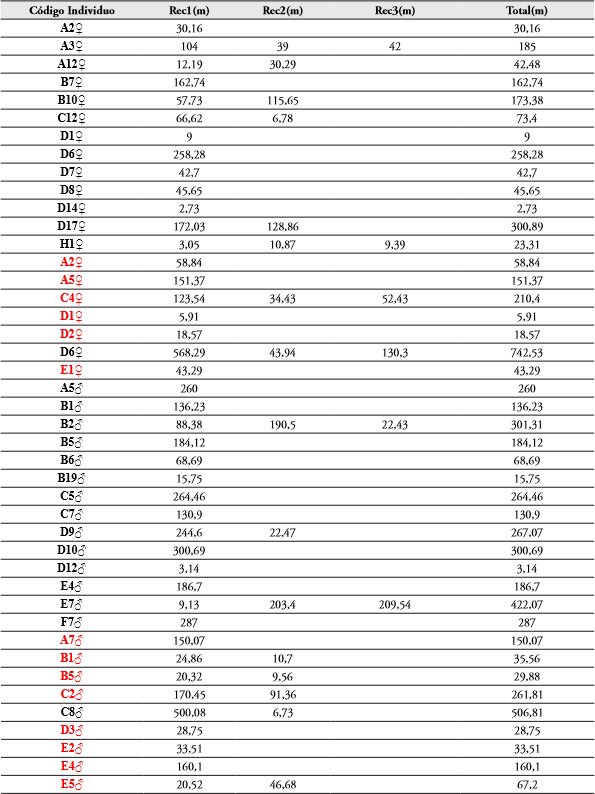
Tabla 1 Variación de individuos capturados más recapturados de M. ornata por muestreos y sexo en los fragmentos (Frag) de Bosque La Montaña (F1) y Sarmiento (F2); Atlántico, Colombia. Se incluyen los datos de precipitación (Prec), temperatura (T), humedad relativa (H.R) e intensidad lumínica (I.L.). Abreviaturas: capturados (Cap), recapturados (Rec), hembra (He), macho (Ma), lumen (lm). Letras diferentes en la segunda columna indican diferencias significativas (p<0,05) en el número de individuos entre muestreos por fragmentos. Asterisco se usa para diferenciar letras.
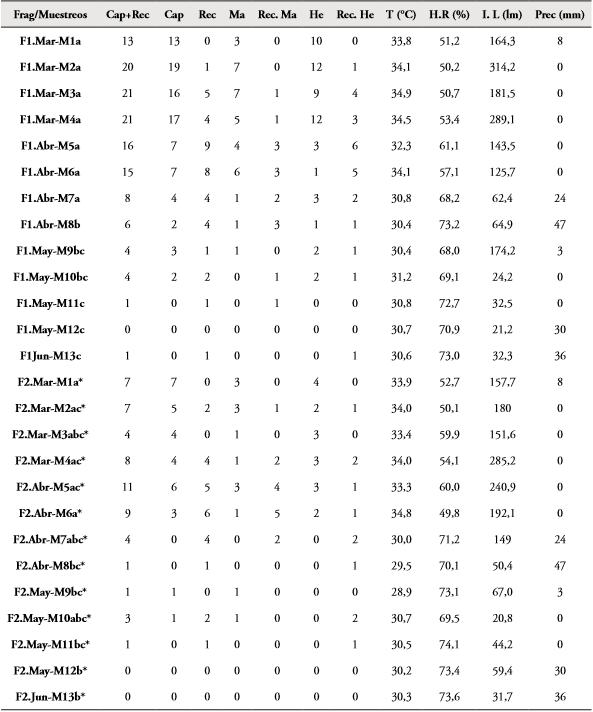
En F2 (Sarmiento), fueron capturados y liberados 31 individuos (14 ♂; 17 ♀), de los cuales 25 (14 ♂; 11 ♀) fueron recapturados una o más veces durante todos los eventos de muestreo. Se presentó el mayor número de capturas en el evento 1 realizado en marzo (3 ♂; 4 ♀) en donde los valores de intensidad lumínica fueron de 157,70 Lumen, temperatura de 33,92°C, humedad relativa 52,74% y una precipitación de 0,0mm (Tabla 1). El menor número de capturas en los eventos 7 y 8 en abril, 11, 12 y 13 entre mayo y junio, con cero individuos capturados para cada uno (Tabla 1). Teniendo en cuenta el análisis del test de Kruskal-Wallis, se demostró que existen diferencias significativas (N=13; H=16,77; Hc=25,43; p=0,01293) entre el número de individuos de M. ornata capturados y recapturados entre los muestreos. Al tener en cuenta la prueba de comparaciones múltiples de Mann Whitney, los muestreos que presentaron diferencias (p<0,05) se detallan en la Tabla 1. Al comparar la abundancia de M. ornata entre los fragmentos F1 y F2, también se presentaron diferencias significativas (N=13; t=2,3279; p=0,028672).
En F2 se presentó la mayor tasa de recapturas (80,64%), ya que de los 45 individuos capturados (14 ♂, 31 ♀), 39 fueron recapturados (14 ♂, 25 ♀) con una mayor tasa de recaptura de machos (100%) y hembras (64,7%). Sin embargo, en este mismo fragmento se presentó el menor número de individuos capturados. En F1, de los 90 individuos capturados (35 ♂, 55 ♀), solo 15 machos (42,85%) y 40 hembras (44,44%) fueron recapturadas.
Proporción sexual, estructura de edades y desplazamiento: En F1 el número de hembras siempre fue mayor (80) que el número de machos (50), presentándose una proporción sexual constante (1:2) y con diferencias significativas (X2=23,403, p=0,02449). En F2, el número de hembras (27) fue muy cercano a los machos (29), presentándose una proporción de 1:1 y sin diferencias significativas (X2= 9,1333, p=0,6915).
Aunque se tuvieron en cuenta tres edades: tenerales, jóvenes y adultos maduros, solo fueron registradas estas dos últimas. Al comparar el número de individuos observados y esperado registrados en cada categoría de edad en F1 (Jóvenes 31; adultos maduros 99) y F2 (jóvenes 16; adultos maduros 41), se observaron diferencias estadísticamente significativas (X2=109,15, p= 8,80E-18). La estructura de edad durante los eventos de captura no fue constante hasta el cuarto evento, ya que a partir del quinto evento desaparecieron los jóvenes (35 ♂; 12 ♀). A partir de este evento, se incrementó el número de individuos adultos maduros (57 ♂; 82 ♀) en los dos fragmentos.
Teniendo en cuenta el desplazamiento, la menor distancia recorrida por los individuos recapturados fue de 2,73 m y la mayor de 742,53 m en las dos áreas de estudio. Se registró un mayor promedio de distancia recorrida en los machos (416,8 m) y las hembras (149,4 m) en F1, mientras que en F2 las distancias fueron más cortas (95,8 m y 81,3 m respectivamente). Los individuos que más se desplazaron fue una hembra con una distancia de 742,3 m y un macho con 506,8 m; los cuales se desplazaron desde F1 hasta F2.
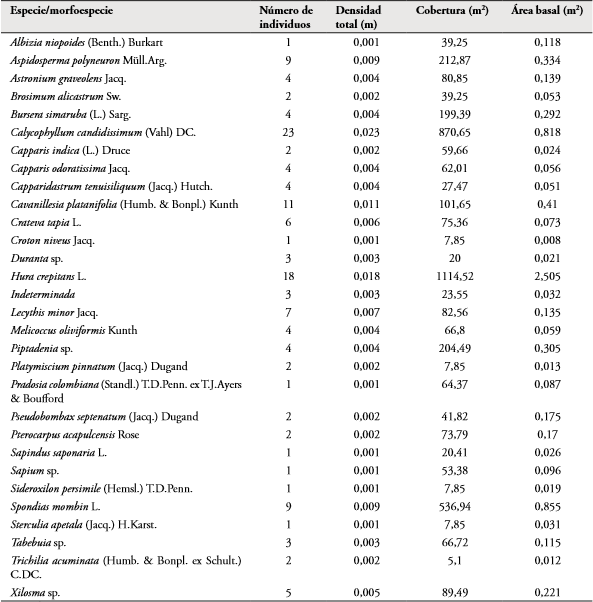
Relación de variables vegetales, ambientales y disponibilidad de hábitat con la abundancia poblacional: En F1, se registraron 16 familias, 30 morfoespecies de plantas vasculares repartidas entre los 140 individuos. Las especies más abundantes fueron Calycophyllum candidissimum (23 individuos) con una densidad total de 0,023, cobertura de 870,75 m2, área basal de 0,818 m2 y Hura crepitans (18 individuos) con densidad total de 0,018, cobertura de 1114,52 m2 y 2,505 m2 de área basal. Las familias con mayor riqueza fueron Fabaceae y Capparidaceae (4 especies cada una). Para este fragmento el mayor número de microhábitats (11 fitotelmas) fue marcado en el punto 2, en el cual 8 de los 12 individuos censados fueron de C. candidissimum.
En F2 se registraron 17 familias y 33 morfoespecies. Dentro de los 123 individuos registrados, H. crepitans presentó una densidad total de 0,23, cobertura de 511,03 m2 y 1,7 m2 de área basal; Lecythis minor con densidad de 0,017, cobertura de 164,85 m2 y área basal de 0,23. C. candidissimum presentó una densidad de 0,017, cobertura de 347,11 m2 y un área basal de 0,6 m2. Estas tres especies fueron las más abundantes (23, 17 y 17 individuos respectivamente) en este fragmento. Las familias con mayor riqueza fueron Fabaceae (5 especies) y Capparidaceae (4 especies).
Con respecto a las fitotelmas, se marcaron 89 fitotelmas repartidas entre los 10 puntos censados en cada una de las dos áreas de estudio (F1= 37, F2= 52). Para F1, el mayor número de microhábitats (11 fitotelmas) fue registrado en el punto 2, en el cual las fitotelmas presentaron una altura de 0,98 m (±0,16) y profundidad promedio de 0,16 m (±0,013). Además, se encontró que 8 de los 12 individuos censados en ese punto eran C. candidissimum; con una altura promedio superior a los 12 m, coincidiendo también como el punto de mayor cobertura vegetal (717,80 m2). Sin embargo, el mayor número de individuos Cap+Rec (7 ♂; 17 ♀) se registró en el punto 6 del transecto de F1, donde se observó una cobertura vegetal de 374,84 m2 y se marcaron 5 microhábitats con una altura promedio de 0,84 m y 0,12 m de profundidad (Tabla 2). En este fragmento, se presentaron diferencias significativas (p<0,05) entre el número de individuos Cap+Rec entre los puntos de muestreo (Tabla 2).
Para F2 se encontró que los cuatro primeros puntos albergan el 80,8% (42 fitotelmas) del total de microhábitats registrados en este transecto con un promedio de altura de 1,02m (±0,05) y una profundidad promedio de 0,22 m (±0,03) (Tabla 2). Las especies más abundantes fueron H. crepitans y C. candidissimum con un total de 23 y 17 individuos respectivamente. En los puntos 1 (510,64 m2) y 2 (442,57 m2) se presentaron los mayores valores de cobertura vegetal. Adicionalmente, en este fragmento el número total de individuos Cap+Rec de M. ornata se presentó entre los primeros 5 puntos del transecto, presentándose diferencias con los últimos cinco puntos con respecto a la abundancia de esta libélula (Tabla 2).
Tabla 2 Variación del número de individuos capturados y recapturados (C+R) totales y por sexos (C+R.Ma; C+R. He) de M. ornata en los 10 puntos (P) en cada fragmento (F) y las variables de la vegetación: Número de individuos (N.Ind) y riqueza de especies vegetales (S), cobertura vegetal (Cob), área basal (A.B), densidad (Den), altura promedio de la vegetación (h.Pro); número de fitotelmas (N.F), altura promedio desde el suelo (h.F) y profundidad promedio de las fitotelmas (Prof.F). Letras diferentes en la primera columna indican diferencias significativas (p< 0,05) en el número de individuos entre puntos. Asterisco se usa para diferenciar letras de F1 y F2.
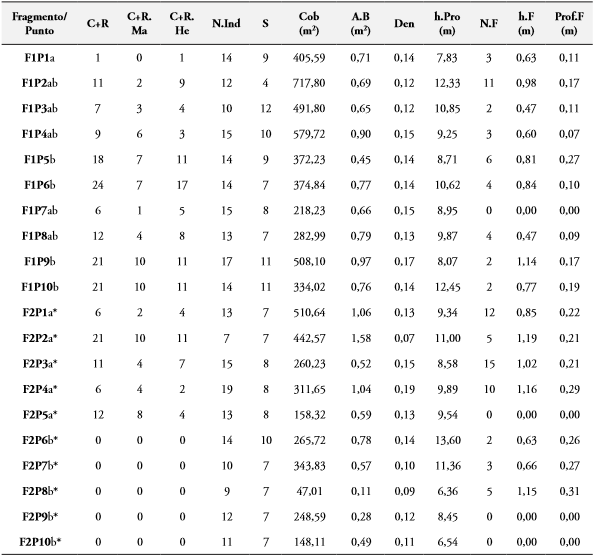
En el punto 3 de F2 fue registrada la mayor densidad de microhábitats, cuya altura y profundidad promedio fue de 1,02 m (±0,05) y 0,20 m (±0,03) respectivamente, con una cobertura de 260 m2. Aunque el mayor número de libélulas (10 ♂; 11 ♀) fueron Cap+Rec en el punto 2; el cual presentó una cobertura de 442,5 m2, mientras que en el 8 donde se presentó la menor cobertura vegetal (47 m2) no se registraron individuos Cap+Rec (Tabla 2). Entre los fragmentos no se presentaron diferencias estadísticamente significativas (p>0,05) entre la cobertura vegetal estimada, el área basal, la densidad y las especies vegetales.
Tanto en F2 como en F1, la mayoría de las fitotelmas (78.37% y 68,42%, respectivamente) tuvieron un volumen ≤ 1 L (pequeñas). Con respecto a las medianas (≤ 4 L), 9 fueron registradas en F2 y 7 en F1, mientras que las fitotelmas con mayor capacidad de volumen (>4 L) se registraron en F2 (4); donde los promedios de cobertura vegetal fueron menores (Tabla 2). En F1, de los 37 microhábitats, se encontraron 3 casos (fitotelmas: 29, 31, 33) donde hubo 2 microhábitats en un solo árbol. En F2 hubo dos casos donde se encontraron 4 microhábitats (fitotelmas: 14 y 17) en un solo árbol, mientras que en otros casos hubieron 3 (fitotelmas: 19 y 35) y 2 (fitotelmas: 23, 29, 31 y 37).
Teniendo en cuenta el análisis de componentes principales (ACP), las variables de la vegetación medidas en el área de estudio (S, número de individuos, Cob, A.B, Den, h.Pro, N.F, h.F) están explicando el 90,81% de la variación de los datos en los primeros cinco componentes (Tabla 3, Fig. 3). La variación más alta se presentó en los tres primeros componentes (73,517%), sin embargo, solo la variación observada en los dos primeros (59,12%) fue significativa (p<0,05). En el componente 1, las variables que más aportan de manera directa sobre el comportamiento de los datos fueron C+R, C+R. Ma, C+R.He, Cob, A.B, N.F y h.F; mientras que en el componente 2 fueron la riqueza de plantas (S) y la abundancia (N.Ind) y densidad (Den) (Tabla 3). Es importante resaltar que tanto C+R, C+R.Ma, C+R.He, presentaron correlaciones positivas con las variables de la vegetación que más aportan en los dos primeros componentes. Por otro lado, se determinó que los primeros cinco puntos del F2 se traslapan con el polígono formado por los puntos del F1; teniendo en cuenta tanto las variables de vegetación medidos en el estudio, así como la abundancia de M. ornata (Fig. 3).
Tabla 3 Porcentaje de la variabilidad explicada por cada uno componentes principales en los puntos de F1 y F2. Abreviaturas se describen en la tabla 4.
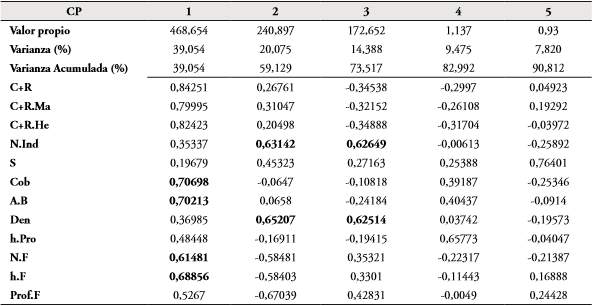
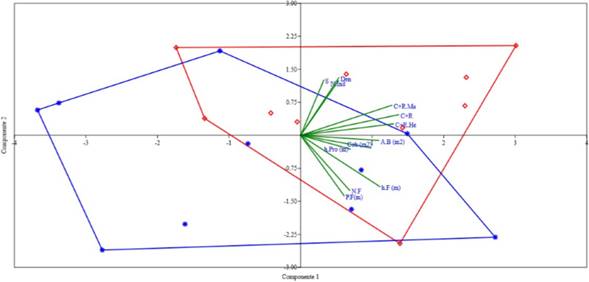
Figura 3 ACP del número de individuos capturados y recapturados (C+R) total y por sexos (C+R.Ma; C+R.He) y las variables vegetales y de las fitotelmas en los fragmentos de bosque F1 (rojo) y F2 (azul). Abreviaturas se describen en la tabla 2.
El número total de libélulas Cap+Rec (r=0,84; p=0,0006), así como los machos (r=0,71; p=0,0086) y las hembras (r=0,84; p=0,0005) presentaron una correlación directamente proporcional y significativa con respecto a la temperatura y la intensidad lumínica registradas en los fragmentos en estudio. Por otro lado, la cantidad de individuos Cap+Rec en los dos fragmentos tienen un comportamiento inversamente proporcional con respecto a la humedad relativa, el cual también se presentó para machos y hembras (Tabla 4). Los individuos Cap+Rec (r=-0,60; p=0,0290) de M. ornata en F2 presentaron una correlación inversamente proporcional con respecto a las precipitaciones al igual que las hembras en este fragmento (r=-0,56; p=0,0432) (Tabla 4). En el caso de F1, la abundancia poblacional de M. ornata presentó una correlación directamente proporcional y significativa con la temperatura (r=0,79; p=0,0037) y la intensidad lumínica (r=0,77; p=0,005), mientras que la humedad relativa (r=-0,88; p=0,0003) presentó un comportamiento inversamente proporcional. Estos mismos comportamientos se presentaron en F2, pero solo con la intensidad lumínica (r=0,81; p=0,002) y humedad relativa (r=-0,68; p=0,02) (Tabla 4).
Tabla 4 Correlación entre los individuos capturados y recapturados con respecto a las variables ambientales medidas en los fragmentos de bosque La Montaña (F1) y Sarmiento (F2) durante los eventos de muestreo. Abreviaturas: precipitación (Prec), temperatura (T), humedad relativa (H.R), intensidad lumínica (I.L.), capturados (Cap), recapturados (Rec), hembra (He), macho (Ma).

DISCUSIÓN
Factores de carácter biológico como la dispersión, comportamiento y relaciones intraespecíficas e interespecíficas pueden determinar la abundancia o distribución de las poblaciones de animales (RABINOVICH, 1982); razón por la cual el uso de una técnica como la de marcaje y recaptura puede servir para explicar algunos de estos factores en M. ornata. Además, nos permite considerar una perspectiva más realista de la abundancia poblacional de esta especie en los fragmentos de BST y comparar situaciones biológicas más realistas con respecto a los cambios constantes que sufren las poblaciones y su hábitat. En la población de M. ornata se estarían presentando movimientos migratorios temporales, los que podrían ser realizados por esta libélula en búsqueda de condiciones óptimas para su colonización, establecimiento y la posibilidad de garantizar la conservación de su progenie. Lo anterior estaría influenciado por el estado crítico de fragmentación y el deterioro a los que están sometidos los fragmentos de BST en el Atlántico, sobre todo por los cambios en los patrones de uso de la tierra (pastoreo de ganado, quemas para cultivos) y la tala intensiva en F2; las cuales están alterando directamente la continuidad de la cobertura vegetal, la riqueza de especies vegetales, la permanencia de microhábitat y consecuentemente los tamaños poblacionales de M. ornata. Las poblaciones de esta libélula están disminuyendo en la zona (FAJARDO, 2012), aunque tenga una flexibilidad fisiológica para adaptarse a condiciones más secas a diferencia de otros pseudostigmatidos (FINCKE, 2006).
La variación temporal entre los eventos de captura y recaptura, posiblemente estén relacionados con los siguientes aspectos 1) M. ornata consigue llegar al punto máximo de su longevidad a finales de marzo y la culminación del ciclo de vida de los individuos adultos, con un tiempo de oscilación estimado entre 75 y 84 días (FINCKE, 1984; FAJARDO, 2012). De esta manera, se puede tener en cuenta que tanto hembras como machos permanecen en diapausa reproductiva hasta 30 días antes de las primeras precipitaciones cuando sincronizadamente maduran, copulan y por ultimo las hembras ovipositan en las fitotelmas una gran cantidad de huevos abriéndole paso a la etapa larvaria (FINCKE, 1992a). 2) La estacionalidad marcada de las precipitaciones en los fragmentos de BST en la zona, ya que cuando ocurren las caídas de las primeras lluvias, estas alteran y limitan comportamientos de sus actividades diarias de alimentación, reproducción y su vuelo, obligando a los individuos a refugiarse en pos de su supervivencia. 3) En el caso de la época seca, los imagos de M. ornata aprovechan los doseles abiertos y las condiciones moderadas de nubosidad para llevar a cabo dichas actividades diarias de alimentación, reproducción y protección contra depredadores.
Las diferencias en la abundancia de M. ornata entre los fragmentos las podríamos atribuir a los distintos tamaños y formas de cada uno. La menor área en F2 puede estar influyendo en la cantidad de recursos requeridos para su alimentación y reproducción, vitales a la hora de considerar las condiciones necesarias para su colonización y establecimiento. Adicionalmente, el mayor efecto borde (forma alargada) en F2, donde la mayor parte de la vegetación se encuentra restringida cerca a la quebrada; puede incidir en estas diferencias, debido a cambios más bruscos de temperatura, humedad e intensidad de luz; así como mayor presencia de parásitos. En este caso, es posible que el mayor efecto borde sea comparativamente más importante que en un fragmento más grande (MURCIA, 1995), lo cual involucra cambios en la abundancia y disposición de los individuos de esta especie. Los pocos individuos de M. ornata que se registraron en este fragmento pueden estar indicando que sirva como sitio de alimentación de esta especie, mas no como lugar de reproducción; razón por la cual se hace necesario realizar un seguimiento más detallado sobre el comportamiento de esta especie en este fragmento. Por ejemplo, la escogencia de fitotelmas con un menor tiempo de secado puede proporcionar permanencia del microhábitat y aumentar la supervivencia de sus larvas en el BST. Es posible que lo anterior esté relacionado con cambios en los patrones de uso de la tierra (pastoreo de ganado, quemas para cultivos) y el resultado de las operaciones de tala intensiva en F2; las cuales están alterando directamente la cobertura vegetal del fragmento y consecuentemente la abundancia de M. ornata, que depende de hábitats estrictos no perturbados para su supervivencia y desarrollo (URRUTIA, 2005).
Adicionalmente, la existencia de dormideros de M. ornata en F1 en los puntos nueve y diez, también podría estar influyendo en las diferencias significativas presentadas entre los dos fragmentos con respecto a su abundancia. En este caso, se lograron registrar de cinco a seis individuos en un arbusto y dos a tres en una misma rama (una vez se capturaron tres individuos en un solo intento con la red) a una altura de 2,2 m entre las 16:00 y 17:00 horas. Por lo anterior, asumimos que las libélulas de este género aprovechan estas horas para regresar a los dormideros para posarse y mimetizarse, descansar y evitar ser depredado. FINCKE (1992a) nunca logró encontrar este tipo de agregaciones naturales de M. ornata en Isla Barro Colorado en Panamá; sin embargo, en México se registró en un insectario dormideros de cinco a diez individuos de M. ornata en un arbusto y regularmente dos a tres por rama entre los 1,5 y 2 m por encima del suelo (BEATTY & BEATTY, 1963).
En los odonatos en general, los porcentajes de recaptura de los machos son mayores que en las hembras (ANHOLT, 1997; ANDRÉS & CORDERO-RIVERA 2001; ANHOLT et al., 2001), lo cual coincide con lo calculado en este estudio para M. ornata en F2. Sin embargo, este fragmento de bosque también presento el menor número de individuos capturados, lo que podría estar influyendo en los valores elevados de las tasas de recaptura con respecto a los porcentajes de recaptura en F1. En este último fragmento, el porcentaje de hembras recapturadas superó al de los machos, lo cual se puede atribuir a algunos aspectos del comportamiento como la fidelidad al sitio de las hembras; ya que estas mantuvieron la tendencia de sobrevolar en cercanías de las fitotelmas durante las horas de mayor intensidad lumínica como estrategia para permanecer más cerca de los posibles microhábitats que posteriormente utilizarían para llevar a cabo la oviposición durante la llegada de las lluvias. Adicionalmente, la mayor proporción de hembras puede estar relacionada con la coloración del pseudostigma; lo cual le confiere un vuelo más vistoso y fácil de distinguir al posarse, aumentando sus probabilidades de ser capturadas y recapturadas. En el caso de los machos, la captura y recaptura fue menos frecuente, aunque son igual de visibles a la hora del vuelo que las hembras, pero no al posarse por la desaparición de la coloración amarilla del pseudostigma en la parte ventral del ala al llegar a su madurez sexual (FINCKE, 1992a). Nuestros resultados en cuanto a las proporciones sexuales son invertidos de acuerdo con los registrados por GARRISON & HAFERNIK (1981) y por HAMILTON & MONTGOMERIE (1989) para otras especies de odonatos. Estos autores han explicado que los machos pueden ser capturados más fácilmente en el campo; debido a que las hembras poseen un comportamiento más críptico. Adicionalmente, la emergencia tanto de hembras como machos no está sincronizada y la mortalidad en las hembras es mayor en el período pre-reproductivo (GARRISON & HAFERNIK, 1981). De esta manera, la menor probabilidad de supervivencia de las hembras, se puede atribuir a algunos aspectos comportamentales como el esfuerzo de forrajeo adicional, donde comprometen a los huevos provisionales (ANHOLT, 1992). Otra explicación es la exposición de las hembras a un mayor riesgo de depredación al momento de la oviposición, lo cual parece ser un factor determinante entre los eventos de captura; debido a que los patrones de comportamiento están influenciados por su estado de madurez que varían temporalmente con respecto a los machos. Además, las hembras están presentes en un sitio solo para el apareamiento y la oviposición, mientras que la alimentación la realizan en un sitio diferente debido a la necesidad de mayores requerimientos energéticos y tiempo para la gametogénesis que los machos (ANHOLT, 1992; BANKS & THOMPSON, 1985). Adicionalmente, en los machos los costos asociados con el sostenimiento de los territorios y la atracción de las hembras no logran influir en su supervivencia; debido a que M. ornata es una especie no territorial y que solo se aparea de manera oportunista con o sin presencia de fitotelmas en los claros del bosque, donde se alimentan y hay penetración de la luz hasta la parte baja (FINCKE, 1992a, 1992b; FINCKE & HEDSTRÖM, 2008). Las proporciones sexuales equilibradas en F1 (Sarmiento) se pueden atribuir al menor tamaño del fragmento y los impactos antrópicos (reducción de área, presencia de ganado vacuno y tala) observados en este lugar; lo cual influye en el desplazamiento y el bajo número de individuos capturados y recapturados y probablemente tanto machos como hembras lo usan solo para la búsqueda de alimento que garantice su crecimiento y maduración.
En M. ornata el número de hembras en la categoría de adulto madura y la transición del número de machos jóvenes a adultos maduros podría estar relacionado con el tiempo en que fueron realizados los eventos de captura y recaptura. Estos muestreos estarían coincidiendo con los periodos reproductivos y post reproductivos de la especie en ambas áreas de estudio. La variación en la estructura etaria muestra grandes proporciones de individuos adultos maduros, lo cual puede atribuirse a poblaciones que se encuentran en declinación de su estructura etaria; posiblemente como consecuencia de una natalidad decreciente y una mortalidad creciente. Estos resultados no coinciden con los obtenidos por ALTAMIRANDA & ORTEGA (2012) para Polythore gigantea, quienes encontraron que la dominancia de adultos maduros en la mayoría de los eventos de captura debió estar altamente relacionada con la captura de hembras tenerales y jóvenes en mayor proporción, sumado también a la incapacidad de los machos tenerales y jóvenes de establecer territorios con fines reproductivos porque aún no han alcanzado la madurez sexual.
El mayor promedio de dispersión de los machos de M. ornata en comparación a las hembras, puede estar relacionado con el comportamiento no territorial del macho; el cual no se estaciona en un solo sitio, sino que sobrevuela todo el bosque en búsqueda de alimento y oportunamente de parejas. El menor desplazamiento de las hembras coincide con el mayor número de las fitotelmas en los puntos donde fueron capturadas y recapturadas, probablemente por la filopatría de este sexo hacia los puntos donde son más frecuentes estos microhábitats. Sin embargo, de manera individual las mayores distancias fueron compartidas entre hembras y machos en F1; lo que al parecer demuestra la misma capacidad existente de dispersarse tanto de machos y hembras dentro de los fragmentos. El desplazamiento de pocos individuos entre sitios (solo dos, un macho y una hembra) se puede atribuir a la calidad de la matriz entre los dos fragmentos, como la poca conectividad y cobertura, así como condiciones ambientales adversas en la matriz entre los dos fragmentos. Esto puede incidir en el confinamiento no estricto de la especie en cada fragmento, tanto así que podríamos estar hablando de una metapoblación. En este caso, podríamos suponer que los individuos de F1 actúan como una población fuente, mientras que en F2 estaríamos refiriéndonos a una población sumidero, pero se necesitarían seguimientos más intensos complementados con algunos estudios moleculares para tales afirmaciones.
Aunque en F2 se registró el mayor número de fitotelmas y al mismo tiempo las de mayor volumen, es posible que tanto el efecto borde como la menor cobertura vegetal y densidad de especies vegetales estén influyendo en las condiciones de estos microhábitats, necesarias para que esta libélula no haga uso de estos para el posterior desarrollo de sus larvas. Los resultados demuestran que la abundancia de M. ornata depende tanto de su adaptación a las condiciones abióticas del BST, como de la disposición no aleatoria de las especies vegetales, abundancia, densidad, área basal y cobertura vegetal. La asociación espacio-temporal de estos elementos biológicos vegetales trae consigo una serie de beneficios para M. ornata como: i) la formación y disponibilidad de nuevas fitotelmas; ii) dominancia de algunas especies vegetales que estarían aportando y generando la calidad de estos fragmentos de BST como ecosistemas adecuados para M ornata, iii) la cantidad de radiación solar que llega a penetrar hasta el suelo, lo cual influye en el desarrollo de sus actividades diarias, así como también en la detección de las telas de araña, ya que con poca luz corren el riesgo de enredarse en las redes (FINCKE, 2006). Adicionalmente, existe una gran influencia del número de fitotelmas y la altura en la que estas encuentran desde el suelo, ya que la suficiente retención de agua les proporciona un hábitat adecuado y disponible, que es aprovechado al máximo por la especie en búsqueda de supervivencia para sus huevos y posteriormente sus larvas. FINCKE (1992a, 2006) asegura que la densidad de pseudostigmatidos es relativamente alta en Barro Colorado, donde las especies de árboles con agujeros como Platypodium elegans (Vogel) y Ficus spp. son comunes. Estos resultados coinciden con los obtenidos para la abundancia de Megaloprepus, la cual fue relativamente alta en el bosque, donde se estima que un tercio de todos los tallos son del árbol leñoso Pentaclethra macroloba (Hartshorn y Hammel) y que la morfología del tronco les suele proporcionar múltiples agujeros en un solo árbol (FINCKE, 1998). Sumando también, que las variables vegetales medidas influirían directamente en el agrupamiento de algunos puntos de muestreo de F2 con los de F1; por similitudes en la estructura vegetal.
Entre los fragmentos de BST en estudio, se encontró que la presencia y disponibilidad de los agujeros en los árboles cambian en función de la composición de especies de árboles, pero lo anterior puede variar considerablemente entre las zonas geográficas que ocupa el BST (por ejemplo GENTRY, 1995). En este caso, la formación de agujeros depende de características tales como hendiduras en el tronco de árbol y de nudos para formar agujeros. En las especies con troncos muy suaves, como H. crepitans, aunque es posible la formación de fitotelmas es poco probable que alguna vez formen fitotelmas de calidad. En cambio, C. candidisimum por la calidad de su madera parece ser la especie vegetal en el área de estudio mejor adecuada en cuanto a la formación de fitotelmas, la cual brinda una mejor capacidad de retención de agua disminuyendo así el tiempo de secado y aumentando el tiempo de uso (YANOVIAK, 2001; YANOVIAK & FINCKE, 2005). Para la disposición de estas fitotelmas, es fundamental la alta abundancia, el área basal y la cobertura de C. candidisimum (registra individuos con múltiples agujeros); lo cual representa una pieza esencial para explicar las variaciones espaciales de las abundancias de M. ornata en los fragmentos y las actividades reportadas en este estudio. Esta especie vegetal estaría jugando un papel importante en la ecología poblacional de M. ornata en la zona, ya que proporciona refugio y disponibilidad de sustrato para la oviposición; debido a que los volúmenes estimados para estos microhábitats (>0,4 L) en la zona coinciden con los reportados por FINCKE (1992b), quien describe que este es el volumen mínimo donde se encontraron larvas del Pseudostigmatidae M. coerulatus. El volumen de las fitotelmas es un factor importante en la elección del microhábitat por las hembras, ya que de esta manera se optimiza la cantidad y la calidad de las crías. En los bosques húmedos entre las bromelias, sólo un subconjunto de las especies, como las de los géneros Aechmea (Ruiz y Pav.), Guzmania (Ruiz y Pav.) y Vriesea (Lindl.) retienen el agua suficiente para aportar un hábitat conforme para los odonatos. Incluso otro menor número de especies (por ejemplo, Bertholletia excelsa (Bonpl), Lecythis ampla (Miers), Tontelea ovalifolia (Miers)) producen frutos cuyas cáscaras caídas logran retener agua y ser aprovechadas para la oviposición (FINCKE, 2006).
El hecho de que la intensidad lumínica y la temperatura jueguen un papel importante en la variación de la abundancia de M. ornata en las áreas de estudio, se debe a los requerimientos que la especie necesita para sus actividades diarias y el máximo aprovechamiento de las horas del mediodía cuando estas dos variables se encuentran en su pico máximo. Esto evidencia la importancia que tiene la caída de árboles o ramas en el BST en la formación de claros, sitios en los cuales se presenta una mayor penetración de los rayos solares por la disminución de la cobertura vegetal. Estos microclimas con intensidades lumínicas y temperatura óptimas para M. ornata son aprovechados tanto por machos como hembras, con el fin de alcanzar más rápido la temperatura corporal con la ayuda de la radiación solar; lo cual es necesario para iniciar el vuelo y disminuir el gasto metabólico para realizar sus actividades. Estos resultados coinciden con los registrados por FINCKE & HEDSTRÖM (2008) en los bosques húmedos de Panamá, quienes demostraron que los adultos de M. ornata y M. linearis se mantienen activos durante las horas del mediodía cuando ocurren los días más iluminados en el bosque con temperaturas adecuadas.
La influencia de la precipitación sobre la abundancia de M. ornata podría considerarse un factor determinante en la variación de la abundancia poblacional registrado. Las lluvias, además de afectar otras variables como la temperatura, la humedad y la cantidad de radiación solar, también alteran las actividades diarias de alimentación y reproducción; así como el comportamiento del vuelo, obligando a los individuos a refugiarse y proteger sus alas, ya que podría aumentar la probabilidad de ser presa fácil de algún depredador. Adicionalmente, la humedad relativa al parecer estaría influyendo en la creación de microclimas en el BST que esta especie no puede utilizar para el despliegue de sus actividades, afectando directamente la disminución de su temperatura corporal; lo que genera mayores gastos metabólicos y de reservas energéticas, afectando la supervivencia de los adultos M. ornata.
Sumado a lo anterior, debemos tener en cuenta que en estos fragmentos de BST los períodos de lluvia están relacionados con la transmisión de enfermedades parasitarias entre los odonatos adultos (FORBES & ROBB, 2008). Con la llegada de las lluvias, las gregarinas que afectan a los odonatos pueden aumentar su abundancia y hacerse más frecuentes, lo que consecuentemente generaría muertes en las poblaciones de odonatos (PALACINO et al., 2012). En el caso de la población de M ornata tiene sincronía entre la terminación de su ciclo de vida adulto con la estacionalidad que se presenta en el BST; razón por la cual estaría mucho más propensa a contraer este tipo de enfermedades parasitarias, lo que influiría directamente en la mortalidad.
Los resultados de esta investigación demuestran que la abundancia de M. ornata en fragmentos de BST en el Caribe colombiano presenta patrones ecológicos asociados con las condiciones estacionales del ecosistema, la estructura de la vegetación y la disponibilidad de fitotelmas; razón por la cual esta especie es una excelente herramienta para crear planes de manejo de ecosistemas amenazados y su conservación. Debido a que las poblaciones de M. ornata pueden mostrar una considerable variación temporal y espacial de la abundancia (CORDERO & STOKS, 2008), se hace necesario realizar el monitoreo de las poblaciones como los primeros pasos para evaluar el impacto en los fragmentos de BST en el Atlántico y generar herramientas para establecer medidas de conservación; siguiendo las descripciones, aportes y recomendaciones realizadas por Fincke (1992a, 2006) para los pseudostigmatidos por más de tres décadas en los bosques de Isla Barro Colorado en Panamá.