INTRODUCCIÓN
El caracol gigante africano (Achatina fulica) es un molusco gasterópodo de la familia Achatinidae. Esta especie se encuentra generalmente asociada con las zonas urbanas, en especial los sectores de bajos recursos económicos, lo que sumado a su rol como hospedero intermediario de parásitos como Angiostrongylus cantonensis y Angiostrongylus costaricensis causantes de meningitis eosinofílica y angiostrongiliasis abdominal respectivamente, su alta capacidad de adaptación y su impacto documentado sobre cultivos de interés comercial como el de arroz y papaya (FONTANILLA, 2010; MOLINA, 2013; CHACÓN & LOLLOBRIGIDA, 2014; GOLDYN et al., 2016, CORDOBA et al., 2017, PATIÑO-MONTOYA et al., 2018), han permitido incluirla en la lista de las 100 especies exóticas invasoras más peligrosas del mundo (LOWE et al., 2000).
En el mundo, la investigación sobre el control del caracol gigante africano se remonta a comienzos del siglo pasado, al tener como punto de partida iniciativas direccionadas al control biológico a partir de la introducción de un potencial depredador del molusco, siendo descartada la mayor parte del tiempo (GERLACH, 2001). Durante los últimos 50 años, el control físico y químico, consistente en la recolección manual y posterior eliminación por medios químicos, generalmente sal común (NaCl), cal viva (Ca2OH), o el uso de cebos con metaldehído (C8H16O4), u otro atrayente/repelente, han sido los métodos más utilizados (MOREAU et al., 2015; GARCÉS-RESTREPO et al., 2016). Sin embargo, el alto costo económico asociado a la implementación de este tipo de control, han impulsado a la comunidad científica a identificar metodologías alternativas, a través de procesos de investigación científica sistemática para fortalecer las iniciativas de control y manejo de las poblaciones (ESTÉVEZ et al., 2015; COVA et al., 2017).
En términos generales, las estrategias de control físico y químico, han demostrado una baja eficiencia en su propósito, acompañadas de daños colaterales al entorno, como acidificación del suelo y muerte de especies nativas debido a la baja especificidad de los cebos suministrados (ANDREWS, 2012; MOREAU et al., 2015). Por lo tanto, se hace necesario direccionar los esfuerzos hacia una estrategia integral de manejo, que no se fundamente en las acciones de erradicación directa, sino que de manera sistemática incremente el papel de las comunidades locales en las acciones de control, atenuando el impacto de la especie invasora (GARCÉS-RESTREPO et al., 2016). Una alternativa para alcanzar este propósito ha sido la identificación de sustancias molusquicidas de fácil acceso para las comunidades locales y con un menor efecto colateral. Estas sustancias han sido obtenidas a partir de extractos elaborados con especies de plantas propias de cada región, que de acuerdo con el saber etnocultural, presentan actividad molusquicida, especialmente de las familias Bignonaceae, Euphorbiacea, Apiaceae o Fabaceae, familias vegetales que contienen antraquinonas y polifenoles en órganos como las hojas, las semillas o el tallo (GOVINDAPPA et al., 2013; YADAVH & SINGH, 2014; SELVI et al., 2015; VIEIRA et al., 2016; NAWASH et al., 2013; SOUSA et al., 2017).
En Colombia, el control del caracol gigante africano se encuentra a cargo de las Corporaciones Autónomas Regionales (CAR) por decreto del Ministerio de Ambiente, Vivienda y Desarrollo Territorial (MAVDT, 2011). Actualmente, la medida de control dispuesta por la autoridad ambiental es la recolección manual y posterior tratamiento de los individuos con cal viva o sal común (GIRALDO et al., 2014; GARCÉS-RESTREPO et al., 2016). Recientemente, GARCÉS-RESTREPO et al. (2016) propusieron una metodología basada en la exposición del molusco a extractos vegetales de fácil acceso, sugiriendo el extracto de guayacán rosado (Tabebuia rosea) como alternativa para el control, debido a su actividad molusquicida. Con la presente investigación se propone evaluar el uso de otros tipos de especie planta o producto derivado para el control de caracol gigante africano y se evalúa la eficiencia de esta propuesta metodológica, destacando elementos a mejorar.
MATERIALES Y MÉTODOS
Se recolectaron especímenes de caracol gigante africano (Achatina fulica) en la zona urbana del municipio de Santiago de Cali, departamento del Valle del Cauca, Suroccidente colombiano. Esta es una ciudad capital, con población aproximada de 2.500.000 de habitantes, que se localiza a la margen izquierda del río Cauca, a una elevación promedio de 1000 m sobre el nivel del mar. La precipitación anual es del orden de 900 mm y la temperatura ambiente varía entre 23°C y 30°C, siendo la vegetación dominante de tipo bosque seco tropical (Bs-T) (PATIÑO-MONTOYA & GIRALDO, 2017).
Para realizar la recolección de los especímenes de estudio se siguieron las recomendaciones de manipulación dispuestas por el Ministerio de Ambiente, Vivienda y Desarrollo Territorial (MAVDT, 2011), la captura se realizó mediante un muestreo de oportunidad, a partir de la información suministrada por la comunidad de los barrios Salomia y Siloé de Cali (Figura 1). En cada uno de los sitios establecidos, se buscaron activamente los individuos mediante inspección visual y por excavación hasta 10 cm de profundidad en las zonas con refugios potenciales. Todos los especímenes fueron recolectados manualmente y se dispusieron en bolsas sella fácil para su traslado al laboratorio de Ecología Animal de la Universidad del Valle, sede Meléndez. De acuerdo con la normativa ambiental vigente, no se requiere permiso de recolección o investigación de parte de la Autoridad Nacional de Licencias Ambientales (ANLA) para desarrollar trabajo de investigación en especies catalogadas como invasoras (MAVDT, 2008).
Figura 1 Ubicación de los sitios de recolección de especímenes de caracol gigante africano (Achatina fulica) en la ciudad de Cali, Valle del Cauca, Colombia.
Se dispusieron seis tratamientos siguiendo las recomendaciones de SILVA et al. (2007) y KUMAR & SIMON (2016), tres fueron de extractos botánicos, guayacán rosado (Tabebuia rosea), matarratón (Gliricidia sepium) y comino (Cuminum cyminum), uno de cerveza y uno de producto molusquicida comercial, usando agua destilada como tratamiento control. Los extractos de guayacán rosado y matarratón fueron preparados a partir de hojas maduras, secadas en horno a 80°C por 24 horas, luego de triturarlas, se realizaron infusiones con agua destilada a una concentración 30 gr/50 ml, siguiendo el protocolo de GARCÉS-RESTREPO et al. (2016). Para preparar el extracto de comino, se preparó una solución de 55 gr de comino comercial en polvo (composición: extracto de Cuminum cyminum, harina de cereales y tartrazina) en 100 ml de agua destilada. La cerveza utilizada consistió en bebida comercial de cebada, malta y lúpulo fermentado, con concentración de alcohol del 4%, y el producto molusquicida comercial tuvo como principio activo metaldehído 5%.
Para evaluar el efecto molusquicida de los extractos y derivados botánicos, se realizaron cinco ensayos por cinco semanas para un total de 25 ensayos. De los 25 ensayos se destinaron tres para el extracto de matarratón, seis para el extracto de guayacán rosado, seis para el producto molusquicida comercial, tres para la cerveza, tres para el extracto de comino y se realizaron cuatro ensayos de control con agua destilada. Un ensayo constó de un terrario (60x30x20 cm) con 15 individuos seleccionados al azar, un piso de tierra esterilizada de 5 mm, comida en exceso (herbáceas en general) y entrada de aire constante (Figura 2).

Figura 2 Caracol gigante africano (Achatina fulica). A. Caracol gigante africano alimentándose de materia vegetal del suelo en uno de los sitios de recolección (barrio Salomia, Cali). B. Especímenes de caracol gigante africano utilizados para el desarrollo de los experimentos de control. C. Condiciones experimentales de los ensayos.
Cada tratamiento consistió en 60 aspersiones para los extractos y derivados botánicos, la cerveza y el agua destilada, utilizando la dosis recomendada por la casa comercial (32 Kg/Ha) para realizar la oferta del molusquicida comercial. Cada semana al terminar los ensayos, se contabilizaron la cantidad de muertes, además se midieron los individuos con un pie de rey y se pesaron con una balanza digital. Se siguió la normativa vigente para la disposición final de los individuos (MAVDT, 2008; MAVDT, 2011).
Se describió la estructura de talla de los individuos recolectados a partir de un gráfico de distribución de frecuencias y se evaluó el efecto molusquicida de los tratamientos empleados, a partir de una prueba no paramétrica de varianza de Kruskall Wallis (KW), para la cual se consideró cada tratamiento como factor experimental y el número de individuos muertos por ensayo como variable de respuesta. Las pruebas estadísticas se realizaron en el programa PAST 3 ® y los gráficos en el programa Minitab 16 ®.
RESULTADOS
Fueron recolectados y procesados 375 individuos de caracol gigante africano, siendo la talla (longitud total) promedio de la concha de 39,1 mm ± 12,6 mm y el peso promedio de 6,98 g ± 7,3 g. Del total de individuos recolectados, 20 estuvieron en el intervalo de longitud de adulto (60,1 mm en adelante), 255 de adulto joven (30,1-60 mm) y 100 individuos de juvenil (0-30 mm) (Figura 3).
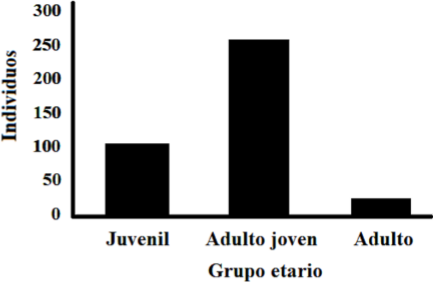
Figura 3 Distribución etaria de los individuos de A. fulica colectados en el barrio Salomia de Cali, Valle del Cauca.
Solamente los tratamientos con producto comercial (56%) y extracto de comino registraron muertes, aunque en este último solo se obtuvo una muerte. Sin embargo, con el tratamiento con comino se observaron signos de estrés fisiológico en los animales como inactividad, inanición y secreción de mucosa, en una intensidad menor al producto comercial.
Se establecieron diferencias significativas entre los tratamientos utilizados (KW, χ² 13,62, p = 0,0005), siendo la fuente de variación el tratamiento producto comercial. A este tratamiento se sometieron un total de 17 individuos juveniles, 62 individuos adultos jóvenes y 11 adultos, con 41% de muertes en juveniles, 58% en adultos jóvenes y de 63% para adultos.
DISCUSIÓN
La recolección manual es la forma de control del caracol gigante africano sugerida en Colombia, sin embargo, la mayor parte de los individuos recolectados para el desarrollo de este trabajo correspondieron a individuos juveniles y adultos, lo que sugiere que los esfuerzos de control (recolección manual) realizados por la autoridad ambiental han tenido un sesgo hacia individuos adultos, asociado a su detección y tendencia a permanecer en el mismo lugar (MARQUES, 2012; GARCÉS-RESTREPO et al., 2016). Probablemente, la alta disponibilidad de adultos jóvenes y juveniles que no se detecta durante las campañas de recolección, ya sea por su comportamiento (estivación) o el desplazamiento natural en busca de zonas de mejor oferta alimentaria, sigue manteniendo latente el problema y los impactos negativos de la especie en estos lugares (FONTANILLA, 2010), haciendo urgente la implementación de propuestas alternativas como lo sugieren GARCÉS-RESTREPO et al. (2016).
En este estudio se obtuvo mayor mortalidad con el producto comercial (metaldehído). Sin embargo, su uso a gran escala no es recomendable debido a la baja especificidad de los cebos (ANDREWS et al., 2012; MOLINA, 2013; MOREAU et al., 2015). De acuerdo con la literatura, el uso de extracto de guayacán rosado puede llegar a tener un 17% de mortalidad (GARCÉS-RESTREPO et al., 2016). Aunque, en los ensayos realizados en la presente investigación el extracto de esta planta no presentó actividad molusquicida, los extractos de algunos congéneres, como T. aurea, T. argentea y T. avellanedae, han demostrado una alta actividad molusquicida (KIM et al., 2013; GOVINDAPPA et al., 2013; RAMALASKSHIMI & MUTHUCHELIAN, 2015). Sin embargo, es importante destacar que las condiciones experimentales bajo las cuales se realizó el presente experimento fueron sustancialmente diferentes a las condiciones descritas en la literatura bajo las cuales se estableció el efecto molusquicida de todas estas especies vegetales. Por ejemplo, los procesos de extracción fueron realizados con etanol y los ensayos experimentales se realizaron bajo condiciones estrictas de laboratorio, de tal manera que las modificaciones en el proceso de extracción y las condiciones experimentales (tiempo del ensayo, tipo de terrario y la incorporación del piso de tierra) pudieron contribuir a la disminución de la eficacia del extracto.
Aunque el extracto de matarratón en su perfil fitoquímico presenta compuestos polifenoles (CRUZ et al., 2016; KUMAR & SIMON, 2016) y la cerveza contiene un 4% de alcohol, ambas sustancias no presentaron evidencia de acción molusquicida. Sin embargo, esta última ha sido ampliamente utilizada como cebo atrayente para recolectar moluscos terrestres por trampeo (CHACÓN & LOLLOBRIGIDA, 2014).
De otro lado, a pesar de que extracto de comino, como aceite esencial, ha sido utilizado como control de moluscos acuáticos (SOUSA et al., 2017), su efecto sobre el caracol gigante africano no fue concluyente, aunque los especímenes expuestos al extracto de esta planta exhibieron condición de estrés fisiológico similares a las generadas por el molusquicida comercial. Sin embargo, la presencia de tartrazina en la presentación comercial de comino utilizado para obtener el extracto utilizado en los ensayos podría llegar a generar una reacción alérgica en los especímenes expuestos, como lo sugiere SÁNCHEZ (2013).
En conclusión, no se encontraron evidencias concluyentes de la eficacia del extracto de guayacán rosado, matarratón o cerveza como sustancia alternativa para el control del caracol gigante africano. Sin embargo, teniendo en cuenta que el extracto de comino ocasionó la muerte de una unidad experimental y que los especímenes expuestos exhibieron condiciones de estrés fisiológico similares a los que fueron observados con el uso del molusquicida comercial, se sugiere continuar con el proceso de experimentación con el extracto de esta planta. En este sentido, se hace necesario que la autoridad ambiental reglamente los protocolos utilizados para evaluar el efecto de sustancias alternativas de potencial uso para el control del caracol gigante africano. Específicamente, se requiere definir la procedencia de los especímenes que se van a utilizar en los ensayos, los procedimientos para obtener las sustancias experimentales que vayan a ser puestas a prueba, las características físicas de los terrarios a utilizar como unidades experimentales y las condiciones mínimas de diseño requeridas para establecer los efectos molusquicidas.














