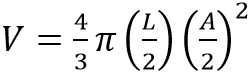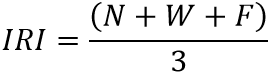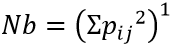INTRODUCCIÓN
Los anfibios juegan un papel muy importante en los ecosistemas que habitan debido a que controlan insectos, sirven de alimento para otros animales, incrementan la dinámica de sedimentos en los cuerpos de agua (sensu bioturbación) y generan un vínculo de materia y energía entre ambientes acuáticos y terrestres (WHILES et al., 2006). De igual manera se ha resaltado que la forma en que los recursos espacio, dieta y tiempo son repartidos entre las especies, y como son usados, es de gran importancia para la estructuración de los ensambles de anuros (TOFT, 1980, 1985). Las interacciones de las especies, la variación temporal y espacial en la disponibilidad del recurso y la filogenia parecen estar actuando de una manera compleja, interviniendo en la conformación de las dietas de especies simpátricas (VITT & ZANI, 1998). Varios estudios han demostrado la importancia del alimento para el ensamblaje, evolución y organización de las comunidades de anuros tanto de adultos como de jóvenes en varios ecosistemas (DUELLMAN, 1967, 1978; HEYER & BELLIN, 1973; PIANKA, 1974; COBAS & ARBIB, 1992; CALDWELL et al., 1996; LAJMANIVICH, 1996; LAMB, 1984).
La dieta constituye una de las fuerzas selectivas más potentes de la evolución fenotípica, existiendo numerosos ejemplos de adaptaciones frente a cambios dietarios tanto a nivel macroevolutivo ―por ejemplo, cambios en el tamaño corporal o en la dentición― como microevolutivo ―por ejemplo, organelos blancos de enzimas catabólicas― (BIRDSEY et al., 2005).
Estos antecedentes han llevado a determinar una influencia del hábitat sobre las poblaciones de anfibios, en donde las modificaciones de este afectan la dieta y la estructura de las poblaciones (KRZYSIK, 1979; TOFT, 1980, 1981; BEEBEE, 1996; ANDERSON & MATHIS, 1999; ANDERSON et al., 1999). La dieta representa entonces un importante componente de la historia natural de las especies y sugiere consecuencias ecológicas en la vida de estas en los diferentes hábitats que ocupan (ANDERSON & MATHIS, 1999).
Las especies Andinobates minutus (Shreve, 1935) y Andinobates fulguritus (Silverstone, 1975) (Figura 1) ―pertenecientes al género Andinobates― se caracterizan por tener la piel levemente granulada, franjas dorsolaterales incompletas, pequeñas manchas en su dorso o vientre y con colores en el dorso que van desde el amarillo, verde oscuro, café hasta azul en la parte ventral; sus tamaños oscilan entre 12 a 17 mm, presentan cuidado parental y su mayor actividad se registra en las horas de la mañana. Para las especies A. minutus y A. fulguritus son pocos los estudios realizados sobre su dieta; hoy solo existe un trabajo reportado para A. minutus, que fue realizado en Isla Palma, en Colombia. Por esta razón, se pretende determinar la composición dietaría de estas dos poblaciones en zonas de bosque pluvial tropical en el departamento del Chocó (Colombia); lo que permite incrementar el conocimiento de los Dendrobatidae de la región pacífica colombiana en el noroccidente suramericano.

Fuente: Jhon Tailor Rengifo-Mosquera.
Figura 1 Ejemplares de Andinobates: A. minutusShreve, 1935 y A. fulguritus Silverstone, 1975.
ÁREA DE ESTUDIO
Las zonas objeto de estudio se localizan en las llanuras aluviales y colinas bajas del valle del río Atrato en municipios aledaños a los alrededores de Quibdó, capital del departamento del Chocó, en donde se concentra la mayor pluviosidad del Andén del Pacífico y en donde las formaciones selváticas se encuentran entre las más ricas del mundo (CUATRECASAS, 1958; FORERO & GENTRY, 1989). Los puntos de muestreo están incluidos en las coordenadas geográficas 5°00’-6°45’ N y 77°15’-76°30’0. El régimen de precipitación es de tipo bimodal tetraestacional con un período de mayor concentración de lluvias entre abril y octubre, y una época de menor concentración desde noviembre hasta marzo (POVEDA et al., 2004). La precipitación anual es de 8558 mm con un promedio mensual de 395,5 (RANGEl-Ch. & LOWY, 1993; ESLAVA, 1994). La temperatura está dividida en dos tipos: temperatura megatermal baja (23,5 a 25,7 °C) y temperatura megatermal (25,7 a 27,9 °C), con un promedio anual de 23,5 °C (POVEDA et al., 2004).
En el valle del río Atrato se ubicaron cinco municipios de la selva pluvial central; las zonas donde se realizaron los muestreos fueron: zona 1: municipio de Tadó, ubicado en la parte oriental del departamento del Chocó dentro del área del Alto San Juan; zona 2: municipio de Lloró, que está situado en la zona occidental del departamento del Chocó; zona 3: corregimiento de Samurindó, que pertenece al municipio del Atrato, situado al occidente sobre la margen derecha del río Atrato y dista a 15 km de la cabecera municipal de Yuto; finalmente el corregimiento de Pacurita que se encuentra a unos 15 km al suroriente de Quibdó y limita al norte con Guadalupe, al sur con el municipio de Atrato, al oriente con el resguardo de Playa Alta y al occidente con el área urbana de Quibdó.
METODOLOGÍA
En un lapso de tiempo comprendido entre marzo y julio de 2016 se realizaron muestreos mensuales con una intensidad de cuatro horas y una duración de seis días para cada zona. Para la captura de los individuos adultos se utilizó el método de relevamiento por encuentros visuales (PEARMAN et al., 1995); este consistió principalmente en la búsqueda de individuos en los diferentes microhábitats que ofrece el ecosistema, sin tener en cuenta ningún modelo sistemático (PATLA & PETERSON, 2003).
El sacrificio de las especies se realizó in situ, por inmersión en una solución de cloretona al 10 %, posteriormente se realizó una incisión desde la cintura escapular hasta la porción terminal del abdomen que permitió extraer todo el contenido estomacal; luego fueron transportados (contenido y ranas) al laboratorio de la Universidad Tecnológica del Chocó para el análisis de los mismos. La fijación de los individuos se realizó en cámaras de formalina, con posterioridad fueron marcados e introducidos en la Colección Herpetológica de la Universidad Tecnológica del Chocó (GIHUTCHCOLZOOCH-CH) para su conservación.
Con la ayuda de claves taxonómicas, y la utilización de un microscopio estereoscópico de referencia Zeiss, se analizaron e identificaron los ítems alimenticios de cada estómago hasta la categoría de orden; se presentaron varios casos en que los contenidos estomacales no pudieron ser identificados debido a que se trataba de tejidos en un estado avanzado de digestión, este material fue clasificado como “material no identificable”; fue catalogado como material vegetal a las semillas y restos vegetales lignificados y como material geológico a los restos de arena, piedra y barro que fueron encontrados en los estómagos; este material no fue utilizado para el análisis de las presas.
Los individuos fueron medidos con un calibrador Vernier (+ 0,02 mm), longitud rostro-cloaca (LRC) y ancho de la boca (AB), con el fin de calcular su volumen a través de la fórmula del volumen de un elipsoide (DUNHAM, 1983):
Para conocer la contribución de cada categoría de alimento a la dieta se calculó el índice de importancia relativa (IRI) propuesto por PINKAS et al. (1971):
En donde N es el porcentaje numérico agregado, W es el volumen porcentual agregado y F la frecuencia de ocurrencia. Este índice permite comparar la importancia relativa que cada ítem representa para la dieta. Para calcular la jerarquía de las presas en la dieta se aplicó al valor de IRI el índice de jerarquización (DJ), que toma el valor más alto del IRI para calcular el porcentaje de todos los demás valores a partir de este: si el porcentaje del ítem de la presa se encuentra incluido entre el 100 % y el 75 %, se le considera fundamental; si se ubica entre el 75 % y el 50 %, se le considera secundario; si está entre el 50 % y el 25 %, es accesorio y si está por debajo del 25 %, es accidental (MARTORI, 1991); además se calculó la diversidad trófica, según el criterio de HURTUBIA (1973), y la amplitud de nicho trófico (índice de Simpson):
En donde Nb es amplitud del nicho trófico y p ij es la probabilidad de hallar el ítem i en la muestra j, Ij es el solapamiento de nicho trófico, c son las presas compartidas y a y b es el número de presas de cada una de las especies.
Se calcularon las novedades tróficas acumuladas para establecer la muestra mínima de ejemplares en este estudio; además se emplearon los estimadores Chao 2 e ICE, que presentan un índice de confianza del 95 %, a través del programa estadístico Estimates versión 8.0 (COLWELL, 2006). Para observar diferencias entre el número y el volumen de presas consumidas, entre las distintas especies, se aplicó una prueba de Kruskal-Wallis (prueba no paramétrica) puesto que no se cumplieron los supuestos de normalidad y homogeneidad de varianza.
RESULTADOS
Con un esfuerzo de muestreo de 360 horas/hombre se registró un total de 80 ranas para un éxito de 0,22 individuos/h-h. La identificación fue de acuerdo a la nomenclatura taxonómica orden para un total de 140 presas; el contenido fue clasificado dentro de dos filos, tres clases y 5 órdenes (Tabla 1); al aplicar los estimadores de riqueza se encontró que los estimadores Chao 2 e ICE mostraron el mismo comportamiento al no predecir más presas, registrando el 100 % de la dieta para las especies (Tabla 2).
Tabla 1 Composición taxonómica de la dieta de dos especies del género Andinobates (Anura: Dendrobatidae) en el bosque pluvial tropical en el departamento del Chocó, Colombia.
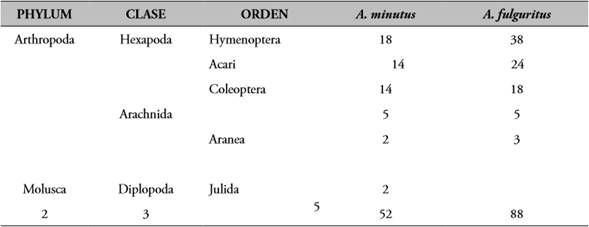
Fuente: elaboración propia.
Tabla 2 Estimadores de novedades tróficas de A. minutus y A. fulguritus en zonas de bosque pluvial tropical en el departamento del Chocó.

Fuente: elaboración propia.
Con los valores de los estimadores se elaboraron curvas de novedades tróficas, que muestran como a medida que se incrementa el esfuerzo de muestreo se suman más presas hasta llegar a alcanzar su asíntota. Las curvas muestran que se registró un porcentaje significativo de presas consumidas por las especies; por otro lado, los estimadores no muestran la aparición de nuevos ítems alimenticios (Figuras 2, 3).
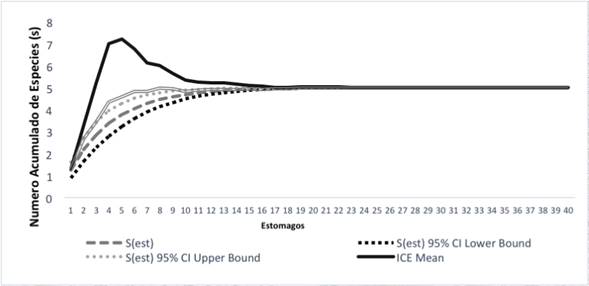
Figura 2 Curvas de novedades tróficas acumuladas de A. minutus en zonas de bosque pluvial tropical en el departamento del Chocó.
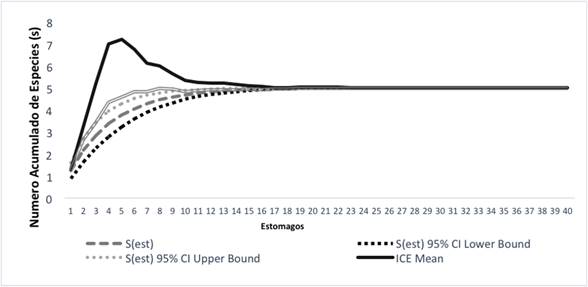
Figura 3 Curvas de novedades tróficas acumuladas de A. fulguritus en zonas de bosque pluvial tropical en el departamento del Chocó.
En el análisis del contenido estomacal de las especies analizadas se destaca la presencia de restos minerales (arena, lodo y piedra) y de restos vegetales (madera, semillas y hojas). En este trabajo, alrededor del 20 % de las dos especies fueron encontradas con material vegetal en los contenidos estomacales (Tabla 3).
Tabla 3 Contenido de origen vegetal y mineral encontrado en los tractos digestivos.

Fuente: elaboración propia.
La abundancia relativa de estas especies estuvo representada por los himenópteros con el 34 % para A. minutus y el 43,1 % para A. fulguritus respectivamente; la contribución de cada categoría se ve reflejada por el índice de importancia relativa (IRI); en donde los mayores valores correspondieron a Hymenoptera (38), Acari (25) y Coleóptero (18) (Tablas 4, 5).
Tabla 4 Presas de A. minutus.
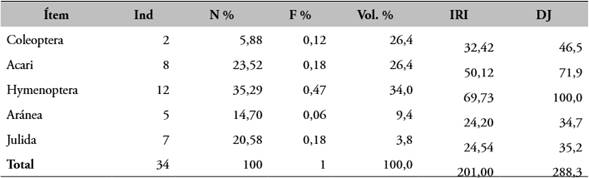
Nota: Ind: abundancia, N %: abundancias relativas, F %: frecuencias relativas de presas, Vol. %: volumen de presas, IRI: índice relativo de importancia; DJ: índice de jerarquización.
Fuente: elaboración propia.
Tabla 5 Presas de A. fulguritus.
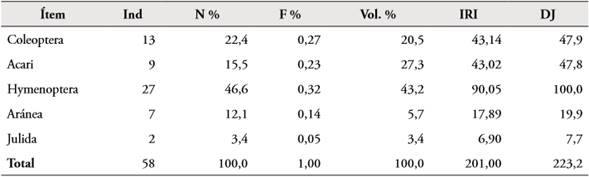
Nota: Ind: abundancia, N %: abundancias relativas, F %: frecuencias relativas de presas, Vol. %: volumen de presas, IRI: índice relativo de importancia; DJ: índice de jerarquización.
Fuente: elaboración propia.
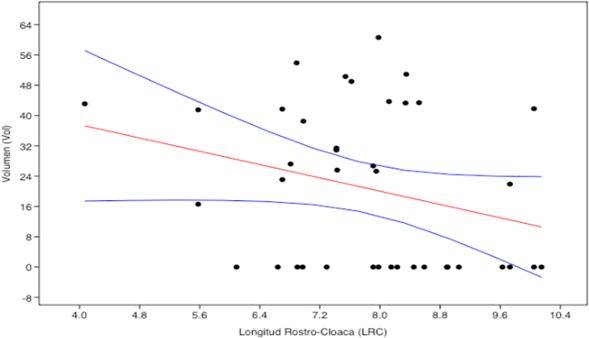
Al explorar la relación entre la talla de la rana y el tamaño de la presa observamos que la pendiente para A. minutus fue débil, arrojando como resultados: (Y= -4,3918x+55,158 ) (R2=0,07721); mientras que para A. fulguritus no existió correlación, siendo valores: (Y=-0,4494x719, 035) (R2=0,00168) (Figuras 4, 5).
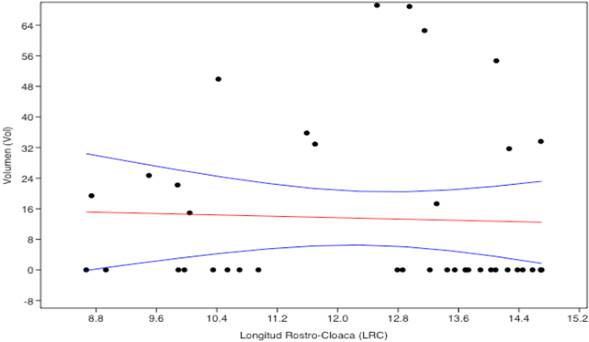
Figura 4 Correlacion lineal de sperman entre LRC y volumen de presa de A. minutus en bosque pluvial tropical de la zona centro del departamento del Chocó, Colombia.
DISCUSIÓN
Con base en los resultados de este trabajo, y a la utilización de claves taxonómicas, se observa que ambas especies coinciden en el consumo de presas del orden Hymenoptera. Aunque no se realizó una comparación, las especies no se diferencian de forma significativa en cuanto a las características tróficas; pues el consumo de Hymenoptera, Acari y Coleoptera es abundante en ambas. El gran consumo de hormigas se explica por la abundancia de este recurso en los bosques pluviales tropicales. KOVÁCS & TÖRÖK (1997) estiman que el número de individuos necesarios para describir la dieta de las especies de Dendrobatidae está entre 8 y 36, y que el tamaño necesario de muestra está directamente relacionado con la diversidad de la dieta; por lo que la cantidad (40 para cada especie) de individuos para analizar la dieta de estas especies, fue suficiente.
Estudios han sugerido que la ingestión de material vegetal en muchas especies de anuros es accidental, es decir que es producto de la ingestión de presas animales (GUIX, 1993; LAJMANOVICH, 1995; ZUG & ZUG, 1979); sin embargo para NUÑEZ et al. (1982), no existe claridad respecto a la importancia del ítem vegetal dentro de la dieta de los anuros. SILVA & BRITTO-PEREIRA (2006) sugieren que el consumo de plantas también pudiera estar funcionando como un mecanismo para secuestrar toxinas, esto sucede en algunas especies de anuros que ingieren exclusivamente artrópodos (DALY et al., 2000) de agua adicional para prevenir desecación (ANDERSON et al., 1999).
Por su parte DURANT & DOLE (1974, 1976) encontraron que más del 60 % de la dieta de un grupo de anfibios, incluyendo Dendrobatidae, está compuesta por hormigas y coleópteros; LIMA & MOREIRA (1993), expresan que el volumen de Formicidae incrementa con el aumento del tamaño del individuo. Según la disponibilidad de presas en el medio, los dendrobátidos pueden ser generalistas o especialistas de presas como hormigas y termitas; cuyo consumo repercute en la producción de veneno (CALDWELL, 1996). Los ácaros fueron el segundo ítem importante en este estudio, posiblemente esto se deba a que son un alimento fácil de ingerir y son comúnmente encontrados en el suelo y hojarasca de muchas áreas tropicales (SIMON & TOFT, 1991). Este resultado concuerda con el estudio realizado por GÓMEZ-FERNÁNDEZ et al. (2013) en Isla Palma, en donde expresan que por los hábitos terrestres y el pequeño tamaño corporal de A. minutus el grado de acarifagia en la rana no resulta inesperado.
El hecho de que las hormigas hayan sido las presas más consumidas en este estudio se debe a que estas son un recurso fácilmente disponible para predadores, ya que se encuentran en colonias y son lentas (PARMELEE, 1999). La especialización en el consumo de hormigas por parte de algunas especies pertenecientes a la familia Dendrobatidae ha sido asociada con el secuestro y síntesis de alcaloides (DONNELLY, 1991; DALY et al., 1994; DALY et al., 1997; DARST et al., 2005).
TAIGEN & POUGH (1983) encuentran que la depredación de hormigas y termitas por parte de anuros tropicales también puede estar relacionada con aspectos fisiológicos de las ranas tales como su alta capacidad aeróbica, baja capacidad anaeróbica y alto metabolismo de respuesta.
Debido a que los anfibios tragan entera a su presa, el tamaño y diseño de su aparato trófico los limita morfológicamente para explotar ciertas categorías alimentarias (PIANKA, 1978). El tamaño de la rana puede explicar la presencia de algunas categorías de alimento en relación con la distribución del tamaño y abundancia del recurso (TOFT, 1981; LIMA & MAGNUSSON, 2000). En consecuencia, una presa de igual o mayor tamaño a las dimensiones del hocico de la boca de la rana puede resultar difícil de manejar y tragar; por el contrario, una presa pequeña puede ser más manejable pero puede no ser energéticamente rentable; por ello el tamaño de la rana se ha tomado como indicador del tamaño, tipo y número de presas que consume (CHRISTIAN, 1982; DONNELLY, 1991; LIMA, 1998; MANEYRO et al., 2004). Al analizar la dieta de A. minutus y A. fulguritus, con la registrada para otras especies de la familia Dendrobatidae, se nota que existe una tendencia con el patrón cuyo ítem dietético más importante es las hormigas (DARST et al., 2005).
CONCLUSIONES
Los índices de importancia relativa y jerarquización permitieron determinar que las especies estudiadas consumen una amplia variedad de invertebrados destacando entre estos las hormigas, ácaros y coleópteros.
La variedad numérica de las presas consumidas en las especies estudiadas podría explicar la partición del nicho trófico puesto que no se encontraron diferencias significativas entre el volumen de presas consumidas.
Para estas dos especies existen varios factores que condicionan de uno u otro modo la dieta de los individuos analizados como, por ejemplo, el tamaño de la presa y predador y el modo de forrajeo. De igual manera existen otros factores que no están relacionados directamente con la dieta, pero que también la afectan tal como el micro hábitat y la morfología.





![CONTRIBUTION TO THE KNOWLEDGE OF THE GENUS EUSELASIA HÜBNER [1819] IN COLOMBIA WITH DESCRIPTION OF NEW TAXA (LEPIDOPTERA: RÍODINIDAE: NEMEOBIINAE)](/img/en/next.gif)