INTRODUCCIÓN
Los ecosistemas estuarinos presentan variabilidad diaria y estacional respecto a su volumen de agua, temperatura y salinidad; lo que está relacionado con los regímenes de marea, el aporte de aguas continentales y la precipitación (YÁÑEZ, 1978). Por tal razón su fauna se compone de organismos marinos, estuarinos, limnéticos y terrestres (ELLIOTT et al., 2007).
En el Caribe continental colombiano se encuentran cuatro estuarios principales que corresponden a los formados por el río Magdalena, el Canal del Dique y los ríos Sinú y Atrato (RESTREPO et al., 2005). El delta del río Atrato alberga la mayor extensión de bosque de manglar dentro del Golfo de Urabá con asociaciones vegetales como arracachales, eneales, vegetación flotante y helechos (THOMAS et al., 2007; INVEMAR et al., 2007). Los manglares son reconocidos por su función como guardería, zona de alimento y refugio para muchas especies de peces (NAGELKERKEN et al., 2001) y representan uno de los ecosistemas tropicales más importantes con elevada productividad (MÁRQUEZ & JIMÉNEZ, 2002). Los eneales están compuestos principalmente por la enea (Typha domingensis); la cual se desarrolla en ambientes dulceacuícolas como canales, lagunas y sabanas inundables que van hasta los 1000 m s. n. m. (GARCÍA et al., 2004). Por su parte el arracachal se compone de la planta herbácea llamada localmente arracacho (Montrichardia arborescens), que habita aguas salobres (JIMÉNEZ & SOTO, 1985); este, en el Golfo de Urabá, se desarrolla en el borde de lagunas costeras (INVEMAR et al., 2007).
En los estuarios, diferentes grupos animales aportan gran número de individuos entre los que se destacan los peces (NÚÑEZ et al., 2010); formando el grupo biológico más notorio en el intercambio energético en la red trófica de estos ecosistemas (YÁÑEZ & NUGENT, 1977). Por tanto, son elementos importantes en el mantenimiento de la salud ecosistémica (ANDRADE, 2011). Asimismo, la diversidad ictiológica se encuentra relacionada con las condiciones hidrológicas del sistema (AMEZCUA, 1977).
De los peces del Golfo de Urabá se han listado 186 especies marinas entre las ensenadas de Pinorroa y Sapzurro (ACERO & GARZÓN, 1987) y 71 especies en diferentes hábitats costeros y limnéticos de la región (ROMÁN & ACERO, 1992). En la cuenca del río Atrato se identificaron 134 especies de peces dulceacuícolas agrupadas en 7 órdenes, 30 familias y 40 especies de peces (MALDONADO et al., 2006), en donde se incluyen especies de hábitos marino-estuarinos que son objeto de pesca en la cuenca del Atrato (LASSO et al., 2011). En la cuenca baja del río Atrato se caracterizó la pesca en las ciénagas de Tumaradó, en jurisdicción del Parque Nacional Natural Los Katíos, encontrando que Prochilodus magdalenae es la especie más importante en la pesquería de la zona (JARAMILLO, 2005). Sobre las áreas estuarinas del golfo se ha estudiado poco; en el marco del plan de manejo integral de los manglares del Golfo de Urabá y del mar Caribe antioqueño se realizaron varias faenas de pesca en diferentes lugares del golfo encontrando a Opisthonema oglinum, Centropomus undecimalis, Oligoplites saurus, Mugil curema, Scomberomorus cavalla, Trichiurus lepturus y Bagre bagre como las especies más abundantes (CORPOURABA, 2005). En la costa occidental del golfo se identificaron 32 especies de peces asociadas a los manglares en las bahías Turbo y El Uno, evidenciando la dominancia de Arius sp. (Ariidae) (CORREA & PALACIO, 2008).
Esta investigación analiza algunos parámetros ecológicos de la ictiofauna y su relación con la salinidad, la temperatura superficial del agua, la clorofila a y el seston en cuatro hábitats estuarinos del delta del río Atrato.
MATERIALES Y MÉTODOS
Área de estudio
El Golfo de Urabá se encuentra localizado en el extremo noroccidental de Colombia (8°37’ y 7°55’N-76°55’ y 77°25’O) (CORPOURABA, 2005). Es un cuerpo de agua semicerrado que tiene aproximadamente 80 km de longitud, 25 km de ancho, una profundidad media de 25 m y una máxima de 60 m (BERNAL et al., 2005). Se reconocen dos épocas climáticas, una época seca de diciembre a abril y una época lluviosa de mayo a noviembre (CHEVILLOT et al., 1993; MOLINA et al., 1993; THOMAS et al., 2007). La interacción dinámica entre los aportes del mar Caribe, el río Atrato y la zona litoral generan en el golfo una circulación de tipo estuarino con aguas menos saladas de origen fluvial en las capas superficiales y aguas de origen oceánico más saladas en las capas más profundas (BERNAL et al., 2005). Se observan en el golfo fuertes variaciones de salinidad entre la temporada lluviosa y seca, presentando mayores salinidades en la primera, lo que se explica por las variaciones del régimen de vientos; pues en la época seca los vientos son particularmente activos del norte o noreste, confinando las aguas de los ríos al interior del golfo, entretanto en la época lluviosa los vientos provenientes del sur ayudan a que las descargas de agua dulce salgan del golfo por la zona noreste e ingresen aguas marinas por el noroeste (CHEVILLOT et al., 1993; BERNAL et al., 2005). Los principales ríos que desembocan en el golfo son Atrato, León, Turbo, Caimán Viejo, Caimán Nuevo y Currulao. La descarga del río Atrato es superior a los demás ríos, distribuyéndose a través de varias desembocaduras entre las que se destacan El Roto, Tarena, Las Pavas, Matuntugo, Coco Grande, Urabá y Leoncito (BERNAL et al., 2005), formando un delta típicamente fluvial (RESTREPO & CORREA, 2002; THOMAS et al., 2007). El caudal medio del río Atrato se ha estimado en 2740 m3/s-1 y una descarga de sedimentos de 11,26 x 106 ton/año-1 (RESTREPO & KJERFVE, 2000), lo que ha originado fondos lodosos de origen terrígeno en la mayor parte del golfo (CHEVILLOT et al., 1993). El presente trabajo se desarrolló en la bahía Marirrío y el brazo Leoncito, zona que alberga abundante vegetación arbórea y herbácea de áreas húmedas e inundables en las que domina el mangle a orillas del mar (THOMAS et al., 2007). Es un área de uso sostenible, de acuerdo con la zonificación de los manglares del Golfo de Urabá, y una de las zonas del delta con menor población humana (CORPOURABA, 2003, 2005).
Método
Se establecieron cuatro estaciones de muestreo en hábitats estuarinos: manglar (Rhizophora mangle) en la bahía Marirrío; arracachal (Montrichardia arborescens) y eneal (Typha domingensis) en la porción final del brazo de Leoncito; mientras que la estación sin vegetación correspondió a un fondo lodoso al exterior de la desembocadura de dicho brazo (Figura 1). En cada sitio y momento de muestreo se registró la salinidad con un refractómetro y la temperatura (°C) con un multiparámetro YSI. Adicionalmente se tomaron muestras de agua superficial para el análisis de la concentración de clorofila a por el método de Strickland y Parson (GARAY et al., 2003) como índice de la biomasa de fitoplancton (SAVILLE, 1978) y para el análisis de la concentración de seston por el mismo método como la cantidad de sólidos en suspensión.
Fuente: modificado de URREGO et al. (2011).
Figura 1 Área de estudio. Los círculos rojos representan la ubicación de las estaciones de muestreo.
Durante los meses de noviembre y diciembre de 2012 y enero, abril, mayo y junio de 2013 se recolectaron peces en faenas entre las 8:00 y las 14:00 horas. En cada ocasión se realizaron 30 lances con una atarraya de 2,5 cm de ojo de malla y 2,8 m de altura y se emplearon dos redes agalleras con 5,5 y 7 cm de ojo de malla, ambas con 100 m de longitud y 2,5 m de altura; las redes agalleras se mantuvieron por tres horas en el agua durante cada jornada de muestreo. Los ejemplares colectados se anestesiaron con eugenol, durante 10 minutos aproximadamente, luego se conservaron en formalina al 10 % y fueron llevados al laboratorio para su posterior análisis donde se determinaron taxonómicamente utilizando los trabajos de DAHL (1971), CERVIGÓN et al. (1992), CARPENTER (2002), NELSON (2006) y MALDONADO et al. (2012).
Se describió el comportamiento de las variables ambientales durante el período de muestreo. De igual forma los rangos de salinidad en que se encontraron las especies y se clasificó la composición íctica, según ELLIOTT et al. (2007), en uno de los siguientes grupos: marinos rezagados, entran pocas veces al estuario y solo donde la salinidad es superior a 35; marinos migrantes, entran a menudo al estuario en estadios juveniles con fines alimenticios o de refugio; especies estuarinas, cumplen todo o gran parte de su ciclo de vida en el estuario; especies anádromas, migran a los ríos para desovar; especies semi-anádromas, su proceso de desove se da solo en la parte superior del estuario en lugar de entrar a agua dulce; especies catádromas, migran hacia el mar a desovar; especies semi-catádromas, el desove lo hacen en el estuario en vez de llegar al mar; especies anfídromas, migran entre el mar y los ríos sin razón reproductiva; migrantes de agua dulce, se encuentran regularmente y en cantidades moderadas en los estuarios; rezagados de agua duce, se encuentran en bajas cantidades en los estuarios y su distribución se limita a la parte alta del estuario donde la salinidad es más baja.
La información sobre abundancia de los peces se empleó en el cálculo de algunos índices ecológicos, utilizando el programa Past (HAMMER et al., 2001). La expresión matemática propuesta por SHANNON-WEAVER (1963) se usó en el cálculo de la diversidad. Como estrategia para el mejor análisis de este índice se estimó la dominancia de SIMPSON (1949) y la riqueza de Margalef.
Para identificar diferencias significativas de la abundancia y la riqueza de Margalef entre los hábitats y períodos de muestreo se verificaron los supuestos de normalidad (prueba de Shapiro-Wilk) y homogeneidad de varianzas (estadístico de Levene), posteriormente se realizó la prueba ANOVA de un factor cuando se cumplieron estos supuestos o la prueba no paramétrica de Kruskal-Wallis en caso contrario (GONZÁLEZ & FELPETO, 2006). Se realizaron correlaciones de Spearman entre los factores fisicoquímicos (salinidad, temperatura, clorofila a y seston), la abundancia y la riqueza de Margalef. Estas pruebas fueron realizadas empleando el programa SPSS 13,0.
RESULTADOS
Variables ambientales
La temperatura del agua varió entre 26 y 32 °C; la estación sin vegetación registró los valores más altos de temperatura en mayo y julio de 2013, y el más bajo en enero de 2013. No obstante, no se presentaron diferencias significativas a través del tiempo y las estaciones de muestreo (Kruskal-Wallis, p>0,05).
La salinidad en las estaciones arracachal, eneal y sin vegetación tuvo un comportamiento similar con valores generalmente menores a cinco a lo largo del período de muestreo. En enero se observó una disminución de la salinidad en la estación manglar (10); mientras que en los demás meses fue superior (12 y 20). La salinidad no mostro diferencias significativas (Kruskal-Wallis, p>0,05) a través del tiempo de muestreo. No obstante, se presentaron diferencias significativas en la estación manglar respecto a las demás estaciones (Kruskal-Wallis, p<0,05).
Durante el período de muestreo los valores de clorofila a se mantuvieron entre 0,002 y 0,013 mg/l-1; excepto en el mes de mayo de 2013 donde los valores aumentaron considerablemente en todas las estaciones (0,015-0,026 mg/l-1). La estación arracachal fue la única que presentó valores bajos en todos los meses de muestreo. No se encontraron diferencias significativas temporales ni espaciales de clorofila a (Kruskal-Wallis, p>0,05).
El seston presentó una mayor concentración en la estación arracachal en noviembre y diciembre de 2012. La estación eneal también presentó alta concentración de seston en noviembre de 2012 (148 mg/l-1), sin embargo los valores fueron menores en los meses siguientes y se mantuvieron por debajo de 65 mg/l-1. La estación sin vegetación presentó menor variabilidad durante el período de estudio; exceptuando el valor más bajo obtenido en julio de 2013 (22 mg/l-1), los registros se mantuvieron entre 90 y 107 mg/l-1. Durante el período de estudio la estación manglar presentó los menores valores de concentración del seston, el valor más alto se obtuvo en diciembre de 2012 (22,2 mg/l-1), entretanto en los otros meses no supero 4 mg/l-1. A pesar de esto el seston no mostro diferencias significativas a través del período de estudio (Kruskal-Wallis, p>0,05). Se encontró una correlación negativa entre el seston y la salinidad (correlación de Spearman r= -0,468 p<0,05).
Composición taxonómica
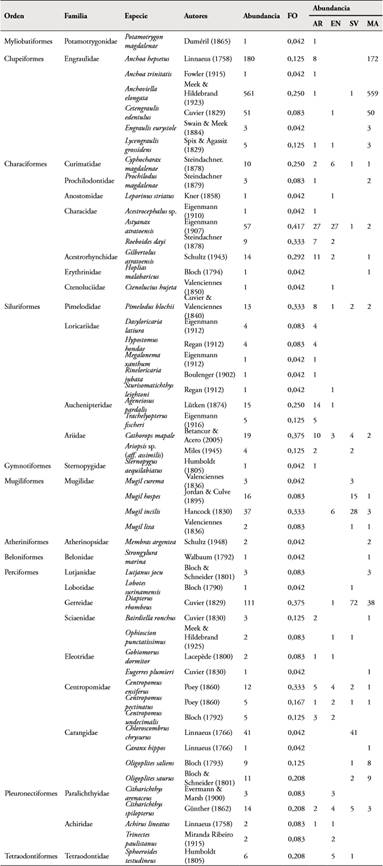
Se registraron 52 especies de peces, 51 de la clase Osteichthyes y una especie de la clase Chondrichthyes. Las especies se distribuyeron en 44 géneros, 27 familias y 11 órdenes. Se destaca el orden de los perciformes por contener el mayor número de especies (14), seguido por el orden de los siluriformes (10) (Tabla 1). Se capturaron 1262 individuos, la mayor abundancia se observó en la estación de manglar con 872 individuos capturados; de estos la mayoría de los individuos (664) pertenecen al orden de los clupeiformes, siendo capturados en noviembre y julio. En la estación arracachal se capturaron 126 individuos, en la estación sin vegetación 185 y en la eneal 79.
Distribución por hábitats y rango de salinidad de las especies de peces
En la estación manglar se encontraron ocho órdenes, entretanto las demás estaciones presentaron siete. De las 52 especies identificadas, Cathorops mapale, Centropomus ensiferus, Centropomus pectinatus, Citharichthys spilopterus y Cyphocharax magdalenae estuvieron presentes en las cuatro estaciones de muestreo.
Algunas especies fueron encontradas de manera exclusiva en cada estación de muestreo y nunca superaron los 10 individuos (Figura 2). Así, por ejemplo: Pimelodus blochii, Acestrocephalus sp., Anchoa trinitatis, Hypostomus hondae, Megalonema xanthum, Potamotrygon magdalenae, Rineloricaria jubata, Sternopygus aequilabiatus y Trachelyopterus fischeri se encontraron únicamente en la estación arracachal. Por su parte Caranx hippos, Eugerres plumieri, Hoplias malabaricus, Lutjanus jocu, Membras argentea, Strongylura marina y Engraulis eurystole se encontraron únicamente en la estación manglar. Entretanto Leporinus striatus y Sturisomatichthys leightoni se hallaron únicamente en el ecosistema eneal. Y Lobotes surinamensis y Mugil curema fueron encontradas exclusivamente en la estación sin vegetación.
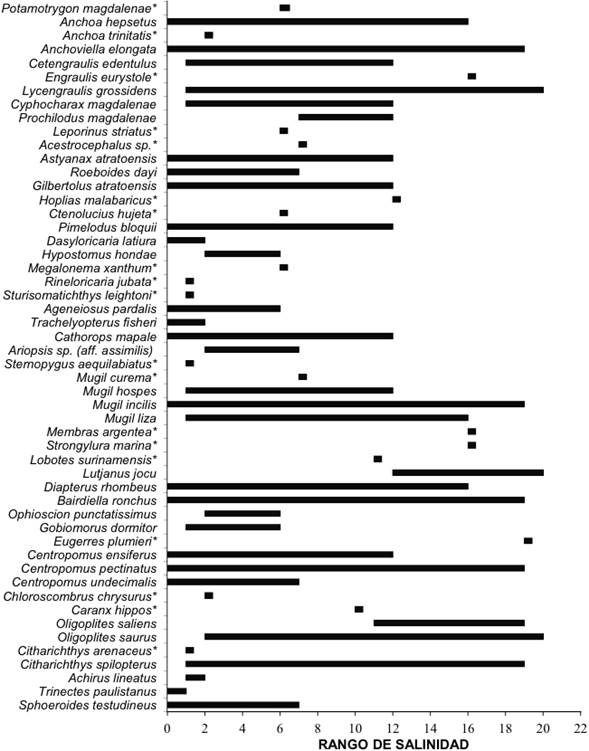
Figura 2 Rango de salinidad de las especies de peces en hábitats estuarinos del delta del río Atrato. (*) Especies capturadas una vez.
Se identificaron 3 especies marinas rezagadas (5,8 %), 21 marinas migrantes (40,4 %), 7 estuarinas (13,5 %), 1 semi-anádromas (1,9 %), 4 migrantes de agua dulce (7,7 %) y 16 rezagadas de agua dulce (30,8 %). No se identificaron especies semicatádromas (Tabla 2).
Tabla 2 Ictiofauna según su comportamiento halino en hábitats estuarinos del delta del río Atrato.
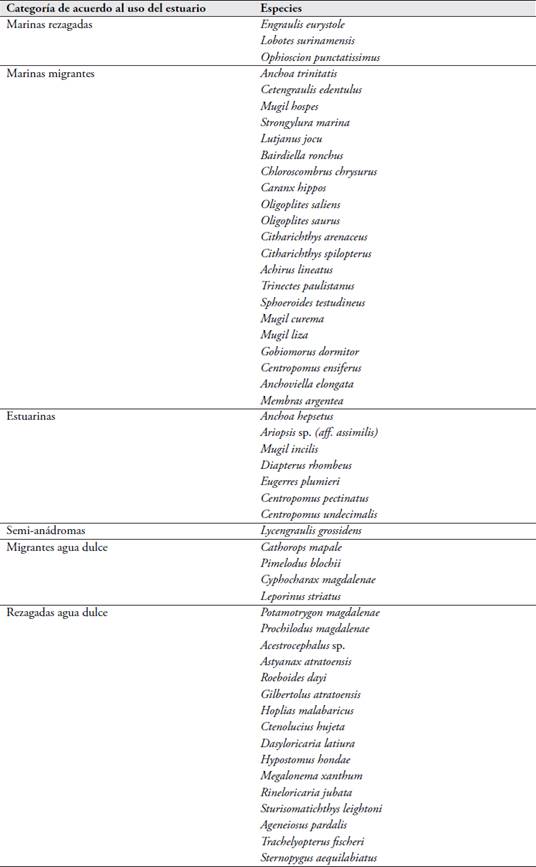
Fuente: para las especies que solo se capturaron una vez durante los muestreos se utilizó información de apoyo disponible en FROESE & PAULY (2015).
Comportamiento temporal de la diversidad de la comunidad de peces
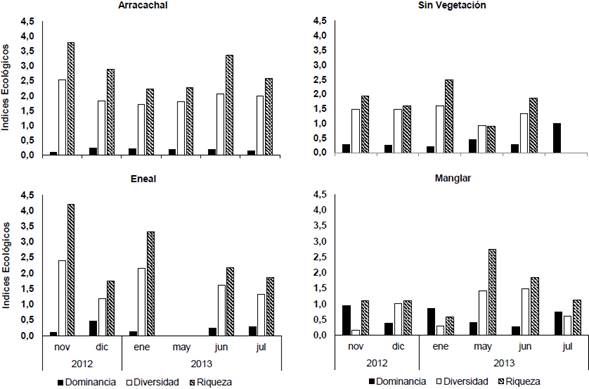
Los valores de los índices de diversidad son similares en las estaciones arracachal y eneal. La estación arracachal presentó altos valores de riqueza y baja dominancia a lo largo del período de estudio con un incremento de la riqueza en noviembre de 2012 (3,8) y junio de 2013 (3,4), así como su valor más bajo en enero de 2013 (2,2). El mayor valor de riqueza se observó en la estación eneal en noviembre de 2012 (4,2); mientras que en los meses siguientes el número de especies capturadas disminuyó, incluso llegó a 0 en mayo de 2013. La estación manglar presentó los índices más altos de dominancia en todos los meses (promedio 0,6 ± 0,28); mientras que los índices de diversidad y riqueza fueron bajos. En esta estación los valores más altos de riqueza y diversidad se presentaron en mayo de 2013 (2,8 y 1,4 respectivamente). La estación sin vegetación mostró valores bajos de dominancia, excepto en julio de 2013 donde solo se capturó una especie (Figura 3). A nivel espacial no se encontraron diferencias significativas en la riqueza de los peces (ANOVA de un factor p>0,05). No se encontraron correlaciones significativas entre los parámetros ecológicos y las variables ambientales.
DISCUSIÓN
La temperatura promedio en la época seca fue muy similar a la indicada por FRANÇOIS et al. (2007) para las bocas del río Atrato. En la época húmeda la temperatura superficial del agua fue más alta con un promedio de 28,5 °C ± 3,2. Trabajos previos revelaron que los niveles de salinidad en el agua tienden a ser más bajos (18) en la época seca en los primeros cinco metros de profundidad en la costa sur y oriente del golfo e incluso pueden llegar a valores menores a dos (2) en las bocas de los ríos (THOMAS et al., 2007). Este patrón también se ha encontrado en otras zonas estuarinas del Golfo de Urabá; CORREA & PALACIO (2008) reportaron baja salinidad para las bahías Turbo y El Uno en la misma época climática. Esto se debe a la influencia de los vientos alisios provenientes del noreste, pues mantiene represada dentro del golfo el agua dulce que proviene de los ríos (FRANÇOIS et al., 2007). Otro es el caso del comportamiento halino del estuario del delta del río Magdalena donde se registran mayores valores de salinidad en la época seca y las más bajas en época de lluvias a causa del aporte adicional de agua dulce por los ríos (SÁNCHEZ & RUEDA, 1999; RENGIFO et al., 2009). CAÑÓN et al. (2007) afirman que en bahía Cartagena ocurre el mismo patrón que en el estuario del río Magdalena debido al incremento de la descarga del Canal del Dique.
La concentración de seston se mantuvo alta en las estaciones con mayor influencia de agua dulce (arracachal y eneal) debido a la gran cantidad de sólidos suspendidos que transporta el río Atrato. Esta información se respalda por RESTREPO & KJERFVE (2000), quienes mencionan la gran descarga anual de sedimentos de este río. En noviembre y diciembre de 2012 la concentración de seston fue mayor en las estaciones arracachal y eneal, un período en que se apreciaron mayores precipitaciones. Esto se asemeja a lo hallado por CAÑÓN et al. (2007) en bahía Cartagena donde los sólidos suspendidos fueron mayormente concentrados en la superficie del agua en la época de lluvias. La estación manglar mantuvo concentraciones bajas del seston, posiblemente por no tener influencia directa de aguas continentales y estar resguardado de los vientos que causan la resuspensión de los sedimentos del fondo por acción del oleaje.
El promedio de clorofila a fue de 0,007 ± 0,008 mg/l-1 y alcanzó los más altos valores en mayo de 2013 en todas las estaciones de muestreo (0,021 ± 0,005 mg/l-1). MANCERA et al. (1994) encontraron indicadores de clorofila a y fósforo en niveles superiores a los normales en la ciénaga grande de Santa Marta a raíz de una muerte masiva de peces de la familia Ariidae. Diversos estudios han encontrado que hay una relación directa entre los procesos fotosintéticos y los nutrientes nitrógeno (N) y fósforo (P) (REDFIELD et al., 1963; STRICKLAND, 1960), por lo que es conveniente obtener información sobre estos elementos para explicar el incremento de la productividad primaria. No obstante, la cantidad de nutrientes no es finalmente la que controla el proceso de la fotosíntesis y existen otros factores que conjuntamente modulan este proceso biológico (HECKY & KILHAM, 1988). CONTRERAS (1994) encontró valores de clorofila a entre 0,009 y 0,02 mg/l-1 como usuales para cuerpos acuáticos estuarino-lagunares tropicales y los califica de mesotróficos a eutróficos. En ese contexto trófico, en los hábitats estuarinos estudiados, en el delta del Atrato, se evidenciaron condiciones mesotróficas a través del período de estudio alcanzando niveles eutróficos en el mes de mayo; sin embargo es una condición temporal del sistema, pues organismos del zooplancton y el necton que se alimentan del fitoplancton ejercen control sobre su abundancia.
En el sur del delta del Atrato la familia Engraulidae (Anchoa hepsetus y Anchoviella elongata) fue dominante por su mayor abundancia en número, especialmente de A. hepsetus en manglar en julio de 2013; sin embargo otros estudios sobre la ictiofauna estuarina del golfo registran a Ariidae como la más importante (ROMÁN & ACERO, 1992; CORREA & PALACIO, 2008). En el área de estudio, Ariidae fue una de las familias más importante por su abundancia; no obstante, solo alcanzó el octavo lugar. De las 52 especies de peces encontradas, 3 marinas migrantes se habían registrado por ACERO & GARZÓN (1987) (C. hippos, L. jocu y Sphoeroides testudineus). Las especies C. magdalenae, Anchovia clupeoides, Cetengraulis edentulus, S. testudineus, C. hippos, Oligoplites saliens, C. ensiferus, C. pectinatus y E. plumieri (17 % del total de las especies) fueron encontradas en común por el presente estudio con respecto a los trabajos de ROMAN & ACERO (1992) y CORREA & PALACIO (2008). De las 39 especies de peces obtenidas en faenas tradicionales de pesca por CORPOURABA (2005), en este estudio se encontraron nueve en común: Ariopsis sp. (aff. assimilis) (SANDOVAL et al., 2015), Bairdiella ronchus, C. hippos, C. pectinatus, C. undecimalis, Chloroscombrus chrysurus, L. surinamensis, M. liza y O. saurus. Por otro lado, entre las 42 especies registradas en la ciénaga de Tumaradó por JARAMILLO (2005), se identificaron 17 en el sur del delta del Atrato; siendo C. mapale, C. ensiferus, C. undecimalis y Mugil spp., las especies estuarinas que migran hasta la cuenca media del Atrato. El 90 % de las especies rezagadas de agua dulce y el 38 % de las especies totales fue encontrado en común entre este estudio y el trabajo de MALDONADO et al. (2012). Por último, A. trinitatis, E. eurystole, Lycengraulis grossidens, Citharichthys arenaceus, Trinectes paulistanus, Ophioscion punctatissimus y Membras argentea no se habían identificado en trabajos previos en el Golfo de Urabá.
El componente íctico en el estuario del delta del río Atrato tiene similitud con otras áreas estuarinas en el Caribe colombiano. En el delta del río Sinú, TORRES-AGUDELO (2010) identificó representantes de las familias Megalopidae (Megalops atlanticus), Elopidae (Elops saurus), Gerreidae (E. plumieri), Lobotidae (L. surinamensis), Scianidae (B. ronchus), Mugilidae (M. curema, Mugil incilis y M. liza), Ariidae [C. mapale y Ariopsis sp. (aff. assimilis)] y Centropomidae (C. ensiferus, C. undecimalis y C. pectinatus) como especies estuarinas. Todas estas especies, excepto las dos primeras, fueron encontradas al sur del delta del río Atrato; no obstante, se reconoce que también se hallan en el Golfo de Urabá (ROMÁN & ACERO, 1992).
En el delta del río Magdalena, SÁNCHEZ & RUEDA (1999) encontraron que las especies dominantes en los complejos de Salamanca Occidental y Pajarales y en la Ciénaga Grande de Santa Marta pertenecen a las familias Gerreidae (D. rhombeus y E. plumieri), Ariidae [Cathoros sp. y Ariopsis sp. (aff. assimilis)], Mugilidae (M. incilis), Centropomidae (C. ensiferus y C. undecimalis), Paralichthyidae (A. lineatus) y Engraulidae (Anchovia clupeoides); familias típicamente estuarinas con gran importancia comercial y ecológica. Estas especies también fueron halladas en el estuario del delta del río Atrato. Los mismos autores, adicionalmente encontraron representantes de familias de hábitats dulceacuícolas como Characidae (Astyanax sp y R. dayi), Ctenoluciidae (C. hujeta), C. Prochilodontidae (P. magdalenae), Anostomidae (Leporinus muyscorum) y Pimelodidae, quienes también se hallaron en la presente investigación.
A nivel general, en las cuatro estaciones, se presentaron especies en casi todas las categorías de uso del estuario; con excepción de arracachal donde no se presentaron especies marinas rezagadas. Sin embargo se observó una preferencia por las estaciones manglar y sin vegetación de las especies marinas migrantes y estuarinas posiblemente por las diferencias entre la salinidad de las estaciones, ya que la estación manglar presentó una salinidad más alta que las demás estaciones. De igual forma las especies rezagadas de agua dulce tuvieron preferencia por la estación arracachal. Esto probablemente a que esta estación se encontraba dentro de la desembocadura del brazo Leoncito.
A pesar de que no se encontraron correlaciones significativas entre los factores ambientales con los parámetros ecológicos estudiados, se sugiere desarrollar trabajos adicionales en otros períodos del año para explorar estas relaciones. No obstante, es evidente que la diversidad fue más alta en las estaciones donde la salinidad fue menor.
CONCLUSIÓN
Los datos de salinidad y temperatura obtenidos se encuentran en niveles típicos descritos en el área de estudio durante la época de transición de lluvias a seca. El delta del Atrato exhibe características halinas específicas que difieren de otros estuarios del Caribe colombiano en cuanto a su relación con factores como la precipitación y la influencia de los vientos, presentando mayores salinidades durante la época lluviosa en la zona interna del golfo. En concordancia, la configuración espacial y temporal de la distribución de los peces varía siguiendo estos cambios encontrando especies marinas en manglar y sin vegetación durante la época lluviosa. Los sitios estudiados son áreas mesotróficas con alta producción primaria, así lo indican los valores de clorofila a. Adicionalmente poseen altas concentraciones de seston atribuidos a la descarga del río Atrato, reconocido por su gran caudal y aporte sedimentario al Golfo de Urabá.
En la zona estuarina ubicada al sur del delta del río Atrato se encontraron 52 especies de peces, 3 especies marinas rezagadas, 21 marinas migrantes, 7 estuarinas, 1 semianádromas, 4 migrantes de agua dulce y 16 rezagadas de agua dulce. Existe gran similitud en la composición de la comunidad íctica y aquella encontrada en humedales al interior de la zona baja del río tal como las ciénagas de Tumaradó. También hay similitud con la diversidad de especies de áreas estuarinas del Caribe colombiano como la Ciénaga Grande de Santa Marta y el estuario del río Sinú. Por lo anterior, es evidente que el estuario del delta del río Atrato cumple un rol fundamental en el mantenimiento de la ictiofauna regional; constituyéndose en una zona de desarrollo y tránsito de peces. Por tanto, se debe avanzar en el conocimiento de la ecología de los peces en el delta del río Atrato.
A pesar de estos esfuerzos, es necesario avanzar en el conocimiento de la ecología de los peces en el delta del río Atrato; ya que solo se conocen listados taxonómicos de los peces en este estuario.




![CONTRIBUTION TO THE KNOWLEDGE OF THE GENUS EUSELASIA HÜBNER [1819] IN COLOMBIA WITH DESCRIPTION OF NEW TAXA (LEPIDOPTERA: RÍODINIDAE: NEMEOBIINAE)](/img/en/prev.gif)