Introducción
Cuando las plantas son atacadas por artrópodos liberan compuestos volátiles que cumplen importantes funciones ecológicas debido a las interacciones que se presentan entre dichas plantas con factores bióticos y abióticos, actuando como señales en la comunicación planta-planta, planta-ambiente y planta-animal (Mattiacci et al., 1995; Turlings et al., 1995; Röse et al., 1996; Calyecac et al., 2006; Holopainen & Gershenzon, 2010; Vivaldo et al., 2017).
Los compuestos volátiles de las plantas son sustancias químicas generalmente líquidas y lipofílicas, con una presión de vapor alta que les permite atravesar las membranas celulares libremente y salir hacia la atmósfera o el suelo en ausencia de una barrera de difusión (Pichersky et al., 2006), los cuales son emitidos por las partes vegetativas de las plantas cuando están expuestas a estímulos bióticos o abióticos (Scala et al., 2013; Dong et al., 2016; Cantúa et al., 2019). Estos compuestos volátiles son importantes para las plantas por que actúan como mecanismos de defensa para repeler insectos, atraer parasitoides y depredadores, los cuales actúan como mensajeros intra e interespecíficos (Takabayashi & Dicke, 1996; De Moraes et al.,1998; Du et al., 1998; Venzon et al., 1999; Arimura et al., 2000; Knudsen & Gershenzon, 2006; Marín & Céspedes, 2007; Khan et al., 2008; D’Alessandro et al., 2009; Dicke & Baldwin, 2010; Filella et al., 2011; Ángeles et al., 2012., Patiny, 2012; Ponzio et al., 2013; Schettino et al., 2017).
Michereff et al. (2011) determinó alta producción de compuestos volátiles (E, E) -α-farneseno, salicilato de metilo, (Z) -3- hexenil acetato y (E) -2-octen-1-ol, en estudios realizados sobre volátiles emitidos por el daño de herbívoros en plantas resistentes, comparado con plantas susceptibles de soya (Glycine max L.). Ángeles et al. (2012), detectaron un total de 36 compuestos orgánicos volátiles diferentes, 23 terpenoides, decanal, decano y salicilato de metilo producidos por plantas de tomate infestadas con mosca blanca de los invernaderos T. vaporariorum. Zabala (2010) menciona que frente al ataque de insectos las plantas responden produciendo compuestos volátiles como los monoterpenos o sesquiterpenos, que atraen a insectos carnívoros o parasitoides que se alimentan de las larvas que dañan las hojas. El ácido jasmónico regula la activación no solo de las defensas directas sino también las indirectas (volátiles), coordinando la defensa contra los insectos herbívoros. Tanto los insectos carnívoros como los parasitoides tienen receptores que pueden detectar los diferentes compuestos volátiles que emiten las plantas.
Los compuestos volátiles vegetales se podrían utilizar como una alternativa adicional para integrarla en los programas de manejo integrado de plagas, la cual ofrece un enfoque nuevo y ambientalmente racional para la protección de cultivos (James, 2005; Arab & Bento, 2006; Martínez, 2013; Peñaflor & Bento, 2013). También podrían explotarse como una alternativa importante para el manejo de plagas con el fin de reducir la aplicación de insecticidas de síntesis utilizados para su control, disminuir la contaminación ambiental, aumentar la resistencia de las plantas a los insectos, particularmente la resistencia inducida, también puede ser manipulada con el uso de elicitores químicos de metabolitos secundarios, que confieren resistencia a los insectos (Sharma et al., 2012; Stenberg et al., 2015).
En este trabajo fue estudiado el efecto de dosis subletales del aceite de Neem en la respuesta olfativa del parasitoide E. formosa a olores de plantas de fríjol no atacadas y atacadas con T. vaporariorum.
Materiales y métodos
El estudio se realizó en el Centro de Investigación y Cría de Enemigos Naturales de la Universidad de Caldas, ubicado en el municipio de Manizales, Colombia (Coordenadas: 5° 05’N y 75° 40’ W). Fue evaluado el efecto de la azadirachtina sobre la capacidad de búsqueda del parasitoide E. formosa por volátiles provenientes de plantas de fríjol infestadas por T. vaporariorum. El aceite de Neem (4,5 mg/L de azadirachtina) fue aplicado en dosis de 0,2 mg i.a/L, valor este definido previamente por el análisis de Probit y que corresponde a CL53, o sea a cuando la tasa instantánea de crecimiento poblacional ri= 0,1 para el parasitoide E. formosa (Gutiérrez, 2016).
El experimento correspondiente a la respuesta olfativa de hembras E. formosa a los volátiles de la planta hospedera infestada con T. vaporariorum asperjados con azadirachtina fue evaluado en olfatómetro tipo “Y” (diámetro interno de 0,5 cm y el largo de los brazos de 5 cm) (Pallini et al., 1997). El aparato está constituido por un tubo de vidrio en forma de “Y”, siendo que cada brazo está conectado por una manguera a dos cajas de plástico transparentes (50 x 36 x 43 cm). Dentro de estas cajas fueron colocadas las fuentes de olores, representadas por plantas de fríjol no atacadas por fitófagos o plantas de fríjol atacadas con T. vaporariorum. El flujo de aire fue producido por un ventilador conectado a la base del tubo de vidrio, formando una corriente de aire uniforme en los dos brazos del aparato. La velocidad de la corriente de aire al interior del olfatómetro fue de 0,45 m/s en cada brazo, medida por fluxómetros digitales y calibrada por registro manual. Las hembras fueron colocadas en la extremidad basal del olfatómetro, contra la corriente de aire formada en el interior del aparato. Fueron consideradas en el análisis aquellas hembras que respondieron y llegaron al punto de unión del tubo en donde realizaron escogencia por una de las fuentes, considerándose una respuesta positiva la llegada de la hembra hasta la extremidad de uno de los brazos del olfatómetro.
Los tratamientos correspondieron a la exposición de los parasitoides E. formosa a agua destilada (control) y a T. vaporariorum con residuos de azadirachtina (aceite de Neem 0,2 mg i.a/L). Como fuentes de olores fueron utilizadas plantas de fríjol con 10 hojas no infestadas y plantas infestadas con cerca de 1000 formas inmaduras y adultos de T. vaporariorum por planta. Hembras E. formosa fueron liberadas individualmente en el olfatómetro y evaluadas una a una, en un total de 20 parasitoides por repetición, totalizando tres repeticiones por tratamiento. A cada cinco hembras evaluadas, las posiciones de las fuentes de olores fueron invertidas y, al final de cada repetición, las hojas de fríjol fueron trocadas con el fin de evitar la pseudorepetición (Ramirez et al., 2000). Las diferencias entre los números de parasitoides que escogieron para cada una de las fuentes de olores fueron evaluadas utilizando la prueba estadística Replicated Goodness of Fit (Sokal & Rohlf, 1995) considerando una frecuencia esperada de 0,5 para cada fuente de olor (Pallini et al., 1997).
Resultados y Discusión
En los análisis de olfatómetro, el parasitoide E. formosa pulverizado con agua prefirió los olores de plantas de fríjol infestadas con T. vaporariorum a olores de plantas no infestadas (Gp= 33,25; g.l.= 1; p< 0,0001) (figura 1). De estos parasitoides, el 81 % prefirieron plantas de fríjol infestadas con T. vaporariorum a plantas no infestadas. Estos resultados muestran evidencia de que volátiles de la planta hospedera atacada por T. vaporariorum tienen un papel relevante en la localización de la presa por parte de E. formosa.
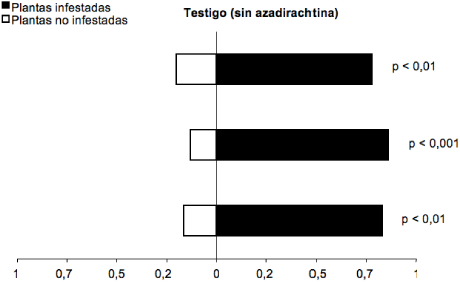
Figura 1 Respuesta del parasitoide E. formosa a los olores de plantas no infestadas y plantas de fríjol infestadas por T. vaporariorum en olfatómetro tipo “Y”. Cada barra corresponde a una repetición (n= 20 parasitoides). (Gp = 33,25; g.l.= 1; p< 0,0001)
Cuando T. vaporariorum fue asperjado con la dosis subletal de azadirachtina, el parasitoide E. formosa expuesto a residuos de azadirachtina continuó prefiriendo los olores de plantas de fríjol infestadas con T. vaporariorum a los de plantas no infestadas (Gp= 45,23; g.l.= 1; p< 0,0001) (figura 2). De estos parasitoides, 86 % prefirieron plantas de fríjol infestadas con T. vaporariorum asperjadas con azadirachtina, lo que indica que en la dosis subletal aplicada de azadirachtina el producto no afecta la capacidad de búsqueda de E. formosa.
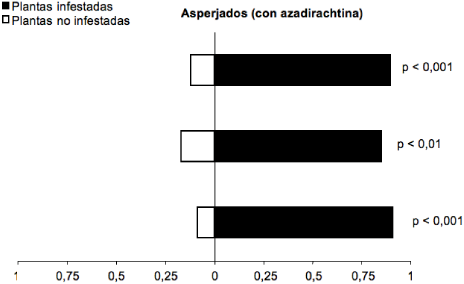
Figura 2 Respuesta del parasitoide E. formosa a los olores de plantas no infestadas y plantas de fríjol infestadas por T. vaporariorum con aplicación de azadirachtina en olfatómetro tipo “Y”. Cada barra corresponde a una repetición (n= 20 parasitoides). (Gp = 45,23; g.l.= 1; p< 0,0001)
Los resultados muestran que E. formosa puede diferenciar entre olores de plantas de fríjol no atacadas y plantas de fríjol atacadas por T. vaporariorum. La azadirachtina en la concentración de 0,2 mg i.a/L (equivalente a la concentración cuando ri= 0,1 para el parasitoide) no interfirió en la respuesta olfativa de E. formosa alimentado de presas asperjadas, pudiendo discriminar entre plantas infestadas por T. vaporariorum y plantas no infestadas. La olfatometría es utilizada para estudiar la respuesta olfativa de parasitoides a olores de larga distancia, o sea, plantas no atacadas y plantas atacadas, así como colonias de insectos fitófagos dentro de la planta. Por tanto, E. formosa expuesta a concentraciones subletales de azadirachtina en el campo, al conseguir encontrar sus presas, no compromete el control biológico natural ejercido sobre T. vaporariorum. De esta manera E. formosa puede aumentar la eficiencia en la localización de presas, pudiendo reducir el tiempo necesario para localizarlas. Los resultados aquí encontrados evidencian que el Neem en la dosis aplicada se podría utilizar en plantaciones de fríjol cuando la mosca blanca T. vaporariorum alcance los niveles de daño económico, complementando el control con liberaciones del parasitoide E. formosa, sin que dicho producto afecte al enemigo natural.
Los volátiles de plantas dañadas por herbivoría se consideran que actúan como defensas indirectas de las plantas ya que sirven como señales confiables de que están presentes los hospederos y presas de los parasitoides y depredadores (Turlings & Wackers, 2004). Ton et al. (2007) en experimentos de laboratorio realizados con plantas de maíz, observaron el aumento en la concentración de compuestos orgánicos volátiles provocado por el daño de Spodoptera exigua (Lepidoptera: Noctuidae) a la planta, los cuales generaron una fuerte atracción del parasitoide Cotesia marginiventris (Hymenoptera: Braconidae). Ortiz et al., (2019) encontraron que los volátiles liberados por plantas de maíz sanas son atractivos para las hembras de Cotesia insularis (Hymenoptera: Braconidae) y los volátiles que liberan las plantas dañadas por Spodoptera frugiperda (Lepidoptera: Noctuidae) son aún más atractivos, por lo que deducen que los volátiles juegan un papel clave en las decisiones de localización del hospedante.
Shi et al. (2016) encontraron que el ácido salicílico induce resistencia en las plantas contra patógenos biotróficos e insectos que se alimentan del floema; las aplicaciones de ácido salicílico podrían usarse para repeler, reducir la fecundidad, longevidad y supervivencia de la mosca blanca Bemisia tabaci (Hemiptera: Aleyrodidae) en los cultivos y que aplicaciones de ácido salicílico también aumentan la cantidad y la composición de volátiles liberados por las plantas, especialmente la cantidad de metil salicilato y δ-limoneno.
Con el entendimiento del papel que juegan los semioquímicos en la ecología y en los mecanismos de emisión de los compuestos orgánicos volátiles de las plantas inducidos por herbívoros, se abren caminos para desarrollar nuevas estrategias en programas de control biológico y etológico, con el objetivo de mejorar la eficacia de los enemigos naturales en la supresión de poblaciones de plagas en los cultivos (Peñaflor & Bento, 2013).














