Introducción
Las conductas de defensa varían en forma e intensidad según especie, sistema social, clase de depredador, etapa de reproducción de la pareja, distancia de sus descendientes a la amenaza y relación costo-beneficio de la acción (Gottfried, 1979; Wittenberg, 1981; Alcock, 1989; Piersma y Xiersma, 1996). Estudios anteriores establecen que la defensa del nido aumenta en frecuencia y nivel de agresividad a medida que avanza el desarrollo de la nidada o a medida que la progenie gana edad (Barash, 1975., Anderson Wiklund & Rundgren, 1980; Greig-Smith, 1980; Shields, 1984; Lavery & Keenleyside, 1990). Este fenómeno puede ser explicado por la teoría de la Inversión Parental Óptima (Trivers, 1972), que relaciona costo-beneficio con respecto a las expectativas futuras de reproducción. A medida que avanza el periodo de incubación, las probabilidades de ganar éxito reproductivo con la nidada actual se incrementan en especies nidífugas y, por ende, se espera que los adultos respondan con una mayor inversión en conductas defensivas. Sin embargo, el exceso de inversión en defensa podría disminuir drásticamente las posibilidades de reproducción futura (Coleman et al., 1985). Otra explicación al incremento de la defensa de la nidada durante el período de incubación es la llamada “Falacia del Concorde” o de la “Gran Inversión” (Dawkins & Brockmann, 1980), según la cual la inversión actual depende de qué tanto se ha invertido en el pasado. Esta hipótesis implica una inversión continua y cada vez mayor para evitar perder lo que se ha invertido hasta el momento y supone que los animales tienen acceso ilimitado a los recursos de tiempo y energía.
La tercera propuesta para explicar el fenómeno está basada en la probabilidad de detección de la progenie. Esta alternativa, que no excluye a las anteriores, sugiere que los polluelos de mayor edad son más conspicuos a depredadores que los de menor edad y que, por consiguiente, el nido y su contenido se hacen más visibles a medida que el ciclo de anidamiento progresa. Según esta hipótesis, se requiere un incremento en la intensidad de la defensa de los adultos para contrarrestar el incremento de detectabilidad por los depredadores (Davies, Krebs & West, 2012; Knight & Temple, 1986).
La forma de defender un esfuerzo reproductivo puede presentar una gradación de patrones conductuales que pueden ir desde huir del depredador en silencio hasta ataques directos efectuados individual o colectivamente (Curio, Ernest & Vieth, 1978; Frankenberg, 1981; Chandler & Rose, 1988; Flasskamp, 1994; Gehlbach & Leverett, 1995; Griesser & Ekman, 2005). El Pellar (Vanellus chilensis) es territorial y muy agresivo en la defensa del nido (Myers, 1978; Gallegos, 1984, Mena-Valenzuela, 2018); detectan depredadores próximos, los adultos manifiestan conductas como: falsa incubación: el individuo se agazapa en el suelo y opta postura de incubación en un lugar diferente al del nido; ala rota: el adulto con una ala completamente extendida camina con aparente dificultad; vuelos de ataque directo: vuelos rápidos y con orientación directa hacia un depredador potencial, que ejecutan a medida que se alejan del nido y con los que supuestamente distraen la atención del depredador (Myers, 1978; Gallegos, 1984; Piersma & Wiersma, 1996). Esta especie parece discriminar entre depredadores y no depredadores, a juzgar por la respuesta diferencial de los adultos ante los estímulos próximos durante la incubación y cría de polluelos (Walters, 1990).
Los detalles y tipo de respuesta conductual que pueden tener los adultos frente a diferentes estímulos de su hábitat y sus implicaciones ecológicas con relación a la supervivencia de las crías, son aspectos aún poco conocidos. Si la especie discrimina diferentes riesgos potenciales durante el evento reproductivo, se espera que la respuesta de defensa varíe en categoría, intensidad o distancia a la cual se ejecute; además se asume que, según la relación costo beneficio, los adultos presentarán una respuesta conductual que confiera ventajas reproductivas actuales, pero sin afectar drásticamente las probabilidades de anidamiento futuro. Se esperaría que la conducta de defensa más generalizada entre los adultos sea la que mayor éxito reproductivo les confiera. Los objetivos de este estudio fueron: a) evaluar si los patrones conductuales de defensa de nido varían con el grado de desarrollo embrionario de los polluelos; b) determinar si la respuesta conductual está relacionada con la naturaleza del estímulo próximo (en dos momentos del desarrollo embrionario); y c) examinar si existe una relación entre la categoría de respuesta defensiva y el éxito reproductivo de las parejas.
Materiales y Métodos
Área de estudio
Este estudio se realizó entre marzo de 2001 y diciembre de 2003 en la Reserva Natural El Hatico, municipio de El Cerrito (3°38’25.6’’ N y 76°19’13.6’’ W) y el campus de la Universidad del Valle (3°22’23.94’’ N y 76°32’1.23’’ W), municipio de Cali, departamento de Valle del Cauca, Colombia. Ambas áreas de estudio se encuentran a una elevación de 1000 m y sus precipitaciones presentan una distribución bimodal comparable con máximos de lluvia en marzo-abril y octubre-diciembre, separados por dos épocas secas con mínimos de precipitación en agosto y febrero. De acuerdo con sus características climáticas, ambas localidades se clasifican como Bosque Seco Tropical, según el sistema de Holdridge (Espinal, 1967).
La Reserva Natural El Hatico tiene una extensión de 288 ha con una cobertura de bosque natural, potreros de extensión variable dedicados al cultivo de la caña de azúcar orgánica y sistemas silvopastoriles. La precipitación y temperatura promedio anual es de 511 mm y 23,6°C, respectivamente. El campus de la Universidad del Valle posee una extensión de ca.100 ha ocupadas por construcciones civiles (9,5 ha), dos lagos (1 ha), jardines, prados y pastizales (45,5 ha), y áreas con densa vegetación de regeneración natural (44 ha). La precipitación y temperatura promedio anual es de 1094,5 mm y 24,5°C, respectivamente (IDEAM, 2015).
Especie y seguimiento de nidos
El Pellar es una especie que excava una depresión circular poco profunda para anidar en el suelo (Piersma & Wiersma, 1996). Esta excavación es recubierta con pequeñas ramas y hojas secas que encuentra en la vecindad inmediata de los sitios de anidamiento (Piersma & Wiersma, 1996). El tamaño de la nidada es de 3 o 4 huevos y el período de incubación es de 27 días (Naranjo, 1991; Piersma & Wiersma, 1996; Santos, 2009). Mediante recorridos diarios y observación constante del comportamiento de los adultos en las zonas de estudio, se identificaron aquellas parejas reproductivamente activas.
Los nidos tuvieron monitoreo diario durante todo el evento reproductivo y su estado de desarrollo embrionario se determinó por seguimiento de éstos desde el momento de la puesta. Una nidada se clasificó en estado de desarrollo embrionario temprano (DET) desde la postura de los huevos hasta los primeros 10 días de incubación y en estado de desarrollo embrionario avanzado (DEA) desde el día 21 de incubación hasta la eclosión.
Experimentos en campo
Se capturaron y marcaron 45 adultos reproductivamente activos (41 en la Reserva El Hatico y 4 en la Universidad del Valle), con dedicación de 222 horas trampa en los nidos. La trampa, con forma cúbica (1 m3), paredes translúcidas y un lado móvil, cubrió el nido y se accionó a distancia cuando el individuo ingresó a incubar. Antes de la captura de los adultos hubo un periodo de tres días de familiarización con la trampa durante el cual ésta se instaló en el nido por cortos períodos de tiempo, pero sin ser accionada. Cada individuo recibió anillos de celuloide de colores en combinaciones únicas en la región del tibio-tarso para su reconocimiento individual y se determinó su sexo mediante métodos moleculares (Ellegren, 1996; Fridolfsson & Ellegren, 1999; Cruz-Bernate, Riascos & Barreto, 2013). Se tomaron 100 μl de muestra sanguínea de la vena braquial con jeringa para insulina y se empleó el anticoagulante EDTA (ácido etil-enediamín tetra-acético). Se almacenaron a -20°C y se procesaron en el laboratorio de Biología Molecular Humana de la Universidad del Valle.
Se seleccionaron 21 parejas marcadas y a cada una se le presentaron tres estímulos: un humano a pie, un jinete y un tractor. Los estímulos fueron presentados de manera controlada y se aproximaron en dirección al nido en línea recta desde aproximadamente 45 m de distancia. Todos los estímulos recorrieron la distancia dos veces: primero para aproximase y segundo para alejarse del nido; en las dos trayectorias la velocidad fue constante (0,8 m/s). Los tractores usados en ambas áreas fueron similares en cuanto al tamaño y modelo (Tractor Ford 5000, modelo 1982). El humano que participó en los experimentos fue una persona que nunca tuvo contacto previo con el área ni con los Pellares del estudio. Los estímulos se seleccionaron por representar diferente riesgo para la nidada, como aplastamiento (jinete y tractor) o depredación directa (humano). Las 21 parejas del estudio se dividieron en dos grupos según el estado de desarrollo embrionario; 11 en estado desarrollo embrionario temprano y 10 en estado desarrollo embrionario avanzado. Los eventos experimentales tuvieron ordenamiento aleatorio y se distanciaron entre 14-31 horas (media = 23, DE = 3,87, n = 42). En cada uno de ellos se determinó la identidad y número de los individuos involucrados en la respuesta conductual frente a los estímulos, la distancia al estímulo a la cual el ave abandonó el nido y el éxito reproductivo de cada una de las parejas; este último medido como el número de huevos que llegaron al momento de la eclosión. Todas las observaciones relacionadas con comportamiento reproductivo de adultos y defensa de nidada (experimental) fueron registradas en video y se hicieron desde un escondite móvil a 30 m del nido.
La respuesta conductual se clasificó en una de las siguientes categorías mutuamente excluyentes según su intensidad: defensa pasiva, activa o colectiva. 1. Defensa Pasiva (DP): el ave permanece incubando ante la proximidad de un estímulo, o se levanta un poco del suelo, emitiendo vocalizaciones fuertes. En otras ocasiones, el ave se aleja del nido caminando inclinada hacia adelante (eventualmente ejecuta incubación falsa), corriendo o volando directamente desde el nido (Walters, 1990) (figura 1a, b). 2. Defensa Activa (DA): los individuos atacan por medio de vuelos directos orientados hacia el depredador potencial y emiten vocalizaciones estridentes en series largas (Gallegos, 1984; Walters, 1990; Piersma & Wiersma, 1996). Pueden intervenir uno (DA1) o ambos miembros de la pareja (DA2). (figura. 1c, d). 3. Defensa Colectiva (DC): los dos miembros de la pareja y otros individuos de la misma especie hacen sobrevuelos y vuelos de ataque directo al depredador potencial con vocalizaciones estridentes (Myers, 1978; Gallegos, 1984; Walters, 1982, 1990; Piersma & Wiersma, 1996).

Figura 1 Patrones conductuales de defensa de nidada del Pellar ante depredadores en el departamento del Valle del Cauca, Colombia. Defensa pasiva: se levanta un poco del nido (a) o se aleja del nido con su cuerpo inclinado hacia adelante (b). Defensa activa: vuelo de ataque directo al depredador de un individuo (c) o los dos miembros de la pareja (d).
Análisis estadísticos
Se analizó si la conducta de defensa (variable de respuesta) varió con el estado de desarrollo embrionario y con el estímulo próximo al nido (factores fijos) con un Modelo Lineal Generalizado Mixto (MLGM), con distribución de errores binomial. Se incluyó la identidad de la pareja como efecto aleatorio debido a que cada una de ellas se evaluó para cada uno de los estímulos. Se generaron dos MLGM, con y sin interacción entre los factores fijos, seleccionando el mejor modelo mediante los criterios de verosimilitud penalizada (criterio de información de Akaike-AIC y criterio de información BayesianaBIC) y la prueba de razón de verosimilitudes (Agresti, 2015). También se evaluó si la distancia a la cual el ave abandonó el nido (variable de respuesta) varió con el estado de desarrollo embrionario y con el estímulo próximo (factores fijos) con un Modelo Lineal Mixto (MLM). Se incluyó la identidad de la pareja como factor aleatorio y se generaron tres modelos MLM. Los dos primeros modelos, con interacción entre los factores, para determinar si las varianzas eran homogéneas o heterogéneas. Una vez estimado el modelo con la mejor estructura de varianza, según la prueba de razón de verosimilitudes, se comparó con un tercer modelo donde se examinó la influencia de la interacción de los factores, según los criterios AIC y BIC (Agresti, 2015). Se utilizó la prueba de comparación múltiple de Tukey para evaluar si había diferencias significativas al interior de uno de los factores.
El tamaño de nidada y éxito reproductivo de las parejas que defendieron siempre de manera pasiva y aquellas que al menos manifestaron una defensa activa, se comparó por medio de la prueba Mann-Whitney (Zar, 2010). Para las pruebas estadísticas se utilizó el paquete estadístico R (RCORE TEAM 2018).
Resultados
Defensa de nidada
Las frecuencias de los distintos tipos de defensa de nidada por parejas en reacción al paso de los estímulos cercanos al nido en las dos etapas de desarrollo embrionario se muestran en la figura 2a. En solo ocho defensas pasivas, de 51 que hubo en total, el individuo incubante llegó a tolerar la presencia del estímulo a una distancia de 0,2 m (media = 0,84, DE = 0,59). En esta situación, se presentaron tres tipos de variaciones: a) el individuo incubante continuó con su tarea, pero eventualmente cambió la orientación de su cuerpo (cinco defensas), b) el individuo se agazapó más en el nido y bajó su cabeza a nivel del suelo (dos defensas) y c) el individuo extendió una o las dos alas y expuso las rectrices (una defensa). En las 43 defensas pasivas restantes, el adulto incubante no permaneció en el nido y respondió alejándose frente a la presencia de los estímulos experimentales.
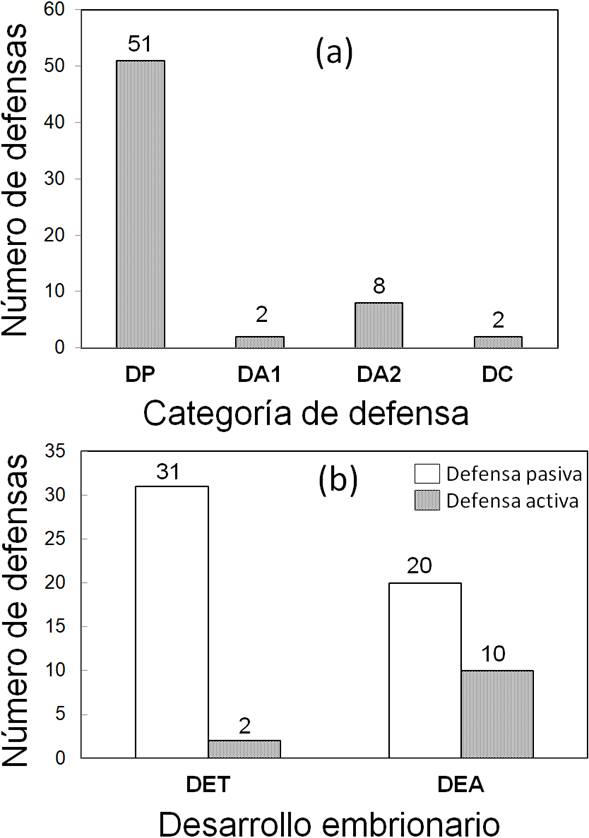
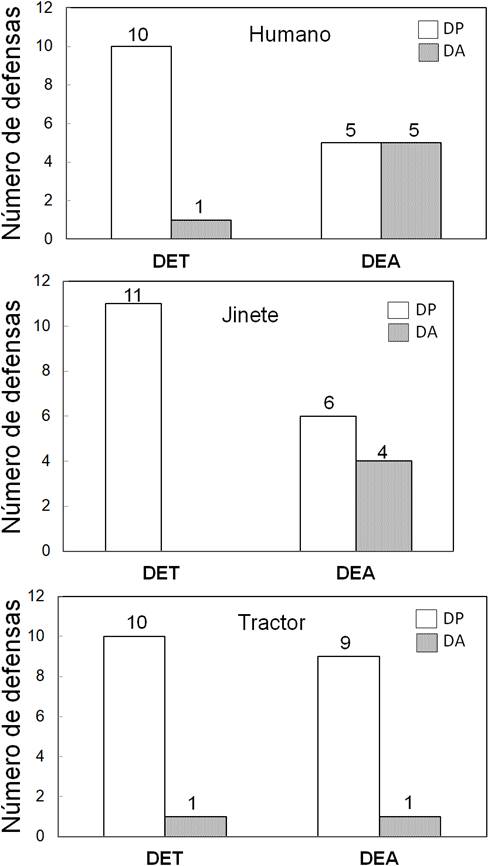
Figura 2 Patrones conductuales de defensa de nidada de los adultos reproductivamente activos, durante la fase experimental (a) y según estado de desarrollo embrionario (b) en el departamento del Valle del Cauca, Colombia. DP = defensa pasiva, DA1 = defensa activa: interviene un solo individuo de la pareja, DA2 = defensa activa: ambos miembros de la pareja intervienen, DC = defensa colectiva, DET= desarrollo embrionario temprano, DEA= desarrollo embrionario avanzado.
Las dos defensas activas, en las que participó un solo individuo, fueron realizadas por machos, con 1 y 4 vuelos de ataque directo. En las defensas activas en las que ambos participaron, los machos realizaron el mayor número de vuelos de ataque directo por defensa (media = 3,75, DE= 6,18, n = 8) en comparación con las hembras (media = 1,75, DE =0,89, n = 8). En las dos defensas colectivas, además de la pareja propietaria de nido, participaron dos parejas vecinas que ejecutaron vuelos en círculo sobre el estímulo. La pareja propietaria de la nidada fue la única que realizó vuelos de ataque directo a estímulos próximos al nido, 20 vuelos ante humano y cinco ante jinete. Todas las parejas marcadas tuvieron parejas vecinas alrededor de su territorio, que tuvo un tamaño promedio de 6.389,23 m2 (DE = 2911,02, n = 28). La distancia promedio entre nidos cercanos simultáneamente activos fue de 81,03 m (DE = 27,18, n = 23).
Tipo de defensa, desarrollo embrionario y estímulos próximos
La prueba de razón de verosimilitudes entre los dos MLGM explorados (con y sin interacción entre los factores) indica que no hay diferencia entre los modelos (X2 = 3,1371, gl = 2, p = 0,2083). Los criterios de verosimilitud penalizada AIC y BIC, sugieren al modelo sin interacción como el de mejor ajuste (AIC = 60,366 vs 61,229 y BIC = 71,082 vs 76,231 modelo sin vs. con interacción; respectivamente). La respuesta conductual de las parejas varió con el estado de desarrollo embrionario de la nidada (figura 2b), pero no con el tipo de estímulo próximo (MLGM: Desarrollo embrionario X2 = 6,404, gl =1, p = 0,011; Estimulo X2 = 2,615, gl = 2, p = 0,270) (figura 3). Este modelo indica que los Pellares disminuyen la defensa pasiva de la nidada con el avance del desarrollo embrionario mientras que la defensa activa se incrementa (figura 2b).
Distancia, desarrollo embrionario y estímulos próximos
La prueba de razón de verosimilitud entre los dos Modelos Lineales Mixtos Generados con interacción para evaluar la estructura de varianza, indica que el modelo presenta un patrón heterogéneo debido al estímulo (Razón de verosimilitud = 8,1752, p = 0,0168). Al comparar los modelos de varianzas heterogéneas con y sin interacción de factores, se sugiere el modelo con interacción, como el de mejor ajuste según criterios de verosimilitud penalizada (AIC = 525,218 vs. 516,197 y BIC = 541,838 vs. 536,627 modelo sin vs. con interacción; respectivamente). Se encontró que sólo la naturaleza del estímulo próximo afecta la distancia a la que el ave se aleja del nido (umbral) (MLM: Estímulo X2 = 34,936, gl= 2, p = 0,001; Desarrollo embrionario X2 = 0,471, gl = 1, p = 0,492; Estímulo-Desarrollo embrionario (X2 = 0,262, gl = 2, p = 0,877). La distancia a la cual el ave abandona el nido frente al tractor es significativamente menor que ante los otros dos estímulos y, la distancia de respuesta de los Pellares ante el jinete y el humano es estadísticamente similar, según la prueba de comparación múltiple de Tukey (tabla 1, figuras 4 y 5).
Tabla 1 Prueba de Tukey para la comparación de la distancia a la cual el adulto abandona el nido ante los estímulos, H=humano, T=tractor y J=jinete, en Colombia.
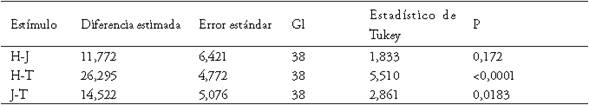
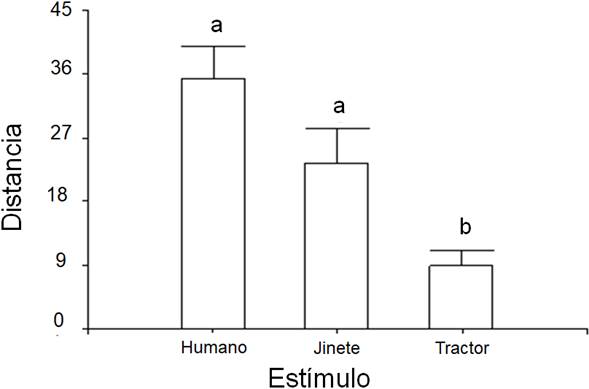
Figura 4 Conducta de defensa de nidada del Pellar ante estímulos próximos al nido en los estados de desarrollo embrionario temprano (DET) y avanzado (DEA) en el departamento del Valle del Cauca, Colombia. DP=defensa pasiva, DA=defensa activa.

Figura 5 Comportamiento y distancia de adulto reproductivamente activo ante la proximidad del estímulo. Tractor pasa a 0,5 m del nido y el adulto no interrumpe la incubación pese a la proximidad del estímulo en el departamento del Valle del Cauca, Colombia. Flecha indica posición del adulto incubando.
Éxito reproductivo
Se registraron 59 huevos en 21 nidos (21 parejas evaluadas) de los cuales 27 (45,76 %) eclosionaron. Las parejas que respondieron siempre de manera pasiva tuvieron el mismo éxito reproductivo que aquellas parejas que presentaron al menos una defensa activa dentro de su conjunto de defensas de nidada (Prueba U de Mann-Whitney, U = 126, p = 0,69). De 12 parejas pasivas en su defensa, el 58,3 % tuvo huevos que llegaron al momento de la eclosión, con un promedio de 2,57 huevos/nido. De siete parejas con defensa activa, el 55,56 % presentaron supervivencia de huevos hasta la eclosión, con promedio de tres huevos/nido. Tampoco hubo relación entre el tamaño de nidada y la intensidad de la respuesta manifestada por los adultos (Prueba U de Mann-Whitney, U = 139,5, p = 0,62).
Discusión
La respuesta de defensa de nido manifestada por el Pellar es principalmente pasiva, la cual disminuye con el avance del desarrollo embrionario a medida que la defensa activa se incrementa. Existe respuesta diferencial según el estímulo próximo al nido y hay mayor tolerancia del tractor en la vecindad del nido que ante los estímulos jinete y humano, lo cual sugiere discriminación entre estos. El Pellar efectúa defensas activas tanto individuales como en pareja, en las que el macho es quien tiene mayor participación que la hembra, triplicando el número de vuelos de ataque directo al depredador.
La conducta de defensa de nidada en Pellares varía con el estado de desarrollo embrionario probablemente por las diferencias en expectativas futuras de los padres en las dos situaciones (Royle, Smiseth & Kölliker, 2012). Según Trivers (1972), la inversión paterna varía en función de las posibilidades de éxito del actual intento reproductivo y de la proporción costo/beneficio esperado de la presente reproducción versus las posibilidades de re-anidamiento futuro. Se tiene evidencia del incremento de la defensa de la nidada a lo largo del período de anidamiento en algunas especies al igual que en el Pellar (Anderson et al., 1980; Greig-Smith, 1980; Biermann & Robertson, 1983; Shields, 1984; Galeotti, Tavecchia & Bonneti, 2000; Carrillo & Aparicio, 2001; Pavel & Bures, 2001).
La conducta de defensa pasiva de la nidada se manifiesta con mayor frecuencia en estado de desarrollo embrionario temprano. En ella están incluidos algunos casos (ocho de 51 que hubo en total) en los que la respuesta del ave fue permanecer inmóvil en el nido y sin vocalizar ante el riesgo potencial. La defensa pasiva es una respuesta no tan costosa energéticamente para su ejecución y puede traer beneficios para la pareja, al estar apoyada con estrategias conductuales de disuasión del depredador. Gallegos (1984), Walters (1990), Naranjo (1991) y Piersma & Wiersma (1996); reportan conductas no tan demandantes energéticamente como “incubación falsa y “ala rota” dentro de su repertorio de disuasión. Si la pareja sólo responde de manera pasiva y por ello sus huevos/polluelos son depredados, es posible que sea menos costoso producir una nidada de reemplazo al inicio de la temporada reproductiva que correr un alto riesgo de supervivencia, al responder agresivamente al estímulo de depredación. Otra de las características, que puede otorgar una ventaja adaptativa a la conducta pasiva, es la presencia de patrones de coloración críptica en huevos y polluelos, que dificultan su detección en potreros con y sin vegetación (Piersma & Wiersma, 1996; Hilty & Brown, 2001).
La defensa activa de la nidada es un comportamiento que, si bien protege y aumenta la supervivencia de los huevos o descendientes (Anderson et al., 1980; Greig-Smith, 1980; Blancher & Robertson, 1982; Parish & Coulson, 1998; Macedo, Karubian & Webster, 2008; Saracura, Macedo & Blomqvist, 2008), también implica la inversión de tiempo, energía y riesgo de daño corporal para el individuo que lo ejecuta (Denson, 1979; Wittenberg, 1981; Brunton, 1986; Alcock, 1989; Sordahl, 1990). Myers (1978), por ejemplo, documentó la captura de un Pellar por parte del Guaraguaco común (Polyborus plancus) mientras efectuaba defensa colectiva de nidada con otros cinco individuos. En este estudio, la intensidad de la defensa aumentó con el desarrollo embrionario significativamente, pero en ninguno de los casos la defensa activa sobrepasó a la pasiva. Esto evidencia el incremento de la inversión paternal en el esfuerzo reproductivo actual sin comprometer la supervivencia futura del adulto, como lo propone Davies et al. (2012).
En los Pellares, la distancia a la cual el ave se aleja del nido cuando se aproxima el tractor es menor que cuando se aproxima un humano o un jinete. La respuesta que manifiesta la especie va a depender de la habituación anterior, en términos evolutivos, a los estímulos a los que está siendo sometida y al riesgo que representa en relación con los beneficios de una reproducción futura (Davies et al., 2012). En la Gaviota Occidental (Larus occidentalis), se demostró que la variación del disturbio humano afecta la distancia a la cual el ave inicia el vuelo para alejarse del depredador potencial (Wittenberg, 1981; Webb & Blumstein, 2005). El tractor parece ser un estímulo para el cual se tiene habituación por experiencias previas; en la zona de estudio se presentan diferentes usos del suelo, como bosque natural, sistema silvopastoril y cultivos orgánicos de caña de azúcar, en los que se emplean con frecuencia herramientas agrícolas propias para tales fines y con las cuales los Pellares interactúan tanto visual como acústicamente. Además, si se tiene en cuenta que, en el Pellar, según Walters (1990), existe reconocimiento visual de estímulos en el hábitat, la figura humana sería menos reconocible dentro del tractor que en cualquiera de las otras dos opciones experimentales, lo cual contribuye a explicar la diferencia entre los umbrales de respuesta (distancia) ante el estímulo tractor vs. jinete y humano a pie.
Para estímulos potencialmente riesgosos para la nidada pero que normalmente se encontraron en el hábitat y que se aproximaron de manera no controlada al nido, se presenciaron respuestas conductuales no manifestadas con los estímulos planeados en este trabajo. Para ungulados como vacas, obesnos y caballos la conducta estuvo centrada en señalización visual y, ante su aproximación, se levantaron del suelo, expusieron las zonas blancas del plumaje ubicadas en las rectrices y las alas y emitieron vocalizaciones estridentes. Con ello lograron que cambiaran la trayectoria de su desplazamiento y no afectaran la nidada por aplastamiento. Ante humanos y perros, el adulto que se encontraba incubando siempre respondió de manera más activa y agresiva; se alejó del nido y ejecutó vuelos de ataque directo contra el depredador potencial emitiendo fuertes vocalizaciones. La diferencia en respuesta comportamental insinúa un reconocimiento (visual) de estímulos en el hábitat, como lo documentan Walters (1990) y otros autores con varias especies que ejecutan comportamientos diferenciales según la clase de depredador (Cully & Ligon, 1976; Chandler & Rose, 1988; Gehlbach & Leverett, 1995; Kleindorfer, Fessl & Hoi, 2005).
El éxito reproductivo similar para parejas con diferente intensidad de defensa de nidada sugiere factores adicionales involucrados, tales como intensidad, estrategia de depredación y/o falta de una respuesta evolutiva ante otros depredadores potenciales. Pude registrar, por ejemplo, el ingreso de hormigas en huevos de los Pellares al momento de la eclosión, sin que el adulto respondiera a esta situación. Es conocido que varias especies de hormigas, como Solenopsis invicta y Myrmica rubra, tienen un impacto negativo en el éxito reproductivo de varias especies de aves y de vertebrados en general (Ridlehuber, 1982; Kopachena, Bucley & Potts, 2000; Allen, Epperson & Gamerstani, 2004; Campomizzi et al., 2009; Wilcoxen & Rensel, 2009; Defisher & Bonter, 2013). La mayoría de la depredación se atribuyó a desaparición de huevos y polluelos. En una de las revisiones de los nidos, se encontraron dos polluelos recién nacidos con heridas profundas en el dorso y con Rupornis magnirostris posado y vocalizando a 15 m sobre el suelo, en un árbol a 8 m de distancia del nido. También se halló un adulto reproductivamente activo y dueño del nido, muerto a 20 cm de este. Los huevos del nido habían desaparecido. Se conoce que en el área de estudio se pueden observar Didelphis marsupialis y Potus flavus, como potenciales depredadores para la especie, merodeando en zonas cercanas a los nidos monitoreados.
Por otro lado, es importante determinar a futuro cuál es la tendencia conductual de defensa de la pareja durante todo el período de incubación frente a diversos estímulos próximos y durante épocas reproductivas consecutivas, para poder analizar su relación con el éxito reproductivo en una escala temporal más amplia. El Pellar manifiesta una mayor inversión paternal al final del período de incubación con el incremento en la intensidad de la defensa de la nidada y además reconoce estímulos potencialmente riesgosos para la nidada debido a la variación en distancia a la cual el ave abandona el nido (tractor vs humano-jinete).