Introducción
Los nematodos fitoparásitos de los géneros Meloidogyne, Globodera, Heterodera, Pratylenchus y Radopholus se encuentran entre los patógenos de plantas más perjudiciales alrededor del mundo, afectando el crecimiento y rendimiento de los cultivos (Agrios, 2005; Jones et al., 2013; Sikora et al., 2018).
La mayoría de las especies de nematodos fitoparásitos viven sobre o alrededor de las raíces de las plantas (rizósfera), donde alteran la absorción de agua y nutrientes, así como su transporte desde las raíces hacia los tallos, creando un desbalance de macro y micro-nutrimentos que afectan su metabolismo y crecimiento (Abad et al., 2009; Melakeberhan, 1997; Perry et al., 2009; Been y Schomaker, 2006; Sikora et al., 2018). Sin embargo, es común que los estudios sobre la interacción planta-nematodo se evalúen de forma indirecta, basados principalmente en la disminución del rendimiento del cultivo por unidad de área y la reducción del valor del producto por unidad de peso (Been y Schomaker, 2006). No son comunes los estudios sobre los procesos fisiológicos alterados, donde se combine el daño en la morfología de las raíces y los cambios en el movimiento de nutrientes de la planta parasitada por los nematodos y sus efectos en los procesos fotosintéticos (Melakeberhan, 2004; Strajnar et al., 2012).
Las alteraciones del sistema radical por el daño de las células, causado por los nematodos, interfieren con los procesos fisiológicos relacionados con la absorción de agua y nutrientes y las fitohormonas que se originan en las raíces (daños primarios), de este modo, crean una cascada de efectos sobre la síntesis de clorofila, fotosíntesis y respiración en los tejidos aéreos de las plantas (daños secundarios) (Agrios, 2005; Colhoum, 1973; Melakeberhan et al., 1986; Schoeneweiss, 1975). La combinación de estos efectos primarios y secundarios causa disminución en el crecimiento y productividad de las plantas comparado con las plantas sanas (Melakeberhan, 2004).
Los principales procesos afectados en las plantas infectadas por los fitonematodos son: tasa fotosintética (postuka et al., 1986; melakeberhan, 1999), contenido de clorofila, conductancia estomática y condiciones foto-químicas (Schans y Arntzen, 1991), balance nutricional (Agrios, 2005; Wallace, 1974), translocación de factores que regulan la fotosíntesis y que se producen en las raíces (Loveys y Bird, 1973), expansión del área foliar y acumulación de materia seca, rendimiento, absorción de agua y nutrientes, consumo de agua y respiración (Jones et al., 2013; Sasser y Freckman, 1987; Sikora et al., 2018; Strajnar et al., 2012).
En la relación plantas-nematodos, la respuesta de las plantas al daño ocasionado por estos está estrechamente relacionada con la alimentación de los nematodos; por consiguiente, en la primera sección se presenta un resumen sobre los aspectos generales de esta relación. A continuación, se examinan resultados de investigaciones donde los nematodos fitoparásitos se relacionan con diferentes aspectos del funcionamiento fisiológico de las plantas y cuyas respuestas se han estudiado en las raíces y los órganos aéreos. Los resultados corresponden a investigaciones realizadas en varios cultivos en diferentes partes del mundo desde 1966 hasta 2020.
Esta revisión pretende contribuir a una mejor comprensión de las implicaciones fisiológicas de la interacción de la planta con los nematodos fitoparásitos que causan destrucción celular, sincitia y células gigantes.
Relación planta - nematodo
La respuesta de las plantas al daño ocasionado por los nematodos está estrechamente relacionada con la alimentación del parásito, la cual se puede clasificar así:
Las partes afectadas de las plantas: los nematodos pueden parasitar el sistema radical o los tejidos aéreos.
El hábitat alimenticio: los nematodos pueden parasitar las células interna o externamente, clasificándose como: parásitos externos de tejidos (ectoparásitos) y parásitos internos de tejidos (endoparásitos).
El tipo de daño celular: cuando los nematodos se alimentan de las células de la planta pueden ocasionarle varios tipos de daño o modificación, como los siguientes:
Destrucción de células, causadas por Pratylenchus spp. y Radopholus similis (Dropkin, 1969; Melakeberhan, 2004). Las especies de Pratylenchus o Radopholus parasitan las células de la epidermis, el córtex y la endodermis, ocasionando muerte de tejidos y pardeamiento de estos; también causan destrucción mecánica de las células de las raíces durante su migración, al igual que pérdida de integridad de la membrana celular (Oramas Nival y Román, 2006). El tejido de las raíces se afecta y mueren numerosas células epidermales sobre la superficie de estas (Sikora et al., 2018), lo cual posibilita la entrada de otros patógenos habitantes del suelo como especies de los géneros Fusarium y Rhizoctonia (Kurppa y Vrain, 1985).
Formación de sincitia por Heterodera spp. y Globodera spp. (Dropkin, 1969; Golinowski et al., 1997; Melakeberhan, 2004; Moens et al., 2018). Estos nematodos son endoparásitos sedentarios, cuyo estado juvenil 2 (J2) infectivo penetra y migra intracelularmente, destruyendo las células, y cuando se ubica en el cilindro interno, cambia su comportamiento, ya que modifica la célula donde se alimenta y forma una sincitia, que es una estructura de alimentación multinucleada que se forma por la disolución parcial de la pared de varias células (Sobczak y Golinowski, 2011; Moens et al., 2018).
Desarrollo de células gigantes como Meloidogyne spp. (Dropkin, 1969; Melakeberhan, 2004). Las especies del género Meloidogyne son endoparásitas sedentarias, cuyos estados juveniles (J2) infectivos penetran las raíces, migran intercelularmente, y cuando llegan al sitio de alimentación, inducen la diferenciación de las células del parénquima en células de alimentación multinucleadas, que ocasiona hipertrofia e hiperplasia, y toman el nombre de células gigantes, las cuales son células de alimentación especializadas que funcionan como sumideros para suministrar nutrientes al nematodo hasta su reproducción (Abad et al., 2009; Goverse y Smant, 2014; Ibrahim et al., 2019; Been y Schomaker, 2006).
Aspectos moleculares de la relación planta - nematodo
Los estados (J2) infectivos de los nematodos, durante la migración, dañan las células del hospedante, ocasionando la activación de respuestas de defensa de las plantas. Estos estados infectivos poseen glándulas esofágicas, una glándula dorsal y dos glándulas sub-ventrales, donde se producen proteínas (efectores) que son secretadas por el estilete en la pared celular y también se transfieren dentro de las células (Ibrahim et al., 2019; Liu y Park, 2018; Van Den Akker y Birch, 2016).
Los efectores son proteínas patógenas y moléculas pequeñas que alteran la estructura y función de las células del hospedante (Hogenhout et al., 2009). Los nematodos secretan efectores para degradar el tejido de la planta, modificar la pared celular y suprimir la respuesta de defensa, modificando la señalización de la planta y las vías hormonales para establecer y mantener el sitio de alimentación y absorber fácilmente el contenido del citoplasma. Los efectores también son necesarios el desplazamiento (invasión) del nematodo a través de los tejidos vegetales (Ibrahim et al., 2019; Liu & PARK, 2018; López-Nicora & Niblack, 2018; Van Den Akker y Birch, 2016). Algunos de los efectores que se han encontrado son celulasas, pectatoliasas, poligalacturonasas, xilanasas, arabinogalactano endo-1,4-betagalactosidasas y arabinasas en muchas especies de diferentes géneros de fitonematodos (Haegeman et al., 2012; Palomares-Rius et al., 2017).
Revisiones complementarias relacionadas con estudios genómicos, transcriptómicos y proteómicos, al igual que las enzimas de degradación y modificación de la pared celular vegetal, respuestas al estrés, síntesis de proteínas, división celular, transporte y transducción de señales, biosíntesis de hormonas y otras funciones de las proteínas efectoras en el sitio de alimentación del nematodo pueden complementarse en los documentos de Cabrera et al. (2016), Chen et al. (2017), Gheysen & Mitchum (2019), Goverse y Smant (2014), Haegeman et al. (2012), Kyndt et al. (2013), Quentin et al. (2013), Rehman et al. (2016), Siddique et al. (2015) y Karanastasi et al. (2018).
Las implicaciones del daño de un nematodo sobre un órgano específico de la planta y sobre los demás órganos no se pueden dilucidar de forma simple debido a los procesos y arquitectura celular del sitio de alimentación del nematodo y a la ausencia de estudios que los incluyan (Kyndt et al., 2013). Sin embargo, se ha demostrado que los cambios fisiológicos inducidos por los nematodos pueden ser sistémicos, ya que cuando se evalúa la interacción entre Heterodera glycines y la nodulación formada por bacterias y rizobios, en plantas de soya, que tienen el sistema radical dividido, H. glycines en la mitad del sistema de raíces, donde tiene lugar la infección, reduce la nodulación en la otra mitad, donde el nematodo no está presente (Ko et al., 1984).
Respuestas en raíces
Independientemente del hábitat alimenticio, los nematodos fitoparásitos interrumpen el consumo de macro y micro-nutrientes y crean un desbalance de estos en las plantas (Melakeberhan, 2004). Síntomas como amarillamiento, enanismo y reducción del crecimiento de las plantas son manifestaciones de la destrucción de raíces por los nematodos, que impiden la absorción de nutrientes y alteran su metabolismo (Baldwin et al., 1976; Evans et al., 1977; Fatermy & Evans, 1986a, 1986b; Wilhelm et al., 1985). Teniendo en cuenta las funciones que tienen el agua y los nutrientes en el proceso de la fotosíntesis, es probable que los efectos de los nematodos sobre la fotosíntesis sean precedidos por la alteración en la absorción de estos elementos.
1. Absorción de nutrientes
Para los nematodos que causan adaptación celular y células gigantes, nutrientes como potasio, calcio, nitrógeno, fósforo y sodio se incrementaron independiente del número de individuos inoculados. Esto se ha demostrado en plantas de papa infectadas con Globodera pallida (Fatemy y Evans, 1986; Been y Schomaker, 1986), al igual que cuando se inoculan plantas de remolacha susceptibles y resistentes a Heterodera schachtii (Hojat-Jalali et al., 2007), plantas de papayo (Carica papaya) inoculadas con M. incognita y Rotylenchulus reniformis (Ramakrishnan y Rajendran, 1999), y plantas de fríjol (Phaseolus vulgaris) interactuando con estados juveniles (J2) de M. incognita (Melakeberhan et al., 1985). La reducción del contenido de potasio en raíces de Musáceas ha sido demostrada en la interacción de Radopholus similis y Grande Naine (Musa AAA) (Moens et al., 2006), y con Cavendish (Musa AAA) y Gros Michel (Musa AAA) (Mateille, 1993). Por el contrario, no hay efecto sobre los citados nutrientes cuando se inoculan plántulas de banano Cavendish y Gros Michel con Helicotylenchus multicinctus y H. pararobustus (Mateille, 1993). Las diferencias entre los nematodos que ocasionan adaptación celular y células gigantes versus los que causan destrucción celular, pueden relacionarse con dos aspectos: el primero, las necesidades diferenciales de los cultivos evaluados, puesto que, por ejemplo, las plantas de la familia Musaceae son más exigentes en potasio; el segundo, la mayor diferenciación celular asociada a los nematodos que forman células gigantes puede incrementar las concentraciones de calcio, mientras R. similis ocasiona daños significativos en las raíces que son la principal vía de absorción.
2. Consumo de agua
La escasez de agua es probablemente el factor abiótico más limitante para el crecimiento de las plantas (Boyer, 1985). La disminución en la disponibilidad de agua en el suelo resulta en la reducción del consumo de nutrientes y translocación de solutos, menor actividad de los cloroplastos, descomposición de proteínas y ácidos nucleicos e incremento de enzimas hidrolíticas (Colhoum, 1973; Schoeneweiss, 1975). La alteración del transporte de agua causa estrés hídrico que se manifiesta en síntomas en las plantas como retraso del crecimiento, marchitez y clorosis. Además, se ha encontrado que una reducción en el suministro de agua influye negativamente en los procesos fisiológicos y bioquímicos de las plantas como fotosíntesis, respiración, translocación, absorción de iones, niveles de nutrientes, composición de pigmentos, niveles de carbohidratos, promotores del crecimiento y metabolismo (Jaleel et al., 2009).
El grado en el cual los nematodos afectan la absorción de agua puede variar con el tipo de interacción parásito-hospedante, por lo que los nematodos invariablemente afectan el consumo de agua. Consecuentemente, la planta disminuye la fotosíntesis, hay pérdida de turgencia, marchitamiento y muerte. Para comprender mejor el efecto de la escasez de agua inducida por nematodos sobre la fisiología del hospedante, es necesario profundizar en la relación causa y efecto, para separar el estrés biótico y el abiótico, y cuantificar sus efectos aditivos o interactivos sobre el crecimiento de la planta (Melakeberhan, 2004).
Para los nematodos que causan adaptación celular, el uso de agua total (g) se reduce significativamente en plantas de papa atacadas por G. pallida (Fatemy & Evans, 1986). En relación con los nematodos que causan células gigantes, como M. incognita y M. ethiopica, se ha demostrado en tomate (S. lycopersicum) que estos nematodos disminuyen la absorción total de agua en las plantas (Dorhout et al., 1991; Strajnar et al., 2012), al igual que M. incognita o M. javanica en plantas de tabaco (Nicotiana tabacum) (Rahi et al.,1988). Debido a que algunas especies de plantas pueden sufrir estrés hídrico más fácil que otras (Atherton & Rudich, 1986), podría ser difícil separar los efectos en absorción de agua cuando están parasitadas por nematodos.
3. Desarrollo de raíces
Existen pocos estudios que relacionan el daño de los nematodos fitoparásitos con el desarrollo del sistema radical de las plantas. Los efectos del nematodo del nudo radical Meloidogyne spp. han sido ampliamente estudiados, principalmente en procesos particulares como el tamaño de las agallas ocasionadas por el nematodo, pero rara vez combinan los cambios de la morfología de las raíces con los procesos fisiológicos de las plantas (Strajnar et al., 2012). Por ejemplo, Strajnar et al. (2012) comprobaron cambios morfológicos de las raíces de tomate (Lycopersicum esculentum), inoculadas con huevos M. ethiopica sobre el porcentaje de raíces finas y gruesas; las raíces finas (diámetro hasta 0,5 mm) de las plantas infectadas con nematodos se reducen significativamente. Asimismo, Strajnar et al. (2012) demostraron en este mismo rpatosistema, que la longitud de las raíces se acorta por el efecto del nematodo. Se requieren más estudios acerca del efecto de los nematodos fitoparásitos sobre el desarrollo de las raíces.
Respuestas en órganos aéreos
1. Tasa fotosintética
Los nematodos fitoparásitos, las especies vegetales y el medio ambiente determinan el nivel de daño económico y el grado en el cual los nematodos afectan la fotosíntesis de las plantas. Los resultados de diferentes investigaciones han demostrado que se presenta una disminución en la tasa fotosintética en las especies de plantas infectadas por los diferentes fitonematodos (Tabla 1). La mayoría de estas investigaciones se han realizado bajo condiciones controladas en cámaras de crecimiento e invernaderos, principalmente con los nematodos del nudo radical (nematodo de la agalla o agallador) (Meloidogyne incognita y M. javanica) parasitando plantas de tomate (Solanumly copersicum), tabaco (Nicotiana tabacum), fríjol (Phaseolus vulgaris), vid (Vitis vinifera) y papayo (Carica papaya), y los nematodos formadores de quiste (Globodera pallida, G. rostochienesis y H. glycines) infectando papa (Solanum spp.) y soya (Glycinemax), respectivamente.
Tabla 1 Reportes del efecto limitante de los nematodos fitoparásitos en la tasa fotosintética de varias especies vegetales.
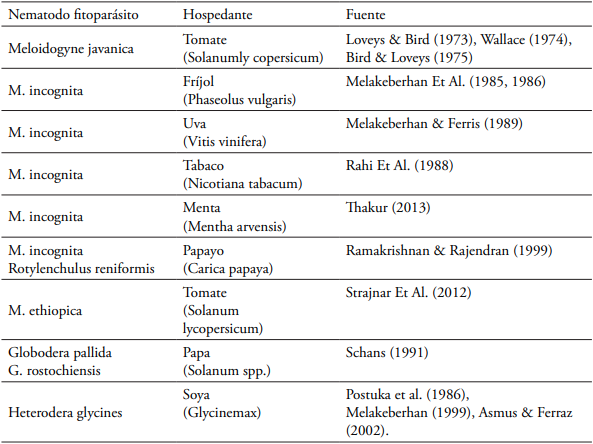
Los cambios a nivel de la fotosíntesis en plantas, inicialmente se reportaron en plantas jóvenes. En estudios realizados por Loveys y Bird (1973) y Wallace (1974) en tomate infectado con estados juveniles (J2) de M. javanica no observaron diferencias en la disminución la tasa neta de fotosíntesis. Estudios recientes, en la misma especie, pero inoculadas con M. ethiopica, indican que la fotosíntesis neta de las plantas no inoculadas es dos veces mayor en comparación con las plantas inoculadas (Strajnar et al., 2012). La disminución en la tasa de fotosíntesis en plantas jóvenes se ha demostrado en otras plantas como papayo (Carica papaya) inoculadas con M. incognita y R. reniformis (Ramakrishnan y Rajendran, 1999), soya (Glycinemax) inoculada con estados juveniles (J2) de Heterodera glycines (Postuka et al., 1986; Melakeberhan, 1999; Asmus y Ferraz, 2002); fríjol (Phaseolus vulgaris) inoculado con M. incognita (Melakeberhan et al., 1986; Melakeberhan et al., 1985; Melakeberhan y Ferris, 1989), y plantas de papa (Solanum spp.) infectadas con Globodera pallida y G. rostochiensis (Schans, 1991).
La resistencia de las plantas a los fitonematodos es una de las tácticas exploradas en las plantas cultivadas como estrategia para su manejo. La tasa de fotosíntesis podría proporcionar evidencia de un mecanismo de compensación en la actividad metabólica en respuesta al parasitismo de los nematodos, y que contribuye a su resistencia o tolerancia al daño causado por ellos. Al respecto, un incremento significativo en la tasa fotosintética se ha demostrado en plantas de arroz resistentes a Meloidogyne graminicola (Swain y Prasad, 1989), mientras que en plantas de soya resistentes a Heterodera glycines no se altera la fotosíntesis (Melakeberhan, 1999).
2. Conductancia estomática
La conductancia estomática permite que las hojas de las plantas realicen el intercambio gaseoso y es afectada por el estado nutricional, pero también por el nivel de estrés hídrico (Melakeberhan, 2004). Como se mencionó, los nematodos pueden afectar la absorción de agua, disminuir la conductancia estomática, limitar la concentración de CO2 en el sitio de carboxilación y, por lo tanto, reducir la tasa neta de fotosíntesis. La disminución en la conductancia estomática se ha reportado en plantas de tomate (S. lycopersicum) inoculadas con M. ethiopica (Strajnar et al., 2012); y en plantas de papa (Solanum spp.) con G. pallida (Schans, 1991). Sin embargo, no todas las especies de plantas tienen el mismo tipo de respuesta. Por ejemplo, en plantas de menta (Mentha arvensis cv. Shivalik) inoculadas con el estado juvenil J2 de M. incognita existe una relación directa entre la conductancia estomática con el incremento del nivel de inóculo del nematodo. El aumento de la conductancia estomática acelera la tasa de transpiración, ayudando a regular la temperatura de las hojas (Thakur, 2014).
3. Contenidos de clorofila
En general, todos los nematodos disminuyen los contenidos de clorofila total, clorofila a y b, como se ha demostrado en plantas de papayo (Carica papaya) inoculadas con estados juveniles de M. incognita y R. reniformis, individualmente y en combinación (Ramakrishnan y Rajendran, 1999); en plantas de menta (Mentha arvensis cv. Shivalik) inoculadas con M. incognita (Thakur, 2014); en plantas de fríjol (P. vulgaris) con M. incognita (Melakeberhan et al., 1986); en plantas de arroz inoculadas con M. graminicola (Swain y Prasad, 1989); en plantas de fríjol mungo (Vigna radiata) parasitadas por M. incognita (Abbasi y Hisamuddin, 2014); en plantas de remolacha (Beta vulgaris) afectadas por Heterodera schachtii (Hojat-Jalali et al., 2007); y en plantas de soya (Glycinemax) susceptibles a Heterodera glycines (Asmus y Ferraz, 2002).
En contraste, no se han documentado los mismos resultados con los nematodos que destruyen células radicales como R. similis, Helicotylenchus multicinctus y H. pararobustus. Por ejemplo, en plántulas de Musa AAA (subgrupo Cavendish) ‘Poyo’ y Musa AAA (subgrupo Gros Michel) ‘Gros Michel, las concentraciones de clorofila a, clorofila b y caroteno en las hojas no se alteran con la presencia de estos nematodos; excepto en plantas de G. Michel infectadas con poblaciones muy altas de R. similis, las cuales afectan la concentración de los pigmentos (Mateille, 1993).
Debido a la participación crucial de los pigmentos en la actividad fotosintética, los materiales resistentes a fitonematodos, donde se ha incluido esta variable en las respuestas a la interacción, la concentración de clorofila se incrementa principalmente en materiales resistentes, lo cual se ha demostrado en plantas de arroz inoculadas con el nematodo del nudo radical M. graminicola (Swain y Prasad, 1989), plantas de remolacha afectadas por Heterodera schachtii en (Hojat-Jalali et al., 2007). Una excepción son plantas de soya (Glycinemax) susceptibles a Heterodera glycines (Asmus y Ferraz, 2002).
4. Respiración y transpiración
La información disponible sobre el efecto de los nematodos en la respiración de las plantas es limitada (Melakeberhan, 2004). Según Nobel (1983), una de las áreas poco estudiada es cómo los nematodos inciden sobre la fotorrespiración, el consumo de O2 y la evolución de CO2 en la luz que resulta desde la síntesis de glicolato en los cloroplastos y metabolismo de la glicina en peroxisomas y la mitocondria. La identificación de cualquier relación entre la infección de nematodos e incremento en la actividad de la vía glicolato es útil para entender las bases fisiológicas de la interacción planta-nematodo (Melakeberhan & Ferris, 1989).
La tasa de transpiración es, como las variables anteriores, sensible a la presencia de nematodos. La reducción de la tasa de transpiración se ha verificado en diferentes cultivos solamente con los fitonematodos que ocasionan células gigantes. Está documentado que en plantas de menta (Mentha arvensis cv. Shivalik) interactuando con Meloidogyne incognita (Thakur, 2014), y en plantas de tomate (Solanum lycopersicum), M. ethiopica (Strajnar et al., 2012), y plantas de papa que creciendo en suelos infestados con G. rostochiensis (Fatemy & Evans, 1986) se produce menores tasas de transpiración o cambios en el uso del agua. Esas respuestas se atribuyen a la reducción de la apertura estomática pero solo una pequeña disminución en el peso seco total de materia seca, porque los estomas parcialmente cerrados reducen la transpiración más que la producción de materia seca (Raschke, 1976).
5. Área foliar
Esta variable tiene una relación estrecha con la actividad fotosintética y por tanto con el rendimiento de las plantas. Los nematodos en la mayoría de los casos reducen el área foliar como sucede en plantas de soya (Glycinemax) inoculadas con H. glycines (Asmus y Ferraz, 2002), en plantas de papa creciendo en suelos infestados con G. rostochiensis (Fatemy y Evans, 1986), y plantas de tomate afectadas por M. javanica (Loveys y Bird, 1973). Más aún, algunos investigadores reportan que hay reducción en el rendimiento de plantas de soya atacadas por H. glycines, sin mostrar síntomas visibles del ataque del nematodo del quiste (Postuka et al., 1986; Wang et al., 2003).
En relación con los nematodos del nudo radical, el área foliar o el número de hojas se reduce en presencia de estos, lo cual está bien documentado en patosistemas como: plantas de fríjol (Phaseolus vulgaris) - M. incognita (Melakeberhan et al., 1985); de vid (Vitis vinifera) - M. incognita (Melakeberhan y Ferris,1989); de papayo (C. papaya L.) - M. incognita (Ramakrishnan y Rajendran, 1999) y fríjol mungo (Vigna radiata) - M. incognita (Abbasi y Hisamuddin, 2014). Con los resultados disponibles, en la actualidad no es posible dilucidar si el área foliar o el número de hojas pueden ser los mejores indicadores de los efectos negativos de los fitonematodos, y ninguno de los que destruyen células vegetales han considerado como importante esta variable.
6. Materia seca y rendimiento
La mayoría de las investigaciones realizadas con nematodos fitoparásitos se han concentrado en evaluar el efecto de estos en la materia seca y en el rendimiento de las plantas. Según Agrios (2005), los fitonematodos causan pérdidas anuales entre 11 y 14% en cultivos de importancia como las leguminosas, granos, banano, yuca, coco, remolacha azucarera, caña de azúcar, papa, hortalizas y varios frutales, estimándose estas pérdidas en US$ 80 billones/año (Nicol et al., 2011; Sasser & Freckman, 1987).
Las pérdidas en el rendimiento y de la biomasa de los cultivos varían, dependiendo de la especie de planta, el género del nematodo fitoparásito y su hábitat alimenticio, así como de sus interacciones en un ambiente favorable, y otros factores como la edad de las plantas y sus respuestas fisiológicas (Agrios, 2005).
Los nematodos del nudo radical como M. incognita y M. javanica disminuyen la biomasa de plántulas de tabaco (Nicotiana tabacum) (Rahi et al., 1988); lo mismo sucede con plantas de tomate (Solanum lycopersicum) infectadas con M. javanica (LOVEYS & BIRD, 1973) y plantas de fríjol (Phaseolus vulgaris) (Melakeberhan et al., 1986), de papayo (Carica papaya) (Ramakrishnan y Rajendran, 1999) y fríjol mungo Vigna radiata (Abbasi y Hisamuddin, 2014) afectadas por M. incognita. Lo mismo se ha demostrado con el nematodo del quiste H. glycines y G. rostochiensis afectando plantas de soya (Glycinemax) (Asmus y Ferraz, 2002; Wang et al., 2003) y de papa (Solanum tuberosum), respectivamente (Fatemy & Evans, 1986).
En relación con las pérdidas ocasionadas por los nematodos que destruyen las células, Fogain (2000) demostró como el ataque de R. similis en plátano produce un alto porcentaje de volcamiento de plantas en detrimento del rendimiento. En este mismo cultivo, Guzmán-Piedrahita et al. (2012) estimaron pérdidas del 28,49% ocasionadas por R. similis, principalmente por efecto del volcamiento, en plátano Dominico Hartón en Colombia. En banano Musa AAA ‘Grande Naine’ el efecto en el rendimiento se reporta como una disminución significativa en el peso del racimo en plantas parasitadas por R. similis, M. incognita y P. coffeae (Moens et al., 2006), siendo las pérdidas superiores en plantaciones atacadas por R. similis (Guzmán-Piedrahita y Castaño-Zapata, 2020).
En la tabla 2 se muestran 17 cultivos de importancia económica con los estimativos mundiales de pérdidas anuales en rendimiento, causadas por nematodos fitoparásitos.
Tabla 2 Cultivos de importancia económica con estimativos mundiales de pérdidas anuales en rendimiento causadas por nematodos fitoparásitos.
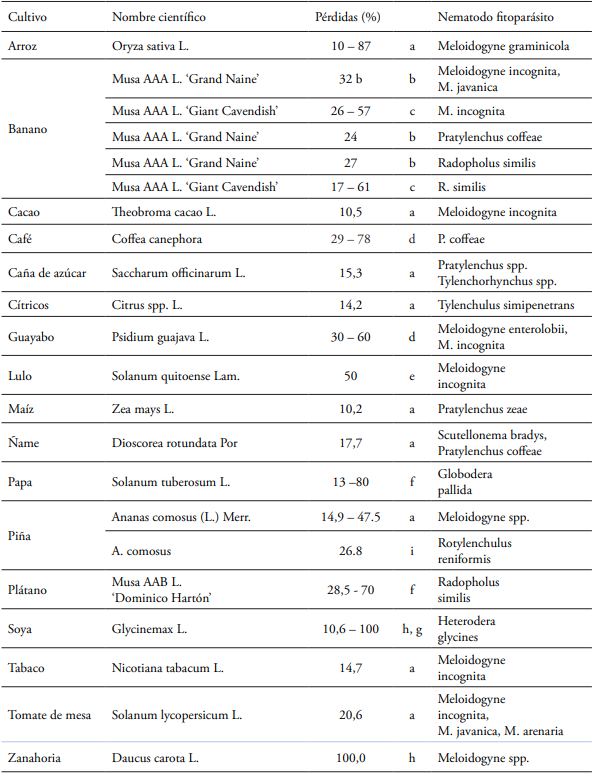
a Sasser & Freckman (1987), Jones et al. (2013) y Sikora et al. (2018)bMoens et al. (2006)cHerradura et al. (2012)dBolaños et al. (2011)eGelpud et al. (2011)fGuzmán-Piedrahita et al. (2012)gAsmus & Ferraz (2002), Wang et al., 2003h Observaciones de los autores en Colombia sobre daños en raíces de zanahoria en condiciones de campo.
Consideraciones finales
Las variables contenido de clorofila y concentración de macro y micronutrientes, aparte de la biomasa acumulada y el rendimiento, se podrían utilizar para verificar el impacto de las prácticas de manejo de fitonematodos. Es importante avanzar en el conocimiento de la interacción molecular y celular del patosistema planta-nematodo para su mejor comprensión e integrarlo dentro de las prácticas de manejo en condiciones de campo, ya que aún se desconocen muchos cambios morfológicos y moleculares que ocurren durante el ataque de los nematodos fitoparásitos. Para lograr esto, se necesita la integración multidisciplinaria de varias áreas del conocimiento.
En general, los nematodos fitoparásitos incluidos en esta revisión, independiente del tipo de daño que ocasionan, reducen las funciones fisiológicas de las raíces y de la parte aérea produciendo pérdidas anuales significativas en rendimiento. Lo anterior, también depende de la interacción entre la especie vegetal, el tipo de nematodo fitoparásito, su hábitat alimenticio y sus interacciones en un ambiente favorable. Se requiere realizar más estudios para comprender mejor la interacción planta-nematodo en doble vía, tanto en el efecto de los nematodos en los daños causados a la planta como también, en conocer las respuestas fisiológicas de la planta a su ataque. En ésta última, se requiere mayor investigación donde se relacione el estado nutricional de la planta, prácticas de manejo agronómico como nutrición edáfica y foliar, producción de hormonas e insumos biológicos, con una mejor respuesta fisiológica del hospedante, que permitiría un menor impacto del parasitismo de los nematodos, y que contribuiría al manejo integrado de estos.





![Genetic introgression and speciation of Heliconius hecalesia (Hewitson [1854]) (Lepidoptera: Heliconiinae) in hybridization areas in western Colombia](/img/en/next.gif)








